Анемия хронических заболеваний
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Ключ. слова
Об авторах
ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Минздрава России 394036 Воронеж
ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Минздрава РФ 394000, г. Воронеж, Россия
ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Минздрава России 394000, Воронеж
ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Минздрава России 394000, Воронеж
ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко» Минздрава РФ 394000, г. Воронеж, Россия
Список литературы
Чучалин А.Г., Авдеев С.Н., Айсанов З.Р., Белевский А.С., Лещенко И.В., Мещерякова Н.Н. и др. Российское респираторное общество. Федеральные клинические рекомендации по диагностике и лечению хронической обструктивной болезни легких. Пульмонология. 2014; (3): 15-54.
Белевский А.С. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких (пересмотр 2011 г.). Пер. с англ. М.: Российское респираторное общество. 2012; 94.
Авдеев С.Н. Хроническая обструктивная болезнь легких: обострения. Пульмонология. 2013; (3): 5-19.
Barnes P.J., Celli B.R. Systemic manifestations and comorbidities of COPD. Eur. Respir. J. 2009; 33: 1165-85.
World Health Organization. Nutritional Anemias: Report of a WHO Scientific Group. WHO Techn. Rep. Ser. N 405. Geneva: World Health Organization; 1968.
Cote C., Zilberberg M.D., Mody S.H., Dordelly L.J., Celli B. Haemoglobin level and its clinical impact in a cohort of patients with COPD. Eur. Respir. J. 2007; 29: 923-9.
John M., Hoernig S., Doehner W., Okonko D.D., Witt C., Anker S.D. Anemia and inflammation in COPD. Chest. 2005; 127: 825-9.
Chambellan A., Chailleux E., Similowski T., ANTADIR Observatory Group. Prognostic value of hematocrit in patients with severe COPD receiving long-term oxygen therapy. Chest. 2005; 128: 1201-8.
John M., Lange A., Hoernig S., Witt C., Anker S.D. Prevalence of anemia in chronic obstructive pulmonary disease: comparison to other chronic diseases. Int. J. Cardiol. 2006; 111: 365-70.
Portillo K., Belda J., Antón P., Casan P. High frequency of anemia in COPD patients admitted in a tertiary hospital. Rev. Clin. Esp. 2007; 207: 383-7.
Halpern M.T., Zilberberg M.D., Schmier J.K., Lau E.C., Shorr A.F. Anemia, costs and mortality in chronic obstructive pulmonary disease. Cost Eff. Resour. Alloc. 2006; 16(4): 17.
Shorr A.F., Doyle J., Stern L., Dolgitser M., Zilberberg M.D. Anemia in chronic obstructive pulmonary disease: epidemiology and economic implications. Curr. Med. Res. Opin. 2008; 24(923): 1123-30.
Cartwright G.E. The anemia of chronic disorders. Semin. Hematol. 1966; 3: 351-75.
Nissenson A.R., Goodnough L.T., Dubois R.W. Anemia: not just an innocent bystander? Arch. Intern. Med. 2003; 163: 1400-4.
Melnikova I. Anaemia therapies. Nature Rev. Drug. Discov. 2006; 5: 627-8.
Будневский А.В., Овсянников Е.С., Чернов А.В., Дробышева Е.С. Диагностическое значение биомаркеров системного воспаления при хронической обструктивной болезни легких. Клин. мед. 2014; 92(9): 16-21.
Будневский А.В., Овсянников Е.С., Чернов А.В., Дробышева Е.С. Биомаркеры как предикторы исходов хронической обструктивной болезни легких (обзор литературы). Молодой ученый. 2014; 5(64): 125-8.
Tassiopoulos S., Kontos A., Konstantopoulos K., Hadzistavrou C., Vaiopoulos G,. Aessopos A. et al. Erythropoietic response to hypoxaemia in diffuse idiopathic pulmonary fibrosis, as opposed to chronic obstructive pulmonary disease. Respir. Med. 2001; 95: 471-5.
Roy C.N. Anemia of inflammation. Hematology. Am. Soc. Hematol. Educ. Program. 2010; 2010: 276-80.
Nemeth E., Tuttle M.S., Powelson J., Vaughn M.B., Donovan A., Ward D.M. et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004; 306: 2090-3.
De Domenico I., Lo E., Ward D.M., Kaplan J. Hepcidin-induced internalization of ferroportin requires binding and cooperative interaction with Jak2. Proc. Natl. Acad. Sci. USA. 2009; 106: 3800-5.
Nemeth E., Valore E.V., Territo M., Schiller G., Lichtenstein A., Ganz T. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute-phase protein. Blood. 2003; 101: 2461-3.
Nemeth E. Iron regulation and erythropoiesis. Curr. Opin. Hematol. 2008; 15: 169-75.
Babitt J.L., Huang F.W., Wrighting D.M., Xia Y., Sidis Y., Samad T.A. et al. Bone morphogenetic protein signaling by hemojuvelin regulates hepcidin expression. Nature Genet. 2006; 38: 531-9.
Kautz L., Jung G., Nemeth E., Ganz T. Erythroferrone contributes to recovery from anemia of inflammation. Blood. 2014; 124(16): 2569-74.
Zhu Y., Ye D., Huang Z. The correlation of cytokines TNF alpha, IFN-gamma, Epo with anemia in rheumatoid arthritis. Zhonghua Xue. Ye. Xue. Za. Zhi. 2000; 21: 587-90.
Papadaki H.A., Kritikos H.D., Valatas V. Anemia of chronic disease in rheumatoid arthritis is associated with increased apoptosis of bone marrow erythroid cells: improvement following anti-tumor necrosis factor-alpha antibody therapy. Blood. 2002; 100: 474-82.
Casaburi R., Bhasin S., Cosentino L., Porszasz J., Somfay A., Lewis M.I. et al. Effects of testosterone and resistance training in men with chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2004; 170: 870-88.
Ferrucci L., Maggio M., Bandinelli S., Basaria S., Lauretani F., Ble A. et al. Low testosterone levels and the risk of anemia in older men and women. Arch. Intern. Med. 2006; 166: 1380-8.
Tsantes A.E., Tassiopoulos S.T., Papadhimitriou S.I., Bonovas S., Poulakis N., Vlachou A. et al. Theophylline treatment may adversely affect the anoxia-induced erythropoietic response without suppressing erythropoietin production. Eur. J. Clin. Pharmacol. 2003; 59: 379-83.
Goodnough L.T., Skikne B., Brugnara C. Erithropoietin, iron, and erythropoiesis. Blood. 2000; 96(3): 823-33.
Suominen P., Punnonen K., Rajamaki A., Irjala K. Serum transferrin receptor and transferrin receptor-ferritin index identify healthy subjects with sub clinical iron deficits. Blood. 1998; 92(8): 2934-9.
Mast A.E., Blinder M.A., Gronowski A.M., Chumley C., Scott M.G. Clinical utility of the soluble transferrin receptor and comparison with serum ferritin in several populations. Clin. Chem. 1998; 44(1): 45-51.
Sawhney M.S. Should patients with anemia and low normal or normal serum ferritin undergo colonoscopy? Am. J. Gastroenterol. 2007: 102(1): 82-8.
Punnonen K., Irjala K., Rajamaki A. Serum transferrin receptor and its ratio to serum ferritin in the diagnosis of iron deficiency. Blood. 1997; 89(3): 1052-7.
Beguin Y. The soluble transferring receptor: biological aspects and clinical usefulness as quantitative measure of erythropoiesis. Hematologica. 1992; 77: 1-10.
Shin Y.J., Baynes R.D., Hudson B.G. Serum transferrin receptor is a truncated form of tissue receptor. J. Biol. Chem. 1990; 265: 19077.
Baynes R.D., Shih Y.J., Cook J.D. Production of soluble transferrin receptor by K562 erythroleukemia cells. Proc. Soc. Exp. Biol. (N.Y.). 1993; 204: 65.
Beguin Y., Huebers H.A., Josephson В., Finch C. Transferrin receptors in rat plasma. Proc. Natl. Acad. Sci. USA 1988; 85: 637.
Cook J.D., Skikne B.S., Baynes R.D. Serum transferrin receptor. Ann. Rev. Med. 1993; (44): 63.
Ganz T., Olbina G., Girelli D., Nemet H.E., Westerman M. Immunoassay for human serum hepcidin. Blood. 2008; 112: 4292-7.
Theurl I., Aigner E., Theurl M., Nairz M., Seifert M., Schroll A. et al. Regulation of iron homeostasis in anemia of chronic disease and iron deficiency anemia: diagnostic and therapeutic implications. Blood. 2009; 113: 5277-86.
Celli B.R., Cote C.G., Marin J.M., Casanova C., Montes de Oca M., Méndez R.A. et al. The bodymass index, airflow obstruction, dyspnea, and exercise capacity index in chronic obstructive pulmonary disease. N. Engl. J. Med. 2004; 350: 1005-12.
Lima D.F., Dela Coleta K., Tanni S.E., Silveira L.V., Godoy I., Godoy I. Potentially modifiable predictors of mortality in patients treated with long-term oxygen therapy. Resp. Med. 2011; 105: 470-6.
Lowenthal R.M., Gill D.S. Twenty-year remission of rheumatoid arthritis in 2 patients after allogeneic bone marrow transplant. J. Rheumatol. 2006; 33: 812-3.
Анемия хронических заболеваний и железодефицитная анемия: сравнительная характеристика показателей феррокинетики и их связь с воспалением у больных ХСН в пожилом и старческом возрасте
Цель: провести сравнительный анализ анемии хронических заболеваний (АХЗ) и железодефицитной анемии (ЖДА) у больных ХСН пожилого и старческого возраста по показателям феррокинетики и воспаления, а также исследование связей между ними. Материал и методы. Обследованы 65 пациентов с ИБС: 35 с ХСН и АХЗ; 10 пациентов с ХСН и ЖДА и 20 пациентов без ХСН, АХЗ и ЖДА, составивших контрольную группу (КГ). Результаты. Выявлено, что у больных ХСН с ЖДА имеется истинный дефицит железа, тогда как у 54% больных ХСН с АХЗ - функциональный дефицит железа, а у 46% - отсутствие дефицита железа. У больных ХСН с АХЗ выявлены весьма значимые относительно пациентов ХСН с ЖДА уровни острофазовых белков - ферритина и гепсидина, а также - С-реактивного белка (СРБ) и интерлейкина-6 (ИЛ -6), при этом между ИЛ-6 и ферритином, ИЛ-6 и СРБ, СРБ и гепсидином выявлены значимые положительные связи. У больных ХСН с ЖДА уровни острофазовых белков - ферритина и гепсидина, а также СРБ и ИЛ-6 - низкие, а связи между ИЛ-6 и ферритином, ИЛ-6 и СРБ, СРБ и гепсидином незначимы. Выявлено, что уровни эритропоэтина значимо повышены как у больных ХСН с АХЗ, так и у больных ХСН с ЖДА относительно пациентов контрольной группы, при этом значимых различий между ними не выявлено.
Ключевые слова
Об авторах
Список литературы
1. Лазарева Н. В., Ощепкова Е. В., Терещенко С. Н. Коморбидность у больных с хронической сердечной недостаточностью (по Данным Регистра ХСН). Кардиологический Вестник. 2016; XI (4):24-31.
5. Anand I. Anemia and Its Relationship to Clinical Outcome in Heart Failure. Circulation. 2004;110 (2):149-54. DOI:10.1161/01. CIR. 0000134279.79571.73
6. Muzzarelli S., Pfisterer M. Anemia as independent predictor of major events in elderly patients with chronic angina. American Heart Journal. 2006;152 (5):991-6. DOI:10.1016/j. ahj. 2006.06.014
7. Anand I.S. Anemia and Chronic Heart Failure. Journal of the American College of Cardiology. 2008;52 (7):501-11. DOI:10.1016/j. jacc. 2008.04.044
8. Ezekowitz JA, McAlister FA, Armstrong P.W. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12065 patients with new-onset heart failure. Circulation. 2003;107 (2):223-5.
10. Зубрихина Г. Н., Блиндарь В. Н., Матвеева И. И. Дифференциальная диагностика анемического синдрома при истинном железодефицитном состоянии и функциональном дефиците железа у больных с хроническими заболеваниями (злокачественными новообразованиями). Терапевтический архив. 2016;88 (4):61-7. DOI: 10.17116/terarkh201688461-67
11. Зубрихина Г. Н., Блиндарь В. Н., Матвеева И. И. Возможности современного автоматизированного клинического анализа крови в дифференциальной диагностике истинного и перераспределительного (функционального) дефицита железа при анемическом синдроме у онкологических больных. Клиническая лабораторная диагностика. 2014;59 (5):21-5.
12. Стуклов Н. И. Дефицит железа и анемия у больных ХСН. Рациональная фармакотерапия в кардиологии. 2017; 13 (5):651 60. DOI: 10.20996/1819-6446-2017-13-5-6 51-660
13. Koorts AM, Viljoen M. Ferritin and ferritin isoforms I: Structure - function relationships, synthesis, degradation and secretion. Archives of Physiology and Biochemistry. 2007;113 (1):30-54. DOI:10.1080/13813450701318583
14. Arezes J., Nemeth E. Hepcidin and iron disorders: new biology and clinical approaches. International Journal of Laboratory Hematology. 2015;37:92-8. DOI:10.1111/ijlh. 12358
15. Camaschella C. Iron-Deficiency Anemia. Longo DL, editor. New England Journal of Medicine. 2015;372 (19):1832-43. DOI: 10.1056/NEJMra1401038
17. van der Meer P., Lok DJ, Januzzi JL, de la Porte PWB-A, Lipsic E., van Wijngaarden J. et al. Adequacy of endogenous erythropoietin levels and mortality in anaemic heart failure patients. European Heart Journal. 2008;29 (12):1510-5. DOI:10.1093/eurheartj/ehn205
18. Блиндарь В. Н., Зубрихина Г. Н., Матвеева И. И. Анемический синдром и основные метаболиты феррокинетики (ферритин, растворимый рецептор трансферрина, прогепсидин, гепсидин-25 и эндогенный эритропоэтин). Медицинский алфавит. 2015;2 (8):16-9.
19. Azerbaijan State Advance Training Institute for Doctors, Baku, Azerbaijan, Zakhidova K.K. Correlation Between Concentration of Pathological Cytokines and Erythropoietin in Patients with Chronic Heart Failure with Anemic Syndrome. Annals of the Russian academy of medical sciences. 2014;69 (1-2):32-7. DOI:10.15690/vramn. v69i1-2.939
20. Nairz M., Theurl I., Wolf D., Weiss G. Iron deficiency or anemia of inflammation? Differential diagnosis and mechanisms of anemia of inflammation. Wiener Medizinische Wochenschrift. 2016;166 (13-14):411-23. DOI: 10.1007/s10354-016-0505-7
21. Drozd M., Jankowska EA, Banasiak W., Ponikowski P. Iron Therapy in Patients with Heart Failure and Iron Deficiency: Review of Iron Preparations for Practitioners. American Journal of Cardiovascular Drugs. 2017; 17 (3): 183-201. DOI: 10.1007/s40256-016-0211-2
24. Diskin C.J. Erythropoietin, haemoglobin, heart failure, and mortality. European HeartJournal. 2008;29 (21):2695-2695. DOI:10.1093/eur-heartj/ehn399
Анемия хронического заболевания
Анемия хронического заболевания является многофакторной анемией. Диагноз обычно требует наличия хронического воспалительного состояния, такого как инфекция, аутоиммунное заболевание, заболевание почек или рак. Состояние характеризуется микроцитарной или нормоцитарной анемией и низким количеством ретикулоцитов. Показатели сывороточного железа и трансферрина, как правило, снижены или в норме, в то время как сывороточный уровень ферритина может быть нормальным или повышенным. Терапия направлена на лечение основного заболевания; кроме того, в некоторых случаях назначается эритропоэтин.
Анемия хронического заболевания является 2-ой по частоте причиной развития анемии во всем мире. На ранних этапах наблюдается нормоцитоз; со временем анемия приобретает микроцитарный характер. Основная проблема заключается в том, что эритропоэз ограничен вследствии неадекватной секвестрации железа.
Этиология анемии хронического заболевания
Выделяют три патофизиологических механизма развития анемии:
Незначительное укорочение продолжительности жизни эритроцитов, обусловленное, как считается, усилением гемофагоцитоза макрофагами, возникает у пациентов с воспалительными заболеваниями.
Эритропоэз нарушается в связи со снижением продукции эритропоэтина (ЭПО) и снижением реакции костного мозга на него.
Метаболизм железа изменяется в связи с увеличением уровня гепсидина, который ингибирует всасывание и рециркуляцию железа, что приводит к секвестрации железа.
Ретикулоэндотелиальные клетки задерживают железо, полученное из старых эритроцитов, делая его недоступным для участия в синтезе гемоглобина (Hb). Таким образом, компенсация анемии путем повышения продукции эритроцитов становится невозможной. Цитокины, синтезируемые макрофагами (интерлейкин-1-бета, фактор некроза опухолей-альфа, интерферон-бета ), у пациентов с инфекционными, воспалительными и онкологическими заболеваниями способствуют снижению продукции эритропоэтина (EPO), а также ухудшают доступность железа за счет увеличения синтеза печеночного гепсидина.
Диагностика анемии хронического заболевания
Симптомы и признаки основного заболевания
Общий анализ крови и сывороточное железо, ферритин, трансферрин и количество ретикулоцитов
Клинические данные анемии хронических заболеваний обычно соответствуют основному заболеванию (инфекционному, воспалительному или онкологическому). Анемию хронического заболевания необходимо подозревать у пациентов с микроцитарной или нормоцитарной анемией, у которых также имеются хронические инфекционные, воспалительные или онкологические заболевания. Если имеется подозрение на наличие анемии хронического заболевания, проводят определение уровня сывороточного железа, трансферрина, ретикулоцитов, а также содержания ферритина в сыворотке крови. Уровень гемоглобина обычно составляет > 8 г/дл (> 80 г/л)при отсутствии дополнительных механизмов, способствующих развитию анемии, таких как сопутствующий дефицит железа (см. таблицу Дифференциальная диагностика микроцитарной анемии, вызванной снижением выработки эритроцитов [Differential Diagnosis of Microcytic Anemia Due to Decreased RBC Production] Дифференциальная диагностика микроцитарной анемии, вызванной снижением выработки эритроцитов ) или ятрогенная флеботомия.
Уровень сывороточного ферритина 100 нг/мл ( Хроническая болезнь почек Хроническая болезнь почек (ХБП) представляет собой длительное прогрессивное снижение почечной функции. Симптомы развиваются медленно и на продвинутых стадиях включают в себя анорексию, тошноту. Прочитайте дополнительные сведения ) свидетельствует о том, что железодефицит может накладываться на анемию хронического заболевания, потому что, уровень сывороточного ферритина, как белка острой фазы воспаления, обычно повышен.
Лечение анемии хронического заболевания
Лечение основного заболевания
Иногда препараты железа
Лечение анемии хронических заболеваний требует лечения основного заболевания. Поскольку анемия обычно характеризуется легкой степенью тяжести, проведение гемотрансфузий, как правило, не требуется.
Основные положения
Почти каждая хроническая инфекция, воспаление или рак могут вызывать анемию; обычно уровень гемоглобина при этом > 8 г/дл (> 80 г/л), если не подключается дополнительный механизм, влияющий на уровень гемоглобина в крови.
В патологический процесс вовлекаются множественные факторы, включая укорочение продолжительности жизни эритроцитов, нарушенный эритропоэз и уменьшение доступности железа.
Анемия первоначально имеет нормоцитарную форму, а затем может перейти в микроцитарную.
Уровни железа и трансферрина сыворотки, как правило, снижены, в то время как уровень ферритина нормальный или повышен.
Лечение основного заболевания.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Анемия хронических заболеваний
Анемия хронических заболеваний – клинический синдром, сопровождающий различные заболевания, в том числе хронические инфекции, злокачественные новообразования, ревматоидный артрит и дисфункцию почек. Этиология анемии хронических заболеваний многогранна и недостаточно изучена.
Патогенез
До недавнего времени молекулярные механизмы и патогенез нарушений распределения железа при анемии хронических заболеваний были неизвестны. Однако исследования последних десятилетий позволили установить полифакториальные патофизиологические механизмы анемии хронических заболеваний (рис. 1). Так, секреция провоспалительных цитокинов при острой инфекции или хроническом заболевании может изменить системный метаболизм железа посредством избыточного синтеза ключевого железорегуляторного гормона гепсидина. Кроме того, гепсидин ингибирует экспорт железа из клеток, блокируя активность ферропортина. Избыток гепсидина является первопричиной снижения концентрации сывороточного железа и ассоциированного с этим нарушения нормального эритропоэза, наблюдающихся при анемии хронических заболеваний.
Установлена несомненная связь между активацией иммунных клеток и ответом провоспалительных цитокинов, которые угнетают выработку эритропоэтина в почках, подавляют пролиферацию клеток эритроидного ростка, сокращают продолжительность жизни эритроцитов и в целом способствуют дисрегуляции гомеостаза железа. Так, отмечено, что интерлейкин (ИЛ) 6, ФНО ингибируют синтез эритропоэтина в почках посредством активации гена GATA‑2 и нуклеарного фактора и экспрессию трансферрина, вследствие чего снижается доставка железа в костный мозг и уменьшается захват железа эритробластами. Провоспалительные цитокины оказывают влияние на процессы депонирования и транспорта железа. Установлено, что ИЛ‑6 угнетает экспрессию белка ферропортина на мембране клеток-депо железа (энтероцитов, гепатоцитов, макрофагов). Он отвечает за транспорт железа из клетки наружу, таким образом, при уменьшении содержания ферропортина нарушается высвобождение железа из депо.
Итак, ключевым звеном патогенеза анемии хронических заболеваний является повышенная экспрессия провоспалительных цитокинов, что приводит к угнетению синтеза эритропоэтина и значительно снижает его эффекты, направленные на усиление пролиферации и созревания эритроидных предшественников.
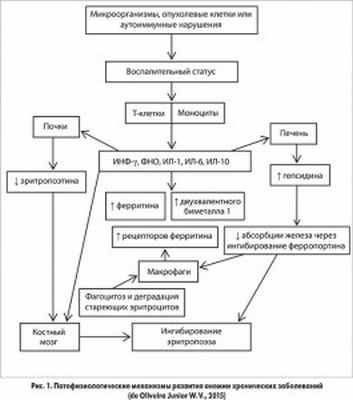
Тяжесть анемии
В соответствии с предложенной ВОЗ (2008) классификацией выделяют 5 степеней тяжести анемии: 0 – норма (уровень гемоглобина ≥110 г/л); 1 – легкая (95-109 г/л); 2 – умеренная (80-94 г/л); 3 – выраженная (65-79 г/л); 4 – тяжелая (угрожающая жизни;
Клиническая картина
Анемия воспаления, или анемия хронических заболеваний, как правило, возникает при различных патологических состояниях и не имеет специфичных клинических проявлений. Отмечаются медленное развитие и, как правило, легкая степень анемии, стертая симптоматика или отсутствие клинических признаков. В большинстве случаев проявления основного заболевания превалируют над анемией, но иногда оно может манифестировать анемическим синдромом. При анемии хронических заболеваний могут наблюдаться усталость, слабость, бледность кожных покровов, сердцебиение, одышка, снижение толерантности к физической нагрузке.
Особо следует подчеркнуть, что при ряде хронических заболеваний имеются и другие факторы, приводящие к анемическому синдрому: железодефицит, недостаточность витамина В12, фолиевой кислоты, повторные кровотечения, гемолиз, хроническая почечная недостаточность с абсолютным дефицитом эритропоэтина, инфильтрация костного мозга при гемобластозах или метастазах солидной опухоли. Подобные случаи не могут рассматриваться как анемия хронических заболеваний.
Диагностика
Дифференциальный диагноз анемии хронических заболеваний
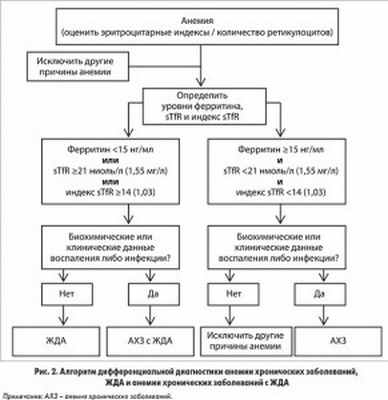
Критерии дифференциальной диагностики анемии хронических заболеваний перечислены в таблице 2, чувствительность и специфичность маркеров отражены в таблице 3. Показано, что ЖДА характеризуется истощением запасов железа (снижением концентрации сывороточного железа, ферритина и компенсаторным повышением содержания эритропоэтина) и сопровождается активацией факторов иммунной системы (повышением уровня ИЛ‑1β, растворимой молекулы межклеточной адгезии sICAM‑1 и, при легкой и средней степени анемии, увеличением содержания лактоферрина). В отличие от ЖДА анемия хронических заболеваний характеризуется недостаточностью запасов железа (снижением уровня сывороточного железа) без активационной реакции эритропоэтина на анемию и сопровождается активацией иммунной системы (повышением содержания ферритина, ИЛ‑1β, sICAM‑1 и лактоферрина).
В исследовании B.S. Skikne, K. Punnonen, P. H. Caldron и соавт. (2011) установлено, что дополнительное определение уровня sTfR и индекса sTfR наряду с содержанием сывороточного ферритина значительно улучшает диагностику ЖДА. Доступность этих исследований повысилась с появлением автоматизированного гематологического анализатора (используется в стационарах и клинических лабораториях) (рис. 2).
Лечение
Предполагается, что при анемии хронических заболеваний могут быть эффективны и другие способы, направленные на повышение доступности железа. Среди них использование малых молекул, ингибирующих активность гепсидина или интернализацию ферропортина, др. Такой подход также может быть более эффективен в сравнении с применением глюконата железа, поскольку уменьшает риск вызванного железом окислительного стресса.
В настоящее время проводятся экспериментальные и клинические исследования по оценке эффективности новых молекул, мишенью которых являются цитокины или гепсидин, ферропортин (табл. 5).
Антицитокиновые препараты, в частности тоцилизумаб и силтуксимаб, одобрены для лечения тяжелой воспалительной патологии. В то же время изучена их эффективность в терапии анемии хронических заболеваний в аспекте клинической симптоматики и качества жизни пациентов, однако необходимы дальнейшие исследования для оценки влияния на исходы основного заболевания, а также безопасности лечения и его побочных эффектов.
Выводы
Анемия воспаления может определяться при инфекционном процессе (бактериальные, вирусные или грибковые инфекции), а также при аутоиммунных заболеваниях, в частности при системной красной волчанке, ревматоидном артрите и др. К появлению анемии хронических заболеваний также приводят хронические состояния, сопровождающиеся незначительно выраженным воспалением, например новообразования, ХБП, ХСН и др. Кроме того, постулируется подобный патогенез развития анемии в процессе старения, при котором отмечается активация провоспалительных цитокинов. Исследования последних десятилетий позволили установить полифакториальные патофизиологические механизмы анемии хронических заболеваний.
Среди многочисленных патологических состояний, сопровождающихся дефицитом железа, основными являются ЖДА и анемия хронических заболеваний. Их дифференциальная диагностика представляет сложность для клиницистов. При анемии хронических заболеваний, как и при ЖДА, имеет место гипохромная анемия с низким содержанием сывороточного железа и одновременным увеличением показателей ферритина, а лечение препаратами железа не приводит к компенсации эритропоэза.
Применение современных диагностических тестов позволяет улучшить и ускорить диагностику анемии.
Поскольку анемия хронических заболеваний является вторичным проявлением основной патологии, лечение последней будет корригировать и анемию, однако такой подход не всегда возможен.
Актуальной тенденцией является изучение новых молекул, мишенью которых являются основные патогенетические звенья анемии хронических заболеваний, в частности цитокины, гепсидин, ферропортин. На сегодня большая часть этих молекул находится на стадии экспериментальных исследований, другие изучаются в доклинических и клинических испытаниях.
Список литературы находится в редакции.
СТАТТІ ЗА ТЕМОЮ Діагностика
Система гемостазу є складною, адже фізіологічно вона призначена для захисту людини від кровотечі. Ця система задіюється одразу після ушкодження ендотелію судин з одночасною синергічною взаємодією тромбоцитів і факторів згортання. Водночас у здорових людей цей процес здійснюється так, щоб уникнути надлишкового утворення та відкладення фібрину всередині кровоносних судин, з одного боку, і бути готовим зупинити кровотечу – з іншого. Для досягнення цієї найважливішої мети потрібне тонке регулювання її діяльності. Інакше кажучи, всі дії системи гемостазу перебувають під постійним контролем для забезпечення ідеального балансу на відстані від Сцилли (кровотеча) та Харибди (тромбоз). Ця система є динамічною і дуже залежить від віку. Існують значні відмінності між системою згортання в новонароджених порівняно з дітьми та дорослими. Так само як Одіссею та аргонавтам для того, щоб вижити, потрібно було пропливти через вузьку протоку між Сциллою та Харибдою, так і новонародженому в перші години та дні життя необхідно лавірувати між ризиком тромбозу та ризиком геморагії. .
Наприкінці листопада 2021 року дослідники з Південно-Африканської Республіки (ПАР) повідомили про новий варіант коронавірусу B.1.1.529, який має більшу частоту мутацій, ніж його попередники. Перший підтверджений випадок був зареєстрований 9 листопада 2021 р. в Ботсвані, далі кілька випадків інфікування виявлено в ПАР [1]. 26 листопада Всесвітня організація охорони здоров’я (ВООЗ) віднесла новий варіант коронавірусу до вірусів, що «викликають стурбованість» (variants of concern – VOC), і дала йому найменування, яке відповідає 15-й літері грецького алфавіту – «омікрон» [2]. .
Тромбоз глибоких вен (ТГВ) і легенева емболія (ЛЕ) є проявами одного захворювання під назвою венозна тромбоемболія (ВТЕ), яка становить серйозну проблему для охорони здоров’я й залишається предметом обговорення в клінічній медицині, що зачіпає лікарів усіх спеціальностей. Щорічна частота венозних тромбозів становить 0,1-0,3% на рік, у європейській популяції вони трапляються в 1-2 осіб на 1000 випадків 6. Симптоматичну тромбоемболію легеневої артерії (ТЕЛА) має приблизно третина пацієнтів із венозним тромбозом [7].
Как диагностировать и лечить анемию хронических заболеваний

Анемия хронических заболеваний — вторая по распространенности анемия, нередко сопровождающая воспалительные процессы, онкологические и аутоимунные заболевания. Особенно часто этот вид анемии встречается у пожилых людей.
Почему врачу важно знать про этот тип анемии?
Согласно одной из классификаций все анемии делят на 3 группы:
1) дефицитные анемии, связанные с недостатком железа или витаминов В12/В9;
2) анемия хронических заболеваний;
3) гемолитические анемии (включая пациентов с гемобластозами и состояния, связанные с недостаточностью костного мозга или с повышенным разрушением клеток красной крови (гемолитические).
Пациентов из 1-й группы лечат, как правило, терапевты, пациентов из 3-й группы — врачи-гематологи, а пациентов с АХЗ из 2-й группы ведут врачи всех специальностей — это пациенты с онкопатологией, инфекционно-воспалительными и аутоиммунными заболеваниями.
Патогенез анемии хронических заболеваний
● Повышенное содержание гепсидина, который является маркером воспаления или инфекции. Он не позволяет железу всасываться или высвобождаться из трех основных источников: кишечника, макрофагов печени/селезенки и гепатоцитов. Пациент не может восполнить дефицит этого элемента даже принимая препараты.
Такой патогенез АХЗ чаще всего встречается при хронических заболеваниях кишечника (болезнь Крона, неспецифический язвенный колит) и ревматических болезнях.
Как это работает?
Низкий уровень гепсидина в крови свидетельствует о дефиците железа в организме и активирует все три пути поступления железа в организм. А при воспалении, инфекции или онкозаболевании гепсидин повышается, как белок острой фазы воспаления. Получается замкнутый круг: дефицит железа есть, но высокий уровень «воспалительного гепсидина» у пациентов с онко- и воспалительными хроническими заболеваниями не дает его восполнить.
● Влияние фактора некроза опухолей α (ФНО-α), интерлейкина-1 (ИЛ-1), и других цитокинов на клетки-предшественники. Это приводит к торможению выработки и созревания эритроцитов, угнетению продукции эритропоэтина, который также важен для стимуляции эритропоэза.
Такой патогенез АХЗ чаще встречается при хронических заболеваниях почек.
Как это работает?
На синтез эритропоэтина, который отвечает за стимуляцию эритропоэза (образование новых эритроцитов) влияют не только хронические болезни почек, но и любые воспалительные заболевания, потому что в крови повышается содержание провоспалительных цитокинов (ИЛ-6, ИЛ-1), которые снижают секрецию эритропоэтина.
Как диагностировать АХЗ?
● Размер эритроцитов (MCV) в норме, реже снижен (в отличие от железодефицитной анемии).
● Содержание гемоглобина в эритроцитах (MCH) в норме, реже ниже нормы.
*Таким образом, чаще всего анемия хронических заболеваний — это нормоцитарная нормохромная анемия.
● Важным признаком, отличающим железодефицитную анемию от АХЗ, является снижение ферритина. При АХЗ уровень ферритина остается нормальным или повышается как острофазовый белок воспаления/инфекции или онкомаркер при онкозаболеваниях.
● При постановке диагноза АХЗ надо ответить на вопрос: «Дефицит железа является абсолютным (истинным) или функциональным (перераспределительным)?». Тактика лечения будет разной: в первом случае назначение препаратов железа приведет к быстрой компенсации дефицита и выздоровлению, во втором — их прием будет бесполезным.
Как лечить анемию хронических заболеваний?
1. Лечение основного заболевания.
Выше разобран патогенез анемии — для понимания того, что при АХЗ в первую очередь надо лечить основное заболевание. Снижая активность воспалительного процесса в организме, мы даем возможность железу при его дефиците всасываться из ЖКТ. Бывают ситуации, когда это невозможно. Единственное утешение — АХЗ развивается медленно и чаще имеет легкую степень тяжести.
2. Переливание эритроцитарной массы и эритропоэзстимулирующие препараты, с или без сочетания с внутривенными препаратами железа — при тяжелом течении анемии.
В любом случае лечением АХЗ должны заниматься грамотные специалисты, самодиагностики и самолечения здесь быть не должно.
Читайте также:
