Ангиоиммунобластная лимфома. Гистология ангиоиммунобластной лимфомы.
Добавил пользователь Skiper Обновлено: 29.01.2026
Метод определения Гистологическое исследование биоптата согласно гистологической классификации Всемирной организации здравоохранения (ВОЗ) с окрашиванием гематоксилином-эозином. ИГХ-исследование с применением спектра антител (до пяти антител) (пероксидазный и авидин-биотиновый методы).
Комплексное исследование биоптатов при лимфопролиферативных заболеваниях, включающее морфологическое описание и оценку экспрессии спектра опухолевых маркеров, для определения тактики лечения и прогноза.
Лимфомы относят к заболеваниям кроветворной ткани – гемобластозам, среди которых выделяют лейкозы и гематосаркомы. Для лимфом характерно развитие очаговых опухолевых разрастаний из элементов кроветворной ткани без поражения костного мозга (лимфатического узла) на ранних стадиях. Этиология лимфом окончательно не установлена. Риск развития неходжкинских лимфом ассоциируется с инфекционными агентами (вирусом Эпштейна-Барр (ВЭБ), вирусом иммунодефицита человека (ВИЧ), человеческим Т-клеточным лимфотропным вирусом типа I), факторами внешней среды (ионизирующим излучением, пестицидами), первичным и вторичным (ятрогенным) иммунодефицитом, аутоиммунными заболеваниями.
В соответствии с российскими клиническими рекомендациями по диагностике и лечению лимфопролиферативных заболеваний (2013), диагноз устанавливают на основании морфологического исследования биопсийного или операционного материала с помощью гистологических и иммуногистохимических методов. Морфологическое исследование должно выполняться патологом-экспертом и соответствовать критериям текущей классификации Всемирной организации здравоохранения (ВОЗ). Объем иммуногистохимического исследования определяет врач-патологоанатом при гистологическом изучении биоптата. В отдельных случаях проводятся молекулярно-биологическое и генетическое исследования. Цитологическое исследование пунктатов или мазков-отпечатков лимфоузла или других опухолевых очагов не является достаточным основанием для нозологической верификации лимфом.
Пункционная биопсия или трепанобиопсия опухоли с диагностической целью могут быть выполнены только в исключительных случаях при необходимости немедленного лечения.
Дифференциальная диагностика наиболее часто встречающихся лимфом с учетом классификации ВОЗ (2008) и российских клинических рекомендаций по диагностике и лечению лимфопролиферативных заболеваний (2013).
Заболеваемость лимфомой Ходжкина (ЛХ) в России составляет 2,1 случая на 100 тысяч населения в год. Заболевание возникает в любом возрасте, но преимущественно в интервале 16-35 лет, в этой возрастной группе в России преобладают женщины. Критерии диагноза: все варианты классической ЛХ характеризуются единым иммунофенотипом: CD30+, CD15+, PAX-5+. В опухолевых клетках может обнаруживаться вирус Эпштейна-Барр (LMP1/EBER).
Фолликулярная лимфома (ФЛ) занимает второе место по частоте всех злокачественных лимфопролиферативных заболеваний взрослых. Этот показатель значительно варьирует в разных географических регионах, зависит от этнической и расовой принадлежности больных. Медиана возраста пациентов составляет 60 лет, соотношение мужчин и женщин приблизительно 1:1,7. Иммунофенотип: В-клеточная лимфома с иммунофенотипом CD20+, CD10+/-, BCL-2+, BCL-6+, CD3-, CD5-, CD23+/-, CD43-, сyclin D1-. В редких случаях ФЛ может быть BCL-2-негативная. В таком случае рекомендовано цитогенетическое исследование для выявления t(14;18) или реаранжировки BCL-2. Пролиферативный индекс обычно не превышает 20%, Ki-67 > 30% ассоциируется с неблагоприятным прогнозом.
Лимфомы маргинальной зоны (ЛМЗ) представляют собой группу злокачественных В-клеточных новообразований, происходящих из В-лимфоцитов, которые в норме встречаются в маргинальной зоне в фолликулах лимфатических узлов (ЛУ), селезенки и лимфатических тканей. Выделяют три типа ЛМЗ:
- нодальную лимфому;
- экстранодальную MALT (Mucosa-Associated Lymphoid Tissue – мукозоассоциированную) лимфому;
- лимфому селезенки.
В-клеточная лимфома Диффузная крупноклеточная B-клеточная лимфома (ДВКЛ) является наиболее распространенным вариантом лимфом взрослых (30% от всех неходжкинских лимфом). Заболеваемость составляет 4-5 случаев на 100 тысяч населения в год. Риск развития болезни увеличивается с возрастом (медиана заболеваемости – 63 года). Мужчины и женщины болеют почти с равной частотой. Иммунофенотип: экспрессия пан-В-клеточных антигенов CD20+, CD79a+, PAX 5+, CD45+, CD3-. ДВКЛ, как правило, характеризуется высокой митотической и пролиферативной активностью. Ki-67 экспрессируется в широком диапазоне: от 40 до 90%, в отдельных наблюдениях превышает 90%. При наличии технической возможности в алгоритм диагностики может включаться генетическое исследование с определением наличия перестройки генов MYC (до 10% случаев), BCL-6 (до 30% случаев), t(14;18)(q32;q21).
Лимфома из клеток мантии (ЛКМ) составляет около 6% от числа лимфатических опухолей. Болеют преимущественно пожилые мужчины (медиана заболеваемости – 65-75 лет, соотношение мужчин и женщин – 3:1). Опухоль клинически и морфологически гетерогенна, в большинстве случаев (70-80%) в дебюте выявляется генерализованное поражение ЛУ, селезенки и экстранодальных областей. Это агрессивная лимфома, при которой общая выживаемость больных составляет 3-5 лет. Заболевание характеризуется коротким временем до прогрессирования, первый рецидив обычно химиорезистентен. Иммунофенотип: CD20+, CD5+/CD43+, сyclin D1+, BCL-2+, CD3-, CD23- (редкие случаи ЛКМ могут экспрессировать CD10, CD23, BCL-6). Индекс пролиферации менее 30%, как правило, ассоциируется с благоприятным течением заболевания, при бластоидном варианте он может достигать 80-90%. В сложных диагностических случаях целесообразно выполнение цитогенетического/FISH-исследования для выявления t(11;14). В редких случаях при типичной клинической и иммуноморфологической картине отсутствуют t(11;14)(q13;q32) и гиперэкспрессия сyclin D1, имеется гиперэкспрессия cyclin D2 или cyclin D3. В случаях cyclin D1-негативных лимфом из клеток мантии можно дополнительно использовать антитела к p27.
Редкая группа заболеваний, которая характеризуется патобиологической гетерогенностью и составляет около 15% от всех лимфом. Вне зависимости от особенностей своего развития и течения, за редким исключением, это агрессивные лимфомы с плохим прогнозом. Наиболее распространенные формы: - периферическая Т-клеточная лимфома. Иммунофенотип: CD2+, CD3+, CD4+, CD5+, CD7+, CD8+, с признаками аберрантности иммунофенотипа (утратой некоторых из них), часть клеток может экспрессировать CD30. - ангиоиммунобластная Т-клеточная лимфома. Иммунофенотип: опухолевые клетки экспрессируют пан-Т-клеточные маркеры, CD4+ преобладают над CD8+. Возможна утрата какого-либо из пан-Т-клеточных антигенов как проявление аберрантного фенотипа. Вариабельное количество опухолевых Т-клеток экспрессирует CD10, BCL6. Наиболее специфичным, но менее чувствительным маркером для данного варианта лимфомы является наличие антител к CXCL13. - анапластическая крупноклеточная лимфома (АККЛ). Иммунофенотип: ключевым иммунофенотипическим признаком является экспрессия CD30 и полиморфная/анаплазированная морфология. Опухолевые клетки имеют аберрантный фенотип с утратой некоторых Т-клеточных антигенов. В части случаев не удается доказать Т-клеточный иммунофенотип (так называемые 0-клеточные АККЛ). Часто обнаруживается экспрессия цитотоксических молекул (TIA-1, granzyme В, perforin). Экспрессия CD45 и EMA вариабельна.
Хронический лимфолейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых. Частота его в европейских странах составляет 4:100 тысяч населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30:100 тысяч человек в год. Медиана возраста на момент установления диагноза в европейских странах – 69 лет. В России ХЛЛ выявляется реже и медиана возраста на момент установления диагноза меньше, соразмерно меньшей продолжительности жизни россиян. Иммунофенотип: ХЛЛ характеризуется гетерогенной экспрессией CD20, коэкспрессией CD5, CD23, CD43.
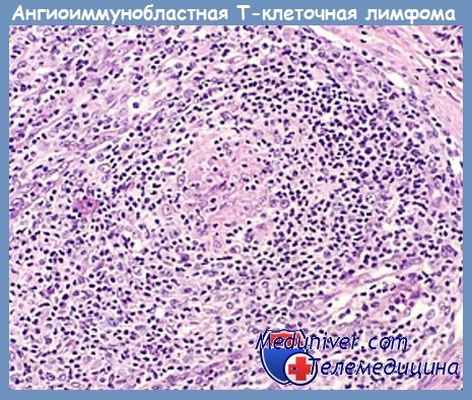
Ангиоиммунобластная лимфома. Гистология ангиоиммунобластной лимфомы.
Ангиоиммунобластная лимфома. Гистология ангиоиммунобластной лимфомы.
Первые описания ангиоиммунобластной лимфомы (A1LT) как «иммунобластной лимфаленонатии» или «ангиоиммунобластной лимфаденопатии с диспротеинемией» относятся к середине 1970-х, где AILT характеризуется, в основном, как реактивный системный процесс. Наряду с этим указывается, что в конечном итоге AILT является предзлокачественным процессом с неблагоприятным прогнозом и развитием у части больных истинной лимфомы. Не исключено, что ранее в большинстве случаев ставился диагноз лимфомы Ходжкина или реактивного процесса неясной этиологии.
Использование молекулярных методик по выявлению моноклональных Т-клеточных популяций показало, что AILT в большинстве случаев изначально является Т-клеточной опухолью (Dogan).
Этиология AILT, как и большинства лимфом, неизвестна. В ранних исследованиях у многих больных в анамнезе отмечена медикаментозная терапия, особенно антибиотики; однако не исключено, что они назначались им из-за появления системных проявлений, имитирующих на ранних стадиях заболевания инфекционный процесс. Изучение роли вирусного поражения в развитии опухоли показало интересную связь с вирусом Эпштейна-Барр (EBV), что будет рассматриваться далее, и отсутствие других убедительных ассоциаций.
AILT насчитывают до 15—20 % Т-клеточных лимфом и 1-2 % неходжкинских лимфом. Большинство больных находятся в возрасте между 50 и 70 годами (средний возраст составляет 59—64 года) с одинаковой заболеваемостью мужчин и женщин. Типичными для заболевания являются системные проявления, генерализованная лимфадснопатия и гепатоспленомегалия. У некоторых также отмечается кожная сыпь и зуд, асцит, выпот в плевральной полости и артриты. Исследования показали поликлопальную гипергаммаглобулинемию, повышение СОЭ и лактатдегидрогиназы (ЛДГ), анемию, нередко Кумбс-позитивного аутоиммунного типа.
Могут определяться и другие антитела: ревматоидный фактор, аутоантитела к щитовидной железе и антигладкомышечные антитела.
Несмотря на интенсивную химиотерапию, прогноз остается неблагоприятным с 5-тилетнсй выживаемостью только 20—30 % больных. Это частично обусловлено связанным с заболеванием иммунодефицитом и развитием у многих больных смертельных инфекционных осложнений.
Гистология ангиоиммунобластной лимфомы.
Первичный диагноз AILT обычно зависит от биопсии лимфатическою узла. Биопсии из экстранодальных зон, таких как кожа, селезенка, печень, костный мозг и легкие, менее достоверны, поскольку диагноз определяется сочетанием структурных и цитологических признаков.
Изначально диагностическими признаками ангиоиммунобластной лимфаденопатии считались наличие ветвящихся кровеносных сосудов, окруженных аморфным окрашивающимся по ШИК веществом и полиморфного инфильтрата, включающего плазмоциты, гистиоциты, нейтрофилы и юзинофилы. Достоверным признаком считалось также наличия рассеянных крупных, похожих на бласты клеток, отчасти напоминающих клетки Ходжкин/Рид-Штернберга. На светлых клетках в ранних описаниях внимание не акцептировалось, однако сегодня признано, что они представляют собою злокачественную популяцию. Эти клетки являются промежуточной формой образования крупных клеток со светлой питоплазмои, встречающихся по одиночке или группами.
Они проявляют различную степень атипии и имеют тенденцию к расположению вокруг пролифсрирующих сосудов. В большинстве AILT-биопсий встречаются также гипоклеточные, эозинофильные области, соответствующие областям «выгоревших» фолликулов с пролиферацией дендритных клеток. В настоящее время наличие этого признака учитывается в постановке диагноза, однако признается также возможность вариантов с гиперпластическими фолликулами (Ree и соавт., 1998). Ветвящиеся сосуды с высоким эндотелием отчетливо выявляются в срезах, окрашенных на ретикулин и по методу ШИК. При окрашивании по ШИК вокруг сосудов определяется толстый слой ШИК-позитивного вещества базальной мембраны.
Нормальная структура узла стертая за счет полиморфного инфильтрата, нередко распространяющегося в периузловые ткани, но без инфильтрации субкапсулярного синуса, который остается зияюшим Ottavianni и соавт.).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Т-клеточная лимфома
T-клеточные лимфомы встречаются реже В-клеточных, а их классификация затруднена в связи с разнообразием проявлений. Кроме того, большинство этих лимфом протекает агрессивно, поэтому только своевременная диагностика (морфологическая верификация диагноза с иммуногистохимическим исследованием ) позволяет назначить правильное лечение и значительно улучшить прогноз заболевания.
Т-клеточные лимфомы могут поражать лимфатические узлы :
- ангиоиммунобластная лимфома - проявляется общими симптомами (сыпь, увеличение периферических лимфоузлов, увеличением размеров печени и селезёнки), повышенной концентрацией гамма-глобулинов в крови, гемолитической анемией. Этот вид лимфомы, особенно на ранних стадиях, легко ошибочно принять за проявления инфекционного процесса.
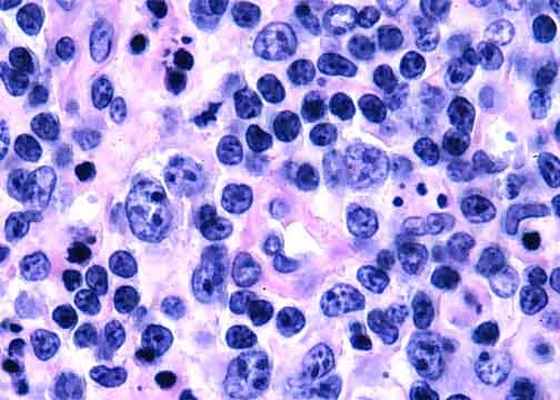
- анапластическая крупноклеточная лимфома – ещё один вид лимфомы, который чаще встречается у детей и молодых людей. Часто заболевание проявляется общими симптомами: повышением температуры, ночная потливость, потеря массы тела. Кроме лимфатических узлов, часто поражаются кожа, кости, мягкие ткани, костный мозг, легкие и печень. Во многих случаях в опухолевых клетках присутствует общая генетическая мутация – транслокация t(2;5), ее наличие ассоциировано с хорошим прогнозом заболевания.
- Периферическая T-клеточная лимфома неспецифицированная – одна из наиболее агрессивных форм неходжкинских лимфом. При ней в опухолевый процесс вовлекаются костный мозг, печень, селезёнка и кожа, кроме того при поражении костного мозга лимфома может трансформироваться в лейкоз. Этот вид лимфомы обычно плохо поддается лечению.
- Т-клеточная лимфома/лейкоз взрослых возникает у людей, инфицированных вирусом Т-клеточного лейкоза человека 1 типа (HTLV-1) и встречается только в местах, где распространен этот вирус (Япония, страны Западной Африки)
или локализоваться в других органах:
- Т-клеточная лимфома энтеропатического типа,
- первичная кожная анапластическая крупноклеточная лимфома,
- грибовидный микоз/синдром Сезари – варианты Т-клеточной лимфомы кожи. Грибовидный микоз протекает стадийно, сначало в форме пятен, затем принимает форму бляшки и затем – опухоли. Синдром Сезари протекает более агрессивно, с покраснением кожи , поражением костного мозга и лимфатических узлов. Кроме лимфоузлов, при далеко зашедших стадиях обычно поражаются лёгкие, селезёнка и печень.
- экстранодальная NK/T-клеточная лимфома, назальный тип – высокоагрессивная лимфома с характерным поражением носа и его придаточных пазух.
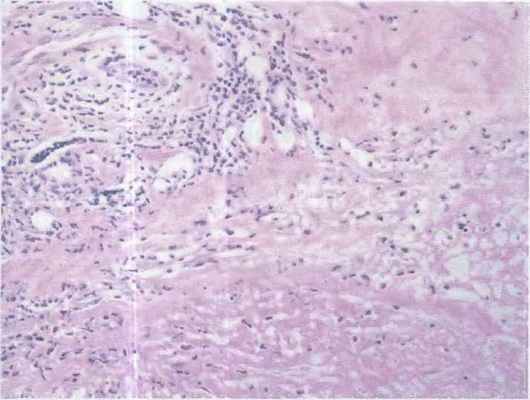
- гепатоспленическая Т-клеточная лимфома – протекает с первичным поражением печени и селезёнки,
- подкожная панникулитоподобная Т-клеточная лимфома – редкий вид лимфомы, при котором поражается подкожная жировая клетчатка.
Лечение Т-клеточных лимфом – химиотерапия . При распространенном процессе возможно применение высокодозной химиотерапии и лучевой терапии, а при рецидивах используется трансплантация костного мозга и гемопоэтических стволовых клеток.
Периферические Т-клеточные лимфомы (ПТКЛ)
Периферические Т-клеточные лимфомы (ПТКЛ) представляют собой лимфомы, происходящие из зрелых (посттимических) Т-лимфоцитов и NK-клеток с первичными нодальными или экстранодальными манифестациями. ПТКЛ составляют более 10% всех диагностируемых неходжкинских лимфом.
Цель первичной системной терапии куративная. Однако примерно в 30% случаев может возникать рефракция на терапию. Ответ на последующую терапию, как правило, хуже, поэтому терапии второй линии рекомендовано проводить в рамках исследовательских программ.
Факторы риска
Причины возникновения неходжкинских лимфом, в том числе периферических Т-клеточных лимфом до конца не изучены. Согласно исследованиям, к факторам риска развития заболевания можно отнести длительный прием иммуносупресивных препаратов, а также наличие глютеновой энтеропатии (целиакии).
Заболевание может возникнуть в любом возрасте, однако чаще поражает людей старше 60 лет. Мужчины заболевают чаще женщин, соотношение составляет 3:2.
Симптомы заболевания
Как и при других видах лимфом, начальными признаками заболевания часто являются увеличенные безболезненные лимфатические узлы и/или экстранодальные манифестации. При Т-клеточных лимфомах, ассоциированных с энтеропатией и мономорфной эпителиотропной Т-клеточной лимфоме экстранодальные манифестации возникают, как правило, в области гастроинтестинального тракта, при экстранодальной NK-T-клеточной лимфоме носового типа, в области носа и его придаточных пазух. Панникулитоподобная Т-клеточная лимфома проявляется в виде подкожных уплотнений.
Типичной для периферических Т-клеточных лимфом является В-симптоматика (потеря веса, ночное потоотделение, сильная слабость) и высокая подверженность инфекциям. При ангиоиммунобластной Т-клеточной лимфоме часто наблюдаются поликлональная гипергаммаглобулинемия, кумбс-положительная гемолитическая анемия или Эппштейн-Барр ассоциированные и клональные В-клеточные пролифирации.
Классификация периферических Т-клеточных лимфом
Всемирная организация здравоохранения классифицирует следующие формы периферических Т-клеточных лимфом:
Т-клеточный пролимфоцитарный лейкоз (T-PLL)
Т-клеточный лейкоз из больших гранулярных лимфоцитов (Z-LGL)
Хроническое лимфопролиферативное нарушение NK-клеток (CLPD-NK)
Агрессивный NK-клеточный лейкоз (ANKL)
Эппштейн-Барр ассоциированная + T-клеточная лимфома детского возраста (EBVT)
Гидроа-вакциниформное лимфопролиферативное заболевание (HV-подобная LPD)
Взрослый Т-клеточный лейкоз/лимфома (ATLL)
Экстранодальная NK/T-клеточная лимфома носового типа (ENKTL)
Т-клеточная лимфома ассоциированная с энтеропатией (EATL)
Мономорфная эпителиотропная интестинальная Т-клеточная лимфома (MEITL)
Индолентное Т-клеточное лимфопролиферативное заболевание ЖКТ (ITCLD-GT)
Гепатолиенальная Т-клеточная лимфома (HSTL)
Подкожная панникулитоподобная Т-клеточная лимфома (SPTCL)
Грибовидный (фунгоидный) микоз (MF)
Синдром Сезари (SS)
Первичные кожные CD30+Т-клеточные лимфопролиферативные заболевания (PCTPD)
- Лимфоматоидный папулез (LyP);
- Первичная кожная анапластическая крупноклеточная лимфома (PCALCL).
Первичная кожная yo-Т-клеточная лимфома (PCGDTCL)
Первичная кожная агрессивная эпидермотропная CD8+ цитотоксическая Т-клеточная лимфома (PCACETL)
Первичная кожная акральная CD8+ Т-клеточная лимфома (PCATCL)
Первичная кожная CD4+ у мелко-/среднеклеточные Т-клеточные лимфопролиферативные нарушения (PCSM-LPD)
Периферическая Т-клеточная лимфома, NOS (PTCL, NOS)
Ангиоиммунобластная Т-клеточная лимфома (AITL)
Фолликулярная Т-клеточная лимфома (FTCL)
Нодальная периферическая Т-клеточная лимфома с TFH-фенотипом (PTCLTFH)
Анапластическая крупноклеточная лимфома, ALK+ (ALCL, ALK+)
Анапластическая крупноклеточная лимфома, ALK- (ALCL, ALK-)
Ассоциированная с грудным имплантом анапластическая крупноклеточная лимфома (BIA-ALCL)
Диагностика периферических Т-клеточных лимфом
Диагноз Т-клеточная лимфома ставится на основании патологического исследования тканей (например, анализа удаленного лимфатического узла, или биопсии других тканей). Очень часто необходимыми являются иммунологические или молекулярно-биологические исследования. Во многих случаях целесообразно проведение второго пересмотра заключения патологоанатомами, специализирующимися на диагностике лимфом.
Пункция костного мозга
Во время проведения пункции (биопсии) осуществляется забор клеток и тканей костного мозга. Это, как правило, является частью контроля за состоянием пациентов при патологиях крови.
Для определения распространения заболевания и его стадии проводятся такие обследования как:
- Компьютерная томография (КТ), при необходимости в комбинации с позитронно-эмиссионной томографией (ПЭТ), шеи, грудной клетки, живота и малого таза;
- Магнитно-резонансная томография (МРТ);
- При поражении костного мозга проводят пункцию костного мозга;
- При неврологических жалобах возможно проведение люмбальной пункции.
Многочисленные анализы крови позволяют сделать заключение об активности заболевания и наличии сопровождающих заболеваний, например вирусной инфекции. Кроме этого, проводятся обследования функции органов, например, ЭКГ и эхокардиография.
Первичный Т-клеточный лейкоз поражает, в первую очередь, органы лимфатической системы — лимфатические узлы и селезенку, но также костный мозг и другие органы, такие как кожа. Подтверждение диагноза в данном случае основывается преимущественно на анализе клеток крови, например, микроскопически и с помощью так называемой проточной цитофлуориметрии, для исследования картины признаков поверхностей клеток, а также на основе биопсии поврежденных тканей.
Автореферат и диссертация по медицине (14.00.15) на тему: Гистологическая и иммуногистохимическая дифференциальная диагностика неходжкинских лимфом
Оглавление диссертации Криволапов, Юрий Александрович :: 2006 :: Санкт-Петербург
СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ.
1.1 Исторический очерк развития представлений о лимфомах и эволюция гистологических классификаций неходжкинских лимфом.
1.2 Онтогенетические основы морфологической диагностики лимфом.
1.3 Методические основы иммуногистохимии и характеристика иммунологических маркеров, применяемых в морфологической диагностике лимфом.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ.
2.1 Гистологические методы исследования биопсийного материала.
2.2 Методика иммуногистохимического исследования биопсийного и операционного материала.
2.3 Методы клинического обследования больных лимфомами.
2.4 Методы математической обработки результатов исследования.
ГЛАВА 3. ОБЩАЯ ХАРАКТЕРИСТИКА ОБСЛЕДОВАННОЙ ГРУППЫ ПАЦИЕНТОВ С НЕХОДЖКИНСКИМИ ЛИМФОМАМИ.
3.1 Общая клиническая характеристика больных неходжкинскими лимфомами.
3.2 Анализ частоты встречаемости различных вариантов неходжкинских лимфом.
ГЛАВА 4. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ДИФФУЗНЫХ
4.1 Морфология диффузных крупноклеточных В-кпеточных лимфом.
4.2 Результаты иммуногистохимического анализа диффузных крупноклеточных В-клеточных лимфом.
4.3 Морфология и иммунофенотип медиастинальной крупноклеточной В-клеточной лимфомы.
4.4 Морфология и иммунофенотип внутрисосудистой крупноклеточной В-клеточной лимфомы.
4.5 Морфология и иммунофенотип лимфом Беркитта.
4.6 Характеристика морфологических признаков и оптимизация иммуногистохимического исследования с целью дифференциальной диагностики крупноклеточных лимфом диффузного строения.
ГЛАВА 5. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ДИФФУЗНЫХ МЕЛКОКЛЕТОЧНЫХ ЛИМФОМ.
5.1 Морфология и иммунофенотип В-клеточной лимфомы из малых лимфоцитов.
5.2 Морфология и иммунофенотип лимфомы из клеток зоны мантии
5.3 Морфология и иммунофенотип лимфом маргинальной зоны.
5.4 Морфология и иммунофенотип лимфоплазмоцитарной лимфомы.
5.5 Морфология и иммунофенотип волосатоклеточного лейкоза.
5.6 Морфология и иммунофенотип фолликулярных лимфом диффузного строения.
5.7 Характеристика морфологических признаков и оптимизация иммуногистохимического исследования с целью дифференциальной диагностики диффузных лимфом из мелких клеток.
ГЛАВА 6. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ЛИМФОМ ИЗ КЛЕТОК С ВЛАСТНОЙ МОРФОЛОГИЕЙ.
6.1 Морфология и иммунофенотип лимфом из клеток-предшественников В-лимфоцитов и Т-лимфоцитов (В- и Т-лимфобластных лимфом).
6.2 Морфология и иммунофенотип NK-клеточной бластной лимфомы.
6.3 Характеристика гистологических признаков лимфом из клеток с бластной морфологией и оптимизация иммуногистохимического исследования с целью дифференциальной диагностики.
ГЛАВА 7. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ЛИМФОМ ПОЛИМОРФНОКЛЕТОЧНОГО И АНАПЛАСТИЧЕСКОГО СТРОЕНИЯ.
7.1 Морфология и иммунофенотип ангиоиммунобластной лимфомы.
7.2 Морфология и иммунофенотип панникулитоподобной Т-клеточной лимфомы подкожной жировой клетчатки.
7.3 Морфология и иммунофенотип экстранодалыюй NK/T-клеточной лимфомы назального типа.
7.4 Морфология и иммунофенотип Т-клеточной лимфомы типа энтеропатии.
7.5 Морфология и иммунофенотип лимфомы из клеток с иммуно-фенотипом периферических Т-лимфоцитов, неуточненной.
7.6 Морфология и иммунофенотип Т-клеточного пролимфоцитарного лейкоза.
7.7 Морфологическая картина и иммунофенотип крупноклеточной анапластической лимфомы.
7.8 Характеристика гистологических признаков лимфом полиморфноклеточного и анапластического строения и оптимизация иммуногистохимического исследования с целью дифференциальной диагностики.
ГЛАВА 8. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ОПУХОЛЕВЫХ И ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ ФОЛЛИКУЛЯРНОГО СТРОЕНИЯ В ЛИМФОИДНОЙ ТКАНИ.
8.1 Морфология и иммунофенотип фолликулярных лимфом.
8.2 Характеристика морфологических признаков и оптимизация иммуногистохимического исследования с целью дифференциальной диагностики фолликулярных лимфом и фолликулярной гиперплазии лимфатических узлов.
Введение диссертации по теме "Патологическая анатомия", Криволапов, Юрий Александрович, автореферат
Актуальность проблемы. Лимфомы являются гетерогенной группой злокачественных опухолей лимфоидной ткани, которые традиционно делят на лимфому Ходжкина (лимфогранулематоз) и неходжюшские лимфомы [59, 141, 524, 687,810].
В странах, где достоверная регистрация впервые выявленных случаев злокачественных опухолей позволяет сравнивать заболеваемость в прошлом и настоящем, отмечается ощутимый рост заболеваемости неходжкинскими лим-фомами [487, 661, 833]. С 70-х годов XX века в Соединенных Штатах Америки ежегодный прирост заболеваемости неходжкинскими лимфомами составляет 3— 4%. Долгосрочное популяционное исследование по программе SEER Национального института рака США обнаружило для всех полов и возрастных групп почти двухкратный рост заболеваемости лимфомами в Соединенных Штатах за последние 28 лет прошедшего столетия (с 10,2 на 100000/г в 1973 г. до 19,0 на 100000/г в 2000 г.) [258, 426]. Увеличение частоты новых случаев неходжкин-ских лимфом происходит в мужской и женской популяции, во всех возрастных и этнических группах; особенно быстрый рост заболеваемости отмечается у пожилых, в возрасте старше 75 лет [188, 468, 489, 848]. Такой прирост только отчасти объясняется увеличением продолжительности жизни, совершенствованием методов диагностики и эпидемией СПИДа — заболевания, ассоциированного с высоким риском развития опухолей иммунекомпетентной системы [103, 186, 1012]. Констатация устойчивой тенденции роста заболеваемости неходжкинскими лимфомами стала главным результатом изучения новейшей истории этого вида опухолей.
Наиболее впечатляющие результаты современной клинической онкологии связаны с лечением опухолей кроветворной и лимфоидной тканей. В большинстве случаев лимфом Ходжкина и неходжкинских лимфом с агрессивным клиническим течением принципиальной задачей терапии является излечение больного. Многие современные схемы комбинированного лечения лимфом специализированы, поскольку разрабатывались с учетом морфологического варианта и стадии опухолевого процесса [7, 28, 29, 42, 302, 303, 1094]. Широкое распространение получают методы рецепторно-опосредованной терапии лимфом [423, ИЗО].
Морфологический вариант неходжкинской лимфомы является важнейшим независимым фактором прогноза течения заболевания [14, 38, 64, 508, 791, 873], пятилетняя выживаемость в группе больных с лимфомой из клеток зоны мантии, Т-клеточными лимфомами с иммунофенотипом периферических лимфоцитов, Т-лимфобластными лимфомами оказывается менее 30%, а в группе фолликулярных лимфом, анапластических крупноклеточных лимфом и лимфом из клеток маргинальной зоны — более 70% [448].
Морфологическая диагностика лимфом остается одним из наиболее трудных разделов онкоморфологии [43]. Объективные причины трудностей диагностики обусловлены особенностями как лимфоидной ткани, так и опухолей, связанных с ней гистогенетически. Лимфоидная ткань имеет сложный гистогенез, выраженную морфологическую гетерогенность и характеризуется высокой функциональной динамичностью [3, 18, 19, 693, 841]. Лимфомы — опухоли лимфоидной ткани — не только несут на себе отпечаток этих особенностей, но и отличаются многообразием вариантов, близостью гистологического строения некоторых вариантов лимфом, морфологическим сходством нормальных и опухолевых клеток и сходством гистологических проявлений некоторых реактивных процессов и опухолей лимфоидной ткани [420, 434].
Многообразие морфологических вариантов неходжкинских лимфом и быстрое развитие методов экспериментальной иммунологии и молекулярной патологии привели к созданию последовательности быстро сменяющихся морфологических классификаций опухолей лимфоидной ткани [8, 123, 319, 451, 655, 688, 689, 690, 717, 791, 901], последней из которых стала классификация ВОЗ, опубликованная в 2001 году [532]. Она содержит описание эпидемиологических и клинических особенностей, гистологического строения, иммуно-фенотипа, молекулярно-генетических аномалий и факторов прогноза 40 форм неходжкинских лимфом и 5 вариантов лимфомы Ходжкина (лимфогранулематоза). Классификация была расширена и дополнена в 2005 г. в части, касающейся лимфом кожи [1124].
Определяющими признаками в классификации ВОЗ 2001 г. опухолей лимфоидной ткани стали клинические проявления (первичная локализация), цитологический состав и гистологическое строение, иммунофенотип клеток опухоли. Многие лимфомы характеризуются сходством строения, а иногда просто неразличимы при исследовании традиционных гистологических препаратов [1]. Проведение иммуногистохимического исследования признается обязательным компонентом морфологического диагноза лимфомы [452, 532].
Иммунофенотипические характеристики лимфом имеют популяционно-статистический характер, в литературных источниках частного и обобщающего содержания приводятся частоты выявления экспрессии того или иного антигена в однородной выборке лимфом [14, 72, 190, 198, 254, 602, 780, 1025, 1026]. Для различных лимфом, которые могут иметь значительное сходство гистологического строения, набор иммунологических признаков и частоты экспрессии существенно отличаются. Подбор соответствующей панели иммунологических маркеров определяется опытом исследователя, материально-техническими возможностями лаборатории, а не устоявшимися алгоритмами дифференциальной диагностики сходных явлений, как это принято в госпитальной клинической практике [1, 17, 40, 44].
В течение последних трех десятилетий в отечественной онкогематоло-гии углубляется разрыв между постоянно возрастающей информативностью методов лучевой и эндоскопической диагностики и возможностями цитологического и гистологического анализа опухолей [37]. В подавляющем большинстве специализированных лечебных учреждений используются рутинные гистологические методы исследования, что не позволяет ни патоморфологам, ни гематологам получить информацию, соответствующую сегодняшнему уровню научных представлений в онкологии. Следствием отставания в методах морфологической диагностики являются неточная верификация лимфом [25], проблематичность решения ряда сложных вопросов дифференциальной диагностики, лежащих за пределами возможностей рутинных методов исследования, несоответствие гистологических диагнозов современным международным классификациям, предполагающим использование иммуногистохимических и молеку-лярно-генетических методов исследования, затруднение работы клиницистов по выделению групп риска на основании учета иммунофенотипических и молекул яр но-генетических характеристик опухолевых клеток, как этого требует повседневная практика [42].
В отечественной литературе дано фрагментарное описание некоторых морфологических вариантов неходжкинских лимфом, основанное на отдельных наблюдениях или небольших выборках [20, 24, 26, 27, 28, 32, 33, 35, 39, 48], но не представлен анализ частоты встречаемости основных морфологических вариантов лимфом, верифицированных в соответствии с одной из общепринятых ранее международных классификаций или классификацией ВОЗ 2001 года.
Опубликованные в специальной литературе данные содержат противоречивую информацию о частоте экспрессии практически каждого антигена, обнаружение которого имеет диагностическое значение [1071]. Недостаточно полно исследованы отличительные гистологические признаки и особенности иммунофенотипа опухолевых клеток неходжкинских лимфом, которые имеют выраженное сходство гистологического строения. Гистологический анализ и выбор панели иммунологических маркеров для верификации диагноза опухолей лимфоидной ткани в отечественной монографической литературе оказываются разобщенными [36, 40], а в периодической — часто опираются на индивидуальные подходы авторов и не содержат оценки информативности признаков, используемые в доказательной медицине [17, 24, 26, 32, 35, 39, 44]. и
Целью работы является оптимизация морфологической дифференциальной диагностики неходжкинских лимфом в группах опухолей лимфоидной ткани, имеющих выраженное сходство гистологического строения, на основе оценки диагностической информативности дифференциальных признаков и минимальной достаточности иммуногистохимического исследования.
Для достижения указанной цели были поставлены следующие задачи:
1. Исследовать гистологическое строение и иммунофенотип опухолевых клеток в отдельных клинико-морфологических вариантах неходжкинских лимфом, выделенных в соответствии с классификацией ВОЗ 2001 года в обследованной группе больных.
2. Оценить относительную частоту выявления отдельных клинико-морфологических вариантов неходжкинских лимфом на основе результатов работы па-томорфологической лаборатории в Северо-Западном регионе России и провести сравнительный анализ с сопоставимыми данными из других регионов.
3. Дать клиническую характеристику больных различными клинико-морфологическими вариантами неходжкинских лимфом на основе данных первичного определения стадии опухолевого процесса и охарактеризовать особенности клинической картины отдельных видов лимфом.
4. Оценить чувствительность и специфичность гистологических и имму-нофенотипических признаков, отношения правдоподобия положительных и отрицательных результатов и другие характеристики диагностических тестов, использованных в иммуногистохимической дифференциальной диагностике при исследовании гистологически сходных вариантов неходжкинских лимфом.
5. Выявить комбинации гистологических и иммунофенотипических признаков, имеющие наибольшее дифференциально-диагностическое значение при морфологическом исследовании лимфом в группах, объединенных выраженным сходством гистологического строения.
6. На основании полученных показателей информативности дифференциально-диагностических признаков определить оптимальный объем и структуру иммуногистохимического исследования для каждой группы неходжкин-ских лимфом, объединенных сходством гистологического строения.
Научная новизна. Впервые на репрезентативном биопсийном и клиническом материале, полученном в результате исследования 1024 первичных больных неходжкинскими лимфомами и 61 пациента с реактивной лим-фаденопатией с помощью гистологического и иммуногистохимического методов выполнена идентификация опухолей лимфоидной ткани в соответствии с классификацией ВОЗ 2001 года, установлена частота выявления отдельных клинико-морфологических вариантов неходжкинских лимфом в обследованной выборке. В работе исследованы диагностические характеристики гистологических и иммуногистохимических признаков, позволякищгх дифференцировать гистологически сходные формы опухолей лимфоидной ткани. Методами анализа информативности диагностических признаков определены оптимальные по объему и структуре способы дифференциальной диагностики неходжкинских лимфом, имеющих сходство гистологического строения.
Основные положения, выносимые на защиту
1. На основании выявленных отличий в частотах встречаемости различного вида неходжкинских лимфом в выборке из 400 последовательных впервые диагностированных лимфом у пациентов, проживающих преимущественно в Северо-Западном регионе России, по сравнению с данными эпидемиологических исследований в других странах, следует ожидать значительного регионального разнообразия в относительной частоте возникновения морфологических вариантов неходжкинских лимфом в России — географически протяженной и этнически разнородной.
2. Гистологическое исследование неходжкинских лимфом в биопсийном и операционном материале дает возможность отнести лимфому к одной из групп опухолей с выраженными чертами морфологического сходства и позволяет сформулировать дифференциально-диагностическую гипотезу для проведения иммуногистохимического исследования, но не может иметь целью определение нозологического диагноза в соответствии с классификацией ВОЗ (2001 г.) опухолей лимфоидной ткани.
3. В морфологической дифференциальной диагностике неходжкинских лимфом, характеризующихся сходством гистологического строения, наибольшее диагностическое значение следует придавать признакам, которые по своему происхождению являются гистогенетическими и патогенетическими.
Практическая значимость работы. В исследовании получены результаты, свидетельствующие о существенных различиях в относительных частотах выявления некоторых видов неходжкинских лимфом у пациентов, проживающих преимущественно в Северо-Западном регионе России, по сравнению с данными эпидемиологических исследований в других странах. Изучены гистологические признаки, иммунофенотипические характеристики неходжкинских лимфом, позволяющие дифференцировать их в группах опухолей сходного гистологического строения. Даны количественные оценки диагностической ценности гистологических и иммуногистохимических признаков отдельных форм неходжкинских лимфом для дифференциальной диагностики опухолей сходного гистологического строения. Для каждой группы неходжкинских лимфом со сходным гистологическим строением определен оптимальный состав панелей иммуногистохимических маркеров, позволяющих провести дифференциальную диагностику нозологических форм, образующих группу.
Реализация результатов исследования. Результаты исследования внедрены в практическую деятельность Гематологического центра Главного военного клинического госпиталя имени академика Н. Н. Бурденко; 2 Центрального военного клинического госпиталя имени П. В. Мандрыка; 3 Центрального военного клинического госпиталя имени академика А. А. Вишневского; ГУЗ «Ленинградская областная клиническая больница»; ГУЗ «62 онкологическая больница», г. Москва; ГУЗ «Свердловское областное патологоанатомическое бюро»; ГУЗ «Свердловская областная клиническая больница №1»; ГУЗ «Клинический онкологический диспансер МЗ Республики Татарстан», г. Казань; Киевской городской онкологической больницы.
Научные положения, обоснованные в диссертации, используются в преподавании вопросов патологии опухолей лимфоидной ткани на кафедре патологической анатомии с курсом цитологии ГОУ ДПО СПб МАЛО и кафедре факультетской терапии ГОУ ВПО ВМедА имени С.М. Кирова.
Апробация работы. Материалы и результаты исследования докладывались на научно-практической конференции «Актуальные проблемы клинической онкологии», Санкт-Петербург, 1995 г.; Всеармейской научной конференции «Актуальные вопросы гематологии», Санкт-Петербург, 1995 г.; III Всероссийском съезде гематологов и трансфузиологов, Санкт-Петербург, 1996 г.; научно-практической конференции «Диагностика и лечение злокачественных лимфом», Санкт-Петербург, 1997 г.; международной конференции «Диагностика, патогенез и лечение злокачественных лимфом», Санкт-Петербург, 1998 г.; научно-практической конференции «Гематологический диагноз в лаборатории», Санкт-Петербург, 1999 г.; на заседании Санкт-Петербургской ассоциации патологоанатомов, 1999 г.; научной конференции «Актуальные вопросы клинической патоморфологии», Санкт-Петербург, 2000 г.; гематологическом декаднике «Новое в гематологии и трансфузиологии», Москва, 2001 г.; Первом съезде гематологов России, Москва, 2002 г.; конференции «Актуальные вопросы диагностики и лечения лимфом», г. Екатеринбург, 2002 г.; научно-практической конференции с международным участием «Онкология - XXII», г. Киев, 2003 г.; V Всероссийской школе-семинаре «Иммуногистохимическая диагностика опухолей», г. Казань, 2004 г.; II Российской конференции с международным участием «Злокачественные лимфомы», Москва, 24-25 октября 2005 г.; Всероссийской конференции с международным участием «Современные проблемы клинической патоморфологии», Санкт-Петербург, 17-18 ноября 2005 г.
Читайте также:
