Антрациклины. Доксорубицин и даунорубицин
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Противоопухолевый антибиотик антрациклинового ряда. Оказывает антимитотическое и антипролиферативное действие. Механизм действия заключается во взаимодействии с ДНК, образовании свободных радикалов и прямом воздействии на мембраны клеток с подавлением синтеза нуклеиновых кислот. Клетки чувствительны к препарату в S- и G2-фазах.
Фармакокинетика
Абсорбция - высокая, распределение - относительно равномерное. Через ГЭБ не проходит. Объем распределения при Css - 20-30 л/кг. Связь с белками плазмы - 74-76%. Метаболизируется в печени (в течение 1 ч) с образованием активного метаболита доксорубицола. Ферментативное восстановление доксорубицина под действием оксидаз, редуктаз и дегидрогеназ приводит к образованию свободных радикалов, что может способствовать проявленнию кардиотоксического действия. После в/в введения быстро исчезает из крови, концентрируясь в печени, почках, миокарде, селезенке, легких. T1/2 - 20-48 ч для доксорубицина и доксорубицинола. Выведение: с желчью - 40% в неизмененном виде в течение 5 дней, с мочой - 5-12% доксорубицина и его метаболитов в течение 5 дней.
Показания
Саркома мягких тканей,
остеогенная саркома,
саркома Юинга,
рак молочной железы,
мелкоклеточный рак легкого,
рак щитовидной железы,
злокачественная тимома,
рак пищевода,
гепатобластома,
первичный гепатоцеллюлярный рак,
рак желудка,
рак поджелудочной железы,
карциноид,
рак мочевого пузыря (лечение и профилактика рецидивов после оперативного вмешательства),
герминогенная опухоль яичка,
рак яичников,
трофобластические опухоли,
опухоль Вильмса,
нейробластома,
рак эндометрия,
рак шейки матки,
рак предстательной железы,
острый лимфобластный лейкоз,
острый миелобластный лейкоз,
хронический лимфолейкоз,
миеломная болезнь,
лимфогранулематоз,
неходжкинская лимфома,
саркома Капоши при СПИДе,
рак надпочечников,
ретинобластома.
Противопоказания
Гиперчувствительность (в т.ч. к др. компонентам препарата, а также к др. антрациклинам и антрацендионам), беременность, период лактации. Введение в мочевой пузырь: инфекции и воспаление мочевого пузыря и мочевыводящих путей.
С осторожностью. Угнетение костномозгового кроветворения (в т.ч. инфильтрация костного мозга опухолевыми клетками, предшествующая химио- или лучевая терапия), паразитарные и инфекционные заболевания вирусной, грибковой или бактериальной природы (в настоящее время или недавно перенесенные, включая недавний контакт с больным): простой герпес, опоясывающий герпес (виремическая фаза), ветряная оспа, корь, амебиаз, стронгилоидоз (установленный или подозреваемый) - риск развития тяжелого генерализованного заболевания; подагра (в т.ч. в анамнезе), уратный нефроуролитиаз (в т.ч. в анамнезе), заболевания сердца (кардио-токсическое действие может отмечаться при более низких суммарных дозах), печеночная недостаточность.
Дозирование
В/в (струйно в течение 3-5 мин - лучше через трубку системы для в/в введения во время капельного введения 5% декстрозы или 0.9% раствора NaCl), в/а, внутрь мочевого пузыря. Взрослым, в/в - по 60-75 мг/кв. м 1 раз в 3-4 нед; или 25-30 мг/кв. м/сут в течение 2-3 дней подряд каждые 3-4 нед; или 20 мг/кв. м 1 раз в неделю в течение 3-4 нед. Цикловую дозу можно разделить на несколько введений (например вводить в течение первых 3 дней подряд или в 1 и 8 день цикла). Для уменьшения токсического действия доксорубицина, особенно кардиотоксичности, применяется еженедельный режим введения в дозе 10-20 мг/кв. м. При использовании в комбинации с др. ЛС, применяемыми в химиотерапии опухолей, - 40-60 мг/кв. м каждые 3-4 нед. Суммарная доза доксорубицина не должна превышать 550 мг/кв. м.
Детям вводят в/в в дозе 30 мг/кв. м/сут в течение 3 дней каждые 4 нед. Больным с гепатоцеллюлярным раком для обеспечения интенсивного местного воздействия при одновременном уменьшении общего токсического действия доксорубицин может вводиться в главную печеночную артерию в дозе 30-150 мг/кв. м с интервалом от 3 нед до 3 мес. Более высокие дозы следует применять только в тех случаях, когда одновременно осуществляется экстракорпоральное выведение препарата (поскольку этот метод потенциально опасен, и при его использовании может произойти распространенный некроз ткани, в/а введение могут осуществлять только врачи, в совершенстве владеющие данной методикой). В мочевой пузырь вводятся 30-50 мг с интервалом от 1 нед до 1 мес. Общая суммарная доза препарата не должна превышать 500-550 мг/кв. м поверхности тела. Рекомендуемая концентрация раствора (используется вода для инъекций или 0.9% раствор NaCl) - 1 мг/мл. После завершения инстилляции, для обеспечения равномерного воздействия препарата на слизистую оболочку мочевого пузыря, пациенты должны переворачиваться с боку на бок каждые 15 мин. Препарат должен находиться в мочевом пузыре в течение 1-2 ч, после чего больной должен его опорожнить. Во избежание чрезмерного разбавления препарата мочой пациентам следует воздерживаться от приема жидкости в течение 12 ч перед инстилляцией. Системная абсорбция доксорубицина при инстилляции в мочевой пузырь очень низка. При проявлениях местного токсического действия (химический цистит, который может проявляться дизурией, полиурией, никтурией, болезненным мочеиспусканием, гематурией, дискомфортом в области мочевого пузыря, некрозом стенки мочевого пузыря) дозу, предназначенную для инстилляции, следует дополнительно растворить в 50-100 мл 0.9% раствора NaCl. Особое внимание следует уделить проблемам, связанным с катетеризацией (например при обструкции мочеиспускательного канала, обусловленной массивными внутрипузырными опухолями).
Дозирование в особых ситуациях. Нарушение функции печени: у пациентов с гипербилирубинемией доза доксорубицина должна быть уменьшена в соответствии с показателями уровня общего билирубина: на 50% при концентрации билирубина в сыворотке крови 12-30 мг/л и на 75% - выше 30 мг/л.
Др. специальные группы пациентов: рекомендуется назначение более низких доз или увеличение интервалов между циклами у пациентов, которые ранее получали массивную противоопухолевую терапию, а также у детей, пациентов пожилого возраста, пациентов с ожирением (если масса тела составляет более 130% от "идеальной", отмечается снижение системного клиренса доксорубицина) и у пациентов с опухолевой инфильтрацией костного мозга.
У больных, получавших ранее лучевую терапию на область легких и средостения или лечившихся др. кардиотоксичными ЛС, суммарная доза доксорубицина должна не быть более 400 мг/кв. м.
Побочные эффекты
Со стороны органов кроветворения: тромбоцитопения, лейкопения (самый низкий уровень лейкоцитов отмечается через 10-14 сут после введения и восстанавливается в течение 21 сут после введения), анемия.
Со стороны ССС: аритмии (в т.ч. угрожающие жизни во время введения или в течение нескольких часов после него), развитие или усугубление СН, КМП (сопровождается стойким снижением вольтажа комплекса QRS, удлинением систолического интервала и снижением УОК). Кардиотоксическое действие проявляется обычно в течение 1-6 мес после начала лечения.
Со стороны пищеварительной системы: стоматит или эзофагит (через 5-10 сут после введения), рвота, тошнота, снижение аппетита, диарея; воспаление слизистой оболочки, изъязвление и некроз толстой кишки (у пациентов с острым миелобластным лейкозом на фоне 3-дневного курса доксорубицина в комбинации с цитарабином).
Со стороны нервной системы: периферическая невропатия (при в/а введении доксорубицина, обычно в комбинации с цисплатином); судороги и кома (в комбинации с цисплатином или винкристином). Аллергические реакции: кожная сыпь, крапивница, лихорадка, озноб, анафилактоидные реакции.
Прочие: гиперурикемия или нефропатия, связанная с повышенным образованием мочевой кислоты, гиперпигментация кожи (подошв, ладоней) и ногтей, рецидив лучевой эритемы (в случае предшествующей лучевой терапии), конъюнктивит, слезотечение, алопеция, инфекции, "прилив" крови к коже лица (при быстром в/в введении).
Местные реакции: при экстравазации - некроз подкожной клетчатки, флебосклероз; при внутрипузырном введении - цистит, окрашивание мочи в красный цвет.
Передозировка. Симптомы: тяжелая миелосупрессия (преимущественно лейкопения и тромбоцитопения), токсические эффекты со стороны ЖКТ, острая кардиотоксичность. Антидот к доксорубицину неизвестен, проводится симптоматическая терапия.
Взаимодействие
Фармацевтически несовместим с гепарином, дексаметазоном, фторурацилом, гидрокортизоном, натрия сукцинатом, аминофиллином, цефалотином, др. противоопухолевыми ЛС. Повышает риск развития геморрагического цистита, вызываемого циклофосфамидом.
Урикозурические противоподагрические ЛС увеличивают риск развития нефропатии, поэтому предпочтительным препаратом для предотвращения или устранения связанной с использованием доксорубицина гиперурикемии может быть аллопуринол.
При лечении гиперурикемии и подагры может потребоваться коррекция режима дозирования противоподагрических ЛС в результате повышения концентрации мочевой кислоты на фоне лечения препаратом. ЛС, вызывающие угнетение функции костного мозга, лучевая терапия - аддитивное угнетение функции костного мозга.
Даунорубицин, циклофосфамид, дактиномицин, митомицин, облучение области средостения повышают риск развития кардиотоксического действия; рекомендуемая доза доксорубицина - не более 400 мг/кв. м. Применение доксорубицина у больных, получавших полные кумулятивные дозы даунорубицина или доксорубицина (в анамнезе), не рекомендуется. Стрептозоцин увеличивает T1/2 доксорубицина.
Гепатотоксические ЛС, ухудшая функцию печени, могут приводит к повышению токсичности доксорубицина.
При одновременном приеме с живыми вирусными вакцинами возможна интенсификация процесса репликации вакцинного вируса, усиление его побочных/неблагоприятных эффектов и/или снижение выработки антител в организме больного в ответ на введение вакцины, поэтому интервал между прекращением применения препарата и вакцинацией варьирует от 3 до 12 мес.
Особые указания
В период лечения необходимо проводить регулярный контроль картины периферической крови, печени, ЭКГ, ЭхоКГ. При числе лейкоцитов менее 3.3-3.5 тыс./мкл и тромбоцитов менее 100-149 тыс./мкл дозу уменьшают на 50%. Повторный курс можно начинать после нормализации клеточного состава крови. Если содержание билирубина повышено в 2-3 раза, то дозу уменьшают на 50-75% соответственно. Риск развития СН оценивают в 1-2% при общей кумулятивной дозе 300 мг/кв. м, 3-5% - при дозе 400 мг/кв. м, 5-8% - при дозе 450 мг/кв. м и 6-20% - при дозе 500 мг/кв. м.
При экстравазации необходимо немедленно удалить инъекционную иглу, обколоть раствором гидрокортизона в дозе 100 мг, оросить хлорэтилом или положить лед, затем наложить спиртовую повязку. При появлении признаков кардиотоксичности лечение немедленно прекращают. Кардиотоксическое действие более часто отмечается у пациентов, получающих общую дозу более 550 мг/кв. м (400 мг/кв. м у пациентов, которым ранее облучали область грудной клетки или которые получали кардиотоксические ЛС), у пациентов с заболеванием сердца или облучением области средостения в анамнезе, а также у детей в возрасте до 2 лет и у пожилых пациентов. По возможности следует избегать введения в вены над суставами или в вены конечностей с нарушенным венозным или лимфатическим дренированием.
Развитие нефропатии, связанной с повышенным образованием мочевой килосты, у больных лейкозом или лимфомой можно предотвратить путем адекватного потребления жидкости и в некоторых случаях применением аллопуринола. При гиперурикемии может быть необходимо подщелачивание мочи.
Больных с развившейся лейкопенией следует тщательно наблюдать для выявления признаков возникновения инфекции.
При остром лейкозе доксорубицин можно применять, несмотря на наличие тромбоцитопении и кровотечений; в некоторых случаях в процессе лечения происходило прекращение кровотечения и повышение числа тромбоцитов, в др. случаях целесообразны переливания тромбоцитов. Отказ от иммунизации, если она не одобрена врачом в интервале от 3 до 12 мес после приема препарата; др. членам семьи больного, проживающим с ним, следует отказаться от иммунизации пероральной вакциной против полиомиелита; избегать контактов с людьми, получавшими вакцину против полиомиелита, или носить защитную маску, закрывающую нос и рот.
Антрациклины. Доксорубицин и даунорубицин
1 Федеральное государственное бюджетное учреждение науки Институт физиологически активных веществ Российской академии наук
Было проведено сравнение цитотоксичности антрациклиновых антибиотиков даунорубицина и доксорубицина в отношении опухолевых и нормальных линий клеток. Оба препарата проявили сильно выраженный противоопухолевый эффект. В отношении карциномы легкого А549 и карциномы кишечника НСТ116 даунорубицин и доксорубицин действуют аналогично. Линии клеток рабдомиосаркомы RD, аденокарциномы молочной железы MCF7 и нормального эмбрионального эпителия почки собаки MDCK-M в 2–5 раз менее чувствительны к действию даунорубицина. Существует разница в чувствительности к исследуемым антрациклинам нормальных клеток. Токсичность антрациклинов в отношении линии MDCK-M выше, чем токсичность к опухолевым линиям клеток. Линия клеток нормального эмбрионального эпителия почки человека НЕК293 мало чувствительна к действию антрациклиновых антибиотиков. Токсичность доксорубицина в отношении линии НЕК293 в 13,5 раз меньше токсичности даунорубицина. Таким образом, токсикологический профиль доксорубицина и даунорубицина in vitro повторяет клинический профиль данных препаратов. Разница в токсичности антрациклинов по отношению к нормальным и опухолевым клеткам очевидна, однако требует дополнительных экспериментов с клетками разных типов тканей и видов млекопитающих.
1. Arcamone F. Doxorubicin, Anticancer Antibiotics // In: Medicinal Chemistry, a Series of Monographs, vol. 17. – Academic Press, New York, 1981.
2. Beretta G. L., Zunino F. Molecular mechanisms of anthracycline activity // Top. Curr. Chem. – 2008. – 283. – P.1-19.
3. Chaires J. B., Leng F. et al. Structure-based design of a new bisintercalating anthracycline antibiotic // J. Med. Chem. – 1997. – 40. – P.261-266.
4. Chu L. L., Pandey R. P. et al. Synthetic analog of anticancer drug daunorubicin from daunorubicinone using one-pot enzymatic UDP-recycling glycosylation // J. Mol. Catalysis B: Enzymatyc. – 2016. – 124. – Р. 1-10.
5. Czyz M., Szulawska A. et al. Effects of anthracycline derivatives on human leukemia K562 cell growth and differentiation // Biochem. Pharmacol. – 2005. – 70. – Р. 1431-1442.
6. Karsten Krohn. Anthracycline Chemistry and Biology II: Mode of Action, Clinical Aspects and New Drugs // Springer-Verlag Berlin Heidelberg. – 2008.
7. Menna P., Salvatorelli E. et. al. Anthracicline cardiotoxicity // Top. Curr. Chem. – 2008. – 283. – P.21-44.
8. Monneret C. Recent developments in the field of antitumour anthracyclines // Eur. J. Med. Chem. – 2001. – 36. – Р. 483-493.
9. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assay // J. Immunol. Meth. – 1983. – 65(1–2). – P. 55–63.
10. Rodrigues P. C. A., Roth T. et al. Correlation of the acid-sensitivity of polyethylene glycol daunorubicin conjugates with their in vitro antiproliferative activity // Bioorganic & Medicinal Chemistry. – 2006. – 14. – Р. 4110-4117.
11. Tewey K. M., Rowe T. C., Yang L., Halligan B. D., Liu L. F. Adriamycin-induced DNA damage mediated by mammalian DNA topoisomerase II // Science. – 1984. – 226. – Р. 466–468.
Антрациклиновые антибиотики даунорубицин и доксорубицин были введены в клиническую практику более 40 лет назад для лечения широкого спектра онкологических заболеваний, таких как острая миелоидная лейкемия и, в случае с доксорубицином, многие сóлидные опухоли. Сами по себе и в комбинации с другими препаратами антрациклины являются компонентами основного, вспомогательного и паллиативного лечения [1].
Несмотря на интенсивное клиническое применение антрациклинов, их механизмы действия являются объектом для дискуссий вследствие использования различных концентраций и условий эксперимента. Однако некоторые данные не подлежат сомнению. Во-первых, в терапевтических дозах и при внутривенном способе введения механизм действия антрациклиновых антибиотиков обусловлен взаимодействием с топоизомеразой II путем стабилизации тройного комплекса ДНК-топоизомераза II-антрациклин [11]. Во-вторых, ограничивающим фактором приема антрациклиновых антибиотиков является кумулятивная кардиотоксичность и развитие резистентности опухолей [8].
Кардиотоксичность, которую вызывают антрациклиновые антибиотики, ограничивает их клиническое применение. Пациенты, принимающие антрациклины, страдают от аритмии, гипотензии, угнетения сократимости сердца, возможно возникновение миокардитов. В кардиомиоцитах антрациклины являются причиной сосудистой дегенерации, митохондриальных включений, миофибриллярных мерцаний и трепетаний, увеличения количества лизосом и некроза. Максимальная рекомендованная доза для даунорубицина составляет 500 мг, а для доксорубицина – 450-600 мг на весь курс лечения. Это доза представляет собой сумму доз, которые принял пациент, даже если между циклами приема были промежутки в месяцы и годы. При превышении рекомендованных доз развивается дилятационная кардиомиопатия и сердечная недостаточность [7]. Кроме кардиотоксичности частым осложнением после терапии антрациклиновыми антибиотиками является токсическое действие на другие паренхиматозные органы, например нефротоксичность [2].
Развитие резистентности опухолевых клеток снижает эффективность противоопухолевой терапии и требует увеличения доз препарата, что в случае антрациклиновых антибиотиков недопустимо. Развитие резистентности опухолей связывают сo взаимодействием между антрациклинами и транспортными белками Р-гликопротеином и белком множественной лекарственной резистентности MRP через N3’ атом даунозамина. Сверхэкспрессия транспортных систем в опухолевых тканях играет ключевую роль в удалении антрациклинов из клеток и уменьшению взаимодействия лекарство-мишень [3].
Клиническая востребованность даунорубицина и доксорубицина стимулировала интенсивный синтез аналогов и структурно близких соединений [4, 5, 10]. Несмотря на доклинические исследования огромного количества соединений данного класса, только малая часть антрациклинов и других интеркалирующих агентов доступна для клинического использования. Даунорубицин остается одним из наиболее эффективных агентов для лечения острых лимфоидных и миелоидных лейкемий, но его активность в отношении сóлидных опухолей мала. Доксорубицин является наиболее активным препаратом для лечения сóлидных опухолей, особенно при раке молочной железы, мелкоклеточном раке легкого и раке яичников [6].
В связи с тем, что скрининговые исследования на противоопухолевые свойства новых соединений в настоящее время проводятся в основном в тестах in vitro, сравнение цитотоксичности эталонных препаратов сравнения на различных опухолевых линиях клеток является интересным. Кроме того, дальнейшее сравнение с данными по цитотоксичности, полученными на культурах нормальных клеток, представляется перспективным для прогнозирования токсикологического профиля веществ в опытах in vivo. Целью данной работы является сравнение цитотоксичности антрациклиновых антибиотиков даунорубицина и доксорубицина в отношении опухолевых и нормальных линий клеток.
Материалы и методы
В работе использовано оборудование Центра коллективного пользования научным оборудованием для создания генно-модифицированных линий животных и изучения эффективности соединений на оригинальных клеточных и трансгенных моделях нейродегенеративных заболеваний человека (соглашение 14.621.21.0008, идентификатор RFMEFI62114X0008).
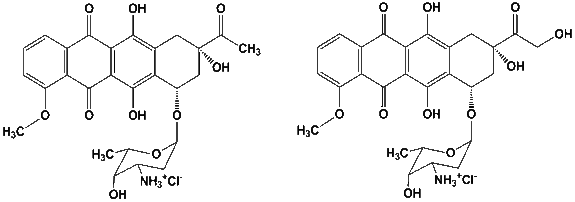
Исследуемые соединения даунорубицин (DNR) и доксорубицин (DOX) были синтезированы на ОАО «Омутнинская научная опытно-производственная база» (п. Восточный, Кировская область). Формулы представлены на рисунке.
Скелет антрациклина состоит из тетрациклической системы с сопряженным хинон-гидрохиноновыми кольцами, аминосахара даунозамина, связанного гликозидной связью с С7 и короткой боковой цепи с карбонильной группой при С13. Относительно малые изменения в этом скелете приводят к большим изменениям в спектре противоопухолевой активности. Антрациклины с первичным спиртом на конце боковой цепи (DOX и эпирубицин) показывают активность как к сóлидным, так и гематологическим опухолям. Антрациклины с метильной группой (DNR и идарубицин) в основном используются для лечения острой миелобластной лейкемии и связанной со СПИДом саркомой Капоши.
В эксперименте были использованы культуры опухолевых клеток человека А549 (карцинома легкого, ATCC® CCL-185™), HCT116 (карцинома кишечника, ATCC® CCL-247™), MCF7 (аденокарцинома молочной железы, ATCC® HTB-22™), RD (рабдомиосаркома, ATCC® CCL-136™), а также культуры нормальных клеток эмбрионального почечного эпителия человека HEK293 (ATCC® CRL-1573™) и собаки MDCK-M (ATCC® CCL-34™).
Культуры клеток А549, HCT116, RD и НЕК293 выращивались в среде DMEM, культура клеток MCF7 выращивалась в среде EMEM, культура клеток MDCK-M – в среде DMEM/F12 (все среды произведены в ООО НПП «ПанЭко»). В культуральные среды были добавлены 10 % эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2мM L-глутамина (ООО НПП «ПанЭко») и 1% гентамицина (ОАО Биохимик) в качестве антибиотика. Культивирование происходило при 37oC и 5 % CO2 во влажной атмосфере.
Определение цитотоксичности МТТ-тестом
Цитотоксичность даунорубицина и доксорубицина была определена с помощью МТТ-теста [9]. Клетки были посеяны в концентрации 1·104 клеток/200 мкл в 96-луночный планшет и культивировались при 37 oC во влажной атмосфере с 5 % CO2. После 24 часов инкубации к культурам клеток были добавлены различные концентрации тестируемых соединений (от 100 до 1,56 мкМ/л), и далее клетки культивировались в тех же условиях 72 часа. Каждая концентрация веществ была выполнена в трех повторностях. Все вещества были растворены в ДМСО (Panreac Química S.L.U), конечная концентрация ДМСО в лунке не превышала 0,1 % и не была токсична для клеток. Контрольными лунками выступали лунки, в которые добавляли растворитель в конечной концентрации 0,1 %. После инкубации в каждую лунку было добавлено 20 мкл MTT (3-[4,5-диметилтиазол-2-ил]-2,5-дидифенил тетразолия бромид, 5 мг/мл, Sigma-Aldrich), и планшеты инкубировались еще 2 часа. Далее из планшетов была удалена среда и в каждую лунку добавлено 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50 % ингибирование роста популяции клеток (IC50), было определено на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0.
Результаты и обсуждение
Результаты исследования цитотоксического эффекта антрациклиновых антибиотиков приведены в таблице. Оба препарата проявляют сильно выраженный противоопухолевый эффект. Очевидно, что в отношении ряда культур – карциномы легкого А549 и кишечника НСТ116 – даунорубицин и доксорубицин действуют аналогично. Линии клеток рабдомиосаркомы RD, аденокарциномы молочной железы MCF7 и нормального эмбрионального эпителия почки собаки MDCK-M менее чувствительны к действию даунорубицина. Дозы, при которых проявляется эффект даунорубицина, на этих линиях клеток в 2–5 раз выше, чем дозы доксорубицина.
Антрациклины. Доксорубицин и даунорубицин
Антрациклины. Доксорубицин и даунорубицин
Доксорубицин и даунорубицин широко используют в химиотерапии злокачественных опухолей: препараты занимают второе место после алкилирующих соединений. Доксорубицин эффективен при следующих опухолях:
• неходжкинская лимфома;
• болезнь Ходжкина;
• острые лейкозы;
• рак молочной железы, легких, желудка и щитовидной железы;
• саркомы.
Доксорубицин используют для лечения солидных опухолей, тогда как при лейкозах иногда предпочитают даунорубицин, т.к. он вызывает менее выраженный мукозит (воспаление слизистых оболочек). Доксорубицин представляет собой пролекарство. Активный метаболит идарубицин эффективен при лейкозах и может быть применен с терапевтической целью в качестве монотерапии, поскольку его можно принимать перорально. Антрациклины обладают уникальной кардиотоксичностью. Все они являются хинонами, способными к продукции свободных радикалов. Свободные от радикалов хиноны вызывают перекисное окисление саркоплазматического ретикулума сердца, приводя к возникновению Са2+-зависимого некроза миокарда. Этот побочный эффект можно блокировать одновременным введением хелатора железа, дексразоксана. Эпирубицин менее кардиотоксичен, чем другие антрациклины, и его широко используют в Европе. Этот препарат особенно эффективен при раке молочной железы. Кардиотоксичность антрациклинов не зависит от дозы.
Антрациклины и антрацендионы включаются в ДНК и авидно связываются с ядерным хроматином, образуя тройной комплекс лекарства, включенного в ДНК, и топоизомеразой Тор II, что приводит к разрыву цепи ДНК. Опосредованный Тор II механизм, возможно, представляет собой наиболее важный молекулярный механизм действия.
Вторым цитотоксическим механизмом служит образование свободных радикалов, вызывающих посредством окисления-восстановления повреждение злокачественных клеток. Все антрациклины представляют собой хиноны, способные продуцировать свободные радикалы, повреждающие мембраны, белки и липиды. Глутатион и каталаза могут детоксифицировать свободнорадикальные хиноны, и отсутствие каталазы в ткани сердца служит основой внешне избирательной кардиотоксичности антрациклинов. Комплексы железа и антрациклина тесно связываются с клеточными мембранами, вызывая их спонтанное разрушение. Была описана активация пути с участием церамидсинтетазы, вызывающая апоптотическую клеточную гибель. Связь данного эффекта с благоприятным действием этих препаратов при лечении рака еще нельзя считать доказанной.
Механизмы резистентности к антрациклинам включают:
• отток препарата из клеток, опосредованный геном гликопротеина V-G?/mdr;
• изменение концентрации топоизомеразы II;
• наличие мутантной топоизомеразы II;
• повышение концентрации глутатиона;
• повышение активности глутатионпероксидазы (этот фермент детоксифицирует свободные радикалы);
• сниженние концентрации глюкозо-6-фосфатдегидрогеназы.
Антрациклины и антрацендионы в неионизированной форме пассивно диффундируют в клетки. При подкислении внеклеточной среды, что относится к общим свойствам солидных опухолей, препараты приобретают заряд, что предотвращает их диффузию в клетки. Длительный конечный период полувыведения доксорубицина, равный 30 час, предъявляет меньше требований к схеме дозировки. Длительная инфузия или еженедельное применение оказываются менее кардиотоксичными по сравнению с ежемесячными болюсными инъекциями. За исключением идарубицина, все антрациклины предназначены только для в/в введения. Доксорубицин является сильным радиосенсибилизатором. Гепарин связывает дауносаминосахар и повышает клиренс. Доксорубицин снижает клиренс паклитаксела.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Кардиотоксичность современных химиотерапевтических препаратов
В настоящее время кардиотоксичности, развивающейся на фоне проведения противоопухолевого лечения, уделяется большое внимание. Это связано с тем, что в современной онкологии используются новые, более интенсифицированные схемы лечения, что, в свою очередь, увеличивает риск развития побочных эффектов, в том числе и со стороны сердечно-сосудистой системы. В статье описаны кардиологические осложнения, связанные с химиотерапией опухолей, лучевые поражения сердца составляют отдельную тему.
Использование новых схем химиотерапевтического лечения ведет к удлинению срока безрецидивной выживаемости и увеличению числа пациентов, излеченных от онкологических заболеваний. Следует указать, что среди этих больных большую часть составляют работоспособные пациенты, а развитие кардиологических осложнений на фоне химиотерапии ведет к ухудшению качества жизни и снижению ее продолжительности у потенциально излечиваемых пациентов, особенно уже имеющих сердечно-сосудистые заболевания.
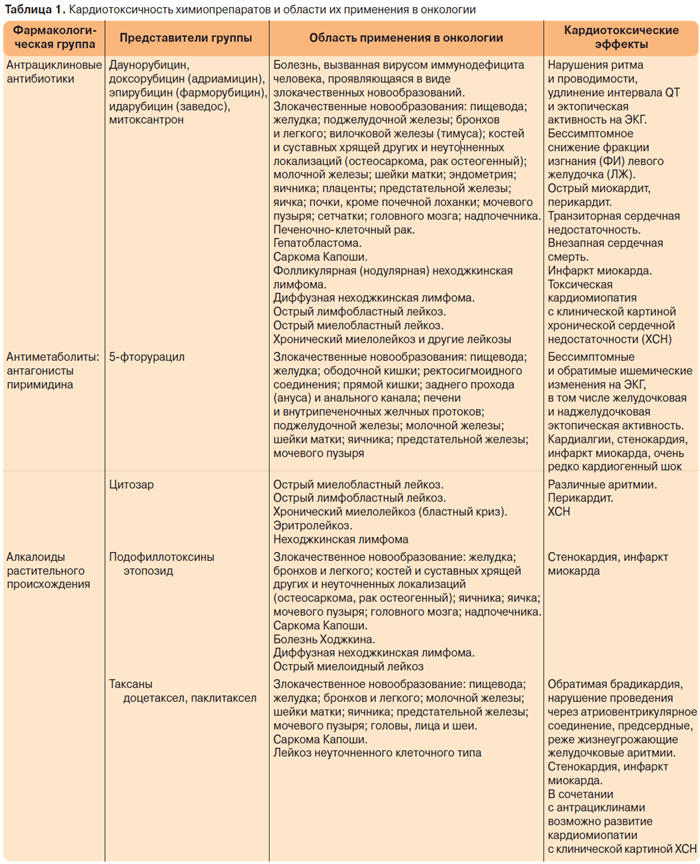
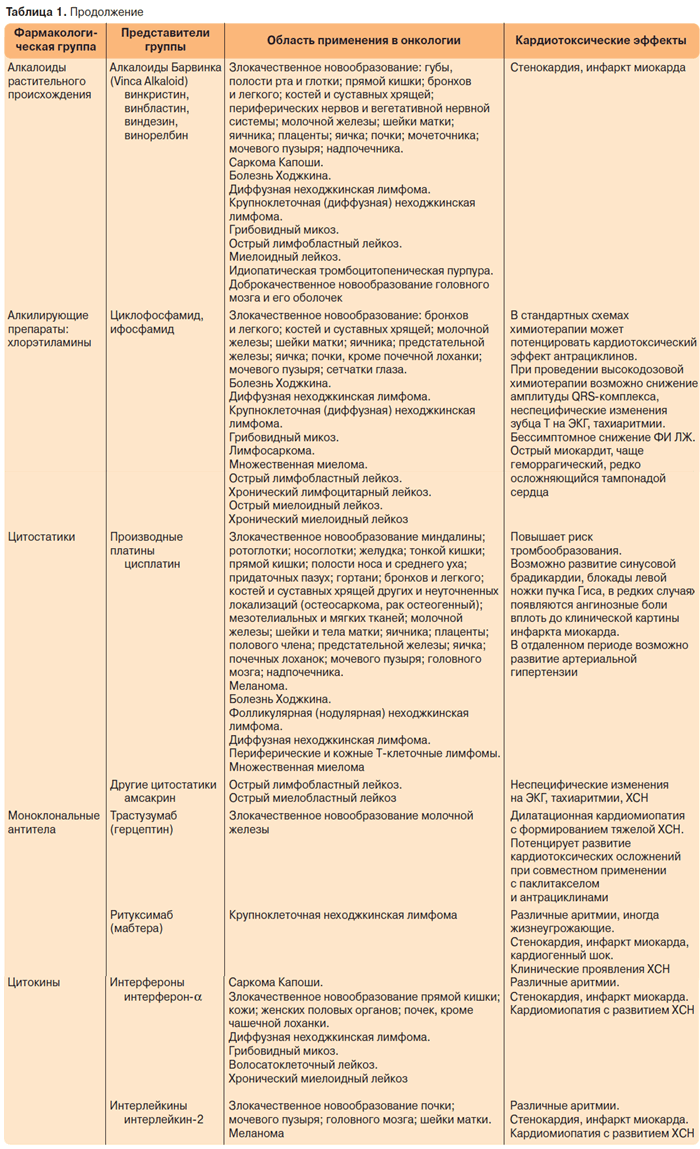
Многие химиотерапевтические препараты обладают кардиотоксичностью, однако в настоящее время описано большое количество случаев кардиологических осложнений, развивающихся на фоне введения антрациклиновых антибиотиков, что связано с их высокой противоопухолевой активностью, а также с широким их применением в различных схемах химиотерапевтического лечения. Антрациклиновые антибиотики используются преимущественно в составе различных схем химиотерапии, поэтому об “антрациклиновой кардиотоксичности” при появлении кардиологических осложнений можно говорить условно. Помимо антрациклиновой описана кардиотоксичность и многих других химиотерапевтических препаратов, ниже представлены препараты, на фоне введения которых могут развиваться кардиологические осложнения (табл. 1).
В настоящее время определены факторы риска развития кардиологических осложнений при применении противоопухолевых препаратов, к которым относятся: суммарная доза препарата (характерно в большей степени для антрациклинов, например, для доксорубицина кумулятивная доза составляет 500–550 мг/м2); общая доза, введенная за день или за курс химиотерапии; скорость и порядок введения препаратов; облучение средостения в анамнезе; возраст (младше 15 и старше 65 лет); женский пол; одновременное введение других противоопухолевых средств (циклофосфан, блеомицин, этопозид, цисплатин, винкристин, актиномицин, метотрексат); предшествующая терапия антрациклиновыми антибиотиками; сопутствующие заболевания сердечно-сосудистой системы; дисбаланс электролитов (гипокалиемия, гипомагниемия).
На данный момент нет единой классификации кардиотоксичности химиотерапевтических препаратов, которая может развиться в различные сроки от начала лечения. Для антрациклиновых антибиотиков принято разделение кардиотоксичности по срокам ее возникновения на острую, подострую, хроническую и позднюю хроническую.
Подострая кардиотоксичность встречается редко, в основном она проявляется токсическим перикардитом и/или миокардитом спустя несколько недель после последнего введения антрациклиновых антибиотиков.
Для хронической и поздней хронической кардиотоксичности характерно развитие кардиомиопатии с клинической картиной ХСН в течение 1-го года или спустя десятилетия после окончания противоопухолевого лечения соответственно. По данным литературы, кардиомиопатия, развивающаяся на фоне лечения антрациклиновыми антибиотиками, может быть как дилатационной, так и рестриктивной, что не всегда определяется дозой препарата. По нашим данным, у 27,6% больных, которые получают комбинированное лечение, включающее антрациклины, в отдаленном периоде после окончания химиотерапии возможно развитие так называемой неклассифицируемой кардиомиопатии, которая проявляется снижением ФИ ЛЖ без дилатации его полости при постепенном увеличении конечного систолического объема (КСО) ЛЖ. А во время проведения химиотерапевтического лечения происходит статистически значимое снижение конечного диастолического объема (КДО) и его индексированного значения. В дальнейшем, в течение 6 мес после завершения химиотерапии у пациентов с ХСН, развившейся после лечения антрациклинами, КДО ЛЖ продолжает снижаться, а у больных без ХСН возвращается к исходному уровню.
Пациентов чаще всего беспокоит снижение переносимости физической нагрузки и одышка различной степени выраженности, что иногда принимается врачом за проявления основного заболевания и остается недооцененным. Согласно принятым рекомендациям, больные с развившейся симптоматикой должны получать стандартную терапию ХСН. Однако, по мнению разных авторов, на фоне кардиотропной терапии дисфункция ЛЖ не всегда полностью обратима. Фармакологическое лечение может улучшить качество жизни и снизить количество осложнений, однако для антрациклиновой кардиомиопатии характерен плохой ответ на лечение и соответствующий плохой прогноз, смертность составляет 27–61%. При развитии кардиологических осложнений в течение первых 4 нед после окончания химиотерапии прогноз наиболее неблагоприятен.
Поздняя хроническая кардиотоксичность протекает субклинически и носит прогрессирующий характер, часто она развивается у пациентов, которые получили относительно низкие дозы антрациклинов – менее 480 мг/м2. Следует отметить, что длительное бессимптомное течение кардиотоксичности особенно характерно для детей. При использовании паклитаксела кардиотоксичность развивается у 30–35% больных, она проявляется обратимой брадикардией на ЭКГ; в 0,5% случаев возникают предсердные, реже жизнеугрожающие желудочковые аритмии, нарушения проводимости; еще реже возможно развитие ишемии или инфаркта миокарда. Паклитаксел потенцирует кардиотоксический эффект антрациклиновых антибиотиков за счет снижения почечной экскреции, что ведет к увеличению времени циркуляции антрациклинов в плазме.
Для 5-фторурацила характерно развитие ишемии миокарда за счет спазма коронарных артерий, что встречается в 3–8% случаев. Характерными симптомами являются кардиалгии, предсердные и желудочковые аритмии, довольно редко развивается инфаркт миокарда и кардиогенный шок. В 60–65% случаев от общего количества кардиологических осложнений на фоне введения 5-фторурацила проявления ишемии миокарда ограничиваются бессимптомными изменениями на ЭКГ, при этом уровень кардиоспецифических ферментов не повышается. В большинстве случаев кардиотоксичность 5-фторурацила проходит после его отмены или на фоне лечения антиангинальными препаратами.
Кардиотоксический эффект трастузумаба проявляется бессимптомным снижением ФИ ЛЖ, что в дальнейшем ведет к развитию дилатационной кардиомиопатии. При использовании трастузумаба в качестве монотерапии она развивается у 4–8% пациентов, среди них явления тяжелой сердечной недостаточности (III–IV функционального класса по NYHA) встречаются у 0,6–4,1% больных. При применении трастузумаба в комбинации с другими противоопухолевыми препаратами, такими как антрациклины и паклитаксел, кардиотоксический эффект увеличивается. Важно то, что кардиологические осложнения на фоне использования комбинации трастузумаба с паклитакселом обратимы, а при комбинации с антрациклинами – нет. Трастузумаб наряду с ритуксимабом и бевацизумабом входит в группу моноклональных антител, используемых в таргетной терапии онкологических заболеваний, их эффект опосредуется ингибированием тирозинкиназ, которые играют ключевую роль в передаче клеточного сигнала. Ко второму классу таргетных препаратов относят малые молекулы ингибиторов тирозинкиназы (лапатиниб, иматиниб, сорафениб, сунитиниб), которые широко используются в лечении метастатического рака почки, рака молочной железы, толстой кишки, легкого, желудочно-кишечных стромальных опухолей и хронического миелолейкоза. Кардиотоксичность, развивающаяся на фоне применения ингибиторов тирозинкиназы, может проявляться снижением ФИ ЛЖ с последующей клинической картиной ХСН, нарушениями проводимости, в том числе с удлинением интервала QT на ЭКГ, острым коронарным синдромом и артериальной гипертензией. Механизмы развития кардиотоксичности ингибиторов тирозинкиназы в настоящее время изучаются как онкологами, так и кардиологами.
Алкилирующие агенты, в частности циклофосфамид, в стандартных схемах химиотерапии способны лишь потенцировать кардиотоксический эффект антрациклинов. А при проведении высокодозовой химиотерапии кардиотоксичность циклофосфамида проявляется снижением амплитуды QRS-комплекса, неспецифическими изменениями зубца Т на ЭКГ, тахиаритмиями, бессимптомным транзиторным снижением ФИ ЛЖ. Также возможно развитие острой или подострой, как правило обратимой, сердечной недостаточности. Наиболее часто у таких пациентов возникает острый миокардит, возможно развитие геморрагического миокардита, в редких случаях осложняющегося тампонадой сердца.
Для цисплатина характерно увеличение риска тромбообразования, что в очень редких случаях проявляется ангинозными болями, вплоть до развития инфаркта миокарда, а в отдаленном периоде – артериальной гипертензией. Чаще всего кардиотоксичность цисплатина проявляется синусовой брадикардией, блокадой левой ножки пучка Гиса на ЭКГ.
В 3–4% случаев во время введения митоксантрона или в течение 1-го года после терапии этим препаратом развивается миокардит, токсическая кардиомиопатия со снижением ФИ ЛЖ, также возможно появление аритмии различных типов. В редких случаях при использовании этопозида и винкристина возможно развитие ишемии, вплоть до инфаркта миокарда, что, вероятнее всего, связано со спазмом коронарных артерий.
Под нашим наблюдением находятся пациенты с кардиотоксическими осложнениями, возникшими в различные сроки от начала комбинированного лечения, включающего антрациклиновые антибиотики. Приводим описание двух клинических случаев типичной острой и поздней хронической кардиотоксичности.
Клинический пример 1. Больной О., 27 лет, с диагнозом: лимфома Ходжкина, нодулярный склероз II типа с выраженной эозинофильной инфильтрацией, с массивным поражением медиастинальных и шейных лимфатических узлов, с распространением на мягкие ткани грудной стенки, перикард, левую долю щитовидной железы, стадия IVА. По данным эхокардиографии (ЭхоКГ), проведенной до начала лечения, патологии сердца не выявлено, перед передней стенкой правого желудочка визуализировалось
объемное образование неоднородной структуры.
Химиотерапия у этого больного проводилась по новой схеме ЕА(50)COPP-14 в рамках российского протокола ЛХМосква-1-3. Доза доксорубицина на курс, рассчитанная по поверхности тела, составила 100 мг, что несколько больше дозы, используемой в ранее применявшихся протоколах. Следует обратить внимание на то, что в схему кроме антрациклинов входили препараты, также обладающие кардиотоксическим эффектом, такие как этопозид, винкристин, циклофосфан, в общепринятых дозах.
В первый день химиотерапии проводилось суточное мониторирование ЭКГ по Холтеру, зафиксирована синусовая тахикардия с максимальной частотой сердечных сокращений (ЧСС) 139 в 1 мин; значимой диспозиции сегмента ST, эктопической активности выявлено не было. После первого курса химиотерапии был достигнут значительный противоопухолевый эффект, по данным компьютерной томографии грудной клетки отмечалось уменьшение тени средостения с 11 до 9 см на уровне III ребер.
На 2-й день после окончания полихимиотерапии у пациента появились сжимающие боли за грудиной с иррадиацией в обе руки, слабость. На ЭКГ выявлены инфарктоподобные изменения (рис. 1). В биохимическом анализе крови наблюдалось повышение уровней кардиоспецифических ферментов: креатининфосфокиназы-МБ с 40 до 80 нг/мл, тропонина с 1,3 до 11 нг/мл. Пациент был госпитализирован в отделение реанимации и интенсивной терапии Российского онкологического научного центра им. Н.Н. Блохина РАМН, на фоне введения наркотических анальгетиков ангинозные боли были полностью купированы, в дальнейшем проводилось лечение гепарином, изоптином, кардикетом.
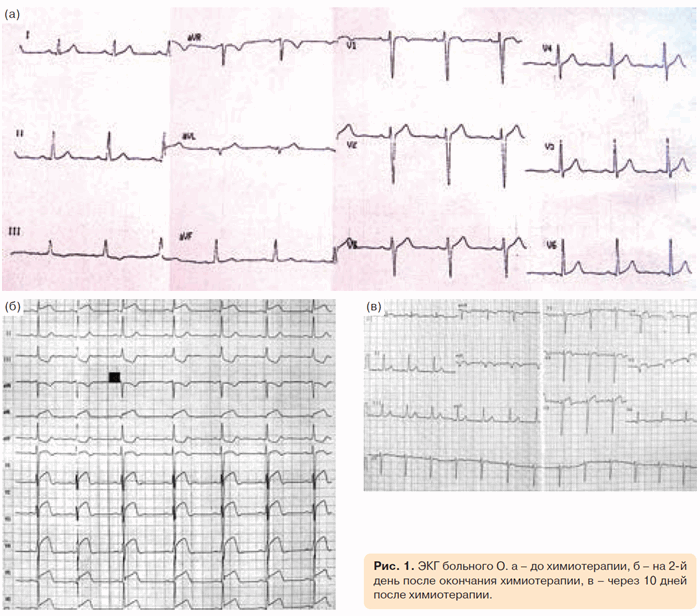
Больной был переведен в городскую клиническую больницу (ГКБ) № 12 (база кафедры госпитальной терапии № 2 Российского национального исследовательского медицинского университета им. Н.И. Пирогова) для дальнейшего наблюдения и лечения. За время нахождения в стационаре проводилась терапия антикоагулянтами, нитратами, титрование доз β-адреноблокаторов (БАБ), ингибиторов ангиотензинпревращающего фермента (ИАПФ), на этом фоне ангинозные боли не рецидивировали, на ЭКГ отмечалась динамика, характерная для переднего инфаркта миокарда (см. рис. 1).
На фоне проводимой терапии уровень кардиоспецифических ферментов снизился, и на 5-й день госпитализации уровни креатининфосфокиназы, тропонинов вернулись к нормальным значениям. При повторном суточном мониторировании ЭКГ по Холтеру также не было выявлено эктопической активности и смещения сегмента ST, однако в вечерние часы сохранялась синусовая тахикардия с максимальной ЧСС до 124 в 1 мин.
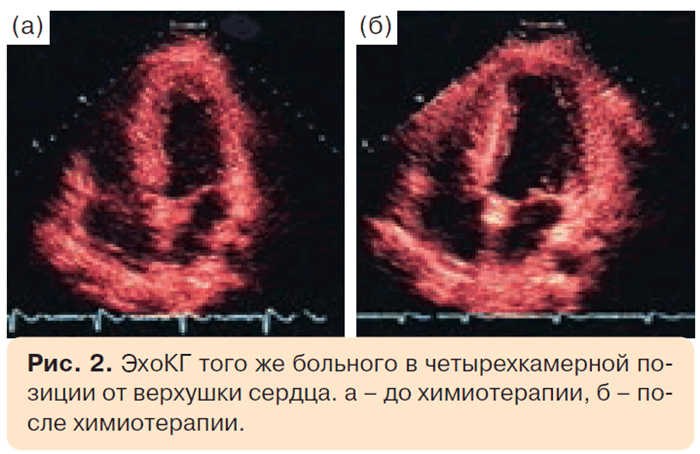
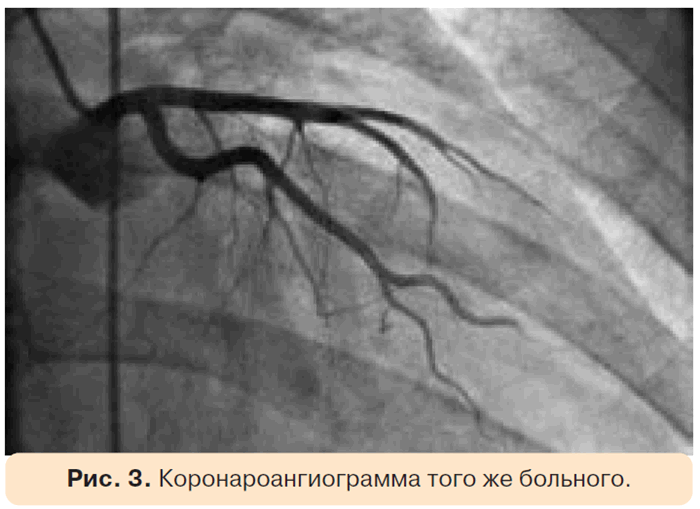
При динамической ЭхоКГ было обнаружено снижение ФИ ЛЖ с 66 до 56,1%, гипокинез верхушечной области и боковой стенки, увеличение КСО ЛЖ с 41,9 до 52,9 мл (рис. 2). Была выполнена коронароангиография. Стенозирования просвета коронарных артерий не отмечено, при этом определялось умеренное замедление скорости смыва контрастного вещества (до 6 сердечных циклов), которое, скорее всего, было обусловлено поражением мелких коронарных артерий, развившимся под воздействием химиотерапевтических препаратов (рис. 3).
Перед выпиской, на 17-й день после окончания химиотерапии проведена контрольная ЭхоКГ, по данным которой показатели систолической функции ЛЖ вернулись к исходным значениям (табл. 2). При этом отмечено уменьшение полости ЛЖ после химиотерапии с последующей его дилатацией, что характерно именно для антрациклиновой кардиомиопатии.
Через 1,5 мес после эпизода острой кардиотоксичности был проведен тредмил-тест. Толерантность к физической нагрузке оказалась высокой, реакция сердечно-сосудистой системы на нагрузку адекватная, тест на коронарную недостаточность отрицательный.
Таблица 2. Динамика показателей ЭхоКГ до и после химиотерапии и на фоне кардиотропной терапии
Доксорубицина гидрохлорид : инструкция по применению
Что собой представляет препарат, и для чего его применяют
Доксорубицина гидрохлорид – это противоопухолевое средство. Этот препарат замедляет рост опухолевых клеток и способствует их гибели.
Доксорубицина гидрохлорид применяется для лечения многих видов рака, включая рак крови (лейкоз), лимфомы, злокачественные опухоли мягких тканей и костей, рак молочной железы, рак легких и рак мочевого пузыря.
Доксорубицина гидрохлорид используется для лечения и взрослых, и детей. Доксорубицина гидрохлорид часто применяется с другими противоопухолевыми лекарственными средствами. Способ его применения зависит от вида злокачественной опухоли.
Не применяйте препарат, если
• у Вас аллергия на доксорубицина гидрохлорид или другие компоненты препарата, указанные в разделе «Состав»;
• у Вас аллергия на другие антрациклины или антрацендионы, такие как даунорубицин, эпирубицин, идарубицин;
• у Вас низкое количество клеток крови;
• у Вас после приема последней дозы образовались язвы, или Вы чувствовали жжение во рту;
• у Вас какая-либо инфекция;
• у Вас серьезные проблемы с печенью;
• Вы перенесли инфаркт сердца, у Вас нарушен сердечный ритм, воспаление сердца (миокардит) или другие серьезные проблемы с сердцем;
• Вы раньше получали лечение доксорубицином или другими подобными препаратами, такими как даунорубицин, эпирубицин, идарубицин, в высокой дозе;
• Вы кормите ребенка грудью.
Доксорубицина гидрохлорид нельзя вводить в мочевой пузырь через катетер (гибкую трубку), если:
• опухоль врастает в стенку мочевого пузыря;
• у Вас инфекция мочевыводящих путей;
• у Вас воспаление мочевого пузыря;
• имеются трудности при введении катетера в мочевой пузырь;
• у Вас есть примеси крови в моче;
• Вы кормите ребенка грудью.
Если Вы не уверены, относится ли к Вам что-либо из выше перечисленного, сообщите лечащему врачу перед применением препарата Доксорубицина гидрохлорид.
Особые указания и меры предосторожности
Перед применением препарата Доксорубицина гидрохлорид проконсультируйтесь с лечащим врачом, если:
• Вам проводили или собираются проводить лучевую терапию в области грудной клетки;
• Вам сделали или собираются делать прививку с использованием живой или живой ослабленной вакцины (например, против полиомиелита и малярии).
До и во время лечения препаратом Доксорубицина гидрохлорид Вам нужно будет сдавать анализ крови и проходить обследование сердца, чтобы подтвердить, что лечение безопасно для Вас.
Ваш лечащий врач будет контролировать состояние Вашего сердца на всем протяжении лечения, потому что:
• Доксорубицина гидрохлорид может вызывать повреждение сердечной мышцы;
• Доксорубицина гидрохлорид может приводить к развитию сердечной недостаточности;
• риск повреждения сердца повышается, если Вы раньше принимали препараты, которые оказывают негативное влияние на сердце, или получали лучевую терапию в области верхней части туловища.
Выполнение анализа крови на протяжении лечения необходимо, так как:
• Доксорубицина гидрохлорид сильно снижает образование новых клеток крови. Это повышает риск инфекций и кровотечения;
• анализ крови позволит контролировать состояние Вашей печени. Нарушение работы печени может приводить к усилению побочных реакций;
• Доксорубицина гидрохлорид может повышать уровень мочевой кислоты в крови, что приводит к развитию подагры и повреждению почек. Если уровень мочевой кислоты будет слишком высоким, Ваш лечащий врач назначит препарат для предотвращения негативных эффектов.
Дети и подростки
Доксорубицина гидрохлорид можно применять для лечения злокачественных опухолей у детей и подростков до 18 лет.
Взаимодействие с другими лекарственными средствами
Проконсультируйтесь с лечащим врачом, если Вы принимаете, недавно принимали или можете начать принимать любые другие препараты. Это относится к любым растительным препаратам и препаратам, отпускаемым без рецепта врача. Проконсультируйтесь с лечащим врачом, если Вы принимаете:
• другие противоопухолевые препараты, такие как трастузумаб, антрациклины (даунорубицин, эпирубицин, идарубицин), цисплатин, циклофосфамид, циклоспорин, цитарабин, дакарбазин, дактиномицин, 5-фторурацил, митомицин С, таксаны (например, паклитаксел), меркаптопурин, метотрексат, стрептозоцин, сорафениб;
• препараты для лечения заболеваний сердца, такие как блокаторы кальциевых каналов, верапамил и дигоксин;
• препараты, которые снижают уровень мочевой кислоты в крови (например, аллопуринол);
• барбитураты, включая фенобарбитал;
• препараты для лечения эпилепсии, такие как карбамазепин, фенитоин, вальпроат;
• клозапин, который применяется для лечения шизофрении;
• гепарин, который предотвращает образование тромбов;
• антиретровирусные препараты, которые применяются для лечения ВИЧ-инфекции;
• хлорамфеникол, сульфониламиды (антибактериальные препараты);
• прогестерон (например, при риске невынашивания беременности);
• амфотерицин В (противогрибковый препарат).
Доксорубицина гидрохлорид с пищей, напитками и алкоголем
Доксорубицина гидрохлорид не взаимодействует с пищей, напитками и алкоголем.
Беременность, грудное вскармливание и фертильность
Если Вы беременны или кормите грудью, думаете, что можете быть беременны, или планируете беременность, перед началом применения препарата проконсультируйтесь с лечащим врачом.
Доксорубицина гидрохлорид проникает через плаценту и может нанести вред плоду. Если Вы беременны, врач назначит Вам этот препарат, только если преимущества от лечения явно перевешивают возможный риск для плода.
Откажитесь от грудного вскармливания на время лечения препаратом Доксорубицина гидрохлорид, так как он проникает в грудное молоко и может нанести вред Вашему ребенку.
Мужчинам и женщинам детородного возраста необходимо использовать эффективные средства контрацепции во время лечения и в течение шести месяцев после его окончания.
У мужчин Доксорубицина гидрохлорид может приводить к необратимой стерильности. Проконсультируйтесь с врачом по поводу консервации спермы.
Во время лечения препаратом Доксорубицина гидрохлорид может наблюдаться нарушение менструального цикла. После окончания лечения менструальный цикл нормализуется, однако возможна ранняя менопауза.
Управление транспортными средствами и работа с механизмами
Доксорубицина гидрохлорид часто вызывает тошноту и рвоту. Откажитесь от вождения на время лечения препаратом.
Способ применения и дозы
Доксорубицина гидрохлорид должен назначать квалифицированный врач, имеющий опыт лечения противоопухолевыми препаратами. Данный препарат должен применяться в полном соответствии с рекомендациями лечащего врача.
При появлении сомнений либо вопросов, проконсультируйтесь с лечащим врачом.
Доза препарата будет зависеть от вида и распространенности опухоли, Вашего роста, веса и общего состояния. Лечащий врач рассчитает площадь поверхности Вашего тела и подберет ту дозу, которую Вы будете принимать. Доза Доксорубицина гидрохлорида также будет зависеть от того, принимаете ли Вы другие противоопухолевые препараты.
Продолжительность лечения
Продолжительность лечения определит Ваш лечащий врач. Обычно требуется проведение нескольких курсов с интервалом от 1 до 4 недель.
Способ применения
Перед применением квалифицированный специалист подготовит раствор препарата Доксорубицина гидрохлорид.
Препарат вводят внутривенно в виде «капельницы» в течение 3-10 минут.
В редких случаях препарат может вводиться внутриартериально.
Если Вы страдаете раком мочевого пузыря, Доксорубицина гидрохлорид могут вводить в мочевой пузырь через катетер (гибкую трубку). В этом случае препарат будет находиться в мочевом пузыре 1–2 часа. Вам потребуется не пить в течение 12 часов до начала процедуры и опорожнить мочевой пузырь сразу после ее окончания.
Применение у детей и подростков
Детям и подросткам может потребоваться меньшая доза Доксорубицина гидрохлорида, чем взрослым. Необходимую дозу определит врач.
Если Вы применили препарата больше, чем следовало
Ваш лечащий врач будет контролировать Ваше состояние во время лечения и после его окончания. Если Вы получите слишком высокую дозу препарата, то могут усилиться нежелательные реакции, которые обычно наблюдаются при лечении препаратом Доксорубицина гидрохлорид (нарушения крови, проблемы с сердцем и желудочно-кишечным трактом). Проблемы с сердцем могут возникать в течение 6 месяцев после передозировки. При появлении любых из этих симптомов немедленно обратитесь к врачу. Врач примет необходимые меры, такие как переливание крови и лечение антибиотиками.
Если Вы досрочно прекращаете применение препарата Доксорубицина гидрохлорид
Ваш лечащий врач определит, когда Вам следует прекратить лечение. Если Вы досрочно прекращаете применение препарата, это может снизить эффективность терапии. Если Вы желаете закончить ее раньше, обратитесь к Вашему врачу, чтобы обсудить с ним другие варианты Вашего лечения. При наличии вопросов по применению препарата обратитесь к лечащему врачу.
Возможные нежелательные реакции
Подобно всем лекарственным препаратам Доксорубицина гидрохлорид может вызывать нежелательные реакции, однако они возникают не у всех.
Немедленно обратитесь к врачу, если Вы чувствуете любую из приведенных ниже нежелательных реакций – Вам может понадобиться неотложная медицинская помощь:
• признаки аллергии, такие как зуд, затрудненное дыхание, головокружение, снижение артериального давления, кожная сыпь по всему телу или отек век, губ или горла;
• усталость и вялость, синяки, кровотечения, язвы во рту или признаки инфекции, такие как воспаленное горло, высокая температура, озноб;
• покалывание или жжение в месте введения препарата. Просачивание препарата из вены может приводить к отмиранию тканей, из-за которого Вам может понадобиться хирургическая операция.
Могут возникать следующие нежелательные реакции:
Очень часто (могут проявляться более чем у 1 из 10 человек):
инфекция, низкое количество клеток разных типов в крови, снижение аппетита, воспаление слизистых оболочек кишечника и полости рта, тошнота, рвота, диарея, покраснение, отек и боль в ладонях и подошвах ног, выпадение волос (у мужчин также может прекращаться рост бороды; обычно волосы отрастают снова после окончания лечения), лихорадка, слабость, озноб, нарушение работы сердца, изменение электрокардиограммы (ЭКГ), повышение уровня печеночных ферментов в крови, увеличение массы тела.
Часто (могут проявляться менее чем у 1 из 10 человек):
заражение крови (сепсис), воспаление слизистой оболочки глаза, сердечная недостаточность, учащение сердцебиения, воспаление пищевода, боль в животе, крапивница, сыпь, изменение цвета кожи и ногтей, реакции в месте введения препарата.
Нечасто (могут проявляться менее чем у 1 из 100 человек):
закупоривание кровеносных сосудов.
Частота неизвестна:
рак крови, тяжелая аллергическая (анафилактическая) реакция, обезвоживание, повышение уровня мочевой кислоты в крови, воспаление роговой оболочки глаза, усиление слезотечения, шок, кровотечение, воспаление вен, прилив крови, желудочно-кишечное кровотечение, воспаление желудка, воспаление кишечника, изменение окраски слизистых оболочек, повышенная чувствительность кожи к солнечному свету, возвращение симптомов радиационного поражения, зуд, нарушения со стороны кожи, окрашивание мочи в красный цвет из-за цвета препарата (Обратитесь к врачу, если нормальный цвет мочи не восстановится через несколько дней, или Вам кажется, что в моче есть примеси крови!), прекращение менструаций, отсутствие или снижение количества сперматозоидов в сперме, чувство недомогания.
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше.
Хранение препарата
Храните препарат в недоступном и невидимом для детей месте.
Храните в защищенном от света месте при температуре от 2 до 8 °C.
Храните препарат в оригинальной упаковке.
Срок годности
Не применяйте препарат после окончания срока годности, указанного на упаковке.
Датой истечения срока годности является последний день месяца.
Состав
Действующим веществом препарата является доксорубицина гидрохлорид. Каждый флакон содержит 10 мг доксорубицина гидрохлорида.
Вспомогательные вещества: маннитол (маннит).
Внешний вид препарата и содержимое упаковки
Доксорубицина гидрохлорид, порошок лиофилизированный для приготовления раствора для внутривенного введения представляет собой пористую массу красного цвета, гигроскопична.
Доксорубицина гидрохлорид выпускается по 10 мг во флаконах стеклянных, укупоренных пробками резиновыми. Каждый флакон вместе с листком-вкладышем помещают в пачку из картона. Упаковка для стационаров: 40 флаконов с листком-вкладышем в групповые коробки.
Читайте также:
