Артериит Такаясу
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Быстрицкая Н.С. 1 Степченко М.А. 1 Хардикова Е.М. 1 Волобуев Д.К. 1 Колупаев Н.С. 1 Борисова К.Н. 1 Драговоз И.С. 1 Меснянкина Е.А. 1 Иваныкина В.М. 1 Сиделева Е.Н. 1 Колесников Д.А. 1
Артериит Такаясу или неспецифический аортоартериит, называемый так же как болезнь Такаясу, заболевание отсутствия пульса, средний аортальный синдром, синдром Марторелля, артериит молодых женщин является заболеванием, относящимся к группе системных васкулитов, с частым поражением сосудов крупного диаметра и является возможной причиной развития инфаркта миокарда. Распространенность заболевания до конца не известна. По мнению А. Политано и К. Дж. Cherry (2015), неспецифический аортоартериит, является второй причиной окклюзионной болезни сосудов крупного диаметра в Америке. По одним данным в России на 1 миллион населения приходится 2,6 человека, имеющих данную патологию. Соотношение мужчин и женщин в Российской Федерации колеблется от 1: 2,4 до 1,71. Большая часть пациентов с неспецифическим аортоартериитом находятся в возрастном диапазоне от 10 до 30 лет. В статье представлено описание клинического случая заболевания неспецифическим аортоартериитом пациентки 38 лет с развитием инфаркта миокарда. Данный пример доказывает, что определение наличия артериита Такаясу представляет собой трудную задачу из-за первично-хронического течения заболевания у большей части больных, отсутствия специфичных симптомов, наличия многообразных клинических проявлений, что зачастую приводит к запоздалому диагнозу и возникновению осложнений.
1. Alibaz-Oner F. Clinical features of Takayasu’s arteritis from an inception cohort: early disease is characterized by systemic inflammation. Rheumatology. 2019. Vol. 58 (2). P. 228.
2. Onen F., Akkoc N. Epidemiology of Takayasu arteritis. Presse Med. 2017. P. 197-203. DOI: 10.1016/j.lpm.2017.05.034.
Incidence, prevalence, mortality and causes of death in Takayasu Arteritis in Korea – a nationwide, population-based study. Int J Cardiol. 2017. 235 p. DOI: 10.1016/j.ijcard.2017.04.013.
5. Pacheco R.L., Latorraca C.O.C., de Souza A.W.S., Pachito D.V., Riera R. Clinical interventions for Takayasu arteritis: A systematic review. Int J ClinPract. 2017. P. 71(11). DOI: 10.1111/ijcp.12993.
6. Kim H., Barra L. Ischemic complications in Takayasu’s arteritis: A metaanalysis. Semin Arthritis Rheum. 2018. P. 47. DOI: 10.1016/j.semarthrit.2017.11.001.
7. Im J.H., Park H.Y., Yi S.H. Carotid Ultrasonography in Takayasu’s Arteritis. Journal of Neurosonology and Neuroimaging. Korean Society of Neurosonology. 2018. Vol. 10 (1). P. 45-46.
8. Огнерубов А.Н., Антипова Т.С. Возможности ПЭТ/КТ в диагностике и мониторинге терапии артериита Такаясу: клинические наблюдения // Вестник Тамбовского университета. Серия Естественные и технические науки. 2017. № 6. С. 1437-1444.
9. Басек И.В., Березкина Н.Н. Роль МСКТ-ангиографии в диагностике артериита Такаясу. Клиническое наблюдение // Трансляционная медицина. 2018. № 5. С. 51–57.
10. Arend W.P., Michel B.A., Bloch D.A. et al. The American College of Rheumatology 1990 criteria for the classification of Takayasu arteritis. Arthritis and Rheumatism. 1990. V. 33. № 8. P. 1129-1134.
11. Chikhladze N.M. Arterial hypertension in patients with non-specific aortoarteritis. Systemic Hypertension. 2018. P. 43–48. DOI:10.26442/2075-082X_2018.2.43-48.
12. Dejaco C., Ramiro S., Duftner C., Besson F.L., Bley T.A., Blockmans D., Brouwer E., Cimmino M.A., Clark E., Dasgupta B., Diamantopoulos A.P., Direskeneli H., Iagnocco A., Klink T., Neill L., Ponte C., Salvarani C., Slart R.H.J.A., Whitlock M., Schmidt W.A. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann Rheum Dis. 2018. P. 77. DOI: 10.1136/annrheumdis-2017-212649.
Первое описание неспецифического аортоартериита было дано R. Yamamoto в 1830 г. Более подробно, с описанием клинического случая, данную проблему охарактеризовал в 1908 г. профессор офтальмологии Takayasu. Он приводит случай артериовенозной фистулы центральной артерии сетчатки у молодой женщины. Спустя несколько лет, в 1951 г., Shimizu и Sano опубликовали случай, названный «Болезнь отсутствия пульса», причиной которой была окклюзия крупных артерий, отходящих от дуги аорты. В дальнейшем заболевание стало называться «артериит Такаясу» (АТ) [1].
Артериит Такаясу, или неспецифический аортоартериит, относится к группе системных васкулитов с частым поражением сосудов крупного диаметра. В литературе встречается большое количество синонимов этой патологии, таких как «средний аортальный синдром», «синдром дуги аорты», «болезнь отсутствия пульса», «синдром Марторелля» [2].
Неспецифический аортоартериит является ведущей причиной окклюзионной болезни сосудов крупного диаметра пациентов в Южной Америке и Азии. Большая часть больных с неспецифическим аортоартериитом находятся в возрастном диапазоне от 10 до 30 лет [3].
АТ признан редким заболеванием, встречающимся в 1–2 случаях на 1 млн населения в Японии и в 0,8 случая на 1 млн населения – в Швеции и Великобритании.
Причина развития данного заболевания до настоящего времени до конца не известна. Триггерам могут стать аутоиммунные изменения, инфекции (как вирусной, так и бактериальной этиологии). В патологический процесс вовлекаются все слои артериальной стенки [4]. Это, в конечном счете, ведет к развитию стенозов, тромбозов за счет утолщения и нарушения проходимости сосудов. При поражении среднего слоя артерии наблюдаются аневризмы сосудов и дилатация сосудов выше места стеноза. Указанные изменения сопровождаются вариабельной клинической симптоматикой, которая зависит от фазы и активности заболевания.
Диагностика артериита Такаясу представляет собой трудную задачу из-за первично-хронического течения заболевания у большей части больных, отсутствия специфичных симптомов, наличия многообразных клинических проявлений, что часто приводит к запоздалому диагнозу и возникновению осложнений.
Некоторые пациенты отмечают у себя длительную (в течение нескольких месяцев), постоянную, необъяснимую лихорадку с повышением температуры тела до 38–39°С. У других пациентов болезнь проявляется субфебрильной температурой, снижением веса, слабостью, усталостью, т.е. неспецифическими симптомами заболевания.
Однако возможно и бессимптомное течение до появления первых признаков ишемического поражения [5].
В изученной литературе имеются данные, что от дебюта заболевания до клинического диагноза пациента проходит в среднем полтора года. Однако этого срока недиагностированного заболевания бывает достаточно для развития у пациента сосудистой патологии, что клинически проявляется ишемическими последствиями [6].
А ведь именно своевременное его распознавание может оказать решающее влияние на исход болезни. В последние годы все энергичнее ведется поиск новых решений, позволяющих оценить наличие или отсутствие воспаления стенки артерии [7].
Ангиографию с изображением артериального сосудистого русла до сих пор можно считать золотым стандартом. Большинство российских и зарубежных центров в последнее время используют компьютерную томографическую ангиографию (КТ-ангиографию) или магнитно-резонанснуюангиографию (МР-ангиографию) вместо традиционной ангиографии. Преимущество этих методов в том, что они малоинвазивны, при этом КТ-ангиография дает низкую лучевую нагрузку, а при МР-ангиографии она вовсе отсутствует. Также МР-ангиография дает возможность оценить толщину сосудистой стенки, рассмотреть расслоение аневризмы или сформировавшийся тромб. Несмотря на все плюсы данных методов, они малоинформативны для ранней диагностики артериита Такаясу, так же как и ангиография.
Все более перспективным методом с целью оценки сосудистого воспаления считается позитронно-эмиссионная томография (ПЭТ) с 18F фтордезоксиглюкозой (18F-ФДГ). Данная методика дает возможность оценить участки воспаления в стенке артерии независимо от степени стеноза сосуда. Однако данный метод остается труднодоступным и имеет высокую стоимость в сочетании с лучевой нагрузкой [8, 9].
По преимущественной локализации, согласно ангиографической классификации поражения, неспецифический аортоартериит принято разделять на несколько типов.
I тип – дуга аорты и отходящие от нее артерии.
IIа тип – восходящий отдел, дуга аорты и ее ветви.
IIb тип – восходящий отдел, дуга аорты и ее ветви, нисходящий грудной отдел.
III тип – нисходящий грудной, брюшной отделы аорты и (или) почечная артерии.
IV тип – брюшной отдел аорты и (или) почечные артерии.
V тип – смешанный вариант типов IIb и IV.
При поражении коронарных сосудов развивается стенокардия, вплоть до острого коронарного синдрома (ОКС). Однако в основе лежат абсолютно разные механизмы развития – иммунное воспаление в сосудистой стенке при артериите Такаясу и атеросклеротическое поражение коронарных сосудов у больных с ишемической болезнью сердца. Метаанализ, основанный на 35 исследованиях, показал, что распространенность у пациентов с неспецифическим аортоартериитом может составлять лишь 3,4%. В связи с этим представленное собственное клиническое наблюдение имеет неоспоримую значимость для практикующего врача.
Цель исследования. Изучить особенности течения артериита Такаясу у пациентки 38 лет, проявившегося инфарктом миокарда в дебюте заболевания.
Материалы и методы исследования
Проведен ретроспективный анализ истории болезни пациентки, поступившей вотделение неотложной кардиологии регионального сосудистого центра бюджетного медицинского учреждения Курской областной клинической больницы.
Американской коллегией ревматологов (The American College of Rheumatology) были разработаны критерии для верификации диагноза неспецифического аортоартериита [10]. Согласно этим критериям, диагноз считается оправданным при наличии трех или более условий:
1) возраст менее 40 лет;
2) наличие симптомов ишемии конечностей, что проявляется дискомфортом и мышечной слабостью при движении;
3) ослабление пульсации на плечевых артериях;
4) градиент давления между конечностями >10 мм рт. ст.;
5) систолический шум в проекции подключичных, сонных артерий или аорты;
6) изменения ангиографической картины.
Для верификации диагноза инфаркта миокарда использовали критерии острой ишемии миокарда согласно клиническим рекомендациям Министерства здравоохранения Российской Федерации (2020 г.):
• симптомы ишемии миокарда;
• ЭКГ – остро возникшие ишемические изменения;
• появление патологических зубцов Q на ЭКГ;
• наличие новых участков миокарда с потерей жизнеспособности или нарушением локальной сократимости, подтвержденных визуализирующими методами;
• наличие тромба коронарных артерий (по данным коронарной ангиографии).
Достаточно одного из показателей, чтобы диагностировать инфаркт миокарда.
Для оценки тяжести острой сердечной недостаточности (ОСН) применяли классификацию Killip, согласно которой выделяют 4 стадии – от отсутствия сердечной недостаточности (I стадия) до кардиогенного шока (IV стадия).
Стадия гипертонической болезни (ГБ) устанавливалась согласно трехстадийной классификации ГБ: ГБ I стадии предполагает отсутствие поражения органов-мишеней, ГБ II стадии – присутствие изменений со стороны одного или нескольких органов-мишеней. Диагноз ГБ III стадии устанавливается при наличии сердечно-сосудистых заболеваний (ССЗ), цереброваскулярных болезней, хронической болезни почек ≥4 стадии [11].
Для диагностики клинического случая были использованы следующие методы исследования:
– лабораторные: исследование динамики уровня сердечного тропонина высокочувствительными методами;
– инструментальные: электрокардиография; эхокардиография (Эхо-КГ); коронароангиография (КАГ); ультразвуковая диагностика брахицефальных артерий; рентгенографическое исследование органов грудной клетки; УЗИ брюшного отдела аорты; тредмил-тест; компьютерная томографическая ангиография торакоабдоминальной аорты [12].
Сведения получены способом выкопировки данных из больничной карты (форма 033У) за выбранный период. Обработка данных и графическое представление выполнялись с помощью компьютерных программ, включая MS Excel 2013 и Statistica 10.0.
Результаты исследования и их обсуждение
Пациентка К., 38 лет, поступила в отделение неотложной кардиологии регионального сосудистого центра БМУ Курской областной клинической больницы с жалобами на интенсивные жгучие, давящие боли за грудиной, иррадиирущие в левую руку в покое в течение 1 ч, что послужило причиной вызова бригады скорой медицинской помощи.
Из анамнеза настоящего заболевания известно, что впервые интенсивные давящие боли за грудиной появились 6 месяцев назад. Боли провоцировались умеренной физической активностью, повышением АД до 150–160/100 мм рт. ст. С того же времени отмечала понижение аппетита, в связи с чем потеряла в весе 5 кг, слабость в мышцах конечностей, чувство онемения левой руки, онемение и зябкость пальцев кистей, одышку при ходьбе, сердцебиение, головные боли, головокружение.
Известно, что с 34 лет пациентка стала отмечать повышение артериального давления (АД) до 150–160/90 мм рт. ст. За медицинской помощью не обращалась. Постоянной антигипертензивной терапии не получала, при повышении АД принимала каптоприл в дозе 25 мг сублингвально.
Интерес представляет тот факт, что мать больной перенесла инфаркт миокарда в возрасте 44 лет.
Из анамнеза жизни известно, что страдает синдромом раздраженного кишечника, частыми запорами. Курит 20 лет (менее 1 пачки в день).
При поступлении: общее состояние средней степени тяжести, температура 36,7°С, положение вынужденное; сознание ясное; цвет кожи и видимых слизистых оболочек бледный; подкожно-жировой слой развит слабо, лимфатические узлы не пальпируются. Снижение пульсации на плечевой артерии слева, гипотрофия мышц нижних конечностей. Частота дыхательных движений составила 17 в минуту. Дыхание в легких жесткое; сухие, свистящие хрипы при форсированном выдохе. Тоны сердца ритмичные. Аускультативно выслушивался шум над левой подключичной артерией. Следует отметить, что пальпаторно выявлялось ослабление пульса, преимущественно на левой лучевой артерии, частота дыхательных движений 66 уд/мин. Разница АД между правой и левой рукой составляла 15 мм рт. ст. (слева – 125/75 мм рт. ст., справа – 110/70 мм рт. ст.). Живот при пальпации мягкий, безболезненный, размеры печени по Курлову 9–8–7 см, что соответствует норме. Отеков нижних конечностей не отмечалось.
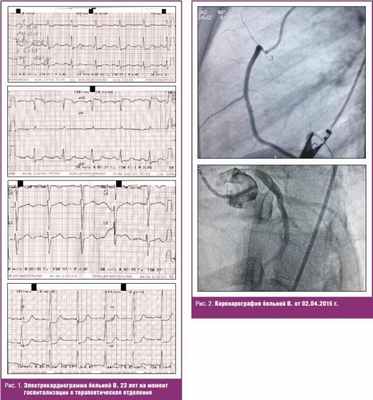
На электрокардиограмме ритм синусовый, подъемсегмента ST II, III, aVF, с реципрокной депрессиейST вVl –V3, замедление атриовентрикулярной проводимости.
Данные лабораторно-диагностических исследований:
– общий анализ крови выявил значительное увеличение уровня скорости оседания эритроцитов до 56 мм/ч;
– биохимические показатели в пределах референсных значений;
– повышение уровня высокочувствительного С-реактивного белка до 72,3 мг/л;
– высокочувствительный (вч) тропониновый тест 7 нг/мл.
При проведении эхокардиографии при поступлении выявлено: диаметр аорты – 3,0; стенки аорты незначительно уплотнены; стенки аортального клапана не изменены, раскрытие 1,7; размеры левого предсердия – 2,7; створки митрального клапана не изменены; движение створок митрального клапана дискордантное, двуфазное; КДР ЛЖ (конечный диастолический размер левого желудочка) – 4,0; ФВ ЛЖ (фракция выброса левого желудочка) – 64%; ТМЖП (толщина миокарда межжелудочковой перегородки) – 1,1; движение межжелудочковой перегородки – правильное; ТЗСЛЖ (толщина задней стенки левого желудочка) – 1,0; размер правого предсердия – 3,5х2,7; гипокинез нижних сегментов ЛЖ, отсутствует снижение глобальной сократимости миокарда, фракция выброса левого желудочка (ФВ ЛЖ) по Симпсону соответствует 64%.
Коронароангиография: тип кровоснабжения – правый. Ствол левой коронарной артерии не изменен. Передняя нисходящая артерия: стеноз 70% на границе проксимальной и средней трети. Огибающая артерия: стеноз 50% в дистальной трети.
Ультразвуковая допплерография (УЗДГ) брахицефальных артерий: геометрия хода, показатели кровотока общей сонной артерии в пределах нормы. Слева: общая сонная артерия – 0,6 мм, в зоне бифуркации – 0,9 мм. Справа: общая сонная артерия – 0,6 мм, в устье подключичной артерии – 1,3 мм (незначительно утолщен).
R-графическое исследование ОГК: Легочные поля воздушны. Легочный рисунок умеренно обогащен в прикорневых зонах. Корни структурны. Купола диафрагмы четкие. Синусы свободны. Срединная тень не расширена.
УЗИ брюшного отдела аорты без изменений. КТ-ангиография торакоабдоминальной аорты: признаки расширения (61 мм) среднего отдела восходящей аорты, диффузного утолщения стенки аорты и магистральных артерий, гемодинамически значимого стеноза устья правой позвоночной артерии (80–85%), гемодинамически значимого стеноза левой подключичной артерии (85%).
В связи с нетипичной клиникой развития инфаркта миокарда и изменений при инструментальных методах исследования пациентка была консультирована ревматологом. На основании диагностических критериев заболевания, таких как дебют заболевания в возрасте 38 лет, пальпаторно выявленное ослабление пульсации на плечевых артериях, наличие градиента давления между правой и левой руками 15 мм рт. ст.; наличие типичных ангиографических изменений, был установлен диагноз: Артериит Такаясу II Б с поражением среднего отдела восходящей аорты, правой позвоночной артерии, левой подключичной артерии, коронарных артерий (передней нисходящей артерии, огибающей артерии), феномен Рейно, амиотрофический синдром. Инфаркт миокарда нижней стенки левого желудочка с подъемом сегмента ST. Острая сердечная недостаточность Killip I.
Проводилось лечение: наблюдение и лечение в блоке интенсивной терапии в течение 2 суток, антикоагулянты, антиагреганты, бета-блокаторы, ингибиторы АПФ, гиполипидемические препараты.
После выписки из стационара рекомендованы:
1) диспансерное наблюдение кардиолога, ревматолога по месту жительства;
2) диета с ограничением соли, жиров животного происхождения;
3) дозированные физические нагрузки, ходьба со скоростью 80 шагов в минуту 1 ч в день;
4) контроль липидов крови через 3 месяца;
5) конкор 1,25 мг в 9.00 под контролем АД, ЧСС;
6) зилт 75 мг в 9.00 12 месяцев.
Заключение
Первично-хроническое течение болезни Такаясу делает ее диагностику трудной, а порой и нерешаемой задачей. Для увеличения информативности в оценке сосудистого воспаления рекомендуется сочетание различных методов визуализации, особенно у пациентов с длительным течением артериита Такаясу или нетипичной картиной болезни.
Данный клинический случай доказывает, что диагностика болезни Такаясу в настоящее время затруднена из-за неспецифичности многих симптомов болезни, в связи с чем от момента появления первых признаков заболевания до клинического диагноза проходит большое количество времени.
Болезнь Такаясу (неспецифический аортоартериит)
Обслуживание на двух языках: русский, английский.
Оставьте свой номер телефона, и мы обязательно перезвоним вам.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначить только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.

- Благодаря современной аппаратуре и высокой квалификации специалистов Клинического госпиталя на Яузе, диагностика болезни Такаясу (анализы, УЗИ, КТ, ангиография) занимает всего
- Индивидуально разработанная терапия с применением инновационных методик лечения неспецифического аортоартериита (экстракорпоральная гемокоррекция — ЭГ) позволяет предотвратить развитие осложнений.
- В 2,5 раза чаще болезнь Такаясу поражает женщин, чем мужчин. Обычно впервые заболевание проявляется в возрасте до 20 лет
- В случаев своевременное выявление и адекватная терапия гарантируют удовлетворительный прогноз течения заболевания
- Прогноз более благоприятен при ранней диагностике (до 2 лет с дебюта заболевания), стабильном течении и низкой активности процесса (нормальной СОЭ)
О развитии заболевания

Неспецифический аортоартериит (болезнь Такаясу) — это хроническое, часто рецидивирующее воспалительное заболевание аорты и ее основных ветвей (прежде всего подключичных и сонных артерий), вызывающее окклюзию (закупорку) сосудов. Это проявляется отсутствием пульса на одной или обеих руках. Нередко данное заболевание приводит к образованию аневризм (25%) и/или стенозу аорты.
Заболевание более характерно для азиатских народов. До настоящего времени истинная причина развития болезни Такаясу неизвестна. Ученые всего мира склоняются к мультифакторной теории возникновения недуга, в которой ведущую роль отдают вирусам, сбоям в работе иммунитета, генетической предрасположенности. Под их воздействием в организме человека образуются аутоантитела к собственным сосудам, что приводит к их воспалению, склерозированию и нарушению работы соответствующих органов и систем.
Симптомы болезни Такаясу
Клинические проявления неспецифического аортоартериита условно делятся на 2 большие группы:
- Общие:
- слабость;
- снижение массы тела;
- гипертертермия;
- сонливость;
- артралгиии;
- боли в мышцах.
Верхние конечности: слабость и боль в руках при движении, снижение или отсутствие пульса на одной или обеих руках, похолодание кистей, разница в АД на здоровой и пораженной руке, болезненность в зоне проекции артерий.
Нижние конечности: возможны боли в икроножных мышцах при ходьбе, если поражены подвздошные артерии, снабжающие кровью нижние конечности
ЦНС: головокружение, обмороки, головные боли, снижение памяти и общей работоспособности, пошатывание при ходьбе, симптомы очагового поражения головного мозга, инсульты.
Глаза: снижается острота зрения, появляется двоение в глазах, внезапная слепота на один или оба глаза.
Сердечная мышца: формируются пороки аортального клапана, возникают приступы стенокардии (угроза инфаркта), кардиомиопатия, хроническая сердечная недостаточность.
Брюшная полость: боли в животе, тошнота и рвота при поражении брюшной аорты, мезентериальных артерий. Возможны ректальные кровотечения.
Артериальная гипертензия диагностируется не менее, чем в 50% случаев болезни Такаясу, связана с ишемией почек.
Бронхолегочная система: одышка, кашель, боли в грудной клетке.
Мочевыделительная система: появление крови и белка в моче (гематурия, протеинурия), почечная гипертония, хроническая почечная недостаточность.
Диагностика неспецифического аортоартериита
Для верификации диагноза болезни Такаясу в Клиническом госпитале на Яузе применяются следующие методы обследования:
- Общеклинические анализы крови и мочи.
- Биохимическое исследование крови: общий белок и его фракции, фибрин, холестерин, липопротеины.
- Коагулограмма.
- Иммунологическое исследование крови: количество Т- и В-лимфоцитов, ЦИК, HLA-антигенов.
- ЭКГ.
- Дуплексное сканирование сосудов.
- КТ, МРТ.
- Эхокардиография.
- Ангиография пораженных артерий.
Диагностические критерии
Диагноз болезни Такаясу с точностью до 90% можно поставить при наличии не менее 3 критериев из следующих:
- Манифест патологии в молодом возрасте (до 40 лет).
- Синдром перемежающейся хромоты при поражении подвздошных артерий.
- Снижение характеристик пульса или его полное исчезновение на одной или обеих плечевых артериях.
- Разница в АД на руках, которая равна или больше 10 мм ртутного столба.
- Систолический шум при аускультации брюшной аорты или подключичных артерий.
- Сужение просвета сосудов (артерий), подтвержденное ангиографией или дуплексным сканированием и не связанное с атеросклерозом или другими патологиями.
Лечение болезни Такаясу
Консервативная терапия
В Клиническом госпитале на Яузе проводится консервативная терапия неспецифического аортоартериита, которая разрабатывается индивидуально для каждого пациента и основывается на данных диагностических манипуляций и степени тяжести состояния пациента.
Для медикаментозного лечения могут применяться:
- глюкокортикоиды;
- цитостатические препараты;
- современные биологически активные препараты;
- нестероидные противовоспалительные средства;
- антиагреганты и антикоагулянты (профилактика тромбозов);
- антигипертензивные препараты.
Хирургическое лечение
![]()
При наличии критического сужения магистральных артерий пациентам показано оперативное вмешательство с целью восстановления кровоснабжения зоны ишемии (катетерная баллонная ангиопластика, если возможно — стентирование, эндартерэктомия, шунтирование).
В Клиническом госпитале на Яузе проводится консультация сосудистого хирурга, оказывается помощь в организации хирургического лечения на базе партнёрского специализированного стационара. В дальнейшем пациенты наблюдаются и проходят лечение неспецифического аортоартериита на базе нашего госпиталя.
Экстракорпоральная гемокоррекция
В Клиническом госпитале на Яузе для лечения болезни Такаясу применяются инновационные медицинские технологии — методы экстракорпоральной гемокоррекции, что позволяет:
- уменьшить активность патологического процесса,
- существенно снизить риск развития осложнений,
- улучшить кровоснабжение пораженных органов,
- увеличить восприимчивость организма к минимальным дозам лекарств,
- улучшить прогноз и сделать более контролируемым и благоприятным течение заболевания.
В терапии неспецифического аортоартериита используются следующие методы ЭГ:
- криоаферез;
- каскадная фильтрация плазмы;
- иммуносорбция;
- высокообъемный плазмообмен;
- экстракорпоральная фармакотерапия;
- фотоферез.
Показания к ЭГ: наличие поражения сосудов, подтвержденного ангиографией, МРТ или КТ, ишемия части организма или органа, принадлежащими к «ареалу» определенного сосуда, неэффективность медикаментозной терапии, побочное действие или осложнения при использовании лекарственных средств.
Почему мы?
- Квалифицированная помощь. В нашем госпитале врачи проводят обследование на высокоточном оборудовании экспертного класса. Назначают терапию, согласно международным стандартам лечения. Дают исчерпывающие рекомендации при неспецифическом аортоартериите.
- Удобное размещение. Диагностический комплекс и терапевтические отделения размещены в одном здании, поэтому вы потратите минимум времени на обследование и консультации.
- Конфиденциальность. Наши сотрудники строго соблюдают принцип врачебной тайны, поэтому вы можете не опасаться разглашения информации о состоянии вашего здоровья.
- Комфортные условия. Каждому клиенту наши ревматологи уделяют максимум времени. При необходимости операции вам предоставляется комфортная палата в нашем стационаре.
Современная медицина в подавляющем большинстве случаев позволяет купировать риски и повысить качество жизни при этом сложном заболевании, при условии ранней диагностики. При малейшем подозрении на неспецифический аортоартериит, запишитесь на прием к ревматологу Клинического госпиталя на Яузе, чтобы выявить болезнь вовремя и начать лечение.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Цены на услуги ревматолога
- Стандартные консультации
- Прием (осмотр, консультация) врача-ревматолога первичный 3 900 руб.
- Прием (осмотр, консультация) врача-ревматолога повторный 3 600 руб.
- Консультации экспертов
- Прием (осмотр, консультация) врача-ревматолога Бородина О.О. 7 000 руб.
- Телеконсультации
- Удаленная консультация врача-ревматолога первичная 2 500 руб.
- Удаленная консультация врача-ревматолога повторная 2 500 руб.
- Эндоскопия
- Капсульная эндоскопия 50 000 руб.
Внимание! Цены на сайте могут отличаться.
Пожалуйста, уточняйте актуальную стоимость у администраторов по телефону.Наши специалисты:
![Бородин Олег Олегович]()
БородинОлег Олегович Врач-ревматолог
Прием пациентов с 16 лет
Стоимость приема: 7000 ₽АРТЕРИИТ ТАКАЯСУ. ОБЗОР ЛИТЕРАТУРЫ
Артериит Такаясу является редкой формой васкулита крупных артерий. В настоящем обзоре представлены особенности клинического течения заболевания, возможности визуализирующих методов в диагностике поражения артерий и оценки активности артериита Такаясу, включая использование новых биомаркеров. Особое внимание уделено эффективности современной медикаментозной терапии, интервенционным, хирургическим методам лечения артериита Такаясу и возможным осложнениям.
Ключевые слова
Об авторах
Кандидат медицинских наук, старший научный сотрудник научно-исследовательской лаборатории кардиомиопатий ФМИЦ им. В.А. Алмазова)
Федеральный медицинский исследовательский центр имени В.А. Алмазова, Санкт-Петербург
Россия
Кандидат медицинских наук, заведующая отделением рентгеновской компьютерной томографии ФМИЦ им. В.А. АлмазоваФедеральный медицинский исследовательский центр имени В.А. Алмазова, Санкт-Петербург
Россия
Кандидат медицинских наук, заведующий отделением магнитно-резонансной томографии ФМИЦ им. В.А. АлмазоваФедеральный медицинский исследовательский центр имени В.А. Алмазова, Санкт-Петербург
Россия
Кандидат медицинских наук, заведующий научно-исследовательской лабораторией рентгенэндоваскулярной хирургии ФМИЦ им. В.А. АлмазоваФедеральный медицинский исследовательский центр имени В.А. Алмазова, Санкт-Петербург
Россия
Доктор медицинских наук, заведующая научно-исследовательским отделом «Некоронарогенные заболевания сердца», заместитель директора Института сердца и сосудов ФМИЦ им. В.А. АлмазоваСписок литературы
1. Shikata H., Sakamoto S., Ueda Y. et al. Reconstruction of bilateral branch pulmonary artery stenosis caused by Takayasu’s aortitis // Circ. J. — 2004. — Vol. 68, № 8. — P. 791–794.
2. Johnston S.L., Lock R.J., Gompels M.M. Takayasu arteritis: a review // J. Clin. Pathol. — 2002. — Vol. 55, № 7. — P. 481–486.
3. Watts R., Al-Taiar A., Mooney J. et al. The epidemiology of Takayasu arteritis in the UK // Rheumatology. — 2009. — Vol. 48, № 8. — P. 1008–1011.
4. Karageorgaki Z.T., Bertsias G.K., Mavragani C.P. et al. Takayasu Features in Greece // Clin. Exp. Rheumotol. — 2009. — Vol. 27, № 1. — P. 833–839.
5. Sheikhzadeh A., Tettenborn I., Noohi F. et al. Occlusive thromboaortopathy // Angiology. — 2002. — Vol. 53, № 1. — P. 29–40.
6. Kerr G. Takayasu’s arteritis // Curr. Opin. Rheumatol. — 1994. — Vol. 6, № 1. — P. 32–38.
7. Mason J.C. Takayasu arteritis — advances in diagnosis and management // Nature reviews rheumatology. — 2010. — Vol. 6, № 7. — P. 406–415.
8. Arend W.P., Michel B.A., Bloch D.A. et al. The American College of Rheumatology 1990 criteria for the classification of Takayasu arteritis // Arthritis Rheum. — 1990. — Vol. 33, № 8. — P. 1129–1134.
9. Sharma B.K., Jain S., Suri S. et al. Diagnostic criteria for Takayasu arteritis // Int. J. Cardiol. — 1996. — Vol. 54, suppl. — P. S141–S147.
10. Park M.C., Lee S.W., Park Y.B. et al. Clinical characteristics and outcomes of Takayasu’s arteritis: analysis of 108 patients using standardized criteria for diagnosis, activity assessment, and angiographic classification // Scand. J. Rheumatol. — 2005. — Vol. 34, № 4. — P. 284–292.
11. Mwipatayi B.P., Jeffery P.C., Beningfield S.J. et al. Takayasu arteritis: clinical features and management: report of 272 cases // ANZ. J. Surg. — 2005. — Vol. 75, № 3. — P. 110–117.
12. Hata A., Noda M., Moriwaki R. et al. Angiographic findings of Takayasu arteritis: new classification // Int. J. Cardiol. — 1996. — Vol. 54, suppl. — P. S155–S163.
13. Moriwaki R., Noda M., Yajima M. et al. Clinical manifestations of Takayasu arteritis in India and Japan — new classification of angiographic findings // Angiology. — 1997. — Vol. 48, № 5. — P. 369–379.
14. Nooshin D., Neda P., Shahdokht S. et al. Ten-year investigation of clinical, laboratory and radiologic manifestations and complications in patients with Takayasu’s arteritis in three university hospitals // Malays. J. Med. Sci. — 2013. — Vol. 20, № 3. — P. 44–50.
15. Внутренние болезни / Под. ред. С.И. Рябова, В.А. Алмазова, Е.В. Шляхто. — СПб. : СпецЛит, 2000. — 861 c. / Internal diseases / Ed. by S.I. Ryabov, V.A. Almazov, E.V. Shlyakhto. — St Petersburg : SpetsLit, 2000. — 861 p. [Russian].
16. Sharma B.K., Jain S., Suri S. et al. Diagnostic criteria for Takayasu arteritis // Int. J. Cardiol. — 1996. — Vol. 54, suppl. — P. S141–S147.
17. Ruige J.B., Van Geet C., Nevelsteen A. et al. A 16 year survey of Takayasu in a tertiary Belgian center // Int. Angiol. — 2003. — Vol. 22, № 4. — P. 414–420.
18. Ishikawa K. Natural history and classification of occlusive thromboaortopathy (Takayasu’s disease) // Circulation. — 1978. — Vol. 57, № 1. — P. 27–35.
19. Ishikawa K, Maetani S. Long-term outcome for 120 Japanese patients with Takayasu's disease: clinical and statistical analyses of related prognostic factors // Circulation. — 1994. — Vol. 90, № 4. — P. 1855–1860.
20. Fukuda Y., Shirai K., Takamiya Y. et al. Isolated pulmonary arterial stenosis caused by Takayasu’s arteritis in an elderly male // J. Сardiol. — 2008. — Vol. 51, № 3. — P. 196–200.
21. Aydin S.Z., Yilmaz N., Akar S. et al. Assessment of disease activity and progression in Takayasu’s arteritis with Disease Extent Index — Takayasu // Rheumatology. — 2010. — Vol. 49, № 10. — P. 1889–1893.
22. Cong X., Dai S., Feng X. et al. Takayasu’s arteritis: clinical features and outcomes of 125 patients in China // Clin. rheumatol. — 2010. — Vol. 29, № 9. — P. 973–981.
23. Ishihara T., Haraguchi G., Tezuka D. et al. Diagnosis and assessment of Takayasu arteritis by multiple biomarkers // Circ. J. — 2013. — Vol. 77, № 22. — P. 477–483.
24. Dagna L., Salvo F., Tiraboschi M. et al. Pentraxin-3 as a marker of disease activity in takayasu arteritis // Ann. Intern. Med. — 2011. — Vol. 155, № 7. — P. 425–433.
25. Ishihara T., Haraguchi G., Kamiishi T. et al. Sensitive assessment of activity of Takayasu’s arteritis by pentraxin3, a new biomarker // J. Am Coll. Cardiol. — 2011. — Vol. 57, № 16. — P. 1712–1713.
26. Schmidt W.A., Nerenheim A., Seipelt E., Poehls C., Gromnica-Ihle E. Diagnosis of early Takayasu arteritis with sonography // Rheumatology (Oxford). — 2002. — Vol. 41, № 5. — P. 496–502.
27. Park J.H. Conventional and CT angiographic diagnosis of Takayasu arteritis // Int. J. Cardiol. — 1996. — Vol. 54, suppl. — P. S165–S171.
28. Yamazaki M., Takano H., Miyauchi H. et al. Detection of Takayasu arteritis in early stage by computed tomography // Int. J. Cardiol. — 2002. — Vol. 85, № 2–3. — P. 305–307.
29. Tso E., Flamm S.D., White R.D. et al. Takayasu arteritis: utility and limitations of magnetic resonance imaging in diagnosis and treatment // Arthritis rheum. — 2002. — Vol. 46, № 6. — P. 1634–1642.
30. Atalay M.K., Bluemke D.A. Magnetic resonance imaging of large vessel vasculitis // Curr. Opin. Rheumatol. — 2001. — Vol. 13, № 1. — P. 41–47.
31. Choe Y.H., Han B.K., Koh E.M. et al. Takayasu’s arteritis: assessment of disease activity with contrast-enhanced MR imaging // AJR. Am. J. Roentgenol. — 2000. — Vol. 175, № 2. — P. 505–511.
32. Winterer J.T., Schaefer O., Uhrmeister P. et al. Contrast enhanced MR angiography in the assessment of relevant stenoses in occlusive disease of the pelvic and lower limb arteries: diagnostic value of a two-step examination protocol in comparison to conventional DSA // Eur. J. Radiol. — 2002. — Vol. 41, № 2. — P. 153–160.
33. Flamm S.D., White R.D., Hoffman G.S. The clinical application of ‘edema-weighted’ magnetic resonance imaging in the assessment of Takayasu’s arteritis // Int. J. Cardiol. — 1998. — Vol. 66, Suppl. 1. — P. S151–S159.
34. Morita K., Imai H., Saito K., Miura A.B., Ishikawa H. The role of gallium scintigraphy, computerized tomogram scan, and magnetic resonance imaging angiography in the diagnosis of Takayasu’s disease // J. Rheumatol. — 1993. — Vol. 20, № 9. — P. 1604–1607.
35. Tezuka D., Haraguchi G., Ishihara T. Role of FDG PET-CT in Takayasu arteritis // J. Am. Coll. Cardiol. Img. — 2012. — Vol. 5, № 4. — P. 422–429.
37. Kötter I. , Henes J.C. , Wagner A.D. et al. Does glucocorticosteroid-resistant large-vessel vasculitis (giant cell arteritis and Takayasu arteritis) exist and how can remission be achieved? A critical review of the literature // Clin. Exp. Rheumatol. — 2012. — Vol. 30, Suppl. 1. — P. S114–S129.
39. Freitas D.S., Camargo C.Z., Mariz H.A. et al. Takayasu arteritis: assessment of response to medical therapy based on clinical activity criteria and imaging techniques // Rheumatol. Int. — 2012. — Vol. 32, № 3. — P. 703–709.
40. Akazawa H., Ikeda U., Yamamoto K. Kuroda T., Shimada K. Hypercoagulable state in patients with Takayasu’s arteritis // Thromb. Haemost. — 1996. — Vol. 75, № 5. — P. 712–716.
41. de Souza A.W.S., Machado N.P., Pereira V.M. et al. Antiplatelet therapy for the prevention of arterial ischemic events in Takayasu arteritis // Circ. J. — 2010. — Vol. 74, № 6. — P. 1236–1241.
42. Miyata T., Sato O., Koyama H. et al. Long-term survival after surgical treatment of patients with Takayasu’s arteritis // Circulation. — 2003. — Vol. 108, № 12. — P. 1474–1480.
43. Saadoun D., Lambert M., Mirault T. et al. Retrospective analysis of surgery versus endovascular intervention in Takayasu arteritis a multicenter experience // Circulation. — 2012. — Vol. 125, № 6. — P. 813–819.
Публикации в СМИ
Артериит Такаясу (АТ) — это заболевание с неизвестной этиологией. Оно поражает лиц моложе 50 лет и характеризуется гранулематозным воспалением аорты и ее основных ветвей. С тех пор, как для лечения АТ стали применяться глюкокортикоиды, 10-летняя выживаемость подобных пациентов увеличилась до 90%. Тем не менее необходимо учитывать не только осложнения, приводящие к летальному исходу, но и существенно ухудшающие качество жизни пацентов, например, инсульт, инфаркт, сердечную недостаточность, гангрену конечностей. Таким образом, артериит Такаясу является сложным для диагностики и лечения, зачастую непредсказуемым и весьма опасным заболеванием, которое, несмотря на невысокую распространенность, заслуживает пристального внимания клиницистов.
Воспаление с неизвестной причиной
В качестве основной причины АТ рассматривались инфекционные агенты: микобактерии, внутриклеточные бактерии и вирусы. Однако в более поздних исследованиях их роль в генезе АТ не подтвердилась.
В основе патогенеза АТ лежат воспалительные реакции, которые начинаются в области vasa vasorum. Неизвестный антиген, находящийся в эндотелии vasa vasorum крупных артериальных сосудов, инициирует повреждения эндотелиоцитов. В результате на поверхности этих клеток увеличивается количество адгезивных молекул и экспрессируются различные хемокины. Через vasa vasorum воспалительный инфильтрат, представленный Т- и реже В-лимфоцитами, макрофагами, гранулоцитами и другими клетками, проникает в адвентицию сосуда. Оттуда этот инфильтрат мигрирует в среднюю и внутреннюю оболочки артерии.
В процессе воспаления в медии и интиме происходят процессы неоваскуляризации. Это способствует дальнейшему прогрессированию воспаления. В 50% случаев возле зон неоваскуляризации отмечаются гранулематозные очаги, представленные гигантскими клетками. У некоторых больных воспалительный процесс в артериях прогрессирует настолько быстро, что соединительная ткань не успевает синтезироваться в достаточном количестве. Тогда формируются аневризмы.
Выраженные гемодинамические нарушения в регионе кровоснабжения пораженного сосуда развиваются при стенозе просвета артерии более 70%. Течение болезни со временем приводит к окклюзии крупных артериальных стволов. Однако сосудистые осложнения могут возникать и до окклюзивной стадии, в частности, в результате тромбоэмболии.
При АТ поражаются артерии эластического и мышечно-эластического типа, причем наиболее часто — подключичные и сонные артерии (70—90%), реже — дуга и нисходящая часть аорты, почечные и легочные артерии (30—50%). Еще реже — брюшная аорта, чревный ствол, мезентериальные, общие подвздошные и коронарные артерии (10—30%).
Установление диагноза порой занимает годы
Клиническая картина АТ зависит от того, какие артерии вовлечены в воспалительный процесс и насколько активно он протекает. Дебют АТ, как правило, сопровождается общей слабостью, субфебрилитетом, мигрирующими болями в суставах и мышцах, потерей веса. Однако на этой стадии просвет артерий еще полностью сохранен. Поэтому некоторые клиницисты характеризуют подобный этап развития болезни как «стадия сохранного пульса».
При прогрессировании артериита и образовании гемодинамически значимого стеноза (более 70% от исходного диаметра артерии) возникают симптомы, свидетельствующие об ишемии органов и тканей. Например, при сужении сонных артерий пациенты жалуются на головокружение, головные боли, нарушения зрения, а при стенозе подключичных артерий — на слабость и онемение рук. У таких пациентов часто бывает ослаблен пульс на лучевой артерии, разница между систолическим артериальным давлением (АД) на левой и правой руке составляет более 10 мм рт.ст.
При развитии ишемии тонкой или толстой кишки возникают боли в животе и поносы. Вовлечение почечных артерий может приводить к развитию злокачественной гипертонии. При длительном течении болезни Такаясу это осложнение развивается у 30—50% больных. Подчеркнем, что стеноз почечных сосудов лежит в основе подобной гипертонии только у половины пациентов. Что же касается больных с неповрежденными почечными артериями, то причиной повышения АД у них может служить снижение барорецепторного ответа каротидного синуса, образование коарктаций аорты, ишемия головного мозга.
У незначительной части больных (15—30%) отмечаются боли в проекции пораженных артерий. Наиболее частой из них является каротодиния. Так называют боль в проекции общих сонных артерий. Пациенты описывают ее как ноющую или стреляющую. Локализуется она на передней поверхности шеи, иногда иррадиирует в область нижней челюсти, ушной раковины. У части пациентов воспаление грудной аорты может вызывать боли в межлопаточной области, а брюшной аорты — боли в пояснице.
В последние годы внимание исследователей обращено к проблеме поражения при АТ сердца. Это обусловлено тем, что на сегодняшний день хроническая сердечная недостаточность является ведущей причиной смерти у больных АТ. Она может наступить вследствие развившихся на фоне болезни Такаясу злокачественной артериальной гипертонии, аортальной недостаточности, коронарита и даже миокардита.
Помимо поражения сердца, при АТ также описаны единичные случаи развития гломерулонефритов и гломерулопатий, амилоидоза почек; разнообразные типы поражения тонкой и толстой кишки, а также легких. Через несколько лет после дебюта АТ вышеупомянутые поражения внутренних органов могут возникать даже у лиц, получающих иммуносупрессивную терапию.
Таким образом, клиническая картина АТ, в особенности на ранних этапах болезни, является малоинформативной. На более поздних же стадиях она во многом зависит от типа пораженных артерий и может отличаться разнообразием клинических проявлений, в связи с чем нередко проходят годы с момента возникновения первых симптомов АТ до установления диагноза и начала лечения.
Как обнаружить сужение артерии?
В основе диагностики АТ лежит выявление стенотического поражения аорты и крупных артерий. Проведение биопсии артерий представляло бы оптимальный диагностический метод. Однако в силу крупного калибра пораженных артерий выполнение биопсии невозможно без серьезного оперативного вмешательства, что существенно ограничивает применение данного метода.
Наиболее распространенным подходом к диагностике АТ является визуализация стенозирующего поражения артерий с помощью инструментальных методов (УЗИ, КТ, МРТ, ангиография) и подтверждение воспаления с использованием лабораторных маркеров.
Среди инструментальных методов диагностики сосудистого поражения при артериите Такаясу одно из ведущих мест принадлежит ультразвуковому дуплексному сканированию артерий. Оно позволяет оценить степень гемодинамических нарушений в режиме цветового допплеровского картирования и спектральной допплерографии, а также состояние артериальной стенки.
Наиболее характерной ультразвуковой картиной поражения артерии при АТ является равномерное концентрическое сужение сосуда без признаков кальцификации. Однако надо помнить, что применение УЗИ артерий для диагностики и мониторинга АТ имеет ряд недостатков. Речь идет о невозможности ранней диагностики сосудистого воспаления, когда еще не возникло ремоделирование стенки сосуда; а также трудности в сканировании некоторых артерий, в частности, среднего сегмента подключичных артерий, грудной части аорты, легочных артерий.
Для комплексной оценки всего древа магистральных артериальных сосудов, включая труднодоступные для УЗИ участки артериального русла, используется традиционная рентгеноконтрастная ангиография, а также современные неинвазивные методы:
КТ-ангиография и МР-ангиография.
Хотя традиционная ангиография остается «золотым стандартом» визуализации артериального русла, данный метод также имеет ряд недостатков: инвазивность, высокая лучевая нагрузка, невысокая информативность на ранней стадии АТ. Наконец, невозможность дифференцировать, например, воспалительное поражение от интраваскулярного тромба или кальцифицированной атеромы, что в конечном итоге не позволяет отличить острое внутристеночное воспаление от хронического стенотического поражения.
Во многих клинических центрах вместо традиционной ангиографии используется КТ- или МР-ангиография. Основными преимуществами данных методов является неинвазивность, низкая лучевая нагрузка, а также способность оценить толщину сосудистой стенки, визуализировать расслаивающиеся аневризмы или сформировавшийся тромб. Тем не менее данные методы, как и ангиография, не способны визуализировать ранние этапы сосудистого воспаления или, напротив, остаточный воспалительный процесс у больных с длительно текущим заболеванием.
Итак, ПЭТ позволяет визуализировать очаги воспаления в артериальной стенке вне зависимости от степени стеноза артерии. Это является преимуществом данного метода по сравнению с УЗИ или ангиографией. Однако пока описано не более 100 случаев использования ПЭТ у больных с АТ. Таким образом, еще не накоплено достаточного опыта для определения четких показаний к проведению данного метода.
Маркеры этого воспаления еще предстоит найти
Наиболее широко используемыми лабораторными маркерами воспаления в клинической практике остаются скорость оседания эритроцитов (СОЭ) и С-реактивный белок (СРБ). В течение многих лет данные маркеры служили критерием активности болезни Такаясу. На основании этих показателей оценивалась эффективность иммуносупрессивной терапии. Однако с конца 80-х годов прошлого века стали накапливаться данные, свидетельствующие о малой информативности СОЭ и СРБ для определения степени сосудистого воспаления в рамках аортоартериита у большинства больных, получающих иммуносупрессивную терапию. В первую очередь, о низкой чувствительности вышеупомянутых маркеров свидетельствовали многочисленные наблюдения неуклонного прогрессирования стенозов артериальных сосудов у лиц со стойко нормальными острофазовыми показателями.
Принимая во внимание актуальность данной проблемы, в 1998 г. Международной ассоциацией по изучению системных васкулитов (ISSYS) было проведено проспективное исследование по оценке потенциальных маркеров сосудистого воспаления, таких как СОЭ, СРБ, тканевого фактора, ингибитора тканевого фактора роста, тромбомодулина, фактора фон Виллебранда, элементов системы комплемента, Е-селектина, различных интегринов. К сожалению, исследователи не обнаружили статистически достоверных различий сывороточной концентрации вышеуказанных показателей между группами с активным воспалительным процессом в рамках АТ, группой больных в ремиссии и контрольной группой.
В России преобладает самый сложный вариант болезни
В основе современной классификации АТ (Консенсусная конференция по артерииту Такаясу, Токио, 1994) лежат результаты ангиографического исследования. В зависимости от сосудов, вовлеченных в патологический процесс, выделяют пять типов данного заболевания (табл.).
В зависимости от национальности имеются некоторые различия в локализации сосудистого поражения. В нашей стране до настоящего времени наиболее широкое применение получили классификации по Уэно (1967) и Люпи—Херреру (1975), которые основываются на ином анатомическом принципе. Тем не менее, если учесть 40-летний опыт лечения больных АТ в Институте хирургии им. А.В. Вишневского (более 300 пациентов) и 30-летние наблюдения в Институте кардиологии им. А.Л. Мясникова (более 215 пациентов), а также адаптировать классификацию по Уэно к современной международной номенклатуре, то можно сделать следующее предположение. В России преобладает 5-й тип поражения сосудов, то есть в нашей популяции у больных чаще встречается генерализованный вариант АТ.
Основным лекарством остается преднизолон
Хотя первые клинические наблюдения больных с АТ были опубликованы еще в конце XIX века, подробные патоморфологические и клинические описания стали появляться только в 40-х и 50-х годах XX века. В большинстве подобных наблюдений предпринимались попытки лечения АТ при помощи антибиотиков, противомалярийных препаратов, антикоагулянтов, кортикостероидов.
Только в конце 60-х годов XX века, на основании более чем 20-летнего наблюдения 84-х больных с АТ, японцев по национальности, была продемонстрирована неэффективность хлорохина, противотуберкулезных препаратов и антикоагулянтов в качестве базисного лечения аортоартериита. В вышеупомянутом исследовании было обнаружено, что более 90% (n=76) больных АТ имеют повышенные показатели СОЭ. Высокие острофазовые показатели у части пациентов (35%; n=29) послужили поводом к назначению кортикостероидов (преднизолона (ПЗ)). Почти у половины пролеченных преднизолоном (ПЗ) больных отмечалось быстрое улучшение клинико-лабораторной картины. Таким образом, только после публикации результатов вышеупомянутого исследования кортикостероиды стали более широко использоваться для лечения АТ.
Лишь через 20 лет после этой публикации, на основании двух крупных эпидемиологических исследований (Япония, 1970—80-е гг.) были разработаны национальные рекомендации этой страны по лечению АТ. Ведущая роль в них отводилась именно кортикостероидам.
Согласно японским рекомендациям всем больным АТ назначают ПЗ внутрь в дозе 30—50 мг/сут. Данная дозировка ПЗ сохраняется в течение 1—3 мес. Затем в течение 3—12 мес доза ПЗ снижается до 15—25 мг/сут. В первые два года после постановки диагноза не рекомендуется снижать дозу ПЗ меньше 15 мг/сут. После двух лет непрерывного ежедневного приема ПЗ возможно продолжить снижение дозы ПЗ. Однако необходимым условием для такого снижения должно быть стойко нормальные показатели СОЭ и СРБ. Дозу ПЗ необходимо снижать как можно медленней. Как правило, снижение дозы ПЗ до 5—7,5 мг/ сут должно происходить в течение 3—6 мес. Дальнейшее снижение ПЗ вплоть до его отмены возможно только в случае полного отсутствия клинических признаков рецидива и нормальных показателей СОЭ и СРБ. Таким образом, средняя продолжительность терапии ПЗ в отсутствие рецидива болезни, по мнению японских врачей, должна составлять около 3 лет.
В США, Европе, а также в РФ в большинстве случаев используется менее продолжительная терапия кортикостероидами, которая осуществляется нередко и вместе с цитостатиками. Например, согласно рекомендациям Национального института здоровья США, всем больным АТ назначают ПЗ внутрь в дозе 1 мг/кг (но не более 60 мг/сут) в течение месяца. Затем в последующие 4—6 мес доза ПЗ может быть снижена до 10 мг/сут. При сохранении клинико-лабораторной активности болезни, в случае раннего рецидива или невозможности уменьшить дозу ПЗ в течение 3 месяцев, к ПЗ должен быть добавлен один из следующих цитостатиков: метотрексат (МТ), мофетила микофенолат, азатиоприн, циклофосфан. Среди них препаратом выбора является МТ.
Иммуносупрессивное лечение позволяет существенно замедлить прогрессирование стенотических изменений сосудов. А в случае раннего начала терапии возможно даже уменьшение степени стеноза артерии.
У больных, где диагноз АТ был поставлен с опозданием, а также в случаях, когда иммуносупрессивная терапия оказалась неэффективной или наблюдались рефрактерные варианты болезни, стенозы крупных артериальных стволов могут прогрессировать вплоть до окклюзии. В подобных ситуациях хирургическое лечение улучшает прогноз болезни и позволяет избежать инвалидизации. Оперативное восстановление кровотока в ишемизированной области возможно с помощью стентирования пораженной артерии, протезирования сосуда или шунтирования.
Хирургическое лечение противопоказано при наличии активного сосудистого воспаления, а также у лиц с недавно перенесенным инфарктом миокарда, инсультом, терминальной стадией сердечной или почечной недостаточности.
До начала широкого использования глюкокортикоидов для лечения АТ 10-летняя выживаемость при данной болезни составляла 60—70%. Ведущими причинами смерти больных аортоартериитом являлись острые нарушения мозгового кровообращения (ОНМК). Основными методами их профилактики были реконструктивные операции на сонных артериях. В 80-х годах ХХ века для лечения АТ стали повсеместно применяться глюкокортикоиды. Это позволило к 1998 году увеличить 10-летнюю выживаемость до 90%.
Напоследок подчеркнем, что для полноценного прогноза отдаленных исходов болезни Такаясу необходимо учитывать не только осложнения, приводящие к летальному исходу, но и осложнения нефатальные, тем не менее существенно ухудшающие качество жизни. Например, остается актуальной проблема высокой частоты развития ишемических осложнений АТ (инсульт, сердечная недостаточность, гангрена конечностей и т.д.), приводящих к стойкой утрате трудоспособности и способности к самообслуживанию. Низкое качество жизни больных АТ при возникновении подобных осложнений не позволяет оценивать долгосрочный прогноз АТ однозначно как благоприятный, несмотря на высокие показатели выживаемости.
Свое название болезнь получила в 1952 году. Американские врачи В.Какамис и Д. Уитман предложили называть тогда эту нозологическую форму в честь японского офтальмолога М.Такаясу, описавшего в 1905 году молодую женщину с отсутствием пульса и со специфическим кольцеподобным артериовенозным анастомозом вокруг сосочка зрительного нерва. В нашей стране первыми АТ описали в 1957 году С.П. Абугова и Д.Н.Джибладзе.
Особого внимания заслуживает возможность сочетания АТ с другими аутоиммунными заболеваниями: ревматоидным артритом, системной красной волчанкой, целиакией, язвенным колитом, болезнью Крона. Сопутствующие аутоиммунные болезни могут маскировать симптомы АТ и затруднять оценку активности сосудистого воспаления.
Идет активный поиск высокочувствительных маркеров воспаления при АТ. В нескольких исследованиях себя зарекомендовали цитокинины: интерлейкин-6, RANTES, пентраксин, а также матриксные металлопротеиназы (ММП), представляющие собой ферменты, выделяющиеся макрофагами при активном воспалении. Уже известно более 20 представителей семейства ММП. Подчеркнем, что ММП-2 и ММП-9, в отличие от других типов металлопротеиназ, локализуются преимущественно в стенке артерий, и уровень обоих этих металлопротеиназ избирательно повышается в сыворотке при деструкции сосудистой стенки.
Благодаря иммуносупрессивной терапии продолжительность жизни больных АТ повысилась, причем главным образом за счет уменьшения частоты смертельных исходов в результате острых нарушений мозгового кровообращения. К настоящему же времени в структуре смертности лидирующую позицию занимает сердечная недостаточность.
Для северных стран (Европа, США) артериит Такаясу является редким заболеванием. Частота возникновения здесь составляет 0,1—2 случая на 1 млн населения в год. Данные о заболеваемости АТ в Российской Федерации пока, увы, отсутствуют. В южных странах (Япония, Китай, Индия, Мексика, Южная Африка) частота встречаемости возрастает до 4—6 случаев на 1 млн. Это заболевание обычно начинается в возрасте от 20 до 30 лет. Болеют преимущественно женщины, причем соотношение между ними и мужчинами составляет 6—9:1.
О.Г.КРИВОШЕЕВ, доцент кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кандидат медицинских наук; И.О.СМИТИЕНКО, аспирант кафедры терапии и профессиональных заболеваний ММА им.И.М.Сеченова, кандидат медицинских наук.
Читайте также:


