Аутоиммунная гемолитическая анемия
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Красные кровяные клетки (эритроциты) доставляют кислород ко всем частям тела. У здоровых людей продолжительность жизни эритроцитов составляет около 120 дней. При АИГА иммунная система не работает должным образом и разрушает эритроциты быстрее, чем организм может их выработать. АИГА считается первичной, когда у пациента нет иной причины или иного состояния, вызвавшего АИГА.
Первичная АИГА развивается по-разному у разных людей. Таким людям часто необходимы повторные переливания крови, чтобы поддерживать уровень эритроцитов в норме. Это заболевание может быть смертельно опасным для некоторых людей.
Какова цель этого обзора и в чем его важность?
Цель этого обзора - выяснить, что говорят исследования о безопасности и эффективности лечения первичной АИГА иммуномодулирующими средствами. Иммуномодулирующие агенты изменяют работу вашей иммунной системы. Они не являются средством излечения, но они могут замедлить прогрессирование АИГА
Но насколько хорошо они работают? Являются ли некоторые их них более безопасными, чем другие? Ответы на эти вопросы важны для того,чтобы помочь врачам и пациентам принимать решение о терапии на основании доказательств.
Какие исследования были найдены в обзоре?
Мы изучили исследования, которые были завершены к 7 марта 2021 года. Мы обнаружили два исследования, в которых рассматривали иммуномодулирующее средство ритуксимаб, который прицельно воздействует на иммунные клетки, называемые В-клетками.
В исследованиях сравнили две группы взрослых с первичной АИГА, которых лечили:
- ритуксимабом и стероидами
Важно отметить, что эти исследования были очень небольшими (малыми), в общем счете включили 96 человек. Дизайн одного из исследований имел проблему, которая могла повлиять на результаты.
Восстановление после лечения
· Через 12 месяцев после начала лечения ритуксимаб и стероиды помогают большему числу людей восстановиться после первичной АИГА, чем только стероиды. Исследователи считают, что качество этого исследования низкое. Они считают, что будущие исследования, скорее всего, изменят эти результаты.
· Через шесть месяцев после начала лечения не было какой-либо разницы в выздоровлении между взрослыми, которых лечили ритуксимабом и стероидом, и теми, кого лечили только стероидом.
Побочные эффекты от лечения
· Побочные эффекты в обеих группах были одинаковыми.
Какова основная мысль этого обзора?
Ритуксимаб и стероиды могут помочь большему числу людей полностью восстановиться при впервые диагностированной (выявленной) первичной АИГА, чем только стероиды. Побочные эффекты кажутся примерно одинаковыми для обоих вариантов лечения. Но нужно больше исследований, чтобы знать наверняка.
Врачи предлагают другие методы лечения первичной АИГА, которые могут быть полезны, но не хватает исследований об их эффективности. Пока, основываясь на ограниченной информации, которой мы располагаем, пациент и врач должны будут вместе тщательно принимать решения о лечении первичной АИГА.
Аутоиммунная гемолитическая анемия
Аутоиммунная гемолитическая анемия (АИГА) — группа редких приобретенных гематологических болезней и синдромов, характеризующихся гемолизом (разрушением) эритроцитов, вследствие образования аутоантител к антигенам этих компонентов крови.
АИГА может возникнуть в любом возрасте, чаще ей подвержены женщины (60%). Патология развивается постепенно или внезапно.
Выделяют два основных типа АИГА: тепловую (аутоантитела наиболее активны/атакуют эритроциты при температуре 37-40 °C) и холодовую — с холодовыми гемолизинами (аутоантитела наиболее активны при температуре менее 30 °C, эритроциты разрушаются даже при локальном воздействии холода, например, когда человек пьет холодную воду или моет руки в холодной воде).
Причины
Причины возникновения заболевания изучены недостаточно. На сегодняшний день известно, что примерно 50% случаев т-АИГА являются идиопатическими (развиваются спонтанно). Тогда как х-АИГА ассоциированы с другими заболеваниями или возникают с ними одновременно: аутоиммунными, онкологическими, инфекционными (системная красная волчанка, лимфолейкоз, неходжкинская лимфома, вирус Эпштейна — Барр, цитомегаловирус, микоплазменная пневмония, гепатит, ВИЧ). Играть роль в развитии АИГА может и прием определенных лекарств, например, препаратов пенициллинового ряда (лекарственно индуцированная АИГА).
Симптомы
У некоторых людей заболевание может протекать бессимптомно, особенно если АИГА развивается постепенно (разрушение эритроцитов не настолько масштабно). В основном же симптомы АИГА схожи с клиническими проявлениями других типов анемии (слабость, повышенная утомляемость, бледность кожных покровов).
Симптомы при более тяжелом течении заболевания (быстром разрушении эритроцитов) включают желтушность кожных покровов и видимых слизистых оболочек, слабость, повышенную утомляемость с тахикардией и одышкой при физической нагрузке, ощущение дискомфорта в животе, чувство переполнения, холодные конечности и периферический цианоз (при холодовой АИГА). При физикальном осмотре выявляется спленомегалия (патологическое увеличение размеров селезенки) различной степени.
Если АИГА развивается на фоне другой патологии, преобладать могут симптомы основного заболевания, например: увеличение и болезненность лимфатических узлов, лихорадка, сильные боли в спине и ногах, головные боли, рвота, диарея, изменение цвета мочи на темно-коричневый.
Диагностика
Диагностика АИГА включает физикальный осмотр, общий и биохимический анализы крови, морфологическое исследование эритроцитов. Основным критерием диагностического поиска является определение аутоантител с помощью прямого антиглобулинового теста (прямой пробы Кумбса).
Лечение аутоиммунной гемолитической анемии
Первой линией терапии тепловой аутоиммунной гемолитической анемии являются глюкокортикостероиды. Высокодозная монотерапия преднизолоном может назначаться в течение 3-6 недель с постепенным снижением дозы или отменой в дальнейшем. Однако из-за сильно выраженных побочных эффектов такого лечения все чаще используют краткосрочную пульс-терапию метилпреднизолоном или дексаметазоном. Примерно треть пациентов достигают ремиссии, остальным же необходима поддерживающая терапия ГКС.
При неэффективности стероидной терапии рассматривается возможность проведения спленэктомии (хирургическое удаление селезенки), биологической терапии (ритуксимаб) или иммуносупрессивной терапии (циклоспорин, азатиоприн и др.).
Прогноз зависит от первопричины заболевания, своевременно начатого и правильно подобранного лечения. Благоприятный прогноз (достижение ремиссии, длительная ремиссия) полностью связан с положительным терапевтическим ответом у пациента и отсутствием осложнений.
Пациентам с холодовой аутоиммунной гемолитической анемией рекомендуется избегать триггеров (холода, в том числе инфузий холодных растворов), а также пройти лечение основного заболевания (например, лимфомы), если с ним связано развитие х-АИГА. Терапия первой линии при х-АИГА — ритуксимаб. ГКС не является терапией выбора из-за низкого терапевтического ответа у пациентов. Также неэффективна и спленэктомия. В тяжелых случаях рекомендован плазмоферез.
Особенности и преимущества лечения аутоиммунной гемолитической анемии в клинике Рассвет
Аутоиммунная гемолитическая анемия достаточно редкое заболевание крови, по мере его изучения критерии диагностики и лечения дорабатываются и обновляются.
Гематологи клиники Рассвет придерживаются стандартизированных диагностических критериев и терапевтических подходов, разработанных Международной консенсусной группой по АИГА. Мы осознаем важность точного диагностического поиска у таких пациентов, поскольку течение заболевания и эффективное лечение зависят от типа задействованных антител. Для диагностики первичной АИГА мы используем моноспецифический прямой антиглобулиновый тест, обязательно выясняем причины манифестации вторичной АИГА, т. е. выявляем основное заболевание, с которым связано развитие гемолитической анемии.
При лечении т-АИГА мы используем глюкокортикостероиды. Ритуксимаб назначаем только на раннем этапе тяжелого течения заболевания, а также при отсутствии быстрого терапевтического ответа на стероиды. Ритуксимаб в сочетании с антинеопластическим препаратом назначаем пациентам с х-АИГА в случаях, если их состояние требует лечения по клиническим признакам.
Гематология Рассвета представлена врачами высокой квалификации, имеющими большой опыт в выявлении и лечении сложнодиагностируемых и редких болезней. В своей работе наши специалисты используют международные протоколы лечения, применяют только безопасные, доказанные и эффективные методы.
Аутоиммунная гемолитическая анемия
Гематологический научный центр Минздравсоцразвития РФ, Москва
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Аутоиммунная гемолитическая анемия, ассоциированная с тератомой брыжейки тонкой кишки
Журнал: Терапевтический архив. 2017;89(1): 78‑81
Гематологический научный центр Минздравсоцразвития РФ, Москва
Аннотация Представлен случай аутоиммунной гемолитической анемии (АИГА) у 27-летней женщины, при обследовании которой выявлена опухоль брыжейки тонкой кишки. АИГА имела кризовое течение с временным ответом на терапию кортикостероидами (КС), которая осложнилась развитием соматогенного психоза и была прервана. Спустя 6 мес развился рецидив гемолиза. Пациентке выполнили лапароскопическую спленэктомию и удаление тератомы корня брыжейки тонкой кишки. Непосредственно после операции получен гематологический ответ в виде купирования гемолиза и восстановления нормального содержания гемоглобина. Ремиссия АИГА сохраняется последующие 16 мес.
Гематологический научный центр Минздравсоцразвития РФ, Москва
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
АИГА — аутоиммунная гемолитическая анемия
БТК — брыжейка тонкой кишки
Аутоиммунная гемолитическая анемия (АИГА) — группа заболеваний, обусловленных неконтролируемой выработкой аутоантител (аутоАТ) к неизмененным антигенам эритроцитов, приводящей к резкому уменьшению их продолжительности жизни [1]. Разрушение эритроцитов с фиксированными на мембране аутоАТ происходит преимущественно в макрофагах селезенки. Заболевание встречается редко, заболеваемость, по данным некоторых авторов, варьирует от 1 до 3 случаев на 100 000 населения в год [2]. Возрастная зависимость и наследственная предрасположенность к АИГА не выявлены. У женщин заболевание проявляется чаще, чем у мужчин. Течение, прогноз заболевания, а также тактика лечения во многом определяются типом антиэритроцитарных антител, которые в большинстве случаев являются тепловыми агглютининами.
Тератома — герминогенная несеминомная опухоль из зародышевых клеток или первичных половых клеток, которые на 4—5-й неделе внутриутробного развития мигрируют из желточного мешка в половые бугры, где формируются половые железы. При нарушении миграции и дифференцировки клеток возможно формирование опухолей, которые включают элементы всех трех зародышевых листков: эктодермы (кожа, сальные железы, эмаль, волосы), мезодермы (кости, мышцы, мочевыводящие пути) и эндодермы (легкие, желудочно-кишечный тракт). В 95% эти опухоли являются доброкачественными (зрелые тератомы). Незрелые тератомы протекают агрессивно и быстро метастазируют. Термин «дермоидная киста» обозначает новообразование, содержащее только производные эктодермы, тогда как собственно тератома может содержать производные двух других зародышевых листков. Тем не менее в литературе, как правило, оба термина используются взаимозаменяемо. Тератомы обычно локализуются в крестцово-копчиковой области (47,2%) и половых железах (31,6%), реже — в других областях, таких как шея, средостение, забрюшинное пространство, полость черепа, носоглотка и верхняя челюсть [6]. Тератомы брюшной полости, расположенные в брыжейке тонкой кишки (БТК), а также в таких органах, как желудок и поджелудочная железа, встречаются крайне редко [7]. При интраабдоминальном расположении тератомы чаще всего протекают бессимптомно и являются случайными находками при обследовании или сопровождаются неспецифическими симптомами, такими как жалобы на боли в животе.
Основой фармакотерапии АИГА с тепловыми антителами является иммуносупрессивная терапия. Глюкокортикостероиды (ГКС) в настоящее время остаются препаратами первого ряда. Однако для получения эффекта необходимы высокие начальные дозы и длительная поддерживающая терапия. Как правило, наблюдается замедленный ответ, а частота ремиссии после отмены ГКС сохраняется только в 7—30% случаев, что обусловливает необходимость изменения тактики лечения [1, 8]. Кроме того, при длительной терапии ГКС неизбежны комплексные осложнения, включая высокую вероятность развития соматогенных психозов [9]. Поскольку разрушение эритроцитов при АИГА в большей степени происходит в селезенке, спленэктомия (СЭ) является эффективным вмешательством второго ряда. Отмечено развитие длительной ремиссии примерно в 2/3 наблюдений [10]. При вторичных АИГА также проводят иммуносупрессивную терапию, однако наибольшее значение имеет терапия основного заболевания.
Приводим клинический случай.
Пациентка Б., 27 лет, в июле 2014 г. госпитализирована в гинекологическое отделение с жалобами на боли в животе и выраженную слабость с подозрением на апоплексию яичника. В течение длительного времени беспокоила периодическая не интенсивная мигрирующая боль в области живота. Признаков внутрибрюшного кровотечения при обследовании не выявлено. Обращала внимание желтушность кожных покровов; в гемограмме: гемоглобин 66 г/л, эритроциты 1,82·10 12 /л, ретикулоциты 170‰. В биохимическом анализе крови: гипербилирубинемия 50,7 мкмл/л за счет непрямой фракции (41,83 мкмоль/л) и положительная прямая проба Кумбса. Гепатиты В и С исключены. Гемосидерин в моче не выявлен. При гистологическом исследовании трепанобиоптата костного мозга отмечена гиперплазия эритроидного ростка. При ультразвуковом исследовании брюшной полости выявлено кистозное новообразование БТК, расположенное в области левого мезогастрия, диаметром 70 мм. По данным компьютерной томографии органов брюшной полости выявлено кистозное внеорганное новообразование в корне БТК диаметром 70 мм. Селезенка нормальных размеров, обнаружена добавочная селезенка 8 мм. Установлен диагноз аутоиммунной гемолитической анемии, тератома. В течение последующих нескольких суток уровень гемоглобина снизился до 56 г/л, в связи с чем от удаления новообразования решено воздержаться и начать терапию гемолитического криза преднизолоном в дозе 70 мг (1 мг/кг) в сутки. Через 3 нед лечения отмечено повышение уровня гемоглобина до 116 г/л, уменьшение уровня неконъюгированного билирубина в крови до 23,7 мкмоль/л. Пациентка выписана в удовлетворительном состоянии, а через 3 мес после начала терапии преднизолон постепенно отменен (Hb 118 г/л). Однако через 2 мес возник рецидив гемолиза со снижением уровня гемоглобина до 70 г/л и ретикулоцитозом 221‰. Проведение двух четырехдневных курсов пульс-терапии дексаметазоном (40 мг/сут) лишь незначительно уменьшило интенсивность гемолиза (Hb 84 г/л, ретикулоцитоз 166‰, лактатдегидрогеназа — ЛДГ 769 ед/л). На фоне терапии дексаметазоном манифестировал соматоформный психоз депрессивно-параноидного содержания. Известно, что такие психопатологические состояния в ряде случаев наблюдаются у гематологических больных при лечении ГКС [9]. Пациентка консультирована психиатром, дексаметазон отменен, назначен курс психофармакотерапии (кветиапин до 50 мг/сут, сертралин до 50 мг/сут). В течение 1 нед психоз в основном купирован.
Для хирургического лечения пациентку 09.02.15 госпитализировали в клинику ГНЦ. При компьютерной томографии констатировано внеорганное кистозное новообразование, которое не увеличилось в размерах по сравнению с предыдущими исследованиями (рис. 1). Лапароскопическая С.Э. с удалением добавочной селезенки и новообразования, расположенного в корне БТК, выполнена 18.02. Обращало внимание варикозное расширение вен, окутывающих новообразование брыжейки, свидетельствующее о длительном ее существовании. Кистозное новообразование вылущено из его ложа при помощи ультразвукового диссектора. Селезенка, добавочная селезенка и новообразование извлечены из брюшной полости через единый мини-лапаротомный разрез в надпупочной области (рис. 2, 3, 4, 5).
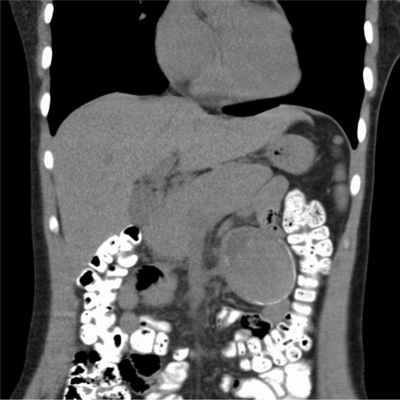
Рис. 1. Компьютерная томограмма органов брюшной полости.
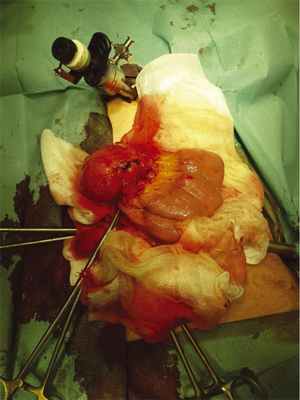
Рис. 2. Петля тонкой кишки с опухолью.
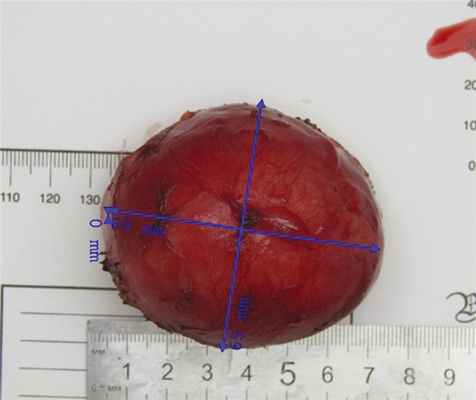
Рис. 3. Внешний вид опухоли.

Рис. 4. Опухоль на разрезе.
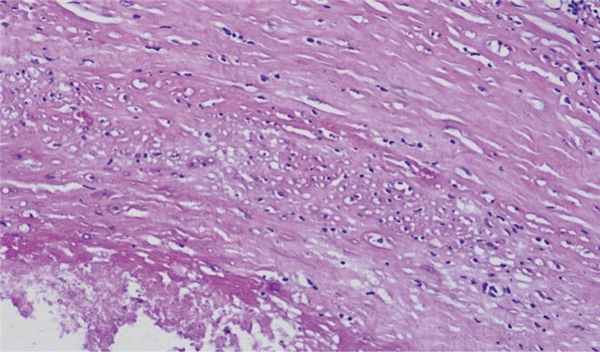
Рис. 5. Микропрепарат среза стенки кисты.
Макропрепараты: селезенка массой 400 г, размером 13×10×5 см, добавочная селезенка диаметром 0,5 см; новообразование размером 7,0×6,5×6,5 см, на разрезе представлена кистозной полостью с толщиной стенки до 0,3 см, заполненной серо-желтыми замазкообразными массами и структурами, напоминающими волосы (рис. 3, 4). Микроскопически: гистоархитектоника селезенки сохранена; фолликулы небольших размеров, без центров размножения. Периартериолярные зоны развиты умеренно. Красная пульпа пониженной клеточности и резко полнокровна. Просветы сосудов в ней заполнены гемолизированными эритроцитами. В селезеночных тяжах среди немногочисленных лимфоидных клеток рассеяно много сидерофагов и зерен гемосидерина. Структура добавочной селезенки аналогична основной. Стенка кистозной полости представлена фиброзной тканью с лимфоидной инфильтрацией и участками хрящевой ткани, внутренняя выстилка тотально некротизирована; в просвете кисты аморфные массы с микрокальцинатами (см. рис. 5).
На 2-е сутки после операции в анализах крови выявили уменьшение ретикулоцитоза и тенденцию к нормализации уровня гемоглобина, билирубина и ЛДГ. Через 1 и 16 мес клинический и биохимический анализы пациентки не имели отклонений от нормальных показателей, прямая проба Кумбса отрицательная, что свидетельствовало о полном прекращении аутоиммунного гемолиза.
У 28 из 30 пациентов (включая представленный клинический случай) гемолиз купирован либо после удаления тератомы, либо после одновременного удаления тератомы и селезенки. В 5 случаях удаление опухоли привело к излечению АИГА без предшествующей иммуносупрессивной терапии. У 24 их них на первом этапе лечения не удалось купировать гемолиз ни ГКС, ни иммунодепрессантами, ни С.Э. Одна пациентка умерла от острой непроходимости кишечника, возникшей после неэффективной СЭ [12]. У остальных 23 из 24 пациентов данной группы иммунный конфликт прерван непосредственно после удаления тератомы либо одновременного удаления тератомы и селезенки, что проявлялось снижением ретикулоцитоза и постепенной нормализацией уровня гемоглобина в крови. Только в одном случае удалось ликвидировать анемию с помощью продолжительной терапией ГКС и введением высоких доз иммуноглобулина, однако при этом прямая проба Кумбса стала отрицательной только через 2 нед после удаления тератомы яичника [21].
Отмечено, что аутоАТ сохраняются от 1 нед до 7 мес после операции, что проявляется остаточным гемолизом (у 3 пациентов в течение 7—8 мес, у остальных в течение 1—4 мес). Механизм аутоиммунного гемолиза при тератомах неясен. Существует 3 основные гипотезы этого редкого явления: 1) выработка тератомой веществ, которые изменяют антигены мембран эритроцитов, чем стимулируют продукцию аутоАТ; 2) наличие в тератоме антигенов, вызывающих перекрестную реактивность к эритроцитами; 3) наличие в тератоме скоплений иммунокомпетентных клеток, вырабатывающих антитела к эритроцитам [14, 16, 17]. Большинство авторов склонны поддерживать гипотезу о наличии аутоАТ, перекрестно реагирующих с антигенами эритроцитов и тератомы, так как в ряде случаев выработка антител прекращается немедленно после удаления опухоли. Кроме того, в большинстве случаев исчезновение сывороточных антител соответствует периоду полураспада IgG в сыворотке крови. Наконец, это же подтверждают выявлением высокой концентрацией IgG в жидком содержимом кисты [13, 16].
Представляет интерес, что в ряде случаев, как и в нашем наблюдении, при гистологическом исследовании тератом обнаруживали некроз опухоли [12, 14]. Возможно, хроническое воспаление тератомы становится пусковым фактором развития иммунного конфликта, вызывая протеолиз и изменение структуры антигенов опухоли. Обращают внимание крупные размеры большинства тератом, ассоциированных с АИГА. Эта особенность может приводить к нарушению их кровоснабжения из-за сдавливания сосудов, питающих опухоль, а также к нарушению целостности стенки напряженной кисты. Этим можно объяснить внезапность развития АИГА в разные периоды жизни пациентов с врожденной опухолью.
Заключение
В представленном клиническом случае у пациентки возникали рецидивы гемолиза при отмене ГКС, а собственно терапия ГКС была опасна из-за риска развития соматогенного психоза, в связи с чем проведение комбинированной операции позволило быстро купировать гемолиз без длительной иммуносупрессивной терапии.
Единственным эффективным средством для лечения аутоиммунного гемолиза, ассоциированного с тератомой, является удаление опухоли. СЭ либо сочетание СЭ с иммуносупрессивной терапией дает лишь временный эффект. При тяжелом состоянии больного, обусловленном гемолитическим кризом, иммуносупрессивная терапия необходима лишь как этап предоперационной подготовки. При противопоказаниях к терапии ГКС (психотическое состояние, неконтролируемые артериальная гипертония и гипергликемия, язвы желудка и двенадцатиперстной кишки и др.) возможно одновременное выполнение СЭ и удаление опухоли для скорейшего прерывания тяжелого гемолиза. При умеренно выраженном гемолизе первым этапом лечения целесообразно проводить удаление опухоли.
Диагностика и лечение хронической аутоиммунной гемолитической анемии
Больная Ш., 80 лет, пенсионерка. Из анамнеза известно, что в течение последних двух лет неоднократно проходила амбулаторное и стационарное лечение по поводу хронической B12–фолиеводефицитной анемии, диагностированной на основании анемического синдрома в сочетании с гиперхромией и макроцитозом эритроцитов. Стернальная пункция, определение уровня витамина B12 и фолиевой кислоты не проводились. Отмечался временный незначительный положительный эффект лечения витамином B12. С конца 2011 года, несмотря на ежемесячное введение витамина B12 в дозе 500γ в сочетании с фолиевой кислотой, стала нарастать анемия (14.02.2012 г. гемоглобин – 54 г/л). Для обследования и лечения госпитализирована в больницу № 40 с диагнозом: B12–фолиеводефицитная анемия тяжелой степени. ИБС. Стенокардия напряжения II ф. к. Гипертоническая болезнь II ст. Желчнокаменная болезнь. Хронический калькулезный холецистит. Мочекаменная болезнь. Конкремент правой почки, простые кисты обеих почек. Полипы желудка.
При поступлении жалобы на выраженную общую слабость, головокружения, головную боль, учащенное сердцебиение, перебои в работе сердца.
При объективном осмотре отмечены субиктеричность кожи и слизистых оболочек, умеренная гепатомегалия (+2 см) и спленомегалия (+ 2 см).
Результаты клинического анализа в динамике представлены в таблице 1.
Таблица 1. Клинические анализы крови пациентки Ш. в динамике
| 15.02.12 | 54 | 1.39 | 10.5 | 133 | 80 | 2 | 66 | 21 | 9 | 2 | - | 75 |
| 11.03.12 | 50 | 1.41 | 11.8 | 114 | 98 | 4 | 75 | 11 | 4 | 3 | 1 | 78 |
| 15.03.12 | 49 | 1.31 | 17.8 | 121 | 288 | 4* | 60 | 23 | 5 | 1 | - | 78 |
| 20.03.12 | 72 | 1.93 | 11.4 | 116 | 297 | 2 | 73 | 14 | 7 | 2 | 0 | 46 |
| 27.03.12 | 66 | 1.9 | 11 | 108 | 202 | 2 | 60 | 26 | 7 | 3 | 0 | 40 |
| 12.04.12 | 70 | 1.75 | 1.9 | 112 | 104 | 3 | 62 | 24 | 11 | 0 | 0 | 27 |
| 26.04.12 | 93 | 2.56 | 5.7 | 109 | 148 | 3 | 74 | 13 | 9 | 0 | 0 | 11 |
| 24.06.12 | 111 | 3.42 | 4.7 | 97 | 7 | 2 | 69 | 21 | 10 | 0 | 1 | 15 |
| 16.08.12 | 120 | 3.97 | 5.8 | 93 | 12 | - | 71 | 19 | 9 | 1 | 0 | 40 |
Примечание: * в лейкоцитарной формуле 15.03.12 выявлялись также миелоциты (2%) и метамиелоциты (5%).
При поступлении выявлены гиперхромная анемия (гемоглобин 54 г/л, эритроциты 1,39×10 12 /л , MCV 133 фл), ретикулоцитоз (80‰), ускорение СОЭ (75 мм/час), анизоцитоз, пойкилоцитоз и анизохромия эритроцитов.
В биохимическом анализе крови – повышение уровня креатинина (189 ммоль/л), билирубина (58 ммоль/л) за счет непрямого билирубина.
УЗИ органов брюшной полости: гепатоспленомегалия; камни желчного пузыря; диффузные изменения поджелудочной железы; простые кисты обеих почек, конкремент правой почки.
ФГДС: два полипа желудка размером до 0,5 см.
Учитывая высокий риск сердечно-сосудистых осложнений у пожилой пациентки с анемией тяжелой степени, проведены трансфузии эритроцитарной взвеси. На основании клинико-лабораторных данных (спленомегалия, гипербилирубинемия, гиперхромная анемия с ретикулоцитозом) и неэффективности лечения витамином B12 и фолиевой кислотой заподозрена гемолитическая анемия.
При исследовании крови на антиэритроцитарные антитела выявлены аутоантитела класса IgG ++++.
Результаты стернальной пункции представлены в таблице 2.
Таблица 2.Миелограмма пациентки Ш. от 17.02.12 г.
Заключение
Клеточный костномозговой пунктат. Эритропоэз – нормобластический. Гиперплазия эритроидного ростка – 74,8%. Со стороны эритрокариоцитов отмечаются клетки с цитоплазматическими мостиками, скопления в виде «эритроидных островков».
Мегакариоциты различной степени зрелости с умеренным тромбоцитообразованием.
На основании данных миелограммы (гиперплазия эритроидного ростка при нормобластическом типе кроветворения) и выявления антиэритроцитарных антител диагностирована аутоимунная гемолитическая анемия с тепловыми антителами. При дополнительном обследовании признаков вторичного характера анемии не выявлено.
С 11.03.12 г. начата пульс-терапия метипреднизолоном в дозе 500 мг 1 раз в день внутривенно в сочетании с пероральным приемом преднизолона в дозе 45 мг в сутки под прикрытием гастропротекторов. После 5 дней лечения анемический синдром продолжал нарастать, появился выраженный сдвиг лейкоцитарной формулы влево, увеличение количества ретикулоцитов (табл.1). Доза преднизолона перорально увеличена до 75 мг в сутки, к лечению добавлен азатиоприн по 100 мг/сутки per os, проведена трансфузия1 дозы эритроцитарной взвеси.
С 20.03.12 г. с учетом сохраняющегося гемолиза (ретикулоциты 297‰) проведен второй курс пульс-терапии метилпреднизолоном в дозе 500 мг в сутки № 4, однократно введен внутривенно циклофосфан в дозе 600 мг.
Лечение больная переносила хорошо. С 27.03.12 г. отмечена тенденция к увеличению уровня гемоглобина без поддерживающих гемотрансфузий. Решено продолжить введение циклофосфана по 200 мг в сутки, отменить азатиоприн. Анемический синдром продолжал уменьшаться: к 12.04.12 г. уровень гемоглобина достиг 70 г/л, снизился гемолиз (ретикулоцитов 104‰), однако развилась лейкопения (1,9×10 9 /л), в связи с чем циклофосфан был временно отменен. После восстановления количества лейкоцитов лечение циклофосфаном по 200 мг дважды в неделю было возобновлено на фоне постепенного снижения дозы преднизолона.
Больная в удовлетворительном состоянии 28.04.12 г. выписана из стационара. На амбулаторном этапе продолжено введение циклофосфана по 200 мг в сутки 2 раза в неделю, преднизолон в течение месяца полностью отменен.
В течение нескольких месяцев получала поддерживающую терапию циклофосфаном по 200 мг в сутки 2 раза в неделю (суммарная доза составила 7200 мг). На этом фоне уровень гемоглобина стабилен в пределах 100–120 г/л, количество ретикулоцитов не превышает 20%.
Комментарий к клиническому случаю
Аутоиммунная гемолитическая анемия (АИГА) – гетерогенная группа заболеваний и синдромов, обусловленных повышенным разрушением эритроцитов вследствие образования аутоантител. Частота АИГА во всех возрастных группах составляет 1:40000 – 1:80000, причем женщины болеют в 2 раза чаще мужчин. Выделяют первичные (идиопатические) и вторичные АИГА, которые чаще всего развиваются при лимфомах, солидных опухолях и заболеваниях соединительной ткани. По серологическим свойствам различают АИГА с тепловыми (85%) и холодовыми (15%) антителами; по месту разрушения эритроцитов выделяют АИГА с внутриклеточным (наиболее частым), внутрисосудистым и смешанным гемолизом.
Клинические проявления АИГА:
- анемия;
- иктеричность кожи и склер;
- умеренная спленомегалия;
- субфебрильная температура тела.
При внутрисосудистом гемолизе моча приобретает темно-бурую или черную окраску.
Лабораторные критерии:
- анемия с высоким ретикулоцитозом;
- повышение уровня билирубина за счет непрямого;
- наличие антиэритроцитарных антител (при холодовой форме часто не выявляются);
- гиперплазия эритроидного ростка костного мозга.
Стандарт первой линии терапии АИГА – пероральные глюкокортикостероиды в начальной дозе 1 мг/кг в сутки, возможно проведение пульс-терапии метилпреднизолоном в дозе 0,5–1,0 г/сутки внутривенно в течение 3-5 дней. Второй линией терапии является спленэктомия, которая используется при отсутствии эффекта глюкокортикостероидов в течение 4–6 месяцев. У пожилых пациентов показано назначение иммунодепрессивных и цитостатических препаратов (азатипоприн, циклофосфон, циклоспорин). Значительно реже используют моноклональные антитела (ритуксимаб) и иммуноглобулин. Выживаемость больных АИГА в течение 5 лет составляет 75%.
При анализе данного случая обращает внимание длительное латентное течение заболевания у больной преклонного возраста с гиперхромной анемией, что послужило причиной ошибочного диагноза B12–дефицитной анемии (для АИГА характерен нормохромный характер анемии). С учетом возраста пациентки и наличия сопутствующих заболеваний было принято решение о подключении к лечению цитостатической терапии, позволившее получить ремиссию заболевания, отменить глюкокортикостероиды и отказаться от проведения спленэктомии.
Аутоиммунная гемолитическая анемия
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Гематология / О.А. Рукавицын, А.Д. Павлов, Е.Ф. Моршакова [и др.] /под ред. О.А.Рукавицына. – СПб.: ООО «ДП», 2007. – 912 с.
2. Кардиология. Гематология /под ред. Н.А. Буна, Н.Р. Колледжа и др. – М.: ООО «Рид Элсивер», 2009. – 288 с.
3. Наглядная гематология / Перевод с англ. Под редакцией проф. В.И. Ершова. – 2-е изд. – М.: ГЭОТАР-Медиа, 2008. – 116 с.: ил.
4. Папаян А.В., Жукова Л.Ю. Анемии у детей: руководство для врачей. – СПб.: ПИТЕР. – 2001 год – 384 с.
5. Патофизиология: учебник: в 2 т./под ред. В.В. Новицкого, Е.Д. Гольдберга, О.И. Уразовой. – 4-е изд. – ГЭОТАР-Медиа, 2010. – Т.2. – 848 с.: ил.
6. Патофизиология: учебник, в 3 т.: [А.И. Воложин и др.]; под ред. А.И. Воложина, Г.В. Порядина. – М.: Издательский центр «Академия», 2006.- Т.2 – 256 с.: ил.
7. Патофизиология: курс лекций/ [Порядин Г. В. и др.]; под ред. Г. В. Порядина. – М.: ГЭОТАР-Медиа, 2012. – 592 с.
Приобретенные гемолитические анемии
Приобретенные гемолитические анемии включают в себя четыре основные группы:
1. Иммуногемолитические анемии;
2. Приобретенные мембранопатии;
3. Анемии, связанные с механическим повреждением эритроцитов;
4. Токсические гемолитические анемии различной этиологии.
I. Иммунные гемолитические анемии
Иммунные гемолитические анемии – это гетерогенная группа анемий, характеризующаяся участием иммуноглобулинов (G и М) или иммунных лимфоцитов в повреждении и преждевременной гибели эритроцитов или эритрокариоцитов.
Среди иммунных гемолитических анемий выделяют следующие группы:
1. Аутоиммунная гемолитическая анемия характеризуется наличием антител против собственных неизмененных эритроцитов. В эту группу анемии входят гемолитические анемии, вызванные тепловыми антителами, холодовыми антителами; гемолитические анемии, вызванные двухфазными гемолизинами и неполными тепловыми агглютининами.
А. Аутоиммунные гемолитические анемии, вызываемые тепловыми аутоантителами, имеют две формы: симптоматическую и идиопатическую.
Симптоматические формы развиваются на фоне опухолей лимфоидной ткани, ревматоидного полиартрита, миеломной болезни, системной красной волчанки и др.
Идиопатические формы возникают без какой-либо видимой причины.
При исследовании картины крови обнаруживаются нормо- или гиперхромная анемия, высокий ретикулоцитоз; иногда в периферической крови появляются нормоциты. Выражен анизоцитоз эритроцитов (наличие микросфероцитов и макроцитов), встречаются фрагменты эритроцитов и эритрофагоцитирующие моноциты. Осмотическая резистентность эритроцитов снижена.
Количество лейкоцитов в периферической крови может быть различным и зависит от заболевания, которое лежит в основе аутоиммунного гемолиза. Количество тромбоцитов у большинства больных нормальное или немного снижено.
Как и при других гемолитических анемиях, отмечается увеличение непрямого билирубина в сыворотке крови, однако при прогрессирующем гемолизе, сопровождающемся поражением печени, повышается и конъюгированная фракция билирубина.
Б. Аутоиммунные гемолитические анемии, вызываемые холодовыми аутоантителами, также могут быть в двух формах: симптоматической и идиопатической.
Симптоматическая форма патологии чаще развивается на фоне инфекционного мононуклеоза, микоплазменной пневмонии, лимфопролиферативных процессов и возможна в любом возрасте. Идиопатическая форма встречается без какой-либо явной причины и наблюдается чаще у женщин и у лиц пожилого возраста.
Картина крови характеризуется умеренной анемией нормохромной или гипохромной. Иногда наблюдаются небольшой сфероцитоз, эритрофагоцитоз. Осмотическая резистентность эритроцитов нормальная или слегка пониженная. Эритроциты при охлаждении быстро агглютинируют, но эта агглютинация обратима и полностью исчезает при нагревании пробы крови.
Содержание лейкоцитов и тромбоцитов не изменено.
При исследовании белковых фракций крови у больных обнаруживается особая фракция Ig M, которая представляет собой холодовые антитела.
В. Гемолитическая анемия, вызванная двухфазными гемолизинами (пароксизмальная холодовая гемоглобинурия), является наиболее редко встречающейся формой аутоиммунной гемолитической анемии.
Заболевание развивается на фоне острых вирусных инфекций, реже при сифилисе. В крови таких больных обнаруживают двухфазные гемолизины, которые при охлаждении организма фиксируются на эритроцитах и в последующем вызывают их гемолиз при повышении температуры тела выше 37° С. Считают, что двухфазные гемолизины относятся к классу IgG.
Заболевание развивается вскоре после охлаждения и характеризуется лихорадкой, ознобом, болью в суставах и мышцах, головной болью. Характерными признаками являются появление черной мочи в течение 1-2 дней, желтушность кожи и слизистых. Селезенка и печень умеренно увеличены и чувствительны при пальпации.
Картина крови. Быстрый внутрисосудистый гемолиз вызывает развитие анемии, как правило, нормохромной. Однако при частых кризах содержание гемоглобина может снижаться до 70- 80 г/л. Как свидетельство раздражения костного мозга, в периферической крови появляются нормоциты, большое количество ретикулоцитов, а со стороны белой крови – лейкоцитоз со сдвигом влево.
При исследовании мазка крови в эритроцитах обнаруживаются базофильная пунктация, полихромазия.
Г. Аутоиммунная гемолитическая анемия с неполными тепловыми агглютининами встречается одинаково часто и в виде симптоматической, и в виде идиопатической форм у людей любого возраста.
Симптоматическая форма развивается чаще на фоне опухолей лимфоидной ткани и системной красной волчанки.
По серологическому типу неполные тепловые агглютинины относятся к классу IgG, реже IgМ и IgА.
Заболевание может начаться постепенно, но может быть и острым, с бурным гемолизом и анемической комой.
При исследовании картины крови обнаруживают нормо- или гиперхромную анемию, высокий ретикулоцитоз. Резко выражен анизоцитоз эритроцитов, в периферической крови встречаются микросфероциты и макроциты. Могут обнаруживаться фрагментированные, разрушенные эритроциты, эритрофагоцитирующие моноциты. При высоком титре антител разрушаются не только эритроциты периферической крови, но и эритрокариоциты. Эритропоэз часто приобретает макронормобластический характер, что связывают с усиленным потреблением эндогенного витамина В12 и фолиевой кислоты.
При симптоматических аутоиммунных гемолитических анемиях лейкоцитарная формула определяется основным заболеванием.
При идиопатической форме чаще отмечается лейкоцитоз со сдвигом лейкоцитарной формулы влево.
Число тромбоцитов у большинства больных нормальное или несколько снижено.
2. Изоиммунные (аллоиммунные) гемолитические анемии развиваются у новорожденных с несовместимостью по изоантигенным системам АВО и резус (Rh–Hr) между плодом и матерью (гемолитическая болезнь плода и новорожденного), а также как осложнение при переливании крови, несовместимой по системам АВО, резус (Rh–Hr) и другим более редким изоантигенным системам эритроцитов.
Гемолитическая болезнь новорожденного возникает в связи с антигенным различием эритроцитов матери и ребенка, выработкой антител иммунокомпетентной системой матери, проникновением антиэритроцитарных антител (IgG) через плаценту и разрушением эритроцитов плода и новорожденного.
Различают три клинические формы заболевания: анемическую, желтушную и отечную. Патология выявляется с момента рождения ребенка или в первые часы жизни.
Клиническая картина гемолитической болезни в значительной степени определяется количеством антител, проникающих через плаценту, однако большое значение имеет степень зрелости организма новорожденного (отмечено более тяжелое течение заболевания у недоношенных детей).
Высокий титр антител обусловливает интенсивный гемолиз, эритроцитов, начинающийся еще в период внутриутробного развития и усиливающийся в момент рождения ребенка.
Картина крови. Количество эритроцитов снижается до 2-3 млн. и ниже, содержание гемоглобина в тяжелых случаях составляет 60-80 г/л. Значительно увеличено количество ретикулоцитов – 10-15 %. В периферической крови появляются эритробласты, нормоциты ЦП либо в пределах нормы, либо немного выше. Со стороны белой крови нейтрофильный лейкоцитоз со сдвигом влево.
Одним из наиболее опасных симптомов гемолитической болезни новорожденных является ядерная желтуха с симптомами поражения нервной системы – билирубиновая энцефалопатия. Нарушение билирубинового обмена усугубляется несовершенством процессов конъюгации непрямого билирубина вследствие незрелости в печени фермента уридиндифосфо–глюкуронилтрансферазы. Наряду с нарушением билирубинового обмена рано выявляются нарушения белковой и протромбинобразовательной функции печени, что приводит к кровоизлияниям и кровотечениям,
3. Гетероиммунные гемолитические анемии (лекарственные) обусловлены появлением аутоантител (IgG, IgМ) могут при приеме некоторых лекарственных препаратов – антибиотиков, стрептомицина, индометацина, противотуберкулезных препаратов, фенацитина, хинидина и др.
Механизм развития лекарственной иммуногемолитической анемии может быть различным. Препарат может вступать во взаимодействие с компонентами мембраны эритроцита и стимулировать образование лекарственных антител типа IgG. Таков механизм действия пенициллина. Лекарственный препарат может участвовать в образовании иммунного комплекса с антителом (IgМ), оседать на мембране эритроцита, активировать систему комплемента и вызывать гемолиз клетки. В ряде случаев лекарственное вещество может индуцировать образование аутоантител, таких как при тепловой аутоиммунной гемолитической анемии (IgG, IgМ).
II. Приобретенные мембранопатии
Среди приобретенных мембранопатии выделяют пароксизмальную ночную гемоглобинурию (болезнь Маркиафавы – Микели) и шпороклеточную гемолитическую анемию.
Пароксизмальная ночная гемоглобинурия (болезнь Маркиафавы – Микели). Заболевание встречается чрезвычайно редко (1 случай болезни на 500000 здоровых лиц) вследствие соматической мутации, ведущей к появлению аномальной популяции эритроцитов, нейтрофилов и тромбоцитов, что указывает на мутацию клетки-предшественницы миелопоэза,
Эритроциты, лейкоциты и тромбоциты больных имеют повышенную чувствительность к воздействию антител-агглютининов и комплемента.
Гемолиз эритроцитов происходит в сосудистом русле и провоцируется самыми различными, в том числе физиологическими, факторами (состоянием сна, у женщин – месячными), сопровождающимися сдвигами кислотно-основного равновесия в сторону ацидоза при вышеуказанных состояниях. Провоцирующими агентами могут быть и различные инфекции, прием лекарственных средств, переливание крови и др.
В последнее время появились сведения об изменении липидного состава мембран эритроцитов при болезни Маркиафавы – Микели. Отмечено небольшое увеличение количества непредельных жирных кислот, входящих в состав фосфолипидов. Возможно, что изменение в составе липидов лишь одно из изменений в структуре мембраны эритроцита, которые обусловливают феномен повышенной комплементчувствительности.
Необходимо отметить, что наряду с патологической популяцией эритроцитов у больных пароксизмальной ночной гемоглобинурией имеется и здоровая популяция клеток красной крови.
Клиническая картина характеризуется длительным течением. Нередко больных длительное время беспокоят головные боли, головокружения, слабость, боли в животе различной локализации, рвота. Гемоглобинурия является одним из поздних симптомов болезни.
Картина крови. Выраженная анемия сначала нормо-, а затем гипохромного типа. Содержание гемоглобина в период обострения снижается до 30-50 г/л. Вследствие длительной гемосидеринурии («железный диабет») истощается депо железа в организме и развивается гипосидеремия. У большинства больных отмечается небольшое увеличение количества ретикулоцитов – 2-4 %. Количество тромбоцитов и лейкоцитов понижено. Фагоцитарная активность нейтрофилов снижается.
В период гемолиза эритроцитов выражены все симптомы гемолитической желтухи: гипербилирубинемия, уробилинурия, может быть увеличение печени и селезенки.Одним из частых и тяжелых осложнений болезни Маркиафавы-Микели является синдром гиперкоагуляции с последующими сосудистыми тромбозами в системе воротной вены, абдоминальных, мозговых, коронарных сосудах, сосудах малого таза. Тромбообразование сопровождается болевым синдромом, может осложниться развитием инфаркта.
Шпороклеточная гемолитическая анемия. Этиология этого заболевания неизвестна. Отмечено, что шпороклеточная анемия встречается у людей с тяжелыми формами цирроза печени. В мембране эритроцитов таких больных повышено содержание холестерина и снижено содержание фосфолипидов. В результате нарушения структуры мембраны на поверхности эритроцитов образуются многочисленные мелкие шиловидные отростки. Продолжительность жизни таких эритроцитов укорочена, они легко разрушаются в сосудах селезенки.
Картина крови. Умеренная анемия, чаще нормохромная, ретикулоцитоз. В период гемолитического криза анемия и ретикулоцитоз значительно выражены, отмечается лейкоцитоз с нейтрофильным сдвигом формулы влево. Количество тромбоцитов может быть нормальным или сниженным.
Диагноз основывается на обнаружении в крови эритроцитов с многочисленными мелкими отростками, а также увеличении в плазме содержания литохолевой кислоты.
III. Гемолитические анемии, связанные с механическим повреждением эритроцитов
Эта группа гемолитических анемий включает в себя маршевую гемоглобинурию, микроангиопатическую гемолитическую анемию (болезнь Мошкович) и гемолитические анемии при протезировании сосудов и клапанов сердца.
Маршевая гемоглобинурия – это редкая форма механической гемолитической анемии с внутрисосудистым гемолизом. Впервые описана Флейшером (1881), который наблюдал ее у здорового солдата, совершившего длительный пеший переход.
Гемолиз эритроцитов возникает у физически крепких молодых людей (чаще у мужчин) в связи с повышенной нагрузкой на мышцы нижних конечностей при длительной ходьбе, марше, беге, а также на мышцы рук при проведении приемов каратэ. В сосудах частей тела, длительно испытывающих столкновение с жесткой поверхностью, местно развивается механический гемолиз.
Причины, вызывающие разрушение эритроцитов, не выявлены. Нарушений мембраны эритроцитов не обнаружено. Возможно, патология обусловлена необычным расположением сосудов стоп.
Характерный симптом болезни появление черной мочи. Могут быть легкая желтуха, боли в пояснице и конечностях. Морфология крови не изменена, анемия отмечается редко.
Болезнь Мошкович (микроангиопатическая гемолитическая анемия, тромботический микроангиотромбоз, тромботическая тромбоцито–пеническая пурпура) развивается на фоне коллагенозов, острого гломерулонефрита, диссеминированного карциноматоза, может возникнуть после перенесенной бактериальной или вирусной инфекции, после вакцинации.
В основе заболевания лежит системное поражение мелких сосудов комплексами антиген – антитело, вызывающее пролиферацию эндотелия, фибриноидный некроз, образование фибриновых и гиалиновых тромбов. В патологически измененных суженных сосудах происходит гемолиз эритроцитов. Из разрушенных эритроцитов освобождаются тромбопластические факторы, возникают агрегация тромбоцитов и диссеминированное внутрисосудистое свертывание крови.
Картина крови характеризуется снижением количества эритроцитов, гемоглобина, появлением деформированных эритроцитов (шизоцитов, эритроцитов с шипами). Выражена тромбоцитопения. Повышенный гемолиз сопровождается лейкоцитозом со сдвигом в лейкоцитарной формуле влево, а также высоким ретикулоцитозом.
У больных обнаруживается низкий уровень I, II, VII, VIII и Х факторов свертывания крови.
Гемолитические анемии при протезировании сосудов и клапанов сердца наблюдаются при протезировании крупных сосудов и клапанов сердца, особенно при недостаточности клапанов левого сердца, вследствие интенсивного кровотока при систоле желудочка возникают механическая травматизация и разрыв мембраны исходно полноценных эритроцитов больного.
Картина крови. Может развиться умеренная анемия. Характерно появление признаков фрагментации эритроцитов – шизоцитов, треугольных, шлемовидных эритроцитов. Возможны гипохромия эритроцитов и снижение цветового показателя из-за потери железа с мочой. Количество лейкоцитов и тромбоцитов обычно в пределах нормы.
IV. Токсические гемолитические анемии
Гемолиз эритроцитов могут вызвать самые разнообразные факторы инфекционной и неинфекционной природы. Из химических веществ гемолиз вызывает мышьяковистый водород (взаимодействие с SН-группами мембраны эритроцита), свинец, соли меди (блокада пируваткиназы эритроцита), спирты, хлораты калия и натрия, нитробензол, анилин и др. Гемолитические анемии могут возникнуть при гипербарической оксигенации, после укусов пчел, пауков, змей.
К инфекционным агентам, вызывающим гемолиз эритроцитов, следует отнести возбудителей малярии, лейшманиоза, а также токсины – ботулинический, газовогангренозный, стафилококковый, пневмококковый и др.
Механизм гемолиза различен и обусловлен действующим этиологическим агентом. Следует отметить, что в большинстве случаев под влиянием гемолитического фактора происходит дезорганизация фосфолипидно-белковой структуры мембран эритроцитов. Повышается проницаемость цитоплазматической мембраны, и в эритроциты из окружающей среды поступают ионы натрия, кальция. Из-за нарушения метаболизма углеводов, белков, липидов в гиалоплазме эритроцитов накапливаются мелкодисперсные органические соединения, эритроциты гипергидратируются, теряют дискоидную форму и легко разрушаются в просвете сосудов.
Картина крови. Анемия выражена в момент криза и проявляется снижением количества эритроцитов и гемоглобина. Цветовой показатель остается в пределах нормы. Отмечаются ретикулоцитоз и нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево.
В период гемолитического криза появляется желтуха, увеличивается непрямой билирубин в крови.
Читайте также:
