Бактериостатические антибиотики ингибиторы синтеза белка
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Бактериостатические антибиотики ингибиторы синтеза белка
Синтез белка представляет собой реализацию генетической информации, т. е. построение пептидной цепи с помощью мРНК. Сборка цепи из аминокислот (АК) происходит на рибосоме. В доставке аминокислот к мРНК участвуют разные транспортные молекулы РНК (тРНК), каждая из которых связывает конкретную АК.
Каждая тРНК несет антикодон триплета нуклеотидных оснований, которые комплементарны определенной кодирующей единице мРНК к(одон, состоит из трех нуклеиновых оснований).
Синтез белка состоит из следующих этапов:
1. Первый этап, инициация, включает сборку аппарата для синтеза белка из мРНК, малой и большой рибосомных единиц и инициирующего комплекса тРНК-АК. За этим следуют этапы удлинения.
2. Рибосома фокусируется на двух кодонах мРНК. Один (слева) связывает комплекс тРНК-АК, а АК уже добавлена к пептидной цепи. Другой (справа) готов принять следующий комплекс тРНК-АК.
3. После последнего присоединения аминокислоты двух смежных комплексов связываются в результате воздействия рибосомной пептидсинтетазы (пептидилтрансферазы). Она является рибозимом, т. е. ферментом, каталитическая функция которого обеспечивается рибосомной РНК. Одновременно отсоединяется левый комплекс тРНК-АК.
4. Левая тРНК отсоединяется от мРНК. Рибосома двигается вдоль нити мРНК и фокусируется на следующем кодоне.
5. Затем правый комплекс тРНК-АК перемещается влево, что дает возможность связать справа следующий комплекс.
Эти отдельные этапы могут ингибироваться антибактериальными препаратами. В отличие от линезолида, который продуцируется синтетически путем, все антибиотики, указанные на рисунке ниже, получают преимущественно из Streptomyces spp. Ниже обсуждаются группы препаратов в соответствии с этапами синтеза белков.
В классификации, построенной по принципу терапевтической важности, имеются градации. Во главе стоят макролиды и тетрациклины, которые имеют значение при амбулаторном лечении. За ними следуют аминогликозиды, вводимые парентерально и поэтому предназначенные для стационарного лечения, и в конце — линезолид (резервный препарат) и хлорамфеникол, который в настоящее время почти не используется.
2а. Тетрациклины ингибируют связывание комплексов тРНК-АК. Они обладают бактериостатическим свойством и поражают возбудителей многих видов. Тетрациклины всасываются из ЖКТ в различной степени в зависимости от вещества, причем полностью всасываются доксициклин иминоциклин. Внутривенная инъекция требуется редко. Наиболее частым побочным эффектом является нарушение со стороны ЖКТ (тошнота, рвота, диарея и т. д.), возникающее вследствие
1) прямого раздражающего действия на слизистую этих веществ и
2) подавления естественной бактериальной кишечной флоры (антибиотики широкого спектра), что позволяет патогенным микроорганизмам, включая грибы рода Candida, колонизировать кишку.
Не следует одновременно принимать антациды или молоко, т. к. тетрациклины образуют нерастворимые комплексы с многовалентными ионами (Са 2+ , Mg 2+ , AI 3+ , Fe 2+/3+ ), что приводит к их инактивации, т. е. к нарушению всасывания, отсутствию антибактериальной активности и местному раздражающему действию. Свойство тетрациклинов образовывать комплексы с Са 2+ обусловливает их способность накапливаться в растущих зубах и костях.
В результате происходит необратимое желто-коричневое окрашивание зубов и обратимое торможение роста костей. Исходя из этих нежелательных реакций, тетрациклины не следует применять после 2-го месяца беременности и назначать детям в возрасте до 8 лет. К другим побочным эффектам относятся повышенная фоточувствительность кожи и повреждение печени в основном после в/в введения.
Тигециклин — производное тетрациклина с измененной структурой (глицилциклин). Это резервный препарат при тяжелых инфекциях, эффективен также против тетрациклин-резистентных бактерий.
2b. Аминогликозиды вызывают образование аномальных комплексов тРНК-АК, что приводит к появлению ошибок при синтезе белка. Аминогликозиды являются бактерицидными средствами. Их спектр активности охватывает в основном грамотрицательные организмы. Стрептомицин и канамицин используются преимущественно при лечении туберкулеза.
Аминогликозиды состоят из аминосахаров, соединенных гликозидной связью с агликоновым фрагментом (см. гентамицин С1а, компонент смеси гентамицина). Они содержат несколько гидроксильных групп и аминогруппы, которые связывают белки. Следовательно, эти вещества имеют высокую полярность, плохо проникают через мембраны и плохо всасываются в кишечнике. Неомицин используется только местно накожно и для нанесения на слизистые оболочки.
Аминогликозиды для системного лечения серьезных инфекций вводят в виде инъекций (гентамицин, тобрамицин, амикацин, нетилмицин). Аминогликозиды проникают внутрь бактерий за счет бактериальных транспортных систем. В почках они проникают в клетки проксимальных канальцев посредством системы захвата олигопептидов. Канальцевые клетки чувствительны к повреждающему действию аминогликозидов (в основном обратимая нефротоксичность). Во внутреннем ухе могут повреждаться чувствительные клетки вестибулярного аппарата и спирального органа (в некоторых случаях развивается необратимая ототоксичность).
3. Хлорамфеникол ингибирует пептидсинтетазу. Он обладает бактериостатическим свойством против широкого спектра возбудителей, полностью всасывается после приема внутрь и легко преодолевает диффузионныебарьеры, например ГЭБ. Несмотря на эти благоприятные свойства, хлорамфеникол используется только в редких случаях (при инфекции ЦНС) из-за риска повреждения костного мозга.
4. Макролиды подавляют синтез белка на рибосомах. Они оказывают преимущественно бактериостатическое действие, которое направлено главным образом против грамлоложительных бактерий. Кроме того, поражаются внутриклеточные бактерии, например, хламидии и микоплазмы. Макролиды эффективны при введении внутрь. Прототипом препаратов этой группы является эритромицин, который также применяется как резервный препарат при аллергии или резистентности к пенициллину. Кларитромицин, рокситромицин и азитромицин являются производными эритромицина с одинаковой активностью, тем не менее они медленно выводятся, что позволяет снизить дозу и вводить их менее часто.
Макролиды обычно хорошо переносятся. Они вызывают желудочно-кишечные расстройства, возможно, из-за стимуляции рецепторов эндогенного посредника мотилина, который активирует перистальтику.
Эритромицин и другие макролиды ингибируют реполяризацию миокарда, в результате чего возникает риск сердечных аритмий у пациентов с уже имеющимся удлинением интервала ОТ на ЭКГ или у пациентов получающих одновременно другие препараты, удлиняющие интервал ОТ. Вследствие ингибирования изоферментов CYP, например CYP3A4, появляется риск неблагоприятных лекарственных взаимодействий. Длительное использование приводит к повреждению печени с холестазом.
Телитромицин — синтетический макролид с измененной структурой («кетолид»). Он обладает другим видом резистентности, которая связана со взаимодействием с дополнительным местом связывания рибосомы.
5. Линкозамиды. Клиндамицин обладает такой же антибактериальной активностью, как и эритромицин. Он оказывает бактериостатическое действие в основном на грамположительные аэробы, а также на анаэробные возбудители. Клиндамицин хорошо всасывается после приема внутрь и достигает эффективных концентраций даже в костной ткани, поэтому он используется при лечении стафилококкового остеомиелита.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
лекции FARMA / Антибиотики 1
Антибиотики – это продукты микробного синтеза, обладающие антимикробным действием.
В настоящее время применяются антибиотики природные и полусинтетические.
Природные антибиотики – получаемые биосинтетическим путем. Здесь живые микроорганизмы, чаще грибки, помещают в инкубационную среду, где они продуцируют антибиотики, которые затем очищают.
Полусинтетические – производятся на основе природных, где к нему добавляются химические радикалы (формула: R-х).
КЛАССИФИКАЦИЯ
АНТИБИОТИКОВ ПО МЕХАНИЗМУ ДЕЙСТВИЯ.
Ингибиторы синтеза микробной стенки (бактерицидное действие):
пИнгибиторы функций цитоплазматической мембраны (бактерицидное действие):
полимиксины (полимиксин М)
полиеновые антибиотики (нистатин, амфотерицин Б).
Ингибиторы синтеза нуклеиновых кислот (в повышенных дозах – бактерицидное действие, в среднетерапевтических – бактериостатическое).
хинолоны (налидиксовая кислота, невиграмон, неграм)
фторхинолоны (офлоксацин, перфлоксацин, ломефлоксацин, ципрофлоксацин)
Ингибиторы синтеза белка (бактериостатическое действие):
макролиды (эритромицин, олеандомицин)
Модификаторы клеточного метаболизма:
МЕХАНИЗМЫ действия антибиотиков основаны на структурных органах-мишенях микроорганизма:
цитоплазматическая мембрана (ЦПМ)
опорная структура (клеточная стенка)
Ингибиторы синтеза стенки микроорганизма – имеют точку приложения – жесткую опорную структуру микроба, состоящую из пептидогликана муреина. Его синтез идет в 2 этапа:
образование из N-ацетилглюкозамина и N-ацетилмурамовой кислоты длинных мукополисахаридных цепей
соединение этих цепей между собой пептидными связями с помощью фермента транспептидазы, после которой структура приобретает необходимую жесткость.
защитная – от повреждающих факторов
опорная – придание размеров и формы микробной клетке.
П Бнаиболее чувствительны к нему молодые микроорганизмы, поэтому их назначают как можно раньше
действуют только на грам+ микрофлору
вызывают реакцию бактериолиза в больших дозах (выход токсинов в кровь, озноб до 40 С, потеря АД, потеря сознания и т.д.).
ЦЕФАЛОСПОРИНЫ – ИМЕЮТ АНАЛОГИЧНЫЙ МЕХАНИЗМ ДЕЙСТВИЯ, но тормозят синтез опорной структуры на первых стадиях ее образования.
Ингибиторы функции ЦПМ.
Мембрана микроорганизма имеет следующие функции:
яввляется осмотическим барьером
транспорт в клетку питательных веществ
удаление из клеток продуктов метаболизма.
Нарушение этих функций ведет к бактерицидному эффекту этих антибиотиков.
ПОЛИМИКСИНЫ – это липофильные вещества, которые накапливаются в липидном компоненте ЦПМ, что ведет к нарушению ее структуры, резко увеличивается ее проницаемость, в конечном счете нарушаются ее функции.
ПОЛИЕНОВЫЕ АНТИБИОТИКИ – (нистатин, амфотерицин В) накапливаются также в липидах ЦПМ, но в тех случаях, где есть стерины – у грибков. Поэтому обладают противогрибковым действием.
3 и 4 группы антибиотиков – ИНГИБИТОРЫ СИНТЕЗА НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКА.
Они выключают определенные звенья цепочки:
ФТОРХИНОЛОНЫ – ингибируют синтез ДНК-гиразы (фермент), в результате чего нарушается синтез ДНК, и вторично – синтез белка.
РИФАМПИЦИН – ингибируют РНК-полимеразу, в результате чего нарушаются процессы транскрипции.
МАКРОЛИДЫ и ЛИНКОМИЦИН – ингибируют фермент транслоказу, нарушается перемещение рибосомы вдоль нити РНК.
ТЕТРАЦИКЛИНЫ и ГРИЗЕОФУЛЬВИН – нарушается прикрепление т-РНК к и-РНК, и синтезируется дефектный белок, либо его синтез вообще прекращается.
АМИНОГЛИКОЗИДЫ – нарушают процесс считывания информации антикодоном т-РНК с кодоном на и-РНК.
КЛАССИФИКАЦИЯ антибиотиков по спектру действия.
Антибиотики широкого спектра действия:
Они действуют на 4 вида микроорганизмов:
грам+ : кокки, дифтерия, газовой гангрены, столбняка.
грам- : кокки, кишечные, синегнойная палочка
риккетсии : сыпной тиф и др.
некоторые крупные вирусы : трахома и др.
Сейчас они имеют небольшое значение.
ампициллины и амоксициллин (полусинтетические пенициллины)
аминогликозиды 3- и 4-го поколений (гентамицин и нетромицин)
цефалоспорины 2- и 3-го поколений (кетоцеф и клафоран)
Эти антибиотики сейчас широко применяются.
Антибиотики узкого спектра действия:
действующие преимущественно на грам+ флору
аминогликозиды 1-го поколения
действующие преимущественно на грам- флору
Противогрибковые антибиотики – применяются для лечения микозов:
полиены (нистатин, леворин, амфотерицин Б) – для лечения кандидамикозов, глубоких микозов, дерматомикозов.
Гризеофульвин (накапливается в клетках, формирующих кератин, ингибирует синтез нуклеиновых кислот) – для лечения : - микроспории (стригущий лишай)
КЛАССИФИКАЦИЯ антибиотиков по клиническому применению:
АНТИБИОТИКИ 1-ГО РЯДА (основные) – применяются для лечения инфекций легкой и средней тяжести.
пенициллины (природные и полусинтетические)
тетрациклины (природные и полусинтетические)
цефалоспорины 1-го поколения (цефалексин, цефазолин)
аминогликозиды 2-го поколения (гентамицин)
АНТИБИОТИКИ 2-ГО РЯДА (резервные) – применяются для лечения тяжелых инфекций, и инфекций, вызванных резистентной флорой.
аминогликозиды 3-го поколения (нетромицин)
цефалоспорины 2- и 3-го поколений (кетоцеф и клафоран )
ПЕНИЦИЛЛИНЫ - это антибиотики, полученные на основе продуктов жизнедеятельности плесневых грибков рода Penicillum.
Различают по способу получения – природные и полусинтетические.
Природные пенициллины (бензилпенициллин, натриевая и калиевая соль его) получают биосинтетическим путем.
Спектр действия – влияют на грам+ флору, но сейчас большинство штаммов малочувствительно к ним. Важно значение высокой чувствительности бледной спирохеты к пенициллинам.
Бензилпенициллин – основной путь введения внутримышечный, быстро разрушается в ЖКТ, плохо всасывается в кишечнике. Подкожные инъекции очень болезненны (особенно калиевая соль).
Действует через 15-30 минут, длительность не более 4 часов, поэтому для поддержания терапевтической концентраци необходимл вводить каждые 4-6 часов.
3-4 раза в день – при средней и легкой
0 4 8 12 16 20 24
Можно вводить и внутривенно, но тут пенициллины очень быстро секретируется в почках и выводится с мочой. В/в капельно применяют при лечении сифилиса.
Дозировка – до 20 млн ЕД в сутки, то есть токсического эффекта нет. Можно назначать беременным в 1 триместре, (во 2 триместре предпочтительны цефалоспорины).
Пролонгированные формы пенициллина - это плохо растворимые соли бензилпенициллина, вводят внутримышечно, где создается депо, из которого медленно рассасывается действующее вещество.
Новокаиновая соль бензилпенициллина – до 12 часов
Бициллин-1 – до 7 дней
Бициллин-3 – до 7 дней.
не удается создать в крови высокую бактерицидную концентрацию, уступая по эффективности бензилпенициллину. Поэтому эти формы применяются для лечения заболеваний легкой и средней тяжести, и для профилактики ревматизма.
Полусинтетические пенициллины – получают при энзиматическом расщеплении бензилпенициллина на бензиловый радикал и 6-АПК (6-аминопенициллановая кислота). К 6-АПК добавляют различные другие радикалы, получая новые препараты:
Отличия природных от полусинтетических:
действуют на резистентные к бензилпенициллину штаммы микроорганизмов (исключение – ампициллин)
ряд антибиотиков обладают широким спектром действия, то есть действуют и на грам- флору (ампициллин, амоксициллин – к нему также чувствительна Helicobacter pylori)
назначается не только внутримышечно, но и в таблетках, в крови создается бактерицидная концентрация. Таблетки по 0,25 и 0,5 по 4-6 раз в день.
Применение пенициллинов – инфекции легкой и средней степени тяжести, вызванной чувствительной к нему флорой.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Антибиотики, нарушающие синтез белка на уровне рибосом
К ингибиторам синтеза белка на уровне рибосом относятся антибиотики системного действия, которые обратимо связываются с 30 S -субъединицей (аминогликозиды, тетрациклины), с 50 S -субъединицей (макролиды, азалиды, кетолиды, линкозамиды, фениколы); необратимо связывают 30 S - и 50 S -субъединицы рибосом и нарушают процесс образования 70 S -комплекса (оксазолидиноны).
Преферанская Нина Германовна
Доцент кафедры фармакологии фармфакультета Первого МГМУ им. И.М. Сеченова
Антибиотики оказывают в основном бактериостатическое действие, исключение составляют аминогликозиды, оказывающие бактерицидный эффект и препараты, применяемые в больших дозах. Эти лекарственные средства обладают широким спектром антимикробного действия и часто применяются в клинической практике, особенно они незаменимы в специфической терапии таких редких инфекций, как бартонеллез, бруцеллез, криптоспоридиоз, муковисцидоз, токсоплазмоз, туляремия, туберкулез, сибирская язва, холера, чума и др.
Часть I. Макролиды
Макролиды представляют собой класс антибиотиков, которые содержат в молекуле макроциклическое лактонное кольцо, связанное с углеводными остатками аминосахаров. В зависимости от числа атомов углерода, составляющих кольцо, выделяют 14-членные, 15-членные и 16-членные макролиды. Из всех существующих антибиотиков, макролиды зарекомендовали себя как высокоэффективные и наиболее безопасные химиотерапевтические средства. Макролиды делятся на две группы: природные и полусинтетические.
Джозамицин Спирамицин Мидекамицин
полусинтетические
Рокситромицин Кларитромицин Телитромицин-кетолид
Азитромицин-азалид
Антимикробный эффект макролидов обусловлен нарушением синтеза белка на рибосомах микробной клетки. Макролиды обратимо связываются с различными доменами каталитического пептил-трансферазного центра 50 S -субъединицы рибосом и ингибируют процессы транслокации и транспептидации пептидов, что приводит к прекращению сборки белковой молекулы и замедляет способность микроорганизмов к делению, размножению. В зависимости от вида микроорганизма и концентрации препарата оказывают дозозависимый эффект, проявляя при этом бактериостатическое действие, в больших дозах и на некоторые штаммы микроорганизмов – бактерицидное. Антимикробный спектр действия весьма близок к группе природных пенициллинов.
Макролиды обладают липофильными свойствами, быстро всасываются в ЖКТ, создают высокие тканевые и внутриклеточные концентрации, распределяясь во многих тканях и секретах, плохо задерживаются во внеклеточных жидкостях, не проникают через ГЭБ. Их действие проявляется в основном на стадии размножения. Они высокоэффективны только в отношении активно делящихся микроорганизмов, поэтому хорошо зарекомендовали себя при лечении острого периода заболевания и малоактивны или практически не оказывают действия на вялотекущие процессы.
Обладают повышенной активностью в отношении грам «+» кокков и внутриклеточных возбудителей (хламидий, микоплазм, легионелл), подавляют развитие грамотрицательных кокков, палочки дифтерии, возбудителей бруцеллеза, амебной дизентерии. На грам «-» микроорганизмы семейства Enterobacteriaceae P . aeruginosa и грам «-» анаэробы резистентны. Псевдомонады и ацинетобактеры обладают природной устойчивостью ко всем макролидам. Резистентность микроорганизмов к этой группе препаратов связана с изменением структуры рецепторов на 50 S -субъединицах рибосом, что приводит к нарушению связывания антибиотика с рибосомами. У макролидов, линкозамидов и фениколов связывание с 50 S -субъединицей рибосом происходит на различных участках, это обусловливает отсутствие перекрестной резистентности. Особенностью антимикробного действия макролидов является бактериостатическое действие в отношении тех форм бактерий, которые устойчивы к таким широко применяемым группам, как пенициллины, стрептомицины, тетрациклины.
Макролиды применяют при инфекциях нижних дыхательных путей, включая атипичные формы, обострение хронического бронхита и внебольничную пневмонию. Их назначают при инфекциях верхних дыхательных путей (синуситах, отитах, фарингитах, тонзиллитах), инфекциях полости рта, мягких тканей, кожи, инфицированных угрях и урогенитальных инфекциях. Показаниями для их применения является профилактика и лечение микобактериоза, профилактика ревматической лихорадки, эндокардита, с целью эрадикации H . pylori (кларитромицин). Иммуномодулирующие свойства макролидов используют при панбронхонхиолите (кларитромицин, рокситромицин) и муковисцидозе (азитромицин).
Основные побочные эффекты при применении макролидов – желудочно-кишечные нарушения, риск которых не превышает 5–8%. В редких случаях развиваются аллергические реакции 2–3% (кожная сыпь, отечность лица, шеи, стоп, анафилактический шок), реже холестатический гепатит и псевдомембранозный колит. Наименьшая кратность введения макролидов, улучшенные фармакокинетические показатели не требуют коррекции доз при почечной недостаточности и хорошо переносятся больными. Большинство макролидов (особенно эритромицин и кларитромицин) являются мощными ингибиторами цитохрома Р-450 ( CYP 3 A 4, CYP3A5, CYP3A7, CYP 1 A 2), поэтому на фоне их применения нарушается биотрансформация и повышается максимальная концентрация в крови совместно применяемых лекарств. Это особенно важно учитывать при применении Варфарина, Циклоспорина, Теофиллина, Дигоксина, Карбамазепина и др., которые метаболизируются в печени. Их сочетанный прием может вызвать наиболее опасные осложнения (нарушение ритма сердца, удлинение интервала Q - T , развитие ишемии конечностей и гангрены). Не подвергаются окислению цитохромом Р-450 спирамицин и азитромицин. В организме макролиды подвергаются энтерогепатической рециркуляции, экскретируются главным образом с желчью и только 5–10% препарата выводится почками.
Эритромицин (Erytromycinum) продуцируется почвенными актиномицетами (лучистыми грибами), из культуральной жидкости которых и был выделен в 1952 г. Из желудочно-кишечного тракта всасывается хорошо. В кислой среде желудка частично разрушается, поэтому вводить эритромицин следует в таблетках, покрытых кислоторезистентным покрытием, которое растворяется только в кишечнике. Препарат легко проникает в различные ткани, в т.ч. преодолевает плацентарный барьер. В ткани мозга в обычных условиях не поступает. После однократного приема внутрь максимальная концентрация в крови достигается через 2 часа. У эритромицина биодоступность составляет 2–3 часа, поэтому для поддержания терапевтического уровня в крови его следует вводить 4 раза в сутки. Высшие дозы внутрь: разовая – 0,5 г, суточная – 2 г. Выделяется с фекалиями и, частично, с мочой. Эритромицин в таблетках наиболее широко используется для лечения пневмоний, бронхитов различной этиологии, скарлатины, ангины, гнойных отитов, дифтерии, раневых инфекций. Препарат применяют при тяжелом течении инфекционного заболевания, для лечения коклюша, дифтерии. При конъюнктивите новорожденных вводят внутривенно, разовую дозу разводят в 250 мл изотонического раствора натрия хлорида, вводят медленно в течение часа. При гастропарезах эритромицин дозозависимо вызывает стимуляцию моторики желудка, увеличивает амплитуду сокращений привратника и улучшает антрально-дуоденальную координацию. Местно применяют в виде мази и раствора для наружного применения для лечения гнойно-воспалительных заболеваний кожи, инфицированных ран, трофических язв, пролежней и ожогов II - III степени. К эритромицину быстро развивается устойчивость микроорганизмов, препарат малотоксичен и редко вызывает побочные явления. Иногда возникают диспепсические нарушения (тошнота, рвота), аллергические реакции. Значительно снижается биодоступность при приеме эритромицина во время еды или после, т.к. пища уменьшает концентрацию этого антибиотика в крови более чем в 2 раза. Выпускается в тб., покр. обол. 100 и 250 мг; мазь глазная 10 г (в 1 г 10 000 ЕД); мазь для наружного и местного применения 15 мг – 10 тыс. ЕД/г. Суппозитории для детей по 0,05 г и 0,1 г. Порошок для инъекций по 0,05, 0,1 и 0,2 г и гранулы для суспензии по 0,125 г и 0,2 г во флаконах по 5 мл.
Антибиотики – ингибиторы синтеза белка, классы.
Ингибиторы синтеза белка — многочисленная и разнообразная по химической структуре группа антибиотиков — нарушают функциональные свойства рибосом. Бактерии имеют 70 S рибосомы, а клетки млекопитающих — 80 S рибосомы. Субъединицы этих типов рибосом и их функциональная специфичность весьма различны, что и объясняет подавление синтеза белка антибиотиками на бактериальных рибосомах без, выраженного влияния на рибосомы млекопитающих. К этой группе отнесены
· Аминогликозиды(стрептомицин, гентамицин, амикацин) - показаны при резистентности микроорганизмов к другим препаратам или при необходимости быстрого достижения бактерицидного эффекта. Препараты этой группы проявляют синергизм с другими антибиотиками, в первую очередь с b-лактамными, и этот эффект часто используют при терапии инфекций, вызванных бактериями с множественной антибиотикорезистентностью, реагируют с 30 S субъединицей рибосомы бактерий, образуя необратимый комплекс с одним из рибосомальных белков. В результате блокируются функции рибосом. Спектр активности включает многие грамположительные и грамотрицательные бактерии; к аминогликозидам малочувствительны некоторые стрептококки (пиогенный и зеленящий) и пневмококки, абсолютно резистентны энтерококки, провиденции, бактероиды и прочие анаэробы.
· Тетрациклины(тетрациклин,окситетрациклин)-бактериостатические антибиотики широкого спектра действия, продуцируемые видами Streptomyces, взаимодействуют с 30 S субъединицей рибосомы, блокируя присоединение тРНК к комплексу «рибосома-мРНК» и нарушая включение новых аминокислот в полипептидную цепь. Тетрациклины активны в отношении грамположительных и грамотрицательных бактерий, а также микоплазм и внутриклеточных паразитов — риккетсий, легионелл и хламидий; имеют большое значение в качестве средств лечения холеры, бруцеллёза, туляремии и др. При наличии у бактерий специфических R-плазмид тетрациклины или вообще не проникают в бактериальные клетки, или удаляются слишком быстро.
· Хлорамфеникол(левомицетин) - Его молекула содержит ннтробензен, опосредующий токсичность препарата для клеток бактерий и млекопитающих. Хлорамфеникол взаимодействует с 50 S субъединицей рибосомы и ингибирует активность пептидилтрансферазы, ответственной за образование пептидных связей. Антибиотик может быть инактивирован хлорамфениколтрансферазой, синтез фермента контролируют гены некоторых R-плазмид. Действует на многие грамотрицательные и грамположительные бактерии, риккетсий, спирохеты и хламидий и относится к немногим химиотерапевтическим средствам, эффективным в отношении грамотрицательных анаэробов.
· Макролиды(Эритромицин,Кларитромицин) - Как правило, макролиды оказывают бактериостатическое действие, но в высоких концентрациях способны действовать бактерицидно на БГСА, пневмококк, возбудителей коклюша и дифтерии. Макролиды проявляют ПАЭ в отношении грамположительных кокков. Кроме антибактериального действия макролиды обладают иммуномодулирующей и умеренной противовоспалительной активностью. Макролиды активны в отношении грамположительных кокков, таких как S.pyogenes, S.pneumoniae, S.aureus (кроме MRSA). Макролиды являются одной из самых безопасных групп АМП.
· Азалиды(Азитромицин) - Наиболее известен азитромицин, способный депонироваться в фагоцитах и действовать на поглощённые ими бактерии, а также легко проникать в различные клетки организма. активны в отношении грамположительных и грамотрицательных микроорганизмов, хламидий, микоплазм, уреаплазм, спирохет. Обладают антибактериальным действием широкого спектра.
· Линкозамиды(Линкомицин, Клиндамицин) - Оказывают бактериостатическое действие, которое обусловлено ингибированием синтеза белка рибосомами. В высоких концентрациях в отношении высокочувствительных микроорганизмов могут проявлять бактерицидный эффект. К линкозамидам наиболее чувствительны стафилококки (кроме MRSA), стрептококки, пневмококки и неспорообразующие анаэробы - пептококк, пептострептококки, фузобактерии, бактероиды (включая большинство штаммов B.fragilis). Клиндамицин умеренно активен в отношении некоторых простейших - токсоплазм, пневмоцист, P.falciparum

Ингибиторы синтеза белка
В этой статье рассматриваются следующие антимикробные средства: 1) бактериостатические ингибиторы синтеза белка, действующие главным образом путем связывания с рибосомами, 2) препараты, подавляющие синтез неточной стенки (кроме бета-лактамных антибиотиков), 3) антимикробные средства, применяемые только по особым показаниям. К первой группе относятся тетрациклины, хлорамфеникол, макролиды, клиндамицин, стрептограмины и линезолид. Тетрациклины — антибиотики широкого спектра действия, активные в отношении грамположительных и грамотрицательных бактерий (как аэробных, так и анаэробных), риккетсий, микоплазм и хламидий. Однако за последние 10 лет терапевтическая ценность этих препаратов значительно снизилась из-за широкого распространения устойчивых штаммов. Хлорамфеникол назначают только при угрожающих жизни состояниях (например, при риккетсиозах, больным с бактериальным менингитом, которым нельзя назначить другой препарат), так как обмажет вызвать апластическую анемию. Макролиды (эритромицин, кларитромицин, азитромицин) применяют в первую очередь при пневмонии, так как они активны в отношении Streptococcus pneumoniae и возбудителей атипичной пневмонии. Кларитромицин и азитромицин используют для профилактики и лечения инфекций, вызванных атипичными микобактериями. Клиндамицин, антибиотик из группы линкозамидов, оказывает выраженное бактериостатическое действие на стрептококки, стафилококки и анаэробные микроорганизмы, включая Bacteroides fragilis. Кроме того, клиндамицин эффективен при пневмоцистозе и токсоплазмозе. Хинупристин/дальфопристин — комбинацию двух стрептограминов — применяют парентерально при инфекциях, вызванных полирезистентными грамположительными бактериями, в частности устойчивыми к ванкомицину штаммами Enterococcus faecium. Линезолид, препарат из группы оксазолидинонов, активен в отношении энтерококков, устойчивых к ванкомицину, и Staphylococcus aureus, устойчивых к метициллину. Перекрестная устойчивость для линезолида не характерна, так как он действует на более ранних этапах синтеза белка, чем другие препараты с подобным механизмом действия. Ванкомицин активен в отношении стрептококков, энтерококков, всех штаммов Staphylococcus aureus, исключая редко встречающиеся умеренно устойчивые штаммы, и почти всех штаммов коагулазотрицательных стафилококков. Это единственный гликопептидный антибиотик, разрешенный к применению в США. В Европе применяют и другой гликопептидный антибиотик, тейкопланин; его единственное преимущество перед ванкомицином — возможность в/м введения. Бацитрацин действует на аэробные грамположительные бактерии. Бацитрацин используют только местно, поскольку при системном применении он нефротоксичен. Спектиномицин. представитель аминоциклитолов, назначают только больным с гонококковой инфекцией, которым противопоказаны препараты первого ряда. Полимиксин В активен в отношении аэробных грамотрицательных палочек, включая Pseudomonas aeruginosa. Из-за высокой нефротоксичности при системном введении препарат выпускают только в виде мазей и растворов для промывания. Настоящая глава посвящена фармакологическим свойствам и клиническому применению перечисленных выше препаратов.
Спектиномицин — антибиотик, продуцируемый Streptomyces spectabilis. По структуре препарат представляет собой аминоциклитол. Структурная формула спектиномицина следующая:
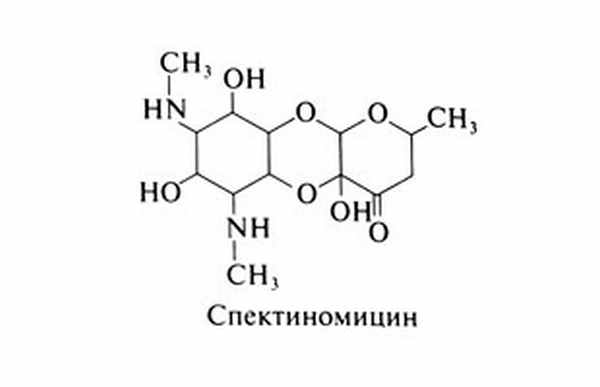
Спектиномицин действует на ряд грамотрицательных бактерий, но уступает в этом отношении другим препаратам, к которым эти микроорганизмы чувствительны (Schoutens et al., 1972). Спектиномицин применяют при гонорее, вызванной устойчивыми к препаратам первого ряда штаммами, а также при наличии противопоказаний к этим препаратам. Устойчивость к спектиномицину встречается редко (Clendennen et al., 1992).
Спектиномицин избирательно подавляет синтез белка у грамотрицательных бактерий. Препарат связывается с 30S-субъединицей рибосом и действует подобно аминогликозидам, но, в отличие от них, не оказывает бактерицидного действия и не нарушает считывание мРНК. Устойчивость к спектиномицину обусловлена изменением мишени препарата вследствие мутации или его инактивацией бактериальным ферментом (Clarket I al., 1999).
Спектиномицин быстро всасывается при в/м введении. После введения в дозе 2 г максимальная сывороточная концентрация достигается через 1 ч и составляет 100 мкг/мл. Через 8 ч после инъекции она снижается примерно до 15 мкг/мл. Спектиномицин почти не связывается с белками плазмы и полностью выводится с мочой в течение 48 ч.
Согласно рекомендациям Центра по контролю заболеваемости, для лечения неосложненной гонококковой инфекции применяют цефтриаксон, цефиксим, ципрофлоксацин или офлоксацин. Спектиномицин назначают в случае непереносимости бета-лактамных антибиотиков и фторхинолонов или аллергии к этим препаратам. Спектиномицин назначают также беременным, которые плохо переносят β-лактамные антибиотики, так как фторхинолоны при беременности противопоказаны. Препарат вводят в дозе 2 г глубоко в/м однократно. Один из недостатков спектиномицина состоит в том, что он не действует на возбудителей сифилиса и хламидиоза. Кроме того, этот препарат малоэффективен при гонококковом фарингите, поэтому излечение должно быть подтверждено посевом.
Однократное в/м введение спектиномицина редко сопровождается побочными эффектами (Duncan et al., 1972). Возможны крапивница, озноб, лихорадка, тошнота, головокружение и бессонница. Инъекции бывают болезненными.
При парентеральном введении эти препараты очень нефротоксичны, поэтому в настоящее время их обычно назначают местно.
Полимиксины — близкие по строению антибиотики, вырабатываемые некоторыми штаммами аэробной спорообразующей палочки Bacillus polymyxa, обнаруженной в почве. Они были открыты в 1947 г. Колистин (полимиксин Е) продуцируется Paenibacillus polymyxa (Bacillus nolymyxa)— микроорганизмом, который был выделен из пробы почвы, взятой в префектуре Фукусима (Япония). Полимиксины представляют собой основные полипептиды с молекулярной массой около 1000. Полимиксин В (смесь полимиксинов В1 и В2) имеет следующую структурную формулу:

Колистин (полимиксин Е) по строению сходен с полимиксином В. Колистин выпускают не только для местного применения, но и для приема внутрь (колистина сульфат) и парентерального введения (колистина мезилат).
Полимиксин В и колистин активны в отношении грамотрицательных бактерий, включая Enterobacter spp., Esherichia coli, Klebsiella spp., Salmonella spp., Pasteurella spp., Bordetella spp. и Shigella spp., в концентрации 0,05—2 мкг/мл. In vitro рост большинства штаммов Pseudomonas aeruginosa подавляется при концентрации менее 8 мкг/мл.
Полимиксины представляют собой амфифильные (содержат и гидрофильные, и гидрофобные группы) катионные поверхностно-активные соединения. Взаимодействуя с фосфолипидами, полимиксины нарушают структуру бактериальных мембран и повышают их проницаемость. Изменение проницаемости мембраны происходит сразу после контакта бактериальной клетки с препаратом. Чувствительность к полимиксину В, видимо, определяется содержанием фосфолипидов в клеточной стенке бактерий (Brown and Wood, 1972). У некоторых устойчивых к полимиксину В микроорганизмов клеточная стенка защищает цитоплазматическую мембрану от действия препарата.
Полимиксин В связывается с липидом А (компонент эндотоксина, представляющего собой липополисахарид наружной мембраны грамотрицательных бактерий) и инактивирует его. Поданным экспериментальных исследований, препарат ослабляет выраженность патофизиологических изменений, вызванных высвобождением эндотоксина (Shenep et al., 1984; Tauber et al., 1987), хотя клиническое значение этого пока не установлено.
Ни полимиксин В, ни колистин не всасываются при приеме внутрь. Кроме того, они плохо всасываются со слизистых и с поверхности обширных ожогов.
Полимиксина В сульфат используют местно (в том числе при болезнях глаз и уха), комбинируя его с другими препаратами для местного применения. Парентеральное введение не рекомендуется, хотя соответствующие лекарственные формы до сих пор выпускаются.
При инфекциях кожи, слизистых, глаз и уха, вызванных чувствительными к полимиксину В микроорганизмами, препарат применяют в виде раствора или мази. Полимиксин В эффективен при наружном отите, возбудителем которого чаще всего бывают Pseudomonas spp. Язвы роговицы, вызванные Pseudomonas aeruginosa, обычно излечиваются при местном нанесении препарата или инъекциях под конъюнктиву.
При нанесении на кожу и слизистые, даже поврежденные, полимиксин В почти не всасывается и потому не вызывает системных побочных эффектов. Аллергические реакции при местном применении редки. Побочные эффекты, возникающие после парентерального введения полимиксина В и колистина.
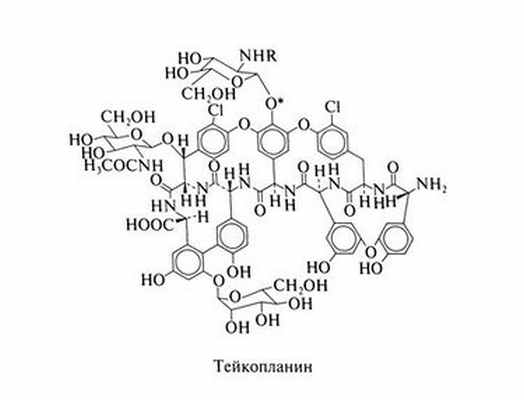
Тейкопланин, как и ванкомицин, нарушает синтез клеточной стенки и активен только в отношении грамположительных бактерий. На чувствительные микроорганизмы он оказывает бактерицидное действие (на энтерококков — бакгериостатическое). Тейкопланин активен в отношении чувствительных и устойчивых к метициллину стафилококков (МПКдля них обычно ниже 4 мкг/мл; Wiedemann and Atkinson, 1991). Для Listeria monocytogenes, Corynebacterium spp., Clostridium spp. и анаэробных грамположительных кокков МПК колеблется от 0,25 до 2 мкг/мл. Рост стрептококков (в том числе зеленящих и Streptococcus pneumoniae) и энтерококков подавляется при концентрации 0,01—1 мкг/мл. Некоторые штаммы стафилококков (в том числе Staphylococcus aureus), энтерококков и других бактерий, обладающих природной устойчивостью к ванкомицину (Lactobacillus spp. и Leuconos-toc spp.), устойчивы и к тейкопланину.
Механизмы устойчивости стафилококков к тейкопланину не изучены. Чувствительный штамм может приобрести устойчивость в процессе лечения (Kaatz et al., 1990). Энтерококки с фенотипом Van А устойчивы и к ванкомицину, и к тейкопланину. Механизм устойчивости тот же, что и для ванкомицина: изменение мишени (клеточной стенки), препятствующее связыванию антибиотика. Штаммы энтерококков с фенотипом Van В часто чувствительны к тейкопланину, так как последний лишь слабо индуцирует ферменты, изменяющие строение клеточной стенки. Штаммы энтерококков с фенотипом Van С, обычно не патогенные для человека, чувствительны к тейкопланину (Arthur and Courvalin, 1993).
По сравнению с ванкомицином тейкопланин в большей степени связывается с белками плазмы (на 90—95%) и гораздо медленнее элиминируется (Ту2 до 100 ч при нормальной функции почек). Кроме того, тейкопланин можно вводить в/м. Взрослым его назначают в дозе 6—30 мг/кг/сут (более высокие дозы используют только при тяжелых стафилококковых инфекциях). Благодаря медленной элиминации в большинстве случаев препарат можно вводить 1 раз в сутки. При почечной недостаточности дозу тейкопланина, как и дозу ванкомицина, уменьшают. Больным с нефункционирующими почками (находящимся на диализе) тейкопланин можно вводить I раз в неделю. При этом необходимо следить, чтобы сывороточная концентрация препарата находилась в пределах терапевтического диапазона (в частности, минимальная концентрация должна составлять 15—20 мкг/мл).
Тейкопланин применяют при многих инфекциях, включая остеомиелит и эндокардит, вызванные стафилококками (метициллиноустойчивыми и метициллиночувствительными), стрептококками и энтерококками (Bibleret al., 1987; Glup-czynski et al., 1986). По эффективности тейкопланин сравним с ванкомицином. Однако при тяжелых инфекциях лечение низкими дозами безуспешно (Calain etal., 1987). При сепсисе и эндокардите, вызванных метициллиночувствительными штаммами Staphylococcus aureus, тейкопланин уступает пенициллинам, активным в отношении стафилококков (частота излечения составляет соответственно 60—70 и 85—90%). Чтобы добиться усиления антимикробной активности в отношении Staphylococcus aureus, тейкопланин комбинируют с аминогликозидами (например, гентамицином), поскольку с ними препарат действует синергично. При нормальной функции почек гентамицин назначают в дозе 1 мг/кг каждые 8 ч. К тейкопланину чувствительны все стрептококки. Назначение препарата 1 раз в сутки достаточно для излечения стрептококкового остеомиелита и эндокардита (Leport et al., 1989). Тейкопланин — один из самых активных препаратов в отношении энтерококков. Опыт его применения пока невелик, но тем не менее позволяет заключить, что тейкопланин эффективен при тяжелых энтерококковых инфекциях (например, эндокардите). Для достижения бактерицидного эффекта препарат комбинируют с гентамицином.
Основной побочный эффект тейкопланина — сыпь. Чаше всего она возникает при использовании больших доз. Возможны также аллергические реакции, лихорадка и нейтропения. Изредка возникает ототоксический эффект.
Бацитрацин — антибиотик, вырабатываемый Bacillus subtilis, штаммом Tracy-1. Этот штамм был выделен в 1943 г. из материала (смесь уличной грязи и поврежденных тканей), полученного при хирургической обработке открытого перелома удевочки по фамилии Трейси. И выделенный штамм, и сам антибиотик (bacitracin) названы в ее честь. История открытия, свойства и применение бацитрацина были описаны в 1949 г. Мелени и Джонсоном (Meleney and Johnson, 1949). Химические свойства. Бацитрацины — это группа полипептидных антибиотиков. В состав выпускаемых в настоящее время препаратов входят несколько соединений. Основной компонент — бацитрацин А Одна единица бацитрацина эквивалентна 26 мкг. Предполагаемая структурная формула бацитрацина А следующая:
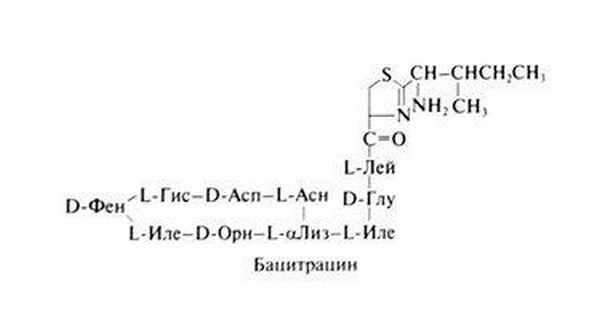
В концентрации 1 ед/мл бацитрацин действует на ряд грамположительных кокков и палочек, Neisseria spp., Haemophilus influenzae и Treponema pallidum. Рост Actinomyces spp. и Fusobacterium spp. подавляется при концентрации препарата 0,5—5 ед/мл. Энтеробакге-рии, Pseudomonas spp., Candida spp. и Nocardia spp. устойчивы к нему. Бацитрацин угнетает синтез клеточной стенки бактерий.
Раньше бацитрацин назначали парентерально. Хотя лекарственные формы для парентерального введения выпускают до сих пор, в настоящее время препарат применяют преимущественно местно. Существуют мази с бацитрацином (в том числе глазная), а также порошок, из которого готовят раствор для местного применения. Мазь наносят непосредственно на пораженные участки не реже 1 раза в сутки. Выпускают также комбинированные препараты для местного применения, содержащие помимо бацитрацина неомицин, полимиксин В и гидрокортизон.
При фурункулезе, пиодермии, карбункуле, импетиго и абсцессах эффективность местного применения бацитрацина (самого по себе или в сочетании с другими антимикробными средствами) не доказана. Если инфицированная поверхность открытая (например, при язвах, вторичных инфекциях на фоне зудящих дерматитов), бацитрацин уничтожает чувствительные к нему микроорганизмы. Даже в виде мази он редко вызывает аллергические реакции, что выгодно отличает его от других антимикробных средств для местного применения. Местное применение бацитрацина эффективно при гнойном конъюнктивите и инфицированных язвах роговицы (если возбудителями служат чувствительные к препарату бактерии). При носительстве стафилококков в носоглотке препарат малоэффективен. Есть сведения об успешном применении бацитрацина внутрь при псевдомембранозном колите (Dudley et al., 1986).
При парентеральном введении бацитрацин оказывает выраженное нефротоксическое действие. При местном применении изредка возникают аллергические реакции.
Читайте также:
