Бесплодие при гиперпролактинемии, иммуннитете к сперме и микоплазмах
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Представлены данные комплексного клинико-лабораторного обследования 578 бесплодных мужчин с антиспермальными антителами (АСАТ), 550 пациентов без АСАТ и 37 фертильных мужчин. Показано, что наиболее часто встречающимися этиологическими факторами образования АСАТ являются инфекции репродуктивного тракта (ИРТ), такие как Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis - 57% случаев, варикоцеле - 31%, субклиническая механическая травма мошонки - 14%, перенесенный орхит - 6%, эпидидимит - 1,5%, отсутствие одного из vas deferens - 1%, подтвержденная непроходимость - 1%. При этом риск появления АСАТ составляет после субклинических травм яичек - 71%, орхита - 67%, эпидидимита - 50%, варикоцеле оперированного - 46% и клинически диагностируемого - 42%, ИРТ - 32%. Аутоиммунные реакции на фоне ИРТ зависят от вида микроорганизма: преобладают перекрестные реакции (Mycoplasma hominis) или повреждение гемато-тестикулярного барьера (Chlamydia trachomatis).
Введение
Сегодня одна из 5-7 пар репродуктивного возраста во всем мире страдает бесплодием, и в половине случаев причиной этого является нарушение качества спермы у мужчины [1]. В 7 - 40% (по нашим данным в 18%) причиной нарушения мужской репродуктивной функции являются антиспермальные антитела (АСАТ) 8. В то же время многие вопросы, связанные с мужским иммунологическим бесплодием, в т.ч. этиопатогенез данного заболевания, до сих пор не ясны. Более десятка факторов, по данным литературы [3,5-7,10-15], могут являться причиной образования АСАТ: 1) травма яичек с и без орхита; 2) вазэктомия с или без вазовазостомии; 3) врожденная обструкция семявыносящих путей; 4) инфекции репродуктивного тракта; 5) травма спинного мозга, приводящая к анэякуляции; 6) пассивный гомосексуализм; 7) психогенная анэякуляция; 8) варикоцеле; 9) крипторхизм; 10) перекрут яичка; 11) рак яичка. Но частота выявления каждого из них у пациентов с АСАТ в разных работах сильно различаются. Кроме того, нередко антитела можно обнаружить и при отсутствии в анамнезе перечисленных повреждающих воздействий, и, наоборот, отсутствие АСАТ при их наличии. Это предполагает существование неких факторов, способствующих развитию антиспермального иммунитета, или, наоборот, предотвращающих этот процесс.
Предполагают, что существует наследственная предрасположенность к формированию данной аутоиммунной патологии, связанная с HLA-системой [10,16-19]. Однако, конкретные механизмы развития антиспермального иммунитета не известны.
Настоящее исследование выполнено с целью получить новые данные, раскрывающие этиопатогенез данного заболевания.
Материал и методы исследования
Было проведено комплексное клинико-лабораторное обследование 367 пациентов с АСАТ и ретроспективный анализ историй болезни 211 пациентов (всего 578 человек), возраст которых колебался от 18 до 59 лет и в среднем составил 32,2.0,34 года. Группу сравнения составили: 1) 550 субфертильных мужчин без АСАТ, 2) 37 фертильных мужчин, жены которых наблюдались по поводу беременности 4-12 недель или спонтанных абортов.
У всех пациентов выполняли комплексный анализ эякулята в соответствии с критериями ВОЗ [1]. Методом MAR (mixed agglutination reaction) [20] вычисляли долю подвижных сперматозоидов, покрытых антителами IgG и IgA (MAR%), иммуноферментным методом (ИФА) - концентрацию АСАТ в сыворотке крови [21], методом проточной цитофлуорометрии (ПЦМ) - процент сперматозоидов, покрытых антителами классов IgG, IgA, IgM и их количество на один сперматозоид [22].
Диагностику инфекций репродуктивного тракта (ИРТ) осуществляли по наличию специфической ДНК методом полимеразной цепной реакции (ПЦР), микрометодом ИФА, для условно-патогенных микроорганизмов - посевом на питательные среды.
Полученные данные обрабатывали методами вариационной статистики с использованием t критерия Стьюдента и F критерия Фишера для независимых и парных значений и Xi-квадрат, вычисляли коэффициент корреляции r.
Результаты исследования
Таблица 1. Продолжительность бесплодного брака и отсутствие эффекта предшествовавшей терапии при различных значениях MAR%IgG у бесплодных мужчин по сравнению с фертильными, % и M.m
| Факторы (%) | Ферт. (n=37) | Инферт. без АСАТ (n=550) | Инферт. с АСАТ (n=376) |
|---|---|---|---|
| Паротит | 5 | 7 | 8 |
| Травмы яичек без орхита | 0 | 4 | 15*** |
| Орхит | 0 | 3 | 6* |
| Эпидидимит | 0 | 1 | 2 |
| Инфекции репродуктивного тракта | 19 | 22 | 41* |
| Варикоцеле оперированное | 5 | 5 | 9* |
| Крипторхизм | 0 | 1 | 0 |
Таблица 2. Особенности анамнеза пациентов с иммунологическим фактором бесплодия, %
Анамнез пациентов с АСАТ по сравнению с фертильными мужчинами и бесплодными без антител имеет особенности: чаще имел место орхит и травмы мошонки с болевым синдромом без орхита, им выполнялись оперативные вмешательства по поводу варикоцеле, осуществлялось лечение различных ИРТ, в т.ч. гонореи, хламидиоза, уреаплазмоза (табл.2). Имеются различия в частоте данных заболеваний в прошлом в зависимости от процента АСАТ-позитивных сперматозоидов (рис.1): более часто травмы и лигирование вен семенного канатика имели место в группе больных с высоким процентом АСАТ-позитивных сперматозоидов, ИРТ - с умеренно выраженным аутоиммунным процессом, орхит - примерно с равной вероятностью во всех группах. Для травм яичек, орхита и операций по поводу варикоцеле это подтверждают результаты корреляционного анализа для всей выборки бесплодных мужчин (r=+0,13, +0,06 и +0,06 соответственно, Pr<0,05-0,01).
Рис. 1. Факторы риска развития антиспермального иммунитета, %.
Частота перенесенного паротита, изолированного эпидидимита, крипторхизма в группах фертильных и бесплодных мужчин с и без АСАТ существенно не отличалась. Также отсутствуют значимые различия в частоте выявления другой сопутствующей андрологической патологии - пальпируемого варикоцеле, отсутствия vas deferens, анэякуляции, сексуальных дисгармоний; существенно реже встречалась лишь эндокринная патология в виде гипер- и гипофункции гипофиза, гипоандрогении и/или гиперпролактинемии (табл. 2 и 3).
| Андрологическая патология (%) | Ферт. (n=37) | Бесплодные без АСАТ (n=550) | Бесплод. с АСАТ (n=376) |
|---|---|---|---|
| Инфекции репродуктивного тракта | 62 | 43 | 48 |
| Варикоцеле | 14 | 25 | 26 |
| Обструкция семявыносящих путей | 0 | 2 | 3 |
| Эндокринные нарушения | 0 | 8 | 4*** |
| Анэякуляция | 0 | менее 1 | 0 |
| Крипторхизм | 0 | менее 1 | 0 |
Таблица 3. Частота и структура сопутствующей андрологической патологии у бесплодных мужчин с АСАТ, %
*** - различия статистически достоверны с PХИ
Хотя на фоне обструкции семявыносящих путей практически всегда наблюдались АСАТ, различия в числе случаев экскреторного бесплодия, диагноз которого ставился при нормогонадотропной азооспермии, отсутствии vas deferens и/или подтвержденной интраоперационно непроходимости в группах с АСАТ и без антител не были достоверны.
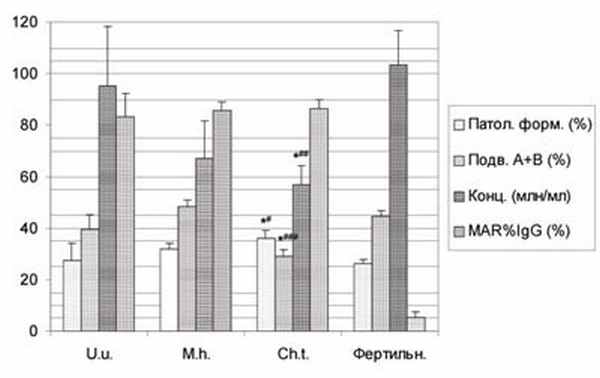
Рис. 2. Особенности количественных показателей спермограммы у мужчин с иммунологическим бесплодием (MAR%IgG>50%), ассоциированным с хламидиозом, уреаплазмозом и микоплазмозом.
* - различия между группой с хламидиозом и группой с уреаплазмозом досто-верны с P
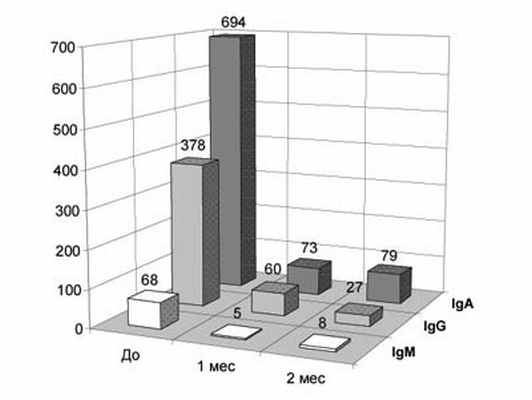
Рис. 3. Количество АСАТ различных классов на сперматозоидах у бесплодных мужчин, инфицированных Mycoplasma hominis, в различные сроки после исчезновения возбудителя в результате антибиотикотерапии, Ед.
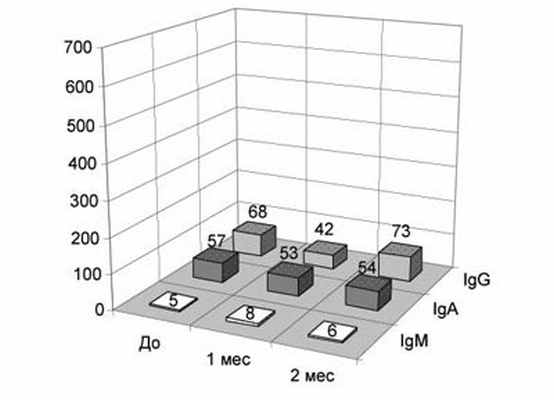
Рис. 4. Количество АСАТ различных классов на сперматозоидах у бесплодных мужчин, инфицированных Chlamydia trachomatis, в различные сроки после исчезновения возбудителя в результате антибиотикотерапии, Ед.
Одной из наиболее частых находок у больных с АСАТ являются различные ИРТ: ВПГ (33%), Chlamydia trachomatis (29%), Ureaplasma urealyticum (29%), Mycoplasma hominis (13%) изолированно или в сочетаниях. При этом наиболее выраженные нарушения качества спермы наблюдаются на фоне хламидиоза (рис.2). Однако частота обнаружения данных инфекций в группе пациентов с АСАТ статистически не отличается от таковой у бесплодных без антител и фертильных мужчин. Отсутствие значимой зависимости между величиной MAR% и ПЦМ% для IgG и IgA и присутствием данных ИРТ подтвердил корреляционный анализ (Pr>0,05). Но процент IgM-позитивных сперматозоидов оказался связанным положительной зависимостью с наличием Mycoplasma hominis (r=+0,36, Pr<0,05). Так же имелась существенная положительная связь между наличием микоплазм и количеством АСАТ на сперматозоидах: для IgG r=+0,49 (Pr<0,05), для IgA r=+0,47 (Pr<0,05), для IgM r=+0,61 (Pr<0,01). По сравнению с присутствием Chlamydia trachomatis плотность АСАТ на фоне Mycoplasma hominis для класса IgG составляет 1020%, для IgA - 663%, для IgM - 1360% (рис.3,4). После излечения микоплазмоза плотность АСАТ уменьшается в 9-14 раз (рис.3), в то время, как излечение хламидиоза практически не влияет на количество АСАТ на сперматозоидах (рис. 4) и не сопровождается значимым улучшением качества спермы (рис.5).
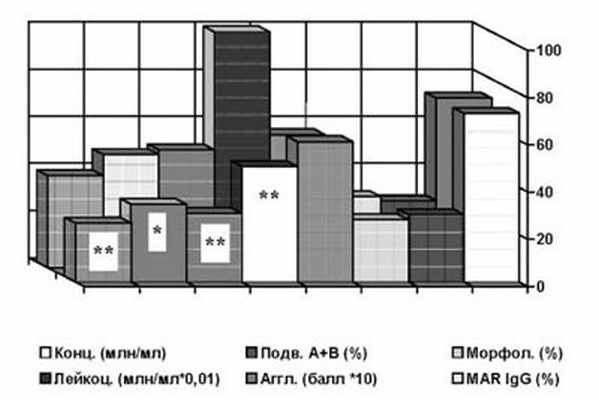
Рис. 5. Параметры эякулята у мужчин с иммунологическим фактором бесплодия после лечения хламидиоза.
При осмотре обращало на себя внимание более часто встречающееся увеличение яичек и/или придатков (в одном из участков или общее), их повышенная чувствительность при пальпации. У части больных, наоборот, пальпируемый размер придатков был меньше нормы. С ростом процента АСАТ-позитивных сперматозоидов вероятность обнаружения данной патологии возрастала (табл. 4).
| Органы | Фертильн. мужчины (n=34) | Бесплодные без АСАТ (n=550) | MAR IgG меньше 50% (n=263) | MAR IgG >=50% (n=217) |
|---|---|---|---|---|
| Яички | Умен.(6%) | Умен. (20%)* | Умен.(16%)* | Умен.(10%) |
| Увел.(0%) | Увел. (4%) | Увел.(4%) | Увел.(9%)* | |
| Придатки | Умен.(10%) | Умен.(18%) | Умен.(14%) | Умен.(32%)* |
| Увел.(17%) | Увел. (20%) | Увел.(24%) | Увел.(29%)* | |
| V.D. | Отс.(0%) | Отсут. (1%) | Отсут.(1,5%) | Отсут.(2%) |
| Варикоцеле | Увел.(13/0%) | Увел. (26/4%) | Увел.(21/4%) | Увел.(27/4%) |
| Простата | Увел.(14%) | Увел. (26%) | Увел. (33%) | Увел.(28%) |
| Умен.(14%) | Умен. (27%) | Умен.(13%) | Умен.(16%) |
Таблица 4. Физикальные особенности пациентов с АСАТ, без антител и фертильных мужчин, %
* - различия с группой фертильных мужчин статистически достоверны с PХИ
Рис. 6. Концентрация ПСА в периферической крови у бесплодных мужчин репродуктивного возраста с АСАТ и без антител, пМ/л.
Суммируя клинико-анамнестические данные, можно отметить, что наиболее часто устанавливаемыми факторами риска образования АСАТ являются ИРТ, затем варикоцеле, травмы яичек с и без орхита, крипторхизм (рис.7). Однако с наибольшей вероятностью к образованию АСАТ приводят травмы яичек, как сопровождающиеся, так и не сопровождающиеся орхитом, эпидидимит, варикоцеле, особенно оперированное, ИРТ (рис.8). Врожденная обструкция или аплазия семявыносящих путей в виде отсутствия одного из vas deferens наблюдались в единичных случаях, однако, нельзя исключить, что уменьшение размеров придатков хотя бы с одной из сторон является следствием непроходимости rete testis в результате недоразвития.
Рис. 7. Клинико-анамнестические особенности больных с иммунологическим бесплодием, %.
Травма спинного мозга, приводящая к анэякуляции, пассивный гомосексуализм, психогенная анэякуляция, перекрут и рак яичка в исследованной популяции не встречались.
Данные показывают, что присутствие АСАТ в сперме приводит к снижению вероятности наступления беременности у партнерши по сравнению фертильными мужчинами, что подтверждает роль антиспермального иммунитета в развитии мужской субфертильности. По сравнению с бесплодными без АСАТ различия становятся статистически значимыми когда все сперматозоиды покрыты антителами (MAR%IgG=100%).
В целом, выявленные закономерности согласуются с известными клиническими данными о воздействиях, провоцирующих образование АСАТ [3,5-7,11,12,14,15]. Однако, в отличие от многих авторов, мы не обнаружили доминирования эпидидимита и обструкции, как основных провоцирующих факторов, хотя частичное или полное увеличение размеров одного из придатков у 29% больных с высоким MAR%IgG может свидетельствовать об односторонней непроходимости. По мнению D.M. de Kretser et al. [23] дистальная обструкция чаще связана с образованием АСАТ. По нашим данным, с наибольшей вероятностью к развитию антиспермального иммунитета приводят орхит, травмы яичек даже без орхита и варикоцеле, причем легирование вен в прошлом имеет прогностически большее значение, чем впервые диагностированное при обследовании. Вероятно, это обусловлено ранним проявлением и большей выраженностью нарушения гемодинамики в лозовидном сплетении, что и потребовало оперативного лечения. Нельзя исключить и влияние самой операции, как провоцирующего воздействия, аналогично тому, как это нередко наблюдается после vasovasostomy [5,24]. Поэтому, представляется важным в дальнейшем специально исследовать преимущества и недостатки различных способов легирования или эмболизации расширенных вен у пациентов с иммунологическим фактором бесплодия.
Отсутствие адекватных и безопасных методов оценки проходимости rete testis не позволило сделать однозначного заключения о том, является ли одностороннее уменьшение размеров придатка у трети пациентов с АСАТ следствием непроходимости rete testis на данной стороне, и таким образом показателем односторонней обтурации, что также требует дальнейшего изучения.
В то же время, роль механических, инфекционных, термических и других повреждений яичка в этиопатогенезе антиспермального иммунитета представляется бесспорной. Нарушение целостности структурных компонентов ГТБ, в результате чего открывается доступ иммунокомпетентных клеток к аутоантигенам развивающихся сперматогенных клеток, сенсибилизация, выработка АСАТ и перенос аутоиммунного процесса на контрлатеральный орган представляется в настоящее время универсальным механизмом развития антиспермального иммунитета 28. Это подтверждают наши собственные экспериментальные исследования с использованием модели частичной резекции яичек у крыс-самцов, и установление возможности сохранения функции органа с использованием стимуляторов регенерации 30.
Одним из факторов, приводящих к повреждению ГТБ, могут быть и различные инфекции [33]. Наши результаты согласуются с данными исследований D.A.Gubin et al. [15], в которых было показано, что между предшествовавшими сексуально-передаваемыми инфекциями и наличием АСАТ существует достоверная корреляция, и наличие в анамнезе инфекций в 3,8 раза увеличивает риск развития бесплодия. Анализ 776 образцов спермы позволил А. Hinting et al. [6] считать инфекции дополнительных половых желез, наряду с односторонней непроходимостью, главными причинами образования АСАТ. Около 60% случаев наличия АСАТ объясняют Д.А.Бондарев и соавт. [11] наличием различных бактериальных и вирусных ИРТ.
Другим возможным механизмом образования АСАТ на фоне воспалительного процесса является способность многих бактерий, вирусов и грибов прикрепляться к мембране сперматозоидов. Известно, что Mycoplasma genitalium и Ureaplasma urealyticum, прикрепившиеся к головке и средней части сперматозоидов, негативно влияют ни их подвижность [34] и оплодотворение яйцеклетки in vitro [35]. Мы разделяем мнение S.Mazumdar и A.S.Levine [36], что эти «частички» в дальнейшем могут служить как антигены или гаптены, запуская аутоиммунные реакции. Об этом свидетельствуют в частности наши данные о том, что излечение микоплазмоза приводит к резкому снижению (4-12 раз) количества АСАТ на сперматозоидах, и данные о наличии перекрестных реакций между антигенами сперматозоидов и Mycoplasma hominis in vitro [37]. Учитывая, что присутствие Chlamydia trachomatis сопровождается выраженным ухудшением количественных показателей спермограммы, что сохраняется после излечения от инфекций, обосновано предположить, что хламидиоз, наоборот, приводит к инфекционно-опосредованному повреждению ГТБ.
В то же время, АСАТ появляются только у 1/3 мужчин с ИРТ. Очевидно имеются дополнительные факторы, определяющие развитие аутоиммунного процесса на фоне ИРТ и действии других неблагоприятных факторов. Это требует учета комплекса иммунологических и эндокринных реакций, что представлено ниже (часть 2).
В целом, полученные данные и анализ научных публикаций позволяют сделать вывод, что основными этиопатогенетическими факторами развития мужского иммунологического бесплодия являются:
Бесплодие при гиперпролактинемии, иммуннитете к сперме и микоплазмах
Бесплодие при гиперпролактинемии, иммуннитете к сперме и микоплазмах
При обнаружении у женщин, страдающих бесплодием, гиперпролактинемии (пролактин выше 30 нг/мл) необходимо исключить опухоль гипофиза с помощью томографии, исследования глазного дна и цветных полей зрения. Гиперпролактинемия наблюдается, по данным литературы, у 13,5—22% больных с аменореей [Bohnet, Jacobs]. В то же время некоторые авторы [Fratz, Tolis] указывают, что концентрацию пролактина выше 15 и 20 нг/мл также следует рассматривать как повышенную и назначать лечение бромэргокриптином.
Нередко гиперпролактинемия и аменорея появляются после гормональной контрацепции. Так, Grant на основании сравнительного изучения частоты ановуляции у женщин, не принимающих пилюли (4%) и принимавших их (9%), пришел к выводу, что гормональную контрацепцию следует рассматривать как одну из причин бесплодия. Для выявления эндогенного уровня эстрогенов у женщин, страдающих бесплодием, следует проводить прогестероновую пробу (примолютнор по 10 мг в течение 8 дней).
Положительный результат ее в таких случаях указывает на умеренную эстрогенную недостаточность. Отрицательная прогестероновая проба свидетельствует о низком содержании эндогенных эстрогенов и необходимости лечения пергоналом. Эстроген-прогестероновую пробу следует ставить для исключения маточного фактора бесплодия, который наблюдается, согласно данным Cooke, в 8,5% случаев.
При невыясненных причинах бесплодия его принято объяснять иммунологическими факторами или микоплазмами [Milne]. На возможность иммунологических факторов бесплодия указывали Behrman и Brambell на основании обнаружения у женщин с бесплодием специфических антител к антигенам спермы мужа. Установлено, что в сыворотке крови женщин, страдающих бесплодием, спермоагглютинины обнаруживаются в большем проценте случаев, чем у фертильных женщин [Волкова Л. С.].

Behrman показал, что АВО-несовместимость между мужем и женой в бесплодных браках отмечается в 87,3%, а в фертильных семьях— только в 38,6%, т. е. в 2 раза реже. При этом особенно часто возникает бесплодие, если у жены группа крови О (I), а у мужа — (АВ) IV [Волкова Л. С, Behrman].
При диагностике вторичного бесплодия следует производить иммуногснотипический анализ групп и типов крови супругов по эритроцитарным и лейкоцитарным антигенам [Волкова Л. С., Hiraizume, Jeffcoate]. На роль микоплазм как причины бесплодия указывают Gnarpe и Fribcrg, Mattnews и соавт., Ноrnе и соавт..
В литературе также имеются данные о частом сочетании таких заболеваний, как туберкулез гениталий и эндометриоз, с бесплодием, что клинически, как правило, не проявляется и устанавливается на основании данных гистеросальпингографии или лапароскопии. У 29% женщин, страдающих бесплодием, эндометриоз был диагностирован при эндоскопии [Kelly, Rock, Cohen].
Следует отметить, что в настоящее время значительно усовершенствованы методы диагностики бесплодия благодаря внедрению в клиническую практику гидротубации под контролем лапароскопии, выявления больных с гиперпролактинемией и проведения функциональных проб с прогестероном, эстрогенами и прогестероном, синтетическими прогестинами, кломифеном, гонадотропинами и рилизинг-гормонами, что позволяет дифференцированно определить оптимальный метод лечения.
Мужское бесплодие

Мужское бесплодие не является самостоятельным заболеванием, хотя по международной классификации болезней (МКБ 10) выделено в самостоятельную нозологическую единицу. Это всегда лишь симптом, иногда первое проявление, заболеваний внутренних органов и систем мужского организма, являясь, в определенном смысле, надводной частью айсберга, основание которого скрыто под толщей воды. Все известные патологические процессы, развивающиеся в органах репродуктивной системы мужчины – опухоли, воспаления, дистрофии, травмы, врожденные аномалии – могут нарушать способность мужчины к воспроизводству потомства. При этом, если еще 15-20 лет назад основными причинами мужского бесплодия были врожденные патологии и дистрофические процессы в яичках, обусловленные нарушениями гормонального фона или сосудистыми расстройствами, то в последние годы на первый план выдвинулись воспалительные заболевания предстательной железы, семенных пузырьков и органов мошонки, обусловленные качественными изменениями сексуальных отношений в обществе, ранним началом половых отношений, количественным ростом инфекций, передаваемых половым путем (ИППП) и их осложнений. Большое значение в развитии мужского бесплодия в последние годы приобрели дополнительные агрессивные факторы и их сочетания - стрессовые состояния, невротические нарушения, хронические интоксикации, обусловленные курением, алкоголем, наркотиками, приемом различных лекарственных средств, с последующей прогрессирующей полинейропатией и тестостеронодефицитными состояниями за счет нарушения функции печени.
Этиология и патогенез мужского бесплодия. Любая форма мужского бесплодия обусловлена неспособностью проникновения сперматозоида в зрелую женскую яйцеклетку. Сперматозоиды образуются в яичках, затем попадают в придатки яичек, где созревают, и по семенному протоку, при половом контакте, примешиваются к семенной плазме, продуцируемой придаточными железами – предстательной железой и семенными пузырьками, образуя сперму, которая по мочеиспускательному каналу попадает в женские половые пути. Так как основными этапами мужской репродукции являются выработка сперматозоидов с последующим транспортом к женской яйцеклетке, все формы мужского бесплодия сводятся к двум основным группам: 1) Секреторное бесплодие, при котором отсутствует или нарушена функция продукции сперматозоидов яичками, 2) Экскреторное бесплодие, при котором нарушен транспорт выработанных яичками спермиев по семявыносящим путям. Примерно в 35-40% случаев мужское бесплодие имеет смешанный, или сочетанный характер, когда нарушение выработки сперматозоидов яичками сочетается с патологией семявыносящих путей.
Секреторное бесплодие формируется двумя основными причинами или их сочетанием. Во-первых, это – патологии собственно яичек, обусловленные врожденными или приобретенными факторами. К этой группе относятся все врожденные аномалии отсутствия или недоразвития яичек, крипторхизм, монорхизм, а также приобретенные заболевания – орхиты, включая обусловленные эпидемическим паротитом, поствоспалительные, посттравматические, послеоперационные, постлучевые дистрофические и атрофические процессы в яичках, опухоли и аутоиммунные процессы вследствие нарушения тестикулярного гистогематического барьера. Во-вторых, секреторное бесплодие образуется как результат локально-сосудистых патологий, нарушающих кровообращения в яичках – одностороннее или двустороннее варикоцеле, а также системных тяжелых инфекций (туберкулез, септические состояния) и интоксикаций (алкоголь, наркотики, феномен полипрагмазии и неконтролируемый, длительный прием лекарственных препаратов) . Особое место в развитии секреторного бесплодия имеют эндокринные патологии гипоталамо-гипофизарно-гонадной системы (врожденный и приобретенный гипогонадизм, тестостеронодефицитные состояния) а также сахарных диабет. Все эти заболевания и патологические процессы способны в той или иной мере нарушать деятельность герминогенного эпителия яичек, приводя к снижению количества сперматозоидов в сперме (олигоспермия), преобладанию среди них неактивных, малоподвижных форм (астеноспермия) или патологических (патоспермия) форм.
Экскреторное бесплодие формируется по трем основным причинам. Во-первых, это патологические процессы, нарушающие транспорт сперматозоидов по семявыносящим путям. Сюда относятся осложнения инфекционно-воспалительных заболеваний, приводящие к обструкции (исчезновению просвета) и стриктурам (сужению просвета) семенные канальцы придатков яичек (эпидидимиты), семенные и семявыбрасывающие протоки (фуникулиты, везикулопростатиты), и мочеиспускательный канал (уретриты с исходом в стриктуры уретры). К этой же группе относятся последствия травм мочеиспускательного канала (посттравматические стриктуры уретры) и хирургических вмешательств (двусторонняя вазорезекция, постоперационные стриктуры и облитерации уретры). Во-вторых, экскреторное бесплодие образуется как результат утраты сперматозоидами своих свойств при попадании в агрессивную среду, что возникает на фоне инфекционно воспалительных заболеваний мужской половой системы, вследствие контакта сперматозоидов с продуктами воспаления и возбудителями ИППП, нарушающими их морфологию, жизнеспособность и активность. При хронических эпидидимитах процесс созревания сперматозоидов нарушается, что может сопровождаться их гибелью (некроспермия) или преобладанием патологических форм (патоспермия, тератоспермия). При контакте сперматозоидов с возбудителями ИППП (особенно с уреаплазмами и микоплазмами), а также при аутоиммунных процессах в придатках яичек, возникает патологическое склеивание сперматозоидов между собой (спермагглютинация). Воспалительные процессы в предстательной железе (простатит) и семенных пузырьках (везикулит) изменяют свойства семенной плазмы, которая, содержа продукты воспаления, угнетает функциональные и жизненные возможности сперматозоидов (астеноспермия). В-третьих, в группу экскреторного бесплодия входят патологические состояния и процессы, нарушающие способность к нормальному половому акту и семяизвержению. К этой группе относятся врожденные аномалии полового члена (недоразвитие, эписпадия, гипоспадия, атрезия уретры) и приобретенные патологические процессы (травмы и опухоли полового члена, сексуально-эякуляторные нарушения – эректильные дисфункции, эякуляторные дисфункции, аспермия вследствие поражений центральной или периферической нервной системы, постоперационная ретроградная эякуляция).
В зависимости от прогноза принято различать мужское бесплодие абсолютное, обусловленное невозможностью оплодотворения и относительное, при котором оплодотворение возможно после устранения причины заболевания.
Диагностика мужского бесплодия. Важно отметить, что бесплодие в браке – не есть изолированная проблема мужчины или женщины. Как правило, это проблема пары, причем, возможность совместного вклада в развитие бесплодия в браке, для мужчин и женщин составляет не менее 14 – 17%. Это обусловливает необходимость репродуктивного обследования обоих супругов, так как при обнаружении патологии у одного из них, второй может полностью выпасть из поля зрения врача. Обследование мужчины начинается с оценки его жалоб на здоровье, сбора анамнеза в целом и репродуктивного анамнеза в частности, осмотра пациента. Диагностическое обследование на первом этапе включает в себя анализ эякулята (спермограммы) в соответствии со стандартами ВОЗ 1997 г., обследование на наличие антиспермального иммунитета в сыворотке крови и на поверхности сперматозоидов (исследование на антиспермальные антитела - АСАТ, MAR – тест, при необходимости методы спермиммобилизации и спермагглютинации), диагностику инфекций, передаваемых половым путем (ПЦР-диагностика, ИФА), и наличие условно-патогенной микрофлоры (в концентрации больше, чем 103 КОЭ), как вероятного инфекционно-воспалительного агента в развитии мужского бесплодия. Отсутствие признаков патологии по результатам этих исследований, с большой достоверностью указывает на то, что причиной бесплодия в браке является женщина. При выявлении признаков патологии по результатам первого этапа обследования, мужчине показана углубленная оценка состояния репродуктивной системы. На этом этапе пациенту проводится обследование урогенитальной системы – предстательной железы, семенных пузырьков, органов мошонки, мочеиспускательного канала, цитологические исследования секрета простаты, цитологические и бактериологические исследования мочи в 3-х порциях, бактериологические посевы на ИППП, в особенности на хламидии, трихомонады, микоплазмы и уреаплазмы, ультразвуковая диагностика (УЗИ) урогенитальной системы, по показаниям – томография органов мошонки.
Оценка гипоталамо-гипофизарно-гонадной системы проводятся путем исследования гормонального состава крови - фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), тестостерона (Ts), пролактина (Prl), эстрадиола (E), а также глобулина, связывающего половые стероиды (ГСПС) и гормонов щитовидной железы - тиреотропного гормона (ТТГ), трийодтиронина (Т-3), тироксина, а также антител к пероксидазе тиреоцитов. При выявлении тех или иных изменений гормонального состава крови, пациенту по показаниям проводятся ультразвуковые исследования щитовидной железы (УЗИ), рентгенологическое исследование черепа, компьютерная томография, медико-генетическое обследование. Если на этом этапе обследования патологических отклонений не выявляется, третьим этапом обследования является биопсия яичек – тестикулярная биопсия с возможным последующим интраоперационным исследованием проходимости семявыносящих протоков.
Лечение мужского бесплодия. В зависимости от причины, приведшей к нарушению мужской репродуктивной функции, лечебные мероприятия осуществляются по трем основным направлениям – консервативное лечение, хирургическое (оперативное) лечение, и лечение с использованием методов вспомогательных репродуктивных технологий (ВРТ). Независимо от выбора направления лечебного процесса, перед его началом пациента в обязательном порядке ориентируют на соблюдение здорового образа жизни, нормализацию режима труда и отдыха, исключение производственных вредностей и хронических интоксикаций – курения, алкоголя. При необходимости проводится психологическое консультирование или психотерапия для устранения внутрисемейных конфликтов, фобий, стрессовых ситуаций. Консервативные методы лечения направлены на устранение патологического процесса, приведшего к нарушению репродуктивной функции. Как правило, эти методы особенно эффективны в лечении инфекционно-воспалительных процессов урогенитальной системы (простатит, везикулит, уретрит, орхит, эпидидимит), сексуально-эякуляторном бесплодии и эндокринных патологиях. В последнем случае, в лечебный процесс активно включаются препараты андрогенного ряда – местеролон, провирон, андриол, гелевые формы тестостерона, гонадотропины – фоллитропин, менотропин, гонадотропин хорионический, а также антиэстрогены – кломифена цитрат, тамоксифен. При наличии гиперпролактинемии назначаются препараты-агонисты дофаминовых рецепторов – каберголин, бромокриптин. Параллельно с патогенетической терапией, в консервативном лечении используются ангиопротективные препараты, направленные на улучшение кровообращения в очаге поражения (трентал, пентоксифиллин), общеукрепляющие средства (витаминотерапия), ферменты. Показаниями к хирургическому лечению являются врожденные аномалии развития (крипторхизм, гипоспадия, эписпадия), сосудистые нарушения (варикоцеле), стриктуры и обструктивные процессы семявыносящих путей (семенных протоков, стриктуры уретры, клапаны уретры), органические, чаще всего, сосудистые формы эректильной дисфункции. В случае безуспешности проводимого лечения воспаления, а также при заведомо неблагоприятном его прогнозе, в последние десятилетия все активнее стали использоваться методы вспомогательных репродуктивных технологий (ВРТ), дающие эффект и в тех случаях, которые ранее считались абсолютно бесперспективными. К этим методам относятся искусственная инсеминация спермой мужа (ИИСМ), искусственная инсеминация спермой донора (ИИСД) и экстракорпоральное оплодотворение (ЭКО), использующее методику инъекции сперматозоида в цитоплазму ооцита (ИКСИ). Показания к использованию вспомогательных репродуктивных технологий (ВРТ) не являются абсолютными и определяются по согласованию с пациентом на основании представленной ему информации о состоянии его репродуктивной функции и сравнительного анализа прогнозов эффективности ВРТ. Лечению по программе ЭКО подлежат только пациенты с неблагоприятным прогнозом восстановления репродуктивной функции.
Гиперпролактинемия
Гипепролактинемия – это патологическое состояние, характеризующееся увеличением уровня пролактина в крови. По статистике, как правило, болезнь диагностируют у женщин от 25 до 40 лет. В структуре эндокринного бесплодия гиперпролактинемия достигает 20%.
Бесплодие и гиперпролактинемия
Гиперпролактинемия характеризуется ановуляцией.
Дело в том, что этот гормон оказывает влияние на выработку гонадотропинов - гормонов гипофиза, которые регулируют рост и развитие фолликулов, а также выход яйцеклетки из яичника (овуляцию). Если уровень пролактина значительно повышен, ФСГ и ЛГ вырабатываются в недостаточном количестве, поэтому оплодотворения не происходит.
Кроме того, высокий пролактин препятствует продукции эстрогенов, также принимающих участие в регуляции менструального цикла.

Диагностика гиперпролактинемии
Диагностика включает в себя:
- сбор анамнеза, в ходе которого женщина рассказывает об имеющихся нарушениях менструального цикла, использовании лекарственных препаратов, изменении полового влечения. Пациентке необходимо сообщить специалисту, связывает ли она появление беспокоящих ее симптомов с каким-либо событием (стрессом, родами, прерыванием беременности);
- внешний осмотр пациентки, который позволяет определить общее физическое состояние, развитие вторичных половых признаков, состояние волос и кожи;
- гинекологический осмотр, который дает возможность выявить инволютивные процессы (т.е. возрастные изменения);
- осмотр молочных желез;
- КТ или МРТ гипофиза для исключения/подтверждения микро- и макроаденом;
- офтальмологическое исследование, в ходе которого врач изучает глазное дно, а также выявляет изменение полей зрения. Обычно о снижении зрения и головных болях говорят пациенты с макроаденомами гипофиза;
- определение уровня пролактина в плазме крови. Как правило, концентрация намного выше, если у пациентки есть опухоль, секретирующая этот гормон (пролактинома);
- определение уровня гормонов щитовидной железы (ТТГ, Т3 и Т4);
- анализ на определение уровня гормонов, продуцируемых надпочечниками (ДЭА-С, ДЭА, кортизол);
- проведение печеночных и почечных проб, призванных исключить патологию этих органов.
Диагностика форм гиперпролактинемии основывается на комплексной оценке результатов проведенного обследования.
Так, например, для макроаденомы гипофиза характерно выявление образования в ходе компьютерной томографии, значительное повышение уровня пролактина, ухудшение зрения и головные боли. Все пациентки указывают на полное отсутствие менструаций, подавляющее большинство в числе жалоб называют галакторею и резкое снижение либидо.
У пациенток с микроаденомой гипофиза аменорея наблюдается в 4 из 5 случаев. Также может иметь место НМЦ по типу олигоменореи. 7 из 10 пациенток сталкиваются с галактореей, а также нередко со снижением полового влечения. В некоторых случаях в ходе исследования выявляются гинекологические заболевания.
Если повышение уровня гормона связано с нарушениями функций органов (щитовидной железы, печени, почек, а также со стрессами), то у пациенток отсутствуют изменения турецкого седла при проведении компьютерной томографии. Повышение уровня пролактина умеренное. У части пациенток может сохраняться менструальный цикл, но отсутствует овуляция, т.е. присутствует эндокринный фактор бесплодия. В 3 из 5 случаев имеет место гипоменструальный синдром. В процессе обследования нередко выявляются изменения в органах малого таза, а также ФКМ (фиброзно-кистозная мастопатия).

Симптомы гиперпролактинемии у женщин
Как правило, пациентки связывают появление симптомов с различными событиями (например, родами) или предъявляют жалобы на бесплодие. В анамнезе могут иметь место значительные стрессы, хирургическое вмешательство или травмы в области грудной клетки, прием некоторых медикаментов.
Повышение уровня пролактина сопровождается рядом симптомов.
Обычно выявляются нарушения цикла по типу опсоменореи, когда промежутки между менструациями превышают 35 дней, и олигоменореи, когда длительность менструации сокращается до 2-х и менее дней. Нередко цикл становится нерегулярным. В дальнейшем может развиться вторичная аменорея.
Часто имеют место ановуляторные циклы, характеризующиеся тем, что при наличии менструаций в цикле не происходит выхода созревшей яйцеклетки из фолликула в брюшную полость.
У ряда пациенток менархе наступает поздно (после 15 лет), а в дальнейшем цикл так и не становится регулярным.
В периоде лактации увеличение продукции пролактина позволяет предотвратить новую беременность, то есть играет роль естественного контрацептива. Если уровень гормона повышается вне периода грудного вскармливания, это может стать причиной бесплодия.
Снижение уровня эстрогенов, обусловленное излишней продукцией пролактина, влечет за собой появление таких симптомов, как вегетососудистые нарушения, сухость влагалища, дискомфорт при интимной близости. Позже начинает развиваться остеопороз – снижение плотности костной ткани, которое представляет серьезную опасность в связи с риском переломов.
Галакторея (выделение молока из молочных желез вне периода лактации) является одним из основных симптомов повышенного уровня пролактина как у женщин, так и у мужчин. Однако нужно иметь в виду, что при гиперпролактинемии она выявляется не всегда.
Примечательно, что выраженность галактореи (количество выделяемого молока) не всегда коррелирует с уровнем пролактина.
Причины
Физиологическая гиперпролактинемия бывает обусловлена такими факторами, как беременность и грудное вскармливание. Кроме того, на выработку гормона влияют психоэмоциональные и физические перегрузки.
Патологическую гиперпролактинемию подразделяют на органическую и функциональную.
Первая обусловлена новообразованиями в гипофизе (микро- и макроаденомами), которые вырабатывают пролактин, а также кистами. Кроме того, причиной развития органической гиперпролактинемии может стать синдром пустого турецкого седла.
Функциональная гиперпролактинемия чаще всего выявляется у пациенток с эндокринными нарушениями (поликистозом яичников, дисфункцией коры надпочечников и щитовидной железы), серьезными хроническими патологиями некоторых органов (например, почек и печени), а также миомой матки и эндометриозом.
Увеличение продукции пролактина также возможно вследствие приема некоторых лекарственных препаратов (например, гипотензивных средств, психотропных препаратов, гормонов).
Если выявить причины повышения уровня пролактина не удается, диагностируют идиопатическую гиперпролактинемию, которая встречается в половине всех случаев.
Лечение
Схема лечения разрабатывается в индивидуальном порядке, исходя из результатов проведенного обследования, с учетом желания женщины восстановить фертильность. Могут применяться медикаментозное, хирургическое лечение, а также лучевая терапия.
Консервативная терапия
В качестве первого этапа помощи при лекарственно-индуцированной гиперпролактинемии рекомендовано отменить лекарственное средство, если это клинически возможно. В противном случае следует заменить препарат на аналогичный, но не вызывающий гиперпролактинемию.
Как правило, для лечения гиперпролактинемии используются лекарственные средства, направленные на уменьшение продукции пролактина. Препаратом выбора в настоящее время признан каберголин.
Часто применение медикаментов способствует не только снижению пролактина, но и уменьшению объема опухоли гипофиза у пациенток с микро- и макроаденомами. Поскольку консервативной терапии нередко оказывается достаточно, хирургическое лечение в подавляющем большинстве случаев не требуется.
Длительность лечения может быть различной. Иногда добиться положительных результатов удается только через несколько лет. Необходимо регулярно оценивать эффективность терапии.
Если гиперпролактинемия связана с гипотиреозом или другими эндокринопатиями, пациентке может быть показана комбинированная терапия выявленных заболеваний.
Хирургическое лечение
Показаниями к проведению оперативного вмешательства являются:
- большие размеры макроаденом, когда опухоль распространяется за пределы турецкого седла и у пациента появляются признаки нарушения зрения;
- апоплексия гипофиза – резкое увеличение объема опухоли, вызванное кровоизлиянием;
- плохая переносимость препаратов;
- аденомы гипофиза (микро- и макроаденомы), консервативное лечение которых не дало результата.
Лучевая терапия
Этот метод при лечении гиперпролактинемии в настоящее время практически не используется.
В целом успех терапии оценивается на основании следующих критериев:
- нормализация уровня пролактина;
- уменьшение размеров опухоли по результатам компьютерной томографии и/или МРТ;
- нормализация цикла пациентки и восстановление фертильности (если женщина находится в репродуктивном возрасте).
Профилактика
Чтобы избежать развития патологии, необходимо устранить факторы, которые способствуют увеличению продукции пролактина.
При необходимости использования лекарственной терапии, особенно психотропных средств, следует обращать пристальное внимание на их побочные действия.
Выбор оральных контрацептивов всегда должен осуществлять врач на основании результатов проведенного обследования.
Чтобы своевременно диагностировать возможные рецидивы, пациенткам с гиперпролактинемией необходимо наблюдаться у специалиста.
Пролактин и бесплодие


Почему повышенный пролактин и бесплодие тесно связаны? Почему он повышается, и как решить эту проблему? Пролактин — гормон, который вырабатывается гипофизом в головном мозге. Также в небольшом количестве его продуцируют эндометрий, яичники, плацента. Если гормон повышен у женщины, которая не вынашивает и не кормит грудью ребенка, то говорят о патологическом состоянии — гиперпролактинемии. Чаще всего она обнаруживается в процессе комплексной диагностики бесплодия у женщины.
Причины повышения уровня пролактина
Выработка этого гормона может увеличиваться во время беременности, лактации, в конце менструального цикла, в период полового созревания. Пролактин подавляет выработку лютеинизирующего гормона, отвечающего за созревание яйцеклетки в яичниках и овуляцию. В результате яйцеклетка не созревает и не покидает фолликул, овуляция не наступает, и соответственно зачатие невозможно.
Длительная гиперпролактинемия сопровождается повышенной концентрацией андрогенных гормонов у женщины, что может проявляться избыточным оволосением. Также вероятно увеличение молочных желез в объеме и выделение грудного молока.
Причинами повышенного пролактина и бесплодия, к которому приводит такое состояние, считаются нарушение функций гипофиза — отдела головного мозга, ответственного за выработку лютеинизирующего, тиреотропного и других гормонов. Также гиперпролактинемию связывают с гипотиреозом, заболеванием щитовидной железы, при котором снижается продуцирование тиреоидных гормонов.
К другим провоцирующим факторам повышения пролактина относятся травмы и операции на молочных железах, заболевания печени, нарушения в работе яичников, а также прием некоторых лекарств (контрацептивы, антидепрессанты).
Что происходит при гиперпролактинемии?
Высокий пролактин блокирует выработку прогестерона, что негативно отражается на вероятности зачатия и даже в случае наступления беременности снижает шансы на ее успешное вынашивание. При сниженном уровне эстрогенов на фоне гиперпролактинемии эндометрий матки истончается, и успешная имплантация эмбриона становится невозможной.
Повышенный пролактин не только приводит к бесплодию, но и может стать причиной мастопатии и повышает риск развития кист молочных желез. Кроме того, гиперпролактинемия провоцирует возрастание уровня инсулина и тестостерона у женщин. Это приводит к повышению аппетита, набору веса, появлению угревых высыпаний на лице. Помимо этого женщины страдают от головных болей, у них может снижаться зрение и ухудшается усвоение кальция, что грозит ломкостью костей и проблемами с зубами.
Репродуктологи клиники «Айвимед» занимаются диагностикой и лечением повышенного пролактина и бесплодия, связанного с дисбалансом этого гормона.
Читайте также:
