Целенаправленные цитостатики для лечения опухоли
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Целенаправленные цитостатики для лечения опухоли
Когда опухолевые клетки проявляют особые метаболические свойства, которые отличаются от нормальных клеток, становится возможным целенаправленное фармакотерапевтическое вмешательство.
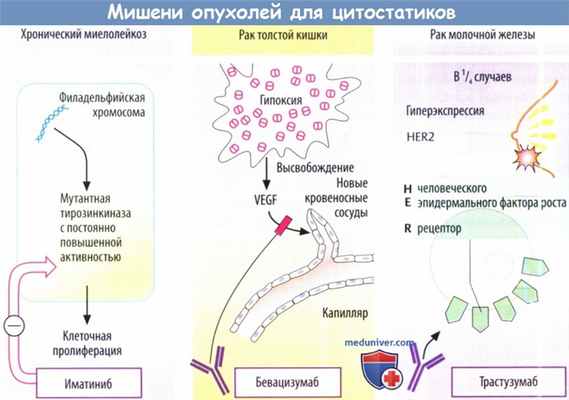
а) Иматиниб. Хронический миелолейкоз (ХМЛ) возникаете результате генетического дефекта в гемопоэтических стволовых клетках костного мозга. Почти у всех пациентов с ХМЛ имеется филадельфийская хромосома.
Она образуется в результате транслокации между хромосомой 9 и 22 протоонкогена с-abl, что приводит к гибридному слитному гену bcr-abl на хромосоме 22. Рекомбинантный ген кодирует мутантную тирозинкиназу с неуправляемой (конститутивной) увеличенной активностью, которая стимулирует клеточную пролиферацию.
Иматиниб — ингибитор тирозинкиназы, который специфично действует на данную мутантную киназу, а также взаимодействует с некоторыми другими киназами. Его можно использовать внутрь при ХМЛ с положительной филадельфийской хромосомой.
Дазатиниб и нилотиниб — резервные препараты, которые применяются в случае резистентности к иматинибу.
б) Бевацизумаб — ингибитор ангиогенеза, который одобрен для лечения колоректального рака, рака молочной железы и других опухолей. Солидной опухоли для роста требуется адекватное кровоснабжение. Сигнальные белки из группы VEGF продуцируются почти всеми клетками.
Важным стимулом для их высвобождения является снижение парциального давления O2, что встречается, например, в центре солидной опухоли. VEGF стимулируют пролиферацию имеющихся эндотелиальных клеток. Новые клетки мигрируют, образуется полость, и появляется связь между опухолевой тканью и кровоснабжением.
Тем не менее активный ангиогенез также важен для восстановительных процессов при воспалении и лечении раны. Это приводит к развитию возможных побочных реакций: желудочно-кишечная перфорация, кровотечение, а также повышение АД (снижение продукции эндотелиального NO).
Ранибизумаб, Fab-фрагмент бевацизумаба местно вводится иньекционно в глаз для борьбы с неоваскуляризацией при влажной макулодистрофии.
в) Трастузумаб служит примером растущего числа моноклональных антител, которые стали доступны для противоопухолевой терапии. Они направлены против поверхностных клеточных белков, которые избыточно экспрессируются опухолевыми клетками. Трастузумаб связывает FHER2.
Плотность данного рецептора значительно увеличивается при некоторых типах рака молочной железы. При связывании опухолевыми клетками антител иммунные клетки распознают их как структуры, требующие удаления. Трастузумаб показан в запущенных случаях при особых обстоятельствах. Антитело является кардиотоксичным; вероятно, кардиомиоциты тоже экспрессируют HER2.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитостатическая противоопухолевая терапия
Призвана воздействовать на те клетки в организме, которые делятся наиболее быстро. Прежде всего это относится к опухолевым клеткам. Химиопрепараты могут назначаться по одному (монотерапия) или в комбинации (полихимиотерапия).
Наиболее часто противоопухолевые цитостатики назначаются внутривенно или внутрь, однако в ряде случаев может потребоваться введение лекарств в спинномозговой канал, либо в плевральную или брюшную полости. Иногда эффективность внутривенного введения повышает длительность введения химиопрепарата (до 48 и даже 96 часов).
Как проводится химиотерапия
Практически всегда химиотерапия проводится курсами (циклами), предполагая перерыв для восстановления нормальных тканей и функций организма (помимо опухолевых клеток, в процессе лечения могут повреждаться другие активно делящиеся клетки – в первую очередь клетки крови, волосяных фолликулов, клетки слизистых оболочек.
В последние годы успехи молекулярной биологии позволили для лечения ряда злокачественных новообразований создать препараты так называемой таргетной, или направленной терапии, с конкретной мишенью приложения, отличающей опухолевую клетку от нормальной.
Препараты таргетной терапии
В большинстве случаев препараты таргетной терапии сочетаются с обычными цитостатиками, повышая эффективность лечения, но иногда используются самостоятельно. Наиболее часто мишенью служат рецепторы на поверхности клеток опухоли или питающих ее сосудов (так действуют моноклональные антитела и ингибиторы тирозин-киназ), но мишенью могут быть и последующие этамы передачи пролиферативного сигнала).
Значительное число опухолевых заболеваний лечится не только химиопрепаратами, но и гормонами. Как правило, гормональные препараты принимаются внутрь и лечение осуществляется длительно. Иногда гормональное лечение требует хирургических вмешательств с целью исключить влияние тех или иных гормонов, вырабатывающихся в организме (удаление яичников или яичек).
Реже для лечения злокачественных новообразований используется иммунотерапия (как правило, цитокины интерферон альфа или интерлейкин-2). Обычно эти препараты используются в случаях, когда ограничены возможности химио- и гормонотерапии.
Бисфосфонаты
В арсенале онкологов существует также группа препаратов, избирательно действующих на костную ткань – бисфосфонаты. Предохраняя кость от разрушения опухолью, эти лекарства уменьшают боль и снижают частоту осложнений (прежде всего патологических переломов).
Кроме того, в арсенале онкологов существует целый ряд препаратов поддерживающей терапии для предотвращения либо лечения осложнений, связанных с химиотерапией. Как правило, такое лечение не носит «универсального» характера и присоединяется к противоопухолевой терапии по мере развития осложнений.
Исключение представляет, главным образом, противорвотная (антиэметическая) терапия, назначаемая перед химиотерапией, исходя из данных о возможности тошноты и рвоты при каждой конкретной схеме лечения.
По мере исчерпания возможностей противоопухолевого лечения (а на поздних стадиях болезни это обычно химиотерапия) возрастает значение паллиативной помощи и симптоматического лекарственного лечения как ее компонента.
В настоящее время медицина располагает большим количеством препаратов, позволяющих эффективно бороться с наиболее мучительными симптомами опухолевой болезни, включая болевой.
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент

Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
Что такое лекарственное лечение
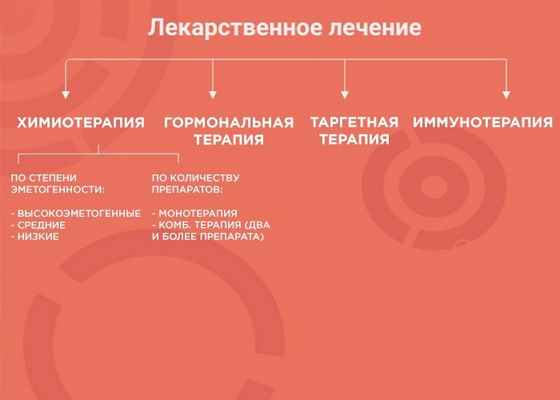
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
У ХТ существует три типа схем: высокоэметогенные (то есть «тошнотворные»), средние и низкие. Чтобы понять, к какому типу относится та или иная комбинация препаратов, химиотерапевт использует специальные схемы и таблицы. Поскольку вместе с опухолью под удар цитостатиков попадают и здоровые клетки, ХТ влечет за собой ярко выраженные побочные эффекты: снижение продукции клеток крови (миелосупрессия), воспаление слизистой оболочки рта (мукозит), выпадение волос, тошнота и рвота. Такой список способен напугать кого угодно, и Мария успокаивает:
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
Цели и оценка эффективности лекарственного лечения
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
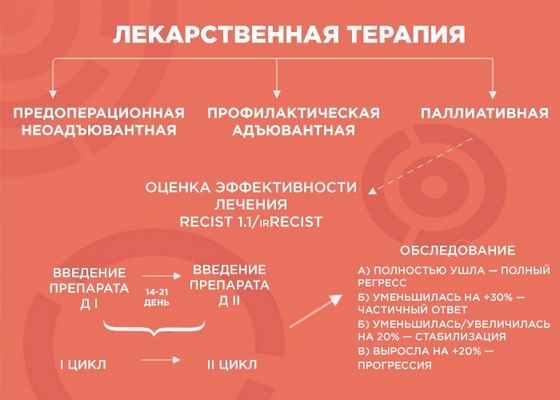
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.
Химиотерапия
Курс химиотерапии при раке: лечение и побочный эффект
Даже самая блестящая хирургическая резекция злокачественной опухоли не способна в полной мере защитить пациента от таких тяжелых осложнений, как рецидивы и метастазы. Поэтому, для повышения эффективности комплексного противоопухолевого лечения, активно применяется химиотерапия. Использование цитостатических препаратов, сдерживающих деление, нарушающих структуру и жизнеспособность атипичных клеток, помогает контролировать течение болезни на различных стадиях рака.
Как проводится химиотерапия?
Химиотерапия – это цикличная курсовая методика. В соответствии с современными протоколами лечения онкопатологий, в планировании курса участвуют специалисты различных направлений. Для каждого пациента разрабатывается индивидуальная схема ХТ. При этом учитывается:
Подобный подход позволяет корректировать медикаментозное лечение, достоверно замедлить прогрессирование болезни и минимизировать риски побочных эффектов.
Для чего проводится химиотерапия?
Существует 3 разновидности лекарственной противоопухолевой терапии, каждая из которых используется в определенной клинической ситуации:
Дополнительная информация
Одним из самых перспективных направлений, применяющихся при лечении онкологии брюшной полости, является интраоперационная гипертермическая химиотерапия (длительное промывание прооперированной области цитостатическим раствором, нагретым до 42°С). Данная методика, использующаяся только в крупных специализированных центрах, доказала свою результативность при раке желудка, толстой кишки, аппендикса, псевдомиксоме брюшины.
Преимущества применения цитостатической терапии при онкологии
Активная разработка и применение новых цитостатических препаратов, обладающих избирательной специфичностью в отношении раковых клеток и сниженной общей токсичностью, делают химиотерапию более легкой для организма.
Где проводят химиотерапию?
Назначение противоопухолевого лечения – прерогатива врача-онколога, специализирующегося на ведении больных определенного онкологического профиля. Курс химиотерапии может проводиться в специализированных медицинских учреждениях поликлинического или стационарного типа, или на дому. Это во многом зависит от общего состояния пациента, назначенной лекарственной формы препарата и способа его введения.
Обязательным условием, требуемым для выполнения процедуры, является наличие профессиональных знаний, опыта и государственного сертификата, дающего право заниматься данным видом деятельности. И даже если было принято решение лечиться дома, первый сеанс рекомендуется пройти в условиях клиники, для возможного выявления и быстрого устранения потенциальных побочных эффектов.
В связи с тем, что большинство цитостатиков вводится внутривенно, во время химиотерапии пациенту необходимо обеспечить максимальный комфорт. Для облегчения введения препаратов применяются специальные венозные катетеры, инфузионные порт-системы и наборы вспомогательных медицинских устройств.
Виды химиотерапии
Помимо базовых вариантов противоопухолевого медикаментозного лечения (адъювантный, неоадьювантный, индукционный) в онкологической практике используются следующие разновидности химиотерапии:
Как цитостатические препараты вводятся в организм?
Обязательным условием успешного противоопухолевого лечения является целенаправленное проникновение цитостатика в раковую клетку, в должной терапевтической концентрации. Для различных форм злокачественных новообразований разработаны разные способы введения химиопрепаратов:
Дополнительная информация
Большинство современных химиопрепаратов вводится внутривенно. Для контроля количества вводимого раствора и соблюдения установленной скорости используются специальные насосы. Длительная инфузионная химиотерапия позволяет воздействовать на опухоль в течение нескольких часов (дней). Также существуют так называемые быстрые инфузии, длящиеся 15-60 минут. Они предусматривают курсовое введение лекарства через определенные интервалы времени.
Как подготовиться к химиотерапии?
Перед началом первого курса противоопухолевого лечения (не более чем за 2 недели) пациент должен пройти комплекс обязательных обследований. В него входит:
При наличии медицинских показаний перечень диагностических процедур может быть расширен. Также, при необходимости, проводятся консультации смежных специалистов. Если цитостатики будут вводиться внутривенно, может быть установлена подкожная инфузионная порт-система для длительного применения, существенно облегчающая процедуру.
Чтобы повысить эффективность лечения и минимизировать побочные эффекты химиотерапии, следует:
Первый курс химиотерапии
К началу лечения пациент подходит полностью обследованным. Это значит, что достоверно определен характер, локализация и размер опухоли, оценено общее состояние организма, индивидуально подобран лекарственный препарат и разработана оптимальная схема лечения.
Современные цитостатики менее токсичны по отношению к здоровым клеткам, чем их предшественники. А дополнительно применяющаяся медикаментозная поддержка минимизируют побочные эффекты. Однако организм каждого человека индивидуален и невозможно заранее предсказать, как он будет реагировать на медикаментозное противоопухолевое лечение. Иногда неприятные симптомы дают о себе знать с первых часов введения препарата, в других случаях проявляются в средине или по окончанию курса.
В то же время, у некоторых людей побочные эффекты химиотерапии могут быть слабо выражены и даже отсутствовать. Подобное состояние связано с индивидуальными особенностями организма или избирательным фармакологическим действием используемых лекарственных препаратов, и никак не свидетельствует об их неэффективности.
Ощущения во время химиотерапии
В большинстве случаев непосредственно во время процедуры не возникает никаких особых ощущений. Слабость, повышенная утомляемость и ухудшение самочувствия могут появиться через 1-2 дня. Также возможно развитие гриппоподобных симптомов, о которых нужно обязательно сообщить врачу.
Сколько длится химиотерапия?
Длительность применения цитостатиков определяется индивидуально, с учетом характера, стадии опухолевого процесса и общего состояния больного. Химиотерапия при раке проводится циклами, при которых периоды лечения чередуются с 3-4-х недельными интервалами для восстановления. Средняя продолжительность курса составляет 14 дней. Промежуток между сеансами определяется назначенной схемой. В целом применяется 4-6 циклов, после чего назначается поддерживающая терапия. Максимальная общая длительность ХТ – 1 год.
Важно!
Главнейшим условием эффективного противоопухолевого лечения является строгое соблюдение режима введения цитостатических препаратов. Иначе ожидаемый эффект не будет достигнут.
Противопоказания к химиотерапии
Абсолютным противопоказанием к проведению медикаментозного противоопухолевого лечения является обще тяжелое состояние пациента, если шанс на излечение и продление жизни отсутствует.
Список относительных противопоказаний включает:
Дополнительная информация
Для некоторых групп цитостатических препаратов существуют специфические противопоказания, которые обязательно учитываются в индивидуальном порядке. В случае развития клинически значимых реакций производится замена противоопухолевого лекарства на схожее по эффективности.
Побочные эффекты
В период химиотерапии могут развиваться различные нежелательные реакции. Их появление во многом зависит от фармакологических свойств, дозировки применяемого препарата и индивидуальных характеристик пациента. Самые часто встречаемые побочные эффекты:
Важно!
Каждый опыт прохождения химиотерапии уникален. И хотя побочные эффекты могут быть достаточно неприятны и непредсказуемы, множество из них можно предотвратить или устранить. И практически все они носят временный характер.
Анализы крови в процессе химиотерапии
Перед началом каждого химиотерапевтического курса (за 3-5 дней) выполняются анализы крови:
Общеплановая оценка эффективности противоопухолевой терапии проводится каждые 6-12 недель.
Стоимость химиотерапии
Это варьируемый показатель, зависящий от ряда параметров:
Точная стоимость химиотерапии рассчитывается индивидуально, после просчета всех предстоящих процедур.
Первые дни после химиотерапии
Чаще всего побочные эффекты цитостатических препаратов развиваются в течение нескольких дней. При тошноте рекомендуется увеличить количество потребляемой жидкости, принимать препараты от тошноты, питаться 5-6 раз в день, но небольшими порциями. При диарее снизить потребление клетчатки и обязательно проконсультироваться с врачом. При запорах как можно больше двигаться, включить в рацион больше продуктов с растительными волокнами, пить теплую воду. В данном случае также может потребоваться назначение специальных лекарственных средств. Чтобы снизить потерю волос, можно использовать специальные устройства (холодовые шлемы).
Питание после лечения
После курса химиотерапии рекомендуется отдавать предпочтение термически обработанной пище. Все продукты обязательно должны быть свежими, а блюда калорийными. Ежедневный рацион должен содержать:
Употребление животных жиров, соли и сахара рекомендуется свести к минимуму. Пациентам с белково-энергетической (нутритивной) недостаточностью дополнительно назначается прием высококалорийных питательных смесей.
Преимущества химиотерапевтического лечения рака в ФГБУЗ СОМЦ ФМБА России
Для получения более детальной информации по вопросу прохождения химиотерапии в Новосибирске записывайтесь на прием к нашим специалистам. И помните: главное – не сдаваться! Уверенность в собственных силах – это 50% успеха.
Иммунотерапия

Благодаря развитию генетики, молекулярной биологии в онкологии разрабатываются и внедряются новые методы лечения, которые помогают бороться с разными видами и стадиями рака, даже с такими видами, при которых ранее прогноз был не очень хорошим. Иммунотерапия относится к таким современным методам. Мы побеседовали с врачом-онкологом Текеевой Асият Иссаевной и выяснили, в чем заключается суть иммунотерапии, при каких локализациях опухоли она показана и по какой схеме проводят лечение.
Расскажите, пожалуйста, как в целом развивалась онкология и как появилась иммунотерапия?
Опухолевые заболевания занимают 2 место в структуре общей заболеваемости по всему миру (на первом месте — сердечно-сосудистые заболевания). До недавнего времени лечение онкологических заболеваний ограничивалось химиотерапией и таргетной терапией:
- Таргетная терапия — целенаправленная терапия, блокирует и уничтожает белковые компоненты опухоли;
- Химиотерапия — применение цитостатиков, которые влияют на все клетки (опухолевые, здоровые), и уничтожают их.
Более 100 лет ученые пытались подтолкнуть иммунную систему к борьбе со злокачественными заболеваниями. И только в 2000-х годах, блокирование иммунных контрольных точек – оказалась эффективной при различных вариантах рака.
Иммунные контрольные точки являются специальными белками, которые действуют на иммунную систему как тормоз, позволяя иммунитету работать, когда нужно и сколько нужно.
Лечение с использованием ингибиторов иммунных контрольных точек заставляет иммунную систему бороться с раковыми клетками. С того момента, как в 2011 году ингибиторы иммунных контрольных точек показали удивительный эффект при распространенной меланоме, исследования в этой области стали развиваться необыкновенно быстро, и на сегодняшний день иммунотерапия показала свою эффективность в лечении более 12 злокачественных заболеваний.
В чем отличие этих методов?
При химиотерапии высок риск побочных эффектов. В некоторых случаях мы вынуждены прерывать лечение, останавливаться на каком-то этапы: проводить терапию бесконечно невозможно.
Таргетная терапия имеет свои особенности: кардиотоксичность, кожная токсичность. Проводится более или длительно: до признаков непереносимости данного препарата, или до признаков прогрессирования заболевания, когда нужно искать другие методы лечения.
Прорывом в онкологии стала иммунотерапия. Об эффективности иммунотерапии говорят следующие данные: при меланоме 5-летняя выживаемость раньше составляла 15%. Сегодня, когда мы имеет возможность применять иммуноонкологические препараты, этот показатель равен 60%.
В чем заключается иммунотерапия?
Иммунотерапия — это противоопухолевое лечение, которое является методом не прямого воздействия на опухоль, а опосредованного , то есть через определенные звенья нашего иммунитета .
Ответ иммунной системы на опухоль представляет собой цепь реакций, где дефект одного звеньев блокирует весь цикл. Клетки опухоли экспрессируют антигены, которые в различной степени отличают опухоль от нормальной ткани, далее эти антигены захватываются и обрабатываются антигенпрезентирующими клетками (такими как дендритные клетки), далее антиген представляется (презентуется) клеткам иммунной системы, непосредственно Т- и В-лимфоцитам. Иммунная система узнает и отвечает на эти антигены, в особенности за счет выработки цитотоксических Т-клеточных антигенспецифических реакций и развития иммунологической памяти (благодаря этой функции при повторной встрече с антигеном, иммунные клетки уничтожают этот антиген). Цитотоксические эффекторные Т-клетки перемещаются к опухоли и атакуют клетки, экспрессирующие антиген.
Однако опухолевые клетки адаптируются и меняются путем своего естественного развития, чтобы ускользнуть от иммунного ответа. Это вторая проблема, которая активно изучается.
Кто снимает этот блок?
Анти PD-1, PDL-1, CTLA-4 ингибиторы — это группа иммуноонкологических препаратов, которые снимают блок с этого «рукопожатия». Передача сигнала, который подавляет активность T-лимфоцитов, прекращается. Иммунная система снова начинает распознавать и атаковать опухоль.
Какие иммуноонкологические препараты используются в России?
На сегодняшний день в арсенале онкологов имеется несколько иммуноонкологических препаратов: пембролизумаб, ипилимумаб , ниволумаб, атезолизумаб , дурвалумаб . Данные препараты воздействуют как минимум на 3 звена иммунной системы.
1-й препарат — ипилимумаб, инактивирует сигнальный путь CTLA-4 и активирует иммунную систему. Дендритная клетка (клетка, которая презентирует иммунным клеткам и поврежденные и/или опухолевые клетки) не может передать информацию лимфоциту , п отому что Т-лимфоцит сам содержит рецептор CTLA-4 и он за блокирован белком опухоли. Когда вводится препарат, блок снимается, то есть рецептор CTLA-4 уходит с лимфоцита, лимфоцит воспринимает информацию от дендритной клетки, видит , что эта клетка -атипичная/поврежденная , и ее уничтожает.
Следующий класс препарат ов — пембролизумаб /ниволумаб , действу ю т через PD-1 — рецептор запрограммированной клеточной гибели ( рецептор преждевременной гибели клеток ) . Опухолевая клетка экспрессирует лиганд PD - L 1 (реже PD - L 2). Взаимодействие рецептора PD -1 и опухолевого PD - L 1 приводит к «ускользанию» раковой клетки от Т-лимфоцита. Что же делать? Как заблокировать этот блок? Путем введения анти- PD -1 препаратов блокируем этот рецептор на поверхности Т-лимфоцита, либо путем введения анти- PD - L 1 препарата блокируем лиганд на опухолевой клетки. Происходит разрыв данной связи и лимфоцит «распознает» чужеродную клетку и инактивирует ее.
PDL-1, CTLA-4 могут применяться одновременно: это двойная иммунная блокада (ипилимумаб+ниволумаб) . Схема является очень эффективной при меланоме , раке почки и раке легкого .
3 сигнальный путь — MSI ( микросателлитная нестабильность ) . Суть в том, что в системе ДНК каждый день происходит более 10 млн мутаций. Эти мутации — поврежденные клетки, против которых работают наши иммунные клетки. Под действием экзогенных и эндогенные факторов происходит сбой в иммунной системе, и в геноме ДНК начинают скапливаться мутации . Это и есть микросателлиты – участки ДНК, которые повторяются в избыточном количестве . Накопление микросателлитов увеличивает опухолевую нагрузку. , и тем самым появляются антигены, которые запускают иммунный ответ. Этим объясняется уровень мутационной нагрузки – чем выше микросателлитная нестабильность ( MSI - High ), тем выше вероятность ответа опухолевого процесса на иммунотерапию.
Чаще всего микросателлитная нестабильность встречается при раке желудка, колоректальном раке, раке эндометрия.
Какой препарат в каких случаях применяется?
Иммунотерапия не может назначаться вслепую и всем подряд.
На сегодняшний день показаниями к иммунотерапии являются около 12 видом онкозаболеваний. Очень важными маркерами ответа на иммунотерапию являются экспрессия PDL-1 и н аличие микросателлитной нестабильности ( MSI - H ) .
Нет лабораторных и молекулярно-генетических методов определения чувствительности к какому-то конкретному препарату. При назначении руководствуемся клиническими рекомендациями, в которых прописано, в каком случае какой препарат назначать.
По какой схеме проводится иммунотерапия при меланоме?
При меланоме не требуется определения трех предикторных маркеров. Иммунотерапия назначается в послеоперационном периоде, когда есть пораженные лимфоузлы.
При 1 линии — когда пациент приходит на прием, процесс распространенный, имеются метастазы, лечения никакого не было, в том числе хирургического — назначаем 1 линию терапии. Это первая схема, которую он вообще получает. Предпочтительно назначать комбинацию ипилимумаб + ниволумаб, потому что эффективность этой комбинации препаратов значительно выше, чем ниволумаба в монорежиме.
А при других локализациях рака?
- При колоректальном раке (прямой кишки, ободочной кишки, сигмовидной кишки,) определяем MSI. При наличии высокого уровня микросателлитной нестабильности, пациенту показана иммунотерапи я .
- При раке легкого определение PDL-1 экспрессии необходимо для того, чтобы выбрать тактику. Если пациент ослабленный, у него небольшой объем поражения других органов и тканей, можем назначать препарата пембролизумаб в монорежиме . Если пациент в удовлетворительном состоянии и/или имеется большая опухолевая масса, возможно проведение комбинированной иммуно- химиотерапии, независимо от уровня PD - L1
- При раке шейки матки, заболеваемость которой неуклонно растет с каждым годом , стандартом была химиотерапия или химиолучевая терапия. Сейчас мы можем использовать иммуноонкологический пепарат ( пембролизумаб ) во второй линии химиотерапии, при наличии экспрессии PD - L1.
- Рак молочной железы (тройной негативный) — прогноз неблагоприятный при метастатических формах. Чаще болеют женщины от 28 до 40 лет. Ассоциирован с наследственным раком. Если у молодой женщины выявлен рак молочной железы тройной негативный подтип, необходимо провести иммуногистохимическое исследование для определени я экспрессии PD - L1 и полное геномное секвенирование на выявление мутации в гене BRCA 1/2. Говоря об иммунотерапии, в 1й линии иммунохимиотерапии проводится комбинация атезолизумаб с наб-паклитакселом.

Как проводят иммунотерапию?
Первое введение длится 1 час. Это время нужно, чтобы мониторировать и контролировать нежелательные явлениям , которые могут возникнуть.
Вторые и последующие курсы иммунотерапии — вводятся в течение 30 минут. После процедуры отпускаем домой. Если нужно наблюдение, оставляем на вторые сутки.
Никакой сопроводительной терапии не требуется , если нет показаний по данным клинико-лабораторного обследования . Более того, бесконтрольное применени е антиоксидантов снижает эффективность проводимого лечения (иммунотерапии).
Как определяется эффективность?
Оценка эффективности лечения проводится каждые 3 месяца при моноиммунотерапии; комбинированной иммуно-химиотерапии – оценка эффекта каждые 2 месяца. При назначении иммунотерапии и при оценке эффекта необходимо учитывать феномен « псевдопрогрессирования », при котором вследствие активизации иммунитет а, Т- лимфоциты «инфильтируют» раковые клетки, увеличивается количество Т-лимфоцитов, и, следовательно, объем(размеры) опухоли.
К первому контролю эффективности лечения, дифференциальную диагностику между псевдопрогрессированием и истинной прогрессией возможно провести, основываясь прежде всего на инструментальной картине, а также сопоставляя с клинической картиной, данными лабораторных обследований.
Какие методы диагностики используются?
Из инструментальных методов проводятся компьютерная томография органов грудной клетки , брюшной полости, малого таза или ПЭТ/КТ. ПЭТ/КТ — универсальный метод диагностики , незаменим при диссеминированном процессе.
Сколько проводить иммунотерапию?
При метастатическом онкологическом процессе, комбинированная иммунотерапия (Ипилимумаб+Ниволумаб) проводится до 4 курсов суммарно, далее продолжается в поддерживающем монорежиме (Ниволумаб) до прогрессирования заболевания или до признаков непереносимой токсичности.
После радикального хирургического вмешательства иммунотерапия в адъювантном (профилактическом) режиме показана в течение 1 года.
Применяется ли иммунотерапия при метастатической форме рака?
Да, конечно. Иммунотерапия проводится при метастатической форме колоректального рака, гепатоцеллюлярного рака,рака желудка, немелкоклеточном и мелкоклеточном раке легкого, при раке головы и шеи, уротелиальном раке, Лимфоме Ходжкина, раке шейки матки, при меланоме, при тройном-негативном раке молочной железы, при почечно-клеточном раке.
В каких случаях не используется иммунотерапия?
Иммунотерапия на сегодняшний день не применяется при лечении первичных опухолей головного мозга, сарком мягких тканей, рака предстательной железы, гормончувствительных опухолей молочной железы, но несмотря на это, клинические исследования ведутся, и мы очень надеемся на позитивные результаты.
Как пациенты могут попасть к вам на консультацию?
Адрес: Московская область, г. Химки, ул. Панфилова 21/2, Клиник и Лядова.
Читайте также:
