Дефект межпредсердной перегородки с сужением трехстворчатой заслонки. Болезнь Толочинова — Роже
Добавил пользователь Алексей Ф. Обновлено: 15.01.2026
Аномалии проводящей системы сердца. Недостаточность митрального клапана у ребенка
Нарушения проведения раздражений наблюдаются не только при приобретенных заболеваниях сердца. Доказательством врожденного происхождения считается их появление у новорожденных и у детей в тех случаях, когда можно исключить инфекционное происхождение их, но имеется врожденный порок сердца.
При классификации расстройств ритма учитывается способ образования импульсов, его место и в случае неправильного образования импульсов — отношение его в физиологическому образованию импульсов в сердце.
При наличии гетеротопного расстройства образования импульсов различают активное и пассивное гетеротопное образование импульсов.
Полный блок среди врожденных нарушений проведения раздражений встречался редко. Частичный блок иногда отмечался при некоторых врожденных пороках сердца, чаще при дефекте межпредсердной перегородки и высоком дефекте межжелудочковой перегородки (И. Литтманн, Р. Фоно).
Недостаточность митрального клапана у ребенка
Для постановки диагноза приобретенного порока сердца большое значение имеют данные о перенесенных детьми заболеваниях. В большинстве случаев после кардитов (гриппозных и др.) не возникает изменений на створках заслонок (клапанов). Недостаточность и стеноз их наблюдаются после ревмокардита, иногда скарлатины, тонзиллита.
Согласно данным П. Кишша и Д. Сутрели, самой частой формой приобретенных пороков сердца у детей является митральная недостаточность с начинающимся стенозом (46.30% общего числа), затем митральная недостаточность (26,8%), митральная и аортальная недостаточность ((9,1%), аортальная недостаточность (5,45%), митральная и аортальная недостаточность в комбинации с митральным стенозом (5,45%) и другие более редкие комбинации.
Таким образом, митральная недостаточность одна или в комбинаций оказалась в 89.97%, митральный стеноз —в 53.62%, аортальная недостаточность — в 17,27% и аортальный стеноз — в 1,81 % случаев приобретенных пороков.
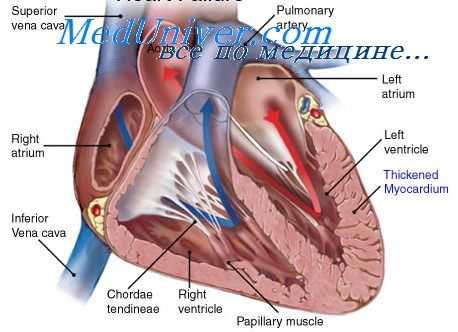
Преобладание пороков двустворчатой заслонки объясняется тем, что на нее ложится самая большая нагрузка гемодинамики, а большая частота недостаточности тем, что у детей еще не успели развиться стенозы.
Следует учесть, что ревматический кардит склонен давать повторные вспышки и поддерживать дальнейшее рубцевание.
Недостаточность двустворчатой заслонки («митральная недостаточность») возникает уже в острой и подострой стадии кардита, поскольку ткань створки быстро погибает при остром бактериальном эндокардите. Створки Рубцовым процессом деформируются, края их неровные, не смыкаются. Сухожильные нити утолщаются, укорачиваются, препятствуют полному закрытию створок.
Нарушается гемодинамика, во время систолы в аорту выводится только часть крови из желудочка, а часть направляется обратно в левое предсердие. В малом круге кровообращения повышается давление, па правый желудочек приходится дополнительная нагрузка. От характера и степени изменения створок заслонки зависпт клиническая картина.
Усиленная работа правого желудочка видна по пульсации в предсердечной и надчревной областях. Верхушечный толчок тоже усплен, может быть смещен кнаружи.
Перкуторно у детей с компенсацией границы тупости сердца не расширены.
Над верхушкой сердца вместо мягкого, меняющегося и жужжащего шума при эндокардите возникает постоянный дующий, немного царапающий систолический шум, появляющийся непосредственно за I тоном (П. Кишш, Д. Сутрелп). В более выраженных случаях ФКГ принимает лентовидную форму. Акцент на II тоне легочного ствола появляется позже, при повышении давления в малом круге кровообращения слышен независимо от перемены положения тела.
В легких случаях ЭКГ не показывает отклонений от нормы. Изменения зубцов Т и интервала S—Т характеризуют состояние миокарда. Со временем появляется P-mitrale или P-sinistrocardiale высокой, широкой, раздвоенной формы.
Рентгенологически при легких формах изменений нет. Одним из ранних признаков считается расширение левого предсердия, а на кимограм-ме — его систолическая экспансия.
Диагноз ставится на основании данных анамнеза, наличия характерного систолического шума, иногда дополняемйх ЭКГ и рентгенологическими данными.
Хорошая адаптация детского сердца вначале практически не понижает работоспособности и активности ребенка. Декомпенсация появляется после вспышки ревмокардита или после интеркуррентных болезней.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Дефект межжелудочковой перегородки
МКБ-10
Общие сведения
Дефект межжелудочковой перегородки (ДМЖП) – отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки – наиболее часто встречающийся врожденный порок сердца (9–25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью - такое состояние характеризуется как единственный желудочек сердца.
Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже - аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации - болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей - приточной, трабекулярной и отточной (инфундибулярной).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже), средний – равен примерно 1/2 диаметра аортального отверстия, большой – равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки - 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки – 10% (приточные, трабекулярные) - расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки - 5% - расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца - «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки - частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) – одно или несколько отверстий в перегородке, разделяющей левую и правую предсердные полости, наличие которых обуславливает патологический сброс крови, нарушение внутрисердечной и системной гемодинамики. В кардиологии дефект межпредсердной перегородки встречается у 5-15% лиц с врожденными пороками сердца, при этом в 2 раза чаще диагностируется у женщин.
Наряду с дефектами межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, дефект межпредсердной перегородки входит в число наиболее часто встречающихся врожденных пороков сердца. Дефект межпредсердной перегородки может являться изолированным врожденным пороком сердца или сочетаться с другими внутрисердечными аномалиями: дефектом межжелудочковой перегородки, аномальным дренажем легочных вен, митральной или трикуспидальной недостаточностью.
Причины дефекта межпредсердной перегородки
Формирование дефекта связано с недоразвитием первичной или вторичной межпредсердной перегородки и эндокардиальных валиков в эмбриональном периоде. К нарушению органогенеза могут приводить генетические, физические, экологические и инфекционные факторы.
Риск развития дефекта межпредсердной перегородки у будущего ребенка существенно выше в тех семьях, где есть родственники с врожденными пороками сердца. Описаны случаи семейных дефектов межпредсердной перегородки в сочетании с атриовентрикулярной блокадой или с недоразвитием костей кисти (синдромом Холта-Орама).
Кроме наследственной обусловленности, к возникновению дефекта межпредсердной перегородки, могут приводить вирусные заболевания беременной (краснуха, ветряная оспа, герпес, сифилис и др.), сахарный диабет и другие эндокринопатии, прием некоторых медикаментов и алкоголя во время беременности, производственные вредности, ионизирующая радиация, гестационные осложнения (токсикозы, угроза выкидыша и др.).
Особенности гемодинамики при дефекте межпредсердной перегородки
Лево-правое шунтирование крови сопровождается увеличением наполняемости малого круга кровообращения, возрастанием объемной нагрузки правого предсердия и усилением работы правого желудочка. Ввиду несоответствия между площадью клапанного отверстия легочной артерии и объемом выброса из правого желудочка, происходит развитие относительного стеноза легочной артерии.
Длительная гиперволемия малого круга кровообращения постепенно приводит к развитию легочной гипертензии. Это наблюдается только тогда, когда легочный кровоток превышает норму в 3 и более раза. Легочная гипертензия при дефекте межпредсердной перегородки обычно развивается у детей старше 15 лет, при поздних склеротических изменениях легочных сосудов. Тяжелая легочная гипертензия вызывает правожелудочковую недостаточность и смену шунта, что проявляется вначале транзиторным веноартериальным сбросом (при физической нагрузке, натуживании, кашле и др.), а затем и стойким, сопровождающимся постоянным цианозом в покое (синдром Эйзенменгера).
Классификация дефектов межпредсердной перегородки
Дефекты межпредсердной перегородки различаются по количеству, размерам и расположению отверстий.
С учетом степени и характера недоразвития первичной и вторичной межпредсердных перегородок соответственно выделяют первичные, вторичные дефекты, а также полное отсутствие межпредсердной перегородки, обусловливающее общее, единственное предсердие (трехкамерное сердце).
Вторичные ДМПП образованы недоразвитием вторичной перегородки. Обычно они имеют небольшие размеры (1-2 см) и располагаются в центре межпредсердной перегородки или в области устьев полых вен. Вторичные дефекты межпредсердной перегородки часто сочетаются с аномальным впадением легочных вен в правое предсердие. При этом типе порока межпредсердная перегородка сохранена в своей нижней части.
Встречаются комбинированные дефекты межпредсердной перегородки (первичный и вторичный, ДМПП в сочетании с дефектом венозного синуса). Также дефект межпредсердной перегородки может входить в структуру сложных ВПС (триады и пентады Фалло) или сочетаться с тяжелыми сердечными пороками - аномалией Эбштейна, гипоплазией камер сердца, транспозицией магистральных сосудов.
Формирование общего (единственного) предсердия связано с недоразвитием или полным отсутствием первичной и вторичной перегородок и наличием большого дефекта, занимающего площадь всей межпредсердной перегородки. Структура стенок и оба предсердных ушка при этом сохранены. Трехкамерное сердце может сочетаться с аномалиями атриовентрикулярных клапанов, а также с аспленией.
Одним из вариантов межпредсердной коммуникации является открытое овальное окно, обусловленное недоразвитием собственного клапана овального отверстия или его дефектом. Однако ввиду того, что открытое овальное отверстие не является истинным дефектом перегородки, связанным с недостаточностью ее ткани, данная аномалия не может быть причислена к дефектам межпредсердной перегородки.
Симптомы дефекта межпредсердной перегородки
Дефекты межпредсердной перегородки могут протекать с длительной гемодинамической компенсацией, а их клиника отличается значительным разнообразием. Выраженность симптоматики определяется величиной и локализацией дефекта, длительностью существования ВПС и развитием вторичных осложнений. На первом месяце жизни единственным проявлением дефекта межпредсердной перегородки обычно служит транзиторный цианоз при плаче и беспокойстве, что обычно связывается с перинатальной энцефалопатией.
При дефектах межпредсердной перегородки средних и больших размеров симптоматика проявляется уже в первые 3-4 мес. или к концу первого года жизни и характеризуется стойкой бледностью кожных покровов, тахикардией, умеренным отставанием в физическом развитии, недостаточным приростом массы тела. Для детей с дефектами межпредсердной перегородки типично частое возникновение респираторных заболеваний - рецидивирующих бронхитов, пневмоний, протекающих с длительным влажным кашлем, стойкой одышкой, обильными влажными хрипами и др., обусловленными гиперволемией малого круга кровообращения. У детей первого десятилетия жизни отмечаются частые головокружения, склонность к обморокам, быстрая утомляемость и одышка при физической нагрузке.
Небольшие дефекты межпредсердной перегородки (до 10-15 мм) не вызывают нарушения физического развития детей и характерных жалоб, поэтому первые клинические признаки порока могут развиться лишь на втором-третьем десятилетии жизни. Легочная гипертензия и сердечная недостаточность при дефекте межпредсердной перегородки формируются примерно к 20 годам, когда возникает цианоз, аритмии, редко – кровохарканье.
Диагностика дефекта межпредсердной перегородки
При объективном обследовании пациента с дефектом межпредсердной перегородки выявляется бледность кожных покровов, «сердечный горб», умеренное отставание в росте и весе. Перкуторно определяется увеличение границ сердца влево и вправо; при аускультации слева от грудины во II-III межреберьях выслушивается умеренно интенсивный систолический шум, который в отличие от дефекта межжелудочковой перегородки или стеноза легочной артерии, никогда не бывает грубым. Над легочной артерией выявляется расщепление II тона и акцентирование его легочного компонента. Аускультативные данные подтверждаются при проведении фонокардиографии.
При вторичных дефектах межпредсердной перегородки ЭКГ-изменения отражают перегрузку правых отделов сердца. Могут регистрироваться неполная блокада правой ножки пучка Гиса, АВ-блокады, синдром слабости синусового узла. Рентгенография органов грудной клетки позволяет увидеть усиление легочного рисунка, выбухание ствола легочной артерии, увеличение тени сердца вследствие гипертрофии правого предсердия и желудочка. При рентгеноскопии обнаруживается специфичный признак дефекта межпредсердной перегородки - усиленная пульсация корней легких.
ЭхоКГ-исследование с цветным допплеровским картированием выявляет лево-правый сброс крови, наличие дефекта межпредсердной перегородки, позволяет определить его величину и локализацию. При зондировании полостей сердца обнаруживается повышение давления и насыщения крови кислородом в правых отделах сердца и легочной артерии. В случае диагностических трудностей обследование дополняется атриографией, вентрикулографией, флебографией яремных вен, ангиопульмонографией, МРТ сердца.
Дефект межпредсердной перегородки следует дифференцировать от дефекта межжелудочковой перегородки, открытого артериального протока, митральной недостаточности, изолированного стеноза легочной артерии, триады Фалло, аномального впадения легочных вен в правое предсердие.
Лечение дефекта межпредсердной перегородки
Лечение дефектов межпредсердной перегородки только хирургическое. Показаниями к кардиохирургической операции служит выявление гемодинамически значимого артериовенозного сброса крови. Оптимальный возраст для коррекции порока у детей - от 1 до 12 лет. Хирургическое лечение противопоказано при высокой легочной гипертензии с веноартериальным сбросом крови, обусловленной склеротическими изменениями легочных сосудов.
При дефектах межпредсердной перегородки прибегают к различным способам их закрытия: ушиванию, пластике с помощью перикардиального лоскута или синтетической заплаты в условиях гипотермии и ИК. Рентгенэндоваскулярная окклюзия дефекта межпредсердной перегородки позволяет закрывать отверстия не более 20 мм.
Хирургическая коррекция дефектов межпредсердной перегородки сопровождается хорошими отдаленными результатами: у 80-90% больных отмечается нормализации гемодинамики и отсутствие жалоб.
Прогноз дефекта межпредсердной перегородки
Малые дефекты межпредсердной перегородки совместимы с жизнью и могут обнаруживаться даже в пожилом возрасте. У некоторых больных с небольшим дефектом межпредсердной перегородки возможно спонтанное закрытие отверстия в течение первых 5-ти лет жизни. Продолжительность жизни лиц с большими дефектами межпредсердной перегородки при естественном течении порока составляет в среднем 35-40 лет. Гибель пациентов может наступить от правожелудочковой сердечной недостаточности, нарушений ритма и проводимости сердца (пароксизмальной тахикардии, мерцательной аритмии и др.), реже — от легочной гипертензии высокой степени.
Пациенты с дефектами межпредсердной перегородки (оперированные и неоперированные) должны находиться под наблюдением кардиолога и кардиохирурга.
Дефект межпредсердной перегородки с сужением трехстворчатой заслонки. Болезнь Толочинова — Роже
Дефект межпредсердной перегородки с сужением трехстворчатой заслонки и с понижением функции правого желудочка — крайне редкая аномалия, при которой правый желудочек находится в рудиментарном состоянии или отсутствует, в кровообращении мало участвует или совсем не участвует.
Отверстие в перегородке предсердий может быть разного размера. Места отхождения магистральных сосудов могут быть разные.
Снижение функции правого желудочка не оказывает вредного влияния на кровообращение плода, и ребенок рождается нормальным. После рождения кровь из правого предсердия направляется в левое предсердие и в левой половине сердца смешивается с венозной кровью. В малый круг кровообращения кровь идет по легочному стволу, исходящему из правого или левого желудочка. Вся нагрузка ложится на левый желудочек.
В случае сильного сужения или атрезии легочного ствола после закрытия артериального протока условия гемодинамики ухудшаются. Цианоз появляется вскоре после рождения, быстро усиливается, сопровождается одышкой. Ребенок погибает обычно в первые недели или месяцы жизни.
Ось ЭКГ уклоняется влево — при единственной форме «синюшной» болезни (при всех остальных формах — вправо).
Рентгенологически форма сердца в передне-заднем направлении напоминает сердце при тетраде Фалло, но отличается расширением контуров влево и нормальным положением верхушки. Тень крупных сосудов узкая, если имеется атрезпя легочного ствола. Дуга праввго желудочка отсутствует, а дуга левого желудочка сильно выпуклая. Рисунок ворот легких резкий.
При ангиокардиографии отсутствует правокардиограмма, рано появляется левокардиограмма. Катетер проходит в левое предсердие, но не попадает в правый желудочек.
Дефект перегородки желудочков описали Толочинов (1874) и Roger (1879). Этот дефект чаще встречается в комбинации с другими аномалиями, особенно группы синих пороков: тетрадой и пентадой Фалло, комплексом Эйзенменгера, общим артериальным стволом, транспозицией магистральных сосудов и др. (рис. 97).
Клинически различают несколько (4) групп или стадий и основные формы: с небольшим отверстием в мышечной части и с большим отверстием в любой части перегородки (Grob). Название болезни Толочинова — Роже относят к первой форме. Третья форма — с гипертензией малого круга кровообращения.
Болезнь Толочинова — Роже с небольшим отверстием перегородки, обычно низким, расположенным в мышечной части.
Сброс крови слева направо отсутствует или незначительный, гемодинамика не нарушена. Характерен жесткий скребущий голосистолический шум, который лучше всего прослушивается у левого края грудины в третьем — четвертом межреберьях. Он часто сопровождается шуршанием, что указывает на место возникновения шума.
Шум проводится вправо и влево, а также в область печени и на спину. В положении лежа шум более сильный (И. Литтманн, Р. Фоно).
Чем меньше отверстие и чем больше сила сердца, тем громче шум. Поэтому на основании интенсивности шума нельзя делать плохой прогноз. Наоборот, при появлении гипертонии в малом круге кровообращения, по мере повышения давления в правой половине сердца шум становится более тихим и коротким (П. Кишш, Д. Сутрели).
Рентгенологически обычно нет изменений, иногда отмечается незначительное увеличение размеров сердца.
При катетеризации сердца давление в правом желудочке нормальное, имеется незначительное повышение насыщенности крови кислородом.
Картина синдрома Толочинова — Роже иногда трудно отличима от картины, наблюдаемой при открытом овальном окне.
Большой дефект межжелудочковой перегородки обычно располагается высоко. При меньших дефектах давление в желудочках до некоторой степенп разделяется, а при больших — выравнивается. В первом случае сброс крови слева направо умеренный, поток в легкие немного или умеренно увеличен. Во втором случае при диастоле значительно повышаются давление и нагрузка правого желудочка, поток крови в легкие сильный и в малом круге повышается сопротивление. Наконец, зарождается обратный сброс крови — справа налево.
У плода данный порок не вызывает нарушений кровообращения, и дети рождаются нормальными. После рождения появляются симптомы, аналогичные симптомам при дефекте межпредсердной перегородки. Слышен громкий, грубый, царапающий голосистолический шум (3/6-5/7) с punctum maximum в третьем — четвертом межреберьях слева парастернально, II тон легочного ствола усилен, обычно удвоен. При дефектах большого размера вследствие нагрузки малого круга кровообращения может появиться одышка и умеренная декомпенсация с увеличением печени, но не бывает цианоза (И. Литтманн, Р. Фоно).
Артериальное давление несколько ниже нормы. ЭКГ редко вполне нормальная, но нет характерных для данной аномалии изменений. ЭКГ позволяет проследить гемодинамику: при небольших дефектах, с небольшим сбросом крови слева направо, ЭКГ может оставаться нормальной. При одновременной гипертрофии левого и правого желудочков можно сделать заключение о гипертензии в малом круге кровообращения.
Изолированная гипертрофия правого желудочка говорит о высокой гипертензии в легких. Сброс слева направо небольшой или сброс обоюдный, или же только справа налево.
Рентгенологическое исследование показывает расширение сердца; дуга легочного ствола выпуклая. Правокардиограмма обычно нормальная. Во время левокардиограммы контрастное вещество одновременно проникает в оба желудочка, с замедлением — в легочные сосуды, но не в правое предсердие.
Катетер сердца иногда попадает в дефект перегородки. Давление и насыщение кпслородом крови в правом желудочке и в легочном стволе повышены, однако остаются ниже давления в левом желудочке.
Дефект межжелудочковой перегородки — болезнь Толочинова — Роже. Диагностика болезни Толочинова-Роже.
Изолированный дефект межжелудочковой перегородки протекает без цианоза, так как давление в левом желудочке выше, чем в правом, и вследствие этого имеется артерио-венозный «шунт». Этот порок сопровождается цианозом только при развившихся осложнениях с гипертонией в малом круге и обусловленной ею перегрузкой правого сердца. При этом симптоматология очень сходна с комплексом Эйзенменгера, однако цианоз редко достигает такой высокой степени (см. стр. 305). Клиническая картина дефекта межжелудочковой перегородки различна в зависимости от того, имеется ли небольшое низко расположенное отверстие (собственно болезнь Толочинова — Роже) или большой, обычно высокий, дефект. В первом случае клинические явления мало выражены и шум Роже не имеет существенного значения («много шума из ничего»), во втором случае речь идет о серьезном заболевании сердца.
Величина дефекта перегородки, по-видимому, не влияет существенно на возникновение цианоза, локализация же его, напротив, имеет значение, так как высоко расположенный дефект может привести к функциональному расщеплению аорты над ним. Многие случаи протекают клинически бессимптомно, но все же ранняя декомпенсация наступает нередко. Одышка при физическом напряжении чаще всего является первым проявлением декомпенсации. Очень часто эти больные стройны (грациозны) и высокого роста.
Аускультативно отмечается характерный громкий грубый систолический шум Роже в области третьего и четвертого межреберии слева у грудины. В некоторых случаях слышен также функциональный диастолическии шум над трехстворчатым клапаном (шум относительного стеноза), иногда бывает также диастолическии шум на легочной артерии. Второй тон на легочной артерии усилен. Пальпаторно обнаруживается дрожание над областью сердца.
Форма сердца может оставаться нормальной, но обычно она изменена вследствие расширения легочной артерии (иногда сильно пульсирующей) й увеличения левого желудочка. Легочные сосуды переполнены кровью.
На ЭКГ у многих больных встречается нарушение внутрижелудоч-ковой проводимости.
В 1/4 случаев развивается затяжной септический эндокардит.
При дифференциальном диагнозе болезни Толочинова — Роже следует учитывать случайные систолические шумы, митральную недостаточность, субаортальный стеноз (стеноз конуса аорты), легкий стеноз легочной артерии и прежде всего дефект межпредсерднои перегородки с открытым боталловым протоком, а также комплекс Эйзенменгера.
Дефект межпредсерднои перегородки.
Дефект межпредсерднои перегородки является наиболее частым врожденным пороком сердца, составляя 15—20% всех врожденных пороков; у женщин встречается в 3 раза чаще, чем у мужчин; прогноз в отношении жизни благоприятен. Цианоз наступает, как правило, только к 25—45 годам. Обычно он не очень выражен, так как артериальная кровь попадает в правое сердце," а шунт справа — налево возникает только в ,том случае, если вследствие повышения давления в легочных сосудах или вследствие сердечной недостаточности давление в правом предсердии превышает давление в левом — поздний цианоз (cyanose tardive). Ток крови через легкие значительно усилен, так как наполнение правого предсердия происходит как из полой вены, так и из левого предсердия, что вместе с пока еще не совсем объяснимым повышением сопротивления в артериолах легких приводит к повышению давления в легочной артерии. Это явление объясняет часто наблюдаемое выбухание дуги легочной артерии (при небольшом или отсутствующем выбухании аорты).
Клинически иногда можно наблюдать расположенный справа сердечный горб. В выраженных случаях рентгенологически наряду с расширением легочной артерии и ее ветвей (усиленная пульсация, «пляска корней») обнаруживается увеличение правого предсердия и желудочка и вместе с тем гипоплазия аорты и небольшой левый желудочек. Артериальное давление в соответствии с недоразвитием левой половины сердца понижено.
Аускультативно часто выслушивается систолический и реже диастолический шум над легочной артерией. Систолический шум, как полагают, возникает в связи с усилением тока крови через устье легочной артерии, что приводит к ее относительному стенозу. Диастолический шум над нижней частью грудины указывает, по-видимому, на относительный стеноз правого венозного отверстия при увеличенном количестве крови, проходящей через него. Иногда диастолический шум очень громок. Второй тон на легочной артерии не акцентуирован, тоны на основании сердца расщеплены на вдохе и выдохе, что имеет большое диагностическое значение. На кривой венного пульса отмечается пресистолическая волна.
При исследовании с помощью кривой разведения краски обнаруживают часто очень незначительный шунт справа — налево, а резко замедленное время разведения отражает наличие шунта слева—направо. Чем больше шунт, тем тяжелее в общем клинические симптомы. Велич'йна шунта может быть установлена с помощью катетеризации сердца или ориентировочно по кривым разведения краски (Hegglin).
На ЭКГ в 95% случаев имеется полная или атипичная блокада правой ножки пучка Гиса, часто находят измененный зубец Р, в 10—20% встречается мерцание предсердий.
Для подтверждения диагноза эффективны новейшие методы исследования. При катетеризации сердца нередко зондом удается попасть из правого предсердия в левое. По сравнению с полыми венами насыщение крови кислородом в правом предсердии велико, оно повышается, например, с 60 до 80%. В результате лучшего смешивания с венозной кровью в желудочке и легочной артерии оно несколько снижается, оставаясь, однако, повышенным по сравнению со средним насыщением. При измерении давления наибольшая величина его обнаруживается в предсердии — около 40 мм ртутного столба при норме около 5 мм.
В отличие от других врожденных пороков сердца затяжной септический эндокардит присоединяется очень редко.
Имеется определенная связь с изменениями в других органах: арахно-дактилия, смещение хрусталика, высокое нёбо, куриная грудь (см. синдром Марфана).
Читайте также:
- Метастазы плоскоклеточного рака в лимфоузлы добавочной цепи - лучевая диагностика
- Диагностика и лечение озены. Хронический катар глотки
- Примеры офтальмотоксокароза симулирующего ретинобластому
- Метаболизм гормонов в простате. Обмен тестостерона в предстательной железе
- Гемимегалэнцефалия - клиника, диагностика
