Гемимегалэнцефалия - клиника, диагностика
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Диагностика гемимегалэнцефалии на МРТ, КТ
а) Терминология:
1. Сокращения:
• Гемимелагэнцефалия (ГМЭ)
2. Синонимы:
• Термин ГМЭ несколько некорректен, поскольку при данной патологии поражается не полностью все полушарие (так называемая геми-гемимелагэнцефалия)
• Диспластическая мегалэнцефалия (обобщение всех форм сегментарного увеличения объема головного мозга вследствие его чрезмерного роста в сочетании с кортикальной дисплазией)
3. Определение:
• Гамартоматозное увеличение объема большей части/всего полушария головного мозга вследствие его чрезмерного роста
• Дефект клеточной организации, миграции нейронов
б) Визуализация:
1. Общие характеристики гемимегалэнцефалии:
• Лучший диагностический критерий:
о Легкое, умеренное или выраженное увеличение всего диспластичного полушария головного мозга или его части:
- Дисплазия коры полушарий головного мозга (обычно в сочетании с диффузной или перисильвиевой полимикрогирией)
- Аномалии белого вещества
о Смещение задних отделов серпа мозга
о Увеличение бокового желудочка в сочетании с аномальной формой (заострением) переднего рога
• Локализация:
о Любая доля (наиболее часто лобная):
- Увеличение размеров ипсилатерального полушария мозжечка встречается нечасто
• Размеры:
о Увеличение размеров обычно значительное, но может быть и невыраженным
• Морфология:
о Вариабельна: от лиссэнцефалии до полимикрогирии
2. КТ при гемимегалэнцефалии:
• Бесконтрастная КТ:
о Большое полушарие головного мозга, 1 /2 мозгового черепа
о «Отклонение» задних отделов серпа мозга и полюса затылочной доли в контрлатеральную сторону о Увеличение бокового желудочка с аномальной конфигурацией переднего рога
о Дистрофическая кальцификация белого вещества (БВ) или утолщение коры
• КТ с контрастированием:
о Часто отмечается увеличение размеров сосудов
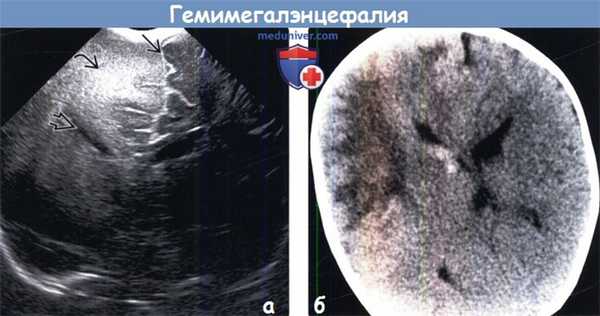
(а) УЗИ, корональный срез: у новорожденного с судорожным синдромом определяется увеличение размеров правого полушария в сочетании с повышением эхогенности БВ и аномальным заострением переднего рога правого бокового желудочка. Межполушарная борозда латерально дислоцирована.
(б) Бесконтрастная КТ, аксиальный срез: у этого же пациента определяется выраженное увеличение размеров правого большого полушария и ипсилатеральной части свода черепа в сочетании с аномальной гиподенсностью БВ лобной и передних отделов теменной областей.
4. УЗИ:
• В-режим:
о Диагноз может быть поставлен как у плода, так и у новорожденного
5. Радионуклидная диагностика:
• ПЭТ:
о Гипометаболизм глюкозы в 50% случаев
• ОФЭКТ:
о Увеличение (во время судорог) или уменьшение поглощения меченного вещества на стороне аномалии
6. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о Мультипланарная МРТ
• Советы по протоколу исследования:
о Для документирования аномалии в полной степени ее выраженности может потребоваться визуализация в динамике:
- Зоны аномалий становятся более хорошо визуализируемыми при миелинизации нормальных областей
о Аномальный сигнал от БВ может быть лучшим индикатором протяженности аномалии
о Состояние контрлатерального полушария является ключевым фактором в выборе клинической тактики
(а) МРТ, Т1-ВИ, аксиальный срез: у этого же пациента определяется увеличение размеров правого большого полушария с заметным смещением серпа мозги межполушарной борозды влево. Передний рог ипсилатерального бокового желудочка заострен. Кроме того, наблюдается понижение сигнала от БВ измененного полушария.
(б) МРТ, Т2-ВИ, аксиальный срез: у этого же пациента определяется увеличение объема БВ правого полушария и повышение сигнала от него по сравнению с противоположной стороной. Визуализируются диспластичность вышележащей коры, а также нечеткость границы между серым и белым веществом. (а) МРТ, последовательность инверсия-восстановление (IR), аксиальный срез: аномальная морфология коры всего полушария. Определяется полимикроги-рия лобной и височной областей, в то время как кора теменной и затылочной областей утолщена, а извилины сглажены.
(б) МРТ, Т2-ВИ, корональный срез: у этого же пациента отмечается значительное различие размеров правого и левого больших полушарий. Такие изменения характерны для классической гемимегалэнцефалии. (Courtesy Р Rodriguez, MD.)
в) Дифференциальный диагноз:
1. Фокальная кортикальная дисплазия 2 тип:
• Небольшие или протяженные области с размытостью границы между серым и белым веществом
• Участки гиперинтенсивного сигнала от нижележащего белого вещества; изменения часто более протяженные, чем определяются при МРТ
2. Энцефалит Расмуссена:
• Односторонний энцефалит с прогрессирующей атрофией
• Поражение практически всегда одностороннее
3. Туберозный склероз (ТСК):
• ГМЭ лобной доли или всего большого полушария = случайное проявление
• Тяжелая нагрузка туберсами может имитировать ГМЭ
о Двустороннее распространение
4. Глиоматоз головного мозга:
• Глиома с диффузной инфильтрацией
• Редко у детей:
о Чаще мультицентричные глиомы
д) Патология:
1. Общие характеристики гемимегалэнцефалии:
• Этиология:
о Аномальные пролиферация, миграция и дифференцировка нейронов
о Эмбриология:
- Нарушение в функции знака «стоп» в процессе пролиферации нейронов, глии в герминальных матриксах
- Приводит к пролиферации чрезмерного количества клеток всех типов:
Вариабельные паттерны чрезмерного роста отражают соматический мозаицизм в проявлении мутаций
• Генетика:
о ГМЭ является прототипом инфантильный таупатии:
- Нейропатологическая тетрада:
Дисморфизм и макроцитоз нейронов
Активация сигнального пути mTOR (приводит к чрезмерному росту нормальных/аномальных клеток)
Постзиготный соматический мозаицизм (мутации имеют только некоторые клетки; отсутствие аномалий в некоторых/многих частях головного мозга)
Позитивная регуляция фосфорилированного тау-белка
о ГМЭ и фокальная кортикальная дисплазия (ФКД2б) могут являться одной и той же аномалией с различными сроками возникновения соматической мутации в митотических циклах нейроэпителия:
- Различие в распространенности, степени выраженности развивающейся аномалии головного мозга
- ФКД2б является анатомически «трансмантийной дисплазией», обычно изолированной
- ГМЭ включает в себя все полушарие, квадрант или крупную часть конечного мозга:
Часто происходит поражение ипсилатеральной обонятельной луковицы, базальных ганглиев, диэнцефальных структур, а также связанных с ними мозговых оболочек, кровеносных сосудов, черепных нервов
Увеличение в размерах ипсилатерального отдела ствола мозга, увеличение в размерах/дисплазия мозжечка
• Ассоциированные аномалии:
о ГМЭ может быть изолированной аномалией или может сочетаться с нервно-кожными синдромами:
- Самые распространенные: синдромы эпидермального невуса (в т.ч. синдром Протея)
2. Макроскопические и хирургические особенности:
• Большие размеры полушария, малая глубина борозд, слияние и дезорганизация извилин
• Регионарные полимикрогирия, пахигирия и гетеротопии
3. Микроскопия:
• Микроскопические признаки ГМЭ идентичны таковым при ТСК, ФКД2а
е) Клиническая картина гемимегалэнцефалии (ГМЭ):
1. Проявления:
• Наиболее частые признаки/симптомы:
о Судороги, задержка развития
о Макрокрания
• Другие признаки/симптомы:
о Гемипарез, гемигипертрофия
• Клинический профиль:
о Наиболее частый = новорожденный/младенец с тяжелой формой эпилепсии
о Часто наблюдаются тяжелая задержка развития и контрлатеральный гемипарез
2. Демография:
• Возраст:
о Обычно диагностируется в течение первого года жизни
• Эпидемиология:
о 3% кортикальных дисплазий, которые диагностируются методами визуализации
3. Течение и прогноз:
• Некупируемые судороги с прогрессирующим гемипарезом
• Неблагоприятный исход → некупируемые судороги и задержка развития
4. Лечение:
• Противосудорожные препараты обычно неэффективны
• Применение ингибитора mTOR эверолимуса является потенциальным методом лечения
• Анатомическая или функциональная гемисферэктомия:
о Сперва необходимо подтвердить, что контрлатеральное полушарие в норме
о При анатомической гемисферэктомии может потребоваться шунтирование хирургической полости:
- Высокий риск недостаточности шунта
е) Диагностическая памятка:
1. Обратите внимание:
• Возможна атрофия аномального полушария (при хроническом судорожном приступе)
2. Советы по интерпретации изображений:
• При МРТ в динамике наблюдается выраженное изменения характеристик сигнала вследствие миелинизации
• Гемимелагэнцефалия является единственным состоянием, при котором увеличение объема паренхимы мозга сочетается с увеличением объема ипсилатерального желудочка
3. Советы по отчетности:
• Цели визуализации → идентификация/количественная оценка изменений, выявление аномалий развития контрлатеральных структур
Гемимегалэнцефалия - клиника, диагностика
Гемимегалэнцефалия является сложной патологией, которая включает в себя нарушения пролиферации, миграции и патологическую дифференцировку. Этот процесс может затронуть только головной мозг или и мозг и мозжечок. Причина одностороннего поражения до сих пор неясна (Flores-Sarnat et al., 2003). Возможно распространение процесса на противоположную сторону, что обязательно учитывается при решении о хирургическом вмешательстве (Chugani, 1996).
В некоторых исследованиях показано, что повреждение противоположного полушария может быть следствием нарушения циркуляции мозгового кровотока (Soufflet et al., 2004) и двустороннего насыщения кислородом (Alfonso et al., 2004), поэтому предполагается, что раннее оперативное вмешательство позволит избежать ухудшения. Структура извилин на стороне повреждения изменена, напоминая пахигирическую или полимикрогирическую кору (Friede, 1989).
Микроскопические исследования (Robain et al., 1988, Flores-Sarnat, 2002, Flores-Sarnat et al., 2003, Salamon et al., 2006) показали диффузное утолщение коры с нагромождением серого вещества и отсутствием ламинарной организации. Дезориентированные нейроны имели широкий разброс. Bosnian et al. (1996) выявили нормальное эуплоидное ДНК. В некоторых случаях обнаруживали очаговые гетеротопии серого вещества. Часто присутствовали гигантские нейроны (Bosman et al., 1996, Salamon et al., 2006); клетки, подвергшиеся баллонной дистрофии, определялись в 50% случаев. Barkovich и Chuang (1990) обнаружили аномалии миграции в 11 из 12 случаев. В одном случае присутствовал гамартоматозный процесс.
Клинические проявления включают различную степень умственной отсталости и судорог, нередко встречаются инфантильные спазмы или так называемый синдром Отахара ассоциированный с очаговыми приступами. Присутствует гемипарез. Наводящее на мысль о гемимегалэнцефалии данные ЭЭГ включают вспышки-подавления активности, альфа-подобную активность, напоминающую таковую при агирии-пахигирии или повторяющиеся трехфазные комплексы (Paladin et al., 1989, Konkol et al., 1990, Vigevano et al., 1996).

КТ, а особенно MPT подтверждают диагноз, показывая утолщение коры с несколькими бороздами, отсутствие или патологическую оперкулярную кору и часто изменения со стороны белого вещества на пораженной стороне (Robain et al., 1988, Hartley et al., 2002). Позитронно-эмиссионная томография (ПЭТ) была использована для выявления поражения противоположного полушария (Chugani, 1996).
Гемимегалэнцефалия может быть изолированной. Нередко это часть синдрома гемигипертрофического разрастания половины лица совместно с кожной или иной гамартоматозной патологией, такой как синдром линейного невуса, синдрома Баннаян-Райли-Рувалькаба или синдрома Протея и синдрома Коудена (глава 3). Нейрофиброматоз в половине случаев сопровождается макроцефалией (Ross et al., 1989).
Судороги у пациентов с гемимегалэнцефалией часто плохо поддаются медикаментозной терапии (Pelayo et al., 1994, Devlin et al., 2003). Гемисферэктомия может помочь контролировать судороги в более 85% случаев (Di Rocco, 1996).
Другие нарушения пролиферации, дифференцировки и апоптоза включают такие важные состояния как туберозный склероз и относящиеся к нему синдромы; они описаны в отдельной статье на сайте.
Макроцефалия, мегалэнцефалия - клиника, диагностика. Отличия макроцефалии от гидроцефалии
У 75% из них наблюдалась гидроцефалия и повышенное внутричерепное давление, у 3% — специфические синдромы и у 20% отмечалась первичная мегалэнцефалия с нормальным давлением. Только у 13% из последней группы развилась умственная отсталость или неврологические отклонения. Основные диагностические критерии — гидроцефалия или перицеребральные скопления, поскольку они делают необходимым немедленное лечение.
Соотношение мальчиков и девочек 4:1, а у 50% пациентов макроцефалия отмечается в семейном анамнезе.
Макроцефалия представлена двумя основными группами: мегалэнцефалия и гидроцефалия с перицеребральным скоплением. Последняя группа описана в отдельной статье на сайте.

Мегалэнцефалия. Под мегалэнцефалией подразумевается увеличение массы мозга. Некоторые авторы (Friede, 1989) отделяют пациентов с большими размерами головы, но нормальным процессом развития и функционирования нервной системы, от случаев «истинной» мегалэнцефалии, т.е. существенного увеличения мозга по сравнению с возрастной нормой. Только последняя группа принадлежит к расстройствам развития мозга. Это различие несколько преувеличено, так как большая голова — и даже тяжелый мозг при аутопсии — нередко встречается у нормальных лиц или в сочетании с заболеваниями, такими как нейрофиброматоз, без каких-либо признаков мозговой дисфункции.
Предметом описания в данной главе будет истинная мегалэнцефалия с чрезмерными размерами мозга, связанными с патологией развития, что вызывает как увеличение числа невральных элементов, так и невральных и глиальных, или нарушение миграции и организации (Friede 1989); оба типа аномалии часто сосуществуют. Во многих случаях также выявляют гигантские патологические клетки, напоминающие таковые при туберозном склерозе и свидетельствующие о нарушении клеточной пролиферации. Причиной могут быть и иные патологические процессы, к примеру, патологическое накопление или рост отсуствующих в норме не-невральных элементов, как при болезни Александера. Структура извилин в таком мозге часто изменена.
Даже при строгом определении мегалэнцефалия включает несколько отличающихся патологических и клинических форм. Она может быть частью специфических синдромов, таких как синдром Сотоса или многочисленных нейрокожных синдромов, таких как макроцефалия-мраморная кожа (Giuliano et al., 2004), или может быть изолированной. Механизм мегалэнцефалии в настоящее время плохо понятен. Нарушена регуляция клеточной пролиферации субопухолевого (гамартоматозного) происхождения, либо диффузного, либо более локализованного, что в некоторых случаях трудно дифференцировать от ганглиоглиом. Повышенный уровень инсулиноподобного фактора роста (ИФРII) был выявлен в мозге новорожденных с макроцефалией вместе с сильно нарушенным развитием неокортекса (Schoenle et al., 1986).
Клинические проявления крайне различаются, зачастую они могут отсутствовать совсем. У большинства пациентов отмечают задержку умственного развития и у многих — судороги и диффузные неврологические симптомы.
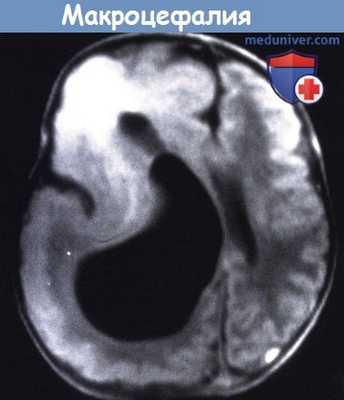
Т1 - взвешенное изображение МРТ пациента в возрасте пяти месяцев.
Большое правое полушарие, с патологически утолщенной корой и несколькими бороздами.
Значительно увеличенный желудочек и аномальный сигнал от лобного белого вещества.
Дифференциальный диагноз может быть трудным. Гидроцефалия и внутричерепные скопления должны быть исключены, поскольку требуют хирургического лечения. Дифференцировка мегалэнцефалии от больших размеров головы у детей с нормальным или практически нормальным развитием нервной системы обычно не вызывает затруднений. Однако такие дети составляют большую гетерогенную группу. У большинства из них, вероятно, большие размеры головы генетически детерминированы. Lorber и Priestley (1981) обнаружили высокую частоту макроцефалии у родителей, особенно отцов таких детей.
De Myer (1972) и Day и Schutt (1979) также предположили доминантный тип передачи «простой» макроцефалии. Некоторые из этих макроцефалических детей имели специфические нарушения способности к обучению, превышающие показатели детей с нормальным размером головы. Скорость увеличения размеров головы особенно высока у детей до четырех месяцев жизни (De Myer, 1972, Lorber и Priestley, 1981). На этой стадии часто возникают подозрения на гидроцефалию и, если темпы прироста быстро не снижаются, показана рентгенография. При отсутствии какой-либо патологии развития нервной системы и большого размера головы в семейном анамнезе не требуется ничего, кроме внимательного наблюдения. Однако необходимо исключить возможность пресимптоматической глутаровой ацидурии (Hoffmann et al., 1991) или другой органической ацидурии, часто сопровождающих макроцефалию.
У детей с долихоцефалией (синостоз сагиттального шва) важную роль играет форма черепа, потому что при выраженном удлинении черепа окружность головы у таких пациентов часто 3 СО и выше среднего, но сама по себе форма черепа вызывает подозрения. У маленьких детей с перинатальными заболеваниями или более старших, имеющих проблемы в питании, «догоняющий» рост временно осложняет диагностику (Sher и Brown, 1975). Нейровизуализацию необходимо выполнить в случаях выраженных расходящихся изгибов головы или при наличии симптомов повышенного внутричерепного давления.
Лечения мегалэнцефалии не существует, а в большинстве случаев в нем нет необходимости.
Институт детской неврологии и эпилепсии
ИДНЭ (с 2006 года), ИДВНЭ (с 2016 года), ЦЗиР (с 2017) и ОЦМУ (с 2019) им. Святителя Луки
Гемимегалэнцефалия
Внедрение магнитно — резонансной томографии (МРТ) в клиническую практику позволило значительно расширить список прижизненно (в последнее время и антенатально) выявляемой патологии, как приобретенного, так и врожденного характера, в том числе, дисплазий головного мозга (ДГМ) (Chugani H.T., Sankar R., 1993). ДГМ являются «идеальной эпилептической моделью», учитывая, что причиной развития приступов становится изначально порочный морфологический субстрат, не претерпевающий каких-либо изменений от рождения до гибели пациента, в отличие от симптоматических форм эпилепсии, индуцированных опухолями, травмами или инфекциями. Guerrini (2003), обобщая богатый клинический опыт изучения детских форм эпилепсии, сообщает, что на долю ДГМ приходится до 40% всех резистентных случаев.
Гемимегалэнцефалия (ГМЭ) или унилатеральная мегалэнцефалия — дисплазия головного мозга, обусловленная унилатеральными нарушениями нейронной миграции и пролиферации, результатами которых является одностороннее диспластическое увеличение одной из гемисфер (В.А. Чадаев и соавт., 2003). Гемимегалэнцефалия может встречаться как изолированный порок, так и сочетаться с гемигипертрофией всего тела — синдром Клиппель-Треноне-Вебера (Anlar B. и соавт., 1988); нейрокожными синдромами: протеуса, линейного невуса, эпидермального невуса, гипомеланоза Ито, нейрофиброматоза, туберозного склероза (De Lone D.R. и соавт., 1999; Sasaki M. и соавт., 2000).
Облигатным признаком ГМЭ является чрезмерное развитие одной гемисферы при нормальных размерах другой. Нарушение устройства рисунка извилин (сулькации) может быть представлено участками коры с увеличенными, утолщенными (пахигирия) или удлиненными и истонченными (полимикрогирия) зонами. В гипертрофию обычно вовлекаются глубинные структуры полушарий, реже мозжечок. Гемигипертрофия ствола мозга или спинного мозга является редкостью (Tuxhorn I. и соавт., 1997). Диспластические нарушения могут обнаруживаться и в контралатеральном «здоровом» полушарии.
Микроскопический анализ ГМЭ констатирует аномальное развитие обеих гистологических составляющих: нейрональной и глиальной (Barcovich A.J. и соавт., 1990). Нейрональные миграционные изменения заключаются в грубых нарушениях горизонтальной кортикальной организации (дисламинация), нечеткости серо-белой демаркации, аномально расположенных нейрональных скоплениях (гетеротопии). Глиальные нарушения выявляются в 50% случаев и заключаются в увеличенном количестве гипертрофированных (в том числе за счет повышенного количества ДНК) глиальных клеток (Manz H.J. и соавт., 2000).
Диагноз ГМЭ в современных условиях устанавливается, в подавляющем большинстве случаев, при МРТ исследовании головного мозга. МРТ у больных с ГМЭ выявляет асимметрию гемисфер за счет диффузно увеличенного, аномального полушария. Характерна вентрикуломегалия диспластичной гемисферы. В Т2 — режиме выявляется интенсивный сигнал в белом веществе — результат сочетания глиоза и участков гипомиелинизации.
Материал и методы. Нами обследовано 4 больных ГМЭ в возрасте от 5 до 7 лет; 2 мальчика и 2 девочки (табл. ). Проводилось неврологическое обследование, рутинная ЭЭГ, видео – ЭЭГ мониторинг с включением сна (6-12 часов исследования), магнитно – резонансная томография (МРТ) с напряженностью поля 1,5 Tsl. Целью исследования было изучение клинических, электроэнцефалографических и нейровизуализационных характеристик больных гемимегалэнцефалией. Особое внимание уделялось характеристики симптоматической фокальной эпилепсии при ГМЭ: возраст дебюта приступов, их характеристика, динамика течения.
Результаты исследования. Среди обследованных нами пациентов, ГМЭ встречалась как изолированный порок развития в 3 случаях и в 1 – в сочетании с гипертелоризмом, потребовавшим хирургической коррекции в раннем детском возрасте. В 2 случаях ГМЭ локализовалась слева (доминантная гемисфера) и в 2 – справа (субдоминантная гемисфера).
Во всех случаях ГМЭ проявлялась триадой симптомов: центральным гемипарезом, умственной отсталостью и эпилептическими приступами. Однако степень выраженности данных неврологических проявлений была весьма различной. В неврологическом статусе у пациентов с ГМЭ контралатерально пораженной гемисфере отмечался центральный гемипарез с преимущественным нарушением моторики кисти. Выраженный гемипарез констатировался в 1 наблюдении, умеренный – 1 и легкий гемипарез с нарушением мелкой моторики — в 2 случаях. Двигательный дефицит был заметен у 2 пациентов практически сразу после рождения, а у оставшихся 2 – только после 3-4 мес. жизни. Задержка психического развития обращала на себя внимание после к 4-6 мес. жизни. У 1 пациента развилась тяжелая умственная отсталость, и в 3 случаях – легкая. Степень выраженности моторного и интеллектуального дефицита четко коррелировала с возрастом дебюта эпилептических приступов. Максимально неврологические нарушения были выражены у пациентки с ранним дебютом эпилепсии (до 6-и мес.) (табл. ).
Дебют эпилептических приступов у всех пациентов наступал в возрасте до 1 года (2-11 мес.). В 2 случаях заболевание манифестировало с инфантильных спазмов, в 2 – с фебрильных судорог (1 – типичные и 1 – атипичные с фокальным компонентом и постприступным парезом). Для инфантильных спазмов была характерна выраженная асимметрия в кинематике приступов с большим участием конечностей на контралатеральной дисплазии стороне. У одной из наших пациенток с ГМЭ (Б.О.), эпилептические приступы дебютировали на 2-ом мес. жизни с тонических экстензорных спазмов; на ЭЭГ регистрировался паттерн «разряд – угнетение». Таким образом, у данной больной наблюдалась электро – клиническая картина синдрома Отахара. В дальнейшем присоединились фокальные моторные, миоклонические и миоклонически — астатические приступы. После 1 года инфантильные спазмы во всех случаях трансформировались в фокальные моторные приступы.
Спектр эпилептических приступов при ГМЭ был разнообразен; в большинстве случаев у больных наблюдалось сочетание различных типов приступов. Преобладающим видом приступов были гемиклонические пароксизмы (3 пациента), миоклонические (3), миоклонически – астатические (2) и вторично – генерализованные (2). В 1 случае преобладали ночные тонические аксиальные приступы, в 1 – фокальные атонические пароксизмы (негативный миоклонус) в руке контралатеральной ГМЭ и в 1 – атипичные абсансы. Аутомоторные приступы отсутствовали.
Характерной особенностью у больных ГМЭ была высокая частота провокации приступов лихорадкой (3 пациента), причем в 2 случаях заболевание дебютировало с фебрильных судорог. У 2 больных после гемиклонических приступов усиливался парез в конечностях.
Основная активность фоновой записи при ЭЭГ исследовании была замедлена в 2 случаях и представлена нерегулярным альфа ритмом частоты 8 Гц в оставшихся 2-х. Для всех больных ГМЭ в нашем исследовании было характерно наличие продолженного замедления, латерализованного по пораженной гемисфере, с максимумом по лобным отведениям. Также во всех случаях регистрировалась пик – волновая эпилептиформная активность: латерализованная по дефектной гемисфере (2 случая), преимущественно бифронтальная (1) и преимущественно диффузная (1). У 2 больных регистрировался на ЭЭГ феномен вторичной билатеральной синхронизации (рис. ). Индекс эпилептиформной активности резко нарастал в фазу медленного сна, и в 2 случаях латерализованная пик – волновая активность приобретала характер постоянной продолженной (рис. ), периодически образуя диффузные разряды. При этом наблюдалась значительная редукция физиологических паттернов сна (сонные веретена, К-комплексы, POSTs, вертекс потенциалы). В одном случае (пациентка Б.О.) с ранним дебютом приступов (в 2 мес.) на ЭЭГ констатировались вспышки высокоамплитудных медленных волн и пик-волн, чередующихся с периодами угнетения биоэлектрической активности длительностью до 3 сек. – паттерн «разряд-угнетение» (рис. ).
МРТ исследование было ведущим в верификации синдрома ГМЭ.
Неожиданным был результат, полученный при медикаментозном лечении больных ГМЭ. Применялись препараты вальпроевой кислоты (депакин – хроно), ламиктал, финлепсин – ретард, клоназепам. В 2 случаях применялась политерапия с включением депакина как базового антиэпилептического препарата (АЭП), в 1 – монотерапия депакином и в 1 – монотерапия финлепсином. В 3 случаях из 4 удалось добиться стойкой медикаментозной ремиссии с катамнестическим наблюдением от 1,5 до 2,5 лет. У наиболее тяжелой пациентки Б.О. с ранним дебютом эпилепсии, выраженным гемипарезом и умственной отсталостью, удалось снизить частоту приступов на 50%.
Вместе с тем, ни в одном случае не удалось добиться «электрической ремиссии», то есть нормализации ЭЭГ. Правильно подобранная терапия АЭП приводила к снижению индекса эпилептиформной активности, в ряде случаев к блокированию диффузных разрядов, однако пик – волновые паттерны продолжали регистрироваться на ЭЭГ, несмотря на длительную ремиссию приступов.
- Наличие триады клинических признаков, разной степени выраженности: центральный гемипарез, умственная отсталость, эпилептические приступы.
- Ранний дебют эпилепсии (во всех случаях до 1 года).
- Наличие полиморфных приступов. Сочетание фокальных (гемиклонические, фокальные моторные, вторично – генерализованные судорожные) и псевдогенерализованных приступов (миоклонические, миоклонически – астатические, атипичные абсансы, атонические).
- В 75% случаев приступы провоцировались лихорадкой.
- На ЭЭГ характерным было сочетание продолженного регионального замедления и латерализованной эпилептиформной активности (нередко с диффузным распространением) с нарастанием в фазу медленного сна.
- Плохими прогностическими признаками развития заболевания являлись ранний дебют эпилепсии, полиморфизм приступов, выраженное снижение интеллекта, наличие феномена вторичной билатеральной синхронизации на ЭЭГ.
- В 75% случаев приступы были купированы адекватно подобранными АЭП. Однако нормализации ЭЭГ не было достигнуто ни у одного пациента.
Таким образом, для ГМЭ оказалось характерна полиморфная клиническая картина с разной степенью выраженности двигательных и когнитивных нарушений. Небезынтересно, что, несмотря на обширные изменения коры головного мозга по данным МРТ, лишь у 1 больной отмечался выраженный гемипарез и умственная отсталость тяжелой степени. Именно у этой пациентки был наиболее ранний дебют эпилептических приступов (в возрасте 2 месяцев). По мнению Vigevano и соавт. (1997), степень неврологических нарушений у больных ГМЭ может быть различной: от глубокой инвалидизации до легких, часто незаметных без специального нейропсихологического тестирования. Сhugani H.T. и соавт. (1993) также установили, что тяжесть клинических нарушений коррелирует со сроками дебюта эпилептических приступов.
Таблица 1. Характеристика обследованных нами больных гемимегалэнцефалией.
Фокальная корковая дисплазия
Фокальная корковая дисплазия — аномалия структуры коры головного мозга, затрагивающая её ограниченный участок. Клинически проявляется фокальными двигательными эпиприступами с потерей сознания, но небольшой продолжительностью. Диагностируется неврологом или эпилептологом по данным ЭЭГ, специально проведённого МР-сканирования, субдуральной электрокортикографии, ПЭТ головного мозга. Как правило, эпилепсия при корковой дисплазии устойчива к проводимой противоэпилептической терапии. Альтернативным методом лечения выступает нейрохирургическая резекция участка дисплазии.
Общие сведения
Фокальная корковая дисплазия (ФКД) — возникшее в период внутриутробного развития локальное нарушение в строении мозговой коры. Является самым частым этиофактором развития эпилепсии у детей. По данным международного исследования ILAE (2005 г.) ФКД была диагностирована у 31% детей с эпилепсией. Отличительными особенностями эпилептических пароксизмов при ФКД являются: устойчивость к проводимой противоэпилептической терапии, агрессивное течение с развитием у детей задержки психического развития и эпилептической энцефалопатии, эффективность нейрохирургических способов лечения.
Локальные диспластические изменения коры располагаются преимущественно в височных и лобных долях. Они слабо заметны на макроскопическом уровне, что затрудняет диагностику ФКД даже при помощи таких современных методов нейровизуализации как МРТ. Проблемы диагностики ФКД особо актуальны в практической неврологии и педиатрии, поскольку её выявление как причины эпилептических пароксизмов имеет решающее значение для выбора эффективной лечебной тактики в отношении резистентных форм эпилепсии.
Причины фокальной корковой дисплазии
ФКД обусловлена нарушением окончательных этапов развития церебральной коры (кортикогенеза) во внутриутробном периоде. В результате нарушений миграции и дифференцировки клеток коры образуется участок с аномальными нейронами, патологической утолщенностью, уплощенностью извилин или изменённой архитектоникой (появлением клеток, типичных для одного слоя, в другом слое коры). Формирование фокальной корковой дисплазии происходит незадолго до родов — за 4-6 недель до окончания периода внутриутробного развития. Более тяжёлые формы пороков мозговой коры (например, полимикрогирия, гемимегалэнцефалия) связаны с нарушениями конца 2-го начала 3-его триместра беременности.
Нельзя исключить генетическую природу ведущего к ФКД сбоя в кортикогенезе. Так, у многих пациентов обнаружены изменения в гене TSC1, которые также наблюдаются при туберозном склерозе. В настоящее время проводятся международные исследования по поиску генетического субстрата корковых дисплазий.
Классификация фокальной корковой дисплазии
До недавнего времени выделяли 2 основных типа ФКД. В 2011 г. была разработана новая классификация, в которую включён 3-й тип, ассоциированный с другим основным поражением церебральных структур. Согласно этой классификации выделяют:
ФКД I типа — локальное нарушение архитектоники коры: радиальное (IA), тангенциальное (IB) или смешанное (IC). Выявляется у 1,7% обследованных практически здоровых людей.
ФКД II типа — очаговое нарушение цитоархитектоники с наличием аномальных нейронов (IIA) и так называемых баллонных клеток (IIB). Как правило, дисплазия затрагивает лобные доли.
ФКД III типа — вторичное нарушение корковой архитектоники, обусловленное другой патологией: мезиальным темпоральным склерозом (IIIA), глиальной опухолью (IIIB), мальформацией сосудов головного мозга (IIIC) или другими нарушениями (IIID) — энцефалитом Расмуссена, нейроинфекцией, посттравматическими или постишемическими изменениями и пр.
Симптомы фокальной корковой дисплазии
Ведущим клиническим проявлением ФКД выступает фокальная эпилепсия. Как правило, она манифестирует в детском возрасте. Эпилептические пароксизмы отличаются своей кратковременностью — длятся не более минуты. Среди них преобладают сложные (с расстройством сознания) фокальные моторные приступы, зачастую с автоматизмами в начальном периоде пароксизма. Спутанность сознания в постприступный период выражена незначительно. Характерны двигательные феномены и внезапные падения. Вторичная генерализация эпиприступов происходит заметно быстрее, чем при височной эпилепсии.
Возраст дебюта эпилепсии и сопутствующая клиническая симптоматика зависят от типа, выраженности и расположения очага корковой дисплазии. Ранняя манифестация аномалии обычно сопровождается задержкой психического развития ребёнка и когнитивными нарушениями.
ФКД I типа имеет менее тяжёлое течение и не всегда проявляется эпиприступами. У ряда пациентов она приводит к затруднению в познавательной деятельности и проблемам в обучении. ФКД II типа сопровождается тяжёлыми парциальными и вторично генерализованными эпиприступами. У многих пациентов наблюдается эпилептический статус. Клиника и течение ФКД III типа зависит от характера основной патологии.
Диагностика фокальной корковой дисплазии
Основной метод диагностики ФКД — магнитно-резонансная томография. Она должна выполняться по специальному протоколу с толщиной срезов 1-2 мм. Только такое тщательное сканирование способно выявить минимальные структурные изменения мозговой коры. В МРТ диагностике корковой дисплазии имеет значение опыт и квалификация рентгенолога. Поэтому при необходимости результаты исследования следует показать более опытному в этом вопросе специалисту.
К МРТ признакам ФКД относятся: локальная гипоплазия или утолщение коры, «смазывание» перехода между белым и серым веществом, изменённый ход извилин, повышенный МР-сигнал на ограниченном участке коры при исследовании в режимах Т2 и FLAIR. Каждый тип ФКД имеет свои особенности МРТ-картины.
В обязательно порядке пациентам с ФКД проводится электроэнцефалография. В большинстве случаев она выявляет очаговую эпилептическую активность мозга не только в момент приступа, но и в межприступный период. Во время приступа отмечается повышенная возбудимость и активация зон коры, прилежащих в визуализируемому на МРТ очагу дисплазии. Это связано с наличием аномальных клеток и за пределами основного участка корковой дисплазии, который является лишь «верхушкой айсберга».
Выявление зоны начала эпилептического приступа возможно при помощи ПЭТ, совмещённой с МРТ-изображением. При этом радиофармпрепарат должен быть введён пациенту после первого же пароксизмального разряда. Такое исследование особенно ценно при МРТ-негативных случаях ФКД и при несовпадении очага, визуализируемого на МРТ, с данными ЭЭГ. Для более точного определения расположения эпилептогенного очага проводится инвазивная электрокортикография с установкой субдуральных электродов, требующая краниотомии.
Лечение фокальной корковой дисплазии
Терапию начинают с подбора эффективного противосудорожного препарата и его дозы. Пациента совместно курируют эпилептолог и невролог. Возможно применение карбамазепина, препаратов вальпроевой к-ты, диазепама, леветирацетама, топирамата и др. антиконвульсантов. Однако зачастую эпилепсия при ФКД оказывается резистентной к противосудорожной терапии. В таких случаях ставится вопрос о хирургическом лечении и проводится консультация нейрохирурга.
Поскольку диспластические изменения носят фокальный характер, то хирургическое удаление патологического очага является эффективным способом лечения ФКД. В начале нейрохирургического вмешательства проводится электростимуляция и индивидуальная интраоперационная кортикография с составлением карты функционально важных участков коры, что позволяет избежать их травмирования в ходе операции. Многие нейрохирурги настаивают на целесообразности как можно более радикального удаления диспластического очага для достижения наилучших результатов лечения. Сложность заключается в широком распространении зоны точечно расположенных патологически изменённых клеток вокруг основного очага и невозможности их полного удаления. Распространённые и билатеральные эпилептогенные поражения являются противопоказанием к хирургическому лечению.
В зависимости от локализации и распространённости очага применяется один из 3 видов оперативных вмешательств: селективная резекция эпилептогенной зоны, стандартизированная резекция головного мозга (лобэктомия), тэйлорированная резекция — «выкраивание» зоны дисплазии, определённой в ходе кортикографии. При ФКД III типа зачастую требуется удаление и дисплазии, и основного очага поражения (опухоли, участка склероза, сосудистой мальформации и т. п.).
Прогноз при фокальной корковой дисплазии
Прогноз зависит от типа ФКД, своевременности проведённого лечения, радикальности удаления участка корковой дисплазии. Консервативная терапия, как правило, не даёт желаемого результата. Длительное течение эпилепсии в детском возрасте чревато нарушением нервно-психического развития с исходом в олигофрению.
Хирургическое лечение наиболее эффективно при единичном хорошо локализуемом очаге. По некоторым данным полное отсутствие пароксизмов или их значительное урежение наблюдается у 60% прооперированных пациентов. Однако спустя 10 лет приступы отсутствуют только у 32%. По всей видимости, рецидив эпилепсии в таких случаях связан с неполным удалением эпилептогенных элементов.
Стойкие послеоперационные неврологические расстройства отмечаются в 2% случаев, при распространённых поражениях — в 6%. Риск их развития повышен при проведении лобэктомии и вмешательствах вблизи функционально значимых участков коры.
Читайте также:
