Дефицит ZAP-70
Добавил пользователь Morpheus Обновлено: 28.01.2026
Синдром Оменна - воспалительное состояние, которое характеризуется эритродермией, шелушением кожи, алопецией, хронической диарей, снижением прибавки массы тела, лимфаденопатией и гепатоспленомегалией, обусловленное тяжелым комбинированным иммунодефицитом.
Синдром Оменна не вызван каким-то определенным генетическим дефектом. В отличии от отдельных форм тяжелого комбинированного иммунодефицита, данная патология имеет особый воспалительный фенотип, который может быть обусловлен генетически различными иммунодефицитами. В большинстве случаев имеют место гипоморфные мутации генов RAG1 и RAG2 (11p13). Остальные случаи демонстрируют мутации в RMRP , ADA , IL2RG , IL7RA , DCLRE1C , chd7 и LIG4 генов (9p21-p12, 20q13.11, Xq13, 5p13, 10p, 8q12.2 и 13q22-q34).
Синдром Оменна манифестирует в течение первого года жизни симптомами тяжелого комбинированного иммунодефицита, включая хронический понос, пневмонит и снижением прибавки массы тела. Кроме того, пациенты обращаются с различными воспалительными симптомами, включая лимфаденопатию, гепатоспленомегалию и генерализованную эритродермию, которые часто могут вызывать облысение, утрату бровей и ресниц, потеря белка может приводить к генерализованным отекам и нарушениям обмена веществ. Клинические признаки патологии могут изменяться с течением времени и могут не проявляться одновременно. Часть пациентов имеют не все эти симптомы и могут быть охарактеризованы как имеющие нетипичный фенотип синдрома. Синдром Оменна также может сопровождаться рядом других синдромальных расстройств, включая гипоплазию хрящей и волос, дефицит аденозин дезаминазы, моносомии 22q11, колобому глаз, CHARGE синдром и дефицит лигазы 4.
Синдром Оменна может представлять диагностическую проблему, поскольку количество лимфоцитов может быть нормальным или высоким, в отличие от типичных вариантов тяжелого комбинированно иммунодефита. Диагноз основывается на картине воспаления с признаками патологического роста одного или нескольких клонов Т-клеток в периферической крови и тканях. Биопсия кожи указывает на акантоз и паракератоз при окрашивании гематоксилином и эозином, что свидетельствует о дисплазии тимуса с наличием остаточных лимфоидных клеток в ткани и лимфаденопатией. Как правило, В-клетки отсутствуют, как и иммуноглобулины за исключением IgE, уровень которого часто увеличен. Наблюдается эозинофилия.
Дородовая диагностика
Если причинный ген идентифицирован у индикаторного пациента, может быть предложена пренатальная диагностика, хотя потомство, вероятно, будет иметь тяжелый комбинированный иммунодефицит.
Дифференциальный диагноз включает болезнь трансплантат против хозяина, гистиоцитоз, синдром Джоба, синдром Нетертона и тяжелые комбинированные иммунодефициты, особенно те, которые связаны с приживлением материнских Т-клеток.
Лечение основано на применении иммунодепрессантов, включая преднизолон и циклоспорин с последующей трансплантации гемопоэтических стволовых клеток в идеале с использованием HLA-идентичного семейного донора.
При отсутствии лечения прогноз неблагоприятный и синдром Оменна приводит к летальному исходу. Воспалительные процессы кожи прогрессируют и со временем приводят к серьезным нарушениям, снижающим ее барьерную функцию, что становится опасно для жизни присоединением серьезных бактериальных и грибковых инфекций на фоне иммунодефицита. Вирусные инфекции являются наиболее серьезными и опасными для жизни. Уровень выживаемости леченых пациентов оцениваются как более 80%.
Комбинированный иммунодефицит вследствие дисфункции CRAC-канала
Синонимы: иммунодефицит вследствие инактивации Т-клеток из-за дефекта входа кальция
Определение и общие сведения
Комбинированный иммунодефицит вследствие дисфункции Ca2 + релиз-активированного Ca2 + канала (CRAC) является одной из форм иммунодефицита, характеризуется рецидивирующими инфекциями, аутоиммунными заболеваниями, врожденной миопатией и эктодермальной дисплазией.
Патология подразделяется на два подтипа в зависимости от локализации мутации: КИД из-за мутации гена ORAI1 и гена STIM1.
Заболевение очень редкое, всего сообщалось о 10 пациентах из 5 семей - 6 пациентов в 3-х семьях с мутацией гена ORAI1 и 4 пациента в двух семьях с мутацией STIM1. Наследование аутосомно-рецессивное.
Этиология и патогенез
Иммунодефицит вследствие инактивации Т-клеток из-за дефекта входа кальция вызывается мутациями генов ORAI1 (12q24) и STIM1 (11p15.5).
Клинические проявления
Заболевание характеризуется с рождения повторяющимися вирусными, бактериальными, микобактериальными и грибковыми инфекциями, хронической диареей, пневмонией, менингитом, энтеритом, желудочно-кишечным кандидозом, сепсисом и отитом. Кроме того, у пациентов при рождении наблюдается врожденная миопатией, которая характеризуется непрогрессирующей генерализованной мышечной дисплазией. Для случаев с мутациями гена ORAI1 это проявляется плохим контролем положения головы, задержкой вставания и положительным симтомом Гауэра, в то время как пациенты с мутацией гена STIM1 демонстрируют генерализованную мышечную гипотонию и частичную гипоплазию радужки.
У всех пациентов отмечается эктодермальная дисплазия, которая характеризуется гипокальцифицирующим несовершенным амелогенезом, который приводят к потере мягкой зубной эмали. Пациенты с мутациями гена ORAI1 обнаруживают также ангидроз и эпизодов ремиттирующей лихорадки из-за нарушения терморегуляции. Пациентов с мутациями гена STIM1 демострируют признаки лимфопролиферативных и аутоиммунных заболеваний, включая лимфаденопатию, гепатоспленомегалия, аутоиммунные тромбоцитопению и аутоиммунную гемолитическую анемию.
Диагностика
Диагноз основывается на клинических признаках и анализе функции и пролиферации Т-клеток. Пациенты имеют нормальное количество лимфоцитов и уровни сывороточного иммуноглобулина, но сильно снижена активация Т-клеток.
Дифференциальный диагноз
Лечение с помощью трансплантации гемопоэтических стволовых клеток было успешным в некоторых случаях.
Дефицит ZAP-70
Влияние экспрессии Zap-70 и CD38 на течение и прогноз хронического лимфолейкоза (ХЛЛ)
Экспрессия Zap-70 в очень высокой степени коррелирует с мутационным статусом. В связи с этим была оценена ее прогностическая значимость, и в разных странах получены данные, аналогичные имеющимся для статуса IgVH-генов. Итальянская кооперативная группа обследовала 145 больных в I— III стадиях по Rai. Оказалось, что 10-летняя выживаемость достоверно ниже в Zap-70-позитивной группе, чем в Zap-70-негативной: 79 и 100 % соответственно (р = 0,003).
За 10 лет наблюдения прогрессирование произошло у 8 % больных из Zap-70-негативной группы и у 68 % из Zap-70-позитивной.
Американская исследовательская группа сопоставила течение болезни, мутационный статус и экспрессию Zap-70 у 201 больного. Установлено, что экспрессия Zap-70 даже более достоверно предсказывает прогрессирование заболевания, чем мутационный статус IgVH-генов: время от постановки диагноза до необходимости в лечении в Zap-70-позитивной группе было достоверно короче, чем в Zap-70-негативной, независимо от мутационного статуса. Эти данные подтверждены данными испанской группы: многофакторный анализ роли различных признаков заболевания у 192 больных показал, что экспрессия Zap-70 по прогностической значимости превосходит возраст, пол, уровень гемоглобина, лейкоцитов и тромбоцитов и атипичную морфологию лимфоцитов. Ее прогностическая значимость сохранялась при различных видах терапии.
Не менее значимой оказалась и экспрессия CD38. После обнаружения корреляции между мутационным статусом IgVH-генов и экспрессией CD38 было предложено рассматривать CD38 как эквивалент определения мутационного статуса. Однако вскоре было продемонстрировано, что корреляция не всегда оказывается значимой, поскольку примерно у 30 % больных имеются несовпадения мутационного статуса и экспрессии CD38. Кроме того, было показано, что экспрессия CD38 может меняться на протяжении болезни: появляется при прогрессировании в тех случаях, когда ее не было вначале. Было обнаружено, что у некоторых больных после лечения в оставшейся лейкозной популяции большее число клеток экспрессируют CD38, чем до лечения.
Иммунофенотип опухолевых клеток при различных лимфопролиферативных заболеваниях
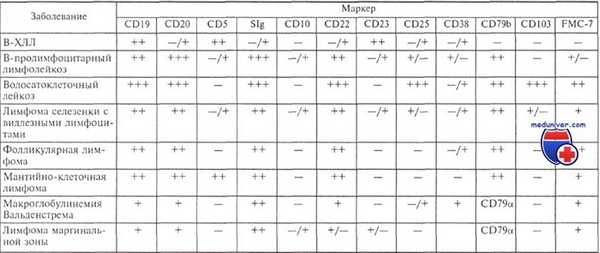
На прогноз особенно влияет сочетание мутационного статуса и экспрессии CD38. Т. Hamblin и соавт. показали, что в группе больных с отсутствием мутаций IgVH-генов и экспрессией лимфоцитами антигена CD38 медиана выживаемости оказалась 97 мес, в группе с наличием мутаций и отсутствием экспрессии CD38 — 309 мес, а в группе с наличием мутаций, но с экспрессией CD38 или наоборот — 182 мес. При многофакторном анализе, включавшем мутационный статус, экспрессию CD38, стадию болезни, типичную или атипичную морфологию лимфоцитов, время удвоения абсолютного числа лимфоцитов и наиболее частые цитогенетические аберрации (трисомия хромосомы 12 и аберрации района 13ql4), оказалось, что только стадия болезни, мутационный статус и экспрессия CD38 являются независимыми прогностическими признаками.
Недавно опубликованное исследование 450 больных показало, что наличие или отсутствие экспрессии Zap-70 и CD38 по отдельности совпадает с мутационным статусом не более чем в 70 %, но сочетание экспрессии того и другого в 90 % совпадает с отсутствием мутаций IgVH-генов, так же как отсутствие экспрессии обоих маркеров — с наличием таких мутаций.
Таким образом, очевидно, что мутационный статус IgVH-генов, определенный профиль экспрессируемых генов, в частности экспрессия молекулы Zap-70 и экспрессия CD38, разделяют хронический лимфолейкоз на два варианта с разным прогнозом. Это подтверждается и цитогенетическими исследованиями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Тяжелый первичный комбинированный иммунодефицит: трудности диагностики и фатальность исхода
Е.Н. Охотникова1, Ю.И. Гладуш2, Т.П. Иванова2, Е.И. Усова1, Е.В. Поночевная1, О.Ф. Зарудняя2, В.Т. Леуш2, С.А. Онысько2, Е.В. Макаревская2 1Национальная медицинская академия последипломного образования имени П.Л. Шупика, 2Национальная детская специализированная больница «ОХМАТДЕТ»

В настоящее время общеизвестно, что первичные иммунодефицитные состояния (ПИДС) – не столь редкая патология, как было принято считать еще 20-30 лет назад. Однако, несмотря на совершенствование методов диагностики иммунодефицитных состояний (ИДС), более чем у 70% больных выявить их не удается [5, 6]. Поэтому диагностика ПИДС и идентификация их нозологических форм, определение иммунного статуса больных, в первую очередь с точки зрения обеспечения адекватной терапии, стали актуальными проблемами клинической медицины и особенно педиатрии [2, 3].
| ПИДС – это наследственно обусловленные заболевания, вызванные нарушением сложного каскада реакций, необходимых для удаления чужеродных агентов из организма и развития адекватных воспалительных реакций [1]. Их типичными проявлениями являются тяжело протекающие бактериальные, вирусные и грибковые инфекции, аутоиммунные заболевания и повышенная склонность к развитию злокачественных новообразований. |
В настоящее время описано более 80 форм ПИДС. Частота встречаемости ПИДС составляет от 1 на 1 тыс. до 1 на 5 млн населения в зависимости от формы.
Диагноз ПИДС можно установить только после специального обследования с использованием иммунологических, генетических и молекулярных методов исследования. Это важно сделать как можно раньше, чтобы предотвратить тяжелые необратимые последствия ПИДС.
Инфекционный синдром ИДС, как правило, является ведущим в клинической картине этой патологии, однако предрасположенность к инфекциям – это один из основных, но далеко не единственный, а в ряде случаев даже второстепенный и не первый по времени возникновения симптомокомплекс.
Неинфекционные клинические проявления, часто встречающиеся при ИДС и достаточно подозрительные с точки зрения диагностики, особенно если они сочетаются с инфекциями, могут быть следующими: диарея и значительное отставание в физическом развитии, артропатии и синдром, подобный системной красной волчанке, гепатоспленомегалия и гематологические изменения (например агранулоцитоз), аплазия или гиперплазия лимфоидной ткани (неинфекционная и неонкологическая лимфаденопатия, спленомегалия, гипергаммаглобулинемия), идиопатические эндокринопатии (в том числе гипопаратиреоз) и неврологические нарушения (ментальная недостаточность, микроцефалия, атаксия), признаки преждевременного старения (например седые волосы) и склонность к онкологическим заболеваниям (у больного и у членов его семьи), скелетные дефекты и пороки развития сердца. Все эти симптомы могут встречаться при многих ИДС [3].
Клинические и иммунологические особенности некоторых нозологических форм ИДС представлены ниже [3, 4].
Тяжелый комбинированный иммунный дефицит (SCID)
Наиболее серьезным заболеванием из группы комбинированных дефектов иммунитета является тяжелый комбинированный иммунный дефицит (ТКИД), который проявляется в первые месяцы жизни. ТКИД представляет собой группу генетически разнородных заболеваний, в основе которых лежит нарушение созревания Т-лимфоцитов с полным отсутствием их функции. В зависимости от генетического дефекта заболевание наследуется Х-сцепленно или аутосомно-рецессивно.
| Критериями диагноза для всех форм ТКИД являются гипоплазия лимфоидной ткани, лимфопения, выраженное снижение уровня CD3+-клеток, значительное уменьшение концентраций сывороточных иммуноглобулинов, раннее начало тяжелых инфекций. |
В зависимости от формы заболевания количество В-лимфоцитов варьирует от нулевых (Т-В-) до нормальных значений (Т-В+), однако во всех случаях их функция значительно нарушена. При некоторых формах ТКИД определяется нормальное количество натуральных киллерных клеток (НК+).
К типичным клиническим проявлениям ТКИД относятся задержка физического развития, хроническая диарея, тяжелая молочница и грибковые поражения кожи, прогрессирующее поражение респираторного тракта в виде пневмоциcтных пневмоний, вирусных и бактериальных инфекций, сепсиса и пневмонии.
ТКИД иммунологически характеризуются нарушением дифференцировки стволовых клеток, блоком созревания Т- и В-лимфоцитов и их дефицитом. Комбинированные формы иммунодефицита встречаются чаще, чем селективные. Как правило, они связаны с нарушением функции центральных органов иммунной системы (вилочковой железы и костного мозга). При комбинированных ИДС ведущая роль принадлежит дефекту Т-клеток.
1. Cиндром ретикулярной дисгенезии – характеризуется уменьшением количества стволовых клеток в костном мозге. Для указанного синдрома характерна внутриутробная гибель плода или смерть детей вскоре после рождения.
2. «Швейцарский» тип иммунодефицита – характеризуется поражением Т- и В-систем и, следовательно, нарушением клеточных и гуморальных реакций иммунологической защиты. При аутосомно-рецессивных формах, по крайней мере, у 40% больных обнаруживается недостаточность аденозиндезаминазы, что ведет к нарушению метаболизма аденозина, блокаде синтеза гипоксантина и в результате этого – блокаде созревания Т-клеток. У части детей на мембранах Т-лимфоцитов отсутствуют антигены гистосовместимости (МНС) 1-го или 2-го класса. Содержание В-клеток может соответствовать нормальному уровню или превышать его, но эти клетки не способны секретировать иммуноглобулины (Ig) в достаточном количестве.
Заболевание проявляется в первые месяцы жизни и часто характеризуется злокачественным течением. Наблюдается задержка прибавки массы тела, уже в первые дни жизни у некоторых детей появляются кореподобные высыпания на коже, что может быть связано с реакциями несовместимости по отношению к материнским лимфоцитам, поступающим через плаценту в кровоток ребенка. Развиваются признаки кожного кандидоза, диарея, острая интерстициальная пневмония, приобретающая затяжной и рецидивирующий характер. Такие дети очень восприимчивы к вирусным инфекциям. В крови выявляется значительная лимфопения, особенно низким является содержание Т-лимфоцитов. Уровень Ig всех классов заметно снижен. Исключение составляют грудные дети с IgG, полученными от матери. Патогномоничны изменения вилочковой железы, гипоплазия миндалин и лимфатических узлов. Возникает неспособность проявлять реакции гиперчувствительности замедленного типа. Дети редко доживают до 2-летнего возраста.
Дифференциальная диагностика
Дифференциальную диагностику проводят в направлении исключения или подтверждения следующих заболеваний:
• ВИЧ-инфекции;
• врожденной краснухи;
• ПИДС:
• синдрома Ди Джорджи;
• дефицита ZAP70;
• CD3-дефицита;
• гипоплазии хрящей и волос;
• дефицита молекул HLA II класса;
• дефицита пуриннуклеозид-фосфорилазы [1].
В качестве иллюстрации приводим из собственной практики случай ТКИД у ребенка грудного возраста, демонстрирующий особенности течения заболевания и трудности его дифференциальной диагностики.
| В плане подозрения на ПИДС обращали на себя внимание следующие клинические проявления: 1. Дебют заболевания, которое характеризовалось быстро прогрессирующим злокачественным течением, – в 2,5 мес жизни. 2. Значительный интоксикационный синдром, обусловленный тяжелейшим микст-бактериальным процессом: сепсисом туберкулезной и синегнойной этиологии с развитием полиорганного поражения (БЦЖ-ит, деструкция легочной ткани, энтерит, гепатит). 3. Выраженный гепатолиенальный синдром: печень – до 5,5 см ниже реберной дуги, плотная, край острый; селезенка нижним полюсом лежит на гребне подвздошной кости, плотная, гладкая (что явилось основанием для исключения онкогематологической патологии). 4. Массивный прогрессирующий гематологический синдром: анемия, тромбоцитопения и лейкопения (4,0-2,7-2,2х10 9 /л) с анэозинофилией, нейтропенией и абсолютной лимфопенией (1,386-0,99х10 9 /л) вплоть до панцитопении с прогрессирующим некупируемым ДВС-синдромом (тромбоцитопения, некрозы кожи и подкожной жировой клетчатки, некротический энтероколит, развитие полиорганной недостаточности, сладж-феномен и др.). 5. Развитие вторичного гистиоцитарного синдрома с накоплением во всех органах и тканях миелоидных клеток, что затруднило диагностику основного заболевания. 6. Невыявление патологии иммунных органов (хотя и подозревалась) – вилочковой железы и лимфоидных образований – с помощью УЗИ и КТ, что еще раз свидетельствует об их низкой диагностической ценности. 7. Иммунологический синдром не был типичным, что затруднило прижизненную диагностику ПИДС и не позволило идентифицировать его вариант. |
Таким образом, современная медицина располагает средствами терапии больных с врожденными дефектами иммунной системы, однако в Украине до настоящего времени нет технических и финансовых возможностей для ранней диагностики и адекватного лечения детей с ПИДС, что объясняет крайне низкую их выявляемость и высокую летальность пациентов. Следует отметить, что даже в экономически развитых странах ПИДС выявляют лишь у 30% больных, и они умирают от септических, онкологических, неврологических, аутоиммунных или других заболеваний. Патогенетическая, клиническая и прогностическая вариабельность ПИДС делает их терапию достаточно сложной. К сожалению, в настоящее время выбор тактики и объема лечения, как правило, базируется не столько на оценке состояния больного, сколько на кумулятивном опыте работы ведущих центров клинической иммунологии, накопленных ими данных о влиянии на течение и исход болезни различных методов терапии [7, 8].
Однако наука не стоит на месте, и скорость внедрения новых технологий не позволяет считать безнадежными даже больных с наиболее тяжелыми вариантами ПИДС.
Симптомы комбинированных Т и В-клеточных иммунодефицитов
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
У человека тяжелая комбинированная иммунная недостаточность впервые описана в 1950 г. в Швейцарии у нескольких младенцев с лимфопенией, умиравших от инфекций в течение первого года жизни. Именно поэтому в течение многих лет в литературе встречалось выражение «швейцарский тип ТКИН». В последующие годы было выявлено, что тяжелая комбинированная иммунная недостаточность включает множество синдромов, имеющих различную генетическую природу и различные типы наследования (X-сцепленное в 46% случаев и аутосомно-рецессивное в 54%). Общая частота ТКИН - 1:50 000 новорожденных. В настоящее время известна генетическая природа примерно 15 форм ТКИН, которые, на основании различий в иммунологическом фенотипе, могут быть разделены на 5 групп: T-B+ NK+, T-B- NK+,T-B+ NK-,T+B+NK- и Т-B-NK-.
Основные клинические проявления тяжелой комбинированной иммунной недостаточности практически не зависят от генетического дефекта. Для больных с ТКИН характерно раннее, в первые недели и месяцы жизни, начало клинических проявлений заболевания в виде гипоплазии лимфоидной ткани, упорной диареи, мальабсорбции, инфекций кожи и слизистых, прогрессирующего поражения респираторного тракта. Возбудителями инфекций являются бактерии, вирусы грибы, условно-патогенные микроорганизмы (в первую очередь Pneumocyctis carini). Цитомегаловирусная инфекция протекает в виде интерстициальной пневмонии, гепатита, энтеровирусы и аденовирус вызывают менингоэнцефалиты. Очень часть встречается кандидоз слизистых и кожи, онихомикоз. Характерно развитие регионарной и/или и генерализованной БЦЖ инфекции после вакцинации. На фоне тяжелых инфекций наблюдается отставание в физическом и моторном развитии. Следует помнить, что даже при наличии тяжелой комбинированной иммунной недостаточности у младенцев не сразу развиваются все вышеперечисленные симптомы, и в течение 2-3 месяцев они могут расти и развиваться почти нормально, особенно, если вакцинация БЦЖ не была сделана. Трансплацентарная передача материнских лимфоцитов может вызвать симптомы реакции «трансплантат против хозяина» (РТПХ), называемой в этом случае материнско-фетальной РТПХ. Она проявляется в основном а виде кожной эритематозной или папулезной сыпи и поражения печени.
При лабораторном обследовании в большинстве случаев выявляется выраженная лимфопения, гипогаммаглобулинемия и снижение пролиферативной активности лимфоцитов. Близкое к норме количество лимфоцитов может являться результатом трансплацентарной передачи лимфоцитов от матери. Как было отмечено выше, Т-лимфоциты значительно снижены при всех формах тяжелой комбинированной иммунной недостаточности, однако число и функции В лимфоцитов и NK клеток зависит от генетического дефекта, лежащего в основе ТКИН. В редких случаях отмечается нормальная концентрация иммуноглобулинов, однако их неадекватная специфичность ведет к полной неэффективности гуморального звена. Далее мы рассмотрим некоторые особенности патогенеза различных форм тяжелой комбинированной иммунной недостаточности.
Молекулярно-генетические особенности различных форм тяжелой комбинированной иммунной недостаточности
Т- В- NK- ТКИН
Ретикулярная дисгенезия является редкой формой тяжелой комбинированной иммунной недостаточности, характеризующейся нарушением созревания лимфоидных и миелоидных предшественников на ранних этапах развития в костном мозге. Предполагается аутосомно-рецессивное наследование, однако в связи с редкостью заболевание оно не доказано. Молекулярно-генетические основы заболевания не известны. Заболевание характеризуется выраженной лимфопенией, гранулоцитопенией, тромбоцитопенией, тяжелыми инфекциями, проводящими к ранней гибели пациентов.
T- B+ NK- ТКИН
- Х-сцепленная тяжелая комбинированная иммунная недостаточность
Х-сцепленная ТКИН, или дефицит g цепи - наиболее часто встречающаяся форма (более 50% всех форм тяжелой комбинированной иммунной недостаточности). Она развивается в результате мутации гена общей у цепи (CD132) рецепторов интерлейкинов 2, 4, 7, 9,15. Мутация у цепи приводит к блокаде рецепторов, в результате чего клетки-мишени не способны ответить на действие соответствующих интерлейкинов. Иммунологические нарушения, развивающиеся у этих больных, характеризуются отсутствием Т-клеток и NK клеток и повышением количества В-клеток. В результате отсутствия T-клеточной регуляции продукция иммуноглобулинов В-клетками резко снижена.
Тирозинкиназа семейства Janus - Jak3 необходима для передачи активационного сигнала от общей уцепи IL2, 4, 7, 9, 15 к ядру клетки. Дефицит jak3 вызывает такие же глубокие нарушения дифференцировки Т- и NK-клеток, как дефицит общей уцепи. Иммунологические нарушения и клинические проявления у больных с дефицитом Jak3 аналогичны таковым при X-сцепленной ТКИН.
Трансмембранная протеинтирозинкиназа CD45, специфичная для гемопоэтических клеток, необходима для передачи сигнала с антигенного рецептора T- и В-клеток. Мутации гена CD45 приводят к развитию ТКИН, характеризующейся резким снижение количества T клеток, нормальным содержанием В-клеток и прогрессирующим снижением концентраций сывороточных иммуноглобулинов. Число NK лимфоцитов снижено, однако не полностью.
Т- В- NK+ ТКИН
Белковые продукты активирующих рекомбинацию генов - recombination activating genes (RAG1 и RAG2) инициируют формирование иммуноглобулинов и T-клеточных рецепторов, необходимых для дифференцирован В- и T-клеток. Таким образом, мутации RAG генов приводят к формированию тяжелой комбинированной иммунной недостаточности. При этой форме иммунодефицита отсутствуют T- и В-клетки, в то время как количество NK-клеток нормально. Количество сывороточных иммуноглобулинов резко снижено.
В 1998 году были идентифицированы пациенты с Т-B-NK+ тяжелой комбинированной иммунной недостаточности, не имеющие мутаций генов RAG1/RAG, отличающиеся высокой чувствительностью к ионизирующей радиации и имеющие нарушения восстановление двухцепочечных разрывов ДНК (DNA double strand break repair), T- и В-лимфоциты распознают антигены с помощью молекул Т-клеточных рецепторов (TCR) и иммуноглобулиноз. Антиген-специфичные участки этих рецепторов состоят из трех сегментов: V- (вариабельных), D (разнообразия) и J (объединения). Полиморфизм антиген-специфичных участков TCR и иммуноглобулинов обеспечивается процессом соматической реарранжировки и V(D)J рекомбинации. В процессе рекомбинации генов иммуноглобулинов и TCR RAG протеины индуцируют двухцепочечные разрывы ДНК. Восстановление индуцированных радиацией и спонтанных разрывов ДНК требует участия ряда протеинкиназ и недавно идентифицированного фактора, названного Artemis. Artemis необходим для остановки клеточного цикла в случае повреждения ДНК.
Мутации гена Artemis приводят к развитию аутосомно-рецессивной тяжелой комбинированной иммунной недостаточности с повышенной радиочувствительностью, характеризующейся отсутствием Т- и В-лимфоцитов и хромосомной нестабильностью. Отличительной чертой клинических проявлений, помимо характерных для scex ТКИН, является наличие номоподобных поражений слизистых рта и других локализаций.
T- B+ NK+ TKИH
Предшественники T- и В-клеток экспрессируют функциональный IL7R, состоящий из а цепи и общей у цепи. Экспрессия этого рецептора критична для созревания T-лимфоцитов, но не критична для развития В-лимфоцитов. Мутации гена альфа цепи IL-7R приводит к развитию ТКИН, с фенотипом T-B-NK+ и выраженным снижением концентраций сывороточных; иммуноглобулинов.
T+ B+ NK- ТКИН
В 2001 году, впервые, Gilmour KC et al. описали пациента с низким абсолютным количеством T-лимфоцитов, нормальным количеством В-клеток и полным отсутствием NK-клеток. И хотя никаких мутаций в генах общей у цепи или JAK3 обнаружено не было, функциональные исследования показали нарушение фосфорилирования JAK3 через комплекс IL2R. Последующий цитометрический анализ показал значительное снижение экспрессии beta цепи рецептора IL15 (IL15Rbeta). Однако, мутации гена IL15Rbeta выявить не удалось, что заставляет предполагать наличие дефектов транскрипции, которые оказались ответственными за отсутствие экспрессии цепи IL15Rbeta.
Дефицит двух ферментов, катализирующих пуриновый метаболизм - аденозиндезаминазы (ADA) и пуриннуклеозидфосфарилазы (PNP), ассоциирован с развитием комбинированной иммунной недостаточности. Вследствие отсутствия этих ферментов накапливаются токсичные для клеток продукты - деэоксиаденозин и дезоксигуанозин, которые частично фосфорилируются в лимфоидных клетках, превращаясь в соответствующие дезоксинуклеозидтрифосфаты. Токсичность этих продуктов особенно важна в быстро делящихся клетках и заключается в ингибировании синтеза ДНК, индукции апоптоза, нарушении метилирования и др. Оба эти состояния гетерогенны по клиническим проявлениям в зависимости от локализации мутации на протяжении генов итого, насколько в результате страдает функция соответствующего фермента.
Дефицит аденозиндезаминазы - одна из первых идентифицированных форм ТКИН. Ген аденозиндезаминазы находится на 20ql3.ll. Известно более 50 вариантов мутаций гена ADA. Существует зависимость между генетически детерминированной резидуальной активностью аденозиндезаминазы и метаболическим и клиническим фенотипом. ADA экспрессируется в различных тканях, особенно высока его экспрессия в незрелых тимоцитах и В лимфоцитах, по мере созревания клеток экспрессия АДА уменьшается. При дефиците аденозиндезаминазы в клетках накапливаются дезоксиаденозинтрифосфат и S-аденозилгомоцистеин. Эти метаболиты ингибируют пролиферацию ТT- и В-лимфоцитов.
У большинства пациентов с дефицитом аденозиндезаминазы в раннем возрасте проявляются все признаки ТКИН. Это, как правило, больные с самым низким число лимфоцитов и самыми ранними и тяжелыми проявлениями. У этих больных не отмечается приживление материнских лимфоцитов. Кроме иммунологических, нарушение пуринового обмена может вызывать скелетные нарушения. Так, при рентгенологическом исследовании выявляются увеличенные косто-хондральные сочленения (как при рахите), расширение концов ребер, тазовая дисплазия. У больных также описаны следующие неврологические изменения: нистагм, сенсорная глухота, спастические нарушения, нарушение психомоторного развития (независимо от инфекций). Частым признаком дефицита аденозиндезаминазы является повышение трансаминаз, вероятно свидетельствующее о наличии токсического гепатита.
В последние годы описаны варианты с «поздним началом» ADA-дефицита и выявлены даже здоровые индивидуумы с частичным дефицитом фермента.
Ведение больных тяжелыми проявлениями ADA-дефицита практически не отличается от терапии других ТКИН. Однако экспериментальным методом является назначение заместительной внутримышечной терапии ферментом PEG-ADA в дозе 15-30 мг/кг/неделю. Коррекция дефектов требует длительного и постоянного лечения. Число и функция Т лимфоцитов как правило улучшается к 6-12 недели терапии, однако даже после длительного лечение (10 лет) у большинства больных сохраняется лимфопения и нарушение митогенного ответа.
Ген PNP расположен на 14ql3. В отличие от ADA, активность пурин-нуклеозндфосфорилазы увеличивается по мере созревания Т лимфоцитов. При дефиците PNP в клетках накапливается деэоксигуанозинтрифосфат, ингибирующий пролиферацию Т-лимфоцитов.
Также как и при дефиците аденозиндезаминазы, у большинства пациентов с дефицитом пурин-нуклеозндфосфорилазы клинические проявления ТКИН развиваются в младенческом возрасте, хотя в отдельных случаях описано более позднее начало. Сопутствующими синдромами при дефиците PNP являются урикемия и урикурия. Часто у больных с дефицитом пурин-нуклеозндфосфорилазы отмечаются аутоиммунные (гемолитическая анемия, тромбоцитопения, нейтроления, системная красная волчанка) и неврологические (плегии, парезы, атаксия, тремор, задержка умственного развития) проявления. У больных отмечается повышенная склонность к онкологическим заболеваниям. При лабораторном исследовании отмечается резкое снижение T лимфоцитов и как правило нормальное число В лимфоцитов. Проявлением дисрегуляции В лимфоцитов являются повышение уровня иммуноглобулинов, гаммапатия, наличие аутоантител.
Синдром «голых лимфоцитов» является врожденным иммунодефицитом, развивающимся из-за отсутствия на поверхности клеток экспрессии молекул II класса главного комплекса гистосовместимости (МНС II). При этом заболевании из-за дефектов генов, контролирующих МНС II, не происходит экспрессии его молекул, необходимых для дифференцировки и активации CD4+клеток, нарушается селекция T-клеток в тимусе, и развивается тяжелый иммунодефицит. Поврежденные гены кодируют четыре высокоспецифичных транскрипционных фактора (RFXANK, RFX5, RFXAP и СИТА), регулирующих экспрессию МНС II. Первые три являются субъединицами RFX (Regulatory Factor X) - тримерного, присоединяющего ДНК комплекса, который регулирует все промоторы МНС II. CIITA
Заболевание характеризуется типичными клиническими признаками ТКИН, которые, однако, протекают легче. Так, а группе 9 нетрансплантированных больных с этим заболеванием средняя продолжительность жизни составила 7 лет.
При лабораторном исследовании отмечается значительное снижение CD4+ лимфоцитов, при как правило нормальном числе CD8+ лимфоцитов. У некоторых больных отмечается отсутствие экспрессии не только молекул МНС II, но и МНС I. В целом отмечается выраженная недостаточность T клеточного ответа, продукция иммуноглобулинов также резко снижена.
Протеин-тирозинкиназы семейства ZAP70/Syk играют важную роль в передаче сигнала от антиген-распознающего рецептора, они необходимы для нормального развития Т-лимфоцитов. ZAP70 необходима для дифференцировки ab Т-лимфоцитов. При дефиците ZAP70 развивается селективный дефицит CD8+ клеток. Количество CD4+ циркулирующих клеток нормально, но они имеют выраженные нарушения функций в виде отсутствия продукции IL-2 и пролиферативной активности. Концентрации сывороточных иммуноглобулинов снижены.
Хронический лимфоцитарный лейкоз

Хронический лимфоцитарный лейкоз – это постоянная выработка костным мозгом и накопление в тканях измененных лимфоцитов – клеток иммунной системы, которые не способны бороться с инфекциями и защищать организм от различных заболеваний.
Как развивается лимфолейкоз?
С самого рождения в теле человека, в том числе в костном мозге, образуются не только обычные клетки, но и отличающиеся от них мутировавшие – измененные. Они становятся такими из-за воздействия различных химических веществ, наследственных особенностей или случайных сбоев. Наш иммунитет выявляет и уничтожает большинство из них, но некоторым все же удается выжить. Они становятся лейкемическими и приобретают опасные свойства:
- перестают созревать и производить нормальные клетки крови;
- быстро размножаются;
- игнорируют апоптоз – механизм «запрограммированной» смерти, из-за чего существуют гораздо дольше, чем длится их правильный жизненный цикл.
Такие способности позволяют им накапливаться в костном мозге, вытеснять нормальные клетки, попадать в кровеносную систему, с ее помощью распространяться в различные области организма и препятствовать нормальной работе тканей.
При хроническом лейкозе такие клетки созревают не полностью – они становятся похожими на нормальные лейкоциты, необходимые нашему телу для борьбы с инфекциями, но не могут выполнять их функции.
Что такое костный мозг, кровь и лимфоидная ткань?
Различные типы лейкемии начинаются в определенных типах клеток крови. Для того, чтобы понять принцип развития заболевания и его влияния на организм, нужно разобраться с работой основных тканей тела.
Костный мозг
Эта мягкая внутренняя часть некоторых костей – черепа, лопаток, ребер, таза и позвоночника состоит из:
- Жировых клеток.
- Небольшого количества стволовых клеток, из которых образуются различные клетки крови.
- Зрелых кроветворных клеток.
- Поддерживающих тканей, которые помогают клеткам расти.
Внутри костного мозга стволовые клетки делятся, созревают и образуют новые клетки крови, которые становятся лейкоцитами, эритроцитами, лимфоцитами или тромбоцитами.

Типы клеток крови
Красные кровяные тельца, или эритроциты, переносят кислород из легких в другие ткани и возвращают углекислый газ обратно в дыхательные пути. Их нехватка – анемия, может вызвать слабость, усталость и одышку – нехватку воздуха.
Тромбоциты необходимы для закупорки вызванных порезами или ушибами отверстий в кровеносных сосудах. Если в теле человека их слишком мало, у него развиваются кровотечения и появляются кровоподтеки.
Белые кровяные тельца, или лейкоциты, помогают организму бороться с инфекциями. При понижении их уровня работа иммунной системы нарушается, а вероятность заражения – увеличивается.
Типы лейкоцитов
Лимфоциты – это полностью зрелые противостоящие инфекциям клетки, которые развиваются из лимфобластов – особого типа стволовых клеток костного мозга. Именно из них в основном состоит лимфоидная ткань иммунной системы, находящаяся в лимфатических узлах Лимфатические узлы – это небольшие органы иммунной системы, задерживающие и обезвреживающие опасные для организма вещества. , вилочковой железе Вилочковая железа, или тимус – небольшой орган, расположенных за верхней частью грудины, перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов. , селезенке Селезенка производит лимфоциты, уничтожает микроорганизмы и другие вредные вещества, а также хранит нормальные клетки крови. , миндалинах Миндалины – расположенные в задней части глотки скопления лимфатической ткани, которые участвуют в выработке антител – белков, не позволяющих вдыхаемым и проглатываемым микроорганизмам размножаться. , а также дыхательной и пищеварительной системах.
- В-лимфоциты: защищают организм от микробов. Именно они чаще всего становятся лейкозными. Созревают и превращаются в плазматические клетки, вырабатывающие антитела – белки, которые прикрепляются к микробам – бактериям, вирусам и грибкам, благодаря чему их распознают и уничтожают гранулоциты.
- Т-лимфоциты: распознают зараженные вирусами клетки, разрушают их и регулируют активность иммунной системы.
Гранулоциты: борются с инфекциями. Развиваются из особых клеток костного мозга – миелобластов, содержат в себе ферменты – белки и другие вещества, способные уничтожать бактерии.
Моноциты. Развиваются из присутствующих в костном мозге монобластов. На протяжении примерно суток они циркулируют в кровотоке, после чего проникают в различные ткани и превращаются в макрофаги, способные переваривать некоторые виды микробов. Кроме того, они помогают лимфоцитам распознавать опасные микроорганизмы и вырабатывать антитела для борьбы с ними.
Все эти клетки содержатся в теле человека в определенном количестве. Нарушение правильного баланса и замещение их на измененные клетки приводит к тяжелым последствиям – сбоям в работе всех систем, включая дыхательную, иммунную, кровеносную и пищеварительную, и отказу важнейших органов.
Типы лимфоцитарного лейкоза
Самый распространенный вид хронического лимфолейкоза развивается в В-лимфоцитах.
Пролимфоцитарный лейкоз: формируется в пролимфоцитах – незрелых В- или Т-лимфоцитах, и быстро распространяется. Большинство его случаев поддается лечению, но у обладателей подобного диагноза нередко случаются рецидивы – возвращение заболевания.
Лейкоз из больших гранулярных лимфоцитов. Его клетки довольно крупные и имеют признаки Т-, либо других типов лимфоцитов. Почти все такие лейкозы медленно развиваются и лечатся препаратами, подавляющими иммунную систему. Некоторые их формы довольно агрессивны – они быстро распространяются и плохо реагируют на терапию.
Волосатоклеточный лейкоз: формируется в измененных В-лимфоцитах. Его клетки необычно выглядят под микроскопом – на их поверхности есть тонкие выступы, похожие на волоски. Данное заболевание обычно хорошо поддается лечению.

Причины развития хронического лимфолейкоза
Точная причина большинства всех его случаев не известна, но принцип образования неправильных лимфоцитов понятен.
Нормальные человеческие клетки растут и работают по «программе», заложенной в содержащихся в них хромосомах, образующих молекулу ДНК. Она несет в себе переданные от родителей гены, которые влияют не только на наш внешний вид:
- онкогены: способствуют росту и делению клеток;
- супрессоры опухолей: замедляют их деление и вызывают гибель по окончанию жизненного цикла.
Каждый раз, когда клетка готовится к делению на 2 новых, она делает новую копию ДНК. Этот процесс не идеален – в его ходе могут возникать ошибки, приводящие к «включению» онкогенов и «выключению» супрессоров опухолей.
Нормальные В-лимфоциты являются частью нашей иммунной системы. Они «запрограммированы» на рост и деление с антигеном – чужеродным веществом, которое обычно не встречается в организме человека. К ним относятся, например, микробы – вирусы, бактерии и грибки. Хронический лимфолейкоз начинается в результате бесконтрольного деления В-лимфоцитов после их взаимодействия с антигеном. Причина этого медицинскому сообществу не понятна, но известны факторы, увеличивающие вероятность подобного события.
- Возраст: примерно 9 из 10 обладателей данного диагноза старше 50 лет.
- Некоторые исследования показали, что часть случаев связана с длительным воздействием радиоактивного газа радона и некоторых пестицидов – химических препаратов, которые используются для борьбы с сорняками и вредителями.
- Пол: у мужчин заболевание встречается несколько чаще, чем у женщин.
- Семейный анамнез: более чем в 2 раза повышены риски людей, у близких кровных родственников которых – родителей, братьев, сестер или детей, уже выявлено заболевание.
- Раса, этническая принадлежность. У проживающих в различных регионах и странах азиатов хронический лимфоцитарный лейкоз возникает реже, чем у европеоидов. Такая статистика подтверждает мнение ученых о том, что основную роль в его развитии играет генетика, а не окружающая среда.
Симптомы и признаки хронического лимфолейкоза
У многих пациентов на момент постановки диагноза никаких проблем со здоровьем нет. Заболевание часто обнаруживают по данным анализов крови при обращении к врачу из-за различных не связанных с ним нарушений.
Симптомы лимфолейкоза часто сложно распознать и легко принять за признаки различных расстройств. К ним относят:
- Слабость.
- Постоянную усталость.
- Увеличение размеров лимфатических узлов, похожих на плотные шишки под кожей.
- Потерю веса без усилий со стороны пациента.
- Повышенную температуру.
- Ночную потливость.
- Боль или чувство переполнения в области живота, сытость даже после небольшого приема пищи из-за увеличения селезенки или печени.
Многие симптомы заболевания возникают из-за замещения лейкозными клетками нормальных кроветворных клеток костного мозга. В результате этого процесса в организме пациентов присутствует слишком мало эритроцитов, правильно работающих лимфоцитов и тромбоцитов:
- Анемия – нехватка переносящих кислород эритроцитов. Приводит к слабости, усталости и одышке – ощущению нехватки воздуха.
- Лейкопения – дефицит нормальных лейкоцитов увеличивает риск развития инфекций.
- Нейтропения: низкий уровень нейтрофилов – особого типа гранулоцитов, необходимых для борьбы с бактериями.
- Лимфоцитоз – избыток измененных лимфоцитов, не способных бороться с инфекциями.
- Тромбоцитопения – нехватка тромбоцитов, приводящая к появлению большого количества кровоподтеков, частым или сильным носовым кровотечениям и кровоточивости десен.
У людей с хроническим лимфолейкозом из-за неправильной работы иммунитета развиваются инфекции – обычные простуда или герпес, пневмония – воспаление легких, или другие тяжелые заболевания.
Кроме того, в некоторых случаях лейкозные клетки вырабатывают неправильные антитела – белки, атакующие нормальные клетки крови. Эта особенность также приводит к снижению количества нормальных тромбоцитов, эритроцитов и лейкоцитов.
Диагностика хронического лимфолейкоза
Обследование начинается с опроса о беспокоящих симптомах, дате их появления, возможных факторах риска, общем самочувствии и состоянии здоровья, а также о известных тяжелых заболеваниях у кровных родственников. Затем проводится осмотр лимфатических узлов, брюшной полости и других областей тела, которые могли пострадать от лейкоза. После чего назначается целый ряд процедур.
- Анализы крови. Необходимы для подсчета различных типов клеток крови и химических веществ, а также качества работы внутренних органов, таких как печень и почки. У пациентов с хроническим лимфолейкозом очень много лимфоцитов – их содержание в количестве более чем 10 тысяч на кубический миллиметр крови фактически подтверждает диагноз.
- Анализ костного мозга. Как правило, для выявления заболевания достаточно данных показателей крови. Данное исследование проводится перед началом лечения для оценки его распространения и в процессе терапии для определения ее эффективности. Как правило, образцы берутся из задней части бедренной кости в ходе:
- аспирации – вытягивания густого жидкого костного мозга иглой в шприц;
- и обычно проводимой после нее биопсии – удаления небольшого кусочка кости и костного мозга с помощью специального инструмента.
Любые из вышеперечисленных исследований и диагностику лимфолейкоза можно пройти в онкологическом центре «Лапино-2».
Мы проводим полное обследование и берем все необходимые анализы, результаты которых получаем из собственной лаборатории.
Наши специалисты не только выявляют заболевания, но и проводят любое их лечение – без очередей и потерь времени.
Пациентам, проходящим терапию в других медицинских учреждениях, мы предлагаем услугу второго мнения – консультацию врача любой специальности. Независимые эксперты «Лапино-2» помогут вам убедиться в правильности уже поставленного диагноза или найти в нем ошибки и неточности.Стадии хронического лимфолейкоза
Для большинства видов онкологических заболеваний стадирование – это оценка количества поврежденных новообразованиями тканей. С помощью этой информации врачи определяют примерные прогнозы человека, и исходя из них подбирают самое подходящее лечение.
Хронический лимфоцитарный лейкоз же опухолей обычно не образует, но нередко к моменту выявления успевает распространить измененные клетки в другие ткани и органы. Перспективы его обладателей зависят от результатов лабораторных анализов и визуализирующих исследований.Лимфолейкоз стадируется по 2 международным системам, но в Российской Федерации применяется только одна из них – Binet. Она классифицирует заболевание по:
- количеству пораженных групп лимфоидной ткани, к которой относятся лимфоузлы шеи, паха и подмышек, селезенка и печень;
- наличию или отсутствию анемии – нехватки переносящих кислород эритроцитов, или
- тромбоцитопении – необходимых для правильной свертываемости крови тромбоцитов.
Стадия А: увеличено менее чем 3 участков лимфоидной ткани без анемии и тромбоцитопении.
Стадия В: укрупнено более чем 3 области лимфоидной ткани.
Стадия С: увеличено любое количество областей лимфоидной ткани, присутствуют анемия и/или тромбоцитопения.Лечение хронического лимфолейкоза
Многие пациенты с данным диагнозом живут очень долго, а доказательств пользы раннего начала лечения, тяжело переносимого организмом, на сегодняшний день не существует. Именно по этой причине врачи назначают его только после появления беспокоящих симптомов и прогрессирования, то есть ускорения развития заболевания.
В качестве начальной терапии специалисты применяют множество различных лекарств и их комбинаций. Они включают в себя:
- Моноклональные антитела – искусственные, то есть созданные в лаборатории белки иммунной системы, которые прикрепляются к определенной мишени – белкам, находящимся на поверхности измененных клеток.
- Химиотерапию – препараты, которые принимаются внутрь либо вводятся в вену или мышцу и уничтожают лейкозные клетки. Они попадают в кровоток и распространяются по всему телу, воздействуя на любые его области. Такое лечение проводится циклами, включающими в себя периоды отдыха, необходимые организму для восстановления.
- Таргетную терапию – препараты, которые работают только против определенных изменений, присутствующих в неправильных клетках. Они блокируют белки, которые помогают им быстро расти и существовать гораздо дольше, чем длится обычный жизненный цикл.
Если единственной серьезной проблемой является разрастание областей лимфоидной ткани, врачи назначают местное лечение:
- Лучевую терапию – разрушение лейкозных клеток с помощью радиации.
- Хирургию– удаление вызывающей тяжелые симптомы увеличенной селезенки.
В некоторых случаях избыток неправильных клеток приводит к лейкостазу – нарушению кровообращения. Их количество может уменьшить химиотерапия, но это происходит не раньше, чем через несколько дней после введения первой дозы препаратов. Перед ее проведением выполняется лейкаферез – изъятие излишков измененных клеток. Эта процедура сразу же улучшает показатели крови, но эффект от нее длится не долго.
Пациентам, у которых врачи обнаружили очень высокий риск развития заболевания, перед началом лечения может быть рекомендована трансплантация стволовых клеток, из которых образуются нормальные клетки крови.
![Прогнозы выживаемости]()
Прогнозы и выживаемость при хроническом лимфолейкозе
Перспективы каждого пациента индивидуальны и зависят от огромного количества показателей.
Благоприятные прогностические факторы, связанные с длительной продолжительностью жизни:
- Не диффузное, то есть очаговое поражение костного мозга.
- Повреждение только одной части тринадцатой хромосомы.
- Низкая доля лейкозных клеток, содержащих менее 20% белка ZAP-70 или менее 30% CD38.
- Наличие клеток с измененным геном IGHV.
Неблагоприятные прогностические факторы, уменьшающие возможную продолжительность жизни:
- Пожилой возраст.
- Диффузное поражение костного мозга, то есть замещение большого его количества лейкозными клетками.
- Повреждение частей 17 или 11 хромосом.
- Трисомия – 3 двенадцатых хромосомы вместо двух в неправильных клетках.
- Лейкозные клетки без изменения гена IGHV.
- Высокий уровень в крови бета-2-микроглобулина – белка, присутствующего на поверхности почти всех клеток организма. Его количество в крови повышается при воспалениях, лимфоме, лейкозе и других заболеваниях.
- Отсутствие в измененных клетках гена TP53.
- Время, необходимое для удвоения количества лимфоцитов в организме – менее 1 года.
- Высокая доля лейкозных клеток, содержащих более 20% белка ZAP-70 или более 30% CD38.
- Избыток пролимфоцитов, из которых развиваются лимфоциты.
Продолжительность жизни пациентов с хроническим лимфолейкозом в последние годы значительно увеличилась. На сегодняшний день пятилетняя выживаемость, или вероятность прожить 5 или более лет с момента постановки диагноза, составляет 83%.
Зейналова Первин Айдыновна Гематолог, онколог, доктор медицинских наук, профессор, врач высшей категории. Заведующая отделением онкогематологии
Читайте также:

