Демпинг-синдром. Диагностика и лечение демпинг-синдрома.
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Демпинг-синдром. Диагностика и лечение демпинг-синдрома.
У больных, перенесших операцию на желудке, при нарушении функции привратника, регулирующей опорожнение желудка, может развиться демпинг-синдром. Недостаточность регулирующей опорожнение желудка функции привратника может возникать по следующим причинам:
1. Рассечение привратника (пилоропластика).
2. Обходное шунтирование привратника (гастроею-ностомия).
3. Резекция привратника (резекция по Billroth II или Billroth I).
Термин «Dumping» (разгрузка) впервые был предложен Mix в 1922 году и означает очень быстрое опорожнение желудка.
Демпинг-синдром характеризуется вазомоторными желудочно-кишечными симптомами. Вазомоторные симптомы развиваются в результате стимуляции адренергической системы и проявляются тахикардией, приливом крови, возбуждением, слабостью, тревогой, расстройством дыхания, и т.д. Наиболее частые желудочные симптомы — это вздутие живота, тошнота рвота, схваткообразная боль в животе и диарея. Прием внутрь гипертонических растворов воспроизводит клиническую картину демпинг-синдрома при поступлении этих растворов в тощую кишку. С другой стороны, быстрое опорожнение желудка вместе с ускоренным прохождением содержимого через кишечник и растяжением отводящей петли, приводят к уменьшению объема циркулирующей плазмы крови. Демпинг-синдром приводит также к другим нейрогуморальным нарушениям, таким как повышение концентраций вазоактивных кишечных пептидов, нейротензина, панкреатических полипептидов, инсулина, и глюкагона в крови. Известно, что соматостатин, ингибируя секрецию обоих вышеупомянутых гормонов, предупреждает развитие клинической картины демпинг-синдрома, поэтому его используют для лечения этого осложнения.
Симптомы демпинг-синдрома появляются во время приема пищи или спустя 45 минут. Поэтому, если симптомы развиваются во время еды или спустя несколько минут, то это осложнение называют ранним демпинг-синдромом, в отличие от позднего демпинг-синдрома, развивающегося через 1 или более часов после еды. Эти симптомы могут значительно различаться у разных пациентов, но вместе они дают клиническую картину, сходную с картиной гипогликемии, так как при демпинг-синдроме снижается уровень сахара в крови. В связи с этим демпинг-синдром часто определяют как реактивный гипогликемический синдром, который объясняют реакцией мозгового вещества надпочечников и увеличением продукции адреналина. Поздний демпинг-синдром можно предупредить или купировать инъекцией соматостатина.
Демпинг-синдром обычно умеренно выражен и постепенно самопроизвольно исчезает. Существует небольшая группа больных, которые являются нетрудоспособными из-за тяжелой формы демпинг-синдрома.
Демпинг-синдром развивается у больных, оперированных по поводу язвы двенадцатиперстной кишки, и реже — у больных, оперированных по поводу язвы желудка или рака.
Больные с язвой двенадцатиперстной кишки часто имеют психосоматическую предрасположенность к развитию демпинг-синдрома. Данный факт заставляет учитывать при выборе вида операции не только патологические изменения, вызванные язвой, но и психосоматическое состояние пациента. Демпинг-синдром, ранний или поздний, следует лечить консервативными методами, учитывая его природу. Оперативное лечение демпинг-синдрома показано в исключительно редких случаях и дает спорные результаты.
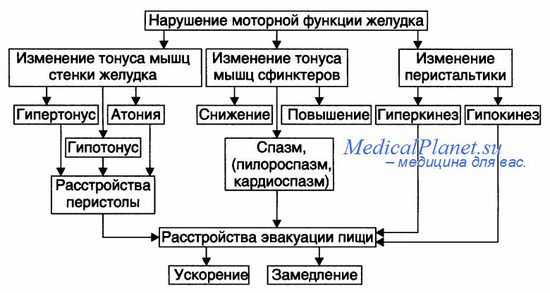
Патогенз нарушения моторной функции желудка при демпинг-синдроме
Проявления раннего демпинг-синдрома обычно уменьшаются, когда больной ежедневно принимает пищу чаще, но в меньших количествах. Пища должна содержать в основном белки, жиры и минимальное количество углеводов. Больным не следует принимать жидкость с едой, жидкость следует употреблять между приемами пищи. Важно принимать седативные и антигистаминные средства. Кроме того, в первые дни после операции больным рекомендуется принимать пищу, лежа на левом боку; это положение значительно уменьшает проявления раннего демпинг-синдрома.
Применение соматостатина предупреждает развитие симптомов как раннего, так и позднего демпинг-синдрома или приводит исчезновению уже имеющихся симптомов.
Этот гормон применяют подкожно за 20 минут до еды, как и аналог соматостатина пролонгированного действия октреотид.
Для лечения раннего демпинг-синдрома было предложено множество видов хирургических вмешательств, особенно в случаях, когда нарушается трудоспособность больных. К сожалению, не доказана эффективность ни одного из этих методов.
Вот некоторые из этих операций:
1. Интерпозиция сегмента тощей кишки длиной 20— 25 см в изоперистальтическом положении между культей желудка и двенадцатиперстной кишкой. Эту операцию всегда следует дополнять стволовой ваготомиейлля предупреждения развития язвы анастомоза.
2. Интерпозиция двойного сегмента тощей кишки длиной 10—12 см, одного— в изоперистальтическом направлении, другого — в антиперистальтическом, с созданием еюно-еюноанастомоза между ними.
3. Интерпозиция антиперистальтического сегмента тощей кишки длиной 10 см между желудком и культей двенадцатиперстной кишки.
4. Гастроеюностомия по Roux-en-Y, дополненная антрэктомией и стволовой ваготомией для предотвращения развития язв анастомоза.
5. Трансформация резекции желудка по Billroth II в Billroth I.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Демпинг-синдром: современный взгляд на патогенез, диагностику и лечение
Для цитирования: Гасиева О.Ю., Эмбутниекс Ю.В., Березина О.И., Бордин Д.С. Демпинг-синдром: современный взгляд на патогенез, диагностику и лечение. Эффективная фармакотерапия. 2022; 18 (14): 42–47.
- Аннотация
- Статья
- Ссылки
- Английский вариант
В обзоре литературы обобщены современные представления о патогенезе демпинг-синдрома – патологического состояния, возникающего после резекции желудка. Представлены принципы выявления и коррекции проявлений демпинг-синдрома, позволяющие улучшить послеоперационную реабилитацию и обеспечить приемлемое качество жизни больных.
- КЛЮЧЕВЫЕ СЛОВА: демпинг-синдром, патогенез, послеоперационная реабилитация, качество жизни
В обзоре литературы обобщены современные представления о патогенезе демпинг-синдрома – патологического состояния, возникающего после резекции желудка. Представлены принципы выявления и коррекции проявлений демпинг-синдрома, позволяющие улучшить послеоперационную реабилитацию и обеспечить приемлемое качество жизни больных.
Демпинг-синдром – это патологическое состояние, возникающее после резекции желудка (по модификации Бильрот II, наиболее часто), гастрэктомии, ваготомии, пилоропластики вследствие быстрого поступления желудочного содержимого в тонкую кишку. Демпинг-синдром встречается примерно у 20% пациентов, перенесших ваготомию с пилоропластикой, у 40% пациентов после резекции желудка и у 50% пациентов, перенесших эзофагэктомию [1–5]. В литературе также описаны случаи демпинг-синдрома после фундопликации по Ниссену [6–8]. На сегодня нет установленных стандартов по диагностике и лечению демпинг-синдрома. Для разработки рекомендаций в помощь практикующим врачам, а также для определения направлений, нуждающихся в дальнейшем исследовании, в 2020 г. был проведен консенсус, посвященный диагностике и лечению демпинг-синдрома [9]. В данной статье приведен обзор литературы, а также ключевые положения указанного консенсуса.
Одним из основных механизмов формирования раннего демпинг-синдрома является быстрая эвакуация содержимого из культи желудка в тонкую кишку. Пусковой причиной служит удаление либо рассечение пилорического жома во время операции, а также выключение двенадцатиперстной кишки из акта пищеварения. По результатам исследования В.П. Акимова и соавт., выдвинута теория о перевозбуждении энтерохромаффинных клеток за счет ускоренного поступления пищи при разрушении пилорического жома. В пользу этой теории коллектив авторов привел пример положительного эффекта использования медикаментов антисеротонинового действия и производных соматостатина [10]. Ввиду гиперосмолярного содержимого тонкой кишки происходит перераспределение жидкости из сосудистого русла в просвет кишечника, что приводит к уменьшению циркулирующего объема плазмы, тахикардии, гипотонии, изменению ЭКГ и в редких случаях обморокам. Перераспределение жидкости в тонкую кишку также может вызвать вздутие двенадцатиперстной или тощей кишки и провоцировать появление абдоминальных симптомов: спастическиой боли, вздутия живота, диареи. Еще одним немаловажным механизмом раннего демпинг-синдрома является повышенное высвобождение нескольких гастроинтестинальных гормонов, таких как нейротензин, вазоинтестинальный пептид, энтероглюкагон, инсулин и глюкагон [6, 11–16].
В развитии синдрома позднего демпинга основную роль играет быстрое поступление непереваренных углеводов в тонкий кишечник, что способствует повышению концентрации глюкозы с последующим гиперинсулинемическим ответом и последующей гипогликемии.
Классификация
Выделяют ранний и поздний демпинг-синдром.
Ранний демпинг-синдром проявляется абдоминальным болевым синдромом, метеоризмом, урчанием в животе, тошнотой и диареей, а также вазомоторными симптомами: желанием лечь после еды, потливостью, тахикардией, гипотонией и в редких случаях обмороком. Возникает в течение первого часа после еды.
Поздний демпинг-синдром связан с нейрогликопенией (на что указывают утомляемость, слабость, спутанность сознания, голод и обмороки) и вегетативной и/или адренергической реактивностью (на что указывают потливость, учащенное сердцебиение, тремор и раздражительность).
Клиническая картина
Ведущими клиническими проявлениями демпинг-синдрома являются слабость после приема пищи, сонливость, головокружение, шум в ушах, тремор, метеоризм, тошнота, диарея, сердцебиение, повышенное потоотделение, спутанное сознание и обморочное состояние [6, 11]. Тяжесть проявлений демпинг-синдрома уменьшается в положении лежа, а пища, богатая углеводами, напротив, усиливает симптоматику.
Выделяют три степени тяжести демпинг-синдрома.
Первая степень (легкая). Провоцирующими факторами возникновения приступа являются сладкая пища и молоко. Клинические проявления (слабость, головокружение, потливость, бледность) слабо выражены и непродолжительны по времени (чаще 10–15 минут, не более получаса). Гемодинамика во время приступа, как правило, стабильная. При рентгенологическом исследовании верхних отделов ЖКТ эвакуация контрастного вещества из культи желудка проходит за 15–20 минут, а длительность пассажа по тонкой кишке – 3–4 часа.
Вторая степень (средней тяжести). Приступы могут возникать после приема любой пищи и длятся 30–60 минут. Клинические проявления (слабость, головокружение, потливость, бледность) имеют более выраженный характер, к ним могут присоединяться жалобы на шум в ушах, тошноту, парестезии, ощущение жара, тахикардии. Стул неустойчивый. Отмечается изменение гемодинамики: частота сердечных сокращений (ЧСС) возрастает на 15–20 уд/мин, систолическое артериальное давление (АД) снижается на 10 мм рт. ст. По данным рентгеноскопии, эвакуация сульфата бария занимает 10–15 минут, а пассаж по тонкой кишке проходит за 2,5–3 часа.
Третья степень (тяжелая форма заболевания). Расстройства возникают после каждого приема пищи, протекают по типу тяжелого вегетативного криза (ЧСС возрастает на 20–30 уд/мин, АД снижается на 15–20 мм рт. ст.) продолжительностью 1,5–2 часа. Боязнь приема пищи и резкие нарушения в процессе пищеварения и усвоения пищи приводят больных к истощению, характерен изнуряющий понос. Контраст из культи желудка эвакуируется за 5–10 минут, а его пассаж по тонкой кишке совершается за 2–2,5 часа.
Диагностика
Для определения предрасположенности к развитию демпинг-синдрома до операции применяют метод Фишера – Стаффорда: интраеюнально через дуоденальный зонд вводят 150 мл 50% раствора глюкозы, в последующем регистрируют в течение 60 минут жалобы больного, пульс, артериальное давление, электрокардиограмму и содержание глюкозы в крови [17].
В зависимости от времени появления симптомов и предполагаемой патофизиологии демпинг-синдром принято классифицировать на ранний и поздний [6, 11, 12]. В диагностике раннего и позднего демпинга выделяют следующие методы.
Провокационная проба. В настоящее время тест на толерантность к глюкозе является предпочтительным методом диагностики демпинг-синдрома [6, 11, 18]. При проведении данного теста пациент принимает внутрь 50 или 75 г глюкозы в растворе, далее с 30-минутными интервалами в течение трех часов измеряют концентрацию глюкозы в крови, уровень гематокрита, ЧСС и АД [19]. Тест считается положительным, если возникает поздняя (120–180 минут) гипогликемия или если происходит раннее (30 минут) повышение уровня гематокрита более чем на 3%. Наиболее чувствительным признаком раннего демпинг-синдрома является увеличение частоты пульса более чем на 10 уд/мин через 30 минут [6, 11, 12, 18, 20–22]. Большинство исследований рассматривают гликемию ниже 60 мг/дл, обычно возникающую между 90 и 180 минутами после приема глюкозы, как диагностику синдрома позднего демпинга. Гипогликемия является маркером позднего демпинг-синдрома и, следовательно, при наличии позволяет диагностировать демпинг-синдром. В то же время ее отсутствие не исключает диагноза демпинг-синдрома, так как ранний демпинг-синдром может присутствовать при отсутствии позднего демпинг-синдрома [11].
Рентгенологическое исследование с оценкой пассажа контрастного вещества из культи желудка и по кишечнику. Для демпинг-синдрома характерны быстрое опорожнение культи желудка от принятого контрастного вещества, значительное усиление перистальтики тонкой и толстой кишки, сменяющееся инертностью. Также характерен провал первой 1/3 или 1/2 порции контрастной взвеси из желудка в тощую кишку в течение 1–2 минут с более длительной эвакуацией оставшейся части контраста.
Дифференциальную диагностику демпинг-синдрома следует проводить пациентам с инсулиномой, нейроэндокринными опухолями, болезнью Крона, частичной кишечной непроходимостью, хроническим энтеритом, секреторной недостаточностью поджелудочной железы [17, 19, 23].
Основополагающим этапом лечения демпинг-синдрома является изменение диеты. Пациентам показано частое дробное питание небольшими порциями, рекомендуется отложить прием жидкости как минимум на 30 минут после еды и исключить быстро усваиваемые углеводы, которые присутствуют во всех сладких продуктах и напитках. Рекомендуется придерживаться диеты, состоящей из продуктов с высоким содержанием клетчатки и белков. Кроме того, пациентам желательно принять горизонтальное положение в течение 30 минут после еды, чтобы задержать опорожнение желудка и уменьшить симптомы гиповолемии [24–28].
Фармакотерапия включает в себя применение акарбозы – ингибитора альфа-гликозидазы, который замедляет высвобождение моноглицеридов из пищевых углеводов. Большинство исследований демонстрируют, что акарбоза улучшает толерантность к глюкозе, снижает выработку гастроинтестинальных гормонов и частоту гипогликемии, которая является основным признаком синдрома позднего демпинга [29–36]. Обычно доза акарбозы составляет 50–100 мг три раза в день во время еды. Основными побочными эффектами являются метеоризм и связанное с ним вздутие живота из-за мальабсорбции углеводов.
Аналоги соматостатина способны замедлять скорость опорожнения желудка, транзит по тонкой кишке, подавлять высвобождение желудочно-кишечных гормонов и секрецию инсулина и снижать постпрандиальную вазодилатацию. Таким образом, аналоги соматостатина потенциально полезны как при раннем, так и при позднем демпинг-синдроме. Их эффективность при демпинг-синдроме была первоначально подтверждена серией случаев [37–43], а затем несколькими рандомизированными контролируемыми исследованиями [20, 44–47]. Исследования, проведенные в Нидерландах и Бельгии, показали, что аналоги соматостатина как короткого, так и длительного действия обеспечивают симптоматическое улучшение, но пациенты предпочитают препараты длительного действия из-за меньшего количества инъекций [12, 19, 45, 38, 43]. Вместе с тем J. Arts. и соавт. отметили, что лучший контроль симптомов был достигнут при применении октреотида короткого действия три раза в день, чем при применении октреотида длительного действия ежемесячно [12, 27, 45]. Данные тестов с провокацией глюкозой и оценкой уровня гематокрита и/или частоты пульса предоставляют объективные доказательства эффективности октреотида как при раннем, так и при позднем демпинг-синдроме
[12, 21].
Пациентам с тяжелой формой гипогликемии, не отвечающим на изменение диеты и фармакотерапию, показано рассмотрение возможности повторного хирургического вмешательства. Основной целью оперативного лечения является замедление пассажа из культи желудка и отводящей петли.
Реконструктивная гастроеюнодуоденопластика является наиболее распространенной операцией, посредством которой осуществляется замедление опорожнения оперированного желудка и/или пассажа по отводящей петле кишки, в ряде случае формируется искусственный резервуар (после гастрэктомии).
Международный консенсус по диагностике и лечению демпинг-синдрома
С учетом отсутствия четких критериев, алгоритмов диагностики и терапии демпинг-синдрома в 2020 г. был проведен консенсус, посвященный этим проблемам. На основе положений консенсуса дан ряд рекомендаций по ведению пациентов с демпинг-синдромом (таблица).
Группа экспертов достигла согласия по нескольким аспектам, включая определение, характер симптомов и предполагаемую патофизиологию. В дополнение к диетическим рекомендациям широко распространенными методами лечения являются аналоги акарбозы и соматостатина. В процессе работы над консенсусом также были выявлены области, нуждающиеся в дальнейших исследованиях, такие как разработка и оценка диагностических опросников, согласование пороговых уровней гликемии для достоверного диагноза, оценка терапевтической эффективности акарбозы при симптомах раннего демпинга и относительной эффективности аналогов соматостатина короткого действия по сравнению с аналогами соматостатина пролонгированного действия.
Несмотря на то что демпинг-синдром является распространенным осложнением хирургических вмешательств, на сегодня нет установленных руководств по его критериям постановки диагноза и ведению пациентов. По итогам консенсуса были разработаны алгоритмы диагностики и лечения демпинг-синдрома:
Синдром приводящей петли ( Пострезекционное дуоденобилиарное расстройство , Синдром желчной рвоты )
Синдром приводящей петли — постгастрорезекционное расстройство, представленное застоем содержимого в слепом отделе кишечника с последующим рефлюксом в желудок. Проявляется рвотой после еды, болями в эпигастрии и справа в подреберье, диспепсическими явлениями, асимметрией живота. Диагностируется с помощью контрастной рентгенографии, УЗИ брюшной полости, эзофагогастродуоденоскопии, копрограммы. Для лечения используются миотропные спазмолитики, панкреатические ферменты, эубиотики, инфузионная терапия. Хирургические методы представлены различными способами реконструкции анастомоза.
МКБ-10
Общие сведения
Причины синдрома приводящей петли
Заболевание вызвано нарушением моторно-эвакуаторной функции кишечника под действием механических и функциональных факторов. Непосредственной причиной возникновения синдрома является застой в приводящей петле тощей кишки дуоденального содержимого и части химуса, попавшей из желудка. У 95% больных предпосылки дуоденобилиарного синдрома имеют органический характер:
- Технические погрешности при проведении операции. Опорожнение культи двенадцатиперстной кишки ухудшается при избыточной длине приводящей петли, отсутствии брауновского анастомоза. Пассаж кишечного содержимого нарушается при антиперистальтическом расположении кишки для анастомоза, перегибе слишком короткого слепого отрезка кишечника, фиксированного к малой кривизне желудка.
- Патологические изменения кишечника и анастомоза. Застой в кишечной культе провоцирует выпадение ее слизистой в просвет отводящей петли или желудок, рубцовую деформацию, стенозирующую пептическую язву анастомоза. Острый дуоденостаз возникает при продольном перекруте, завороте приводящей петли, ее инвагинации в гастроэнтероанастомоз, межкишечное соустье, отводящую кишку.
- Сдавление, ущемление приводящей петли. Внешняя компрессия выхода из еюно-дуоденальной культи наблюдается при спаечной болезни, мезентериальном лимфадените, объемных процессах брюшной полости и забрюшинного пространства — опухолях поджелудочной железы, почки, эхинококковых кистах и др. При наличии внутренних грыж приводящая петля ущемляется брыжейкой тонкого и толстого кишечника.
Постгастрорезекционная дуоденобилиарная болезнь может иметь функциональное происхождение. У части пациентов отмечается неорганический спазм приводящей и отводящей петли, анастомоза. Дуоденостаз выявляется при первичной дискинезии двенадцатиперстной кишки, снижении тонуса и моторики кишечной стенки из-за интраоперационных повреждений мышечной оболочки, волокон блуждающего нерва. Гипокинезия также формируется вследствие парасимпатической денервации при ваготомии.
Патогенез
Механизм развития синдрома приводящей петли связан с нарушением естественного пассажа содержимого слепой дуоденально-еюнальной культи кишечника и его рефлюксом в резецированный желудок. При попадании пищи в оставшуюся двенадцатиперстную кишку выделяется холецистокинин, стимулирующий образование за сутки до 1,5-2 литров пищеварительных соков — панкреатического и кишечного секрета, желчи. При неправильно сформированном анастомозе в расширенной приводящей петле застаивается часть пищи, поступившей из желудка. Появление механических или функциональных препятствий для оттока содержимого культи в отводящую петлю провоцирует дуоденостаз, который усугубляется еюногастральным рефлюксом с возникновением рвоты, щелочного гастрита, эзофагита. Из-за постоянной потери дуоденального содержимого с рвотными массами болезнь приводящей петли осложняется вторичной панкреатической недостаточностью, кишечным дисбактериозом.
Классификация
Систематизация клинических форм синдрома проводится с учетом этиологического фактора, времени возникновения, динамики нарастания и выраженности клинических проявлений. В зависимости от причин, спровоцировавших патологическое состояние, различают механический и функциональный варианты болезни. Внезапный полный дуоденостаз, вызванный органическими изменениями и выявляемый не более чем у 2% пациентов, считается острой формой дуоденобилиарного расстройства. При хроническом синдроме желчной регургитации, который диагностируется у большинства больных, нарушение эвакуации дуоденального содержимого является частичным. Для выбора врачебной тактики важно учитывать тяжесть заболевания:
- I (легкая) степень. Срыгивание, рвота пищевыми массами с примесью или без примеси желчи возникает не чаще 1-2 раз в месяц после употребления молокопродуктов. Диспепсия и болевой синдром мало выражены, общее состояние удовлетворительное.
- II (средняя) степень. Рвота пищей с примесью желчи беспокоит пациента до 2-3 раз в неделю. Ей предшествует тяжесть в правой подреберной области и эпигастрии. Объем рвотных масс составляет до 300 мл. Отмечается потеря веса.
- III (тяжелая) степень. Рвота с отхождением до 500 мл и более рвотных масс отмечается практически каждый день. Больной жалуется на распирание в эпигастрии, правом подреберье. Выражено истощение, снижена трудоспособность.
- IV (очень тяжелая) степень. Кроме диспепсического и болевого синдрома наблюдаются алиментарно-метаболические нарушения. Характерно резкое истощение, развитие анемии, безбелковых отеков, дистрофии паренхиматозных органов.
Симптомы синдрома приводящей петли
Острый дуоденостаз проявляется резкой болью в области правого подреберья, эпигастрии, тошнотой, рвотой без желчи. Общее состояние пациента быстро ухудшается: нарастает интоксикация, учащается пульс, падает артериальное давление. Возможно развитие механической желтухи. При хроническом течении клинические проявления возникают в среднем через полчаса после приема пищи. У больных появляются постепенно нарастающие боли в правом подреберье и эпигастральной области, диспепсический синдром, для которого характерна тошнота, отрыжка, изжога, неприятный запах изо рта. Наблюдается обильная рвота непереваренной пищей и желчью, после чего пациенты обычно чувствуют облегчение, в связи с чем при тяжелом течении расстройства сами вызывают регургитацию. Вследствие значительного растяжения приводящей петли живот становится асимметричным. При длительном течении заболевания нарушается общее состояние: отмечается слабость, эмоциональная лабильность, снижается трудоспособность, прогрессирует потеря массы тела.
Осложнения
Вследствие хронического застоя желчи и вторичного инфицирования желчевыводящих путей развивается синдром холестаза с желтушностью склер и кожных покровов, зудом, увеличением и болезненностью печени. Длительная билиарная гипертензия может спровоцировать возникновение холангита, панкреатита. Продолжительный застой кишечного содержимого приводит к размножению патогенных микроорганизмов и формированию синдрома слепой петли, основными проявлениями которого являются мальабсорбция, стеаторея, нарушение всасывания жирорастворимых витаминов. При стенозе приводящей петли наблюдается полинейропатия и снижение когнитивных функций, вызванные дефицитом витамина В12. Наиболее опасные осложнения заболевания — разрыв двенадцатиперстной кишки, несостоятельность анастомоза, ишемия, гангрена кишечника, становящиеся причиной выхода кишечного содержимого в полость брюшины, развитию перитонита.
Диагностика
Постановка диагноза синдрома приводящей петли не представляет затруднений при наличии типичной клинической картины и анамнестических сведений о предшествующей резекции желудка. Диагностика включает комплексное лабораторное и инструментальное обследование, которое проводится для определения степени тяжести заболевания и оценки состояния других органов пищеварительного тракта. Наиболее информативными являются:
- Контрастная рентгенография брюшной полости. Выполнение серии рентгенограмм после перорального контрастирования подтверждает заброс и длительную задержку контрастного вещества в просвете приводящей петли, рубцовую деформацию в области анастомоза. Могут определяться признаки атонии тонкого кишечника.
- Эзофагогастродуоденоскопия. При эндоскопическом исследовании визуализируется расширенная петля кишечника, заполненная застойным содержимым, наблюдается деформация гастроеюноанастомоза. Обнаруживаются признаки воспалительного процесса в культе желудка, тощей кишке, атрофия слизистой.
- УЗИ органов брюшной полости. Сонография производится для оценки структурных изменения в поджелудочной железе и органах гепатобилиарной системы. Ультразвуковой метод позволяет выявить расширение желчевыводящих протоков, утолщение стенки желчного пузыря, неоднородность эхоструктуры печени.
- Копрограмма. Бактериоскопическое исследование осуществляется для верификации синдрома слепой кишечной петли. В кале определяется большое количество нейтральных жиров, непереваренных мышечных волокон и клетчатки. Отсутствие стеркобилина указывает на присоединение механической желтухи.
Изменения в общем анализе крови (лейкоцитоз, увеличение СОЭ) наблюдаются при присоединении вторичной инфекции, развитии воспаления приводящей петли. При биохимическом исследовании крови выявляется повышенное содержание АЛТ, АСТ, щелочной фосфатазы, прямого билирубина, возможно появление изменений, характерных для синдрома мальабсорбции, — гипопротеинемии, гипогликемии, гипокальциемии. Дифференциальная диагностика проводится с пептическими язвами анастомоза и культи желудка, демпинг-синдромом, злокачественными новообразованиями пищеварительного тракта, паразитарными инвазиями, панкреатитом, гепатитом, холециститом. Кроме наблюдения гастроэнтеролога пациенту рекомендованы консультации хирурга, онколога, инфекциониста, гепатолога.
Лечение синдрома приводящей петли
Пациентам с легкими и умеренно выраженными хроническими расстройствами показана коррекция диеты и консервативная терапия. Рекомендовано частое дробное питание с исключением молочных, сладких и других продуктов, провоцирующих усиленную секрецию дуоденального сока. С учетом причин возникновения дуоденобилиарного синдрома с заместительной и корригирующей целью могут назначаться:
- Миотропные спазмолитики. Эффективны при функциональных расстройствах. За счет устранения спазма облегчается отток дуоденального секрета в отводящую кишечную петлю, устраняются предпосылки для еюногастрального рефлюкса, уменьшается выраженность болевого синдрома.
- Заместительная энзимотерапия. Для восполнения потерь панкреатического секрета показаны ферментные препараты, улучшающие процессы пищеварения. Таблетированные энзимы компенсируют недостаточность ферментов, расщепляющих в кишечнике жиры, крахмал и белки.
- Инфузионная терапия. При дегидратации и недостаточности энтерального питания рекомендовано введение глюкозо-солевых, коллоидных растворов, аминокислотных и белковых препаратов, витаминов. В более тяжелых случаях переливают кровезаменители, компоненты крови.
- Эубиотики. Бактериальных антагонистов патогенных и условно-патогенных микроорганизмов используют для предупреждения или устранения дисбиоза кишечника, восстановления нормальной кишечной микрофлоры. Опосредованным эффектом пробиотиков является улучшение пищеварения.
Экстренное хирургическое лечение требуется пациентам с острым дуоденостазом: во время релапаротомии устраняется еюногастральная инвагинация, внутренняя грыжа, расправляется заворот, рассекаются спайки, накладывается межкишечный анастомоз, выполняется резекция двенадцатиперстной, тощей кишки при их некрозе. При тяжелом хроническом течении синдрома желчной регургитации операция проводится в плановом порядке. Оптимальным решением для большинства больных является реконструктивная резекция по Бильрот I. При полном выключении кислотообразующей функции желудка возможно создание У-образного соустья. Больным с сочетанием дуоденобилиарного и демпинг-синдрома осуществляется гастродуоденоеюнопластика. Эффективным также является формирование энтероэнтероанастомоза по Брауну.
Прогноз и профилактика
Исход заболевания при I-II степени тяжести болезни благоприятный, у большинства пациентов выздоровление наступает после назначения диеты и фармакотерапии. Прогноз становится сомнительным в случае острого или тяжелого течения заболевания с некротическими изменениями в стенке приводящей петли. Профилактика включает тщательный выбор способа резекции, сохранение физиологического положения культи желудка и петли тонкого кишечника после наложения анастомоза, создание брауновского межкишечного соустья, тщательное ушивание всех окон брыжейки. В послеоперационном периоде важно обеспечить динамическое наблюдение, рекомендовать пациенту специальную диету с ограничением пищи, богатой жирами и углеводами.
1. Хирургия язвенной болезни желудка и двенадцатиперстной кишки/ Черноусов А.Ф., Богопольский П.М., Курбанов Ф.С. – 1996.
3. Профилактика и лечение осложнений при резекции желудка по поводу язвенной болезни желудка и двенадцатиперстной кишки: автореферат диссертации/ Коноваленко В.Г. – 2004.
Болезни оперированного желудка
Болезни оперированного желудка — это патологические состояния, возникшие после гастрорезекционных вмешательств и патогенетически связанные с ними. Проявляются диспепсическими расстройствами, болью в эпигастрии, вазомоторными и нейровегетативными реакциями, метаболическими и нутриционными нарушениями. Диагностируются с помощью рентгенографии желудка, эзофагогастродуоденоскопии, общего и биохимического анализа крови. Для лечения используют серотониновые, симпато- и холиноблокаторы, заместительную ферментную терапию, седативные средства, спазмолитики, прокинетики, антибактериальные препараты, эубиотики. При необходимости выполняют повторные операции.
Симптомы постгастрорезекционной болезни развиваются у 20-45% пациентов после удаления 2/3-3/4 органа, проведения ваготомии и антрумэктомии. У 2,5-3% больных тяжесть клинической картины оперированного желудка превышает тяжесть первичного заболевания. В связи с успехами консервативной терапии язвенной болезни, после хирургического лечения которой в прошлом обычно развивались постгастрорезекционные расстройства, в настоящее время превалируют синдромы, связанные с удалением органа по поводу рака.
Причины
Развитие болезней оперированного желудка может быть обусловлено как изменением физиологических условий функционирования органов ЖКТ, так и врачебными ошибками, допущенными в ходе операции и послеоперационном периоде. Зачастую факторы, провоцирующие возникновение БОЖ, сочетаются и усиливают эффект друг друга. По мнению специалистов в сфере гастроэнтерологии, основными причинами постгастрорезекционной болезни являются:
- Перестройка системы пищеварения. У пациентов, перенесших объемную дистальную резекцию, отсутствует антральный отдел, продуцирующий основную часть гастрина и соляной кислоты, что сказывается на эффективности переваривания белков. Потеря резервуарной функции органа способствует попаданию в просвет тонкой кишки недостаточно подготовленной пищи, которая плохо переваривается и всасывается. При выполнении резекции методом Бильрот-2 из процесса пищеварения практически исключается двенадцатиперстная кишка. Осложнением ваготомии зачастую становится нарушение эвакуации химуса из полости желудка.
- Технические ошибки при выполнении вмешательства. Риск развития различных расстройств оперированного желудка возрастает при выборе неподходящей техники операции, избыточной или недостаточной по объему резекции органа, которая существенно влияет на секреторно-эвакуаторную функцию либо способствует дальнейшему прогрессированию заболевания. Нормальному прохождению химуса может препятствовать неправильное наложение швов при формировании анастомозов и ушивании культи. Отсутствие шпоры при создании гастроеюноанастомоза часто провоцирует синдром приводящей петли.
- Патологический преморбидный фон. При наличии сопутствующей патологии снижаются постоперационные компенсаторные возможности пищеварительной системы. У 42% пациентов с синдромом оперированного желудка диагностируются болезни ЖКТ, у 49% — хронические заболевания других органов и систем. Постгастрорезекционные расстройства с большей вероятностью развиваются при недостаточном уровне вазоактивного интестинального полипептида, мотилина, холецистокинина, энкефалинов и других гастроинтестинальных гормонов, секретируемых диффузной нейроэндокринной системой для регуляции процессов пищеварения.
По наблюдениям некоторых исследователей, постгастрорезекционная болезнь чаще встречается у пациентов, имеющих психические травмы и стрессы в анамнезе. У 42% больных с БОЖ установлена связь предшествовавшей язвенной болезни с физическими травмами, заболеваниями ЦНС. В таких случаях послерезекционные нарушения протекали тяжелее, с резко выраженной невротической симптоматикой. В группу повышенного риска входят пациенты холерического и меланхолического склада с неуравновешенным и слабым типами высшей нервной деятельности, больные, которые из экономических соображений отказались от поддерживающего медикаментозного лечения.
Механизм развития постгастрорезекционных расстройств основан на различных сочетаниях нарушений гастроинтестинальной секреции, моторики и всасывания, а также их влиянии на работу других органов. Патогенез конкретного патологического состояния зависит от вызвавших его причин. В большинстве случаев пусковыми моментами являются снижение выработки компонентов желудочного сока и ускоренный пассаж химуса в кишечник, повышающие функциональную нагрузку на тонкую кишку, гепатобилиарную систему, панкреатическую железу оперированного пациента. В ответ на поступление гипертонического химуса усиливается секреция жидкого компонента кишечного сока, увеличивается приток крови к внутренним органам, часто возникает диарея.
Уменьшение объема циркулирующей крови сопровождается развитием гемодинамических расстройств и неврологической симптоматики. При растяжении тонкой кишки большим объемом пищевых масс, которые транзитом поступили из желудка, происходит массивный выброс серотонина, приводящий к нарушению регуляции активности головного мозга. Рефлекторное усиление секреции инсулина поджелудочной железой вызывает падение уровня глюкозы. Конечным итогом недостаточного переваривания и всасывания белков, жиров, углеводов, витаминов, ключевых макро- и микроэлементов, в первую очередь – железа, становятся нарушения обмена веществ и кроветворения, значительное снижение массы тела, полиорганные расстройства.
У части оперированных пациентов ведущую роль играет застой пищевых масс в разных отделах ЖКТ — в двенадцатиперстной кишке (при болезни приводящей петли) либо в желудке (после ваготомии). Кишечный стаз или гастростаз, нарушающий процессы пищеварения, приводит к растяжению стенки соответствующего органа с возникновением болевого синдрома, способствует развитию дисбактериоза, гнилостного брожения. При некоторых состояниях происходит обратный заброс кишечного и желудочного содержимого в расположенные выше отделы ЖКТ с раздражением их слизистой оболочки, возникновением реактивного воспаления, атрофических и неопластических процессов.
При систематизации различных форм болезни оперированного желудка учитывают патогенез постгастрорезекционного синдрома, отсутствие или наличие органических изменений, особенности клинических проявлений. С учетом техники вмешательства в абдоминальной хирургии различают пострезекционную и постваготомическую патологию. В группе болезней, возникших после удаления части желудка, в свою очередь, выделяют:
- Функциональные расстройства. Связаны с нарушением нейрогуморальной регуляции пищеварительных процессов и пассажа химуса. Наблюдаются у 70% оперированных пациентов с БОЖ, в части случаев предшествуют органической патологии или сочетаются с ней. К этой категории заболеваний относят ранний и поздний (гипогликемический) синдромы, синдромы малого желудка и приводящей петли функционального происхождения, пищевую аллергию, дуодено- или еюногастральный, гастроэзофагальный рефлюксы, постгастрорезекционную астению, постваготомическую диарею.
- Органические нарушения. Сопровождаются морфологическими изменениями оперированных органов. Группа органических болезней представлена синдромом приводящей петли механического происхождения, рецидивирующей, в том числе пептической язвой, язвенным дефектом в рамках синдрома Золлингера-Эллисона, желудочно-кишечным свищом, рубцовой деформацией и сужением анастомоза, анастомозитом, раком культи, дистальным пептическим эзофагитом, пищеводом Баррета, сопутствующим послеоперационным гепатитом, панкреатитом.
Постваготомическими болезнями считаются рецидивировавшая язва, послеоперационная диарея, дисфункция желудочной кардии с развитием пептического воспаления пищевода и гастроэзофагорефлюксной болезни, ускоренная (демпинг-синдром) или замедленная (гастростаз) эвакуация химуса, рефлюкс-гастрит щелочного генеза. С пересечением блуждающего нерва также могут быть ассоциированы другие заболевания ЖКТ — панкреатит, холелитиаз. В некоторых случаях (при демпинг-болезни, функциональном и механическом синдромах приводящей петли) оправдано выделение нескольких степеней тяжести.
Симптомы
Симптоматика зависит от вида болезни оперированного желудка. В клинической картине могут наблюдаться как гастроинтестинальные симптомы, так и системные вазомоторные, нейровегетативные нарушения. При наиболее распространенном раннем демпинг-синдроме спустя 20-25 минут после приема пищи возникает слабость, сосудистые реакции (краснота или побледнение кожи лица), мелькание мушек перед глазами, головокружение, учащается сердцебиение. Приступ может длиться от 15 минут до нескольких часов. Характерно появление диспепсических симптомов: ухудшения аппетита, отрыжки, тошноты, урчания, дискомфорта в эпигастрии.
У оперированного больного, страдающего гипогликемическим синдромом, через 2-3 часа после употребления легкоуглеводистых продуктов внезапно развивается выраженная слабость, потливость, озноб. Пациент предъявляет жалобы на головокружение, сильное чувство голода. Урежается пульс, падает АД. Приступ обычно длится 5-20 минут. При синдроме приводящей петли отмечается тошнота, тяжесть в правой подреберной области, отрыжка. Типичный признак болезни — обильная рвота желчью и пищей, съеденной накануне, с последующим улучшением состояния. При прогрессировании заболевания присоединяются общие нарушения: потеря веса, слабость, снижение трудоспособности, отеки.
Клинические проявления пептических язв оперированного желудка выявляются через 6-12 месяцев после хирургического вмешательства. У пациентов возникает выраженный болевой синдром, который не связан с приемом пищи. Возможны диспепсические расстройства. Основными симптомами пострезекционной анемии являются слабость, бледность кожных покровов, одышка, головокружение, глоссит (воспаление языка), тахикардия. В тяжелой стадии болезни могут появляться боли в ногах, парестезии, снижение мышечной силы. У четверти оперированных наблюдается снижение веса ниже рекомендованного или невозможность восстановить дооперационный вес.
Из-за ускоренного продвижения пищи по кишечнику у пациентов после гастрорезекции возникают нарушения всех видов обмена, что клинически проявляется авитаминозами, тяжелыми электролитными сдвигами, остеопорозом, частыми переломами, сухостью кожи, выпадением волос, ломкостью ногтей, снижением остроты зрения, в терминальных стадиях — кахексией. При прогрессировании болезни возможны коллаптоидные состояния, требующие неотложной помощи.
Частыми осложнениями пептических язв являются прободение, сопровождающееся профузным кровотечением, пенетрация в соседний орган. При длительном течении анемии формируется гипоксия, которая может приводить к энцефалопатии, дистрофическим изменениям во внутренних органах. Развитие щелочного рефлюкс-гастрита с атрофией эпителиального слоя, ахлоргидрией повышает риск малигнизации желудочной культи. После резекции зачастую наблюдаются вторичные гнойные осложнения вследствие угнетения иммунитета.
Диагностический поиск при болезни оперированного желудка направлен на уточнение степени функциональных и органических нарушений, оценку состоятельности анастомоза, выявление критических состояний, требующих неотложной терапии. Обследование пациента осуществляется комплексно с применением таких лабораторных и инструментальных методов, как:
- Клинический анализ крови. Для пострезекционной В12-дефицитной анемии характерны изменения в виде уменьшения содержания эритроцитов и гемоглобина, увеличения цветного показателя более 1,05, появления макроцитов. Метод дополняют проведением биохимического исследования крови – при заболеваниях оперированного желудка наблюдается гипопротеинемия, повышение уровня печеночных ферментов, снижение концентрации глюкозы.
- Рентгенологическое исследование. При демпинг-синдроме на рентгенограммах желудка выявляют стремительное продвижение контраста в тонкую кишку и расширение отводящей петли. Типичные рентгенологические признаки рецидивировавшей язвы – симптом «ниши» (депо бария), конвергенция складок слизистой оболочки. В случае расстройства приводящей петли при рентгеноскопии натощак определяется жидкость в желудочной культе, что связано с ее рефлюксом из кишечника.
- Эзофагогастродуоденоскопия. Введение эндоскопа через пищевод в желудок и 12-перстную кишку позволяет оценить состояние слизистой оболочки пищеварительного тракта, обнаружить воспалительные изменения и нарушения моторики, установить локализацию язвенного дефекта, его размеры. Язвы чаще всего располагаются в зоне анастомоза или в отводящей петле. Во время ЭГДС может выполняться биопсия для последующего гистологического анализа.
При возможном рецидиве язвы рекомендовано выполнение анализа кала на скрытую кровь. Для верификации диагноза демпинг-синдрома производится провокационная проба – при положительном результате наблюдается ухудшение состояния пациента через 15-20 минут после перорального приема 150 мл гипертонического раствора глюкозы. Больным с постгастрорезекционной болезнью может потребоваться обследование других органов ЖКТ: УЗИ желчного пузыря, поджелудочной железы, МСКТ брюшной полости, МРТ-панкреатохолангиография и др.
Дифференциальная диагностика патологии оперированного желудка проводится со злокачественными новообразованиями ЖКТ, синдромом Золлингера-Эллисона, частичной кишечной непроходимостью, желудочно-кишечным свищем, хроническим энтеритом, болезнью Крона, инсулиномой, нейроэндокринными опухолями, гипопластической анемией. Кроме наблюдения у врача-гастроэнтеролога и абдоминального хирурга пациенту рекомендованы консультации гематолога, онколога, эндокринолога, инфекциониста, невролога.
Лечение болезней оперированного желудка
Выбор врачебной тактики определяется особенностями патологического постгастрорезекционного состояния. С учетом этапа развития болезни и выраженности симптоматики могут применяться как терапевтические, так и хирургические подходы к лечению БОЖ. Независимо от патологии всем пациентам показана диета с исключением ингредиентов, к которым выявлена непереносимость, жареной, копченой, консервированной, острой, горячей пищи, легкоусвояемых углеводов. В рационе рекомендуется увеличить долю богатых клетчаткой овощей, фруктов, зелени, отрубей, ягод, каш, диетического мяса (говядины, курятины, крольчатины). Питание должно быть частым, дробным (до 6-8 приемов пищи в день). Для коррекции отдельных симптомов оперированного желудка применяют следующие группы медикаментозных средств:
- Неселективные β-блокаторы. Замедляют эвакуацию химуса из желудка и перистальтику тонкого кишечника у больных с демпинг-синдромом. При постоянном приеме медикаментов в малых дозах симптоматика болезни уменьшается либо полностью исчезает. С аналогичной целью назначают ганглиоблокаторы, блокаторы М-холинорецепторов, новокаиновые блокады.
- Ферментные препараты. Заместительная терапия способствует процессу переваривания пищи. При функциональной недостаточности оперированного желудка показан прием желудочного сока, соляной кислоты с пепсином. Для улучшения кишечного пищеварения используют полиферментные средства, ферменты с двухэтапным эффектом, холинолитики.
- Седативные средства и транквилизаторы. Рекомендованы пациентам, у которых в структуре болезни ярко выражен нейровегетативный компонент. Обычно лечение начинают с растительных препаратов (настоев пустырника, валерианы, пиона), в более тяжелых случаях применяют малые дозы барбитуратов, производных бензодиазепина.
- Антагонисты серотонина. Назначение лекарственных средств патогенетически обосновано ролью серотонина в развитии демпинг-синдрома. При ускоренном пассаже пищи из оперированного желудка серотониновые блокаторы замедляют перистальтику кишечника и уменьшают выраженность вазомоторных расстройств за счет ингибирующего эффекта на уровне ЦНС.
- Спазмолитики и прокинетики. Выбор медикамента определяется типом нарушений, возникших после операции. Препараты применяются для нормализации процессов желчевыделения, моторно-эвакуаторной функции ЖКТ. Производные пиперидина способны замедлить кишечную пропульсию и повысить тонус сфинктеров, уменьшив выраженность демпинг-болезни.
- Антибактериальная терапия. Может потребоваться пациентам с симптомокомплексом приводящей петли. Курсовое назначение полусинтетических пенициллинов, тетрациклинов, сульфаниламидов позволяет устранить воспаление и санировать слепой участок петли от развившейся микрофлоры. Для уменьшения дисбиотических расстройств терапию дополняют эубиотиками.
Лечение послеоперационной или рецидивировавшей язвы производится по стандартам противоязвенных протоколов. Некоторым больным с заболеваниями оперированного желудка могут быть показаны антациды, противодиарейные и обволакивающие средства, энтеросорбенты. Для коррекции метаболических и нутриционных расстройств рекомендованы курсы витаминно-минеральных препаратов, восполняющих возможный дефицит витаминов группы В, железа. При терапевтической резистентности и прогрессировании постгастрорезекционной болезни требуется повторное оперативное вмешательство. С учетом клинической формы патологии проводится редуоденизация (гастроеюнодуоденопластика), хирургическая коррекция типа гастроэнтероанастомоза (сужение, реконструкция в анастомоз по Ру), дуоденоеюностомия, наложение Брауновского соустья.
В 75% случаев своевременное назначение адекватной терапии позволяет существенно улучшить или нормализовать состояние больного. У 25% пациентов наблюдается прогрессирование органических и функциональных осложнений резекции желудка, приводящее к стойкой утрате трудоспособности. Профилактика патологий оперированного желудка заключается в развернутом предоперационном обследовании, подборе вида хирургической методики в зависимости от симптоматики, соблюдении техники операции, правильном наложении анастомозов, выборе объема гастрорезекции с учетом кислотопродуцирующей желудочной функции, тщательном наблюдении за больным в послеоперационном периоде с последующим ежегодным проведением ЭГДС.
Демпинг-синдром
Демпинг-синдром – это патологическое состояние, развивающееся после резекции желудка вследствие нарушения нейрогуморальной регуляции деятельности пищеварительной системы. Течение демпинг-синдрома характеризуется вегетативными кризами с приступами головокружения, потливости, сердцебиения, слабости, развитием диспепсических явлений, обморочных состояний. Диагностика основывается на данных анамнеза, объективного обследования, рентгенологического исследования желудка и тонкой кишки. Лечение патологии легкой степени заключается в медикаментозной коррекции проявлений; при тяжело выраженных симптомах показана гастроеюнодуоденопластика.
Демпинг-синдром в современной гастроэнтерологии относится к так называемым болезням оперированного желудка или пострезекционным синдромам. Характеризуется ускоренной эвакуацией, «сбрасыванием» пищи из культи желудка в кишечник, что сопровождается нарушением углеводного обмена и функционирования пищеварительной системы. Развивается у 10-30% пациентов, перенесших операции на желудке, в ближайшем или отдаленном послеоперационном периоде. В большинстве случаев выражен в легкой или средней степени; тяжелая выраженность синдрома, требующая хирургического вмешательства, встречается в 1—9 % случаев, чаще у женщин.
Демпинг-синдром развивается в различные сроки после перенесенного хирургического вмешательства на желудке. Как правило, причиной резекции служит язва 12-перстной кишки или желудка, реже – рак желудка. Частота возникновения пострезекционного синдрома зависит от типа выполненной операции: максимальное число случаев демпинг-синдрома наблюдается после резекции желудка по Бильрот II, меньшее – после резекции по Бильрот-I, минимальное – после селективной проксимальной ваготомии или стволовой ваготомии с пилоропластикой.
Механизм развития патологии обусловлен слишком быстрым поступлением необработанной пищи с высокой осмолярностью из желудка в верхние отделы тонкого кишечника. При стремительном опорожнении оперированного желудка и пассаже содержимого стенки кишки растягиваются, выделяется внеклеточная жидкость и биологически активные вещества (гистамин, серотонин, кинины), что сопровождается уменьшением ОЦК, вазодилатацией и усилением перистальтики кишечника.
Нарушается баланс гормонов желудочно-кишечного тракта: гастроингибирующего пептида, гастрина, нейротензина, энтероглюкагона и др.; изменяется эндокринная регуляция пищеварения, что проявляется вазомоторными и желудочно-кишечными реакциями. Вегетативные кризы при демпинг-синдроме в 2/3 случаев протекают по вагоинсулярному типу, у 1/3 пациентов – по симпатоадреналовому типу.
По времени развития вегетативного криза различают ранний и поздний демпинг-синдром: в первом случае симптоматика появляется через 10-15 минут после еды, во втором – спустя 2-3 часа после приема пищи. По степени тяжести проявлений патология может протекать в легкой (I), средней (II) или тяжелой (III) степени. Легкая степень реакции развивается только в связи с приемом сладких или молочных блюд; в этом случае отмечается небольшая слабость, головокружение, потливость, учащение пульса на 10-15 уд. в мин., сердцебиение. Приступ продолжается до 30 мин.; дефицит массы тела больного не превышает 5 кг, трудоспособность не страдает.
Демпинг-синдром средней тяжести развивается в ответ на прием любой пищи; слабость вынуждает пациента лечь, пульс учащается на 20-30 уд. в мин., повышается систолическое давление. Больные отмечают тошноту, боли в животе, бурную кишечную перистальтику, профузный понос, шум в ушах, зябкость конечностей, которая сменяется чувством жара. Продолжительность приступа до 1 часа; дефицит массы составляет до 10 кг; трудоспособность нарушена. Тяжелый демпинг-синдром харатеризуется симптоматикой ярко выраженного вегетативного криза. Типична тахикардия (иногда брадикардия), лабильность АД, обмороки, страх смерти. Криз длится от 1 до 2 часов и заканчивается обильным мочеиспусканием. Больной истощен, нетрудоспособен.
Клиническое течение патологии характеризуется общими, вазомоторными и желудочно-кишечными проявлениями. Клиника раннего демпинг-синдрома развивается через 10-15 мин после еды, характеризуется слабостью, головокружением, вплоть до обморочного состояния, головной болью, сердцебиением, кардиалгией, обильным потоотделением, чувством жара. Одновременно появляются боли в эпигастрии, рвота, метеоризм, кишечные колики, понос. Тяжелый приступ вынуждает пациента принимать горизонтальное положение на 2-3 часа после еды.
Поздний (гипогликемический) вариант синдрома развивается спустя 2-3 ч после приема пищи. Его механизм связан с повышением уровня глюкозы в крови в период ранней демпинг-реакции и следующей за этим избыточной секрецией инсулина, снижающей концентрацию сахара в крови до субнормальных значений. В момент приступа ощущается резкая слабость, чувство голода, дрожь, обильное потоотделение, головокружение, гипотония, брадикардия, острая боль в эпигастрии. Эти симптомы быстро исчезают после приема углеводистой пищи. Демпинговая атака длится от 30 мин. до 1 часа.
Демпинг-синдром диагностируется на основании данных анамнеза (резекция желудка), субъективных и объективных проявлений. При рентгенографии желудка определяется стремительное опорожнение оперированного желудка от контрастной взвеси. В ходе рентгенографии пассажа бария по тонкому кишечнику отмечается ускоренное продвижение бария, дискинезия тонкой кишки. В диагностике применяются провокационные пробы: демпинг-реакция может быть вызвана приемом концентрированного раствора глюкозы или сладкого сиропа. Из лабораторных тестов используется определение уровня глюкозы крови, инсулина, альбуминов.
Дифференциальную диагностику демпинг-синдрома проводят с инсулиномой, нейроэндокринными опухолями, болезнью Крона, частичной кишечной непроходимостью, хроническим энтеритом, секреторной недостаточностью поджелудочной железы. Пациентам, страдающим данным расстройством, необходима консультация невролога для выявления и коррекции вегетативно-сосудистых и нервно-психических нарушений.
Лечение демпинг-синдрома
При легкой степени патологии рекомендуется диета, основанная на высококалорийном дробном питании, ограничении жидкости и углеводов, полноценном витаминном составе пищи. Демпинг-синдром средней тяжести требует приема медикаментозных средств, снижающих перистальтику тонкого кишечника (ганглиоблокаторов, препаратов атропина, местных анестетиков), проведения общеукрепляющей терапии (введения р-ра глюкозы с инсулином, парентеральной витаминотерапии), назначения заместительной терапии (прием желудочного сока, соляной кислоты, ферментов - панкреатина). Применяют новокаиновые блокады поясничной области, многоканальную электрическую стимуляцию. При психоневрологических нарушениях показан прием нейролептиков.
При демпинг-синдроме тяжелой выраженности, неэффективности диетотерапии и комплексной медикаментозной терапии проводится хирургическое лечение - реконструктивная гастроеюнодуоденопластика. Суть оперативного вмешательства заключается в интерпозиции сегмента тонкой кишки (трансплантата из отводящей петли тощей кишки) между двенадцатиперстной кишкой и культей желудка. Благодаря наложению гастроеюнодуоденоанастомоза происходит восстановление пассажа пищи через 12-перстную кишку, нормализация пищевых рефлексов, функции ферменто- и желчевыделения, замедление пассажа пищевых масс в тощей кишке.
Чаще всего демпинг-синдром развивается в первые полгода после операции: у 50% пациентов со временем он становится выражен слабее, у 25% не прогрессирует, еще у 25% с годами нарастает. Прогрессирующая или тяжелая патология приводит к стойкой потере трудоспособности.
Профилактика состоит в широком применении органосохраняющих вмешательств в сочетании с ваготомией в хирургии язвенной болезни желудка. При необходимости проведения резекции желудка целесообразно наложение гастродуоденоанастомоза. В постоперационном периоде больному необходимо систематическое наблюдение врача-гастроэнтеролога, диетолога, эндокринолога, невролога; проведение психосоматической реабилитации, курортная терапия.
Читайте также:
