Маркерные и кольцевые хромосомы. Особенности
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Малые сверхчисленные маркерные хромосомы — это структурно ненормальные хромосомы, которые могут быть как дополнительными по отношению к нормальному карио-типу, так и заменяющими какую-либо хромосому. Их размер, как правило, меньше, чем размер хромосомы 20 на этой же метафазной пластинке [1]. В 86% случаев малые сверхчисленные маркерные хромосомы происходят из акроцентрических хромосом, в частности 75% происходят из хромосомы 15 [2]. Район 15q11—q13 известен своей нестабильностью и частыми перестройками. В результате появляются малые сверхчисленные маркерные хромосомы благодаря инверсии и дупликации проксимального конца хромосомы 15. Это приводит к тетрасомии 15p и частичной тетрасомии 15q. Клинические проявления у таких пациентов выражаются ранней центральной гипотонией, задержкой развития и интеллектуальной недостаточностью умеренной степени, эпилепсией и аутизмом. Описаны два типа маркерных хромосом, относящихся к inv dup (15) с различными фенотипическими признаками. Первый тип — метацентрическая или субметацентрическая гетерохроматиновая хромосома, у носителей которой в фенотипе не проявляются синдромы Прадера—Вилли/Ангельмана (критический район 15q11). Второй тип включает проявления синдрома Прадера—Вилли/Ангельмана, а маркерная хромосома содержит эухроматиновый участок (критический район 15q12 или 15q13). Большинство изодицентрических хромосом 15q12 или 15q13 возникает из двух гомологичных материнских хромосом во время мейоза, и их частота образования коррелирует с возрастом матери при беременности [2].
Материал и методы
Этика. Пациент вовлечен в исследование строго в соответствии с международными стандартами, которые включают в себя осведомленность об исследовании, согласие на участие в исследовании и гарантии конфиденциальности. Все исследования соответствовали этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации с поправками, внесенными в 2000 г.
Описание клинического случая. Пробанд — пациент мужского пола, возраст 6 лет. Во время беременности у его матери развилась преэклампсия, были угрозы прерывания. При рождении оценка по шкале Апгар 7/8 баллов, показана задержка внутриутробного развития по гипопластическому типу. Выявлена задержка психомоторного развития: удержание головы с 7 мес, научился сидеть к 1-му году жизни, в 2 года мог ходить с посторонней поддержкой. На момент обследования пациент использует в речи 5—6 простых слов, на обращенную речь не реагирует, навыков самообслуживания нет. Визуально отмечаются малые аномалии развития: макроцефалия с умеренно выраженной акроцефалией, высокий лоб, гипертелоризм, эпикант, широкое уплощенное переносье, маленький короткий нос, «рот карпа», расщелина мягкого неба, низкое расположение ушных раковин, макротия, сходящееся косоглазие, клинодактилия V пальцев кистей, конусовидная деформация концевых фаланг кистей. Нижние конечности с вальгусной деформацией, частичная кожная синдактилия II—III пальцев стоп. Со стороны половой системы отмечены двусторонний крипторхизм, паховая ретенция. По результатам ЭхоКГ отмечены малые сердечные аномалии: добавочная хорда левого желудочка, открытое овальное окно.
Получение суспензий клеток и GTG-окрашивание хромосом. Препараты метафазных хромосом были получены из кратковременных культур В-лимфоцитов венозной крови по стандартному протоколу [3]. GTG-окрашивание проводилось соответственно ранее описанной методике [3]. Метафазные пластинки анализировали с помощью микроскопа Olympus BX 53 и программного обеспечения ВидеоТест Карио 3.1 («iMicroTec», Россия).
Микродиссекция метафазных хромосом и флуоресцентная гибридизация in situ. Маркерные хромосомы были диссектированы по описанной ранее методике [4] с использованием микроскопа Olympus IX 51 и микроманипулятора Eppendorf Transferman NK2. ДНК диссектированных хромосом была амплифицирована с помощью набора для полногеномной амплификации GenomePlex Complete Whole Genome Amplification (WGA) Kit («Sigma-Aldrich», США). Полученные зонды метили дигоксигенином. Каждая библиотека была получена из одной копии маркерной хромосомы.
Для локализации генов рРНК использовали плазмиду pHr13, несущую гены 18S, 28S и 5,8S рРНК [5], которую амплифицировали и метили с помощью набора для полногеномной амплификации WGA («Sigma-Aldrich») как описано выше.
Флуоресцентную гибридизацию in situ всех использованных в исследовании зондов проводили по ранее описанной методике [4]. Метафазные пластинки анализировали с помощью флуоресцентного микроскопа Olympus BX 53 и программного обеспечения ВидеоТест FISH 2.0 («iMicroTec», Россия).
Результаты и обсуждение
Анализ кариотипа пробанда (рис. 1) Рис. 1. GTG-окрашенный кариотип пробанда. mar — маркерная хромосома. показал наличие маркерной хромосомы в 100% метафазных пластинок (n=74). Анализ кариотипов родителей показал отсутствие хромосомных патологий. Маркерная хромосома пациента представляет собой акроцентрическую хромосому, размером сопоставимую с хромосомой 20. Для установления происхождения маркерной хромосомы мы локализовали библиотеку сортированных хромосом человека на метафазных пластинках пациента. На маркерной хромосоме локализовалась библиотека хромосомы 15 (рис. 2, а), Рис. 2. Результаты флуоресцентной гибридизации in situ. а — локализация библиотеки хромосомы 15 на метафазных хромосомах пробанда; б — локализация библиотеки диссектированной маркерной хромосомы на метафазных хромосомах здорового контроля; в — локализация библиотеки диссектированной маркерной хромосомы на метафазных хромосомах пробанда; г — локализация генов рРНК на метафазных хромосомах пробанда. На рис. а, в, г стрелкой указана маркерная хромосома. при этом метилась проксимальная часть р-плеча. Для визуализации границ перестройки необходимо было провести реципрокный пэйнтинг. Для этого была выполнена микродиссекция маркерной хромосомы с последующей локализацией полученной библиотеки на метафазных пластинках пациента и здорового контроля. Всего было получено 3 библиотеки из индивидуальных маркерных хромосом. Локализация всех полученных библиотек на метафазных пластинках здорового контроля показала их гомологию с прицентромерными районами хромосомы 15 (см. рис. 2, б), а на хромосомах пациента — также с дистальным и проксимальным концами маркерной хромосомы (см. рис. 2, в). Хромосома 15 содержит ядрышкообразующие районы, которые показали гомологию участкам маркерной хромосомы. В связи с этим было принято решение локализовать гены рРНК на метафазных пластинках пациента. Результат локализации показал наличие двух кластеров генов рРНК на проксимальном и дистальном концах маркерной хромосомы (см. рис. 2, г).
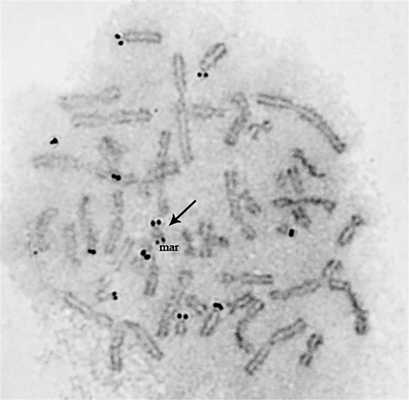
Для оценки активности кластеров рДНК на маркерной хромосоме проведенно окрашивание хромосом пробанда с помощью нитрата серебра. В результате показано, что оба кластера рДНК на маркерной хромосоме являются активными (рис. 3). Рис. 3. Окрашивание активных ядрышкообразующих райо- нов на метафазных хромосомах пробанда. Стрелкой указана маркерная хромосома.
Описанная перестройка затрагивает район 15q11—q13, известный своей нестабильностью. В нем часто формируются точки разрыва с последующим формированием маркерных хромосом, что приводит к тетрасомии 15p и частично 15q. Клиническая и цитогенетическая картина, характерная для этого пациента, соответствует синдрому дупликации 15q11—q13, который зачастую сопровождается синдромами Прадера—Вилли или Ангельмана, так как затронут критический район для этих синдромов [6—9]. Особо следует отметить увеличение копийности генов рРНК, при котором на маркерной хромосоме экспрессируются дополнительные копии, что также может вносить вклад в развитие клинической картины. Ранее показано, что правильная сборка рибосом очень важна для дифференцировки нервных клеток, в частности для формирования дендритов [10], при этом нарушения синтеза рРНК приводили к развитию нейродегенерации у мышей [11]. Таким образом, данная перестройка приводит не только к дупликации критического района 15q11—q13, но и к появлению двух дополнительных районов ядрышкового организатора, нарушению количества рДНК и соответственно рРНК, что вносит свой вклад в формирование патологического фенотипа.
Благодарность. Авторы выражают благодарность М. Фергюсон-Смиту (Кембриджский университет, Великобритания) за предоставленные библиотеки хромосом человека.
Исследование выполнено при поддержке Российского научного фонда, грант 15−15−10001.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах:
Сведения об авторах
Телепова Алена Сергеевна (Alena S. Telepova) — старший лаборант, Институт молекулярной и клеточной биологии СО РАН, 630090, Новосибирск, Россия
Романенко Светлана Анатольевна (Svetlana A. Romanenko) — к.биол.н., старший научный сотрудник, Институт молекулярной и клеточной биологии СО РАН, 630090, Новосибирск, Россия
Лемская Наталья Анатольевна (Natalya A. Lemskaya) — к.биол.н., научный сотрудник, Институт молекулярной и клеточной биологии СО РАН, 630090, Новосибирск, Россия
Максимова Юлия Владимировна (Yulia V. Maksimova) — д.м.н., проф., заведующая кафедрой медицинской генетики, Новосибирский государственный медицинский университет, 630091, Новосибирск, Россия
Шорина Асия Ринатовна (Asia R. Shorina) — врач-генетик, Новосибирская городская клиническая больница №1, 630047, Новосибирск, Россия
Маркерные и кольцевые хромосомы. Особенности
Иногда на препаратах хромосом видны очень небольшие нераспознаваемые хромосомы, называемые маркерными хромосомами, часто в мозаичном состоянии. Они обычно встречаются дополнительно к нормальному набору хромосом, поэтому их также называют избыточными или добавочными структурно-аномальными хромосомами.
Цитогенетики затрудняются специфично охарактеризовать маркерные хромосомы при дифференциальной окраске, даже методами с высоким разрешением, поскольку обычно они настолько невелики, что дифференциальная окраска неоднозначна или неочевидна.
Обычно для точной идентификации необходим FISH-анализ с различными зондами; небольшие маркерные хромосомы часто состоят лишь из околоцентромерного гетерохроматина, выявляемого хромосом-специфичными FISH-зондами на сателлитную ДНК.
Большие маркерные хромосомы неизменно содержат некоторый материал из одного или обоих плеч хромосомы, создающий дисбаланс для вовлеченных генов. Пренатальная частота возникших de novo избыточных маркерных хромосом приблизительно 1 на 2500. Из-за проблем идентификации клиническое значение маркерных хромосом трудно оценить, и обнаружение маркера в кариотипе плода может представлять серьезную проблему при оценке риска анамалий и генетическом консультировании.
В зависимости от происхождения маркерной хромосомы риск аномалии плода может колебаться от очень низкого уровня до очень высокого, вплоть до 100%. Сравнительно большая доля таких маркеров происходит из хромосомы 15 и из половых хромосом. Специфические синдромы описаны в связи с бисателлитными маркерными хромосомами, производными от хромосомы 15 и центромерной части Х-хромосомы.
Интересен подкласс маркерных хромосом, потерявших околоцентромерные последовательности ДНК и, несмотря на это, стабильных. Такие маркеры представляют собой небольшие фрагменты хромосомных плеч (обычно на некотором расстоянии от нормальной центромеры), каким-то образом приобретшие свойства центромеры. Говорят, что такие маркеры содержат неоцентромеры.
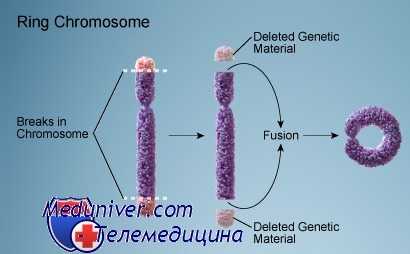
Большинство маркерных хромосом теряют теломерные (концевые) последовательности и, таким образом, вероятно, формируют небольшие кольцевые хромосомы, образующиеся, когда в хромосоме происходит два разрыва и поврежденные концы хромосомы соединяются в кольцевой структуре. Кольцевые хромосомы встречают весьма редко, однако они описаны для каждой хромосомы.
Если центромера находится в пределах кольца, обычно кольцевая хромосома стабильна. Тем не менее некоторые кольца испытывают трудности при митозе, когда две сестринские хроматиды кольцевой хромосомы сцепляются при попытке разойтись в анафазе. Возможны разрывы кольца, сопровождающиеся последующим слиянием с формированием больших и малых колец. Из-за митотической нестабильности кольцевые хромосомы часто обнаруживают только в части клеток.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностические проблемы кариотипирования плода. Маркерные хромосомы. Мозаицизм хромосом.
Лимфоциты крови плода. Для хромосомного анализа крови плода используют стандартную методику стимулирования лимфоцитов фитогемагглютинином. Обычно анализируют 11—20 метафазных пластинок.
Этот метод дает наиболее адекватное представление о хромосомном статусе плода и настоятельно рекомендуется для кари-отипирования плода в случае хромосомного мозаицизма в плаценте, а также при наличии пороков развития не только во II триместре, но, как показывает наш опыт, и в поздние сроки беременности. В последнем случае кариотипирование плода позволяет решить вопрос о тактике ведения беременности, родов и неонатального периода.
Диагностические проблемы кариотипированая плода
К диагностическим ошибкам при цитогенетической ПД могут привести структурные перестройки хромосом, возникшие de novo, сверхчисленные маркерные хромосомы и мозаицизм хромосом.
Структурные перестройки хромосом, возникшие de novo
Структурные перестройки хромосом, не унаследованные от кого-либо из родителей при подтвержденном отцовстве, встречаются довольно редко (0,06-0,20% от всех пренатальных исследований). При обнаружении перестройки хромосом, действительно возникшей de novo, невозможно полностью исключить микроперестройки и, следовательно, несбалансированность хромосомного набора у плода. В этой ситуации риск рождения ребенка с аномалиями развития составляет 10%.
Маркерные хромосомы
Сверхчисленные маркерные хромосомы в пренатальном периоде выявляются с частотой 0,6-0,96/1000. Все маркерные хромосомы делятся на несколько классов: возникшие de novo и семейные, мозаичные и немозаичные, спутничные и лишенные спутников. Риск рождения ребенка с аномалиями развития зависит от хромосом, принимающих участие в их образовании, а также от их принадлежности к тому или иному классу. Поэтому обнаружение в кариотипе плода маркерной хромосомы требует не только ее идентификации всеми доступными методами, но и кариотипирования родителей для установления происхождения маркера и формы анеуплоидии (полная или мозаичная).
Прогноз в отношении плода более благоприятен, если один из фенотипически нормальных родителей является носителем идентичной маркерной хромосомы.
Общий риск аномалий развития у плода при сверхчисленных маркерных хромосомах, возникших de novo, составляет около 8% для сателлитных маркеров (содержащих короткие плечи акроцентрических хромосом, несущих рибосомные гены) и 27% —для несателлитных. При этом наличие эухроматинового материала, выявленного методами дифференциального окрашивания (G-,Q-,NOR-,DA/DAPI) или FISH с использованием наборов цельнохромосомных ДНК-зондов, свидетельствует о частичной трисомии и существенно увеличивает вероятность аномалий развития.
Мозаицизм хромосом
Проблеме хромосомного мозаицизма в ПД уделяется особое внимание в связи с тем, что накопленные к настоящему времени данные свидетельствуют о совместимости с внутриутробным развитием и живорождением многих аутосомных трисомии. При этом тяжесть проявления синдромов не зависит от формы анеуплоидии (полная или мозаичная) и доли анеупло-идных клеток в исследуемой ткани.
Вероятность обнаружения клеток с разным хромосомным набором существенно различается в зависимости от используемого метода приготовления препаратов. Однако в любом случае необходимо определить, является ли мозаицизм артефактным, т.е. возникающим в процессе приготовления хромосомных препаратов, или он действительно отражает кариотип плода. В отличие от аутосомных моносомий, которые, как правило, обусловлены методическими моментами, моносомия X, а также трисомии по любым хромосомам набора требуют самого пристального внимания.
Наиболее частыми источниками диагностических ошибок являются контаминация образца и псевдомозаицизм.
Контаминация образца материнскими клетками
Образцы любого эмбрионального материала могут быть контаминированы клетками материнского происхождения.
При длительном культивировании материнские клетки могут пролиферировать и приводить к диагностическим ошибкам. Риск ошибок, обусловленных контаминацией , составляет 0,16% при культивировании клеток АЖивыше (до 0,4%) при культивировании клеток ворсин хориона. Избежать ошибочных результатов можно лишь при сокращении времени культивирования или использовании «прямого» метода приготовления препаратов.
Во избежание диагностических ошибок при анализе лимфоцитов пуповинной крови необходимо контролировать чистоту образца в соответствии с методикой, основанной на отличиях реакции фетального гемоглобина от окраски гемоглобина взрослых эритроцитов в щелочной среде.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Колотий А.Д. 1, 2 Ворсанова С.Г. 1, 2, 3 Юров Ю.Б. 2, 1, 3 Соловьев И.В. 2 Демидова И.А. 1, 2, 3 Кравец В.С. 1, 2, 3 Шаронин В.О. 2 Куринная О.С. 1, 2, 3 Гордеева М.Л. 1 Богатырева Е.П. 4 Юров И.Ю. 2, 1, 5
1 Обособленное структурное подразделение «НИКИ педиатрии им акад. Ю.Е. Вельтищева» ГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
В статье представлены результаты обследования 96 девочек с синдромом Шерешевского – Тернера, у которых диагноз был подтвержден цитогенетическим и молекулярно-цитогенетическим (FISH и MCB) методами. Регулярные формы синдрома Шерешевского – Тернера с кариотипом 45,Х были обнаружены у 27 девочек (28,1 %). Остальные случаи были представлены мозаичными формами синдрома, а также структурными изменениями гоносом, включая мозаичные кариотипы 45,X/46,XX или 45,X/47,XXX/46,XX (37,5 %), изохромосомами Х по длинному плечу (10,5 %), маркерными и кольцевыми хромосомами Х (14,6 %). Материал хромосомы Y в кариотипе был выявлен в 7,3 % случаев; делеции короткого плеча хромосомы Х – в 2,1 % случаев. Мозаичные формы кариотипа были выявлены в 67,7 %. Задержка психоречевого и/или психомоторного развития наблюдалась у 13 девочек (13,5 %). Молекулярно-цитогенетическое исследование (FISH) проводили в случаях мозаицизма, маркерных и кольцевых хромосом, а также для уточнения структурных перестроек. Анализ корреляции генотип-фенотип при мозаичных формах показал, что классический фенотип синдрома Шерешевского – Тернера проявлялся у пациенток, как при большой доле аномальных клеток, так и при доле, составлявшей 5–10 %, что может свидетельствовать о возможном наличии тканевого мозаицизма.
1. Бужиевская Т.И., Выговская Т.В. Анеуплоидии у человека (факты и гипотезы) // Цитол. и генет. – 1990. – Т.24, № 3. – С.66-72.
2. Ворсанова С.Г., Юров Ю.Б., Александров И.А., Демидова И.А., Миткевич С.П., Доронин Л.Г. Молекулярно-цитогенетическая диагностика наследственных болезней, связанных с различными аномалиями хромосом Х. // Педиатрия. – 1989. – № 1. – С.76-80.
3. Ворсанова С.Г., Юров Ю.Б., Дерягин Г.В., Соловьев И.В., Бытемская Г.А. К методике диагностики анеуплоидий при помощи гибридизации in situ: анализ интерфазных ядер. // Бюлл. экспер. биол. мед. - 1991. - №10. - С.413-415.
4. Ворсанова С.Г., Берешева А.К., Казанцева Л.З., Демидова И.А., Шаронин В.О., Соловьев И.В., Юров Ю.Б. Молекулярно-цитогенетическая диагностика хромосомных аномалий у супружеских пар с нарушением репродуктивной функции. // Пробл. репрод. – 1998. – № 4. – С.41-46.
5. Ворсанова С.Г., Юров Ю.Б., Чернышов В.Н. Хромосомные синдромы и аномалии. Классификация и номенклатура. – Ростов-на-Дону: Молот, 1999. – 192с.
6. Ворсанова С.Г., Юров Ю.Б., Чернышов В.Н. Медицинская цитогенетика (учебное пособие). – М.: МЕДПРАКТИКА-М, 2006. – 300с.
7. Ворсанова С.Г., Юров Ю.Б., Куринная О.С., Воинова В.Ю., Юров Ю.Б. Геномные аномалии у детей с умственной отсталостью и аутизмом: использование технологии сравнительной геномной гибридизации на хромосомах in situ (HR CGH) и молекулярного кариотипирования на ДНК-микроматрицах (array CGH). // Ж. неврол. и психиатр. им. С.С. Корсакова. – 2013. – Т.113, № 8. – С.46-49.
8. Демидова И.А., Ворсанова С.Г., Юров И.Ю., Колотий А.Д., Куринная О.С., Яблонская М.И., Тозлиян Е.В., Юров Ю.Б. Исследование низкопроцентного мозаицизма гоносом у двух детей с задержкой полового и физического развития: необходимость применения молекулярно-цитогенетических методов // Рос. вестн. перинат. и педиатр. – 2010. – Т.55, № 6. – С.36-40.
9. Колотий А.Д., Ворсанова С.Г., Юров И.Ю., Демидова И.А., Куринная О.С., Кравец В.С., Юров Ю.Б. Мозаичные формы хромосомных аномалий у детей с умственной отсталостью и задержкой полового развития: цитогенетические и молекулярно-цитогенетические исследования. // Клин. генет. и перинат. диагн. – 2012. – № 1(ноябрь). – С.19-29.
10. Колотий А.Д., Юров И.Ю., Ворсанова С.Г., Демидова И.А., Кравец В.С., Куринная О.С., Шаронин В.О., Богатырева Е.П., Юров Ю.Б. Выявление структурных хромосомных перестроек у детей с идиопатическими формами умственной отсталости с помощью хромосомного анализа высокого разрешения. // Мол. мед. – 2014. – № 3. – С.41-46.
11. Соловьев И.В., Ворсанова С.Г., Демидова И.А., Вехова Н.В., Шаронин В.О., Мале П., Казанцева Л.З., Гречанина Е.Я., Бужиевская Т.И., Зерова Т.Э., Ройзес Ж., Юров Ю.Б. Роль молекулярно-цитогенетической диагностики в пост- и пренатальном выявлении хромосомной патологии // Ультразвук. перинат. диагн. – 1995. – № 6–7. – С.65-70.
12. Шерешевский Н.А. К вопросу о сочетании уродства с эндокринопатиями // Вести эндокринол. – 1925. – Т.1, №4. – С.296-301.
13. Юров И.Ю., Ворсанова С.Г., Юров Ю.Б. Геномные и хромосомные болезни центральной нервной системы. Молекулярные и цитогенетические аспекты. – Москва, МЕДПРАКТИКА-М, 2014. – 384с.
14. Юров Ю.Б., Ворсанова С.Г., Юров И.Ю. Молекулярная цитогенетика и геномика аутизма // Мол. мед. – 2014. – № 2. – С.3-7.
15. Altunyurt S., Acar B., Guclu S., Saygili U., Sakizli M. Mosaic form (45X/46XX) of Turner's syndrome. A case report. // J. Reprod. Med. – 2002. – Vol.47, No.12. – P.1053-1054.
16. El-Mansoury M., Barrenäs M.L., Bryman I., Hanson C., Larsson C., Wilhelmsen L., Landin-Wilhelmsen K. Chromosomal mosaicism mitigates stigmata and cardiovascular risk factors in Turner syndrome // Clin. Endocrinol. (Oxf). – 2007. – Vol.66. – P.744–751.
17. Ford C.E., Jones K.W., Polani P.E., de Almeida J.C., Briggs J.H. A sex-chromosome anomaly in a case of gonadal dysgenesis (Turner’s syndrome). // Lancet. – 1959. – N1. – P.711-713.
18. Guttenbach M., Koschorz B., Bernthaler U., Grimm T., Schmid M. Sex chromosome loss and aging: in situ hybridization studies on human interphase nuclei. // Am. J. Hum. Genet. – 1995. –Vol. 57. – P.1143–1150.
19. Gravholt C.H., Fedder J., Naeraa R.W., Muller J., Fisker S., Christiansen J.S. Occurrence of gonadoblastoma in females with Turner syndrome and Y chromosome material: a population study. // J. Clin. Endocrinol. Metab. – 2000. – Vol.85. – P.3199-3202.
20. Hook E.B., Warburton D. Turner syndrome revisited: review of new data supports the hypothesis that all viable 45, X cases are cryptic mosaics with a rescue cell line, implying an origin by mitotic loss. // Hum. Genet. – 2014. – Vol.133. – P.417–424.
21. ISCN 2016 An international systeme for human cytogenetic nomenclature. / J. McGowan-Jordan, A. Simons, M. Schmid (ed). // S.Karger, Basel, 2016. – 139p.
22. Kolotii A.D., Vorsanova S.G., Voinova V.Y., Kurinnaia O.S., Demidova I.A., Beresheva A.K., Kravets V.S., Soloviev I.V., Yurov Y.B., Iourov I.Y. Rare case of 46,X,idic(X)(p11.2)/46,XX mosaicism in an autistic child with developmental delay: a karyotypic marker of X chromosome isodisomy and an X-linked mutation. // Eur. J. Hum. Genet. – 2011. – Vol.19 (suppl.2). – P.154.
23. Larsen T., Gravholt C.H., Tillebeck A., Larsen H., Jensen M.B., Nielsen J., Friedrich U. Parental origin of the X chromosome, X chromosome mosaicism and screening for "hidden" Y chromosome in 45,X Turner syndrome ascertained cytogenetically // Clin. Genet. – 1995. – Vol.48, No. 1. – P.6-11.
24. Liehr T., Weise A., Heller A., Starke H., Mrasek K., Kuechler F., Weier H-U G., Claussen U. Multicolor chromosome banding (MCB) with YAC/BAC-based probes and region-specific microdissection DNA libraries. // Cytogen. Genome Res. – 2002. – Vol.97, No.1–2. – P.43-50.
26. Nielsen J., Wohlert M. Chromosome abnormalities found among 34,910 newborn children: results from a 13-year incidence study in Arhus, Denmark // Hum. Genet. – 1991. – Vol. 87, No. 1. – P.81-83.
27. Schinzel A. Catalogue of unbalanced chromosome aberrations in man. / Berlin - New York, Walter de Gruyter, 1984. – 914p. / 2nd ed. Berlin, Walter de Gruyter Inc., 2001. – 966p.
28. Soloviev I.V., Yurov Y.B., Ioannou P., Georghiou A., Hadjimarcou M., Patsalis P.C., Roizes G., Sharonin V.O., Kravets V.S., Vorsanova S.G. Identification and molecular-cytogenetic characterization of large subset of human plasmids, cosmids PAC and YAС clones: the search of DNA probes for pre- and postnatal diagnosis. // Cs. Pediatr. – 1997. – Vol.52, N7. – P.529-538.
29. Sybert V.P., McCauley E. Turner's Syndrome. // N. Engl. J. Med. – 2004. – Vol.16, N351 (12). – P.1227-1238.
30. Turner H.H. A syndrome of infantilism, congenital webbed neck, and cubitus valgus. // Endocrinology. – 1938. – Vol. 23. – P.566-574.
32. Iourov I.Y., Vorsanova S.G., Kurinnaia O.S., Zelenova M.A., Silvanovich A.P., Yurov Y.B. Molecular karyotyping by array CGH in a Russian cohort of children with intellectual disability, autism, epilepsy and congenital anomalies. // Mol. Cytogen. - 2012. – Vol.5, N1. – 10 (порядковый номер статьи).
33. Prior T.I., Chue P.S., Tibbo P. Investigation of Turner syndrome in schizophrenia. // Am. J. Med. Genet. – 2000. – Vol.12, N96 (3). – P.373-378.
34. Wiktor A., Van Dyke D.L. FISH analysis helps identify low-level mosaicism in Ullrich-Turner syndrome patients // Genet. Med. – 2004. – Vol. 6, N3. – P.132-135.
35. Yurov Y.B., Soloviev I.V., Vorsanova S.G., Alexandrov I.A., Sharonin V.O., Monachov V. DNA probes for pre- and postnatal diagnosis of chromosomal anomalies: a collection for FISH analysis // Cs. Pediatr. – 1997. – No. 7. – P.550-554.
36. Yurov Y.B., Vorsanova S.G., Soloviev I.V., Demidova I.A., Alexandrov I.A., Sharonin V.O., Beresheva A.K. Original collection of DNA probes for preimplantational, fetal prenatal and postnatal diagnosis of chromosomal analysis by FISH. / (eds): Macek M.Sr., Bianchi D., Cuckle H Early prenatal diagnosis, fetal cells and DNA in mother, present state and perspectives, Prague, 2002. – P.275-283.
Синдром Шерешевского – Тернера (СШТ) является хорошо изученным хромосомным синдромом с частотой – 1:2000-2500 новорожденных девочек [5,6,26]. СШТ характеризуется низкорослостью, короткой шеей с «крыловидными» складками, нарушением полового развития в виде аплазии или гипоплазии яичников и матки, незначительно развитых вторичных половых признаков, лимфотическим отёком кистей и стоп при рождении, бочкообразной грудной клеткой. Среди МАР могут наблюдаться антимонголоидный разрез и гипертелоризм глазных щелей, эпикант, птоз, низкий рост волос на затылке, высокий и широкий лоб, ретрогения, деформированные низко расположенные ушные раковины, гипертелоризм сосков, вальгусное положение локтевых суставов, гипоплазия ногтей и сосков [6,12,25,30]. Из пороков внутренних органов часто отмечаются аномалии сердца (около 50 %) и почек (около 40 %) [29]. Среди всех хромосомных синдромов СШТ характеризуется большим разнообразием кариотипов, в том числе мозаичных форм, объединенных одним признаком – отсутствием или нарушением структуры хромосомы Х [17]. При мозаичных формах, которые оцениваются по данным литературы в 30–56 % всех случаев СШТ [15,16,29], всегда присутствует клеточный клон 45,Х. Известна высокая степень внутриутробной гибели эмбрионов, имеющих кариотип 45,Х, до 99 % случаев [25]. Среди девочек с низким ростом и задержкой полового развития, проходящих цитогенетическое исследование, СШТ выявляется приблизительно в 25 % [9]. Полиморфизм клинических признаков при СШТ может быть связан с различным кариотипом (мозаицизм c наличием нормального клона клеток, маркерные и кольцевые хромосомы Х) [29]. Присутствие нормальной клеточной линии 46,ХХ может облегчать клинические проявления у пациентов с СШТ [2,6,27,29]. Целью исследования являлась оценка доли регулярных и мозаичный форм синдрома, проведение возможной корреляции генотип-фенотип при разных формах хромосомной аномалии.
Материалы и методы
Ретроспективный анализ результатов цитогенетических и молекулярно-цитогенетических исследований был проведен 96 девочкам с клиническими признаками СШТ. Цитогенетический анализ проводили на хромосомах лимфоцитов периферической крови, культивированных стандартным методом с применением GTG и CBG окрашивания [6]. У каждого пациента было проанализировано не менее 20, а в случае мозаицизма – не менее 30 метафазных пластинок. Молекулярно-цитогенетические исследования проводили методом флюоресцентной гибридизации in situ (FISH) для уточнения доли мозаичного клона, определения генетической природы маркерных и кольцевых хромосом, уточнения сложных структурных перестроек. В случаях мозаицизма проводился анализ 50–100 метафазных пластинок и 1000 интерфазных ядер [31]. В работе использовались оригинальные ДНК пробы из коллекции лаборатории цитогенетики и геномики психических заболеваний ФГБНУ «Научного центра психического здоровья». Описание этих ДНК проб представлено в работах проф. Ю.Б. Юрова с соавт. [35,36] и д-ра И.В. Соловьева с соавт. [11,28]. Применяли ДНК пробы MCB (Multicolor Chromosome Banding), окрашивающие полосы хромосомы в разные цвета [24]. При анализе мозаицизма клон 45,Х учитывался в том случае, если он был выше 2,3 %, т.е. выше значения, определенного для нормальных девочек возрастом до 18 лет [18]. Оценка клинических особенностей пациентов с СШТ проводилась по историям болезни. Запись хромосомных аномалий проводилась согласно международной номенклатуре по цитогенетике человека (ISCN, 2016).
Результаты и обсуждение
В работе представлены результаты цитогенетических и молекулярно-цитогенетических исследований 96 девочек. Средний возраст девочек составлял 10,5+4,1 лет (от 0,3 до 17 лет). Удельный вес различных кариотипов при СШТ представлен в таблице 1. При этом синдроме принято выделять такие кариотипы, как 45,Х, мозаицизм 45,Х/46,ХХ (45,X/47,XXX/46,XX), наличие в кариотипе изохромосомы Х по длинному плечу - i(Xq), кольцевые и маркерные хромосомы Х, материал хромосомы Y в кариотипе, делеции хромосомы Х [29].
Различные кариотипы у обследованных пациентов с СШТ
% от всех случаев СШТ
Кариотип 45,Х был обнаружен у 27 девочек (28,1 %). Помимо основных клинических признаков синдрома, в некоторых случаях наблюдалась тугоухость, гипертрихоз, пигментные невусы. У четырех девочек была отмечена задержка психоречевого и/или психомоторного развития (ЗПРР, ЗПМР). В одном случае симптомокомплекс был особенно тяжелым: ЗПРР, ЗПМР, микроцефалия, судороги и МАР в виде гипоплазии нижней челюсти, оттопыренных ушных раковин. Существует гипотеза о том, что практически все пациентки с СШТ имеют мозаицизм с присутствием клона нормальных клеток, а нежизнеспособны эмбрионы с регулярной формой 45,Х [1,5,6,20]. Данные последних исследований указывают на то, что потеря хромосомы Х у рожденных девочек с СШТ обусловлена в первую очередь митотическими факторами, и клон 45,Х возникает на стадии первых дроблений зиготы с нормальным кариотипом. Кроме того, известен ген PSF2RA, расположенный в псевдоаутосомных участках коротких плеч хромосом Х и Y, необходимый для нормального функционирования плаценты, и, вероятно, девочки, рожденные с кариотипом 45,Х, жизнеспособны благодаря тому, что клетки плаценты в этих случаях имели нормальный кариотип и были способны осуществлять трофическую функцию [20]. Для выявления возможного мозаицизма было проведено FISH исследование 9 девочкам с кариотипом 45,Х, в результате которого клон 46,ХХ, составлявший в среднем 3,2 % клеток, был обнаружен у троих пациентов, что подтверждало данные литературы [2,23,34].
Наиболее многочисленной группой в нашем исследовании были девочки с мозаичным кариотипом 45,X/46,XX или 45,X/47,XXX/46,XX, составлявшие 37,5 % от всех пациентов с СШТ. Доля клона 45,Х варьировала у разных пациентов от 5 % до 95 % и в среднем составляла 30,3 %. Явной корреляции генотип-фенотип в зависимости от доли аномального клона клеток в этой группе не наблюдалось. Так, например, девочки с долей клеток 45,Х в пределах 5 % имели низкий рост, первичную аменорею, гипоплазию и аплазию внутренних половых органов, аномалии почек точно также, как и девочки, у которых доля клона 45,Х составляла более 50 %. У девочки с 6 % клеток 45,Х помимо выраженных признаков СШТ наблюдались черты аутизма и снижение интеллекта. Другая девочка с долей клеток 45,Х, равной 13 %, имела грубые ЗПРР и ЗПМР, эпилепсию. Вероятно, это связано с долей аномальных клеток в различных тканях и органах (головной мозг, почки, сердце и т.д.). Мозаицизм 45,X/47,XXX/46,XX после цитогенетического исследования был выявлен у 5 девочек, однако, после проведения FISH анализа девочкам с мозаицизмом 45,Х/46,ХХ, дополнительный клеточный клон 47,ХХХ выявлялся примерно в половине случаев, но представлен был в небольшой доле клеток (1–5 %) (рис.1 а,б,в). Исключение представлял случай кариотипа 47,ХХX/45,Х/47,XX,+r(X)/46,XX с процентным соотношением клонов: 67%/27%/2%/4% у девочки 14 лет с низким ростом, задержкой полового развития, гипертелоризмом глазных щелей и сосков, широкой грудной клеткой и сандалевидной щелью стоп. В этом случае клон 47,ХХX был преобладающей клеточной линией, однако клинические признаки СШТ не отличались от обычных. Мозаичной формы 45,Х/47,ХХХ среди наших случаев обнаружено не было. Учитывая отсутствие явной корреляции клинических проявлений с долей обнаруженных аномальных клеток лимфоцитов, можно предположить о существовании тканевого мозаицизма, в частности, затрагивающего органы и ткани, в которых содержание клеток с кариотипом 45,Х может быть значительно выше, чем в клетках крови. Несмотря на это, для установления диагноза СШТ важен факт выявления аномального клона в клетках различных тканей, включая и лимфоциты периферической крови.
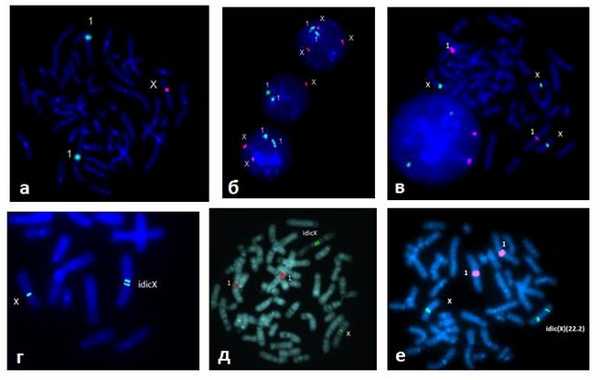
Рис. 1. Результаты FISH исследования с центромерным ДНК зондом на хромосому Х. (для контроля плоидности при интерфазном анализе применялся ДНК зонд на хромосому 1): а) метафазная пластина – 45,Х; б) интерфазные ядра с тремя, одной и двумя хромосомами Х (сверху вниз) у одного пациента; в) метафазная пластина – 47,ХХХ; г) нормальная и изодицентрическая хромосома Х – idic(X)(p11.2) (табл.2, №9); д) позднореплицирующаяся изодицентрическая хромосома Х, специфическая окраска после культивирования с BrDU указывает на инактивацию перестроенной хромосомы (табл.2, №8); е) нормальная и изодицентрическая хромосома Х с точкой разрыва Хq22.2. (табл.2, №10)
Присутствие изохромосомы Х по длинному плечу – i(Xq) в кариотипе наблюдалось в 9 случаях и в одном – изохромосома с точкой разрыва в длинном плече q22.2. Общее число случаев с изохромосомой Х составило 10,4 % (табл. 2). Все случаи были мозаичными за исключением одного, в котором выполнялось только цитогенетическое исследование, в связи с чем невозможно утверждать, что и в этом случае не было мозаицизма. В семи случаях клон 46,X,i(Xq) сочетался с клоном 45,Х, в двух – присутствовал клон нормальных клеток.
Идентификация кольцевой и маркерной хромосом при типичных формах дисгенезии гонад
При цитогенетическом исследовании у больных с типичной формой дисгенезии гонад обнаружен широкий спектр кариотипов: с количественными нарушениями комплекса половых хромосом - Х0, Х0/ХХ, Х0/ХY и др., и структурными нарушениями одной из хромосом - Х или Y, входящих в этот комплекс: делеции, кольцевые хромосомы, изохромосомы по длинному плечу и др.
Несмотря на разнообразие генотипов, подавляющее большинство больных с синдромом Шерешевского-Тернера причисляют к лицам женского пола, в связи с тем, что из всех больных, имеющих хромосому Y в кариотипе, женский пол присваивается в 60% [2].
Наличие хромосомы Y в кариотипе у таких "девочек" часто сопровождается малигнизацией гонад, что требует высокой онкологической настороженности. Установлено, что опухоли дисгенетичных гонад у этих больных до 16 лет выявляются в 10,2% случаев; во второй и третей декадах жизни процент этот возрастает до 30-35 [3]. Однако ряд авторов обнаружили возникновение гонадобластом и дисгермином в раннем детском возрасте, что свидетельствовало о перерождении гонад еще в период внутриутробного развития. В связи с этим обнаружение хромосомы Y в кариотипе имеет важное значение для лечения и прогноза заболевания.
По данным Saenger (1993) [цит. по 1], хромосома Y в кариотипе обнаруживается только у 6% больных с синдромом Шерешевского-Тернера при использовании дифференцированной окраски. В ряде случаев присутствие в кариотипе больных отдельных фрагментов хромосом не позволяет определить их принадлежность к хромосомам Х или Y. Поэтому в последнее время для идентификации этих фрагментов стали применять молекулярно цитогенетический метод FISH-анализа, в основе которого лежит гибридизация in situ.
В настоящей статье представлены два клинических наблюдения больных с типичной формой дисгенезии гонад и мозаичными вариантами кариотипа. В первом случае у пациентки в кариотипе был обнаружен клон с кольцевой хромосомой. В кариотипе второй пациентки присутствовала маркерная хромосома небольшого размера. Кольцевую и маркерную хромосому невозможно было идентифицировать цитогенетическим методом с применением дифференцированной окраски. У обеих больных в кариотипе доминирующим клеточным клоном был клон 45,Х.
Наблюдение 1
Пациентка впервые была обследована в Научном центре акушерства, гинекологии и перинатологии РАМН в возрасте 14 лет в связи с отставанием в росте и задержкой полового развития. Рост 138 см, масса 36 кг. Степень полового развития соответствовала: Ах0 Ма0 Р1 Меabs. Девочка имела тернероидный тип сложения: широкая грудная клетка с широко расставленными втянутыми сосками, укороченная шея, cubitus valyus. Обнаружены и другие стигмы, типичные для данной патологии: высокое небо, эпикант, невусы на туловище, укорочение IV пальца обеих стоп, дистрофия ногтей, припухлость тыльной поверхности стоп. Костный возраст отставал от хронологического на 4 года. При ультразвуковом исследовании внутренних половых органов матка и гонады имели вид тяжей. Гормональные исследования обнаружили высокие концентрации гонадотропинов в крови: ЛГ - 38 МЕ/л, ФСГ - 183 МЕ/л и низкий уровень эстрадиола - 63 пмоль/л. Цитогенетическое исследование выявило мозаицизм. Один клеточный клон был представлен моносомией по Х-хромосоме 45,Х. Другой имел 46 хромосом, одна из которых имела вид кольца. G-окраска позволила идентифицировать 45 хромосом, все аутосомы и хромосому Х. Принадлежность кольцевой хромосомы к Х или Y установить не удалось (рис. 1). Клон клеток, содержащих 45,Х, составил 86%, а клон клеток, содержащих 46,Хr - 14%.
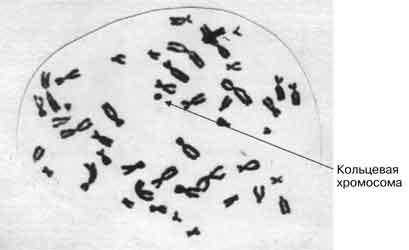 |
| Рис. 1. Кариотип пациентки (наблюдение 1) |
Наблюдение 2
Впервые пациентка была обследована в поликлинике Научного центра акушерства, гинекологии и перинатологии РАМН в возрасте 13 лет в связи с задержкой полового развития и отставанием в росте. Рост 134.5 см, масса 28.5 кг. Степень полового развития соответствовала: Ах0 Ма0 Р1 Меаbs. Девочка имела широкую грудную клетку с широко расставленными сосками, а так же ряд стигм: высокое небо, дистрофию ногтей, на коже туловища массу невусов, укорочение IV пальца правой ступни из-за отсутствия средней фаланги. Со стороны внутрених органов обнаружена гипоплазия почек. Костный возраст соответствовал 10-10,5 годам. Ультразвуковое исследование выявило матку и гонады в виде тяжей. Гормональные исследования показали высокую концентрацию ФСГ - 100,3 МЕ/л и низкую концентрацию эстрадиола - 43 пмоль/л в крови. При цитогенетическом исследовании лимфоцитов крови обнаружено два клона клеток. Один клеточный клон был представлен моносомией по Х хромосоме 45,Х. Другой имел 46 хромосом, одна из которых была представлена фрагментом от неизвестной хромосомы и имела вид маленькой хромосомы, по размерам напоминающую группу G. С помощью G-окраски удалось идентифицировать 45 хромосом, все аутосомы и хромосому Х. Принадлежность фрагмента хромосомы к Х или Y установить не удалось (рис. 2). Процент клеток содержащих кариотип 45,Х составил 83, а содержащих 46,Х + mar - 17%.
Принцип метода основан на специфической гибридизации флюоресцентно меченных зондов с определенными участками хромосом (обычно это расположенные в районе центромеры хромосомоспецифические альфоидные повторы). По флюоресценции зондов можно быстро детектировать число копий хромосомы и структурные перестройки в интерфазных ядрах. Этот метод позволял избежать ошибок в определении пола при наличии маркерной хромосомы Y [5].
Для диагностики половых хромосом были использованы отечественные флюоресцентно меченные альфоидные зонды к хромосомам Х и Y. Эти ДНК-зонды были получены в лаборатории цитогенетики НЦ ПЗ РАМН. ДНК зонд для хромосомы Х был помечен прямым флуорофором - оранжевым Су3. ДНК-зонд для хромосомы Y был помечен биотином. Микроскопию осуществляли на флуоресцентном микроскопе Axioplan 2 (Zeiss), оснащенном соответствующим набором светофильтров (фильтры № 01, 09, 15).
В первом наблюдении исследовано 200 лимфоцитов, с применением метода FISH анализа. В результате обнаружено 2 клеточных клона. Один клеточный клон - 88% имел один флюоресцентный сигнал, которым был помечен зонд на хромосому Х, другой - 12% имел 2 идентичных сигнала (рис. 3).
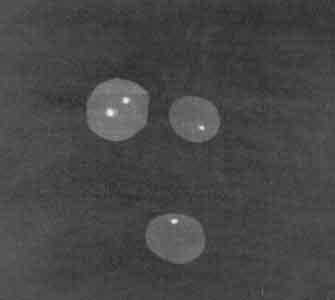 |
| Рис. 3. FISH-анализ лимфоцитов пациентки (наблюдение 1) |
Анализ результатов исследования лимфоцитов больной методом FISH показал, что кольцевая хромосома является дериватом хромосомы Х. Таким образом, кариотип больной был 45,Х/46,Хr(X).
Во втором наблюдении исследовано 400 лимфоцитов, так как было обнаружено 3 типа клеток, различающихся между собой по количеству сигналов в ядрах, принадлежащих зонду хромосомы Х. 70% ядер имели один флюоресцентный сигнал, 30% - два одинаковых сигнала и только 2 клетки из 400 имели 3 сигнала, указывающих на наличие хромосомы Х (рис. 4). Учитывая факт присутствия в крови больной 3 типов клеток с разным количеством Х-сигналов, можно было предположить о наличии сложного мозаицизма. Однако слишком маленький процент клеток с 3 сигналами не исключал присутствия артефакта. Анализ результата исследования лимфоцитов пациентки методом FISH показал, что маркерная хромосома являлась дериватом хромосомы Х. Учитывая небольшие размеры этой хромосомы, установить точно места (границы, точки) делеции не удалось. Полученные данные свидетельствовали, что кариотип больной имел формулу 45,Х/46,Х micro (Х).
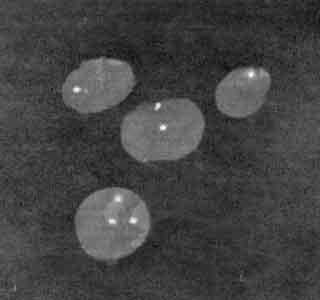 |
| Рис. 4. FISH-анализ лимфоцитов пациентки (наблюдение 2) |
Флюоресцентная гибридизация, позволяющая исследовать не только метафазные хромосомы, но и интерфазные ядра, является методом быстрой цитогенетической диагностики.
Использование флюоресцентной гибридизации при анализе кариотипа у больных с нарушением половой дифференцировки продемонстрировало преимущество метода, так как способствовало идентифицированию комплекса половых хромосом в клеточном клоне, где одна из хромосом была представлена мелким фрагментом.
Ж.И. Глинкина, И.Г. Дзенис, Б.В. Леонов, Г.И. Мушакова, В.А. Бахарев
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
Читайте также:
- Сухожильный панариций - причины, диагностика
- Признаки травмы груди. Пневмоторакс
- Жировой гепатоз у беременных - диагностика
- Компьютерная томография в объективизации неврологических расстройств
- Косоглазие при параличе четвертого (IV) черепного нерва. Двусторонний паралич поднимателей и синдром Дуэйна
