Десмопластическая меланома. Признаки десмопластической меланомы.
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Редкая, смертельная форма рака кожи, известная как десмопластическая меланома, может иметь самое большое число мутаций среди всех злокачественных опухолей, поэтому у иммунотерапии есть шанс стать перспективным методом ее лечения. К такому выводу пришла международная команда во главе с учеными из Калифорнийского университета в Сан-Франциско (UC San Francisco). Одна из этих мутаций, прежде не наблюдавшаяся в других формах рака, вероятно, защищает формирующуюся опухоль от иммунитета и способствует развитию новых генетических нарушений.
«Мы пытались показать, что существует не только одна опухоль под названием “меланома”, но разные её типы, – говорят ученые, – Мы уже обнаружили генетические профили, которые позволили нам разделить опухоли на группы и изучать их по отдельности. Но один тип пока не был хорошо изучен».
В отличие от других видов меланом, которые быстро растут и имеют темно-коричневую окраску, выделяясь на коже, десмопластическая меланома развивается медленно, имеет вид рубца или шишки, сопровождается покалыванием, так как затрагивает нервы. Из-за этого диагноз обычно устанавливается позже. Многие больные быстро погибают, так как опухоль рано дает метастазы в легкие.
«Эти опухоли не пигментированы, поэтому люди не замечают их, пока они не достигают больших размеров, – говорит А. Хантер Шайн (A. Hunter Shain), доктор медицинских наук, – а потом может быть уже слишком поздно».
Десмопластическая меланома (ДМ) составляет 4% от всех типов меланом, ее генетическая структура до настоящего времени изучена недостаточно хорошо. Отчасти это связано с тем, что ученым было сложно собрать нужное количество образцов для анализа. Хотя ДМ – один из самых опасных видов меланомы, о ней мало что известно.
Расшифровка опухоли «по буквам»
В новом исследовании ученые проанализировали 62 образца десмопластической меланомы. Была изучена вся последовательность генома, «буква за буквой», чтобы обнаружить наиболее распространенные мутации, встречающиеся в большинстве образцов.
Внешние проявления ДМ необычны для меланомы, поэтому можно было предположить, что среди других видов меланом эта опухоль – «генетический чудак». Исследователи обнаружили несколько мутаций, встречающихся в других типах меланом, а также ряд мутаций, присутствующих в прочих видах рака – против них уже разработана таргетная терапия.
Также оказалось, что в десмопластической меланоме встречается удивительно большое количество мутаций. В большинстве опухолей обнаруживаются 2 мутации на миллион пар оснований (это своего рода «буквы» в генетическом коде). Меланомы, возникшие в результате воздействия ультрафиолетового излучения, обычно имеют больше мутаций – 15 на миллион пар оснований. В ДМ было обнаружено 62 мутации на миллион пар оснований.
Ученые утверждают, что это самое большое количество мутаций, которое они наблюдали в опухолях, не подвергавшихся химиотерапии и лучевой терапии.
Перспективы для иммунотерапии
Обычно иммунная система быстро обнаруживает и уничтожает раковые клетки с большим количеством мутаций, прежде чем процесс выйдет из-под контроля. Но мутация, обнаруженная в ДМ, позволяет опухолевым клеткам долго скрываться от иммунного «надзора», благодаря чему они могут накопить большое количество других генетических нарушений.
«Это работает как “шапка-невидимка” для раковых клеток», – объясняют ученые.
Хотя этот механизм пока и не доказан, есть основания полагать, что в случае с десмопластической меланомой будет высока эффективность препаратов, известных как блокаторы контрольных точек.
В Европейской клинике лечение всех типов меланом осуществляется в соответствии с современными российскими, европейскими, израильскими протоколами. Также у нас можно пройти исследование на немецком аппарате «Фотофайндер» – оно позволяет составить «карту родинок», контролировать их состояние в динамике и вовремя заметить подозрительные изменения.
Десмопластическая меланома. Признаки десмопластической меланомы.
Десмопластическая меланома. Признаки десмопластической меланомы.
Десмопластическая меланома является одним из вариантов узловой меланомы или меланомы стадии вертикального роста. Состоит из веретенообразных клеток и отличается выраженной десмопластической реакцией стромы. Если присутствует стадия радиального роста, то это обычно один из лентигинозных типов меланомы. Это необычный вариант меланомы, который выглядит как непигментированное образование на коже, подобное шраму или рубцу, но без предшествующего травматического повреждения в анамнезе Если биопсия взята поверхностно, образование можно принять за келоид или дерматофиброму. Так как нет четких клинических проявлений, характерных для мела-номы, очень большое значение имеет анамнез. В вертикальной стадии роста десмопластическая меланома принимает вид твердого узла, также беспигментного или слабопигментированного.
Микроскопически десмопластическая меланома состоит из веретенообразных клеток, расположенных между тонкими прослойками коллагена. Ядра клеток вытянутые, S-образные, подобно клеткам в нейрофибромах или шванномах. Часто клетки сгруппированы в пучки. В более поверхностных отделах могут встречаться эпи-телиоидные клетки, единичные или сгруппированные в гнезда. Если в опухоли есть пигмент, то скорее он будет в эпителиоидных клетках. Описаны поля миксоматоза и многоядерные клетки, подобные клеткам злокачественной гистиоцитомы.
На электронномикроскопическом уровне клетки десмопластической меланомы демонстрируют не только меланоцитарную, но и фибробластическую и шванновскую дифференцировку. Одна часть клеток содержит недавно синтезированные коллагеновые волокна, что характерно для фибробластов, другая — меланосомы, что говорит об их меланоцитарном происхождении .

Десмопластическая меланома обладает выраженным инфильтрирующим ростом с характерным нейротропизмом, но ее все-таки следует отличать от нейротропной меланомы.
Иммуногистохимически клетки десмопластической меланомы дают положительную реакцию на белок S-100 и отрицательную на НМВ-45.
Дифференциальный диагноз беспигментных вариантов десмопластической меланомы проводят со злокачественной эпителиоидной шванномой, а при наличии пигмента — со злокачественной меланоцитарной шванномой. Если опухоль связана с эпидермисом и распространяется на сосочковый слой дермы, то скорее всего это десмопластическая меланома или нейротропная десмопластическая меланома. Если же опухоль расположена глубоко в дерме или в мягких тканях, то более вероятно, что она шванновского происхождения. Если в опухоли отсутствуют митозы и нет ядерной атипии. то это десмопластический доброкачественный Spitz невус.
В некоторых десмопластических меланомах можно встретить один или два митоза в нескольких срезах, такие низкозлокачественные опухоли могут быть расценены как один из вариантов минимально отклоненной меланомы.
В Гистологической классификации опухолей кожи (ВОЗ, 1996г.) нейротропная меланома и минимально отклоненная меланома выделены как самостоятельные формы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Профилактика и лечение узловой меланомы на разных стадиях
Нодулярная (узловая) меланома относится к наиболее агрессивным формам рака. Особенностью этой опухоли является то, что возникать она может в любом месте, в том числе при отсутствии первичного невуса. Узловая меланома кожи даже при очень малых размерах имеет тенденцию к инвазивному росту, что выделяет её среди других злокачественных образований.
Ежегодно выявляется более 1 млн случаев злокачественных опухолей кожи, которые можно разделить на 3 основные группы:
- карцинома базальных клеток дермы;
- плоскоклеточный рак;
- меланома.
Около 80% новых случаев рака кожи приходится на базальноклеточный рак, у 16% пациентов выявляется плоскоклеточная карцинома. Несмотря на то, что на долю меланомы приходится только 4% рака кожи, смертность от этого заболевания, развивающегося из пигментных клеток кожи, превосходит смертность от двух других форм рака. Это объясняется тем, что меланома часто возникает в труднодоступных для ранней диагностики местах (полость рта, носа, гениталии и т.д.).
Морфологически меланомы разделяются на 4 основные подгруппы:
- Поверхностно распространённая меланома. Это наиболее часто встречаемый тип. «Излюбленная» локализация – на конечностях и туловище. Обычно растет медленно и распространяется по поверхности кожи.
- Узловая форма меланомы. На ее долю приходится около 15% всех меланом. По сравнению с другими кожными опухолями она обладает способностью к интенсивному росту. Этот тип меланом, развиваясь, может терять пигмент, становясь красным, а не чёрным. Чаще встречается на груди, спине, шее и голове.
- Лентиго-меланома. Преимущественно встречается у пожилых людей, на участках кожи, подверженных активному воздействию солнца. Обычно появляется на шее и лице, развивается на фоне предраковых состояний lentigo maligna или веснушек Хатчинсона. Внешне эти опухоли напоминают пигментные пятна, растут медленно и менее опасны, чем другие типы меланом.
- Акральная лентигиознгая меланома. Очень редкий тип. Развивается на ладонных и подошвенных поверхностях, под ногтевыми пластинами. Чаще встречается у людей со смуглой кожей. Считается, что эта форма не связана с воздействием солнца.
Узловая меланома: симптомы
Большинство практических пособий рекомендует проверять наличие признаков меланомы по критериям ABCD. Для выявления симптомов узловой меланомы введены дополнительные параметры E, F и G, которые призваны облегчить диагностику.
| Критерии | Признаки |
| A | Асимметрия . Большинство меланом несимметричны по сравнению с невусами. |
| B | «Border» – границы . Обычные родинки имеют гладкие края и четкие границы. Края малигнизированных невусов размыты, имеют нечёткие границы или зубчатые контуры. |
| C | «Color» – цвет . Аномальная окраска родинки служит поводом для беспокойства. Большинство узловых меланом проявляется в виде черно-синих или красно-синих рельефных образований. Некоторые узелковые меланомы не имеют ни цвета, ни выраженной текстуры. |
| D | Диаметр растущего образования более 6 мм может свидетельствовать о меланоме. |
| E | «Elevation» – высота . Увеличение степени возвышения новообразования над поверхностью кожи может сигнализировать об опасности. |
| F | «Firmness» – твердость . Родинки являются довольно мягкими на ощупь и легко смещаются в сторону, в то время как злокачественные меланомы плотные и при надавливании на них пальцем не смещаются. |
| G | «Growth» – рост . Узловая меланома обладает высоким темпом роста. Новые веснушки или родинки обычно прекращают расти в течение 2–3 недель. Новообразования, которые продолжают расти дальше, могут оказаться меланомами. |
В 5% случаев узловых меланом наблюдаются т.н. телесные узелки, которые по цвету ничем не отличаются от окружающей кожи, т.к. не содержат пигмента. Эти амеланотические образования являются узловой беспигментной меланомой, которая по своим злокачественным свойствам не уступает пигментным формам опухоли.
Локализация узловой меланомы
Узловые меланомы преимущественно обнаруживаются на голове, шее и туловище. В отличие от других раков кожи, они возникают как самостоятельные образования, а не развиваются в уже существующих невусах. Узловая меланома на начальных стадиях не всегда обладает манифестными признаками, вместе с тем она может быстро трансформироваться в распространённую форму. Для инвазии этого типа опухоли может потребоваться всего три месяца.
Тщательно собранный анамнез помогает в диагностике
Разновидностью узловой меланомы является десмопластическая опухоль, которая формируется из веретенообразных клеток и характеризуется десмопластическими изменениями стромы. Обычно опухоль данного типа выглядит в виде беспигментного образования на коже в виде шрама или рубца, что может быть ошибочно принято за келоид или фиброму. Тщательно собранный анамнез помогает в диагностике, поскольку при десмопластических опухолях отсутствуют типичные для меланомы клинические проявления. Зачастую эта разновидность меланом имеет характер твердого на ощупь беспигментного или слабопигментированного узла.
Узловая меланома: стадии опухоли
Аналогично другим опухолям, узловая меланома имеет несколько стадий роста:
| Стадия | Характеристики |
|---|---|
| I | Опухоль толщиной 1–2 мм без поражения регионарных лимфоузлов; отдалённые метастазы отсутствуют. |
| II | Опухоль толщиной более 2 мм без поражения регионарных лимфоузлов; отдалённые метастазы отсутствуют. |
| III | Опухоль может изъязвляться, поражаются регионарные лимфоузлы; отдалённые метастазы отсутствуют. |
| IV | Опухоль любых размеров и свойств с наличием отдалённых метастазов. |
Для узловой пигментной меланомы часто характерно отсутствие продромальной фазы радиального роста. Первые стадии могут занять совсем небольшой отрезок времени. От момента первоначальных изменений до метастазов в головной мозг, кости, печень и другие внутренние органы может пройти несколько месяцев.
Факторы риска узловой меланомы
Риск возникновения узловой меланомы кожи повышают:
- чрезмерное воздействие ультрафиолетовых лучей;
- наличие диспластических невусов;
- большое количество невусов;
- склонность к веснушкам и солнечным ожогам;
- светлая кожа, голубые глаза, светлые или рыжие волосы;
- неблагоприятный семейный анамнез в отношении меланомы;
- пигментная ксеродерма;
- ослабленный иммунитет (ВИЧ, лимфома, прием иммунодепрессантов, химиопрепаратов).
Методы диагностики узелковой меланомы
Для диагностики узелковой меланомы чрезвычайно важным является тщательный физикальный осмотр у дерматолога и сбор анамнеза. Многие патологические состояния могут иметь сходные признаки и симптомы.
По результатам консультации врач может планировать дополнительные тесты и обследования:
- биопсия подозрительных участков кожи;
- патогистологическое исследование образца ткани;
- лабораторное тестирование;
- сканирование тканей с визуализацией зоны патологического дефекта: МРТ, КТ и СКТ, ПЭТ КТ;
- биопсия сторожевого лимфатического узла (выступает в качестве лечебно-диагностической процедуры);
- рентгенологическая диагностика;
- эндоскопические методы исследования – ФЭГДС, колоноскопия (при меланомах атипичной локализации).
Нодулярная меланомы: лечение
Методы терапии узловой меланомы зависят от степени прогрессирования опухоли. Факторы, принимаемые во внимание, при выборе протоколов лечения:
- толщина меланомы – чем тоньше опухоль, тем выше шансы на излечение;
- степень изъязвления поверхности опухолевого дефекта;
- распространение меланомы на лимфатические узлы и другие внутренние органы.
Ранние стадии нодулярной меланомы лечатся оперативным способом, при этом удаление малигнизированного участка проводится в пределах здоровых тканей. После операции может понадобиться биопсия сторожевых лимфатических узлов – SLNB (sentinel lymph node biopsy). При отсутствии метастазирования опухолевых клеток объем вмешательства на этом может быть завершен.
При распространении меланомы узловой формы на лимфатические узлы или внутренние органы лечение может потребовать терапевтических протоколов, которые предполагают использование:
- радиолечения;
- иммунотерапии;
- целевой (target) терапии.
Такие подходы дают возможность сократить темпы опухолевого роста и увеличить продолжительность жизни пациентов с распространённой меланомой.
Меланома
БЕСПЛАТНАЯ КОНСУЛЬТАЦИЯ: поможем врачам и владельцам клиник выбрать оборудование для диагностики меланомы
Оглавление
Меланома — это опухоль, вызванная злокачественной трансформацией пигмент-продуцирующих клеток (меланоцитов). Меланоциты происходят из нервного гребня, клетки которого обладают высокой способностью к миграции в организме. Поэтому, хотя меланомы обычно возникают на коже, они также могут появляться и в других местах, куда мигрируют клетки нервного гребня — например, в желудочно-кишечном тракте или головном мозге.
В нашей компании Вы можете приобрести следующее оборудование для диагностики меланомы:
- FotoFinder dermoscope Vexia (FotoFinder)
- FotoFinder ATBM bodystudio (FotoFinder)
- FotoFinder (FotoFinder)
- Handyscope (FotoFinder)
Меланома преимущественно поражает взрослых людей, половой принадлежности у заболевания не выявлено. На международном уровне частота возникновения меланомы сильно варьируется. Так, белые группы населения в Австралии, Новой Зеландии, Южной Африке и на юге США имеют самые высокие показатели этой злокачественной опухоли, тогда как азиатские группы населения в Гонконге, Сингапуре, Китае, Индии и Японии — самые низкие. Это говорит о том, что люди с I–III фототипами кожи, которые живут в солнечных регионах мира, подвергаются значительному риску развития этой злокачественной опухоли.
В одном из исследований было установлено, что период с 1995 по 2012 годы в Европе частота случаев инвазивной меланомы в среднем за год росла на 4,0% у мужчин и на 3,0% у женщин, а частота меланомы in situ — на 7,7% и 6,2% соответственно. Также отмечено, что риск появления второй меланомы после обнаружения первой составляет 3–5%.
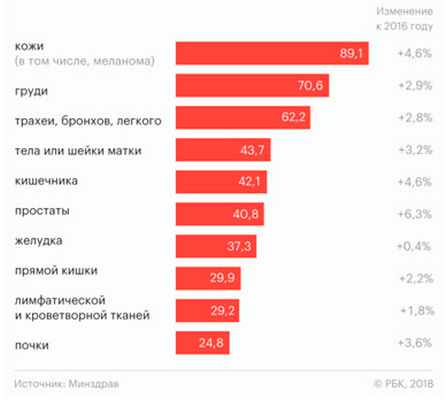
В России ситуация с меланомой, равно как и с другими злокачественными новообразованиями кожи, достаточно сложная — причем из года в год она не становится легче. Так, в 2016 году рак кожи был выявлен у 74 700 человек, а меланома — у 10 500 человек. Уже в следующем, 2017 году зафиксировано 78 000 случаев рака кожи и 11 200 случаев меланомы — прирост 4,6% (рис. 1).
Интересно, что в 2016 году распространенность меланомы составляла 59,3 случая на 100 000 населения, а в 2006 году (10 лет назад) — только 39,7 случаев на 100 000 населения. Всего же в России на данный момент около 500 000 человек имеют диагноз рака кожи, что составляет 0,347% населения страны.
Рис. 1. Статистика онкологических заболеваний в России по состоянию на 2017 год (Минздрав РФ, РБК)
Этиология и патогенез меланомы
Факторы риска появления меланомы:
- Наследственность — положительный семейный анамнез по этой злокачественной опухоли зафиксирован у 5–10% пациентов. Наличие хотя бы одного заболевшего родственника повышает вероятность меланомы кожи у детей в 2,2 раза.
Решающее значение в патогенезе многих меланом имеют молекулярные сигнальные пути MAPK (митоген-активируемых протеинкиназ) и PI3K-AKT (фосфоинозитид-3-киназа + киназы семейства AKT) — они обеспечивают пролиферацию и выживание раковых клеток. Появление мутаций в любой точке путей MAPK и PI3K-AKT приводит к стимуляции клеточного деления и получению опухолевыми клетками особых преимуществ, которые помогают им не только выживать, но и передавать эти свойства новым генерациям.
Клинические проявления меланомы
Злокачественное лентиго и лентиго-меланома
Злокачественное лентиго обычно возникает у пожилых людей с I–III фототипами при наличии признаков фотоповреждения кожи. Его появление начинается с рыжевато-коричневого пятна неправильной формы, которое быстро увеличивается в размерах (рис. 2). Сама лентиго-меланома довольно большая (3–6 см в диаметре и более), с узловой областью шириной от 0,1 до 2 см (рис. 3).
Точный процент злокачественных лентиго, которые прогрессируют до лентиго-меланомы, неизвестен, но, по разным оценкам, он составляет менее 30–50%. Хотя лентиго-меланома имеет продолжительную фазу радиального роста, начало инвазии в ткани является неблагоприятным прогностическим фактором. Считается, что наибольший риск трансформации злокачественного лентиго в лентиго-меланому возникает именно при длительном одномоментном пребывании на солнце, а не при множественной прерывистой инсоляции.
Несмотря на то, что заболеваемость лентиго-меланомой растет, эта опухоль все еще остается достаточно редким видом рака кожи, составляя от 4% до 15% всех меланом. Средний возраст пациентов на момент постановки диагноза — 65 лет.
Поверхностно распространяющаяся меланома
Это самый частый тип меланомы (до 70%). Он встречается в том числе и у молодых людей, хотя пик заболеваемости сегодня находится на четвертом-пятом десятилетиях жизни. Поверхностно распространяющаяся меланома обычно возникает на открытых частях тела, подвергающихся воздействию солнца, а также в областях с наибольшей концентрацией невусов — это верхняя треть спины у обоих полов и голени у женщин.
Сперва опухоль выглядит как плоский или слегка приподнятый неравномерно окрашенный участок кожи с асимметричной границей. Он медленно расширяется и меняет свой цвет — например, можно увидеть оттенки коричневого, черного, синего, красного, розового или белого (рис. 4). Данный процесс длится несколько лет, после чего становится инвазивным и дает метастазы. Поверхностно распространяющаяся меланома может регрессировать — на это указывает исчезновение пигментации.
Узловая меланома кожи
Второй по частоте встречаемости тип меланомы (10–15%) и одновременно самый агрессивный. Клинически узловая меланома проявляется в виде узелка однородного сине-черного, сине-красного или розово-красного цвета, который чаще начинается с нормальной кожи, а не с меланоцитарного невуса (рис. 5). Около 5% опухолей не имеют пигмента (амеланотическая меланома). Наиболее распространенными местами появления опухолей являются туловище, голова и шея. К сожалению, на момент постановки диагноза узловая меланома обычно находится в стадии инвазии.
Акральная лентигиозная меланома
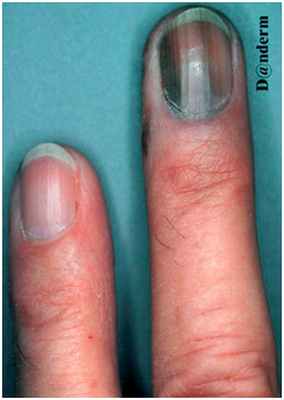
Достаточно редко встречается у светлокожих людей, зато часто — у японцев, африканцев и латиноамериканцев. Считается, что ее развитие напрямую не связано с длительным пребыванием на солнце. Средний возраст появления опухоли — 65 лет, с равным распределением по полу. Клинически акральная лентигиозная меланома проявляется участками черного или коричневого цвета на ладонях, подошвах или под ногтями (рис. 6). Наиболее распространенным местом локализации являются стопы, причем у 60% пациентов имеются подногтевые или подошвенные поражения.
Меланома слизистых
Нетипичный вариант меланомы, который может появляться в полости носа или рта, а также на слизистых половых органов, в аноректальной области и даже на сетчатке.
Десмопластическая меланома
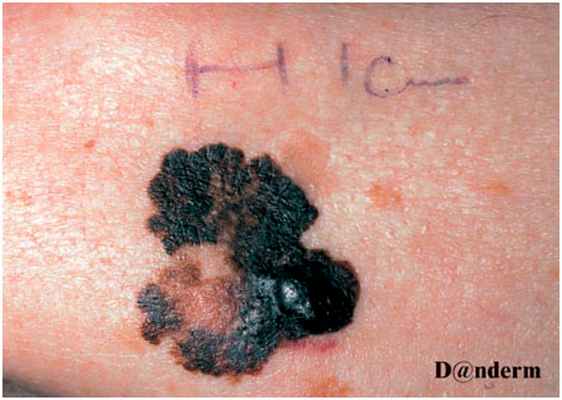
Очень агрессивная, хотя и достаточно редкая опухоль с высокой частотой рецидивов. Обычно развивается на открытых участках головы и шеи пожилых людей. Около половины десмопластических меланом сочетаются со злокачественным лентиго. Клинически проявляется в виде бесцветной (оттенка окружающей кожи) макулы, папулы или узелка (рис. 7). Зачастую она распространяется периневрально, поэтому может давать болевой синдром и чувство покалывания. На момент постановки диагноза десмопластическая меланома почти всегда является глубоко инвазивной (не менее 5–6 мм).
Рис. 2. Злокачественное лентиго (Danish national service on dermato-venereology)
![Меланома - злокачественное лентиго]()
Рис. 3. Лентиго-меланома (Danish national service on dermato-venereology)
Рис. 4. Поверхностно распространяющаяся меланома (Danish national service on dermato-venereology)
![Поверхностно распространяющаяся меланома]()
Рис. 5. Узловая меланома (Danish national service on dermato-venereology)
![Узловая меланома]()
Рис. 6. Акральная лентигиозная меланома под ногтем (Danish national service on dermato-venereology)
![Акральная лентигиозная меланома под ногтем]()
Рис. 7. Десмопластическая меланома (Cleveland Clinic Center for Continuing Education)
![Десмопластическая меланома]()
Уровни инвазии меланомы
Уровни инвазии опухоли в кожу и другие ткани по Бреслоу:
- Первый — 0,75 мм и менее
- Второй — 0,76–1,5 мм
- Третий — 1,51–4,0 мм
- Четвертый — более 4,0 мм
Уровни инвазии по Кларку:
- I — все опухолевые клетки располагаются в пределах эпидермиса (меланома in situ).
- II — базальная мембрана эпидермиса разрушается, и опухоль начинает прорастать в сосочковый (верхний) слой дермы.
- III — сосочковый слой целиком заполнен атипичными меланоцитами, но в сетчатом слое их не наблюдается.
- IV — клетки меланомы проникают в сетчатый (нижний) слой дермы.
- V — опухолевые клетки наблюдаются в подкожно-жировой клетчатке (инвазивная меланома).
TNM классификация меланомы
Характеристика первичной опухоли (Т):
- TX — первичную опухоль оценить невозможно.
- T0 — нет признаков первичной опухоли.
- Tis — меланома in situ, затрагивает только эпидермис (уровень I по Кларку).
- T1 — опухоль толщиной 1 мм и менее, вторгается в сосочковый слой дермы (уровень II по Кларку) или находится на границе с сетчатым слоем (уровень III).
- T2 — толщина опухоли 1,01–2,0 мм.
- T3 — толщина опухоли 2,01–4,0 мм.
- T4 — толщина опухоли более 4,0 мм и/или она проникает в подкожно-жировую клетчатку (уровень V по Кларку) и/или имеются сателлиты в пределах 2 см от первичной опухоли.
- Любая «а» стадия (например, Т1а) — опухоль без изъязвления.
- Любая «b» стадия (например, Т1b) — опухоль с изъязвлением.
Характеристика регионарных лимфоузлов (N):
- NX — регионарные лимфоузлы оценить невозможно.
- N0 — метастазов в регионарных лимфоузлах нет.
- N1 — метастазы в 1 лимфоузле.
- N2 — метастазы в 2–3 лимфоузлах или меланома растет по направлению к лимфоузлу.
- N3 — метастазы в 4 и более лимфоузлах или меланома проросла в лимфоузел.
- Любая «а» стадия (например, N1а) — клетки меланомы в лимфоузле видны только под микроскопом.
- Любая «b» стадия (например, N1b) — меланома в лимфоузле узле видна невооруженным глазом.
Характеристики метастазов (M):
- MX — метастазы оценить невозможно.
- M0 — метастазов нет.
- М1 — метастазы есть.
- M1a — метастазы в кожу или подкожно-жировую клетчатку, либо в отдаленные лимфоузлы.
- M1b — метастазы в легкие.
- M1c — метастазы в другие органы.
Диагностическая визуализация меланомы
Основной принцип успешного лечения меланомы заключается в ранней диагностике — чем раньше была найдена опухоль, чем выше шансы пациента на полное выздоровление или хотя бы значительное продление жизни. Так, пятилетняя выживаемость для пациентов с меланомой в стадии 0 составляет 97%, в стадии IV — около 10%. Поэтому и врач, и косметолог должны крайне ответственно подходить к осмотру любых кожных образований.
Кроме визуального наблюдения опухоли и традиционной дерматоскопии, сегодня существуют мощные технические решения на основе искусственного интеллекта. Они позволяют не только диагностировать минимальные патологические изменения в здоровых тканях, но и проводить осмотр всего тела в динамике — такими возможностями обладает цифровой комплекс FotoFinder (FotoFinder Systems GmbH).
Комплекс FotoFinder с автоматическим картированием тела
FotoFinder может иметь разные комплектации, но чаще всего он состоит из фотокамеры высокого разрешения, роботизированного штатива, лазерного указателя, цифрового видеодерматоскопа и компьютера с набором специальных программ.
Цифровой видеодерматоскоп medicam 1000 используется для прицельного изучения подозрительных новообразований и фиксации результатов с их привязкой к конкретному пациенту. В medicam 1000 применяется целый ряд запатентованных технологий — например, FullHD CrystallVew для получения изображений высочайшего качества, возможность увеличения снимков до 140 раз, а также специальные аксессуары для флуоресцентной диагностики и капилляроскопии. Вместе с удобной сортировкой снимков и быстрым поиском это обеспечивает качественную и раннюю диагностику меланомы и успешные методы лечения меланомы кожи и других новообразований.
Система автоматического картирования тела ATBM (Automatic Total Body Mapping) включает в себя фотокамеру, роботизированный штатив и лазерный указатель. С помощью лазерного указателя оператор (как врач, так и средний медперсонал) устанавливает штатив на рекомендованное расстояние между камерой и пациентом. Далее на компьютере открывается программа-гид — она подсказывает оператору, какую позу следует принять пациенту для съемки.
Для максимально точного воспроизведения поз используется технология Ghost — на мониторе отображается «призрачный-контур» первого снимка человека, которого нужно придерживаться для получения единообразия всех последующих фотографий. Оператор видит, где именно пациент не попадает в контур, и может направлять его словами «поднимите чуть выше правую руку», «выпрямите спину» и так далее. Сама съемка ведется в полуавтоматическом режиме, что также обеспечивает единообразие результатов.
В итоге получаются 20 стандартных снимков, каждый из которых анализируется модулем Bodyscan на предмет динамических изменений. Он фиксирует все новообразования данного пациента, присваивая им уникальный индекс. При последующих съемках Bodyscan выявляет изменения и подсвечивает их для привлечения внимания врача. Кроме предварительного анализа, Bodyscan обладает широкими возможностями по сортировке и сквозному поиску изображений, помогая врачу создать удобную базу снимков своих пациентов.
Программный комплекс с искусственным интеллектом Moleanalyser pro прицельно изучает микроснимки подозрительных новообразований. Данный комплекс был предварительно обучен на сотнях тысяч фотографий с подтвержденными диагнозами, что позволяет ему с точностью до 95% выявлять меланому и другие злокачественные новообразования кожи. В итоге врач получает личного самообучающегося ассистента, обладающего огромной базой знаний и не пропускающего ни единой точки на теле пациента. В свою очередь, пациент получает гарантию действительно качественной ранней диагностики меланомы, что повышает его шансы на успешное лечение.
Мобильная дерматоскопия и телемедицина Handyscope
Более простой альтернативой комплексу FotoFinder является мобильная дерматоскопия и телемедицина Handyscope. Handyscope представляет собой небольшое устройство, которое устанавливается на камеру iPhone, а также специальное приложение для этого смартфона. Врач получает широкие возможности для иммерсионной и поляризационной дерматоскопии, точнейший захват и «заморозку» изображения, 20-кратный оптический зум и высочайшее качество снимков благодаря мощной камере iPhone.
Приложение Handyscope 3 устанавливается на iPhone и работает совместно с устройством Handyscope. Приложение позволяет быстро делать снимки новообразований, хранить их в удобной базе данных, запрашивать их оценку при помощи искусственного интеллекта или стороннего специалиста. В последнем случае используется Сервис второго мнения — телемедицина для связи с дерматологами и гистологами по всему миру. Теперь можно получить консультацию ведущих экспертов для максимально точной диагностики и выбора метода лечения меланомы кожи.
Десмопластическая меланома. Признаки десмопластической меланомы.
ФГБУ «Научно-исследовательский институт онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург;
ГБУЗ «Клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», Санкт-ПетербургФГБУ «Научно-исследовательский институт онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
НИИ онкологии им. Н.Н. Петрова, Санкт-Петербург
ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи», Санкт-Петербург, Россия;
ЧОУВО «Санкт-Петербургский медико-социальный институт», Санкт-Петербург, РоссияИммуногистохимический и генетический профиль меланом с веретеноклеточной морфологией
Журнал: Архив патологии. 2015;77(4): 17‑23
ФГБУ «Научно-исследовательский институт онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург;
ГБУЗ «Клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», Санкт-ПетербургЦель — сравнительное исследование иммуногистохимического профиля и анализ мутаций в генах BRAF и NRAS. Материал и методы. Веретеноклеточные меланомы из архива института были разделены на 6 групп по результатам клинико-морфологического анализа и катамнеза. Иммуногистохимическое исследование проведено в 58 случаях, включавших 19 нодулярных веретеноклеточных меланом, 10 поверхностно распространяющихся, 4 комбинированных варианта, 8 саркоматоидных, 13 смешанных десмопластических и 4 чистых десмопластических варианта. Результаты. Все опухоли исследуемого спектра экспрессировали S100, SOX10, KBA.62, нестин и циклин Д1. Частота позитивного окрашивания для MITF составила 80%, PNL2 — 69%, HMB45 — 61%, MelanA — 58%, CD117 — 36%, SMA — 35%. Экспрессия HMB45 и MelanA была диффузная и выраженная в группах нодулярной и поверхностно распространяющейся меланомы, в саркоматоидном и смешанном десмопластическом типах выявлялись лишь отдельные окрашенные клетки, а случаи чистой десмопластической меланомы были негативны к этим маркерам. Иммуноэкспрессия SMA наблюдалась только в саркоматоидном и десмопластических типах. Двойное окрашивание с S100 выявило отдельную актин-позитивную миофибробластоподобную популяцию, исчезающую в более клеточных зонах. EMA, Сlaudin 1 и DOG1 были негативные во всех случаях. Экспрессия BRAF выявлена в 14% (в 2 нодулярных и 1 поверхностно распространяющейся) и коррелировала с наличием мутации. Мутация NRAS обнаружена в 1 нодулярной веретеноклеточной меланоме. Меланомы десмопластического типа не несли вышеуказанных мутаций. Заключение. Результаты исследования указывают на вариантную гетерогенность веретеноклеточных меланом, что подтверждается как на клинико-морфологическом, так и на иммуногистохимическом и молекулярно-генетическом уровнях. Полученные данные могут быть использованы в дифференциальном диагнозе этих опухолей.
ФГБУ «Научно-исследовательский институт онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург;
ГБУЗ «Клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», Санкт-ПетербургФГБУ «Научно-исследовательский институт онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
НИИ онкологии им. Н.Н. Петрова, Санкт-Петербург
ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи», Санкт-Петербург, Россия;
ЧОУВО «Санкт-Петербургский медико-социальный институт», Санкт-Петербург, РоссияМеланомы с преобладающей веретеноклеточной морфологией сравнительно редки и представляют собой гетерогенный клинико-морфологический спектр злокачественных опухолей с меланоцитарной дифференцировкой. Доминирующая веретеноклеточность может быть особенностью ряда нозологических подвариантов меланомы, таких как поверхностно распространяющаяся, нодулярная, лентигинозная, а также диагностическим признаком других, в частности десмопластических форм. Кроме этого, в литературе описаны так называемые «веретеноклеточные меланомы», которые одни авторы рассматривают в качестве отдельной нозологии, что создает определенную понятийную путаницу [1], а другие исследователи используют данный термин лишь как описательный [2].
Целью настоящей работы явилось сравнительное исследование иммуногистохимического профиля спектра веретеноклеточных меланом на предмет его однородности и анализ мутаций в генах BRAF и NRAS.
Материал и методы
Для поиска веретеноклеточных меланом были пересмотрены меланомы и веретеноклеточные опухоли кожи архива НИИ онкологии им. Н.Н. Петрова за 1982—2014 гг. и Санкт-Петербургского клинического научно-практического (онкологического) центра за 2012—2014 гг. Критериями отбора были дермальная/эпидермодермальная пролиферация атипичных веретеновидных клеток (не менее 80%) и доказательство меланоцитарной дифференцировки (наличие типичной интраэпидермальной меланоцитарной опухоли и/или иммуногистохимические маркеры меланоцитарного генеза). Было выявлено 58 случаев, строго отвечающих вышеуказанным критериям. В каждой опухоли были оценены следующие признаки: силуэт опухоли, симметричность, гистологическая архитектура, наличие юнкционального компонента, изъязвление эпидермиса, наличие пигмента, уровень инвазии по Кларку, толщина по Бреслоу, размер клеток и ядер, особенности их формы, выраженность атипии, митотическая активность с учетом феномена созревания, тип, выраженность коллагенизации стромы, ее качественный состав, наличие воспалительного инфильтрата, его качественный состав и внутриопухолевое распределение, наличие периневральной и васкулярной инвазии, а также сопутствующие изменения эпидермиса и дермы.
Для выяснения катамнеза были проанализированы истории болезни, медицинские карты наблюдения пациентов и данные телефонного опроса пациентов и/или родственников.
По результатам клинико-морфологического анализа с учетом отдаленных результатов спектр веретеноклеточных меланом был разделен на 6 групп:
А — нодулярные веретеноклеточные (полиповидное образование, как правило, пигментированное, с преобладающей фазой «вертикального» роста, компактной узловой пролиферацией опухолевых клеток и минимальным вовлечением эпидермиса; в 30% — метастазы в регионарных лимфатических узлах, безрецидивная выживаемость — 33 мес) (рис. 1, а);
![]()
Рис. 1. Разновидности меланом с веретеноклеточной морфологией. а — нодулярная веретеноклеточная меланома; б — поверхностно распространяющаяся, преимущественно веретеноклеточная, меланома; в — комбинированная веретеноклеточная меланома, сочетающая поверхностно распространяющуюся и саркоматоидную; г — саркоматоидный вариант; д — смешанная десмопластическая меланома: гнезда эпителиоидных клеток расположены среди полей десмопластической меланомы; е — чистый десмопластический вариант. Окраска гематоксилином и эозином. а, б, г—е — ×50, в — ×20.
Б — поверхностно распространяющиеся веретеноклеточные (пигментированное пятно или плоская бляшка с четкими контурами, гистологически выраженная «радиальная» фаза роста; в 14% — метастазы в регионарных лимфатических узлах, безрецидивная выживаемость — 120 мес) (см. рис. 1, б);
В — комбинированные (макроскопически сходные с нодулярной либо поверхностно распространяющейся меланомой, но микроскопически сочетающие один из вышеуказанных вариантов с десмопластической формой; в 50% — метастазы в регионарных лимфатических узлах, безрецидивная выживаемость — 12 мес) (см. рис. 1, в);
Г — саркоматоидные (плоская бляшка светло-серого или белесоватого цвета, без четких контуров с окружающими тканями, диффузно-компактная дермальная пучковая веретеноклеточная пролиферация с межпучковым типом коллагенизации, отчетливо визуализируемым при окраске по Массону; в 25% — местный рецидив, безрецидивная выживаемость — 18 мес) (см. рис. 1, г);
Д — смешанные десмопластические (беспигментное уплотнение кожи или плоская плохо очерченная бляшка, микроскопически сочетание десмопластической формы с участками саркоматоидной и/или эпителиоидноклеточной популяции; в 43% — местные рецидивы, безрецидивная выживаемость — 9,3 мес) (см. рис. 1, д);
Е — чистые десмопластические (беспигментное уплотнение кожи, напоминающее рубец, при гистологическом исследовании гипоклеточная диффузно-инфильтративная дермально-субдермальная пролиферация с межклеточным типом коллагенизации, составляющая 90% и более; в 75% — местные рецидивы, безрецидивная выживаемость — 8,6 мес) (см. рис. 1, е).
Морфологический анализ проводился по микропрепаратам, окрашенным гематоксилином и эозином, трихромом по Массону, по Вейгерту на эластические волокна, ШИК-реактивом, импрегнированных серебром для визуализации ретикулиновых волокон. Иммуногистохимическое исследование выполнено на автостейнере Ventana BM XT с использованием следующих антител: S100 («Genemed», Poly, 1:200), MelanA («Genemed», A103, 1:100), Melanosome («Genemed», HMB45, 1:100), Melanoma associated antigen («Ventana», PNL2, RTU), Melanoma associated antigen («Ventana», KBA.62, RTU), SOX10 («Cell Marque», Poly, 1:50), SMA («Cell Marque», 1A4, 1:200), CyclinD1 («Cell Marque», SP4, RTU), EMA («Cell Marque», E29, 1:100), Claudin1 («BOX Spring», Poly, 1:100), MITF («Cell Marque», C5/D5, 1:300), Collagen IV («DCS Innovative Diagnostic System», CIV22, 1:100), BRAF («BOX Spring», VE1, 1:100), c-Kit («Genemed», CD117, 1:100), DOG1 («Ventana», SP31, RTU), Nestin («Cell Marque», 10C2, 1:100). Количество опухолевых клеток, экспрессирующих антиген, оценивали полуколичественно: 0 — нет окрашивания, 1+ — окрашивание 50% клеток.
Участки парафиновых срезов опухоли выделялись для молекулярно-генетического анализа генов BRAF и NRAS, проводимого посредством ПЦР и секвенирования ДНК.
Результаты и обсуждение
В нашем исследовании все опухоли исследуемого спектра экспрессировали S100, SOX10, KBA.62 и нестин, что указывало на общность их генеза и подтверждало меланоцитарную дифференцировку. Была отмечена диффузная и выраженная коэкспрессия SOX10 (рис. 2, а), S100 и нестина. В большинстве исследованных случаев окрашивание KBA.62 выявлялось в 50% и более опухолевых клеток (см. рис. 2, б), за исключением 1 десмопластической меланомы, где экспрессия составила менее 5%, и 1 нодулярной с умеренно выраженной реакцией с 26—50% опухоли.
![]()
Рис. 2. Иммуногистохимический профиль веретеноклеточных меланом. а — ядерная экспрессия SOX10 в нодулярной веретеноклеточной меланоме. ×200; б — мембранно-цитоплазматическое окрашивание KBA.62 в меланоме саркоматоидного типа. ×200; в — иммуногистохимическая гетерогенность в комбинированной меланоме, сочетающей эпителиоидно-веретеноклеточную поверхностно распространяющуюся форму (MelanA-позитивен) с десмопластической (MelanA-негативен). ×60; г — ядерная экспрессия Cyclin D1 в чистой десмопластической меланоме. ×100; д — двойное окрашивание S100 (красная метка) и SMA (коричневое цитоплазматическое окрашивание) выявляет две разные популяции клеток в десмопластической меланоме. ×200; е — иммуноэкспрессия BRAF в веретеноклеточной нодулярной меланоме, имеющей одноименную мутацию. ×50.
Белки S100 и SOX10 являются также пан-шванновскими маркерами. Белок SOX10, кодируемый геном SOX10, локализующийся на 22-й хромосоме (22q13.1) и являющийся транскрипционным фактором, играет важную роль в формировании тканей и органов в процессе эмбриогенеза, особенно структур нервного гребня, периферической нервной и меланоцитарной системы, а также в поддержании уже дифференцированных клеток. Его роль в данном процессе делает этот транскрипционный фактор идеальным маркером шванновской и меланоцитарной дифференцировки клеток на различных стадиях их созревания. Исследованиями последних лет показано, что SOX10 является более специфичным и чувствительным маркером меланоцитарной и шванновской дифференцировки по сравнению с S100 [3]. KBA.62 — моноклональное антитело к антигенам, ассоциированным с меланомой, полученное с помощью специфической линии меланомных клеток. По данным разных авторов, иммунореактивность этого антитела составляет от 93 до 86% в различных вариантах злокачественной меланомы, в том числе 82% в десмопластическом типе [4, 5].
Белок нестин является одним из промежуточных филаментов и считается маркером нейроэктодермальных стволовых клеток, так как значительно экспрессируется в пролиферирующих клетках во время эмбрионального развития центральной нервной системы. В работе S. Brychtova и соавт. [6] экспрессия нестина была выявлена в доброкачественных меланоцитарных образованиях и в 84% первичных меланом. Причем увеличение количества нестин-позитивных клеток наблюдалось в поздних стадиях развития опухоли и соотносилось с более агрессивным течением заболевания. Результаты нашего исследования продемонстрировали выраженную экспрессию нестина в HMB45-негативных опухолях, отнесенных к смешанному и чистому десмопластическому варианту, что совпадает с данными работы M. Kanoh и соавт.[7], считающими нестин одним из основных диагностических маркеров НМВ45-отрицательных меланом. В нашей серии HMB45-позитивные опухоли также экспрессировали нестин, что противоречит данным M. Kanoh.
Неоднородность спектра на иммуногистохимическом уровне подчеркивала иммунореактивность с MelanA, HMB45 и PNL2, коррелировавших друг с другом. Если в группах веретеновидных меланом, классифицированных как поверхностно распространяющаяся и нодулярная, реакция с этими антителами была выраженная и составляла 50% и более, то в десмопластическом типе она отсутствовала (см. рис. 2, в). Эти результаты совпадают с данными других авторов [8]. При этом в группе, обозначенной нами как саркоматоидные и занявшей промежуточную позицию спектра, диффузно визуализировались отдельные клетки, экспрессировавшие вышеуказанные маркеры. Вероятно, это явление отражает различные уровни меланоцитарной дифференцировки клеток (табл. 1).
![]()
Таблица 1. Сравнительный анализ иммунофенотипа меланом веретеноклеточного спектра Примечание. Здесь и в табл. 2: НВМ — нодулярная веретеноклеточная меланома, ПРВМ — поверхностно распространяющаяся веретеноклеточная меланома, КМ — комбинированная меланома, СМ — саркоматоидная меланома, СДМ — смешанная десмопластическая меланома, ЧДМ — чистая десмопластическая меланома.
В нашей серии была выявлена выраженная диффузная экспрессия циклина Д1 во всех исследованных опухолях, в том числе в чистых, смешанных десмопластических меланомах и так называемых саркоматоидных (см. рис. 2, г). Циклин Д1 играет важную роль в процессах клеточной пролиферации, в прогрессии от G1 к S-фазе и является онкогеном в меланомах [9]. Несмотря на уже общеизвестный факт об иммуногистохимической гиперэкспрессии этого маркера в большинстве меланом, мы не встретили работ, изучавших экспрессию циклина Д1 в десмопластических вариантах.
Среди меланом веретеноклеточного спектра нами было выявлено 36% CD117-позитивных случаев, при этом иммунореактивность с DOG1 отсутствовала. Экспрессия CD117 документирована в меланомах, преимущественно акральной локализации. Среди веретеноклеточных вариантов D. Miller и соавт. [10, 11] отметили существенную разницу между чистыми и смешанными десмопластическими меланомами. Они обнаружили 26% CD117-позитивных чистых десмопластических меланом и 78% позитивных смешанных, при этом не было строгой корреляции с наличием мутаций в гене c-kit (экзоны 11, 13 и 17). Данный факт авторы объясняют либо незрелостью белка, продукта данного гена, либо возможными мутациями других экзонов.
В настоящей серии меланом с веретеноклеточной морфологией мы не выявили популяции клеток с периневральной дифференцировкой (ЕМА и Сlaudin1 были негативные во всех исследованных случаях), которая иногда встречается в невусах [12].
Во всех группах, за исключением комбинированных меланом, отмечалась внутриопухолевая однородность иммунофенотипа. В группе комбинированных меланом обращала на себя внимание бифазность. Опухоли сочетали дифференцированные участки веретеноклеточной нодулярной или поверхностно распространяющейся меланомы с десмопластическим или саркоматоидным типом. При этом иммунофенотип их различался в пределах одной опухоли (см. рис. 2, в).
Интересной особенностью, отмеченной и в предыдущих работах, явилась диффузная иммуноэкспрессия SMA в меланомах десмопластического типа [13]. При этом двойное окрашивание с S100 показало, что гладкомышечный актин экспрессируется на S100-негативных миофибробластоподобных клетках, расположенных диффузно между S100-позитивными меланоцитарными, в свою очередь негативных к SMA (см. рис. 2, д). Мы обнаружили только одну работу, содержащую результаты аналогичного исследования [14]. Количество актин-позитивных клеток было взаимосвязано со степенью межклеточной коллагенизации и уменьшалось в более клеточных участках смешанных десмопластических и саркоматоидных разновидностей, где носило межпучковый характер. Эти клетки отсутствовали в веретеноклеточных нодулярных и поверхностно распространяющихся меланомах, а также в соответствующей части комбинированных форм.
Проведенный анализ генов BRAF и NRAS, являющихся наиболее частыми в меланомах, обнаружил наличие мутаций в гене BRAF в 23% веретеноклеточных меланом, что полностью коррелировало с иммуноэкспрессией BRAF (см. рис. 2, е; рис. 3). Мутации в гене NRAS были выявлены в 8% случаев. При этом меланомы десмопластического типа не несли вышеуказанных мутаций (табл. 2), что совпадает с результатами других исследователей [15, 16].
Таблица 2. Анализ статуса генов BRAF и NRAS в меланомах веретеноклеточного спектра
![]()
Рис. 3. Статус онкогена BRAF в нодулярной веретеноклеточной меланоме: выявлена замена с.1799Т>А (V600E). а — результаты HRMA (зеленая кривая — образец без мутации, красная — образец с мутацией V600E, исследуемый образец указан стрелкой); б — результаты секвенирования (с.1799Т>А).
Заключение
Полученные результаты указывают на вариантную гетерогенность спектра меланом, объединенных морфологическим феноменом веретеноклеточности, что подтверждается как на клинико-морфологическом, так и на иммуногистохимическом и молекулярно-генетическом уровнях.
Нюансы иммунофенотипа и генетические особенности веретеноклеточных меланом могут быть использованы для корректной диагностики и выбора оптимальной лечебной тактики.
Читайте также: