Диагностика свернувшегося гемоторакса - методы
Добавил пользователь Валентин П. Обновлено: 31.01.2026
Свершувшийся гемоторакс - причины и механизмы развития
Продолжающееся на протяжении первых суток после операции кровотечение по дренажам плевральной полости с интенсивностью 250-300 мл в час служит показанием к торакотомии (реторакотомии). Источником кровотечения в подавляющем большинстве наблюдений являются межреберные сосуды, поврежденные при ранении или в процессе оказания хирургической помощи (нарушение техники дренирования плевральной полости, небрежный гемостаз при завершении торакотомии).
При хорошо расправленном легком незначительное кровотечение из его паренхимы или из грудной стенки, как правило, спонтанно останавливается. Но в отдельных случаях (недостаточно расправленное легкое, сосудистая гипертензия, нарушение функции дренажа и т.д.) кровь в плевральной полости продолжает медленно накапливаться, претерпевая со временем определенные морфологические изменения. Возникает проблема свернувшегося гемоторакса.
Помимо такого продолжительного, но неинтенсивного кровотечения, в хирургической практике встречаются наблюдения повторного массивного кровотечения, причиной которого чаще всего бывает несостоятельность сосудистых швов или соскакивание (развязывание) лигатуры. В таких случаях необходимо помнить правило: усиление темпа кровопотери по дренажу до 300 мл в час при удовлетворительных показателях гемостаза требует немедленной реторакотомии.
Свернувшийся гемоторакс является динамическим патологическим процессом, возникающим в плевральной полости вследствие свертывания излившейся в нее крови. Частота возникновения этого патологического процесса после операций на органах груди колеблется, по данным литературы, от 0,5 до 21,3% [Байдан В.Н., Брюсов П. Г. и др., Eddy A.S. et al., Helling Т. С. et al., Fallon W.F., Velmachos J.S. et al., Prissada V. et al., Kimbrell B.J. et al.].
Столь большая разница в частоте свернувшегося гемоторакса объясняется тем, что ее рассчитывают по отношению к различным контингентам пациентов, находящихся в данном лечебном учреждении. Другими словами, частота встречаемости свернувшегося гемоторакса определяется той патологией, с которой имеют дело авторы публикаций. Подавляющее большинство из этих публикаций посвящено свернувшемуся гемотораксу, возникающему после плановых торакальных операций (чаще всего на легком).
Некоторые авторы анализируют, не разделяя, особенности диагностики и лечения как травматического, так и послеоперационного свернувшегося гемоторакса, хотя причина возникновения, особенности клинического течения и лечебная тактика при этих формах свернувшегося гемоторакса существенно различаются.
Ряд авторов -- Е.А.Соколов и соавт., С.А.Субботин и соавт. — рассматривают, не разделяя, наблюдения свернувшегося гемоторакса после ранений груди и после закрытой травмы груди, что также не способствует детальному анализу этой проблемы. Попытки авторов [Байдан В. И.] представить наличие свертков крови, обнаруженных в плевральной полости во время экстренной торакотомии по поводу массивного внутриплеврального кровотечения, как свернувшийся гемоторакс, не выдерживают никакой критики, поскольку механизм формирования свернувшегося гемоторакса в посттравматическом периоде и проблемы, связанные с этим процессом, совершенно другие.
По мнению П. Г. Брюсова и соавт., возникновению свернувшегося гемоторакса способствует одномоментное образование чрезмерно большого сгустка на фоне присоединения инфекции и высокой активности коагулирующих факторов вследствие поступления в плевральную полость большого количества тромбопластина из поврежденных тканей. Однако если это суждение обосновано, например, при огнестрельном ранении с большим разрушением тканей или после травматичной торакотомии, то объяснить этим механизмом наблюдения свернувшегося гемоторакса при колото-резаных ранениях нельзя.
Я.Н. Шойхет и соавт., исследуя коагуляционные свойства клеток у пациентов со свернувшимся гемотораксом, нашли высокую прокоагуляционную активность моноцитов плевры на фоне низкой прокоагуляционной активности макрофагов в ткани легкого и низкой иротеолитической активности моноцитов и лейкоцитов циркулирующей крови.
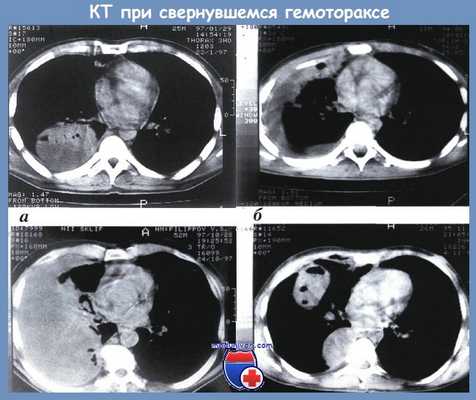
Формы свернувшегося гемоторакса по данным КТ:
а — локальный; б — плащевидный; в — тотальный; г — фрагментарный
Мы считаем, что свернувшийся гемоторакс при проникающих ранениях груди возникает тогда, когда имеется длительное, хотя и неинтенсивное кровотечение в плевральную полость. Такие условия создаются при неэффективном или запоздалом дренировании плевральной полости, а у пациентов, перенесших торакотомию — при длительной и травматичной операции.
В наших наблюдениях наиболее частой причиной нарушения функции дренажей было самовольное отключение пациентами дренажных трубок от системы аспирации вследствие психических заболеваний пациентов при недостаточном надзоре, алкогольной деградации личности. В 8% наблюдений существенным фактором явилось длительное пережатие плевральных дренажей при транспортировке пациентов из операционной в другие отделения, что приводило к скоплению в плевральной полости крови и воздуха.
В 4 % наблюдений причиной свернувшегося гемоторакса стало вторичное кровотечение в плевральную полость. В одном из этих наблюдений на 2-е сутки после торакотомии произошло соскальзывание лигатуры с межреберной артерии, по поводу чего была выполнена торакоскопия с клипированием межреберной артерии и эвакуацией свернувшегося гемоторакса. В другом — свернувшийся гемоторакс выявлен на 10-е сутки после проникающего ранения груди с ранением легкого: при поступлении было выполнено дренирование плевральной полости и хирургическая обработка раны грудной стенки.
Выполнена торакоскопия, коагуляция кровоточащей раны легкого аргоно-плазменным коагулятором и эвакуация свернувшегося гемоторакса.
Следует подчеркнуть, что у отдельных пострадавших выявлено сразу несколько факторов, способствующих образованию этого осложнения.
Наконец, определенную роль в запуске механизмов образования свернувшегося гемоторакса играет инфицирование плевральной полости непосредственно при ранении или при лечебных манипуляциях, выполненных с нарушением правил асептики.
В. И. Ковальчук и соавт. выделяют следующие стадии развития свернувшегося гемоторакса:
I стадия — формирования (первые 4-5 сут после травмы). На этой стадии в плевральной полости имеется желеобразная масса форменных элементов крови и фибрина, рыхло спаянная с листками плевры.
II стадия — организации (с 5-х по 30-е сутки). Ретракция сгустка приводит к разделению жидкостной и плотной фракций, причем в зависимости от условий образования свернувшегося гемоторакса их соотношение может быть различным (как, например, 5:1, так и 1:5). Плотная фракция представляет собой фибрин (с преобладанием лейкоцитов) и молодую соединительную ткань, которая с каждым днем все прочнее фиксируется к листкам плевры.
III стадия — нагноения (с 15-х по 60-е сутки). Стадии нагноения удается избежать при комплексном интенсивном лечении, во всех других случаях она является закономерной. В этой стадии на фоне образования более зрелой соединительной ткани и очагов протеолиза, вследствие вторичного лимфогенного, контактного инфицирования, присоединяется микробная флора, возникает эмпиема плевры.
IV стадия — фиброторакс (спустя 60-90 сутки от начала формирования свернувшегося гемоторакса). Большой объем свернувшегося гемоторакса и недостаточно эффективное лечение эмпиемы плевры приводит к циррозу легочной паренхимы, атрофии межреберных мышц, деформации грудной клетки с грубыми нарушениями функций внешнего дыхания — возникает фиброторакс, приводящий больного к глубокой инвалидности и летальному исходу от очередной легочной инфекции.
Общая летальность при свернувшемся гемотораксе, по данным многих торакальных центров, колеблется от 3,9 до 4,5 %, а при возникновении эмпиемы плевры достигает 10%.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гемоторакс
Гемоторакс – это кровотечение в полость плевры, скопление крови между ее листками, приводящее к сдавлению легкого и смещению органов средостения в противоположную сторону. При гемотораксе отмечается боль в грудной клетке, затруднение дыхания, развиваются признаки острой кровопотери (головокружение, бледность кожных покровов, тахикардия, гипотония, холодный липкий пот, обмороки). Диагностика гемоторакса основана на физикальных данных, результатах рентгеноскопии и рентгенографии грудной клетки, КТ, диагностической плевральной пункции. Лечение гемотракса включает гемостатическую, антибактериальную, симптоматическую терапию; аспирацию скопившейся крови (пункции, дренирование плевральной полости), при необходимости – открытое или видеоторакоскопическое удаление свернувшегося гемоторакса, остановку продолжающегося кровотечения.
МКБ-10
Общие сведения
Гемоторакс является вторым по частоте (после пневмоторакса) осложнением травм грудной клетки и встречается у 25 % больных с торакальной травмой. Довольно часто в клинической практике наблюдается комбинированная патология - гемопневмоторакс. Опасность гемоторакса заключается как в нарастающей дыхательной недостаточности, обусловленной сдавлением легкого, так и в развитии геморрагического шока вследствие острого внутреннего кровотечения. В пульмонологии и торакальной хирургии гемотракс расценивается как неотложное состояние, требующее оказания экстренной специализированной помощи.
Причины гемоторакса
Выделяют три группы причин, наиболее часто приводящих к развитию гемоторакса: травматические, патологические и ятрогенные.
- Под травматическими причинами понимают проникающие ранения или закрытые повреждения грудной клетки. К торакальной травме, сопровождающейся развитием гемоторакса, относятся ДТП, огнестрельные и ножевые ранения грудной клетки, переломы ребер, падения с высоты и др. При подобных травмах довольно часто происходит повреждение органов грудной полости (сердца, легких, диафрагмы), органов брюшной полости (травмы печени, селезенки), межреберных сосудов, внутренней грудной артерии, внутригрудных ветвей аорты, кровь из которых изливается в плевральную полость.
- К причинам гемоторакса патологического характера причисляют различные заболевания: рак легкого или плевры, аневризму аорты, туберкулез легких, абсцесс легкого, новообразования средостения и грудной стенки, геморрагический диатез, коагулопатии и др.
- Ятрогенными факторами, приводящими к развитию гемоторакса, выступают осложнения операций на легких и плевре, торакоцентеза, дренирования плевральной полости, катетеризации центральных вен.
Патогенез
Скопление крови в полости плевры вызывает компрессию легкого на стороне поражения и смещение органов средостения в противоположную сторону. Это сопровождается уменьшением дыхательной поверхности легкого, возникновением расстройств дыхания и гемодинамики. Поэтому при гемотраксе нередко развивается клиника геморрагического и кардио-пульмонального шока с острой дыхательной и сердечной недостаточностью.
Уже в ближайшие часы после попадания крови в плевральную полость развивается асептическое воспаление плевры - гемоплеврит, обусловленный реакцией плевральных листков. При гемотораксе возникает отек и умеренная лейкоцитарная инфильтрация плевры, набухание и слущивание клеток мезотелия. В начальном периоде излившаяся в плевральную полость кровь практически не отличается по составу от периферической крови. В дальнейшем в ней происходит снижение гемоглобина, уменьшение эритроцитарно-лейкоцитарного индекса.
Попадая в плевральную полость, кровь вначале сворачивается. Однако затем вскоре наступает процесс фибринолиза, и происходит повторное разжижение крови. Этому способствуют антикоагулянтные факторы, содержащиеся в самой крови и плевральной жидкости, а также механическое дефибринирование крови за счет дыхательной экскурсии грудной клетки. По мере истощения механизмов антикоагуляции происходит свертывание крови и формирование свернувшегося гемоторакса. В случае присоединения микробного инфицирования на фоне гемоторакса довольно быстро может возникать эмпиема плевры.
Классификация
В соответствии с этиологией различают травматический, патологический и ятрогенный гемоторакс. С учетом величины внутриплеврального кровотечения гемоторакс может быть:
- малый - объем кровопотери до 500 мл, скопление крови в синусе;
- средний - объем до 1,5 л, уровень крови до нижнего края IV ребра;
- субтотальный - объем кровопотери до 2 л, уровень крови до нижнего края II ребра;
- тотальный - объем кровопотери свыше 2 л, рентгенологически характеризуется тотальным затемнением плевральной полости на стороне поражения.
Количество крови, излившейся в плевральную полость, зависит от локализации ранения и степени разрушения сосудов. Так, при повреждении периферических отделов легкого, в большинстве случаев возникает малый или средний гемоторакс; при ранениях корня легкого обычно повреждаются магистральные сосуды, что сопровождается массивным кровотечением и развитием субтотального и тотального гемоторакса.
Кроме этого, также выделяют ограниченный (обычно малый по объему) гемоторакс, при котором излившаяся кровь скапливается между плевральными спайками, на изолированном участке полости плевры. С учетом локализации ограниченный гемоторакс бывает верхушечным, междолевым, паракостальным, наддиафрагмальным, парамедиастинальным.
В случае продолжающегося внутриплеврального кровотечения говорят о нарастающем гемотораксе, в случае прекращения кровотечения – о ненарастающем (стабильном). К осложненным видам относят свернувшийся и инфицированный гемоторакс (пиогемоторакс). При одновременном попадании в полость плевры воздуха и крови, говорят о гемопневмотораксе.
Симптомы гемоторакса
Клиническая симптоматика гемоторакса зависит от степени кровотечения, сдавления легочной ткани и смещения органов средостения. При малом гемотораксе клинические проявления выражены минимально или отсутствуют. Основными жалобами служат боли в грудной клетке, усиливающиеся при кашле, умеренная одышка.
При гемотораксе среднего или большого размера развиваются дыхательные и сердечно-сосудистые расстройства, выраженные в различной степени. Характерна резкая боль в груди, иррадиирующая в плечо и спину при дыхании и кашле; общая слабость, тахипноэ, снижение АД. Даже при незначительной физической нагрузке происходит усиление симптоматики. Больной обычно принимает вынужденное сидячее или полусидячее положение.
При тяжелом гемотораксе на первый план выступает клиника внутриплеврального кровотечения: слабость и головокружение, холодный липкий пот, тахикардия и гипотония, бледность кожных покровов с цианотичным оттенком, мелькание мушек перед глазами, обмороки.
Гемоторакс, сопряженный с переломом ребер, как правило, сопровождается подкожной эмфиземой, гематомами мягких тканей, деформацией, патологической подвижностью и крепитацией отломков ребер. При гемотораксе, протекающем с разрывом легочной паренхимы, может возникать кровохарканье.
В 3-12% случаев формируется свернувшийся гемоторакс, при котором в полости плевры образуются кровяные сгустки, фибринные наслоения и шварты, ограничивающие дыхательную функцию легкого, вызывая развитие склеротических процессов в легочной ткани. Клиника свернувшегося гемоторакса характеризуется тяжестью и болью в грудной клетке, одышкой. При инфицированном гемотораксе (эмпиеме плевры) на первый план выходят признаки тяжелого воспаления и интоксикации: лихорадка, ознобы, вялость и др.
Диагностика
Для постановки диагноза уточняются подробности истории заболевания, проводится физикальное, инструментальное и лабораторное обследование. При гемотораксе определяется отставание пораженной стороны грудной клетки при дыхании, притупление перкуторного звука над уровнем жидкости, ослабление дыхания и голосового дрожания. При рентгеноскопии и обзорной рентгенографии легких выявляется коллабирование легкого, наличие горизонтального уровня жидкости или сгустков в полости плевры, флотация (смещение) тени средостения в здоровую сторону.
С диагностической целью выполняется пункция плевральной полости: получение крови достоверно свидетельствует о гемотораксе. Для дифференциации стерильного и инфицированного гемоторакса проводят пробы Петрова и Эфендиева с оценкой прозрачности и осадка аспирата. С целью суждения о прекращении или продолжении внутриплеврального кровотечения выполняют пробу Рувилуа-Грегуара: свертывание полученной крови в пробирке или шприце свидетельствует о продолжающемся кровотечении, отсутствие коагуляции говорит о прекращении кровотечения. Образцы пунктата направляют в лабораторию для определения гемоглобина и проведения бактериологического исследования.
При банальном и свернувшемся гемотораксе прибегают к лабораторному определению Нb, количества эритроцитов, тромбоцитов, исследованию коагулограммы. Дополнительная инструментальная диагностика при гемотораксе может включать УЗИ плевральной полости, рентгенографию ребер, КТ грудной клетки, диагностическую торакоскопию.
Лечение гемоторакса
Пациенты с гемотораксом госпитализируются в специализированные хирургические отделения и находятся под наблюдением торакального хирурга. С лечебной целью для аспирации/эвакуации крови производится дренирование плевральной полости с введением в дренаж антибиотиков и антисептиков (для профилактики инфицирования и санации), протеолитических ферментов (для растворения сгустков). Консервативное лечение гемоторакса включает проведение гемостатической, дезагрегантной, симптоматической, иммунокорригирующей, гемотрансфузионной терапии, общей антибиотикотерапии, оксигенотерапии.
Малый гемоторакс в большинстве случаев может быть ликвидирован консервативным путем. Хирургическое лечение гемоторакса показано в случае продолжающегося внутриплеврального кровотечения; при свернувшемся гемотораксе, препятствующем расправлению легкого; повреждении жизненно важных органов.
В случае ранения крупных сосудов или органов грудной полости производится экстренная торакотомия, перевязка сосуда, ушивание раны легкого или перикарда, удаление излившейся в плевральную полость крови. Свернувшийся гемоторакс является показанием к плановому выполнению видеоторакоскопии или открытой торакотомии для удаления сгустков крови и санации плевральной полости. При нагноении гемоторакса лечение проводится по правилам ведения гнойного плеврита.
Прогноз и профилактика
Успешность лечения гемоторакса определяется характером травмы или заболевания, интенсивностью кровопотери и своевременностью хирургической помощи. Прогноз наиболее благоприятен при малом и среднем неинфицированном гемотораксе. Свернувшийся гемоторакс повышает вероятность развития эмпиемы плевры. Продолжающееся внутриплевральное кровотечение или одномоментная большая кровопотеря могут привести к гибели пациента.
Исходом гемоторакса может являться образование массивных плевральных сращений, ограничивающих подвижность купола диафрагмы. Поэтому в период реабилитации пациентам, перенесшим гемоторакс, рекомендуются занятия плаванием и дыхательной гимнастикой. Профилактика гемоторакса заключается в предупреждении травматизма, обязательной консультации пациентов с торакоабдоминальной травмой хирургом, контроле гемостаза при операциях на легких и средостении, осторожном выполнении инвазивных манипуляций.
Диагностика свернувшегося гемоторакса - методы
Диагностика свернувшегося гемоторакса до недавнего времени считалась нерешенной проблемой. Клинические симптомы свернувшегося гемоторакса выражены обычно неярко и складываются из физикальных признаков наличия патологического содержимого в плевральной полости (укорочение перкуторного звука, ослабление дыхания), не смещаемого при изменении положения тела. Через 4-5 дней присоединяется субфебрильная температура, может быть тахикардия, сдвиг лейкоцитарной формулы влево. Наиболее распространсным методом диагностики до конца XX в. являлось рентгенологическое исследование, на основании которого ставили показания к диагностической пункции плевральной полости (Брюсов П.Г., Токмовцев Б.Я., Новиков А. С, Шапот Ю.Б., CoselliJ.S. ct al.].
Рентгенологическая картина при свернувшемся гемотораксе весьма вариабельна и зависит от стадии его развития. В ранние сроки рентгенологическое исследование в подавляющем большинстве случаев выявляет затенение гемоторакса, не смещаемое при перемене положения тела. Гораздо реже удается определить негомогенность этого затенения, а во второй стадии -возникновение множественных горизонтальных уровней жидкости в верхней части затенения. Для выявления этого феномена приходится делать рентгеновские снимки в трех проекциях (фронтальной, сагиттальной и боковой горизонтальной — латерографию). Но даже и при таких условиях свернувшийся гемоторакс трудно дифференцировать от внутрилегочной патологии (кровоизлияние в ткань легкого, пневмония, ателектаз).
П. Г. Брюсов и соавт. отмечали, что в таких случаях на первые и вторые сутки после торакальной операции при рентгенологическом исследовании в плевральной полости определялось негомогенное затенение, на фоне которого спустя 4-5 сут появлялись отдельные горизонтальные уровни. Сгустки крови затем покрываются экссудатом, что затрудняет интерпретацию рентгенологической картины.
Другие авторы также подчеркивают вариабельность рентгенологической картины, зависящей от стадии развития свернувшегося гемоторакса. G. С. Velmachos и соавт. отметили, что ошибки в диагностике свернувшегося гемоторакса при рентгенологическом исследовании встретили в 48% наблюдений. В наших наблюдениях рентгенологическое исследование груди применяли как скрининговый метод всем больным с целью комплексной оценки динамики посттравматического процесса (легкие, средостение, плевральные полости, грудная стенка).
Диагноз свернувшегося гемоторакса рентгенологически был первично установлен всего у 30 из 102 больных, в основном при его объеме, превышающем 1000 см 3 , и в поздние сроки. Чувствительность метода составила 31,9%. Как известно, рентгенологическая картина даже при обычном гемотораксе отличается большим разнообразием и зависит от его объема, локализации и степени осумкования.
При оценке рентгенограмм мы учитывали, что объем гемоторакса менее 300-500 см3 рентгенологически не определяется, хотя с клинической точки зрения такой объем в случае образования свернувшегося гемоторакса важно диагностировать, так как при этом резко возрастает возможность развития эмпиемы плевры.
В процессе образования свернувшегося гемоторакса мы наблюдали так называемое ограниченное смещение в некоторых отделах плевральной полости, в то время как основная часть содержимого оставалась неподвижной. В сроки свыше 5-6 сут при ретракции сгустков крови и их фиксации в области синусов иаравертебрально и паракостально большое количество образовавшегося экссудата продолжало свободно перемешаться в средних и верхних отделах плевральной полости, что создавало ложное впечатление об отсутствии плотной части свернувшегося гемоторакса, скрытой большим объемом жидкостной фракции.
Одним из постоянных рентгенологических признаков свернувшегося гемоторакса, но нашим данным, является отсутствие динамики рентгенологической картины гидроторакса при эвакуации из плевральной полости 800-1000 см3 экссудата. В таких случаях следует предположить, что свернувшийся гемоторакс в виде плаща окутывает легкое на большом протяжении. Поэтому судить о состоянии легочной ткани и органов средостения по рентгенологическим данным не представляется возможным до тех пор, пока не будет устранен свернувшийся гемоторакс. Ограниченные (локальные) формы свернувшегося гемоторакса важно дифференцировать с экстраплевральной гематомой, так как попытки опорожнения такой гематомы чреваты возникновением массивного кровотечения из поврежденных межреберных сосудов.
Как известно, при наличии в плевральной полости большого объема свободной жидкости, выявленной при физикалыюм или рентгенологическом исследовании, показана пункция плевральной полости. Эта манипуляция до настоящего времени является наиболее распространеной и рутинной в диагностике, в том числе и свернувшегося гемоторакса, когда по игле получают мелкие тромботические массы. Мы использовали этот метод во всех наших наблюдениях. Получение тромботических масс или отрицательный результат пункции подтверждали наличие свернувшегося гемоторакса, однако его объем, распространеность, локализация, соотношение плотной и жидкостной частей оставались неизвестными.
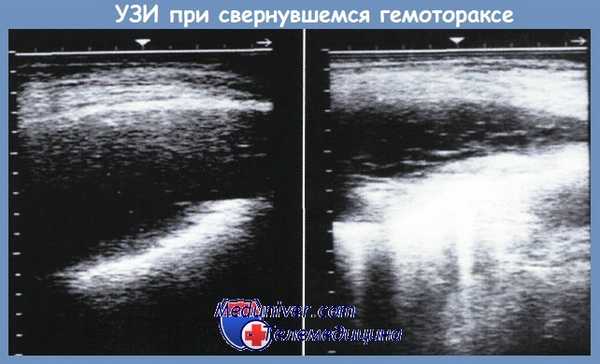
УЗИ позволяет в реальном масштабе времени визуализировать положение листков плевры, их толщину (для оценки воспалительных изменений) и расхождение (выраженное в миллиметрах). С помощью оценки величины этого расхождения можно ориентировочно определить объем патологического содержимого. Необходимо признать, что при одних и тех же величинах расхождения листков плевры разброс показателей объема у разных больных может быть весьма значительным; это зависит от роста больного и его телосложения.
Впервые различия в эхографической семиотике жидкой части крови и тромботических масс описали В. Sigel и соавт.. Они же экспериментально доказали, что смена повышенной эхогенности на пониженную в динамике гематомы происходит вследствие лизиса образовавшегося свертка крови [Sigel В. et al.]. УЗИ дает возможность установить факт ретракции сгустка с образованием жидкостной и плотной фракций, а также констатировать начало абсцедирования плотной части (по неоднородности эхоструктуры со снижением плотности в центре скопления и с появлением пузырьков газа).
Наш опыт показал, что УЗИ является методом выбора в динамической оценке состояния плевральной полости, характера содержимого и реакции плевральных листков. Верификация данных УЗИ путем сравнения с данными, полученными при КТ, дренировании плевральной полости, торакоскопии, торакотомии, позволила установить, что изменения величины расхождения листков плевры в процессе лечения могут быть при УЗИ зафиксированы при уменьшении или увеличении содержимого на 100-150 см3.
Ультразвуковым признаком свернувшегося гемоторакса в наших наблюдениях служило появление содержимого неоднородной структуры с гиперэхогенными включениями сначала линейного, а затем ячеистого характера, не смещаемого при изменении положения тела больного. В то же время в 4 наблюдениях отмечена гипердиагностика нагноения свернувшегося гемоторакса из-за наличия в содержимом мелких пузырьков газа с эффектом реверберации. Учитывая отсутствие клинико-лабораторных признаков нагноения и отрицательные результаты микробиологического исследования эвакуированного из плевральной полости экссудата, мы полагаем, что наличие мелких пузырьков газа в этих наблюдениях было связано не с нагноением, а с предшествующими врачебными манипуляциями (пункции, дренирование). В первичной диагностике свернувшегося гемоторакса чувствительность метода составила 68%.
Спиральная компьютерная томография дает наиболее исчерпывающую информацию о возникновении и развитии стадий свернувшегося гемоторакса. КТ-признаки свернувшегося гемоторакса представляют собой сочетание объективных качественных и количественных характеристик: наличие патологического содержимого, его точный объем, локализация, форма, контуры, структура (плотность, однородность), соотношение плотной и жидкостной фракций, их смещаемость. Чувствительность метода в наших наблюдениях составила 100 %. В отличие от УЗИ и МРТ, этому исследованию не препятствовало наличие эмфиземы мягких тканей, повязок, металлических конструкций и инородных тел. У больных в тяжелом состоянии в ходе КТ продолжалась инфузионно-трансфузионная терапия и ИВЛ. Противопоказаниями к КТ были нестабильная гемодинамика и масса тела свыше 100 кг.
На основании изучения результатов КТ с клинической точки зрения выделены 4 формы свернувшегося гемоторакса [Абакумов A.M.]: локальный, когда свертки крови расположены в синусах плевральной полости (чаще всего заднем), над диафрагмой, паракостально, паравертебрально, парамедиастинально и в междолевой борозде (рис. а); плащевидный, когда свертки крови располагаются одним блоком, узкой полосой, занимают синусы, паракостально и паравертебрально (рис. б); тотальный — свернувшийся гемоторакс объемом свыше 1500 см3 занимает одним блоком большую часть плевральной полости (рис. в); фрагментарный, когда имеются не связанные друг с другом, отграниченные скопления свертков крови в различных отделах плевральной полости и, как показывает опыт, в различных стадиях организации (рис. г).
Серийные срезы на уровне плевральных полостей позволяют установить локализацию осумкованных скоплений свернувшегося гемоторакса (верхушечная, базальная, междолевая, пристеночная, парамедиастинальная), их распространеность, конфигурацию и объем (в кубических сантиметрах) каждого из них, общий объем как жидкостной, так и плотной фракций, а также степень этой плотности, объективно выраженную в единицах по Хаунсфельду.
Кроме того, на компьютерной томограмме можно четко дифференцировать свернувшейся гемоторакс от внутрилегочных изменений. Совокупность информации, полученной при этом исследовании, дает возможность оценить особенности течения патологического процесса у каждого конкретного больного и определить адекватную лечебную тактику.
Из инвазивных методов диагностики свернувшегося гемоторакса применяют торакоцентез и торакоскопию. Торакоцентез (пункция плевральной полости) является традиционным, доступным и достаточно эффективным методом диагностики свернувшегося гемоторакса. Если при наличии клинико-рентгенологических данных о появлении патологического содержимого результат пункции плевральной полости отрицательный или в просвете иглы имеются мелкие тромботические массы темно-красного цвета («червячки»), диагноз свернувшегося гемоторакса можно считать установленным. В то же время следует признать, что при пункции далеко не всегда удается достоверно обнаружить ограниченное скопление патологического содержимого; попадая в скопление жидкостной фракции, можно сделать неверное заключение об отсутствии свернувшегося гемоторакса.
И даже получив так называемые червячки, врач делает заключение о наличии свернувшегося гемоторакса, не имея информации о его объеме, стадии развития.
Торакоскопия привлекает не только своей диагностической точностью, но и возможностью одновременного устранения свернувшегося гемоторакса. Введение через порты манипуляторов и наконечников УЗ-дезинтегратора или электроотсоса позволяет разделить рыхлые сращения, размельчить сплошную массу свертка крови, аспирировать ее и затем тщательно промыть плевральную полость. Операцию заканчивают типичным дренированием плевральной полости. Однако и торакоскопия не лишена недостатков. Безопасной и эффективной она может быть только при выполнении опытным специалистом. Необходимо иметь соответствующее дорогостоящее оборудование и специальный инструментарий.
Торакоскопия свернувшегося гемоторакса показана в ограниченный промежуток времени: с одной стороны, фибринозные спайки и перемычки в плевральной полости должны быть настолько выражены, что простого дренирования плевральной полости с местным применением протеолитических ферментов, промыванием и аспирацией уже недостаточно, а с другой — еще не должно быть прочного сращения листков плевры, которое делает торакоскопию неэффективной и опасной процедурой.
Таким образом, наиболее информативным и щадящим комплексом диагностики свернувшегося гемоторакса является сочетание диагностической пункции плевральной полости, УЗИ и спиральной компьютерной томографии. УЗИ и компьютерно-томографическое исследование для оценки эффективности лечения в сложных случаях следует выполнять до и после проведения лечебных мероприятий.
Лечение свернувшегося гемоторакса - методы
Главной задачей любого метода лечения свернувшегося гемоторакса является ранняя и полная эвакуация патологического содержимого из плевральной полости. Методы лечения свернувшегося гемоторакса представлены в таблице, из которой следует, что у значительной части пострадавших лечение заключалось только в эвакуации жидкостной фракции путем пункции или дренирования плевральной полости на фоне антибактериальной терапии. Как правило, это были пациенты пожилого и старческого возраста, страдающие тяжелыми сопутствующими заболеваниями, с локальной формой свернувшегося гемоторакса и без явлений дыхательной недостаточности.
В этой группе пострадавших формировался ограниченный фиброторакс в результате организации плотной части свернувшегося гемоторакса.
Следует подчеркнуть, что наиболее трудной для диагностики и лечения была фрагментарная форма свернувшегося гемоторакса, поскольку метод УЗИ для визуализации парамедиастинальной и междолевой локализации свертков крови малоинформативен, равно как и для дренирования этих зон под контролем УЗИ. В такой ситуации методом выбора является диагностическая и лечебная видеоторакоскопия, однако ее применение требовало общего обезболивания с раздельной интубацией бронхов, поэтому даже в ранние сроки се выполнение проблематично при наличии пневмонии и гнойного трахеобронхита. В поздние сроки (через 2-3 нед. после травмы) торакоскопия малоэффективна и опасна из-за наличия плотных легочно-плевральных сращений.
По мере накопления опыта в публикациях последних десятилетий возможности торакоскопического вмешательства стали оценивать более сдержанно. В частности, М. A. Rashid отметил опасность выполнения торакоскопических манипуляций при субплевральной гематоме, которую трудно дифференцировать от свернувшегося гемоторакса. Считается, что наилучшим для проведения эффективной торакосконической эвакуации свернувшегося гемоторакса является период со 2-х по 6-е сутки после ранения, так как позже этого срока образуются плотные сращения, которые препятствуют полной ревизии и эвакуации содержимого [Landcrnan R. L. et al.].
Методы лечения свернувшегося гемоторакса
| Методы лечения | % |
| Пункция и дренирование плевральной полости | 40,5 |
| Введение стрептазы | 16 |
| Торакоскопия | 8,5 |
| Торакотомия, плеврэктомия, декортикация | 21,7 |
| Консервативное ведение | 13,3 |
| Всего | 100% |
Однако следует признать, что срок в 2 сут после ранения является слишком ранним для применения торакоскопии, так как свернувшийся гемоторакс возникает обычно не ранее 4-5-х суток после ранения, а следовательно, в первые 3 сут для эвакуации гемоторакса достаточно дополнительного дренирования плевральной полости или просто смены дренажа.
Массивный свернувшийся гемоторакс (более 1500 см 3 ) является жизненным показанием к операции, независимо от стадии его формирования. Неэффективность или частичная эффективность торакоскопии, местного применения фибринолитических препаратов служат показанием к выполнению в срок от 15 до 20 сут после образования свернувшегося гемоторакса торакотомии, если объем свернувшегося гемоторакса превышает 300-500 см3, а следовательно, отрицательным образом сказывается на функции дыхания и является потенциальной причиной развития эмпиемы плевры.
Для выполнения такого рода операции необходимы большой опыт работы хирурга в торакальном отделении, тщательное выполнение аэростаза и контроль за функционированием плевральных дренажей, подключенных к аспирационной системе.
Если операцию производят в поздние сроки, воспалительно измененную париетальную плевру также необходимо удалять для того, чтобы обеспечить прочное слипание ткани легкого с грудной стенкой и предотвратить развитие осумкованных гнойных полостей. Операция заканчивается санацией плевральной полости и установкой дренажей. Дренирование плевральной полости производится в типичном месте — по заднеподмышечной линии в восьмом межреберье.
При нарушении целости легкого следует установить дополнительный дренаж во втором межреберье по среднеключичной линии. Торакотомную рану ушивают с соблюдением принципов асептики.
Необходимо еще раз подчеркнуть, что торакотомия, декортикация легкого и плеврэктомия (даже частичная) являются чрезвычайно травматичными вмешательствами и по возможности их следует избегать, применяя менее агрессивные методы лечения на ранних этапах.
В последнее десятилетие используем видеоассистированную миниторакотомию, которая сочетает в себе достоинства миниинвазивной технологии и возможности мануального разделения плотных сращений с удалением фибрина в стадии организации [Villavincencio R. Т. et al., Eckerberger F.].
Наш опыт насчитывает 25 наблюдений применения классической торакотомии с декортикацией и плеврэктомией и 16 наблюдений видеоассистированной торакотомии. Умерших не было.
В послеоперационном периоде основное внимание должно быть уделено состоянию плевральной полости. Необходим ежедневный контроль за функционированием дренажей, в первые 3-4 сут — контрольные УЗИ. При необходимости данные УЗИ могут быть дополнены и сопоставлены с результатами рентгенологического исследования.
Анализ результатов применения этих препаратов показал, что наиболее эффективным из них является стрептаза (стрептокиназа) — фибринолитический препарат, который способствует превращению плазминогена в плазмин, разрушающий фибрин, фибриноген и некоторые другие белки плазмы крови. При внутривенной инфузии стреитокиназы фибринолитический эффект наблюдается только в течение нескольких часов, однако удлинение тромбинового времени может сохраняться до 24 ч, вследствие одновременного снижения уровня фибриногена и увеличения количества циркулирующих продуктов деградации фибрина и фибриногена. При введении в плевральную полость влияния препарата на свертывающую систему крови не зафиксировано.
В то же время внутриплевральное введение стрептокиназы нередко приводит к сильной боли в груди и гипертермии. Редкие наблюдения острого респираторного дистресс-синдрома, возникающего при введении препарата, некоторые авторы связывают со специфическим анафилактическим действием продуктов фибринолиза на сосуды малого круга кровообращения [Luterman A. et al., Kexstein M. D. et al., Frye D.D. et al.]. Раннее применение стрептокиназы может привести к вторичному кровотечению в плевральную полость [Godley J. P. et al.]. Оптимальным временем применения химического фибринолиза являются сроки от 4 до 10 сут после образования свернувшегося гемоторакса.
В наших 17 наблюдениях мы использовали следующую методику. Порошок стреитазы (стрептокиназы) в дозе 750 тыс. ЕД растворяли в 50 мл изотонического раствора хлорида натрия, добавляли к нему 50 мл 2 % раствора новокаина и вводили через дренаж плевральной полости, стоящий непосредственно в зоне формирования свернувшегося гемоторакса. Так как от локализации дренажной трубки напрямую зависит эффективность введения препарата, ее положение должно быть четко определено и, если нужно, исправлено под контролем УЗИ или КТ.

Для внутриплеврального тромболизиса необходимо использовать стандартную дренажную трубку диаметром не менее 6 мм, так как трубки малого диаметра (Pigtail) не обеспечат надежной эвакуации содержимого плевральной полости после экспозиции препарата, что чревато всасыванием продуктов деградации сгустков и фибрина с гипертермией и эндотоксикозом.
После введения препарата дренаж мы пережимали с экспозицией от 4 до 9 ч, в зависимости от переносимости этой процедуры. Для лучшего контакта лизирующего раствора с тромботическими массами пациент по возможности должен менять свое положение в постели.
По окончании экспозиции дренаж плевральной полости подключали к системе аспирации с разрежением 20-30 см водн. ст. Как правило, одномоментно выделялось от 300 до 1000 мл геморрагического содержимого, после чего выполняли КТ. Если в плевральной полости оставалось плотное содержимое объемом не более 100-150 см3, тромболизис считали завершенным и через 24-48 ч удаляли дренаж. У подавляющего большинства пациентов введение стрептазы было выполнено однократно.
Несмотря на то что мы применяли достаточно высокую дозировку препарата (750 тыс. ЕД против рекомендуемых В. J. Kimbrell и соавт. 250 тыс. ЕД), мы не наблюдали таких осложнений, как вторичное кровотечение, аллергическая реакция. Показатели коагулологии (MHO, протромбиновое время) были в пределах нормы. Примерно 20 % пациентов имели болевые ощущения, максимальные при введении препарата. При использовании раствора новокаина введение было практически безболезненным. Эффективность метода наблюдалась в 87%.
Наличие у 2 пациентов ушитых ран сердца, у 3 — печени, в том числе с наличием под швами гематом (по данным УЗИ и КТ), у 1 — травматического субарахноидального кровоизлияния и у 4 пострадавших пожилого и старческого возраста — последствий нарушения мозгового кровообращения, хронической почечной недостаточности — мы посчитали противопоказанием к применению этого мощного фибринолитического препарата. Противопоказанием является также наличие гастродуоденального кровотечения язвенного или стрессового генеза, геморрагического цистита, беременности.
Всего из 102 больных со свернувшимся гемотораксом умерли 3 (2,9%): одна больная 71 года — от инфаркта миокарда, одна больная 62 лет — от повторного нарушения мозгового кровообращения и один больной 41 года -от сердечной недостаточности на фоне алкогольной кардиомиопатии. Непосредственной связи со свернувшимся гемотораксом летальные исходы не имели.
Таким образом, нами установлено, что причиной свернувшегося гемоторакса после проникающего ранения груди чаще всего является позднее обращение за медицинской помощью и неполноценное дренирование плевральной полости при гемотораксе.
При рентгенологическом исследовании грудной клетки можно только заподозрить свернувшейся гемоторакс. Его наличие подтверждается пункцией плевральной полости. Ультразвуковой метод, являясь неинвазивным, позволяет подтвердить данные рентгенологического исследования, а также осуществлять динамический контроль за состоянием плевральной полости в процессе лечения. Наиболее полноценную информацию, позволяющую выбрать оптимальную лечебную тактику, дает КТ.
В лечение свернувшегося гемоторакса необходимо использовать различные методы в зависимости от состояния пациента, стадии формирования свернувшегося гемоторакса и его объема. Каждый метод имеет ограниченные показания и не является универсальным.
Наряду с мероприятиями, направленными на ликвидацию свернувшегося гемоторакса, и местным лечением его осложнений, комплексное лечение больных должно включать:
1) антибактериальную терапию с применением антибиотиков «легочно-плеврального» спектра действия, а при возникновении гнойных осложнений — с учетом чувствительности выделенных возбудителей;
2) бронхолитические и муколитические препараты, улучшающие дренажную функцию бронхов;
3) неспецифическую и специфическую иммунную терапию.
Накопленный опыт свидетельствует о существенном улучшении результатов лечения больных со свернувшимся гемотораксом при использовании иммунотропных препаратов. Необходимость включения иммунотерапии в комплекс лечебных мероприятий определяется глубиной, направленностью и продолжительностью нарушений иммунного гомеостаза с учетом стадий развития свернувшегося гемоторакса. На стадии формирования свернувшегося гемоторакса применение иммунотропных препаратов является, по сути, профилактическим и преследует цель ускорения процесса иммунореабилитации после травмы и кровонотери.
Относительное число пострадавших, нуждающихся в эти сроки в применении иммунопрепаратов, возрастает по мере увеличения объема острой кровопотери с 24% (кровопотеря в пределах 1500 мл) до 78% (кровопотеря более 3000 мл). Раньше и интенсивнее под влиянием травмы и операции понижается функциональная активность Т-лимфоцитов, что часто сочетается со снижением фагоцитарной активности нейтрофилов, а в случаях массивной кровопотери — и уровня иммуноглобулинов. Это состояние может сохраняться до 28 сут и способствовать развитию гнойного процесса в полости плевры.
Эффективным в эти сроки является применение тимических препаратов или миелопидов в сочетании с донорским нативным или антистафилококковым иммуноглобулином для внутримышечного введения на фоне инфузионно-трансфузионной терапии, объём и качество которой определяются общим состоянием больного. Тактивин или тимоген вводят подкожно ежедневно в течение 5 дней в дозах 10 мкг, а миелопид — по 3-6 мг внутримышечно или подкожно во второй половине дня. Иммуноглобулин для внутримышечного введения назначают ежедневно по 3 мл в течение 3-5 дней. Наиболее прогностически неблагоприятным иммунологическим признаком в плане развития нагноения является продолжающаяся лимфопения с дефицитом основных популяций и дисбалансом субпоиуляций Т-лимфоцитов на фоне снижения резервного бактерицидного потенциала фагоцитирующих клеток по результатам НСТ-теста.
Отсутствие положительной динамики иммунограммы в течение 2 нед. после травмы или операции у пострадавших, не имеющих признаков нагноения, является показанием к проведению иммунотерапии. Наиболее эффективно применение миелопида, в состав которого входят несколько пептидов, обладающих разнонаправленными биологическими функциями (МП-1 усиливает активность Т-хелперов, МП-3 стимулирует активность фагоцитарного звена). Миелопид применяют подкожно или внутримышечно по 6 мг (2 ампулы) ежедневно в течение 5 сут в комплексе с антибиотиками.
Гемопневмоторакс
Гемопневмоторакс – это одновременное наличие в плевральной полости геморрагического выпота и свободного газа. Гемопневмоторакс проявляется как признаками кровотечения (бледностью кожных покровов, тахикардией, снижением АД), так и симптомами дыхательной недостаточности (поверхностным учащенным дыханием, цианозом, болью в грудной клетке и пр.). С целью выявления гемопневмоторакса проводится рентгенография легких и плевральная пункция. Лечение может быть как условно-консервативным (дренирование плевральной полости), так и активным, хирургическим (торакоскопия или торакотомия с ликвидацией гемопневмоторакса).
Гемопневмоторакс – патологическое состояние, развивающееся при попадании крови и воздуха в плевральную полость вследствие повреждения сосудов, легочной ткани или бронхов. Гемопневмоторакс чаще встречается у мужчин, обычно молодого и среднего возраста. По этиологии гемопневмоторакс делится на спонтанный (встречается крайне редко), травматический и ятрогенный. В свою очередь, травматический гемопневмоторакс может быть с наличием или отсутствием открытой раны в грудную полость. Так же, как изолированный гемоторакс и пневмоторакс, данное состояние в хирургической пульмонологии относится к ургентным и требует экстренного медицинского реагирования.
Причины
Производящие причины различаются в зависимости от условий, в которых развился гемопневмоторакс. Так, спонтанный гемопневмоторакс обычно является следствием разрыва субплеврально расположенных воздушных кист при буллезной болезни легких. Кроме этого, может выявляться разрыв плевральных сращений или легочных артериол.
В основе травматического гемопневмоторакса лежит проникающая или тупая травма грудной клетки, полученная при дорожно-транспортных происшествиях, падении с высоты, колото-резаных и огнестрельных ранениях, избиении, сдавлении грудной клетки и т. п. Такие повреждения часто сопровождаются переломом ребер, ключицы или грудины, ушибом или разрывом легкого, а также ранением межреберных, внутренних грудных и других сосудов. Ятрогенный гемопневмоторакс возникает по вине медицинского персонала, например, при нарушении техники выполнения катетеризации центральных вен, биопсии плевры, торакоцентеза, дренирования плевральной полости.
Симптомы гемопневмоторакса
По объему выделяют малый (скопление крови и воздуха в плевральных синусах), средний (уровень крови и газа доходит до угла лопатки), большой (уровень крови и газа доходит до середины лопатки) и тотальный гемопневмоторакс. Клинические проявления гемопневмоторакса во многом определяются количеством геморрагического экссудата и газа в плевральной полости.
Малый гемопневмоторакс не сопровождается значимыми дыхательными и гемодинамическими нарушениями и активными жалобами. При более массивном патологическом процессе возникают боли в грудной клетке, дыхание становится затрудненным, частым и поверхностным, кожные покровы – бледными. Отмечается снижение артериального давления, частый пульс слабого наполнения. При внезапном кровотечении развивается гиповолемический шок, сопровождающийся слабостью, головокружением, нарушением сознания.
Гемопневмоторакс, вызванный нарушением целостности легочной паренхимы, сопровождается кровохарканьем, подкожной эмфиземой, одышкой, цианозом. В тяжелых случаях может развиться плевропульмональный шок. Резкое смещение сердца и крупных сосудов приводит к нарушению гемодинамики и развитию сердечно-сосудистой недостаточности; полный коллапс легкого – к дыхательной недостаточности и асфиксии.
При гемопневмотораксе с наличием открытой раны в грудную полость возникает синдром кардиопульмональных расстройств, характеризующийся парадоксальным дыханием, «флотированием» средостения, гипоксемией, повышением давления в малом круге кровообращения. В этом случае выражены одышка, тахикардия, артериальная гипотония, боли в груди усиливаются при каждом вдохе. При длительном существовании гемопневмоторакса создаются условия для инфицирования плеврального содержимого и развития эмпиемы плевры.
Характерная клиническая симптоматика в сочетании с физикальными данными и указанием в анамнезе на недавнюю травму грудной клетки либо внутриплевральное вмешательство позволяют торакальному хирургу или травматологу заподозрить гемопневмоторакс уже при первичном осмотре пациента. Пораженная сторона отстает (или совсем не участвует) в акте дыхания; над участком поражения везикулярное дыхание не прослушивается, при перкуссии определяется тупой звук.
Наиболее ценными диагностическими инструментами на этапе первичного выявления гемопневмоторакса служат лучевые методы визуализации (рентгенография и рентгеноскопия легких). Для определения характера жидкости информативно УЗИ плевральной полости. Эти методы позволяют не только обнаружить наличие воздуха и жидкости в плевральной полости, но и оценить их объем. Окончательным подтверждением рентгенологических данных служит получение геморрагического экссудата и воздуха при диагностическом торакоцентезе.

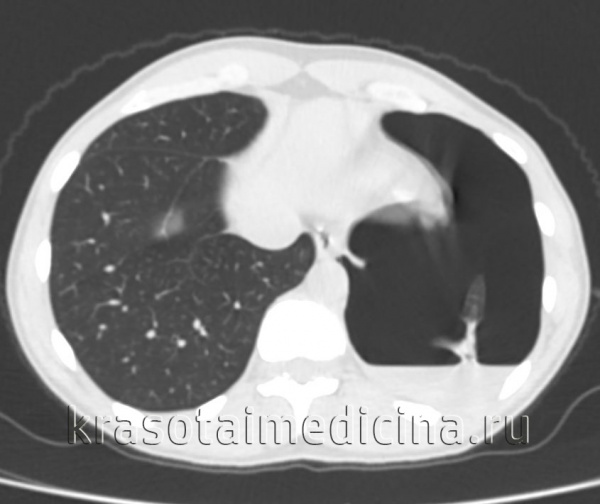
КТ органов грудной клетки. Геморрагическое содержимое в грудной полости слева, воздух в грудной полости слева, поджатое левое легкое
Лечение гемопневмоторакса
Первая помощь может заключаться в ПХО раны, подаче увлажненного кислорода, при необходимости - наложении герметизирующей повязки, введении обезболивающих, и сердечно-сосудистых средств. Современная тактика в отношении гемопневмоторакса предусматривает быстрое удаление крови и газа из полости плевры и достижение расправления легкого. С этой целью прибегают к проведению дренирования плевральной полости с активной аспирацией содержимого через дренаж с помощью электроотсоса. Для растворения кровяных сгустков и фибрина в полость плевры могут вводиться ферментные препараты.
Показанием к торакотомии является ранение легкого, свернувшийся гемоторакс, продолжающееся внутриплевральное кровотечение, неэффективность условно-консервативной тактики. Перевязка или коагуляция кровоточащего сосуда может быть произведена в ходе торакоскопии или плевроскопии. Устранение гемопневмоторакса и расправление легкого в первые 3-5 суток способствуют предупреждению эмпиемы плевры и восстановлению функции легких в полном объеме.
При своевременном оказании необходимого объема медицинской помощи (дренирование, остановка кровотечения, проведении противошоковой терапии и т.д.) прогноз благоприятный. В случаях, когда гемопневмоторакс обусловлен политравмой, исход определяется совокупностью и тяжестью полученных повреждений. Профилактика гемопневмоторакса тесно связана с предупреждением травматизма, обязательным рентгенологическим обследованием больных с травмой грудной клетки и политравмой, устранением источника кровотечения и сброса воздуха в плевральную полость. Чтобы не допустить развитие ятрогенного гемопневмоторакса, необходимо соблюдать технику инвазивных вмешательств на грудной полости.
1. Клинические рекомендации по оказанию медицинской помощи пострадавшим с повреждениями груди в чрезвычайных ситуациях/ Саввин Ю.Н. Краснов С.А., Поярков А.М. – 2015.
2. Оптимизация диагностики и лечения малого и среднего гемоторакса и пневмоторакса у пострадавших с проникающими ранениями и закрытой травмой груди: Автореферат диссертации/ Трефилова Ю.В. – 2006.
3. Результаты лечения больных с травмой груди, осложненной пневмо- или гемотораксом/ Измайлов Е.П., Труханова И.Г.// Врач скорой помощи – 2012 - N12.
Читайте также:
