Дискератоз врожденный. Анемия Фанкони.
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Апластическая анемия - это редкое и серьезное заболевание, характеризующееся неспособностью костного мозга вырабатывать достаточное количество клеток крови. При наличии аплазии костного мозга происходит одновременное снижение количества эритроцитов, лейкоцитов и тромбоцитов.
Следует отметить, что это не онкологическое заболевание, а заболевание костного мозга и клеток крови, характеризующееся недостаточным производством клеток костным мозгом. В определении этого заболевания термин "аплазия" означает неспособность костного мозга - органа, ответственного за производство красных кровяных телец, белых кровяных телец и тромбоцитов для выброса в кровь - адекватно производить кровяные клетки. У большинства пациентов развивается "панцитопения", т.е. все три серии (эритроциты, лейкоциты и тромбоциты) снижены, а костный мозг "пуст": апластическая анемия, таким образом, является синдромом недостаточности костного мозга.
Причины и факторы риска
Три основные причины "пустого костного мозга" следующие:
- прямое повреждение костного мозга: лекарства, такие как химиотерапия, и радиация могут вызвать преходящее, дозозависимое снижение числа клеток, которое восстанавливается спонтанно; у некоторых, с другой стороны, из-за воздействия токсичных молекул (таких как бензол) может развиться ранняя недостаточность костного мозга.
- Конституциональные синдромы: недостаточность костного мозга возникает в результате мутаций - как правило, наследственных - в ДНК половых клеток; к этой группе относятся анемия Фанкони, врожденный дискератоз, болезнь GATA2 и др. Конституциональные синдромы классически возникают в детстве и могут быть связаны с физическими аномалиями.
- Иммуноопосредованная апластическая анемия (почти все случаи спорадической апластической анемии, особенно тяжелой и острой, относятся к иммуноопосредованному типу), т.е. имеет место измененный ответ иммунной системы, приводящий к повреждению костного мозга и, следовательно, к панцитопении.
К факторам, которые могут временно или постоянно повреждать костный мозг и нарушать производство клеток крови, относятся: радиотерапия и химиотерапия, токсичные химические вещества, лекарства, аутоиммунные заболевания, вирусные инфекции, беременность, неизвестные факторы.
Каковы симптомы заболевания?
Апластическую анемию следует подозревать у пациентов с панцитопенией (снижение количества лейкоцитов, эритроцитов и тромбоцитов) и гипоцеллюлярным (т.е. пустым) костным мозгом.
Типичные симптомы включают усталость и легкие кровоподтеки или кровотечения; могут присутствовать инфекции, но обычно нет давней истории болезни. Заболевание может возникнуть внезапно или медленно прогрессировать в течение нескольких недель или месяцев. Хорошо известно распределение по возрасту начала заболевания с пиком в середине-конце детства и пиком в пожилом возрасте: заболевание может развиться в любом возрасте, но чаще встречается у подростков и молодых взрослых (20-25 лет) и у людей старше 50 лет.
Он одинаково влияет на мужчин и женщин. По оценкам, ежегодная заболеваемость апластической анемией составляет около 2 случаев на миллион человек в Европе и Северной Америке, при этом в Восточной Азии заболеваемость в 2-3 раза выше.
Заболевание делится на две формы: приобретенную и присутствующую при рождении (врожденную).
Врожденные формы (20%) обычно являются конечным этапом в развитии генетического заболевания (например, анемии Фанкони или врожденного дискератоза). Приобретенная форма заболевания является наиболее частой и, по оценкам, составляет 80% аплазий костного мозга.
Приобретенная форма может различаться в зависимости от происхождения заболевания:
- идиопатическая аплазия костного мозга (когда причины неизвестны, 80% случаев)
- вторичная медуллярная аплазия (когда причины известны, 20%)
У ~10% пациентов возникновению апластической анемии может предшествовать невирусный гепатит; также сообщалось о редкой ассоциации с эозинофильным фасциитом. За редким исключением, таким как хлорамфеникол, противоэпилептические препараты и возникающая связь с иммунотерапией, бывает трудно установить причинно-следственную связь с лекарствами или токсинами.
Дискератоз врожденный. Анемия Фанкони.
Дискератоз врожденный
Дискератоз врожденный (ДВ) (MIM 305 000, 242 230, 127 550) — редкая форма эпидермальной дисплазии. Встречается почти исключительно у мужчин. Отмечено три типа наследования: аутосомно-рецессивный, связанный с полом рецессивный и аутосомно-доминантньш. Ген ДВ располагается на длинном плече X хромосомы, Xq28. У больных ДВ выявляются также различные иммунные нарушения.
Дети с врожденным дискератозом остаются здоровыми до 5-летнего возраста. В последующие 10 лет у них развиваются эритема, сетчатая гиперпигментация и телеангаэктазии, наиболее выраженные на лице, шее и бедрах, а также оральная или аногенитальная лейкоплакия. Наблюдаются также атрофия кожи с исчезновением ладонной дерматоглифики, дистрофия ногтей, паронихии. Удетей сетчатая серо-коричневая пигментация на шее, бедрах и груди с атрофией и телеангиэктазиями в этих местах придают коже картину пойкилодермии. У взрослых наблюдаются ладонно-подошвенный гиперкератоз, гипергидроз, геморрагические пузыри на слизистой оболочке рта и пойкилодермически измененной коже. Также нередки нарушения со стороны глаз (блефарит, эктропион, катаракта, глаукома, обструкция выходных отверстий слезных протоков), гингивиты, лейкокератоз щек, языка, нёба, раннее выпадение зубов, ранняя алопеция, преждевременная седина. Кроме того, у больных с этим синдромом могут наблюдаться низкорослость и костные нарушения, у 30% — умственная отсталость.
Возможны системные проявления врожденного дискератоза, такие как гематологические заболевания (спленомегалия, тромбоцитопения, апластическая анемия и панмиелофтиз).
На фоне лейкоплакии у больных врожденным дискератозом нередко развивается плоскоклеточный рак. Заболевание также ассоциируется со злокачественньми опухолями ротоглотки, аногенитальной области и желудочно-кишечного тракта, описано развитие аденокарциномы поджелудочной железы, лимфогранулематоза.
При гистологическом исследовании врожденного дискератоза выявляют атрофию эпидермиса, увеличение количества меланина в базальном слое; вдерме — расширение сосудов и появление меланофоров.
Дифференциальный диагноз врожденного дискератоза проводится с синдромом Ротмунда—Томсона, пигментной ксеродермой, ангидротической эктодермальной дисплазией.
Прогноз врожденного дискератоза неблагоприятный из-за развития гематологических заболеваний и рака на фоне лейкоплакии. Причиной летального исхода могут быть инфекции и желудочно-кишечные кровоизлияния.
Лечение опухолей кожи при врожденном дискератозе проводят хирургически или аппликациями мазей с цитостатиками (5% флуороурациловая, 50% проспидиновая и др.); лечение лейкоплакии проводят этретинатом, что снижает частоту ее трансформации в плоскоклеточный рак.
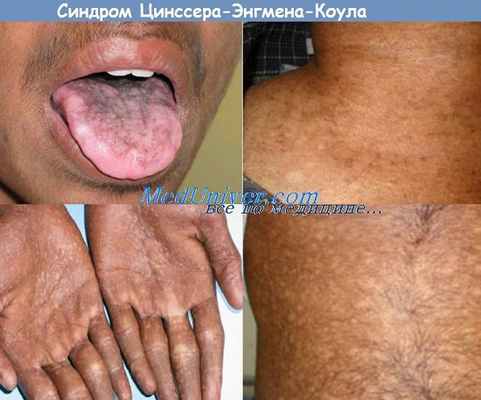
Врожденный дискератоз (ВДК, синдром Циннсера-Энгмана-Коула)
Анемия Фанкони
Анемия Фанкони (АФ) — редкое наследственное заболевание, передающееся по аутосомно-рецессивному типу (MIM 227650). Различают четыре группы АФ, причем ген группы С клонирован и картирован на 9-й хромосоме 9q22.3, а ген группы А экспериментально определен на длинном плече 20-й хромосомы — 20q. Хотя функция белка, закодированного в этом локусе, неизвестна, предполагается, что белок является цитоплазматическим и играет прямую роль в репарации ДНК. В результате наблюдается заметная хромосомная нестабильность, сопровождающаяся повышенной тенденцией к разрыву ДНК перекрестно-связывающими агентами, такими как диэпоксибутан, используемый в диагностическом гесте на АФ.
Анемия Фанкони встречается у детей в возрасте от 4 до 10 лет. Характеризуются аплазией костного мозга и панцитопенией (анемия, нейтроцитопения, тромбоцитопения) в сочетании с рядом соматических и метаболических нарушений: задержкой роста, дефектами формирования скелета (микроцефалия и др.), глаз, ушных раковин, сердца, нервов, мочеполового и желудочно-кишечного трактов, гипогонадизмом, гипоплазией почек или селезенки, аминоацидурией, глюкозурией.
Кожный процесс анемии Фанкони представлен оливковокоричневыми пятнами на нижней части туловища, сгибах конечностей, шее. В пределах этих очагов разбросаны мелкие, депигментированные и гиперпигментированные пятна, придающие коже сетчатый вид. Кроме того, имеются пятна типа «кофе с молоком».
У больных анемией Фанкони отмечается заметная предрасположенность к злокачественным новообразованиям, особенно к острому миелолейкозу, который в 52% случаях развивается в возрасте до 40 лет. Часты и эпителиальные новообразования, в том числе ротоглотки, желудочно-кишечного и мочеполового трактов, кожи, которые развиваются в раннем возрасте.

Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Врожденный дискератоз: клиническое наблюдение Текст научной статьи по специальности «Клиническая медицина»
Аннотация научной статьи по клинической медицине, автор научной работы — Нечаевских В.И., Зинина Е.Е., Попова Н.Б.
Врожденный дискератоз (синдром Цинссера-Энгмана-Коула) относится к группе редких генетических синдромов, реализующихся проявлениями аномалий кожи, слизистых оболочек, костномозговой недостаточностью и склонностью к развитию злокачественных заболеваний. Данная патология встречается крайне редко, до настоящего времени точных данных нет, приблизительно распространенность составляет 1:1 000 000 человек в год, при этом, болеют преимущественно лица мужского пола (в соотношении 3:1). Всего, по данным литературы, описано около 60 пациентов с данной патологией. В статье описан клинический случай врожденного дискератоза у ребенка 5-ти лет, его основные клинические проявления, особенности диагностики и методы лечения.
Похожие темы научных работ по клинической медицине , автор научной работы — Нечаевских В.И., Зинина Е.Е., Попова Н.Б.
Текст научной работы на тему «Врожденный дискератоз: клиническое наблюдение»
ВРОЖДЕННЫЙ ДИСКЕРАТОЗ: КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
врач гематолог первой категории ЦКД гематологии БУ «Сургутская окружная клиническая больница»
врач гематолог высшей категории, руководитель ЦКД гематологии БУ «Сургутская окружная клиническая больница»
врач гематолог ЦКД гематологии БУ «Сургутская окружная клиническая больница»
Врожденный дискератоз (синдром Цинссера-Энгмана-Коула) относится к группе редких генетических синдромов, реализующихся проявлениями аномалий кожи, слизистых оболочек, костномозговой недостаточностью и склонностью к развитию злокачественных заболеваний. Данная патология встречается крайне редко, до настоящего времени точных данных нет, приблизительно распространенность составляет 1:1 000 000 человек в год, при этом, болеют преимущественно лица мужского пола (в соотношении 3:1). Всего, по данным литературы, описано около 60 пациентов с данной патологией.
В статье описан клинический случай врожденного дискератоза у ребенка 5-ти лет, его основные клинические проявления, особенности диагностики и методы лечения.
Ключевые слова: гетерогенное заболевание, дискератоз.
Врожденный дискератоз — генетически гетерогенное заболевание с разными типами наследования. На данный момент известны более 10 генов (ОКС1; RTEL1; TERC; TERT; ЫОРЮ; ЫОЬА1,2,3; WRAP53; ЫНР2; ТЮТ2; ТСАВ1 др.), ответственных за развитие врожденного дизкератоза (ВДК). Все они играют важную роль в поддержании длины теломер, что и является основным звеном механизма развития заболевания.
Один из генов ВДК картирован на Хq28 и получил название «дискерина» DKC1. В настоящий момент доказана роль дискерина в инги-биции апоптоза экспрессирующих его клеток. Так, Филипп Дж. Мейсон и др. показали, что мутации в DKC1 вызывают врожденный диске-ратоз с различной степенью тяжести, при этом у мальчиков развивается классическая триада (сетчатая пигментация кожи, аномальный рост ногтей, лейкоплакия слизистых оболочек) и аплазия костного мозга.
При исследовании больных с врожденным дискератозом Т. УиШату et а1. было установлено, что ген, кодирующий РНК-компонент те-ломеразы TERC, расположенный в 3q, был выбран в качестве гена-кандидата, и обнаружена делеция 3'74 оснований кодирующей области TERC. Укорочение теломеры вызывает хромосомную нестабильность, которая может приводить к гибели клеток и истощению пула ство-
ловых клеток. При этом заболевание, связанное с мутациями TERC, имеет менее тяжелое течение. Так, в исследованиях было показано, что низкая частота мутаций TERC была обнаружена у группы детей с тяжелой апластической анемией и миелодиспластическим синдромом, которые получили трансплантацию костного мозга. Манифестация заболевания происходит в возрасте от 5 до 15 лет, поэтому первым с ним сталкивается педиатр. Симптомы развиваются постепенно, около 85% пациентов в дебюте разворачивают картину апластической анемии. Классическими кожными проявлениями, составляющими триаду симптомов, являются: дистрофические изменения ногтей, характеризующиеся ломкостью, продольной исчерчен-ностью, вплоть до полного исчезновения ногтевой пластины на 5 пальце стопы; сетчатая гиперпигментация кожи с характерной локализацией (лицо, шея, верхняя часть грудной клетки), которая проявляется как мелкими участками гиперпигментации в виде сетчатого рисунка кожи, так и крупными депигментированными участками (4-8 мм) на темном гиперпигментирован-ном фоне; лейкоплакия слизистых оболочек, в большинстве случаев полости рта, особенно среднего отдела языка и неба. Часто возникают поражения глаз (конъюнктивит, блефарит, эк-тропион, катаракта, глаукома). К другим дерматологическим клиническим симптомам можно
Девочка, 5 лет, от возрастных здоровых родителей. Семейный анамнез не отягощен. Ребенок родился от 1 беременности, протекавшей без патологии, роды путем кесарева сечения, весом 4350. Находилась на грудном вскармливании до возраста 3 месяцев.
Поступила с жалобами на синячки на коже, кровоточивость из перфорированной барабанной перепонки, бледность кожных покровов.
Из анамнеза известно, что первые изменения в анализах крови появились в возрасте 3-х лет на фоне ОРВИ: тромбоцитопения до 30 * 10 9 /л, анемия до 110 г/л, увеличение
опыт и инновации №4 2018
MCV до 106 ед. По поводу ОРВИ получала антибактериальную терапию, симптоматическую, жаропонижающие средства. В динамике в ОАК сохранялась тромбоцитопения до 110 — 20*10 9/л. Госпитализирована впервые в гематологическое отделение в 2016 году. При осмотре умеренно выраженный геморрагический синдром на коже. По органам б/о. В ОАК — гемоглобин в пределах нормы, тромбоциты — 56*10 9/л. Им-мунограмма — без патологии. Обмен железа, б/ химические показатели крови — в пределах нормы. ПЦР на ЦМВ, герпес, токсоплазмоз, вирус ЭБВ — отриц. Ревмопробы — отриц. В миело-грамме — недифференцируемые бласты — 4,0%. Костный мозг умеренно клеточный, тип кроветворения нормобластический. Мегакариоци-ты многолопастные без сохранения отшнуров-ки тромбоцитов; генетическое исследование клеток костного мозга — без патологии — 46,ХХ. Выставлен диагноз: иммунная тромбоцитопения среднетяжелой степени. Учитывая наличие геморрагического синдрома проведен курс терапии дексаметазоном в дозе 16 мг четыре дня с положительным эффектом, геморрагический синдром купирован. Далее наблюдалась гематологом амбулаторно. В течении 2-х лет уровень тромбоцитов в пределах 30-40 *10 9 /л.
Ухудшение в январе 2018 года, когда на фоне острого отита появилось кровотечение из перфорированной барабанной перепонки, развился геморрагический синдром на коже. Экстренно госпитализирована в гематологическое отделение. При первичном осмотре в стационаре: физическое развитие соответствует возрасту (Вес 16 кг, Рост 103 см), кожные покровы выраженно бледные, умеренно обильная геморрагическая сыпь на коже рук, ног, передней поверхности грудной клетки по типу экхимозов, петехий. Неяркая гиперпигментация концевых фалаг на верхних конечностях. Обращают на себя внимание койлонихии и явления дистрофии на ногтевых пластинах рук, пойкилодермия (рис. 1-3), лейкоплакия на слизистой оболочке полости рта, слезоточивость обоих глаз, явления блефарита. Нервно-психическое развитие соответствует возрасту. Дыхание везикулярное, хрипов нет. Тоны сердца приглушены, ритм правильный, ЧСС 98 в мин. Живот мягкий, болезненности при пальпации не выявлено. Печень пальпируется по краю реберной дуги, селезенка не пальпируется. Стул и диурез в норме.
В общем анализе крови — гиперхромная анемия среднетяжелой степени, тромбоцито-пения тяжелой степени. Ферритин — 275.4 нг/ мл. Гормоны щитовидной железы в норме. Ревмопробы — отриц. Миелограмма из двух точек: костный мозг в обеих точках скудной клеточности полиморфный. Подсчет произведен ориентировочно. Тип кроветворения нор-мобластический. Эритроидный росток в обеих точках представлен клетками различной степени зрелости, встречаются признаки дизэритро-поэза в виде единичных двуядерных нормоци-тов, макроцитоза на (+), полихроматофилии на (+), единичных нормоцитов с полиморфизмом ядра (форма «восьмерки»). Во 2-й точке имеются фигуры митоза клеток эритропоэза до 0,2%. В просмотренных препаратах обнаружен единственный мегакариоцит с необильной цитоплазмой серо-розового цвета со скудной азурофильной зернистостью и множеством мелких ядер. Свободнолежащие тромбоциты в достаточном количестве. Содержание витамина В 12 и фолиевой кислоты, ретикулоциты — в пределах нормы. Сидеробласты 20%, кольцевидные сидеробласты не найдены. Антитела к вирусным гепатитам — не обнаружены. Проба Кумбса — положительная. Рентгенологические и ультразвуковые исследования без патологии.
Трепанобиопсия подвздошной кости — костномозговые лакуны практически полностью замещены жировой тканью (количество клеток миелопоэза вместе с лимфоидными клетками составляет не более 1-2%, оценить клеточный состав ростков миелопоэза не представляется
возможным). Морфологическая картина наиболее соответствует аплазии костного мозга.
Учитывая клинико-лабораторные данные заподозрен врожденный дизкератоз. Пробы костного мозга и периферической крови были отправлены в ФГБУ НПЦ ДГОИ им. Д. Рога-чева: Цитогенетическое исследование: нет митозов. ПНГ клон не определен.
Определение относительно длины теломер — значительно снижен — 10.8 (контроль 20-39).
ДЭБ тест — отрицательный. Результаты NGS-исследования — обнаружена патогенная мутация в гене ТШР2. Таким образом, поставлен диагноз: врожденный дискератоз (мутация ТШР2).
С целью купирования костномозговой недостаточности ребенку показано проведение аллогенной трансплантации гемопоэтических стволовых клеток. Учитывая отсутствие совместимых родственных доноров, в настоящий момент проводится поиск неродственного донора.
Таким образом, у данной пациентки имеет место тяжелое проявление врожденного дис-кератоза - прогрессирующая костномозговая недостаточность кроветворения, требующая проведения радикальной терапии — трансплантации гемопоэтических стволовых клеток. Однако эффективность данной методики, по данным литературы, не дает полного исцеления: даже при успешном приживлении донорского костного мозга, подавляющее число пациентов умирают от реакции «трансплантат против хозяина» в связи с уже имеющимися изменениями в органах и иммунодефицитом.
1. Ершов, Н.М., Овсянникова, Г.С., Хачатрян, Л.А., Цетлина, В.А., Сунцова, Е.В. и соавт. Врожденный дискератоз: анализ клинических случаев // Педиатрия. Журнал им. Г.Н. Сперанского. — 2014. — Т. 93. — № 6. — С. 90-95.
2. Aalfs, C.M., van den Berg, H., Barth, P.G., Hennekam, R.C. The Hoyeraal-Hreidarsson syndrome: the fourth case of a separate entity with prenatal growth retardation, progressive pancytopenia and cerebellar hypoplasia // Eur J Pediatr. — 1995. — Vol. 154, № 4. - P. 304-308.
4. DKCA1 - dyskeratosis congenita, autosomal dominant 1 [Electronic resource] // OMIM - Online
опыт и инновации №4 2018
7. Drachtman, R.A., Alter B.P. Dyskeratosis congenita: clinical and genetic heterogeneity. Report of a new case and review of the literature // Am J Pediatr Hematol Oncol. - 1992. - Vol. 14, N 4. - P. 297-304.
© Нечаевских В.И., Зинина Е.Е., Попова Н.Б., 2018
АЛКОГОЛЬ КАК ФАКТОР ТЕНДЕРНОГО ГРАДИЕНТА ОЖИДАЕМОМ ПРОДОЛЖИТЕЛЬНОСТИ ЖИЗНИ ГОРОДСКОГО И СЕЛЬСКОГО НАСЕЛЕНИЯ
к.м.н., старший научный сотрудник научно-исследовательской лаборатории УО «Гродненский государственный медицинский университет» МЗ Беларуси, г. Гродно
В Беларуси уровень связанных с алкоголем проблем среди сельского населения существенно выше, чем среди городского населения. Целью настоящего исследования было изучение связи между алкогольными проблемами и разницей ОПЖ (ожидаемая продолжительность жизни) городского и сельского населения Беларуси. В сравнительном аспекте изучена динамика уровня смертности от острого алкогольного отравления (независимая переменная) и динамика разницы ОПЖ городского и сельского населения (зависимая переменная) в период с 1970 по 2015 гг. В рассматриваемый период разница ОПЖ городского и сельского населения выросла для мужчин на 4,4 года (с 0,3 до 4,7 года), а для женщин на 4,1 года (с -1 до 3,1 года). Согласно результатам корреляционного анализа Спирмана уровень смертности от острого алкогольного отравления тесно связан с разницей ОПЖ городских и сельских мужчин (г=0,86; p<0,000), а также с разницей ОПЖ городских и сельских и женщин (г=0,88; p<0,000). Результаты настоящего исследования указывают на алкоголь как один из факторов роста разницы ОПЖ городского и сельского населения Беларуси.
Ключевые слова: ожидаемая продолжительность жизни, алкогольные проблемы, сельское и городское население, Беларусь.
Демографическая ситуация в Беларуси продолжает оставаться сложной. В 1993 г. в Беларуси начался процесс депопуляции, т.е. уменьшения численности населения за счет роста уровня смертности и снижения рождаемости [1]. Современный демографический кризис в особенности затронул сельское население. Анализ демографической ситуации в сельской местности позволяет говорить о «вымирании» деревни [2]. За период с 1960 по 2017 гг. численность сельского населения сократилась в 2,6 раза (с 68,0% до 22,1% от общей численности населения). В период с 1960 по 2016 уровень рождаемости в сельской местности снизился в 1,9 раза
(с 24,3 до 12,7 на 100 тыс. населения), в то время как уровень общей смертности вырос в 3 раза (с 7,2 до 21,6 на 100 тыс. населения). Отставание села от города в социально-демографическом отношении продолжает увеличиваться [1].
В ряде исследований было убедительно показано, что основным виновником вымирания деревни является алкоголь 4. В работах, посвященных изучению особенностей алкоголизации сельского населения был показан высокий уровень связанных с алкоголем проблем среди жителей деревень 7. Причем, с удалением от районных центров возрастает удельный вес лиц, страдающих алкогольной зависимостью, а также растет распространенность
Анемия Фанкони

Анемия Фанкони (АФ), или панцитопения Фанкони, является синдромом нестабильности генома. Это редкое наследственное аутосомно-рецессивное заболевание с вариабельной пенетрантностью и генетической гетерогенностью. АФ была впервые описана в 1927 г. швейцарским педиатром Гвидо Фанкони, который сообщил о 3 братьях с панцитопенией и пороками физического развития. Термин «анемия Фанкони» был предложен Негели в 1931 г. для обозначения комбинации семейной анемии Фанкони и врожденных физических пороков. По настоящее время описано чуть более 2000 случаев АФ. Частота гетерозиготного носительства существенно различается в разных популяциях. Традиционно указывалась цифра 1:300, по последним данным североамериканского регистра, она составляет 1:181, в Израиле — 1:93. Следует заметить, что около 6 % больных не имеют никаких аномалий развития. Некоторые мутации этнически закреплены, в основе их распространения лежит «эффект основателя» — потеря генетической вариабельности в популяциях, основанных малым количеством предков, что свойственно для относительно небольших популяций. Эти мутации встречаются у евреев-ашкенази, испанских цыган, голландцев, выходцев с Канарских островов, у жителей Южной Африки и Кореи. В некоторых из этих популяций частота носительства этнически закрепленных мутаций довольно высока и оценена приблизительно как 1:100. Частота встречаемости тех или иных мутаций в РФ не изучена.
Этиология и патогенез
Нарушение структуры ДНК является результатом воздействия как внутренних (депуринизация, дезаминирование, воздействие эндогенных альдегидов, особенно формальдегида, и активных форм кислорода), так и внешних факторов (ионизирующее и УФ облучение, химические мутагены). При воздействии этих факторов происходят реакции алкилирования, окисления, восстановления, связывания с формальдегидными группами азотистых оснований. В итоге возникают изменения одного или нескольких оснований, вставки и делеции, образование тиминовых димеров, одно- и двухцепочечные разрывы ДНК, образование сшивок между основаниями одной цепи или комплементарными цепями ДНК, между ДНК и белковыми молекулами. Несмотря на это, в целом геном остается свободным от «ошибок», так как клетка имеет механизмы детекции и репарации поврежденной ДНК. Поврежденное основание может быть восстановлено непосредственно его заменой или обратной химической реакцией (direct repair), в других случаях необходимы более сложные процессы, обеспечивающие удаление поврежденного участка ДНК и достраивание правильной последовательности с использованием комплементарной цепи, редко — гомологичной хромосомы. Такая репарация ДНК — сложный многоступенчатый процесс взаимодействия нескольких каскадных путей. Процесс репарации происходит на разных этапах клеточного цикла. При АФ нарушается способность клетки исправлять определенный тип повреждений ДНК — поперечные межхроматидные сшивки (DNA interstrand crosslink), которые препятствуют работе репликационной вилки. Поперечные межхроматидные сшивки формируются как под воздействием продуктов естественного метаболизма клетки (в первую очередь эндогенных альдегидов, но также и активных форм кислорода), так и под воздействием химических веществ, в частности химиотерапевтических препаратов. К такому типу химических веществ относятся алкилирующие соединения, имеющие в своем составе две активные алкильные группы, обеспечивающие им активное связывание с определенными основаниями: цисплатин, митомицин С, азотистый иприт, псорален, диэпоксибутан, мелфалан, циклофосфамид, мустарген, стрептозоцин. Протеины, функция которых нарушается при АФ, задействованы во всех этапах репарации межхроматидной поперечной сшивки. Этот сложный многоступенчатый процесс получил название FA-pathway, а протеины, задействованные в нем, — АФ-протеины. Ключевую роль в этом процессе играет моноубиквитинирование гена FANCD2, который координирует процессы вырезки поврежденных нуклеотидов, прямое достраивание поврежденного участка и гомологичную рекомбинацию. При АФ клетка не способна адекватно исправлять повреждения ДНК, накопление поломок которой может приводить к костномозговой недостаточности, аномалиям физического развития и предрасположенности к развитию опухолей.
Спектр мутаций, которые приводят к АФ:
2) FANCC.
Мутации в гене FANCC встречаются в 10–15 % случаев АФ, почти 90 % случаев представлено двумя мутациями — с.711+4А>Т и delG332. Самая частая мутация в гене FANCC — с. 711+4А>Т, ее выявляют в гомозиготном состоянии в 80 % случаев АФ у евреев-ашкенази. Частота гетерозиготного носительства этой мутации среди евреев-ашкенази достигает 40 %. При этом встречаются и спорадические случаи. Генотип FANCC с.711+4А>Т также распространен среди больных АФ в Японии. В Нидерландах более чем 50 % случаев АФ — это гомозиготные носители мутации с.67delG (также известна как delG332), приводящей к сдвигу рамки считывания в гене FANCC.
3) FANCG.
FANCG задействован в 10 % случаев АФ. Встречаются практически все типы мутаций, за исключением крупных делеций. Клинически характеризуются более частым и быстрым развитием миелодисплазии или лейкоза. Встречаются как спорадические случаи, так и этнически ассоциированный вариант — около 80 % случаев АФ у чернокожих южноафриканцев (Bantu-speakers) (Южная Африка, Свазиленд, Малави и Мозамбик) имеют мутацию 637_643delTACCGCC. Заболевание характеризуется частыми нарушениями пигментации кожи, слабовыраженными аномалиями развития и сравнительно поздними, но тяжелыми гематологическими проявлениями, обусловленными в том числе и поздним обращением к врачу.
Развитие костномозговой недостаточности связывают с повышенным апоптозом гемопоэтических клеток, однако истинные патогенетические механизмы костномозговой недостаточности при АФ мало изучены из-за сложности получения адекватной биологической модели развития заболевания. Последние исследования на ксенографтных моделях и in vitro показали, что в ответ на накопление нерепарированных повреждений ДНК происходит активация р53 проапоптотического пути и запуск поздней р21(Cdkn1a)-зависимой блокировки клеточного цикла в фазе G0/G1 с последующей элиминацией ранних гемопоэтических предшественников из костного мозга. Этот механизм запускается в пренатальном периоде на этапе формирования пула стволовых клеток и ранних клеток-предшественников гемопоэза, что приводит к значительному снижению их количества. Накопление дефектов ДНК после рождения в результате различных физико-химических воздействий усугубляет нарушение гемопоэза. Кроме выраженного апоптоза ранних клеток-предшественников происходит нарушение базовых свойств стволовых кроветворных клеток — способности к самоподдержанию собственной популяции, пролиферации и дифференцировке в различные линии гемопоэза. Генетическая нестабильность при АФ реализуется в повышенной частоте развития ряда опухолей, наиболее частые — ОМЛ и плоскоклеточный рак кожи головы и шеи, слизистых оболочек рта и мочеполового тракта — то есть тканей, характеризующихся высокой пролиферативной активностью.
Клиническая картина
Признаки и симптомы, а также частота их встречаемости указаны в таблице 1.
Таблица 1 | Признаки и симптомы анемии Фанкони
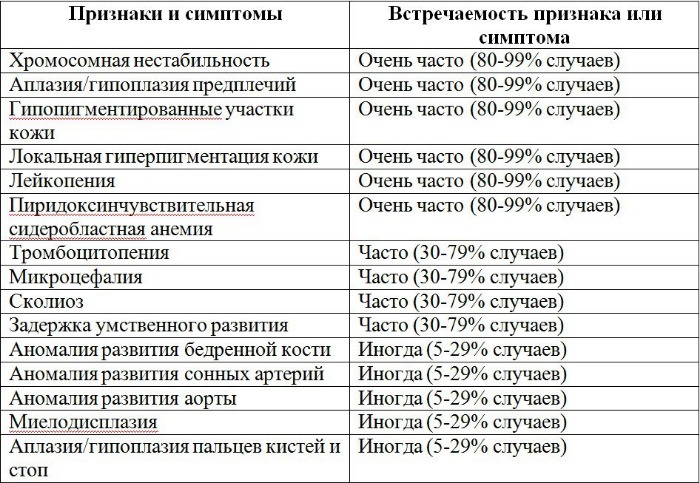
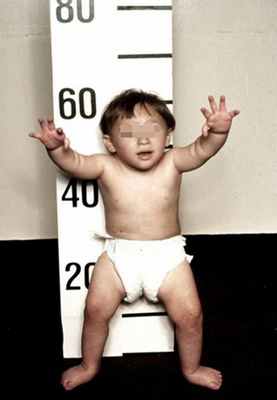
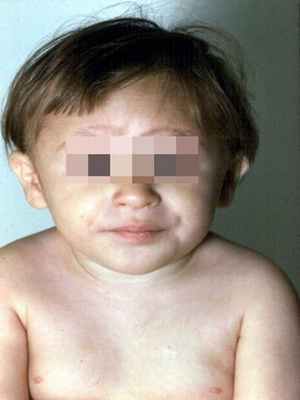
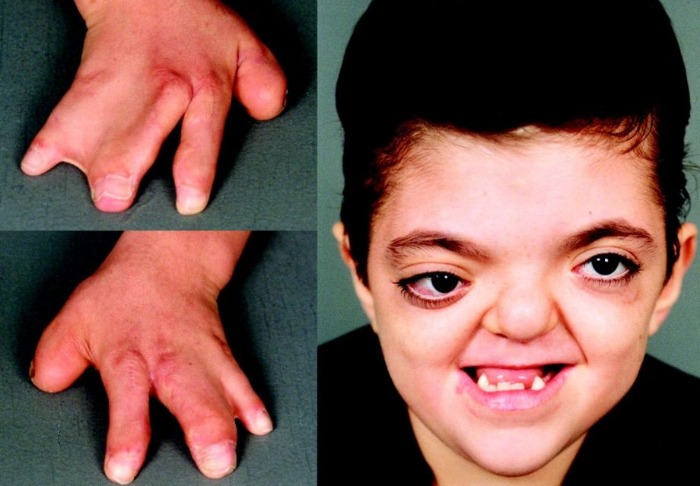
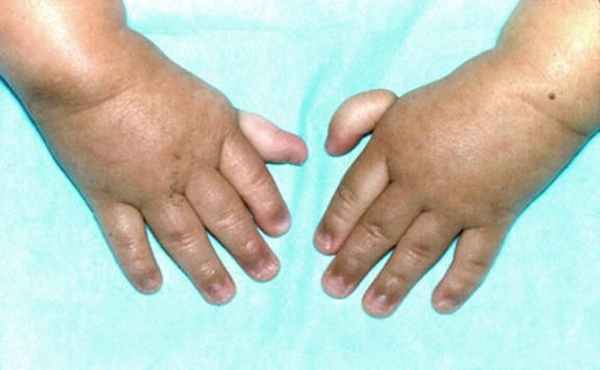
Рисунки 1–5 | Пороки развития, наблюдаемые при анемии Фанкони.
Диагностика
Помимо тщательного физикального осмотра, сбора семейного анамнеза, общего анализа крови и пункции костного мозга для более точной диагностики используются такие методы лабораторной диагностики, как тест на ломкость хромосом, метод MLPA, высокопроизводительное секвенирование и секвенирование по Сэнгеру.
1) Тест на ломкость хромосом.
«Золотым стандартом» скрининга для выявления АФ был и остается тест с диэпоксибутаном (1,3-butadienediepoxide) и его вариант с митомицином С (MMC). Еще в начале изучения АФ было отмечено, что фибробласты и лимфоциты больных АФ в культуре клеток демонстрируют спонтанную повышенную ломкость хромосом. Значительные различия в уровне спонтанных аберраций у больных (вплоть до отсутствия таковых) требовали унифицированного и точного метода детекции. Позже была показана повышенная чувствительность клеток больных АФ к действию алкилирующих агентов, вызывающих поперечные сшивки между нуклеотидами, что препятствует образованию нормальной репликативной вилки для запуска процесса репарации ДНК, позже получивших общее название interstrand cross-link agent. На основании этого был предложен цитогенетический метод диагностики АФ: после обработки лимфоцитов или фибробластов алкилирующим веществом (в нелетальной для клеток концентрации) определяют частоту и спектр спонтанных и индуцированных in vitro хромосомных аберраций. Обычно ставится несколько параллельных клеточных культур, стимулированных фитогемагглютинином лимфоцитов периферической крови: без добавления алкилирующего агента (для определения спонтанного уровня аберраций) и с его добавлением в разной концентрации. Затем в метафазных пластинках подсчитывают число хромосомных разрывов. Для АФ характерны разрывы хромосом с образованием радиальных фигур, фрагментов, хромосомных и хроматидных разрывов, а также три- и тетрарадикалов. При анализе результатов учитывают число разрывов по отношению к числу проанализированных метафаз, процент клеток с разрывами и ряд других показателей. Необходимо отметить, что значения, при которых тест на ломкость хромосом считается положительным, в различных лабораториях варьируются. Тест не имеет 100 % специфичности. Положительный тест на ломкость хромосом бывает у пациентов с синдромом Ниймеген (мутации в гене NBS1), синдромом Робертса (мутации в гене ESCO2), Warsaw breakage syndrome (мутации в гене DDX11), синдромом Блюма (ген BLM), врожденном дискератозе и некоторых других синдромах. В то же время АФ-подобные синдромы могут оказаться действительно АФ с соответствующим генетическим дефектом.
2) Секвенирование по Сэнгеру долгие годы было основным методом определения мутаций при АФ. Учитывая значительные размеры генов, секвенирование каждого из них представляет собой довольно трудоемкий и дорогостоящий процесс. Его обычно проводили после анализа на группу комплементации, предварительно определив вероятный ген. Анализ нуклеотидной последовательности для всех известных АФ-генов затруднен количеством возможных мутаций в каждом, их разнообразием, в том числе в виде крупных инсерций или делеций (indel-мутации). Их длина может варьировать от одного до нескольких сотен и даже тысяч нуклеотидных оснований, что подразумевает использование совершенно разных методов молекулярно-генетического исследования.
3) Метод MLPA (мультиплексная амплификация лигазносвязанных проб) предназначен для определения делеций и амплификаций определенных последовательностей гена длиной до нескольких десятков нуклеотидов. Одновременно может быть исследовано до 60 таких последовательностей, что позволяет выявить как сравнительно небольшие делеции, так и делеции отдельных экзонов и целого гена. Метод MLPA используют для инициального скрининга делеции в гене FANCA, параллельно ген FANCA полностью секвенируют. Если пациент мужского пола, его исследуют на наличие делеций ген FANCB. Выявленные делеции желательно подтвердить другим методом. При этом методы, которые могут быть использованы, требуют индивидуальной разработки в каждом конкретном случае: количественная ПЦР, ПЦР длинных фрагментов (long range PCR) и хромосомный микроматричный анализ.
4) Высокопроизводительное секвенирование.
Метод, который позволяет одномоментно анализировать от нескольких генов до полного генома, является наиболее подходящим для определения мутаций при АФ. Возможны несколько вариантов теста. Первый — секвенирование экзома, позволяет получить максимальный объем информации. Второй — секвенирование ограниченного числа интересующих и уже описанных в литературе генов (таргетное ресеквенирование), список которых можно дополнять или моделировать в соответствии с потребностями исследования. Современные коммерческие панели генов, как правило, помимо генов АФ включают большое число генов, ответственных за развитие других врожденных синдромов, в том числе и АФ-подобных. Внедрение в практику высокопроизводительного секвенирования позволяет избежать последовательного трудоемкого исследования каждого из известных генов методом секвенирования по Сэнгеру, однако пока не позволяет с должной уверенностью выявить крупные делеции и дупликации. Найденные мутации требуют подтверждения одним из других подходящих методов. При обнаружении новых мутаций необходимо подтверждение их патогенности в функциональном тесте и др.
Пренатальная и преимплантационная диагностика должна проводиться в первую очередь в семьях, где ранее были установлены патогенетические мутации. В этом случае проводится целенаправленный поиск известной мутации. Материалом для диагностики служат клетки плода, получаемые путем биопсии ворсин хориона на 10–12 неделе беременности. Следует помнить, что генетический анализ занимает не менее 2–3 недель. Если нет возможности провести молекулярно-генетическое исследование, возможно выполнение теста на ломкость хромосом клеток ворсин хориона на 10–12 неделе беременности либо при амниоцентезе на 15–18 неделе. Однако молекулярно-генетическое исследование предпочтительнее.
Лечение
Основной метод лечения АФ — аллогенная трансплантация гемопоэтических стволовых клеток.
Из медикаментозного лечения в настоящий момент применяют андрогены. Препараты этой группы (оксиметалон, метандростенолон) позволяют достичь гематологического ответа примерно у 50 % больных. Также применение андрогенов значимо увеличивает продолжительность жизни у ответивших на лечение пациентов: медиана продолжительности жизни составляет 9 лет после установления диагноза против 2,5 лет соответственно для тех пациентов, у которых лечение андрогенами не было эффективным.
При возникновении сопутствующих заболеваний, например, инфекций, обосновано применение гранулоцитарного колониестимулирующего фактора, который способен временно увеличить количество нейтрофилов и облегчить протекание заболевания.
В 2015 году коллективу ученых удалось успешно применить технологию Crispr/Cas9 для редактирования мутации с.67delG гена FANCC.
Врожденный дискератоз

Медицинский эксперт по заболеванию
Проф. Полина СтепенскиРуководитель отделения ТКМ и иммунотерапии у детей и взрослых клиники «Хадасса»
Стаж: более 24 лет
Запись на прием
Ведущий трансплантолог клиники «Хадасса» профессор Полина Степенски является одним из наиболее известных израильских специалистов, успешно занимающихся лечением врожденного дискератоза с помощью трансплантации костного мозга. Под руководством проф. Степнски отделение ТКМ добилось огромных успехов и признания европейских и американских коллег.
Десятки детей из разных стран мира обязаны проф. Степенски жизнью и здоровьем.
Общие сведения, что такое врожденный дискератоз
Одной из крайне редких генетических патологий является врожденный (конгенитальный) дискератоз, который проявляется недостаточностью костного мозга и отличается триадой патологических изменений: ониходистрофией, лейкоплакией, пойкилодермией. Врожденный дискератоз характеризуется повышенной склонностью к развитию апластической анемии и злокачественных процессов. Заболевание в основном передается по Х-сцепленному типу, но может наследоваться аутосомно-рецессивным или аутосомно-доминантным путем. Определяют врожденный дискератоз с помощью цитогенетических исследований (кариотипирования) и сопоставления ряда специфических симптомов. Терапия направлена на восстановление костного мозга посредством трансплантации донорских стволовых клеток.
Впервые врожденный (конгенитальный) дискератоз был описан в 1910 году немецким врачом-дерматологом Цинссером. Спустя более 20 лет описание редкой генетической болезни было дополнено американскими исследователями Коулом и Энгманом, после чего патология получила второе название — синдром Цинссера-Энгмана-Коула. Позже были выявлены другие симптомы, кроме дерматологических проявлений, и врожденный дискератоз определили мультисистемным заболеванием. Точная распространенность конгенитального дискератоза не установлена. Приблизительная заболеваемость составляет 1 случай на 1 млн. населения в год. При этом мужчины болеют чаще, чем женщины (3:1).
Первые клинические проявления врожденного дискератоза обнаруживаются у детей от 4-5 до 15-16 лет и постепенно нарастают. Симптоматика болезни приобретает выраженный характер после 25 лет и старше. К летальному исходу могут привести осложнения конгенитального дискератоза: внутренние кровотечения, частые инфекции, злокачественные процессы.
Врожденному (конгенитальному) дискератозу по МКБ-10 присвоен код L90.8.
Чтобы получить более подробную информацию или консультацию специалиста по орфанным заболеваниям, заполните все поля формы. Наши консультанты будут рады Вам помочь.
Причины
Один из спасенных проф. Полиной Степенски детей с врожденным дискератозом — Никита Селин (пересадка сделана в октябре 2017 г.) Однозначная причина возникновения врожденного дискератоза не известна. По мнению генетиков, существует более 10 генов, ответственных за развитие болезни. Среди них ген дискерин DKCI, который картирован на Xq28. Доказано, что мутация гена DKCI вызывает врожденный (конгенитальный) дискератоз различной степени тяжести вследствие индукции запрограммированной гибели экспрессирующих клеток дискерина. Также было установлено, что в механизме развития конгенитального дискератоза участвует ген TERC, локализованный в 3q и кодирующий РНК-компонент теломеразы TERC. Аберрация гена TERC приводит к укорочению концевых участков линейной молекулы ДНК и хромосомной нестабильности, что вызывает истощение пула стволовых клеток. Кроме того, развитие патологического процесса может быть обусловлено аномалиями митоза и разрывами хроматид в локусах 2q33 и 8q22.
В 75-80 % случаев врожденный (конгенитальный) дискератоз передается по X-сцепленному рецессивному типу наследования, когда дефектные гены расположены на Х-хромосоме и проявляются только в гомо- и гетерозиготном состоянии. Поэтому болезнь чаще поражает представителей мужского пола. Около 20-25 % случаев врожденного дискератоза наследуются по аутосомно-доминантному механизму и редко по аутосомно-рецессивному типу.
Симптомы
Первые симптомы врожденного дискератоза могут проявляться в разные периоды жизни, например, у детей дошкольного возраста и у подростков 15-16 лет. В некоторых случаях манифестация клинической картины происходит после 20-25 лет. У грудных детей врожденный дискератоз протекает скрыто. С годами симптоматика усугубляется, развиваются осложнения.
Первый признак конгенитального дискератоза — дистрофические изменения ногтевых пластинок на пальцах ступней и рук. Ногти становятся ломкими, на них возникают борозды и углубления, как при грибковом поражении. С возрастом дистрофия прогрессирует, и некоторые ногтевые пластины полностью исчезают, чаще всего на мизинцах стоп. Также к первым проявлениям болезни можно отнести рецидивирующие носовые кровотечения.
К патологическим изменениям ногтей при врожденном дискератозе спустя два-три года присоединяется возникновение пигментных образований (от 0,2 до 0,9 мм диаметром) в области шеи и лица, а также на верхней части грудной клетки. Со временем пораженная кожа атрофируется и темнеет, на ней возникают сосудистые звездочки. Конгенитальный дискератоз может сопровождаться повышенным потоотделением, огрубением и сухостью кожи ладоней и стоп, прогрессирующим выпадением волос, гипотрихозом ресниц и синюшностью кожных покровов. У трети пациентов наблюдается слабоумие.
В старшем возрасте при конгенитальном дискератозе отмечаются поражения слизистых оболочек рта: эрозии, папулы, воспаление десен, что приводит к выпадению зубов. Также лейкоплакия со временем поражает слизистые оболочки других органов. Нередко у пациентов с врожденным дискератозом выявляют болезни глаз, в том числе: катаракту, глаукому, блефарит, конъюнктивит.
Практически у каждого второго ребенка с врожденным дискератозом до 10 лет выявляется апластическая анемия, нередко расцениваемая педиатрами как анемия Фанкони. Кроме того, у детей обнаруживается иммунодефицит, который сопровождается частыми инфекционными заболеваниями. Прогрессирующий иммунодефицит осложняется гипоплазией мозжечка, развитием фиброза легких и печени, злокачественной опухолью.
Чтобы получить более подробную информацию или консультацию специалиста по орфанным заболеваниям, заполните все поля формы. Наши консультанты будут рады Вам помочь.
Диагностика врожденного дискератоза
Для точной постановки диагноза — врожденный дискератоз, врачи учитывают совокупность симптомов, изучают историю болезни пациента и семейный анамнез, проводят физикальный осмотр и назначают комплексное обследование, которое включает следующие методы:
- Общеклинический анализ крови на повышение СОЭ, уровень нейтрофилов, лейкоцитоз, концентрацию HbF, другие показатели.
- Гистологическое исследование пораженных участков кожи, позволяющее обнаружить гиперкератоз, атрофию эпидермиса и т.д.
- Цитогенетические тесты, направленные на выявление хромосомных аномалий.
- УЗИ брюшной полости, КТ, МРТ внутренних органов.
- Стернальная пункция костного мозга для оценки состояния костномозгового кроветворения.
Врожденный дискератоз дифференцируют с анемией Фанкони, множеством кожных заболеваний, в том числе с лентикулярным меланозом, пойкилодермией,механобуллезной болезнью, синдромом Weech и др.
Лечение врожденного дискератоза
Лечение при врожденном дискератозе направлена на устранение симптомов и предотвращение осложнений. Для этого врачи применяют анаболические гормональные средства, гемопоэтины, ретиноиды, препараты колониестимулирующих факторов, а также с заместительной целью проводят трансфузии тромбоконцентрата и эритроцитарной массы. Однако данные методы при конгенитальном дискератозе на сегодняшний день малоперспективны. В единичных случаях улучшения кроветворения удается добиться с помощью андрогенов.
Для купирования костномозговой недостаточности при конгенитальном дискератозе требуется радикальный подход — аллогенная трансплантация гемопоэтических стволовых клеток от совместимых родственных доноров. Но даже после пересадки костного мозга у многих пациентов возникает реакция «трансплантат против хозяина» (РТПХ), при которой донорские лимфоциты атакуют клетки и ткани реципиента. Кроме РТПХ, осложнением трансплантации гемопоэтических стволовых клеток может быть веноокклюзионная болезнь почек, печени и легких.
Прогноз и профилактика
Не существует профилактических мер для генетически обусловленного, конгенитального дискератоза. Семейным парам с наличием хромосомных аномалий специалисты рекомендуют в период планирования беременности проконсультироваться у генетика. Прогноз врожденного (конгенитального) дискератоза не благоприятный. Практически в каждом случае пациенты погибают от развившихся осложнений: рецидивирующих инфекций, внутренних кровотечений в ЖКТ и других органах. Также летальный исход неизбежен от злокачественных поражений: рака мочеполовых органов, ЖКТ, ротовой полости, в редких случаях от Ходжкинской лимфомы и аденокарциномы поджелудочной железы. Даже после успешного приживления донорского костного мозга при конгенитальном дискератозе, не складывается благоприятная прогностическая картина на фоне иммунодефицита и уже имеющихся патологических изменений.
Если вам необходима консультация специалиста по орфанным заболеваниям, заполнив все поля формы, и наши консультанты будут рады Вам помочь.
Читайте также:
