ЭхоКГ митральной недостаточности при ГКМП
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
В статье представлен клинический случай развития обструктивной гипертрофической кардиомиопатии трансплантированного сердца у мужчины 66 лет в течение 5 лет после ортотопической трансплантации сердца, обсуждаются особенности данного заболевания, в результате которых это стало возможным.
Ключевые слова
Для цитирования:
For citation:
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное заболевание миокарда, характеризующееся гипертрофией левого желудочка (ЛЖ) (ГЛЖ) (>1,5 см) и/или правого желудочка, чаще асимметрического характера за счёт утолщения межжелудочковой перегородки (МЖП), что не может объясняться исключительно повышением нагрузки давлением, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с ГЛЖ [1]. Несмотря на хорошую осведомлённость кардиологов об этой форме кардиомиопатии, она продолжает преподносить немало сюрпризов. Мы представляем случай развития классического фенотипа ГКМП с клинической симптоматикой, обусловленной латентной обструкцией выходного тракта ЛЖ (ВТЛЖ), у пациента 66 лет спустя 5 лет после ортотопической трансплантации сердца (ОТС).
Пациенту Н. в возрасте 61 года 19.04.2015 выполнена ОТС по поводу терминальной стадии ишемической кардиомиопатии. На момент ОТС пациент страдал гипертонической болезнью 1 степени с хорошим контролем артериального давления. Донором была 43-летняя женщина, эхокардиографическое (ЭхоКГ) исследование патологии донорского сердца не выявило. Посттрансплантационная иммуносупрессия состояла из такролимуса 3,0 мг/сут. с поддержанием целевого уровня в крови 5-10 нг/мл, микофенолата мофетила 2000 мг/сут. и метилпреднизона 4 мг/сут.
Наблюдение за пациентом проводилось в соответствии с клиническими рекомендациями по ведению пациентов, перенесших трансплантацию сердца [2]. Трансторакальное ЭхоКГ выполнялось на аппаратах Acuson Simens SC 2000 и PHILIPS IE 33 согласно стандартному протоколу.
После ОТС состояние пациента было удовлетворительным. Спустя год после ОТС пациента начали беспокоить головокружения при переходе в ортостаз, одышка при подъёме на третий этаж, быстрая утомляемость. Толерантность к физическим нагрузкам постепенно снижалась. С 2019г пациент жаловался на нарушение зрения, головокружение и желание лечь после перехода в вертикальное положение или через несколько шагов после вставания, одышку при ходьбе через 50-100 м. В 2020г пациент периодически отмечал отёки стоп и нижних третей голеней, удушье после перехода в горизонтальное положение, одышка возникала при ходьбе через 50 м, сохранялись симптомы ортостатической интолерантности.
При физикальном обследовании в январе 2021г выявлены избыточная масса тела с индексом массы тела 29 кг/м 2 (рост 170 см, вес 86 кг), малоинтенсивный систолический шум в точке Боткина. Активная ортостатическая проба была в норме, дистанция шестиминутной ходьбы составила 180 м.
Электрокардиограмма у пациента после ОТС была без отклонений, с января 2021г регистрировалась преходящая атриовентрикулярная блокада 1 степени (PQ 200-240 мс).
Таблица 1
Параметры ЭхоКГ пациента Н. в период 2015-2021гг

Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ФВ — фракция выброса.
Таблица 2
Показатели диастолической функции пациента Н. в период 2015-2021гг

Сокращения: МК — митральный клапан, пик А — пик позднего диастолического наполнения, пик Е — пик раннего диастолического наполнения, пик Em — ранняя диастолическая скорость движения кольца митрального клапана, DT — время замедления пика раннего диастолического наполнения, Е/Еm — соотношение
пиков раннего диастолического наполнения к ранне-диастолическому смещению тканей боковой части митрального кольца, IVRT — время изволюметрического
расслабления.
Таблица 3
Параметры трансторакальной ЭхоКГ у пациента Н. в январе 2021г

Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, МК — митральный клапан, ФВ — фракция выброса.
По данным коронароангиографии, включая исследование в январе 2021г, гемодинамически значимых препятствий кровотоку в коронарных артериях не было выявлено. Эндомиокардиальные биопсии проводились в соответствии с установленным протоколом. У пациента наблюдался один эпизод острого клеточного отторжения степенью 2R в мае 2015г, купированный внутривенной пульс-терапией кортикостероидами. Гистологические и иммуногистохимические признаки отторжения отсутствовали. Последняя эндомиокардиальная биопсия была выполнена в июле 2016г. Результаты эндомиокардиальных биопсий были пересмотрены в январе 2021г, однако признаков, характерных для ГКМП, в имеющихся образцах ткани из области верхушки правого желудочка не было выявлено.
Таким образом, у пациента в течение 5 лет после трансплантации сердца развилась асимметрическая ГЛЖ, преимущественно за счёт базального отдела МЖП, сопровождающаяся возникновением обструкции на уровне ВТЛЖ и обратимой митральной недостаточности при физических нагрузках, провокационных пробах. Пациенту выставлен диагноз асимметрической формы ГКМП донорского сердца с латентной обструкцией ВТЛЖ.
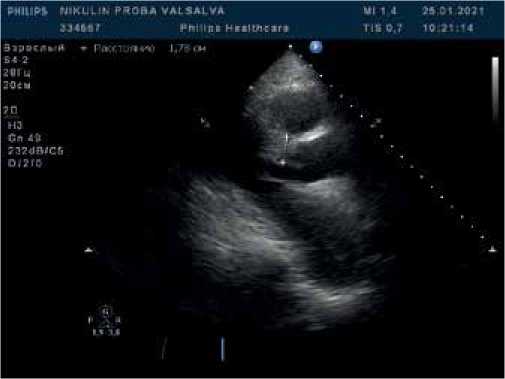
Рис. 1. В-режим. Парастернальная позиция по длинной оси ЛЖ. Асимметричная гипертрофия миокарда ЛЖ с утолщением миокарда в базальном сегменте.
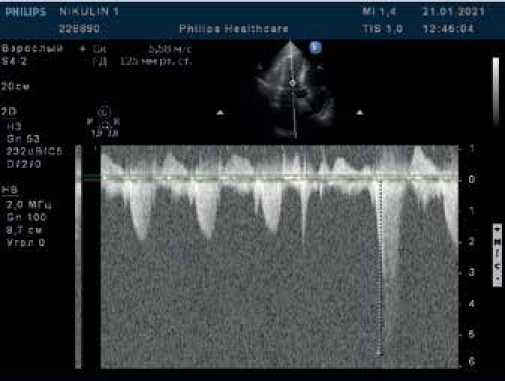
Рис. 2. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ в постоянно-волновом доплеровском режиме (CW-допплер): в покое обструкция отсутствует, во время экстрасистолы повышение градиента давления до 125 мм рт.ст.
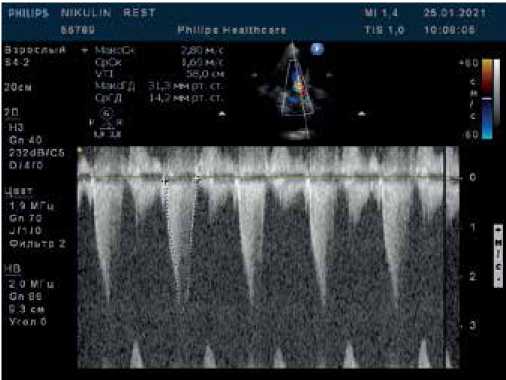
Рис. 3. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ при поведении пробы Вальсальвы. Прирост систолического градиента, максимальный систолический градиент 82,8 мм рт.ст.
ГКМП считается наиболее распространенным наследственным сердечно-сосудистым заболеванием (рис. 4) [5][6]. Она характеризующееся гипертрофией преимущественно ЛЖ с отсутствием дилатации камер сердца без признаков другой кардиальной патологии или системных заболеваний, ответственных за развитие гипертрофии. Имеющаяся у нашего пациента артериальная гипертония первой степени хорошо контролировалась гипотензивной терапией и не могла объяснить развитие ГЛЖ. Также у нашего пациента в анамнезе отсутствовали заболевания, которые могли бы вызвать развитие ГЛЖ как часть синдрома.
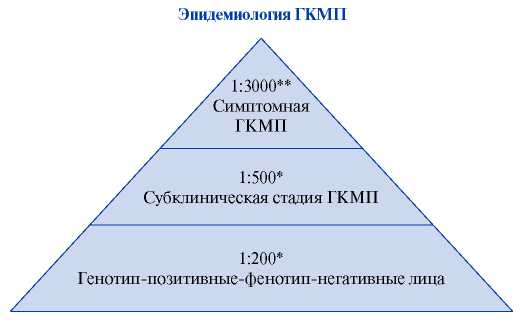
Рис. 4. Распространённость ГКМП в общей популяции взрослых людей.
Примечание: * — 1:200 взрослых людей — минимальная распространённость мутантных генов саркомера в общей популяции, 1:500 взрослых людей — распространённость необъяснимой ГЛЖ как главного фенотипического проявления ГКМП, определяемая ЭхоКГ [3]. ** — 1:3000 — распространённость симптомной ГКМП у взрослых в США [4].
Сокращения: ГКМП — гипертрофическая кардиомиопатия, ГЛЖ — гипертрофия левого желудочка, ЭхоКГ — эхокардиография.
Известно, что приём такролимуса может быть причиной ГЛЖ у детей и взрослых. У детей симметричная ГЛЖ развивалась в сроки от 2-3 мес. до четырёх лет после начала приёма такролимуса по поводу трансплантации печени и/или кишечника, почки 8. ГКМП у взрослых реципиентов, получающих такролимус, посвящены описания отдельных случаев и специально спланированные исследования 12. Как у детей, так и у взрослых ГКМП вследствие приёма такролимуса отличали симметрический характер ГЛЖ, как правило без обструкции ВТЛЖ, и её обратимость после отмены такролимуса. У нашего же пациента имелся морфологически иной тип гипертрофии донорского сердца.
За время наблюдения у нашего пациента развился “классический фенотип” ГКМП донорского сердца с симптомами, обусловленными латентной обструкцией ВТЛЖ. Электрокардиография после ОТС длительное время была без патологии, что наблюдается у 5-25% пациентов с ГКМП. Асимметрическая ГЛЖ с небольшим утолщением стенок и более выраженной гипертрофией единичных сегментов, как в нашем случае, встречается у 1/3 пациентов с ГКМП [16]. Латентный характер обструкции ВТЛЖ в покое у симптомных пациентов с ГКМП продемонстрирован не только в течение нескольких дней между ЭхоКГ исследованиями, но и в течение нескольких минут во время катетеризации сердца 19. По данным исследования Geske JB, et al. (2011), вариабельность спонтанного градиента в ВТЛЖ составила 49,0±53,1 мм рт.ст. в диапазоне от 0 до 210,8 мм рт.ст., а вариабельность градиента в ВТЛЖ после желудочковых экстрасистол значительно коррелировала с вариабельностью градиента ВТЛЖ в покое [19].
На момент проведения ОТС ЭхоКГ донорского сердца не выявила его структурной патологии, что можно объяснить особенностями фенотипических проявлений при ГКМП. В настоящее время определены более тысячи мутаций примерно в 30 генах, ответственных за развитие ГКМП [20]. Большинство форм ГКМП наследуются по аутосомно-доминантному типу, но также описаны митохондриальные и аутосомно-рецессивные паттерны 21. Следствием выраженной генетической гетерогенности является клиническая гетерогенность ГКМП с широким спектром проявлений от носительства мутантных генов (генотип-позитивные-фенотип-негативные лица), бессимптомной ГЛЖ до клинических синдромов сердечной недостаточности, аритмий и внезапной смерти. Например, проспективное исследование Maron BJ, et al. (2001) продемонстрировало разнообразие фенотипических проявлений ГКМП у лиц с мутацией миозин-связывающего протеина С (MYBCP), а также возможность манифестации заболевания в среднем возрасте [24]. Неполная пенетрантность заболевания с отсутствием ГЛЖ во взрослом возрасте наиболее характерна для мутаций гена MYBCP, гена тяжёлых цепей миозина (MYN7) и гена тропонина Т 25. В медицинской литературе уже описан случай, когда, несмотря на адекватный скрининг донора, у женщины 66 лет спустя 19 лет после трансплантации сердца развилась идиопатическая ГКМП со средне-желудочковой обструкцией [27]. В то же время, несмотря на типичную клинико-морфологическую картину обструктивной ГКМП в нашем случае, нельзя полностью исключить влияние такролимуса, хотя в литературе до настоящего времени не описано развитие асимметрической гипертрофии при его применении. Запланирован перевод пациента на эверолимус.
Заключение
Данный клинический случай демонстрирует постепенное развитие асимметрической ГКМП донорского сердца с латентной обструкцией ВТЛЖ в течение 5 лет после трансплантации.
С учётом высокой распространённости в общей популяции мутантных генов, ответственных за развитие ГКМП, неполной пенетрантности и наличия догипертрофической стадии ГКМП, необходимо быть готовым встретиться с этой патологией у реципиентов сердечного трансплантата.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Габрусенко С.А., Гудкова А.Я., Козиолова Н.А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
3. Semsarian C, Ingles J, Maron MS, Maron BJ. New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol. 2015;65(12):1249-54. doi:10.1016/j.jacc.2015.01.019.
4. Maron MS, Hellawell JL, Lucove JC, et al. Occurrence of clinically diagnosed hypertrophic cardiomyopathy in the United States. Am J Cardiol. 2016;117:1651-4. doi:10.1016/j.amjcard.2016.02.044.
5. Martinez HR, Beasley GS, Miller N, et al. Clinical insights into heritable cardiomyopathies. Front Genet. 2021;12:663450. doi:10.3389/fgene.2021.663450.
6. Maron BJ, Rowin EJ, Maron MS. Global Burden of Hypertrophic Cardiomyopathy. JACC Heart Fail. 2018;6(5):376-8. doi:10.1016/j.jchf.2018.03.004.
7. Atkison P, Joubert G, Barron A, et al. Hypertrophic cardiomyopathy associated with tacrolimus in paediatric transplant patients. Lancet. 1995;345(8954):894-6. doi:10.1016/s0140-6736(95)90011-x.
8. Turska-Kmieć A, Jankowska I, Pawłowska J, et al. Reversal of tacrolimus-related hypertrophic cardiomyopathy after conversion to rapamycin in a pediatric liver transplant recipient. Pediatr Transplant. 2007;11(3):319-23. doi:10.1111/j.1399-3046.2006.00633.x.
9. Jarzembowski TM, John E, Panaro F, et al. Reversal of tacrolimus-related hypertrophic obstructive cardiomyopathy 5 years after kidney transplant in a 6-year-old recipient. Pediatr Transplant. 2005;9(1):117-21. doi:10.1111/j.1399-3046.2005.00260.x.
10. Pappas PA, Weppler D, Pinna AD, et al. Sirolimus in pediatric gastrointestinal transplantation: the use of sirolimus for pediatric transplant patients with tacrolimus-related cardiomyopathy. Pediatr Transplant. 2000;4(1):45-9. doi:10.1034/j.1399-3046.2000.00083.x.
11. Dehghani SM, Haghighat M, Imanieh MH, et al. Tacrolimus related hypertrophic cardiomyopathy in liver transplant recipients. Arch Iran Med. 2010;13(2):116-9.
12. Coley KC, Verrico MM, McNamara DM, et al. Lack of tacrolimus-induced cardiomyopathy. Ann Pharmacother. 2001;35(9):985-9. doi:10.1345/aph.10299.
13. Seino Y, Hori M, Sonoda T. Multicenter prospective investigation on cardiovascular adverse effects of tacrolimus in kidney transplantations. Cardiovasc Drugs Ther. 2003;17(2):141-9. doi:10.1023/a:1025339819051.
14. Liu T, Gao Y, Gao YL, et al. Tacrolimus-related hypertrophic cardiomyopathy in an adult cardiac transplant patient. Chin Med J (Engl). 2012;125(7):1352-4. doi:10.3760/cma.j.issn.0366-6999.2012.07.030.
15. Kushwaha SS, Raichlin E, Sheinin Y, et al. Sirolimus affects cardiomyocytes to reduce left ventricular mass in heart transplant recipients. Eur Heart J. 2008;29(22):2742-50. doi:10.1093/eurheartj/ehn407.
17. Kizilbash AM, Heinle SK, Grayburn PA. Spontaneous variability of left ventricular outflow tract gradient in hypertrophic obstructive cardiomyopathy. Circulation. 1998;97:461-6. doi:10.1161/01.cir.97.5.461.
18. Geske JB, Sorajja P, Ommen SR, Nishimura RA. Left ventricular outflow tract gradient variability in hypertrophic cardiomyopathy. Clin Cardiol. 2009;32:397-402. doi:10.1002/clc.20594.
19. Geske JB, Sorajja P, Ommen SR, Nishimura RA. Variability of left ventricular outflow tract gradient during cardiac catheterization in patients with hypertrophic cardiomyopathy. JACC Cardiovasc Interv. 2011;4(6):704-9. doi:10.1016/j.jcin.2011.02.014.
20. Roma-Rodrigues C, Fernandes AR. Genetics of hypertrophic cardiomyopathy: advances and pitfalls in molecular diagnosis and therapy. Appl Clin Genet. 2014;7:195-208. doi:10.2147/TACG.S49126.
21. Jarcho JA, McKenna W, Pare JA, et al. Mapping a gene for familial hypertrophic cardiomyopathy to chromosome 14q1. N Engl J Med. 1989;321(20):1372-8. doi:10.1056/NEJM198911163212005.
22. Konno T, Chang S, Seidman JG, Seidman CE. Genetics of hypertrophic cardiomyopathy. Curr Opin Cardiol. 2010;25(3):205-9. doi:10.1097/HCO.0b013e3283375698.
23. Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124:e783-831. doi:10.1161/CIR.0b013e318223e2bd.
25. Maass A, Konhilas JP, Stauffer BL, Leinwand LA. From sarcomeric mutations to heart disease: understanding familial hypertrophic cardiomyopathy. Cold Spring Harb Symp Quant Biol. 2002;67:409-15. doi:10.1101/sqb.2002.67.409.
26. Moolman JC, Corfield VA, Posen B, et al. Sudden death due to troponin T mutations. J Am Coll Cardiol. 1997;29(3):549-55. doi:10.1016/s0735-1097(96)00530-x.
27. Abbasi SA, Cheezum MK, Ghosh N, et al. Multimodality imaging of hypertrophic cardiomyopathy in a transplanted heart. Circulation. 2014;130(12):1010-3. doi:10.1161/CIRCULATIONAHA.114.01080
Об авторах
Головина Галина Алексеевна — кандидат медицинских наук, врач кардиолог кардиологического отделения № 3
Конфликт интересов не заявляется.
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Ставенчук Татьяна Владимировна — кандидат медицинских наук, врач отделения функциональной диагностики, ассистент кафедры терапии № 1 ФПК и ППС
Конфликт интересов не заявляется.
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Кижватова Наталья Владимировна — кандидат медицинских наук, зав. кардиологическим отделением № 3, доцент кафедры терапии № 1 ФПК и ППС
Конфликт интересов не заявляется.
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Космачёва Елена Дмитриевна — доктор медицинских наук, зам. главного врача по лечебной работе, зав. кафедрой терапии № 1 ФПК и ППС, главный кардиолог Южного федерального округа, главный кардиолог Краснодарского края
Конфликт интересов не заявляется.
Дополнительные файлы
Рецензия
Для цитирования:
For citation:
Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Г. А. Головина
ГБУЗ НИИ — ККБ № 1 им. проф. С. В. Очаповского Минздрава России
Россия
Головина Галина Алексеевна — кандидат медицинских наук, врач кардиолог кардиологического отделения № 3
Т. В. Ставенчук
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Ставенчук Татьяна Владимировна — кандидат медицинских наук, врач отделения функциональной диагностики, ассистент кафедры терапии № 1 ФПК и ППС
Н. В. Кижватова
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Кижватова Наталья Владимировна — кандидат медицинских наук, зав. кардиологическим отделением № 3, доцент кафедры терапии № 1 ФПК и ППС
Е. Д. Космачёва
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Космачёва Елена Дмитриевна — доктор медицинских наук, зам. главного врача по лечебной работе, зав. кафедрой терапии № 1 ФПК и ППС, главный кардиолог Южного федерального округа, главный кардиолог Краснодарского края
ЭхоКГ митральной недостаточности при ГКМП
ЭхоКГ митральной недостаточности при ГКМП
При ГКМП в результате первичного поражения митрального клапанного аппарата происходит переднее систолическое смещение митрального клапана, вызывающее обструкцию выносящего тракта левого желудочка.
Смещение сосочковых мышц кпереди, вытягивание (элонгация) створок митрального клапана и сухожильных хорд приводят к уменьшению натяжения створок, которое способствует смещению их кпереди. Повлечет ли это за собой появление регургитации или нет, зависит от соотношения длины створок и их подвижности: при вытягивании обеих створок митрального клапана и увеличении их подвижности створки смещаются вперед вместе без нарушения их коаптации (симметричное переднее смещение митрального клапана).
Аналогично симметричной форме ПМК, при этом отсутствует гемодинамически значимая митральная регургитация (обструкция без регургитации). Если задняя створка митрального клапана вместе с сухожильными хордами вытягивается в меньшей степени, то их подвижность оказывается недостаточной для того, чтобы произошло переднее смещение более вытянутой передней створки к межжелудочковой перегородке (асимметричное переднее смещение митрального клапана). Аналогично асимметричному ПМК, в результате сепарации створок митрального клапана появляется гемодинамически значимая регургитация (обструкция с регургитацией).
Феномен переднего систолического смещения митрального клапана в конечном итоге можно понимать как пролапс митрального клапана в выносящий тракт левого желудочка, подчиняющийся тем же геометрическим принципам. Примерно у 3% всех пациентов с ГКМП и у 9% оперированных больных отмечается пролабирование створки митрального клапана или разрыв сухожильных хорд как причина митральной регургитации.
Схематическое изображение геометрии митрального клапана при ГКМП без выраженной регургитации.
Слева: удлинение (элонгация) обеих створок митрального клапана приводит к переднему его смещению в целом (феномен симметричного переднего систолического смещения), включая и плоскость коаптации створок (обструкция без регургитации).
Справа: если элонгация задней створки менее выражена, то задняя створка отстает в своем смещении к межжелудочковой перегородке от передней створки (феномен асимметричного переднего систолического смещения). В результате сепарации створок митрального клапана возникает выраженная регургитация. Три клинических примера гипертрофической обструктивной кардиомиопатии и обструкции выводящего отдела левого желудочка (ЧПЭ):
а и б - Несмотря на элонгацию обеих створок митрального клапана (края передней и задней створок митрального клапана обозначены буквами «а» и «р»), коаптация их (участок С) плотная (обструкция без регургитации).
в и г - Сужение коаптирующих краев створок митрального клапана вызывает легкую регургитацию.
д и е - Из-за недостаточной элонгации задней створки она отстает от смещающейся передней створки, что приводит к появлению зияния клапанного отверстия (G) (обструкция с выраженной регургитацией).
ЭхоКГ митральной недостаточности при ГКМП
ВСЕВОЛОД СЕДОВ: «ЭХОКГ ДОЛЖЕН ДЕЛАТЬ КАРДИОЛОГ»
Возможности современной ультразвуковой диагностики сердца уникальны. Однако правильный результат может быть получен только при сочетании опыта оператора, его клинических знаний и умения оценивать ультразвуковое изображение. О том, что должен учитывать врач, направляя пациентов на ЭхоКГ, рассказывает профессор кафедры лучевой диагностики и лучевой терапии Первого МГМУ имени И.М. Сеченова, д.м.н. Всеволод Парисович СЕДОВ.

– Всеволод Парисович, расскажите о показаниях к ЭхоКГ. В каких случаях врач общей практики или кардиолог должен направлять на ультразвуковое исследование сердца?
– Врач, использующий аускультацию в своей клинической практике, безусловно, может услышать грубые шумы в сердце, однако, как правило, он не в состоянии их правильно интерпретировать. Их причиной могут быть клапанные заболевания или пороки сердца (врожденные или приобретенные), диагностировать которые можно только инструментальными методами. Эхокардиография может предоставить врачу массу полезной информации, не требуя в отличие от лучевых методов значительных расходов и специального помещения.
Сегодня эхокардиография входит в обязательные стандарты при обследовании пациентов с гипертонической болезнью, с ИБС, клинически выраженной или предполагаемой на основе факторов риска. Однако таких больных необходимо направлять на исследование ЭКГ и ЭхоКГ, которые проводятся синхронно. Врач видит на дисплее и ультразвуковое изображение, и электрокардиографическую картину, что позволяет ему оценивать фазы сердечного цикла. Золотым стандартом для назначения ЭхоКГ служат пороки сердца – врожденные и приобретенные, а также варианты дилатационной, гипертрофической и рестриктивной кардиомиопатии. Эти виды патологий, к сожалению, часто пропускаются не только терапевтами, но и кардиологами. А ведь правильная интерпретация эхографических изображений и адекватная клиническая оценка играют существенную роль в планировании лечения – консервативного или оперативного.
Поражения сердечной мышцы при таких состояниях, как миокардит, различные формы кардиопатии (дилатационная, гипертрофическая кардиомиопатия, некомпактный миокард), также очень хорошо диагностируются при ЭхоКГ. Тем не менее стоит помнить о том, что наиболее точный метод для оценки морфологии миокарда и его структурных характеристик – это МРТ. Сочетание ЭхоКГ с МРТ позволяет получить больше информации об этих заболеваниях.
– Какие клинические симптомы должны служить поводом для направления на ЭхоКГ?
– Это прежде всего сердечный шум, острая боль в груди, одышка, нестабильность гемодинамики. Причем в последнем случае речь идет не об артериальной гипертензии, а о резких колебаниях АД – сегодня это 120/80 мм рт.ст., завтра 180/100, а через день 110/60 мм рт.ст. Эти случаи в обязательном порядке требуют уточнения морфологии и функции сердца с помощью ЭхоКГ.
– Насколько часто в вашей практике встречаются пациенты, которым ЭхоКГ следовало бы назначить намного раньше?
– Сейчас в основном все врачи знают возможности ЭхоКГ и, как правило, вовремя назначают пациентам с подозрением на сердечные заболевания это исследование, однако далеко не всегда оно выполняется квалифицированно. Нам очень часто приходится либо интерпретировать результаты по‑другому, либо заново обследовать пациента. Так что в основном проблема в кадрах, т. е. тех врачах, которые проводят ЭхоКГ.
В Европе и особенно в США этот метод отдан в руки специалистов со средним образованием, но очень квалифицированных. В России ЭхоКГ делают либо врачи функциональной диагностики, либо врачи ультразвуковой диагностики, и, конечно, они часто интерпретируют результаты не так, как кардиолог. Многое зависит и от клинического опыта оператора, его умения выделить сердце, найти правильную позицию, сечение и на основе полученных данных оценить наблюдаемые изменения сердца. Поэтому, с моей точки зрения, такой врач должен быть клиницистом, хорошо знать кардиологию.
Золотым стандартом для назначения ЭхоКГ служат пороки сердца – врожденные и приобретенные, а также варианты дилатационной, гипертрофической и рестриктивной кардиомиопатии
– В последние годы в профильных учреждениях можно сделать и трехмерную эхокардиографию, а также ЭхоКГ с контрастированием. В каких случаях предпочтительнее прибегать к этим методам?
– Действительно, это очень модные на сегодня модальности, которые могут дать в некоторых случаях более точную информацию. Однако в рутинной практике их не используют по нескольким причинам. Трехмерная кардиография, безусловно, позволяет лучше оценить морфометрические взаимоотношения различных областей сердца, камер и клапанов. Этот метод используется при планировании кардиохирургической операции, поскольку позволяет рассмотреть сердце со всех сторон, понять, как сформирован порок, получить количественные параметры, например длину створок и степень прогиба. Его используют и в послеоперационном обследовании, чтобы оценить достигнутый эффект. Однако в рутинной практике применять трехмерную ЭхоКГ достаточно сложно, потому что, во‑первых, она требует достаточно много времени, а, во‑вторых, пространственное и временное разрешение 3D‑датчиков значительно ниже, чем 2D.
Исследования с контрастированием в основном применяют при диагностике ИБС во время проведения стресс‑кардиографии. Кроме того, контрастная ЭхоКГ хорошо выявляет дефекты межпредсердной или межжелудочной перегородки. Она используется также для верификации гемодинамических нарушений, например при аортальных стенозах. В этих случаях контрастная ЭхоКГ служит хорошим подспорьем.
Нам очень часто приходится либо интерпретировать результаты ЭхоКГ по‑другому, либо заново обследовать пациента. Так что в основном проблема в квалификации тех врачей, которые проводят ЭхоКГ
– Эхокардиография – очень чувствительный метод, но все же, наверное, не универсальный. В каких случаях назначение ЭхоКГ не оправдано?
– Действительно, врачи очень любят направлять пациентов на ЭхоКГ для диагностики ИБС без инфарктов в анамнезе. Однако в этих случаях, когда налицо стенокардия, но нет признаков рубцовых изменений миокарда, возможности ЭхоКГ ограничены. Диагноз ИБС должен быть поставлен на основании целого комплекса обследований – клинического, электрокардиографического и эхокардиографического, как метода, дополняющего все остальные. Существует, правда, и другая возможность диагностики ИБС, когда ЭхоКГ назначается не в состоянии покоя, а под нагрузкой – стресс‑ЭхоКГ. В этих случаях шансы диагностировать ишемию миокарда значительно возрастают.
И, напротив, такой диагноз, как пролапс митрального клапана, с которым к нам очень часто направляют молодых пациентов, мы, как правило, не подтверждаем. Это так называемый случай гипердиагностики. У многих пациентов его «находят» на первичном обследовании из‑за несовершенства ультразвуковых приборов. До сих пор в некоторых медицинских учреждениях используют одномерную кардиографию, которая дает очень большой процент ошибок.
Еще один ошибочный диагноз, с которым часто приходят пациенты, – это митральная недостаточность. Если врач услышал систолический шум, первое, что он пишет, – недостаточность митрального клапана. Причем может быть указана и 1‑я, и 3‑я степень… А правильно оценить степень клапанного порока чрезвычайно важно. От этого зависит дальнейшая тактика лечения – терапевтическая или хирургическая. И метод ЭхоКГ в этих случаях может предоставить врачу наиболее полную информацию. С его помощью можно точно оценить выраженность клапанного поражения не только трансторакально (через переднюю грудную стенку), но и из пищевода (чреспищеводная ЭхоКГ).
– В каких еще случаях используется метод чреспищеводной ЭхоКГ?
– Пациента направляют на чреспищеводную ЭхоКГ при фибрилляции предсердий. Для восстановления синусового ритма может быть использовано как медикаментозное лечение, так и абляция. Но перед этим следует убедиться в отсутствии тромбов внутри сердца и, в частности, внутри ушка левого предсердия. А это ушко видно только из пищеводного доступа.
Еще одним показанием для проведения чреспищеводной ЭхоКГ служит инфекционный эндокардит. Кроме того, доступ через пищевод необходим для оценки функции клапана или его протеза после хирургической операции. Существуют и еще некоторые виды патологий, для диагностики которых используется чреспищеводная ЭхоКГ, – диссекция аорты, патология межпредсердной или межжелудочной перегородки и др.
Оценка клапанных пороков у онкологических пациентов имеет такое же большое значение, как и фракции выброса левого желудочка
– Показана ли ЭхоКГ пациентам с сахарным диабетом или выраженным ожирением? Ведь очень часто сердечная недостаточность у таких больных выявляется в 3‑й или 4‑й стадии и служит поводом для госпитализации.
– На этот вопрос я всегда отвечаю положительно. Конечно, у всех пациентов с сахарным диабетом и преддиабетом должны быть исследованы морфология и функция сердечной мышцы, поскольку сахарный диабет – значительный фактор риска развития ИБС. Причем к ее особенностям относится бессимптомное течение, т. е. на ЭхоКГ мы тестируем сердечную недостаточность без предшествующего болевого синдрома.
– Онкологическим пациентам ЭхоКГ проводится для оценки кардиотоксичности терапии. Однако многие кардиологи считают, что изменение фракции выброса левого желудочка, оцениваемое с помощью ЭхоКГ, менее чувствительный показатель, нежели продольная деформация левого желудочка. Насколько широко распространено в России это исследование?
– Да, действительно, продольная деформация, или продольный стрейн, более точно характеризует дисфункцию левого желудочка по сравнению с фракцией выброса, хотя бы потому, что этот показатель менее зависим от оператора. Уже накоплено достаточно данных, которые свидетельствуют об этом. Однако, к сожалению, не все аппараты УЗИ снабжены этой опцией – программой, которая позволяет измерять деформацию желудочка по своеобразным маркерам на ультразвуковом изображении сердца.
Тем не менее и измерение фракции выброса левого желудочка позволяет достаточно точно оценить его систолическую функцию. Проблема возникает скорее из‑за того, что исследования проводятся на несовершенной аппаратуре. Во многих учреждениях еще используют одномерный режим для оценки фракции выброса. Это неправильно, особенно у пациентов, находящихся на химио – или лучевой терапии. При одномерном режиме мы не видим всех сегментов левого желудочка, которые должны быть оценены. А их на сегодняшний день должно быть 17. Чем больше оператор посмотрит сечений сердца, тем объективнее он оценит сократимость миокарда. Исследование продольной деформации не требует множества измерений, но при этом позволяет более точно оценить систолическую функцию.
Кроме того, говоря об онкологических больных, надо помнить, что сердечная недостаточность может быть и с нормальной фракцией выброса. Такая ситуация возникает у тех пациентов, у которых в первую очередь нарушается диастолическая функция. В этом случае может помочь тканевой допплер, фиксирующий скорость движения фиброзного кольца митрального клапана и самих сегментов левого желудочка. Этот вид исследования помогает поставить диагноз диастолической сердечной недостаточности при нормальной фракции выброса у пациентов на лучевой или химиотерапии.
Следует также помнить, что развитие сердечной недостаточности при химиотерапии может происходить не сразу, а отсрочено – через несколько лет. В этих случаях через три‑пять лет возникает синдром дилатационной кардиомиопатии, вследствие которой не только нарушается систолическая и диастолическая функция, но формируются клапанные пороки – стеноз устья аорты, недостаточность митрального клапана и ряд других. Поэтому оценка клапанных пороков у онкологических пациентов имеет такое же большое значение, как и фракции выброса левого желудочка.
Я убежден, что эхокардиографию должен делать именно кардиолог, а не врач функциональной или ультразвуковой диагностики
– Исходя из этого, пациенты, когда‑либо получавшие лучевую или химиотерапию, должны ежегодно делать ЭхоКГ?
– Да. Онкологические пациенты должны проходить исследование ЭхоКГ каждый год. Но не только они. Ультразвуковое исследование показано также больным с сердечной недостаточностью, даже с сохраненной фракцией выброса, лицам, страдающим многолетней артериальной гипертонией, перенесшим инфаркт миокарда с развитием сердечной недостаточности. К обязательной группе относятся также пациенты после протезирования клапанов, с дилатационной кардиомиопатией, с обструктивными формами гипертрофической кардиомиопатии.
– ЭхоКГ применяется как метод оценки неотложных состояний?
– Конечно, метод очень полезен для диагностики острого инфаркта миокарда или диагностики его осложнений. Их достаточно много – это перикардит, тампонада сердца, острая сердечная недостаточность, разрыв сердечной мышцы. Эти осложнения, как и масса других, нуждаются в правильном ультразвуковом обследовании, а главное, в правильной интерпретации того, что мы видим.
– Наверное, сейчас самая больная тема – это не наличие ультразвукового аппарата в медицинском учреждении, а наличие опытного оператора, который может адекватно оценить полученное изображение?
– Да, сейчас практически во всех лечебных учреждениях есть аппаратура и врач, который может смотреть сердце с помощью ультразвука. Однако организационно это сделано не совсем правильно – я убежден, что эхокардиографию должен делать именно кардиолог, а не врач функциональной или ультразвуковой диагностики.
Однако в любом случае такому специалисту необходимо постоянное повышение квалификации. Они не должны вариться в собственном соку, находясь в своем учреждении. Сейчас очень много конгрессов, симпозиумов, где обсуждается ультразвуковая диагностика патологий сердца и где можно почерпнуть полезную информацию. Это и российский кардиологический конгресс, и ежегодный конгресс лучевой диагностики в «Крокус‑Сити», и масса региональных симпозиумов.
Я придерживаюсь такого мнения, что каждый врач должен уметь правильно интерпретировать ультразвуковое исследование. Для этого совсем необязательно быть оператором. И в Сеченовском университете, где я преподаю и ординаторам, и студентам, такой взгляд признается правильным.
ЭхоКГ митральной недостаточности при ГКМП



- НИО хирургии аорты, коронарных и периферических артерий
- НИО новых хирургических технологий
- НИО хирургической аритмологии
- НИО эндоваскулярной хирургии
- НИО сосудистой и гибридной хирургии
- НИО онкологии и радиотерапии
- НИО ангионеврологии и нейрохирургии
- НИО анестезиологии и реаниматологии
- НИО лучевой и инструментальной диагностики
- Состав совета по защите докторских и кандидатских диссертаций
- Требования к соискателям
- Соискатели
- Апелляции
- ГОСТ по оформлению диссертации и автореферата
- Контакты совета
- Генеральный директор Центра
- Руководство Центра
- Миссия
- История
- Мероприятия
- Фотопроекты
- Истории пациентов
- Нормативные документы
- Структура отдела
- Организационно-методическая работа с регионами
- Развитие телемедицинских технологий
- Кадровая политика и повышение квалификации
- Публичный отчет
- Устав и регистрационные документы
- Лицензии
- Публичный отчет
- Сведения о медицинских работниках
- План развития Центра
- Политика обработки персональных данных
- Охрана труда
- Политика в области охраны труда
- Противодействие коррупции
- Учетная политика
Сотрудники Центра сравнили эффективность двух тактик коррекции митральной недостаточности у пациентов с ГКМП
Ученые Центра Мешалкина первыми в мире оценили эффективность двух технологий одномоментной коррекции митральной недостаточности у пациентов с гипертрофической обструктивной кардиомиопатией.
Фото: Алексей Танюшин
Специалисты центра новых хирургических технологий НМИЦ им. акад. Е.Н. Мешалкина представили результаты первого в мире проспективного клинического исследования эффективности двух методов одномоментной коррекции митральной недостаточности у пациентов с гипертрофической обструктивной кардиомиопатией - наиболее распространенным наследственно обусловленным заболеванием сердца.
Данная патология характеризуется утолщением межжелудочковой перегородки и обструкцией (нарушением проходимости) пути оттока из левого желудочка, что может сопровождаться такими симптомами, как одышка, боль в грудной клетке или внезапная кратковременная потеря сознания. Гипертрофическая кардиомиопатия встречается примерно у 1 из 500 человек в общей популяции и без своевременного хирургического лечения может привести к внезапной сердечной смерти.
Проблемой у некоторых пациентов с обструктивной гипертрофической кардиомиопатией является значимая митральная недостаточность - патология, при которой поступающая в левый желудочек кровь при сокращении частично возвращается в левое предсердие, в результате чего возникает митральная регургитация (обратный поток). Митральная недостаточность при гипертрофической кардиомиопатии может быть обусловлена аномалиями развития сосочковых мышц и/или подклапанных хорд и, в отличие от других причин митральной недостаточности, не приводит к органическим изменениям митрального клапана.
Часто после изолированной коррекции обструктивной гипертрофической кардиомиопатии пациентам требуется дополнительное вмешательство на митральном клапане по поводу умеренной или выраженной остаточной митральной недостаточности, в связи с чем у данной группы пациентов оправдано проведение сочетанных вмешательств. Группа научных сотрудников НМИЦ им. ак. Е.Н. Мешалкина и ФЦССХ (г. Астрахань) провела сравнительное исследование эффективности двух методик коррекции митральной недостаточности при одномоментном хирургическом лечении гипертрофической обструктивной кардиомиопатии. С 2016 по 2017 год специалисты включили в исследование и распределили по двум группам 48 пациентов с показаниями к миоэктомии межжелудочковой перегородки (оперативному вмешательству, направленному на уменьшение толщины гипертрофированной межжелудочковой перегородки и коррекцию возможных внутрижелудочковых аномалий) и сопутствующей коррекции митральной недостаточности. Пациентам первой группы в дополнение к расширенной миоэктомии проводили пластику митрального клапана с использованием техники «край в край», предложенной итальянским кардиохирургом Оттавио Альфиери (SanRaffaeleHospital, Милан, Италия). Пациентам второй группы в дополнение к расширенной миоэктомии выполняли резекцию вторичных хорд митрального клапана по авторской методике европейского хирурга Паоло Феррацци (Policlinico di Monza, Монза, Италия).
Результаты исследования специалисты Центра Мешалкина представили на ежегодном конгрессе Американской ассоциации торакальных хирургов (American Association for Thoracic Surgery) AATS Week 2019.
Эхокардиографическая диагностика обструкции выносящего тракта левого желудочка у пациентов с гипертрофической кардиомиопатией
Гипертрофическая кардиомиопатия (ГКМП) определяется как утолщение стенок левого желудочка (ЛЖ), которое нельзя объяснить его перегрузкой объемом или давлением, и диагностируется у 0,02-0,23% взрослого населения. Заболевание передается по аутосомно-доминантному типу, чаще регистрируется у мужчин в возрасте старше 25 лет. Диагноз ГКМП базируется на выявлении утолщения стенок ЛЖ ≥1,5 см в одном или нескольких сегментах с помощью любых методов визуализации (эхокардиографического исследования (ЭхоКГ), спиральной компьютерной томографии, магнитно-резонансной томографии сердца) при отсутствии перегрузки ЛЖ.
ГКМП может проявляться как асимметричным утолщением определенных зон миокарда ЛЖ (например, межжелудочковой перегородки – МЖП, верхушки), так и тотальной концентрической его гипертрофией. В случае локализации утолщенного сегмента в базальных отделах МЖП может возникнуть препятствие току крови из ЛЖ в аорту – обструкция выносящего тракта. В зависимости от ее наличия и выраженности различают две основные формы ГКМП – обструктивную и необструктивную.
Обструкция выносящего тракта ЛЖ возникает вследствие переднесистолического движения створок митрального клапана и выявляется у трети пациентов в состоянии покоя и еще у трети – при физиологической провокации (проба Вальсальвы, пробы с дозированной физической нагрузкой – ДФН) – динамическая обструкция. Диагностическим критерием обструкции выносящего тракта является повышенный градиент давления на выносящем тракте ЛЖ >30 мм рт. ст. в состоянии покоя или при физиологической провокации, при этом клинически значимым он становится при его увеличении >50 мм рт. ст.
Большое количество пациентов являются бессимптомными, и заболевание обнаруживается во время скрининга. Важность диагностики обструктивной формы ГКМП, особенно динамической, связана с ее влиянием на клиническое течение и прогноз у пациентов. Выраженность обструкции выносящего тракта ЛЖ может уменьшаться на фоне медикаментозной терапии; в некоторых случаях показана хирургическая коррекция (септальная миотомия, алкогольная абляция утолщения стенки ЛЖ). Уменьшение градиента на выносящем тракте ЛЖ способствует улучшению состояния пациента, уменьшению симптомов заболевания.
Таким образом, важность диагностирования ГКМП и выявления обструкции, особенно динамической, является очевидной для выбора дальнейшей тактики лечения. Приводим описание клинического случая динамической обструкции выносящего тракта ЛЖ при ГКМП.
Клинический случай
Пациент М., мужчина, 67 лет, направлен в экспертный лечебно-диагностический центр миокардита и кардиомиопатий ГУ ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины с жалобами на одышку смешанного характера при подъеме на 2 лестничных пролета, ощущение «перебоев» в работе сердца, общую слабость, которые появились в течение месяца и имели постепенно нарастающий характер.
Анамнез заболевания: После обследования у семейного врача и проведения ЭхоКГ была выявлена гипертрофия ЛЖ, и с подозрением на ГКМП пациент госпитализирован в отделение некоронарных болезней сердца и ревматологии ГУ ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины 25.01.2016 г. для дообследования и верификации диагноза.
Анамнез жизни: Курит около 20 лет, 15-20 сигарет в сутки. В течение 2 лет отмечает бессимптомное повышение уровня артериального давления (АД) до 150/90-95 мм рт. ст., регулярно антигипертензивную терапию не принимал.
Объективно: общее состояние удовлетворительное, правильного телосложения, индекс массы тела 29,4 кг/м 2 . Кожные покровы, периферические лимфатические узлы – без особенностей. Границы относительной сердечной тупости: верхняя – III межреберье по левой парастернальной линии, правая – по правому краю грудины, левая – по среднеключичной линии. При аускультации выслушивается регулярный ритм сердца с частотой сердечных сокращений (ЧСС) 78 уд/мин, над всей зоной относительной сердечной тупости – мягкий систолический шум максимально во II межреберье по правой парастернальной линии и на верхушке. АД на обеих руках 155/90 мм рт. ст. Грудная клетка симметрично участвует в акте дыхания. Над легкими перкуторно определяется легочный звук, при аускультации выслушивается везикулярное дыхание. Живот при пальпации мягкий, безболезненный.
При обследовании в общем, биохимическом анализах крови, общем анализе мочи патологических изменений не обнаружено.
При выписке пациенту разъяснены риски, связанные с курением, необходимость поддержания нормального индекса массы тела. Больному рекомендовано избегать интенсивной физической активности, осуществлять ежегодный контроль ЭКГ, ЭхоКГ, показан постоянный прием бисопролола в дозе 5-7,5 мг/сут под контролем ЧСС.
Патофизиологическое объяснение феномена динамической обструкции выносящего тракта ЛЖ со временем претерпело изменения. Согласно исходной гипотезе утолщенная базальная часть МЖП во время систолы ЛЖ могла приводить к обструкции выносящего тракта, создавая эффект Вентури – «засасывание» митрального клапана в просвет выносящего тракта ЛЖ. Однако последующие исследования показали, что ускоренный парасептальный кровоток оказывал, скорее, «тянущий» эффект на вытянутый и смещенный митральный клапан, что толкало створки в выносящий тракт ЛЖ, вызывая явления его обструкции. Применение препаратов с отрицательным хронотропным и инотропным эффектами уменьшает скорость парасептального кровотока, таким образом, обусловливая снижение выраженности обструкции выносящего тракта ЛЖ.
Описанный клинический случай демонстрирует важность проведения пробы Вальсальвы при подозрении на динамическую обструктивную форму ГКМП, а также эффективность оптимального медикаментозного лечения в снижении степени обструкции выносящего тракта ЛЖ. Бета-блокаторы являются препаратами первого выбора для пациентов с наличием обструкции выносящего тракта ЛЖ (или без нее), которые имеют симптомы одышки или недостаточную переносимость физических нагрузок. Бета-блокаторы снижают сократимость ЛЖ, уменьшают градиент на выносящем тракте ЛЖ, уменьшают потребность миокарда в кислороде и выраженность ишемии миокарда.
В рассматриваемом клиническом случае даже непродолжительный прием бисопролола в средней суточной дозе привел к нормализации максимального градиента давления на выносящем тракте при нагрузке, что способствовало расширению физической активности пациента, уменьшению одышки, улучшению общего самочувствия.
Следует отметить, что нередко для выявления динамической обструкции проводится нагрузка в виде приседаний, однако такой подход является неинформативным в диагностике обструкции выносящего тракта ЛЖ. Это, вероятно, связано со сложностью поиска оптимального ультразвукового окна сразу после выполнения нагрузки, а также диагностически непродолжительным приростом градиента давления на выносящем тракте, что может привести к получению ложноотрицательных результатов.
Согласно современным руководствам всем пациентам с ГКМП рекомендовано проведение 2D и допплеровского ЭхоКГ-исследования как в состоянии покоя, так и при проведении пробы Вальсальвы.
Список литературы находится в редакции.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Сьогодні в рамках оцінки чинників ризику серцево-судинних (СС) захворювань дедалі більший інтерес наукового світу прикутий до ендотелію та його функції. Ендотелій уражається насамперед унаслідок артеріальної гіпертензії (АГ), це проявляється розвитком його дисфункції та морфологічною перебудовою артеріальної стінки. Добре відомо, що з віком підвищується судинна жорсткість, що пов’язують зі зниженням в артеріальній стінці вмісту еластину та підвищенням кількості колагену 4. У разі АГ перебіг цих процесів значно прискорюється – судинний вік починає випереджати хронологічний (паспортний). Тому дедалі більше науковців для опису функціонального та морфологічного стану серцево-судинної системи використовують термін «синдром раннього старіння судин», або EVA‑синдром (early vascular aging), як модель старіння судин, яка більш точно відображає структурні та функціональні зміни, що відбуваються в організмі в міру його старіння [1].
Ішемічна хвороба серця (ІХС) є провідною причиною інвалідизації та смертності від серцево‑судинних захворювань (ССЗ). У розвинених країнах Європи на 1 млн населення припадає 30-40 тис. хворих, які страждають на ІХС [1]. До того ж немає пояснень для показників смертності українських чоловіків і жінок, які в 14 і 23 рази більше, ніж у Франції [2]. Крім базисної терапії пацієнтів з ІХС, потенційним напрямом лікування є застосування підходів, які здатні покращити енергозабезпечення кардіоміоцитів, мікроциркуляцію та функцію ендотелію судин [3].
COVID‑19 чинить суттєвий негативний вплив на серцево-судинну (СС) систему. Наявні у пацієнтів серцево-судинні захворювання (ССЗ) до інфікування COVID‑19 та вірусне навантаження асоційовані з пошкодженням міокарда й гіршими результатами. Пандемія триває, зокрема, з’являються нові варіанти коронавірусу, тож розуміння патофізіології та відповідних клінічних наслідків допоможе розширити уявлення про основні механізми розвитку хвороби. Вирішальне значення також мають встановлення нових біомаркерів СС-ускладнень і розробка ефективних методів лікування COVID‑19. Пропонуємо до вашої уваги консенсусний документ Європейського товариства кардіологів (ESC) та Асоціації невідкладної кардіологічної допомоги (ACVC) у співпраці з Європейською асоціацією серцевого ритму (EHRA) 2021 р., у якому підсумовано сучасні відомості про ураження СС-системи на тлі COVID‑19 та його постгострі наслідки. .
Незважаючи на сучасні методи відновлення коронарного кровотоку, показники смертності після перенесеного гострого коронарного синдрому (ГКС) залишаються досить високими, що пов’язують з ушкодженням міокарда під час реперфузії. Відповідно до сучасних уявлень, провідною причиною цього явища є ішемічний каскад, який може запускати процеси загибелі кардіоміоцитів і бути відповідальним за 50% кінцевого розміру зони некрозу при ГКС, виникнення реперфузійних аритмій, систолічної мікросудинної дисфункції. Саме тому адекватне блокування ішемічного каскаду, спрямоване на елімінацію активних форм кисню, активацію антиоксидантів, на сьогодні вважається важливою складовою менеджменту пацієнтів із ГКС. .
Читайте также:
