ЭхоКГ при кардиомиопатии такоцубо
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Известно, что тяжелый психологический стресс может вызывать развитие острой преходящей дисфункции левого желудочка (ЛЖ) [1]. Впервые такой синдром был описан японскими авторами в 1990 г. [2], которые назвали его «кардиомиопатия takotsubo (такоцубо)» на основании сходства данных ангиограммы ЛЖ при этом заболевании с ловушкой для осьминога в связи с акинезией верхушки и средних сегментов ЛЖ в сочетании с гиперкинезией его базальных отделов. В последующем кардиомиопатию, связанную с психоэмоциональным или физическим стрессом стали обозначать также термином «стрессовая кардиомиопатия».
При сочетанном нарушении сократительной способности миокарда верхушки и средних сегментов ЛЖ может развиваться динамическая обструкция выносящего тракта левого желудочка (ВТЛЖ) [3—9]. Считается, что при наличии тяжелой сердечной недостаточности (СН) или выраженной артериальной гипотонии у больных с предполагаемой кардиомиопатией (КМП) с помощью эхокардиографии (ЭхоКГ) необходимо исключать наличие динамической обструкции ВТЛЖ. Имеются данные о том, что частота бессимптомного увеличения внутрисердечного градиента давления у больных с КМП такоцубо может достигать 20% [4, 10], но клинические проявления обструкции ВТЛЖ выявляются нечасто.
Приводим собственное наблюдение больной 60 лет, у которой развитие КМП сопровождалось выраженной динамической обструкцией в ВТЛЖ ЛЖ, тяжелыми нарушениями гемодинамики в большом круге кровообращения и отеком легких.
Больная Е., 60 лет была госпитализирована в палату реанимации и интенсивной терапии отделения неотложной кардиологии Научно-исследовательского института скорой помощи им. Н.В. Склифосовского 22.09.11 с жалобами на боли за грудиной давящего характера, чувство нехватки воздуха, слабость, которые развились через 3 часа после ссоры с сыном.
В анамнезе в течение около 10 лет артериальная гипертония. В 2008 г. после психоэмоционального напряжения был приступ болей за грудиной, который, со слов больной, сопровождался изменениями на электрокардиограмме (ЭКГ); больная госпитализировалась в кардиологическое отделение, где, со слов больной, был диагностирован инфаркт миокарда, коронарография не выполнялась, а информация об уровне кардиоспецифических маркеров отсутствует. Выписку о госпитализации в 2008 г. больная не представила. В период между 2008 г. и последним приступом, развившимся 22.09.11, боли за грудиной не беспокоили. Постоянно принимала эналаприл 10 мг/сут, метопролол 50 мг/сут и аспирин 100 мг/сут.
В момент госпитализации состояние тяжёлое. В сознании. Кожные покровы умеренно бледные. Периферических отеков нет. В легких дыхание с жёстким оттенком, в нижних отделах выслушиваются влажные мелкопузырчатые хрипы. Частота дыханий 26 в минуту. Тоны сердца приглушены, ритмичные, над областью сердца с максимумом по левому краю грудины выслушивается грубый систолический шум, ЧСС 95 в мин. АД 90/60 мм рт.ст. Живот мягкий, безболезненный. Печень не увеличена. Очаговая неврологическая симптоматика не выявляется.
ЭКГ от 22.09.11 (в момент госпитализации): ритм синусовый, ЧСС 84 в мин, амплитуда зубца R снижена в отведениях V2—4; в отведениях V2—6 регистрируется подъем сегмента ST выше изоэлектрической линии на 2 мм (рис. 1А). В динамике на ЭКГ от 26.09.11 формирование глубоких отрицательных зубцов Т в отведениях I, II, aVF, V2—6 (рис. 1Б).
Электрокардиограмма больной. А — в момент госпитализации; Б — через 4 дня после госпитализации.
22.09.11 по экстренным показаниям (через 1 ч. 20 мин после госпитализации) была выполнена коронарография, по данным которой: тип коронарного кровоснабжения правый. Ствол левой коронарной артерии длинный и широкий, проходим, делится по типу трифуркации. Передняя межжелудочковая ветвь крупная, огибает верхушку сердца, в проксимальном отделе (в месте отхождения 1-й диагональной ветви сужена на 30%), далее диффузно изменена. Устье крупной 1-й диагональной ветви сужено на 50%. (рис. 2А). Промежуточная ветвь умеренно развита, проходима. Огибающая ветвь проходима, диффузно изменена. Правая коронарная артерия крупная и широкая, формирует задне-боковую и задне-межжелудочковую ветви, эти артерии без признаков локальных сужений. (рис. 2Б).
А — левая передняя нисходящая артерия; Б — правая коронарная артерия.
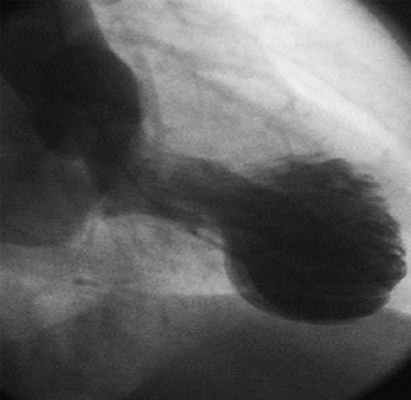
Эхо-КГ от 23.09.11 (рис. 3): дилатация полости левого предсердия и левого желудочка; акинезия переднего, перегородочного, передне-перегородочного сегментов ЛЖ на среднем уровне, акинезия всех верхушечных сегментов. Уменьшение толщины миокарда в области верхушечных, переднего и перегородочного сегментов до 0,7см. Феномен «раздувания верхушки» ЛЖ. Митральная регургитация 2 степени. Трикуспидальная регургитация 1 степени, без признаков легочной гипертонии. Разобщения листков перикарда не выявлено. КДР ЛЖ 6,9 см, КДО ЛЖ 187 мл, КСР ЛЖ 5,3 см, КСО ЛЖ 120 мл. Толщина МЖП в базальных отделах 2,5 см, нижняя треть МЖП 1,10 см, ЗСЛЖ 1,40 см. ИММЛЖ-268г/м 2 ЛП 4,6 см. Ао-3,0. Створки аортального клапана уплотнены, с признаками склероза, но без нарушения их функции. Максимальный градиент давления на уровне ВТЛЖ 119,3 мм рт.ст., средний градиент давления в ВТЛЖ 64,4 мм рт.ст. ФВ ЛЖ 36%.
ЭхоКГ и допплер-ЭхоКг от 23.09.11, феномен «раздувания» верхушки.
После получения результатов коронарографии и ЭхоКГ было высказано предположение о диагнозе стрессовая кардиомиопатия (кардиомиопатия такоцубо).
Лабораторные показатели были в пределах нормальных значений, за исключением уровня тропонина в крови: от 23.09.11 — 1,09 нг/мл; 26.09.11 — 1,3 нг/мл (нормальные значения 0–0,04 нг/мл).
На фоне проводимой терапии аспирином 100 мг/сут, спиронолактоном 100 мг/сут, 3-5мкг/кг/мин допамином со скоростью 3—5мкг/кг/мин, лазиксом по 80 мг 2 раза в сутки состояние больной прогрессивно ухудшалось: усиливались проявления левожелудочковой недостаточности, рецидивировали боли за грудиной, потребовавшие введения наркотических анальгетиков. К терапии было добавлено подкожное введение низкомолекулярного гепарина далтепарина по 2500 МЕ 2 раза/сут с целью профилактики тромбоэмболических осложнений.
В нижних отделах легких увеличилось количество влажных мелкопузырчатых хрипов, тахипное возросло до 32 в мин, снижение насыщения артериальной кровью кислородом (SpO2) 78—80 % на фоне дыхания атмосферным воздухом с повышением до 88—90 % на фоне оксигенотерапии. В связи сохраняющейся гипоксемией, устойчивой к оксигенотерапии, больная была переведена на принудительную искусственную вентиляцию легких.
Сохранялась синусовая тахикардия с ЧСС до 100 в 1 мин. АД 85/62 мм.рт.ст. Доза допамина была увеличена до 9 мкг/кг/мин.
Таким образом, у больной сохранялась устойчивая к лечению СН и артериальная гипотония. В связи с этим, несмотря на признаки левожелудочковой недостаточности и сниженную до 36% ФВ ЛЖ, было принято решение о введении коротко действующего β-блокатора эсмолола с одновременной регистрацией динамики градиента в ВТЛЖ с помощью допплер-ЭхоКГ.
По данным допплер-ЭхоКГ, на фоне введения эсмолола со скоростью 100 мкг/мин регистрировалось снижение градиента в ВТЛЖ: максимального градиента с 96,8 до 71,4 мм рт.ст.; среднего градиента с 42,3 до 35,3 мм рт.ст. (рис. 3). Инфузия β-блокатора сопровождалась также снижением ЧСС до 83 уд/мин и повышение систолического АД до 90 мм рт.ст. и уменьшением одышки.
Учитывая положительную ответную реакцию на введение эсмолола, после его завершения больная начала прием карведилола по 6,25 мг 2 раза в сутки с последующим увеличением дозы до 12,5 мг 2 раза в сутки. Продолжалось подкожное введение низкомолекулярного гепарина далтепарина по 2500 МЕ 2 раза/сут. На фоне терапии карведилолом отмечена быстрая стабилизация гемодинамики, 27.09.11 произведена экстубация трахеи. Учитывая тенденцию к нормализации АД, к терапии был добавлен ингибитор ангиотензинпревращающего фермента периндоприл в дозе 2,5 мг 1 раз в сутки.
По данным ЭхоКГ от 05.10.11 отмечалось уменьшение размеров полости левого предсердия и левого желудочка, улучшение локальной сократимости ЛЖ при сохранении гипо-акинезии переднего, передне-перегородочного, перегородочного сегментов ЛЖ на среднем уровне, акинезии всех верхушечных сегментов, также сохранении признаки субаортального стеноза с уменьшением градиентов давления в ВТЛЖ (максимального градиента давления в ВТЛЖ 50 мм рт ст., средний градиент давления в ВТЛЖ 20 мм рт. ст.; увеличение ФВЛЖ 42%. ТМЖП 1,20 см, ТЗСЛЖ 1,40 см. ЭхоКГот 13.10.11г: дальнейшее уменьшение размеров полости ЛЖ: КДО ЛЖ 140мл, ЛП 4,2см. Улучшение локальной сократимости миокарда при сохранении гипокинезии переднего, перегородочного сегментов на уровне нижней трети МЖП, толщина которой в базальных отделах достигает 1,9 см, на уровне средней и нижней трети 1,2см. Признаки субаортального стеноза не определяются. Максимальный градиент давления ВТЛЖ 13 мм рт.ст., средний градиент давления ВТЛЖ 6,2 мм рт.ст. Увеличение ФВЛЖ до 57%.
13.10.11 больная была выписана в удовлетворительном состоянии с клиническим диагнозом: стрессовая кардиомиопатия (кардиомипатия такоцубо). Атеросклероз аорты. Гемодинамически незначимый атеросклероз коронарных артерий. Артериальная гипертония 2 степени. Осложнения: острая левожелудочковая недостаточность, отек легких. Искусственная вентиляция легких с 24 по 27.09.11.
При выписке даны рекомендации продолжить прием карведилола по 12,5 мг 2 раза в день, периндоприла по 2,5 мг утром, аспирина по 75 мг вечером, аторвастатина 20 мг вечером.
При посещении клиники 25.11.11 жалоб не предъявляет. Ограничений физической активности не отмечает. На ЭКГ от 25.11.11: ритм синусовый, ЧСС 69 в мин; в отведении V2 регистрируется двухфазный зубец Т, в отведениях I, V4—6регистрируются отрицательные зубцы Т, амплитуда который существенно меньше, чем на ЭКГ от 13.11.11.
ЭхоКГ от 25.11.11 (рис. 4): Нарушения локальной сократимости ЛЖ не выявляются. Признаки субаортального стеноза не получены. Максимальный градиент в ВТЛЖ 14,7 мм рт.ст, средний градиент в ВТЛЖ 8,2 мм рт.ст. Митральная регургитация I степени, трикуспидальная регургитация I степени без признаков легочной артериальной гипертонии.
Глобальная систолическая функция ЛЖ не нарушена, ФВ ЛЖ 65%. (рис. 4).
ЭЭхоКГ через 2 мес после развития симптомов кардиомиопатии такоцубо: нормализация сократительной способности миокарда левого желудочка, отсутствие градиента давления в выносящем тракте левого желудочка.
Таблица. Динамика показателей допплер-ЭхоКГ больной Е. 60л
| Дата исследования | Объемные характеристики ЛЖ, мл | ФВ ЛЖ (%) | Градиент давления в ВТЛЖ, мм рт.ст. | Градиент давления между ЛЖ и аортой, мм рт.ст. | |||
| КДО ЛЖ | КСО ЛЖ | максимальный | средний | максимальный | средний | ||
| 23.09.11 | 187 | 120 | 36 | 119 | 64 | 16 | 8 |
| 27.09.11 | 191 | 116 | 39 | 70 | 34 | 19 | 7 |
| 05.10.11 | 164 | 95 | 42 | 50 | 20 | 18 | 9 |
| 13.10.11 | 140 | 60 | 57 | 13 | 6 | 11 | 5 |
| 25.11.11 | 139 | 48 | 65 | 15 | 8 | 17 | 9 |
Примечание. ЭхоКГ — эхокардиография; ЛЖ левый желудочек; ФВ — фракция выброса; ВТЛЖ — выносящий тракт левого желудочка.
Таким образом, представлен случай развития стрессовой КМП (такоцубо) с выраженным градиентом давления в ВТЛЖ и тяжелой СН, который развился вскоре после психоэмоционального стресса. Диагноз КМП такоцубо был установлен в соответствии с критериями экспертов клиники Мейо [11] на основании сочетания следующих признаков:
- женский пол;
- период постменопаузы;
- временная связь с психоэмоциональным стрессом;
- отсутствие гемодинамически значимых изменений коронарных артерий по данным ангиографии;
- несоответствие между тяжестью клинических проявлений заболевания и умеренным повышением концентрации специфических биомаркеров повреждения миокарда;
- характерная локализация регионарного нарушения сократительной способности миокарда с вовлечением верхушки и средних сегментов ЛЖ;
- полное восстановление сократительной способности миокарда через 2 мес после развития симптомов заболевания.
Применение β-блокатора в такой ситуации позволило достаточно быстро стабилизировать гемодинамику и улучшить состояние больной. Несмотря на то, что при наличии высокого градиента давления в выносящем тракте ЛЖ, обусловленным КМП такоцубо, рекомендуется применение β-блокатора, мы не нашли в литературе описания случая применения β-блокатора у больного с КМП такоцубо в такой ситуации при наличии выраженных нарушений гемодинамики и тяжелой СН.
Известно, что динамическая обструкция ВТЛЖ может приводить к систолическому движению вперед передней створки митрального клапана и развитию митральной регургитации, направленной кзади [12, 13]. В таких случаях механизм нарушения внутрисердечной гемодинамики при КМП такоцубо отчасти будет сходным с таковым при обструктивной гипертрофической КМП. Динамическая обструкция выносящего тракта ЛЖ может обусловливать усугубление нестабильности гемодинамики и утяжеление СН. В таких случаях тактика лечения должна включать введение жидкости (в отсутствие противопоказаний, связанных с застоем в легких) и применение β-блокатора с целью снижения повышенной сократимости базальных «отделов сердца, снижения частоты сердечных сокращений и увеличения конечного систолического объема ЛЖ, что должно приводить к снижению обструкции [12, 14, 15]. Хотя применение β-блокаторов противопоказано у больных с выраженной острой СН, описан случай эффективного применения β-блокатора у больной 70 лет с острым коронарным синдромом и кардиогенным шоком при наличии ЭхоКГ признаков динамической обструкции ВТЛЖ и митральной регургитации в отсутствие эффекта от применения препаратов с положительным инотропным действием [16].
Таким образом, у женщин пожилого возраста, госпитализированных с диагнозом острого коронарного синдрома, особенно в отсутствие гемодинамически значимых изменений коронарных артерий по данным ангиографии, целесообразно проводить дифференциальный диагноз со стрессовой КМП. После установления диагноза КМП такоцубо необходимо оценивать градиент давления в ВТЛЖ, поскольку при его существенном повышении может изменяться клиническое течение заболевания и выбор терапии.
Литература
- Sharkey S.W., Lesser J.R., Zenovich A.G., et al. Acute and reversible cardiomyopathy provoked by stress in women from the United States. Circulation 2005;111:472—479.
- Sato H., Tateishi H., Uchida T., et al. Tako-Tsubo–like left ventricular dysfunction due to multivessel coronary spasm. In: Kodama K, Haze K, Hori M, editors. Clinical aspect of myocardial injury: from ischemia to heart failure (in Japanese). Tokyo: Kagakuhyoronsha Publishing Co; 1990. p.56—64.
- Sharkey S.W., Lesser J.R., Maron M.S., Maron B.J. Why not just call it Tako-Tsubo cardiomyopathy: a discussion of nomenclature. J Am Coll Cardiol 2011;57;1496—1497.
- Tsuchihashi K., Ueshima K., Uchida T., et al. Transient left ventricular apical ballooning without coronary artery stenosis: a novel heart syndrome mimicking acute myocardial infarction. Angina Pectoris–Myocardial Infarction Investigations in Japan. J Am Coll Cardiol 2001;38:11—18.
- Abe Y., Kondo M., Matsuoka R., et al. Assessment of clinical features in transient left ven-tricular apical ballooning. J Am Coll Cardiol 2003;41:737—742.
- Seth P.S., Aurigemma G.P., Krasnow J.M., et al. A syndrome of transient left ventricular apical wall motion abnormality in the absence of coronary disease: a perspective from the United States. Cardiology 2003;100:61—66.
- Bybee K.A., Prasad A., Barsness G.W., et al. Clinical characteristics and thrombolysis in myocardial infarction frame counts in women with transient left ventricular apical ballooning syndrome. Am J Cardiol 2004;94:343—346.
- Bybee K.A., Kara T., Prasad A., et al. Systematic review: transient left ventricular apical ballooning: a syndrome that mimics ST-segment elevation myocardial infarction.Ann Intern Med 2004;141:858—865.
- Sharkey S.W., Shear W., Hodges M., Herzog C.A. Reversible myocardial contraction abnormalities in patients with an acute noncardiac illness. Chest 1998;114:98—105.
- Sharkey S.W., Lesser J.R., Zenovich A.G., et al. Acute and reversible cardiomyopathy provoked by stress in women from the United States. Circulation 2005;111:472—479.
- Dib C., Asirvatham S., Elesber A., et al. Clinical correlates and prognostic significance of electrocardiographic abnormalities in apical ballooning syndrome (Takotsubo/stress-induced cardiomyopathy). Am Heart J 2009;157:933—938.
- Bybee K.A., Prasad A. Stress-Related Cardiomyopathy Syndromes. Circulation 2008;118;397—409.
- Parodi G., Del Pace S., Salvadori C., et al. Tuscany Registry of Tako-Tsubo Cardiomyopathy. Left ventricular apical ballooning syndrome as a novel cause of acute mitral regurgitation. J Am Coll Cardiol 2007;50:647—649.
- Hashimoto A., Tsuchihashi K., Takuji Y., et al. Clinical implications of mid-ventricular obstruction and intravenous propranolol use in patients with transient left ventricular apical ballooning, so-called Tako-Tsubo cardiomyopathy. J Am Coll Cardiol 2007;49(Suppl A):93A.
- Ohba Y., Takemoto M., Nakano M., et al. Takotsubo cardiomyopathy with left ventricular outflow tract obstruction. Int J Cardiol 2006;107:120—122.
- Taylor J.S.W., Purnell R., Yousef Z.R. Acquired left ventricular outflow tract obstruction and cardiogenic shock treated with β-blockers. Am J Emergency Med 2009;27:373.e1—373.e3.
Синдром такоцубо: значение эхокардиографии
В обзоре анализируются диагностические и прогностические возможности эхокардиографии (ЭхоКГ) у больных с синдромом такоцубо. Даны характеристики особенностей нарушений локальной сократимости ЛЖ и основных вариантов преходящих нарушений локальной сократимости при синдроме такоцубо. Подробно анализируются изменения показателей деформации левого и правого желудочков у больных с синдромом такоцубо в остром периоде и при динамическом наблюдении. Представлен спектр осложнений синдрома такоцубо, в выявлении которых ЭхоКГ играет ведущую роль. Анализируются состояния и эхокардиографические показатели, неблагоприятные для прогноза у больных с синдромом такоцубо.
Ключевые слова
Об авторе
ФГБУ «Центральная клиническая больница с поликлиникой» Управления делами Президента Российской Федерации
Россия
Список литературы
1. Sato H., Tateishi H., Uchida T. Takotsubo-type cardiomyopathy due to multivessel spasm, in: K. Kodama, K. Haze, M. Hon (Eds.), Clinical aspect of myocardial injury: from ischemia to heart failure, Kagakuhyouronsha, Tokyo, Japan,1990, pp. 56-64.
2. Elliott P., Andersson B., Arbustini E. et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2008;29 (2):270-276.
4. Bybee K. A., Prasad A., Barsness G. W. et al. Clinical characteristics and thrombolysis in myocardial infarction frame counts in wom en with transient left ventricular apical ballooning syndrome. Am J Cardiol 2004;94 (3):343-346.
5. Deshmukh A., Kumar G., Pant S., et al. Prevalence of Takotsubo cardiomyopathy in the United States. Am Heart J 2012;164 (1):66- e1. doi: 10.1016/j.ahj.2012.03.020.
6. Murugiah K., Wang Y., Desai N. R. et al. Trends in Short- and Long-Term Outcomes for Takotsubo Cardiomyopathy Among Medicare Fee-for-Service Beneficiaries, 2007 to 2012. JACC Heart Fail 2016;4 (3):197-205. doi: 10.1016/j.jchf.2015.09.013.
7. Певзнер Д. В., Акашева Д., Жукова Н. С. и др. Синдром «разбитого сердца», или кардиомиопатия такоцубо. Терапевтический архив 2010;82 (9):72-77
8. Буткевич Н. М., Долгатова К. С., Ходырева М. В., Горбаченков А. А. Стресс-индуцированная кардиомиопатия при отсутствии жалоб. Клиницист 2012;3-4:49-53
9. Седов В. П., Гиляров М. Ю., Сафарова М. С. Лучевая диагностика стресс-индуцированной кардиомиопатии (синдром тако-цубо). Российский электронный журнал лучевой диагностики 2013;3 (l):69-75
10. Литвиненко Р. И., Шуленин С. Н., Куликов А. Н. и др. О дифференциальной диагностике транзиторной ишемии миокарда - такоцубо-кардиомиопатии. Вестник Российской военно-медицинской академии 2013;41 (1):84-93
11. Зелтынь-Абрамов Е. М., Артюхина Л. Ю., Белавина Н. И. и др. Кардиомиопатия такоцубо у пациента на программном гемодиализе (наблюдение из практики и обзор литературы). Нефрология и диализ 2015;17 (2):210-215
13. Sharkey S. W., Windenburg D. C., Lesser J. R. et al. Natural history and expansive clinical profile of stress (takotsubo) cardiomyopathy. J Am Coll Cardiol 2010;55 (4):333-341.
14. Redfors B., Vedad R., Angeras O. et al. Mortality in takotsubo syndrome is similar to mortality in myocardial infarction. A report from the SWEDEHEART1 registry. Int J Cardiol 2015;185:282-292.
15. Schneider B., Athanasiadis A., Schwab J. et al. Complications in the clinical course of tako-tsubo cardiomyopathy. Int J Cardiol 2014;176:199-205.
16. Templin C., Ghadri J. R., Diekmann J. et al. Clinical features and outcomes of takotsubo (stress) cardiomyopathy. N Engl J Med 2015;373 (10):929-938.
17. Citro R., Rigo F., DAndrea A., et al. Echocardiographic correlates of acute heart failure, cardiogenic shock, and in-hospital mortality in tako-tsubo cardiomyopathy. JACC Cardiovasc Imaging 2014;7:119-129.
18. Villarroel A. H., Vitola J. V., Stier A. L. et al. Takotsubo or stress cardiomyopathy: role of nuclear cardiology using (123) I-MIBG. Expert Rev Cardiovasc Ther 2009;7:847-852.
20. Citro R., Rigo F., Ciampi Q. et al. Echocardiographic assessment of regional left ventricular wall motion abnormalities in patients with tako-tsubo cardiomyopathy: comparison with anterior myocardial infarction. Eur J Echocardiogr 2011;12 (7):542-549. doi: 10.1093/ejechocard/j er059.
21. Heggemann F., Weiss C., Hamm K. et al. Global and regional myocardial function quantification by two-dimensional strain in Takotsubo cardiomyopathy. Eur J Echocardiogr 2009; 10 (6):760-764. doi: 10.1093/ejechocard/jep062.
22. Citro R., Pontone G., Pace L. et al. Contemporary Imaging in Takotsubo Syndrome. Heart Fail Clin 2016;12 (4):559-575. doi: 10.1016/j.hfc.2016.06.005.
23. Mansencal N., Abbou N., Pillière R. et al. Usefulness of two-dimensional speckle tracking echocardiography for assessment of Tako-Tsubo cardiomyopathy. Am J Cardiol 2009;103 (7):1020-1024. doi: 10.1016/j.amjcard.2008.12.015.
24. Heggemann F., Hamm K., Kaelsch T. et al. Global and regional myocardial function quantification in Takotsubo cardiomyopathy in comparison to acute anterior myocardial infarction using twodimensional (2D) strain echocardiography. Echocardiography 2011;28 (7):715-719. doi: 10.1111/j.1540-8175.2011.01430.x.
25. Hurst R. T., Prasad A., Askew J. W. 3rd et al. Takotsubo cardiomyopathy: a unique cardiomyopathy with variable ventricular morphology. JACC Cardiovasc Imaging 2010;3 (6):641-649. doi: 10.1016/j.jcmg.2010.01.009.
26. Eitel I., von Knobelsdorff-Brenkenhoff F., Bernhardt P. et al. Clinical characteristics and cardiovascular magnetic resonance findings in stress (takotsubo) cardiomyopathy. JAMA 2011;306 (3):277-286. doi: 10.1001/jama.2011.992.
27. Kurowski V., Kaiser A., von Hof K. et al. Apical and midventricu-lar transient left ventricular dysfunction syndrome (tako-tsubo cardiomyopathy): frequency, mechanisms, and prognosis. Chest 2007;132 (3):809-816.
28. Ramaraj R., Movahed M. R. Reverse or inverted takotsubo cardiomyopathy (reverse left ventricular apical ballooning syndrome) presents at a younger age compared with the mid or apical variant and is always associated with triggering stress. Congest Heart Fail 2010;16 (6):284-286. doi: 10.1111/j.1751-7133.2010.00188.x.
29. Citro R., Lyon A. R., Meimoun P. et al. Standard and advanced echocardiography in takotsubo (stress) cardiomyopathy: clinical and prognostic implications. J Am Soc Echocardiogr 2015;28 (1):57-74. doi: 10.1016/j.echo.2014.08.020.
30. Kim S. A., Jo S. H., Park K. H. et al. Functional recovery of regional myocardial deformation in patients with takotsubo cardiomyopathy. J Cardiol 2016. pii: S0914-5087 (16) 30215-5. doi: 10.1016/j.jjcc.2016.09.006.
31. Hung M.J., Kao Y. C., Chen W. S. et al. Layer-specific quantification of myocardial deformation in sepsis-induced Takotsubo cardiomyopathy: Three case reports of a serial 2-dimensional speckle-tracking echocardiographic study. Medicine (Baltimore) 2016;95 (44):e5250.
32. Neil C.J., Nguyen T. H., Singh K. et al. Relation of delayed recovery of myocardial function after takotsubo cardiomyopathy to subsequent quality of life. Am J Cardiol 2015;115 (8):1085-1089. doi: 10.1016/j.amjcard.2015.01.541.
34. Citro R., Rigo F., Previtali M. et al. Differences in clinical features and in-hospital outcomes of older adults with tako-tsubo cardiomyopathy. J Am Geriatr Soc 2012;60 (1):93-98. doi: 10.1111 /j.1532-5415.2011.03730.x.
35. Sharkey S. W., Windenburg D. C., Lesser J. R. et al. Natural history and expansive clinical profile of stress (tako-tsubo) cardiomyopathy. J Am Coll Cardiol 2010;55 (4):333-341. doi: 10.1016 /j.jacc.2009.08.057.
37. Tsuchihashi K., Ueshima K., Uchida T. et al.; Angina Pectoris-Myocardial Infarction Investigations in Japan. Transient left ventricular apical ballooning without coronary artery stenosis: a novel heart syndrome mimicking acute myocardial infarction. Angina Pectoris-Myocardial Infarction Investigations in Japan. J Am Coll Cardiol 2001;38 (1):11-18.
38. Madhavan M., Rihal C. S., Lerman A., Prasad A. Acute heart failure in apical ballooning syndrome (TakoTsubo/stress cardiomyopa thy): clinical correlates and Mayo Clinic risk score.J Am Coll Cardiol 2011;57 (12):1400-1401. doi: 10.1016/j.jacc.2010.10.038.
39. El Mahmoud R., Mansencal N., Pilliére R. et al. Prevalence and characteristics of left ventricular outflow tract obstruction in Tako-Tsubo syndrome. Am Heart J 2008;156 (3):543-548. doi: 10.1016/j.ahj.2008.05.002.
40. Chockalingam A., Xie G. Y., Dellsperger K. C. Echocardiography in stress cardiomyopathy and acute LVOT obstruction. Int J Cardiovasc Imaging 2010;26 (5):527-535. doi: 10.1007/s10554-010-9590-7.
41. Merli E., Sutcliffe S., Gori M., Sutherland G. G. Tako-Tsubo cardiomyopathy: new insights into the possible underlying pathophysiology. Eur J Echocardiog 2006;7 (1):53-61.
42. Parodi G., Bellandi B., Del Pace S. et al.; Tuscany Registry of Tako-Tsubo Cardiomyopathy. Natural history of tako-tsubo cardiomyopathy. Chest 2011;139 (4):887-892. doi: 10.1378 /chest.10-1041.
43. Izumo M., Nalawadi S., Shiota M. et al. Mechanisms of acute mitral regurgitation in patients with takotsubo cardiomyopathy: an echo-cardiographic study. Circ Cardiovasc Imaging 2011;4 (4):392-398. doi: 10.1161/CIRCIMAGING.110.962845.
45. Shah B. N., Curzen N. P. Reversible systolic anterior motion of the mitral valve and left ventricular outflow tract obstruction in association with Takotsubo syndrome. Echocardiography 2011;28 (8):921-924. doi: 10.1111/j.1540-8175.2011.01446.x.
46. Kyuma M., Tsuchihashi K., Shinshi Y. et al. Effect of intravenous propranolol on left ventricular apical ballooning without coronary artery stenosis (ampulla cardiomyopathy): three cases. Circ J 2002;66 (12):1181-1184.
47. Elesber A. A., Prasad A., Bybee K. A. et al. Transient cardiac apical ballooning syndrome: prevalence and clinical implications of right ventricular involvement. J Am Coll Cardiol 2006;47 (5):1082-1083.
48. Citro R., Bossone E., Parodi G. et al.; Tako-tsubo Italian Network Investigators. Independent Impact of RV Involvement on In-Hospital Outcome of Patients With Takotsubo Syndrome. JACC Cardiovasc Imaging 2016;9 (7):894-895. doi: 10.1016 / j.jcmg.2015.06.005.
49. Heggemann F., Hamm K., Brade J. et al. Right ventricular function quantification in Takotsubo cardiomyopathy using two-dimensional strain echocardiography. PLoS One 2014;9 (8):e103717.doi: 10.1371 / j ournal.pone.0103717.
50. Vizzardi E., Bonadei I., Piovanelli B. et al. Biventricular Tako-Tsubo cardiomyopathy: usefulness of 2D speckle tracking strain echocardiography. J Clin Ultrasound 2014;42 (2):121-124. doi: 10.1002/jcu.22066.
51. Citro R., Caso I., Provenza G. et al. Right ventricular involvement and pulmonary hypertension in an elderly woman with tako-tsubo cardiomyopathy. Chest 2010;137 (4):973-975. doi: 10.1378/chest.09-0923.
52. Haghi D., Papavassiliu T., Heggemann F. et al. Incidence and clinical significance of left ventricular thrombus in tako-tsubo cardiomyopathy assessed with echocardiography. QJM 2008;101 (5):381-386. doi: 10.1093/qjmed/hcn017.
54. Buchholz S., Ward M. R., Bhindi R. et al. Cardiac thrombi in stress (tako-tsubo) cardiomyopathy: more than an apical issue? Mayo Clin Proc 2010;85 (9):863-864. doi: 10.4065/mcp.2010.0231.
55. El-Battrawy I., Behnes M., Hillenbrand D. et al. Prevalence, Clinical Characteristics, and Predictors of Patients with Thromboembolic Events in Takotsubo Cardiomyopathy. Clin Med Insights Cardiol 2016;10:117-122. doi: 10.4137/CMC.S38151.
56. Citro R., Lyon A. R., Silverio A., Bossone E. Bubbles in Ballooning: Safety and Utility. J Am Soc Echocardiogr 2015;28 (7):845. doi: 10.1016/j.echo.2015.04.013.
57. Eitel I., Lücke C., Grothoff M. et al. Inflammation in takotsubo cardiomyopathy: insights from cardiovascular magnetic resonance imaging. Eur Radiol 2010;20 (2):422-431. doi: 10.1007/s00330-009-1549-5.
59. Yeh R. W., Yu P. B., Drachman D. E. Takotsubo cardiomyopathy complicated by cardiac tamponade: classic hemodynamic findings with a new disease. Circulation 2010;122 (12):1239-1241. doi: 10. 1161 /CIRCULATIONAHA.110.955633.
60. Sharkey S. W. A Clinical Perspective of the Takotsubo Syndrome. Heart Fail Clin 2016;12 (4):507-520. doi: 10.1016/j. hfc.2016.06.003.
62. Lee J. W., Kim J. Y. Stress-induced cardiomyopathy: the role of echocardiography. J Cardiovasc Ultrasound 2011;19 (1):7-12. doi: 10.4250/jcu.2011.19.1.7.
Кардиомиопатия Такоцубо: клинический случай
Ключевые слова: кардиомиопатия Такоцубо, дисфункция верхушечных сегментов, транзиторный гипокинез верхушечных сегментов, синдром апикального баллонирования, стресс-индуцированная кардиомиопатия.
Для цитирования: Азизова Д.Д., Алдабергенова А.М., Жумабай К.Т. и др. Кардиомиопатия Такоцубо: клинический случай. РМЖ. 2021;9:36-38.
Takotsubo cardiomyopathy: a clinical case
D.D. Azizova, A.M. Aldabergenova, K.T. Zhumabai, G.B. Kanafina, Zh.R. Turgambayeva
Astana Medical University, Nur-Sultan, Kazakhstan
Takotsubo cardiomyopathy belongs to the group of heterogeneous diseases. It is a primary acquired stress-induced syndrome resulting from dysfunction of myocardial mid- and apical segments in the setting of resting global left ventricular contractility or hyperkinesis of the basal segments. This cardiomyopathy occurs in 1–2% of all patients with acute coronary syndrome signs, mainly in postmenopausal women without significant atherosclerotic coronary artery lesions. Clinical manifestations are similar to the myocardial infarction symptoms, and therefore, diagnosis establishment is somewhat complicated. Medical treatment commonly includes standard therapy used for myocardial infarction and heart failure since Takotsubo cardiomyopathy is complicated by the occurrence of heart failure in almost half of cases. Therapy duration is 1 to 4 weeks, during which the contractile function of the heart restores in most cases. The prognosis is commonly favorable. The article presents a clinical case of a female patient with Takotsubo cardiomyopathy. This is the first recorded case on the territory of Kazakhstan. The clinical picture, stages of diagnosis and complications in diagnosis establishment are described.
Keywords: Takotsubo cardiomyopathy, apical segmental dysfunction, transient apical hypokinesis, apical ballooning syndrome, stress-induced cardiomyopathy.
For citation: Azizova D.D., Aldabergenova A.M., Zhumabai K.Т. et al. Takotsubo cardiomyopathy: a clinical case. RMJ. 2021;9:36–38.
Введение
Кардиомиопатия Такоцубо («синдром разбитого сердца», стресс-индуцированная кардиомиопатия, синдром апикального баллонирования) — это острый обратимый синдром сердечной недостаточности, которая представляет собой доброкачественное состояние, возникающее из-за дисфункции верхушки и средних сегментов миокарда на фоне относительно сохранной сократимости или гиперкинеза базальных сегментов. Дословно с японского языка «Такоцубо» — «ловушка (горшок) для ловли осьминогов». Такое название связано с типичной формой левого желудочка (ЛЖ) по данным эхокардиографии (ЭхоКГ). Причины данного состояния до сих пор не ясны, но частыми провоцирующими факторами являются физический и эмоциональный стресс [1].
Синдром Такоцубо диагностируется у 1,0–2,5% всех пациентов, госпитализированных в стационар с симптомами острого коронарного синдрома (ОКС) [2]. В большинстве случаев встречается у женщин в постменопаузальном периоде [3]. Развитие кардиомиопатии Такоцубо имеет сезонную и суточную вариабельность, чаще он возникает в летнее время года и ранние утренние часы [4]. В возрасте 30–32 лет чаще выявляется частичный (апикальный) вариант кардиомиопатии. Клиническими проявлениями данного состояния являются загрудинная боль и/или одышка, что выявляется при ишемической болезни сердца (ИБС), в связи с чем требуется проведение тщательной дифференциальной диагностики. Использование комбинации диагностических методов, таких как электрокардиография (ЭКГ), анализ крови на биомаркеры повреждения миокарда, ЭхоКГ, коронарная ангиография и магнитно-резонансная томография сердца с гадолинием, позволяет повысить точность диагностики этого заболевания [2].
Диагностика синдрома Такоцубо всегда затруднительна, так как клиническая картина острой фазы неотличима от симптомов ОКС с подъемом или без подъема сегмента ST [5]. Еще одной сложностью для постановки правильного диагноза является редкость данного заболевания в мире, отсутствие клинической настороженности, особенно в Казахстане, о чем свидетельствует отсутствие статистических данных. Однако при выявлении у пациента транзиторного баллоноподобного расширения средней части верхушки сердца, сопровождающегося одновременной гиперкинезией базальных сегментов ЛЖ, и при отсутствии гемодинамически значимого стеноза коронарных артерий необходимо учитывать и данную кардиомиопатию.
В связи с отсутствием клинических рандомизированных исследований не имеется четких рекомендаций по введению пациентов с синдромом Такоцубо. Таким образом, при лечении данного состояния опираются на клинический опыт и мнение консилиума экспертов. Медикаментозная терапия на начальном этапе лечения кардиомиопатии Такоцубо обычно включает стандартную терапию, используемую при ОКС, в частности назначаются ацетилсалициловая кислота, гепарин натрия, при необходимости морфин и кислородотерапия. С учетом транзиторного характера синдрома Такоцубо, при отсутствии других показаний обычно данные препараты не назначаются на продолжительное время. Длительность лечения в среднем составляет 1–4 нед. У большинства пациентов в течение этого периода наблюдается полное восстановление функции миокарда ЛЖ. По данным литературы [6], прием ингибиторов ангиотензинпревращающего фермента (АПФ) или блокаторов рецепторов ангиотензина в большей степени препятствовал развитию рецидива, чем назначение β-адреноблокаторов.
Пациенты с кардиогенным шоком или после остановки сердца требуют проведения интенсивной терапии. У части пациентов выявляется удлинение интервала QT, что может служить причиной развития злокачественной желудочковой аритмии типа torsades de pointes, а также регистрируется атриовентрикулярная блокада разных градаций [5].
Прогноз пациентов с кардиомиопатией Такоцубо в целом благоприятный [7]. Функция миокарда ЛЖ может начать восстанавливаться через несколько дней и полностью восстанавливается в течение 2–4 нед. [8].
Клиническое наблюдение
Больная Ч. 1969 г. р. доставлена в городскую многопрофильную больницу № 2 г. Нур-Султан с типичной клиникой ОКС: боли за грудиной давящего характера в покое, длительностью более 1 ч.
Из анамнеза заболевания: в течение нескольких лет страдает артериальной гипертонией, но базисную терапию не принимает. На фоне психоэмоционального напряжения (семейные проблемы) внезапно возникли вышеописанные жалобы, в связи с чем была вызвана скорая медицинская помощь (СМП). Бригадой СМП снята ЭКГ (рис. 1): ритм синусовый с частотой сердечных сокращений (ЧСС) 78 в 1 мин, нормальное положение электрической оси сердца, отрицательные зубцы Т в отведениях I, aVL, V4–V6, сглаживание зубцов Т в отведениях II, V3, удлинение интервала QT. Диагностирован ОКС без подъема сегмента ST, оказана помощь по соответствующему протоколу, пациентка была доставлена в больницу для проведения коронарографии и решения вопроса о дальнейшей тактике лечения.
В приемном покое: при повторной регистрации ЭКГ (рис. 2) выявлено углубление отрицательных зубцов Т, сохранение удлинения интервала QT (корригированный QT составил 460 мс). Отмечено повышение уровня высокочувствительного тропонина до 0,57 нг/мл, с нарастанием в динамике до 1,01 нг/мл. Кроме того, определен высокий уровень ProBNP, который составил 1020 нг/мл. С учетом клинических данных, результатов лабораторно-инструментальных методов обследования пациентке был выставлен диагноз инфаркта миокарда без подъема сегмента ST, она была направлена на экстренную коронарографию.
При осмотре: состояние тяжелое, стабильное. Кожные покровы и видимые слизистые оболочки физиологической окраски, умеренной влажности. Индекс массы тела — 29 кг/м 2 (рост 156 см, масса тела 72 кг). В легких дыхание везикулярное, проводится во все отделы, хрипы не выслушиваются. Частота дыхательных движений — 17 в 1 мин. Тоны сердца ритмичные, приглушены. Артериальное давление — 110/80 мм рт. ст., ЧСС — 64 в 1 мин. Пульс ритмичный, удовлетворительного наполнения. Живот мягкий, безболезненный во всех отделах, печень не увеличена. Отеков нет.
Лабораторные данные: в общем анализе крови выявлен незначительный лейкоцитоз (10,4×10 9 /л), показатели липидного и гликемического спектра — в пределах нормальных значений.
По данным ЭхоКГ обнаружен выраженный акинез апикального сегмента с распространением на переднебоковой сегмент, не исключена аневризма верхушки сердца. Снижение систолической функции ЛЖ — фракция выброса (ФВ) до 35%.
При коронарографии атеросклеротического поражения коронарных артерий не выявлено.
В динамике отмечено снижение уровня ProBNP до 550 нг/мл. При повторной ЭхоКГ через 2 сут отмечено улучшение систолической функции ЛЖ (ФВ выброса возросла до 42%). Зона акинеза значительно уменьшилась, признаков аневризмы верхушки сердца нет.
Таким образом, с учетом наличия типичной клиники ОКС, развившегося на фоне психоэмоционального стресса, признаков повреждения и дисфункции миокарда ЛЖ, отсутствия атеросклеротического поражения коронарных артерий, а также специфических транзиторных изменений по данным ЭхоКГ предварительно выставленный диагноз инфаркта миокарда без подъема ST был изменен и выставлен диагноз «Кардиомиопатия Такоцубо».
Для постановки данного диагноза были использованы следующие международные диагностические критерии [9]:
Транзиторный гипокинез, дискинез или акинез с вовлечением верхушки или без него.
Предшествующий этому состоянию психический или травмирующий фактор (необязательно).
Отсутствие предшествующей травмы головы, внутричерепного кровоизлияния, гипертрофической кардиомиопатии, феохромоцитомы.
Изменения на ЭКГ (элевация, депрессия сегмента ST и/или инверсия зубца Т, а также удлинение интервала QTс).
Незначительное повышение уровня тропонина и креатинфосфокиназы, а также натрийуретического пептида.
Отсутствие обструкции коронарной артерии, ангиографического свидетельства отрыва атеросклеротической бляшки.
Отсутствие ранее перенесенного миокардита.
Преобладание у женщин в постменопаузальном периоде.
Пациентке была назначена кардиопротективная терапия: ингибиторы АПФ, β-адреноблокаторы, антагонист рецепторов альдостерона.
Заключение
При проведении дифференциальной диагностики ОКС необходимо учитывать вероятность наличия у пациента синдрома Такоцубо. Как в приведенном клиническом наблюдении, так и при инфаркте миокарда пусковым механизмом является стресс, но генез его развития различен. В основе развития кардиомиопатии Такоцубо лежит нейрогенный механизм [5]: в ответ на стресс происходит высвобождение катехоламинов (адреналина и норадреналина), инициированное когнитивными центрами головного мозга путем активации гипоталамо-гипофизарно-надпочечниковой системы. Тем самым происходит нарушение иннервации апикальных, средних сегментов ЛЖ, приводящее к транзиторной систолической дисфункции и обширной зоне акинезии. В основе генеза инфаркт миокарда 2-го типа лежит спазм коронарных сосудов, и, как следствие, развивается недостаточный приток крови к ишемизированному миокарду ЛЖ. Несмотря на различные механизмы развития данных состояний, схожесть клиники и сложность дифференциальной диа-
гностики затрудняют постановку диагноза кардиомиопатии Такоцубо. Малая распространенность, отсутствие крупных рандомизированных исследований обусловливают отсутствие протоколов лечения.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
3 марта 2017 г. на очередной конференции Кардиологического центра мц ЭРЕБУНИ был представлен клинический случай пациентки с кардиомиопатией Такотсубо. С докладом выступила кардиолог Отделения неотложной кардиологии Флора Мурадян.
Понятие Кардиомиопатия Такотсубо было представлено кардиологической общественности впервые в 1990г. в Японии, а уже на Конгрессе европейских кардиологов в 2006г. в Барселоне была представлена как самостоятельная назология - как вариант кардиомиопатии. В переводе с японского Takotsubo означает ”ловушка для осьминога”. При данной патологии сердечная мышца расширяется и сердце по своей форме становится похожей на сосуд (кувшин для вина). рис.1
Рис.1.”Ловушка” для осьминонов.
Патология встречается, в основном, у женщин среднего и пожилого возраста после перенесенного тяжелого стресса. Отсюда и другие названия: Transient apical ballooning, Stress-induced cardiomyopathy, Stress cardiomyopathy, “ampulla” cardiomyopathy, Neurogenic myocardial stunning, Broken heart syndrome - “синдром разбитого сердца”.
В основе патогенеза лежит увеличение концентрации катехоламинов в крови, причем в несколько раз больше, чем во время острого инфаркта миокарда, что приводит к спазму коронарной артерии, к нарушению микроциркуляции и гибели кардиомиоцитов (Y. J. Akashi 2003, Wittstein 2005). Биопсия выявляет признаки интоксикации катехоламинов: накопление внутриклеточных гликогенов, увеличение вакуолей, увеличение количества белков во внеклеточном матриксе при отсутствии миокардита.
Эпидемиология: чаще всего встречается у женщин >55 (70-90%), в менопаузе риск заболеваемости возрастает почти в 5 раз. Возможно также проявление болезни у подростков 14-16 лет, поскольку их организм не слишком адаптирован к стрессу. Общий процент данной патологии от всех сердечных случаев 2%.
Клиника: В 60% случаев наблюдается острая боль в загрудинной области, одышка (в 30% случаев), потеря сознания, различные нарушения сердечного ритма, остановка сердца, развитие острой застойной недостаточности кровообращения (систолическая дисфункция, митральная регургитация III- IV0, вплоть до кардиогенного шока), развитие тромба ЛЖ и тромбоэмболических осложнений.
Диагностика основывается на клинической картине, ЭКГ, ЭХОКГ, концентрации биомаркеров и катехоламинов, а также на КАГ (коронароангиография).
• Элевация ST-сегмента в грудных отведениях.
•Удлинение QT-интервала с инверсией T-зубца.
•Скорейшее восстановление ЭКГ-изменений в течение 2-3 недель
Рис.2. ЭКГ и вентрикулография при Takotsubo кардиомиопатии
.Рис.3. ЭКГ дифференциальная диагностика между Takotsubo кардиомиопатией и остром инфаркте миокарда передней локализации.
БИОМАРКЕРЫ И КАТЕХОЛАМИНЫ. Уровень биомаркеров высокой сердечной чувствительности намного ниже, чем при инфаркт миокарда данного объема. Концентрация катехоламинов в крови намного выше, чем при остром инфаркте миокарда, однако надо исключить феохромоцитому и миокардиты.
ЭХОКГ выявляет акинез или дискинез верхушечных и/или средних сегментов ЛЖ, гиперкинез базальных сегментов ЛЖ, вследствие чего возможна, также, обструкция выносящего тракта ЛЖ, сегментарное либо тотальное расширение полости ЛЖ, снижение ФВ ЛЖ от 50% в течение 4-8 недель. (Рис. 4).
Рис. 4. Двухмерная ЭХОКГ-картина Takotsubo кардиомиопатии.
Коронароангиография выявляет отсутствие гемодинамически значимых сужений коронарных артерий, вентрикулография выявляет полиморфизм движения стенок ЛЖ в фазы наполнения и опорожнения (Рис.5.)
Рис.5. Вентрикулография при Takotsubo кардиомиопатии.
Лечение. Конкретных гайдлайнов в лечении Такоцубо кардиомиопатии нет. В остром периоде проводится лечение аналогичное лечению при остром инфаркте миокарда - анальгетики, транквилизаторы, антиагреганты, ACEI, β-блокаторы, мочегонные, инотропные препараты, но в случае обструкции выносящего тракта ЛЖ противопоказаны инотропные препараты.
КЛИНИЧЕСКИЙ СЛУЧАЙ
14.11.2016г. в мц ЭРЕБУНИ поступила больная С.А., 1956г. рожд., с жалобами на боли в области грудной клетки, одышку.
В анамнезе: По данным ЭКГ-элевация сегмента ST в отведениях V1-V5. ЭХОКГ (от 14.11.16г.) - гипертрофия миокарда ЛЖ, дилатация левых полостей: ЛП 4,2 см, ЛЖ 5,7 см. Аорта уплотнена, в восходящем отделе расширена - 4,1см. Акинез и гипокинез всех передне-перегородочных сегментов ЛЖ. Сократимость миокарда снижена. ФВ ЛЖ - 27-28%: Доплер: митральная регургитация III ст., аортальная регургитация II ст., легочная гипертензия II ст., систолическое давление в легочной артерии Pmax PA 77mm Hg.
В результате обследований был поставлен диагноз: ИБС: Острый инфаркт миокарда передней стенки ЛЖ с подъемом сегмента ST.
В стационаре у больной было отмечено развитие острой недостаточности левого желудочка, которая была компенсирована медикаментозно. Лечение было проведено, как при остром инфаркте миокарда, и была выписана с улучшением. После стабилизации состояния, больной было рекомендовано коронароангиография, от которой она отказалась. Однако 30.11.2016г. больная вновь обратилась в МЦ ЭРЕБУНИ с целью проведения ангиогрфии - со стороны коронарных артерий атеросклеротических изменений не было выявлено.
После повторного ЭхоКГ (16.03.2017г.) было выявлено: Гипертрофия миокарда ЛЖ, дилатация левых полостей: ЛП 4,2 см, ЛЖ 5,6 см. Аорта уплотнена, в восходящем отделе расширена - 3,9 см. Сократимость миокарда снижена. ФВ - 42%. Сократимость правого желудочка сохранна. TAPSE>1,8см. Нижняя полая вена коллабирует.
Доплер: митральная регургитация II ст., аортальная регургитация IIст., регургитация легочной артерии IIст., легочной гипертензии не было. В сравнении с предыдущими ЭхоКГ ФВ ЛЖ выросла неадекватно, т.к. у больной наблюдалась клапанная недостаточность.
Исходя из клинико-лабораторных и инструментальных исследований, был поставлен диагноз: Takotsubo. кардиомиопатия. митральная регургитация II ст., аортальная регургитация II ст., недостаточность клапанa легочной артерии II ст., Артериальная гипертензия. HFrecEF, НК ФК II (NYHA):
Важно отметить, что для установления более точного диагноза Takotsubo кардиомиопатия требуется определенный промежуток времени, что затрудняет своевременное диагностирование данной патологии, так как острый период протекает как острый инфаркт миокарда, а восстановление происходит за короткое время (на основе ЭКГ и ЭхоКГ-данных).
Кардиомиопатия Такотсубо, или стресс – индуцированная кардиомиопатия
Донецкая О.П., Тулупова В.А., Дзвониская В.Н., Бесшапошникова И.А.
Кардиомиопатия такотсубо была описана впервые в Японии в 1990 г. H. Satoh как преходящие нарушения сократимости миокарда. Классический вариант болезни сопровождается акинезом или дискинезом верхушки сердца с гиперкинезом базальных сегментов. Сердце при этом приобретает своеобразную конфигурацию: левый желудочек в острой фазе по форме напоминает песочные часы или японскую ловушку для осьминогов такотсубо — кувшин с узким горлышком и широким дном. Кадиомиопатия такотсубо – это обратимая дисфункция левого желудочка в ответ на физический или психический стресс, клинически и электрокардиографически напоминающая острый коронарный синдром, преимущественно у женщин в посменопаузе без значимого стеноза коронарных артерий, отличающаяся относительно благоприятным исходом.
Патогенез синдрома такотсубо полностью не известен. Для объяснения возможных механизмов развития КМПТ было предложено несколько гипотез: вазоспазм коронарных артерий, обструкция выводного тракта левого желудочка (ВТЛЖ), перегрузка катехоламинами, нейрогуморальные нарушения и дисфункция микроциркуляторного коронарного русла. Основной теорией развития кардиомиопатии на настоящий момент является токсическое действие повышенного уровня катехоламинов на миокард и избыточная симпатическая стимуляция. Воздействие эндогенного (эмоционального) или экзогенного (травма, хирургические операции или чрезмерная физическая нагрузка) стресса отмечают в преобладающем большинстве случаев развития кардиомиопатии. Данная взаимосвязь привела к предположению, что механизм развития кардиомиопатии может быть ассоциирован с воздействием симпатической нервной системы при стрессе.
Клиническая картина. Как описано российскими и зарубежными исследователями, симптомы, развивающиеся при кардиомиопатии, во многом совпадают с клинической картиной, наблюдаемой при остром инфаркте миокарда. Так, наиболее типичными клиническими признаками кардиомиопатии являются острое начало, приступ загрудинных болей или одышки, тогда как на электрокардиограмме наиболее часто наблюдаются подъемы сегмента ST, а в крови определяется повышение уровня креатинфосфокиназы, МВ-фракции креатинфосфокиназы и тропонина, а также гиперкатехоламинемия. В тех случаях, когда проводится эндомиокардиальная биопсия, гистологически определяются очаги миоцитолиза, инфильтрация мононуклеарами, а также некроз кардиомиоцитов по типу полос пересокращения при отсутствии признаков миокардита. При проведении эхокардиографии у таких пациентов определяются тяжелые нарушения сократимости миокарда левого желудочка. При этом на коронарографии у пациентов с кардиомиопатией отсутствуют значимые стенозы коронарных артерий. Необходимо отметить, что основным критерием для постановки диагноза КМПТ является полная обратимость нарушений сократимости миокарда. Изменения ЭКГ в острой фазе КМПТ развиваются примерно в 80–85 % случаев. Согласно рекомендациям по диагностике КМПТ, основными изменениями ЭКГ, характерными для КМПТ, являются подъемы сегмента ST, инвертированные зубцы Т, удлинение интервала QT и редкие реципрокные изменения либо их отсутствие. Наиболее часто среди изменений ЭКГ у пациентов с КМПТ встречаются подъемы сегмента ST в грудных отведениях (в отведениях V1–V4). Также с течением времени возможно появление отрицательных зубцов Т и патологических зубцов Q. Таким образом, особенностями течения КМП Такотсубо является: отсутствие значимой обструкции коронарных артерий; площадь акинезии не соответствует зоне, которая может кровоснабжаться одной коронарной артерией; колоссальная разница между объемом вовлеченного миокарда и степенью повышения ферментов; быстрая полная нормализация сократимости миокарда.
Основные критерии диагностики кардиомиопатии Такотсубо («модифицированные критерии клиники Мейо»):
1. Транзиторный гипокинез, дискинез и акинез средних сегментов левого желудочка с вовлечением верхушки или без такового, баллоноподобное расширение полости левого желудочка, не соответствующее зоне кровоснабжения какой – либо одной коронарной артерии, желателен физический или психический травмирующий фактор, предшествующий развитию этого состояния.
2. Отсутствие обструкции коронарных артерий или ангиографического свидетельства признаков острого разрыва атеросклеротической бляшки.
3. Появление изменений ЭКГ – элевация сегмента ST, возможна инверсия зубца Т.
4. Умеренное повышение тропонина
5. Отсутствие предшествующей травмы головы, внутричерепного кровоизлияния, гипертрофической кардиомиопатии, феохромоцитомы или миокардита.
Осложнения:
- Аритмии: АВ – блокады, синусовая брадикардия, фибрилляция предсердий, желудочковые тахикардия и фибрилляция
- Острая левожелудочковая недостаточность
- Образование тромба в верхушке ЛЖ и эмболии
Лечение: В настоящее время специфические методы лечения не разработаны. Четких критериев длительности терапии нет. Необходимо продолжить терапию до полного восстановления сердечной функции. В большинстве случаев пациенты с кардиомиопатией поступают в больницу с клиническими и лабораторными признаками острого инфаркта миокарда, до установления диагноза кардиомиопатии тактика их лечения определяется рекомендациями по лечению острого инфаркта миокарда с подъемом сегмента ST. После диагностирования кардиомиопатии такотсубо возможно переведение пациентов на поддерживающую медикаментозную терапию. В связи с тем, что синдром такотсубо сопровождается развитием преходящей дисфункции левого желудочка, пациентам показано лечение ингибиторами ангиотензинпревращающего фермента либо блокаторами рецепторов к ангиотензину II. У гемодинамически нестабильных пациентов необходимо исключать возможную обструкцию выходного тракта левого желудочка (ВТЛЖ), при наличии которой требуется назначение в-блокаторов. В связи с отсутствием исследований по негативному влиянию вазопрессоров при тяжелом течении кардиомиопатии таким пациентам также показана поддержка ионотропными препаратами. Некоторые исследователи считают, что длительное лечение в-блокаторами показано для предотвращения рецидивов кардиомиопатии. Однако данное заболевание является доброкачественным, в большинстве случаев заканчивающийся полным восстановлением функции левого желудочка через 2-4 недели после манифестирования симптомов.
Прогноз: 95 % пациентов прогноз благоприятный, в течение нескольких недель наблюдается полная обратная динамика изменений ЭКГ и ЭХО-КГ, повторные случаи крайне редкие 2,7%
Заключение: Таким образом, кардиомиопатия такотсубо относится к редким синдромам. Тем не менее можно предположить, что встречается данный синдром значительно чаще, чем описывается, что связано со сложностью его диагностики. Синдром такотсубо занимает важное место среди сердечно-сосудистых заболеваний. Связано это прежде всего с тем, что в остром периоде по клиническим характеристикам болезнь напоминает острый инфаркт миокарда. Чаще всего болезнь развивается после эмоционального стресса и сопровождается приступом загрудинной боли, подъемами сегмента ST на ЭКГ, а также нарушениями сократимости миокарда по данным ЭхоКГ. Показано, что из числа пациентов, поступающих в отделение неотложной кардиологии с предварительным диагнозом ОКС, 3 % впоследствии ставится диагноз кардиомиопатии такотсубо.
Читайте также:
