ЭхоКГ при субаортальном стенозе
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Links
- Espacenet
- Global Dossier
- Discuss
- 206010020871 Hypertrophic cardiomyopathy Diseases 0.000 title claims description 9
- 210000001308 Heart Ventricles Anatomy 0.000 claims abstract description 10
- 210000004165 Myocardium Anatomy 0.000 claims abstract description 5
- 230000005641 tunneling Effects 0.000 claims description 4
- 230000002861 ventricular Effects 0.000 claims description 4
- 238000002224 dissection Methods 0.000 abstract description 3
- 239000003814 drug Substances 0.000 abstract description 3
- 206010061255 Ischaemia Diseases 0.000 abstract 1
- 239000000126 substance Substances 0.000 abstract 1
- 239000012479 in-house spinning solution Substances 0.000 description 6
- 230000002612 cardiopulmonary Effects 0.000 description 3
- 238000002592 echocardiography Methods 0.000 description 3
- 238000000034 method Methods 0.000 description 3
- 238000001356 surgical procedure Methods 0.000 description 3
- 208000000059 Dyspnea Diseases 0.000 description 2
- 206010013975 Dyspnoeas Diseases 0.000 description 2
- 208000005907 Mitral Valve Insufficiency Diseases 0.000 description 2
- 206010027727 Mitral valve incompetence Diseases 0.000 description 2
- 206010033557 Palpitations Diseases 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 230000000250 revascularization Effects 0.000 description 2
- 230000035488 systolic blood pressure Effects 0.000 description 2
- 206010002383 Angina pectoris Diseases 0.000 description 1
- 210000000709 Aorta Anatomy 0.000 description 1
- 210000001765 Aortic Valve Anatomy 0.000 description 1
- 210000004115 Mitral Valve Anatomy 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 210000003516 Pericardium Anatomy 0.000 description 1
- 210000003105 Phrenic Nerve Anatomy 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- 230000001154 acute Effects 0.000 description 1
- 230000016571 aggressive behavior Effects 0.000 description 1
- 230000000271 cardiovascular Effects 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 229940079593 drugs Drugs 0.000 description 1
- 235000013666 improved nutrition Nutrition 0.000 description 1
- 230000003601 intercostal Effects 0.000 description 1
- 230000000302 ischemic Effects 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 230000000414 obstructive Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 230000002980 postoperative Effects 0.000 description 1
- 201000010874 syndrome Diseases 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
Images
Abstract
Изобретение относится к медицине, а именно к кардиохирургии. Выполняют иссечение межжелудочковой перегородки из одной входной точки на левом желудочке на работающем сердце с помощью тубусного скальпеля. Дополнительно проводят туннелирование миокарда левого желудочка. Способ позволяет снять субаортальный ишемический синдром без применения искусственного кровообращения на работающем сердце по закрытой методике. 2 ил.
Description
Изобретение относится к медицине и может быть использовано при хирургических операциях на сердце при лечении идиопатического гипертрофического субаортального стеноза /ИГСС/.
В настоящее время методика хирургического лечения ИГСС включает выполнение операции в условиях искусственного кровообращения /ИК/ в виде П-образной септэктомии по Морроу или протезировании митрального клапана по Шумахеру. Операции достаточно cложные /Ю.М.Ишенин, 1981/.
Наиболее близким является способ хирургического лечения ИГСС, проводимый в условиях ИК, при которой после вскрытия аорты производят продольные насечки межжелудочковой перегородки, что ведет к ее релаксации и уменьшению подклапанной обструкции и градиента систолического давления (В.И.Бураковский. Сердечно-сосудистая хирургия. - М.: Медицина, с. 287). Однако этот способ, используя ИК, выполним только при вскрытии камер сердца и возможно повреждение при этом проводящих структур, что значительно удлиняет операцию и тяжесть хирургической агрессии.
Задачей изобретения является разработка способа хирургической коррекции ИГСС, позволяющей уменьшить объем хирургического вмешательства без искусственного кровообращения и вскрытия камер сердца, по закрытой методике с помощью тубусного скальпеля добиться одномоментной септэктомии и рассечения перегородки на работающем сердце из одной точки на левом желудочке. Это приведет к релаксации перегородки, падению градиента систолического давления и улучшению питания как гипертрофированной межжелудочковой перегородки, так и миокарда левого желудочка. Как известно по данным Ю.Л.Шевченко /1998 г./, "утолщение стенки желудочка в 2 раза ведет к ухудшению его питания в 8 раз", поэтому реваскуляризация миокарда и перегородки с помощью туннелирования позволит нивелировать эту диспропорцию до функционально значимых величин.
Поставленная задача решается способом хирургического лечения ИГСС путем иссечения межжелудочковой перегородки из одной входящей точки на левом желудочке на работающем сердце с помощью тубусного скальпеля и одновременной реваскуляризацией миокарда левого желудочка (при известной необходимости можно реваскуляризировать и правый желудочек).
Заявляемый способ позволяет релаксировать межжелудочковую перегородку, расширить поперечное сечение выходного тракта левого желудочка и снять субаортальный ишемический синдром без применения искусственного кровообращения на работающем сердце по закрытой методике.
Больной укладывается на правую половину грудной клетки с отведенной левой рукой на хирургическом подлокотнике. Подготавливают операционное поле и производят передне-боковую торакотомию по V-VI межреберью. Перикард вскрывают кпереди от диафрагмального нерва и берут на держалки, сердце подтягивают в рану. На верхушку левого желудочка накладывают один П-образный шов на тефлоновых прокладках общей площадью 1 х 1 см и берут в турникет. Затем тубусным скальпелем с диаметром 0,35 см производят сначало стандартные туннели по передней, передне-боковой, задней, задне-медиальной проекциям левого желудочка (фиг.1). После этого через то же входное отверстие тем же скальпелем входят в дистальную часть межжелудочковой перегородки и туннелируют ее по направлению к аортальному клапану на глубину не более 1 см, чтобы не повредить проводящих путей сердца. Одним из этих туннелей производят септэктомию и рассечение перегородки. При этом отчетливо уменьшается систолическое дрожание на перегородке. На этом операцию заканчивают: скальпель удаляют, а П-образный шов завязывают (фиг.2).
ПРИМЕР
Б-ной Г. , 46 лет, ист. бол. 4329, находился в клинике с 17.11.97 по 19.12.97 с диагнозом: ИГСС, III ст. по Кули. Диагноз подтвержден клинически и инструментально. По ЭхоКГ межжелудочковая перегородка до операции 3 см, задняя стенка 1,3 см, относительная митральная недостаточность 1 ст. 27.11.97 выполнена операция: тройное туннелирование левого желудочка, двойное туннелирование межжелудочковой перегородки с туннельной септэктомией. Послеоперационный период протекал относительно гладко: болевой синдром купирован полностью, одышки, сердцебиения не отмечал. Консервативная терапия носила синдромальный характер. Швы сняты на 12-й день. Контрольная ЭхоКГ выявила релаксацию перегородки: ее толщина была в пределах 2,5 см. По данным ЭКГ признаком острой коронарной патологии не наблюдалось. Больной выписан на 20-е сутки после операции. Обследованный через 3,6 месяцев после операции он не отмечал синдрома стенокардии, одышки, сердцебиения. По данным ЭхоКГ толщина перегородки не увеличилась (2,5 см), степень митральной недостаточности не возросла, фракция выброса в пределах 56%. Данный результат оценен как хороший. Больному даны рекомендации приступить к трудовой деятельности. Таких операций выполнено две.
Claims ( 1 )
Способ хирургического лечения идиопатического гипертрофического субаортального стеноза, включающий иссечение межжелудочковой перегородки, отличающийся тем, что иссечение выполняют из одной входной точки на левом желудочке на работающем сердце с помощью тубусного скальпеля и дополнительно проводят туннелирование миокарда левого желудочка.
ЭхоКГ при субаортальном стенозе
ЭхоКГ при субаортальном стенозе
Причиной подклапанного стеноза могут быть фиброз миокарда на уровне подклапанного пространства, гипертрофия его или оба эти процесса, при этом всегда отмечаются функциональные или морфологические изменения в полулунных клапанах.
Под субаортальным стенозом понимают сужение выносящего тракта левого желудочка.
а) Патологическая анатомия. Различают три формы субаортального стеноза, которые отличаются по частоте и диагностируются в основном при ЭхоКГ:
- Туннелеобразный субаортальный стеноз. Эта форма встречается относительно редко и, как правило, сочетается с гипоплазией аортального кольца и восходящей аорты и уплотнением ткани аортального клапана. Это фиброзно-мышечная форма субаортального стеноза, для которой характерны вплетение всех сухожильных хорд в центральную сосочковую мышцу («парашютный» митральный клапан), надклапанный митральный стеноз и стеноз перешейка аорты.
- Мышечная форма субаортального стеноза. Эта форма наблюдается при гипертрофической обструктивной кардиомиопатии, которая рассматривается нами в другом разделе.
б) Гемодинамика. Сужение выносящего тракта левого желудочка приводит к появлению систолического градиента и повышению давления в левом желудочке, что особенно характерно для изолированной формы субаортального стеноза и становится причиной гипертрофии миокарда левого желудочка.
Видео. Субаортальный дефект межжелудочковой перегородки (обозначен звездочкой) у больного с тетрадой Фалло при исследовании вдоль длинной оси из верхушечной позиции датчика. Кровь сбрасывается из правых отделов сердца в левые и попадает непосредственно в корень аорты.
в) Результаты эхокардиографии. Эхокардиография играет ключевую роль в диагностике субаортального стеноза.
г) Двумерная эхокардиография. Наиболее информативной в диагностике данного заболевания является двумерная ЭхоКГ. При изолированном субаортальном стенозе этот метод исследования позволяет выявить выдающееся в просвет левого желудочка шиповидное возвышение на узком основании, которое представляет собой передний край частично перфорированной мембраны. Дорсальную часть перфорированной мембраны на сонограмме можно распознать по втяжению передней створки митрального клапана в выносящий тракт левого желудочка (на рисунке обозначена звездочкой).
д) Эхокардиография в М-режиме. При эхокардиографии в М-режиме шиповидное возвышение, характерное для субаортального стеноза, выявить не удается. Однако имеются косвенные признаки, по которым можно диагностировать данную патологию, например мезосистолическое закрытие аортального клапана, высокий градиент давления и связанная с ним гипертрофия миокарда левого желудочка.
е) Цветовая допплерография. Турбулентный систолический трансаортальный кровоток начинается на уровне шиповидного возвышения под аортальным клапаном в выносящем тракте левого желудочка и достигает восходящей аорты. Правая коронарная створка аортального клапана часто выглядит утолщенной, подвижность ее ограничена, из-за чего раскрытие аортального клапана происходит неполностью. Этот признак часто бывает причиной ошибочной диагностики стеноза аортального клапана.
Описанные изменения отчасти являются артефактами, причина появления которых состоит в недостаточно высокой частоте регенерации изображения при двумерной ЭхоКГ по сравнению с частотой колебаний правой коронарной створки. Поэтому последняя выглядит утолщенной и неподвижной, а клапан аорты - полуоткрытым. На видеозаписи выше запечатлены особенности кровотока в выносящем тракте левого желудочка при изолированном субаортальном стенозе (*): систолическая турбуленция, которая видна уже при прохождении крови через аортальный клапан и достигает луковицы аорты. Описанные изменения вместе с митральным стенозом образуют комплекс, или синдром Шона. Аортальная недостаточность развивается вторично вследствие субаортального стеноза.
ж) Спектральная допплерография. При непрерывноволновой допплерографии но продольной оси, проходящей через верхушку сердца, можно измерить градиент в выносящем тракте левого желудочка.
КАРДИОМИОПАТИИ
Существует множество причин, приводящих к возникновению дилатационной кардиомиопатии (ДКМП); выделяют первичную (идиопатическую) и вторичную формы.
Основные причины ДКМП у новорожденных:
1. Дисфункция сердечной мышцы (асфиксия, транзиторная миокардиальная ишемия, сепсис, гипогликемия, гипокальциемия).
2. Гематологические заболевания (анемия, синдром повышенной вязкости крови).
3. Патология сердечного ритма (суправентрикулярная тахикардия, врожденная полная атриовентрикулярная блокада).
4. Врожденный миокардит, болезнь Помпе.
5. Эндокардиальный фиброэластоз.
6. Эндокринные заболевания (гипотиреоидизм, адреналовая недостаточность).
7. Почечная недостаточность.
8. Структурные аномалии сердца (аномальное отхождение левой коронарной артерии от легочной артерии).
Основные причины ДКМП у детей старше года:
1. Инфекционный эндокардит.
3. Диффузные заболевания соединительной ткани (коллагеноз).
5. Хроническая почечная недостаточность.
6. Нейромышечные заболевания.
8. Желудочковые тахиаритмии.
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Увеличение конечно-систолического и конечно-диастолического диаметров левого желудочка.
- Уменьшение ударного выброса левого желудочка.
- Дилатация левого предсердия (особенно при относительной недостаточности митрального клапана).
- Дилатация правого желудочка и правого предсердия.
- Усиление эхосигнала от эндокардиальной поверхности левого желудочка.
- Гипокинезия перегородки (при отсутствии митральной недостаточности).
- Гипокинезия задней стенки левого желудочка.
- Увеличение митрально-септальной дистанции (точка Е митрального клапана-левая сторона МЖП) (рис.3).
- Волна В на передней створке митрального клапана.
- Постепенное смыкание створок аортального клапана к концу систолы.
- Снижение показателей систолической функции левого желудочка: ФВ, Vcf.
Двухмерная ЭхоКГ:
- Округлой формы левый желудочек, гипокинезия его стенок.
- Относительная недостаточность митрального клапана (рис.145).
Дилатационная
кардиомиопатия:
увеличение
митрально-септальной
дистанции.
Дилатационная
кардиомиопатия,
относительная
недостаточность
митрального клапана,
пассивное движение
межжелудочковой
перегородки.
Допплер-ЭхоКГ:
- Оценка систолической и диастолической функции левого желудочка.
- Определение сопутствующей митральной регургитации.
- Оценка степени легочной гипертензии.
Сопутствующие изменения:
- Легочная гипертензия (рис.146).
- Выпот в перикарде.
Гипертрофическая кардиомиопатия
Различают первичную (идиопатическую) и вторичную формы ГКМП.
С морфологической точки зрения выделяют симметричную и асимметричную (гипертрофический субаортальный стеноз, рис.147), а также обструктивную и необструктивную формы ГКМП.
Дилатационная
кардиомиопатия,
вторичная высокая
легочная гипертензия.
Известны следующие заболевания, сопровождающиеся ГКМП.
- Гликогеновая болезнь (болезнь Помпе)
- Карнитиновая кардиомиопатия
- Дефицит ацетилкоэнзимдегидрогеназы
- Дефицит пируватдегидрогеназы
- Митохондриальная патология (комплекс 1,3,4)
- Мукополисахаридоз (преимущественно при 1,2,6 типах)
- Муколипидоз
- Фукозидоз
- Маннозидоз
- Генерализованный ганглиозидоз
- Болезнь Тея-Сакса
- Болезнь Фабри
- Болезнь Нимана-Пика
- Х-сцепленная кардиомиопатия
- Атаксия Фридрейха
- Периферический тип нейрофиброматоза
- Туберозный склероз
- Гиперпаратиреоидизм
- Гипотиреоз
- Синдром Берардинелли
- Синдром ЛЕОПАРД
- Синдром Нуна
Гипертрофический субаортальный стеноз
Гипертрофический
субаортальный стеноз
(схема).
ЭхоКГ критерии
Одномерная ЭхоКГ:
- Асимметричная септальная гипертрофия
- а) утолщение перегородки (более 15 мм);
- б) диспропорциональное утолщение перегородки (Тмжп:Тзслж 1,3).
- Переднесистолическое движение передней митральной створки (рис.148).
Гипертрофический
субаортальный
стеноз, одномерная
ЭхоКГ.
- Уменьшение фракции систолического утолщения межжелудочковой перегородки ( 30%).
- Уменьшение экскурсии межжелудочковой перегородки.
- Уменьшение дистанции от передней створки митрального клапана до межжелудочковой перегородки (Е-МЖП) в диастолу и систолу.
- Уменьшение полости левого желудочка.
- Ранне- или среднесистолическое прикрытие аортальных створок.
- Уменьшение EF наклона передней створки митрального клапана.
Двухмерная ЭхоКГ:
Гипертрофический
субаортальный стеноз
аорты,
патологическая
гипертрофия
перегородки.
- Непосредственная визуализация величины прикрытия просвета аорты гипертрофированной межжелудочковой перегородкой (рис.149).
- Оценка степени сужения левожелудочкового выходного тракта.
- Позволяет дифференцировать гипертрофический субаортальный стеноз от дискретного стеноза аорты.
- Позволяет выявлять верхушечную форму гипертрофической кардиомиопатии.
Допплер-ЭхоКГ:
- Определение величины обструкции выходного тракта левого желудочка (см. клапанный стеноз аорты).
- Выявление сопутствующей митральной регургитации.
Рестриктирвная кардиомиопатия
Данная форма КМП проявляется в первую очередь нарушением функции диастолы.
- Амилоидоз сердца
- Гемохроматоз
- Эндомиокардиальный фиброз
- Эндокардит Лефлера
- Саркоидоз
- Фиброэластоз эндокарда
ЭхоКГ критерии:
- Умеренное увеличение толщины перегородки и задней стенки левого желудочка.
- Маленькая или нормальная полость левого желудочка.
- Дилатация левого и правого предсердий.
- Снижение фракции систолического утолщения перегородки и задней стенки левого желудочка.
- Увеличение толщины папиллярных мышц.
- Гранулярные уплотнения в миокарде.
- Усиление эхосигнала от эндокарда левого желудочка.
- Небольшой перикардиальный выпот.
- В-волна на передней створке митрального клапана (признак повышения конечно-диастолического давления) (рис.150).
Рестриктирвная
кардиомиопатия,
выпот в перикарде,
в-волна на передней
створке митрального
клапана.
Допплер-ЭхоКГ:
- Укорочение времени децелерации (от пика Е до конца волны) кривой трансмитрального потока.
- Удлинение времени изоволюметрической релаксации.
Амилоидоз сердца
ЭхоКГ критерии:
1) увеличение толщины перегородки и задней стенки левого желудочка,
2) утолщение свободной стенки правого желудочка,
3) нормальный или уменьшенный размер левого желудочка,
4) уменьшение фракции систолического утолщения перегородки и задней стенки левого желудочка,
5) небольшой перикардиальный выпот,
6) наличие перикардиальных узелков,
7) дилатация левого и правого предсердий,
8) увеличение толщины папиллярных мышц,
9) утолщение атриовентрикулярных и полулунных клапанов,
10) утолщение межпредсердной перегородки,
11) гранулярные уплотнения в миокарде.
Допплер-ЭхоКГ:
- Выявляет недостаточность полулунных и атриовентрикулярных клапанов: митральная регургитация встречается в 70 %, трикуспидальная-43 %, недостаточность аортального клапана-23 %, клапана легочной артерии-23 %.
- Оценка систолической и диастолической функции левого желудочка (увеличение времени изоволюметрической релаксации, уменьшение пика Е и увеличение пика А трансмитрального потока,уменьшение отношение Е:А.
Гемохроматоз сердца
ЭхоКГ критерии:
1) увеличение толщины межжелудочковой перегородки и задней стенки левого желудочка,
2) нормальный или увеличенный размер левого желудочка,
3) дилатация левого предсердия,
4) гипертрофия и дилатация правого желудочка,
5) легочная гипертензия.
Эндокардиальный фиброэластоз
ЭхоКГ критерии:
1) утолщение и плотные эхосигналы от эндокарда,
2) плотный внутренний контур левого желудочка,
3) дилатация предсердий,
4) снижение ударного выброса левого желудочка,
5) тромбоз верхушки левого желудочка (наблюдается в 40 % случаев),
6) парадоксальное движение межжелудочковой перегородки,
7) быстрое раннедиастолическое движение задней стенки левого желудочка.
Допплер эхоКГ:
Увеличение пика Е, укорочение времени децелерации, увеличение Е:А отношения на кривой трансмитрального потока.
Хирургическое лечение субаортального стеноза
Среди больных, страдающих аномалиями развития сердечно-сосудистой системы, врожденный аортальный стеноз встречается в 2-5% случаях (Люде М.Н., 1973; Nadas А., 1977; Bircks W., Kitchner D., 1994). В России, по данным В.Н.Гетманского (1984), ежегодно рождаются около 1000 детей с различными анатомическими формами аортального стеноза. Наиболее распространенной анатомической формой порока является клапанный стеноз (до 70%).
Подклапанный стеноз наблюдается у 20-25% больных, а надклапанный у 5-7% пациентов. В 12% наблюдений наблюдается комбинация различных форм стеноза. С момента появления первых жалоб идет быстрое прогрессирующее течение порока (Ananod R. et al., 1997; Kiraly P. et al., 1997).
У 1-19% больных причиной гибели является "внезапная смерть", основной причиной которой служат всевозможные нарушения ритма, связанные с относительной коронарной недостаточностью (Kitchiner D. et al., 1994). В 2-12% случаях течение порока осложняется развитием инфекционного эндокардита различной степени активности. Основные морфологические варианты фиброзного субаортального стеноза следующие:
- Кольцевидный стеноз (локализованный опоясывающий воротник, охватывающий выходной тракт левого желудочка циркулярно и прикрепляющийся как к межжелудочковой перегородки, так и к передней створке митрального клапана);
- Полулунный или гребневидный стеноз (полукружное отложение фиброзной ткани на переднемедиальной створке митрального клапана или на межжелудочковой перегородке);
- Туннелевидный стеноз (преграда образуется диффузным сегментом выходного тракта левого желудочка);
- Различные аномалии митрального клапана, приводящие к стенозированию выходного тракта левого желудочка (аномальное прикрепление передней створки митрального клапана, аневризма передней створки митрального клапана, «парашютная» деформация митрального клапана и др.).
Больной Ш., 17 лет, поступил в Национальный центр грудной и сердечно-сосудистой хирургии им. святого Георгия 18.09.07. При поступлении предъявлял жалобы на быструю утомляемость, одышку при умеренной физической нагрузке. Из анамнеза: в детском возрасте страдал частыми простудными заболеваниями, в возрасте 4 лет выявлен ВПС, толерантность к физическим нагрузкам оставалась высокой, субъективно чувствует себя хорошо, активно жалоб не предъявляет.
Периодически беспокоит одышка, перебои в работе сердца при незначительных физических нагрузках. За медицинской помощью не обращался, медикаментозные препараты не принимал. При осмотре: общее состояние удовлетворительное. Телосложение нормостеническое. Нормального питания. Кожные покровы и слизистые оболочки нормальной окраски и влажности. Опорно-двигательная система без патологии.
В легких перкуторно: ясный легочный звук. ЧД 15 в мин. При аускультации: дыхание везикулярное, проводится над всеми отделами. Хрипов нет. Границы относительной и абсолютной сердечной тупости сердца не расширены. Тоны сердца ясные, ритмичные, жесткий систолический шум с максимумом на верхушке. ЧСС 70 в мин, АД 110/80 мм рт. ст. Пульсация на магистральных периферических артериях сохранена. Признаков варикозного расширения подкожных вен нижних конечностей не выявлено. Со стороны других органов и систем патологи не выявлено.
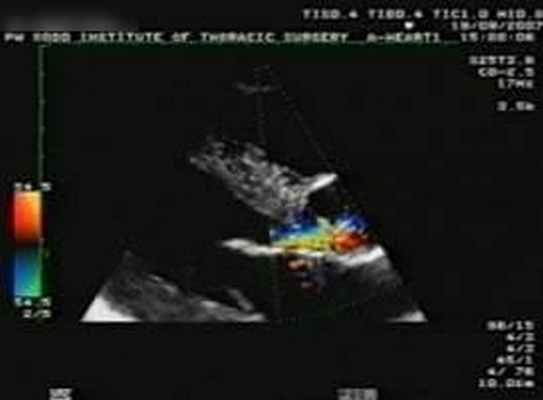
При ЭхоКГ выявлено наличие сочетания выраженного подклапанного и небольшого клапанного стеноза аортального клапана (рис. 1а-в). Градиент на уровне субаортальной мембраны: средний 84 мм рт. ст., максимальный 150 мм рт. ст. (рис. 1г). Размер левого предсердия - 3,5 см, правого желудочка - 2,4 см, толщина межжелудочковой перегородки - 1,9 см. Левый желудочек: конечно-диастолический размер - 4,2 см, конечно-диастолический объем – 78 мл, конечно-систолический размер - 2,3 см, конечно-систолический объем – 18 мл. Диаметр фиброзного кольца аортального клапана - 1,9 см.
| а | б |
 в | 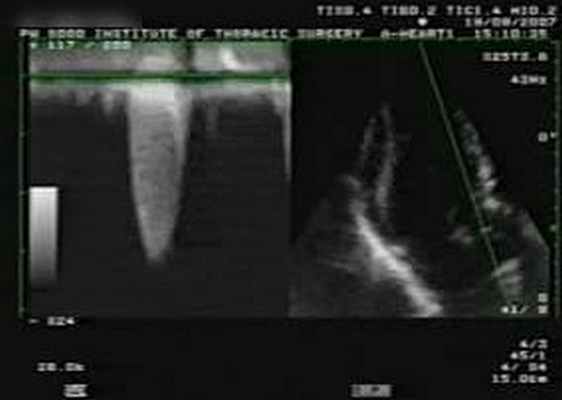 г |
| Рис. 1. ЭхоКГ больного Ш. а, б – в В-режиме (определяется субаортальная мембрана); в – в режиме цветового допплеровского картирования; г – допплерография трансаортального потока крови на уровне субаортальной мембраны. | |
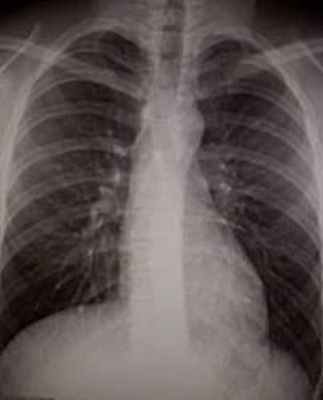
При рентгенографии органов грудной клетки выявлено умеренное увеличение левого желудочка (рис. 2а,б). С целью исключения патологии коронарных артерий, пациенту выполнена коронарография, при которой гемодинамически значимых поражений коронарных артерий не выявлено. Установлен диагноз: ВПС: подклапанный мембранозный стеноз. Выраженная гипертрофия миокарда левого желудочка, НК II а. В связи с наличием у больного ВПС с преобладанием аортального стеноза, выраженной гипертрофией левого желудочка, бесперспективностью консервативной терапии пациенту 01.10.2007 г. выполнена операция: устранение субаортального стеноза в условиях ЭКК и ХКП.
 а | 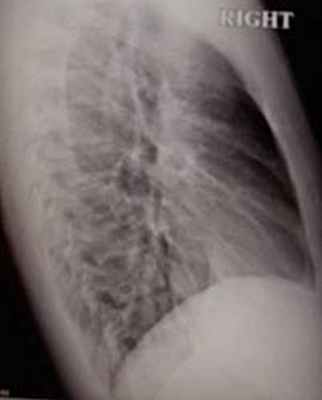 б |
| Рис. 2. Рентгенограмма органов грудной клетки больного Ш. Определяется небольшое увеличение левого желудочка, умеренное расширение аорты (а – прямая проекция; б – правая боковая проекция). | |
Интраоперационно: сердце значительно увеличено в размерах за счет левого желудочка, выраженная его гипертрофия. Аорта умеренно расширена (постстенотическое расширение). Над аортой грубое систиолическое дрожание. После подключения АИК и пережатия аорты выполнена продольная аортотомия.
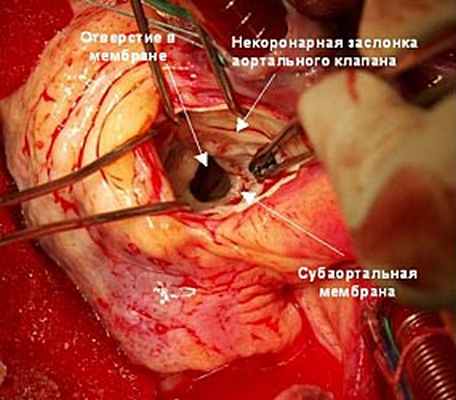
Рис. 3. Ревизия корня аорты и аортального клапана (описание в тексте).
При ревизии: аортальный клапан трехстворчатый (рис. 3), створки умеренно утолщены вследствие постоянной травматизации их струей крови.
Под заслонками аортального клапана определяется плотная (+++) ригидная мембрана шириной около 3 мм с отверстием в центре около 7 мм (рис. 4).
Мембрана иссечена (рис. 5). Ширина выходного тракта левого желудочка более 2 см. Аортальный клапан состоятелен. Ушивание аортотомного разреза двухрядным швом.
Больной в удовлетворительном состоянии на 10-е сутки после операции выписан с рекомендациями по дальнейшему консервативному лечению под наблюдение кардиолога поликлиники по месту жительства.
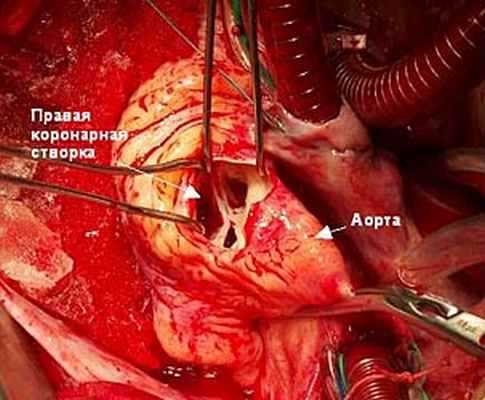
Рис. 4. Интраоперационный вид субаортальной мембраны (описание в тексте).
Следует отметить, что естественная смертность при врожденном стенозе аорты составляет 23±5% в течение первого года жизни.
Насколько злокачественно идет естественное течение данного порока, можно судить по тому, что до 40-летнего возраста доживают не более 40% больных (Campbell M., 1968; Kitchner D., et al., 1993).
Исходя из данных по рождаемости и смертности, в России и странах ближнего зарубежья ежегодно на диспансерном учете должны находится 9-12 тысяч больных врожденным аортальным стенозом, основная масса которых нуждается в хирургическом лечении (Гетманский В.П., 1984).
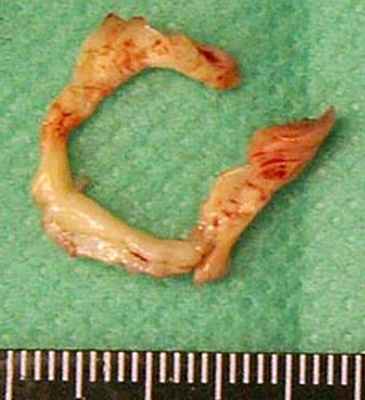
Рис. 5. Препарат иссеченной субаортальной мембраны.
Ранняя постановка диагноза аортального стеноза и своевременное направление больных на хирургическое лечение является актуальной проблемой, так как консервативные методы лечения, особенно при возникновении осложнений, малоэффективны (Шаенко О.Ю. и др. 1997, Шахов Б.Е. и др. 1994; Rosenfeld H.M. et al., 1994).
Это необходимо учитывать кардиологам и кардиохирургам при прогнозировании его естественного течения.
При планировании вмешательства необходимо четко определять оптимальные сроки выполнения операции, обосновывать показания к ее выполнению, учитывая клиническое состояние больных, анатомический вариант порока, определять метод хирургической коррекции и кардиоанестезиологические возможности обеспечения операции.
Именно поэтому становится понятным, что вопрос о своевременной хирургической коррекции врожденного стеноза аорты приобретает особую актуальность, что и продемонстрировало данное клиническое наблюдение.
© 2022 ФГБУ «НМХЦ им. Н.И. Пирогова» Минздрава России. Использование материалов сайта полностью или частично без письменного разрешения строго запрещено.
Гіпертрофічна кардіоміопатія
Гіпертрофічна кардіоміопатія (ГКМП) — первинне ураження міокарда, зумовлене генетичною неповноцінністю скорочувальних білків, характеризується ГЛШ при відсутності серцевої або системної причини.
Епідеміологія
Широко поширена серед багатьох расових груп у країнах Європи, США, Канаді, Ізраїлі, Південній Америці і Далекому Сході. У загальній популяції її поширеність становить 0,2% і відзначається переважно у чоловіків.
Етіологія
На сьогодні за даними численних досліджень підтверджена роль генетичних порушень у розвитку ГКМП. Причиною хвороби є різні мутації генів, які кодують протеїни саркомерів, що дозволяє визначити захворювання як порушення контрактильного апарату міоцита. У більшості пацієнтів захворювання успадковується по аутосомно-домінантному типу, приблизно у 50–60% хворих виявляють мутації в одному з восьми генів, які кодують різні компоненти серцевого саркомера та асоційованих білків: важкого ланцюга β-міозину (14-та хромосома), серцевого тропоніну-Т (1-ша хромосома), серцевого тропоніну-І (19-та хромосома), α-тропоміозину (15-та хромосома), серцевого протеїну С, що зв’язує міозин (11-та хромосома), легких ланцюгів есенціального та регуляторного міозину (3-тя і 12-та хромосоми відповідно), а також серцевого актину (15-та хромосома). За останній час також виявлені мутації трьох інших генів протеїнів саркомера: титіну, тропоніну С і важкого ланцюга α-міозину.
У виникненні захворювання може також мати значення порушення взаємодії серця плода, що розвивається, з катехоламінами, тиреоїдними гормонами, соматотропіном, аденозином.
Розповсюдженість і локалізація гіпертрофії значно варіює, навіть серед родичів. Однакова мутація може призвести до тяжкої гіпертрофії шлуночка у одного члена родини і помірної гіпертрофії у іншого. Причини цих фенотипових розходжень у осіб з ідентичною генетичною мутацією не зовсім зрозумілі, але можуть бути наслідком інших генетичних чинників, які відіграють роль в експресії гіпертрофії серця, таких як DD-генотип АПФ, НУП та інші детермінанти росту міоцитів.
Патогенез
До основних патогенетичних чинників ГКМП належать зниження еластичності і скоротної здатності гіпертрофованого міокарда ЛШ з погіршенням його діастолічного наповнення, в результаті чого в перерахунку на одиницю маси міокарда робота серця істотно зменшується, коронарний кровотік не відповідає ступеню гіпертрофії міокарда. Порушується швидкість проведення збудження в шлуночках з асинхронним скороченням різних відділів міокарда, що знижує пропульсивну здатність ЛШ.
У результаті діастолічної дисфункції виникає хронічне підвищення кінцево-діастолічного тиску ЛШ, тиску заклинювання капілярів ЛА, застій у легенях, прогресуюча гіпертрофія передсердь. Систолічна функція не порушена або навіть посилена внаслідок гіпердинамічності ЛШ (ФВ досягає 80–90%), при цьому КДО зменшений (нерідко
Патологічна анатомія
Захворювання характеризується гіпертрофією міокарда, найчастіше в області міжшлуночкової перегородки, дезорганізацією кардіоміоцитів і міофибрил, фіброзом міокарда та ураженням дрібних судин.
Макроскопічно розрізняють три варіанти ГКМП: асиметрична (60–95%) — ізольована гіпертрофія міжшлуночкової перегородки (ізольований гіпертрофічний субаортальний стеноз); гіпертрофія різних відділів ЛШ, частіше апікальної частини (рис. 10.1); симетрична — тотальна концентрична гіпертрофія (5%) (рис. 10.2).
Рис. 10.1. ГКМП (апікальна гіпертрофія)
Рис. 10.2. ГКМП (симетрична гіпертрофія)
У 25% хворих визначають обструкцію виносного тракту ЛШ у стані спокою. Рівномірна концентрична гіпертрофія міокарда супроводжується значним збільшенням маси серця, але обструкція шлуночків не відзначається. ПШ залучається до патологічного процесу приблизно в 50% випадків, що значно погіршує перебіг захворювання.
Залежно від вираженості потовщення міокарда виділяють три ступені гіпертрофії: помірна (15–20 мм), середнього ступеня (21–25 мм), виражена гіпертрофія (>25 мм).
Характерною анатомічною ознакою ГКМП є структурна зміна мітрального клапана, передня стулка якого розміщена під кутом до площини клапана, потовщена і «випадає» в просвіт виносного тракту ЛШ, що утворює додаткову перешкоду кровотоку. Порожнина ЛШ невеликих розмірів, ліве передсердя часто гіпертрофоване і дилатоване.
Типові патогістологічні зміни включають гіпертрофію кардіоміоцитів і порушення взаємної орієнтації м’язових волокон (як найбільш частий результат мутацій саркомерів), а також вогнища фіброзу і рубцеві зміни внаслідок некрозу міокарда. Волокна розташовуються короткими рядами, мають схильність до закручування при відсутності змін інтрамуральних судин. Ядра клітин змінені, мають потворну форму, часто оточені світлою зоною («перинуклеарним німбом»), у якій відзначається накопичення глікогену.
Класифікація
Залежно від ступеня вираженості перешкоди відтоку крові виділяють дві основні форми ГКМП: обструктивна (рубрика І42.1 за МКХ-10), характеризується наявністю градієнта тиску між порожниною ЛШ і аортою (рис. 10.3) і необструктивна (рубрика І42.2 за МКХ-10) — без градієнта тиску (рис. 10.4).
Рис. 10.3. ГКМП (асиметрична гіпертрофія перегородки з обструкцією)
Рис. 10.4. ГКМП (асиметрична гіпертрофія перегородки без обструкції)
Клінічна картина
Ступінь обструкції і ГЛШ не корелює з наявністю клінічних симптомів. Захворювання може бути повністю безсимптомним або маніфестувати в будь-якому віці, найбільш часто симптоми проявляються у пацієнтів віком 40–50 років .
Класична тріада симптомів включає біль у серці, задишку при навантаженні та синкопальні стани. Біль у ділянці грудної клітки відзначають 75% хворих, класичну стенокардію напруження — 25%. У багатьох хворих відзначається післяобідня стенокардія. Непритомність найчастіше виникає у хворих молодого віку. У деяких випадках раптова смерть може бути першим проявом захворювання, наступає з частотою приблизно 1% на рік.
При необструктивній формі фізикальне обстеження відхилень від норми може не виявити, проте іноді визначають збільшення тривалості верхівкового поштовху, аускультативно IV тон серця.
При обструктивній формі при фізикальному обстеженні виявляється пульсація сонних артерій, швидкий «уривчастий» пульс при пальпації сонних артерій; посилений тривалий верхівковий поштовх, що займає всю систолу аж до II тону.
Аускультативно тони серця глухі, визначається IV тон, а також систолічний шум (crescendo-diminuendo), що не проводиться або слабко проводиться на сонні артерії і ділянку спини, посилюється при зменшенні наповнення серця і зниженні ЗПСО (підйом із положення сидячи навпочіпки, натужування, прийом нітрогліцерину) і слабшає при збільшенні наповнення серця, підвищенні ЗПСО (у положенні лежачи, сидячи навпочіпки, при стисканні кулаків).
ГКМП має повільно прогресуючий перебіг, тяжкість залежить від локалізації та ступеня гіпертрофії міокарда в зоні потовщення, а також від обструкції виносного тракту ЛШ.
Погіршують перебіг захворювання серйозні ускладнення. Раптову смерть реєструють у 2–4% дорослих і 4–6% дітей. Іншими ускладненнями є передсердні аритмії, тромбоемболії, інфекційний ендокардит (5–9%) і застійна СН (10–15%).
Діагностика
Зміни на ЕКГ виявляють у 95% хворих. Найбільш частими з них є збільшення лівого передсердя, порушення реполяризації ЛШ у вигляді депресії сегмента ST та інверсії зубця Т і патологічні зубці Q (25–30%), ознаки ГЛШ. При апікальній гіпертрофії можливі глибокі «гігантські» (до 4 см) симетричні негативні зубці Т. Добове моніторування ЕКГ дозволяє виявити порушення ритму серця: шлуночкові екстрасистоли (88%), пароксизми шлуночкової тахікардії (25–30%), суправентрикулярні тахіаритмії (30–40%), а також порушення провідності.
Рентгенологічну картину багато в чому визначає ступінь вираженості захворювання. Можливі наступні рентгенологічні зміни: в першій косій проекції з’являється вибухання ЛШ, зумовлене гіпертрофією шляхів відтоку, відсутність талії серця та заокруглення дуг, розширення лівого передсердя.
ЕхоКГ є методом вибору і дозволяє виявити ГЛШ — потовщення стінки >1,5 мм в період діастоли (рис. 10.5) без збільшення його порожнини, збільшення лівого передсердя, порушення діастолічної функції при допплєрівській ехоКГ.
Рис. 10.5. ГКМП, необструктивна форма, В-режим, парастернальна позиція, довга вісь
За даними ехоКГ-обстеження в М-режимі найбільш часто можна виявити асиметричний характер гіпертрофії перегородки, систолічний передній рух мітрального клапана, невеликий розмір порожнини ЛШ, зменшення рухливості перегородки і передчасне закриття аортального клапана.
При двомірному зображенні визначаються різні варіанти локалізації гіпертрофії міокарда. Систолічна функція зазвичай не порушена, ФВ збільшена (часто >80%).
Приблизно у 25% хворих відзначають градієнт тиску між порожниною і виносним трактом ЛШ у стані спокою. Хоча клінічне значення градієнта виносного тракту у хворих з ГКМП інтенсивно обговорюється багато років, нині градієнт розглядається як показник справжньої обструкції викиду ЛШ. Прийнято угоду, за якою обструкція виносного тракту ЛШ визначається при наявності градієнта не менше 30 мм рт. ст. (Maron B.J. et al., 2003). Обструкція клінічно важлива (від середнього ступеня до тяжкого) тільки у випадках, якщо градієнт виносного тракту становить >50 мм рт. ст.
Залежно від величини градієнта тиску відповідно до класифікації NYHA виділяють наступні стадії захворювання:
I стадія — градієнт тиску до 25 мм рт. ст., як правило, скарг хворі не пред’являють;
II стадія — градієнт тиску до 36 мм рт. ст., самопочуття погіршується при фізичному навантаженні;
III стадія — градієнт тиску до 44 мм рт. ст., виражені клінічні симптоми — стенокардія, задишка та порушення гемодинаміки;
IV стадія — градієнт тиску 80 мм рт. ст. і вище, є значні порушення гемодинаміки.
При проксимальній формі ГКМП (субаортальному стенозі) найбільш характерними ехоКГ-ознаками є потовщення міжшлуночкової перегородки і зниження її екскурсії в базальному сегменті, збільшення співвідношення товщини міжшлуночкової перегородки і задньої стінки >1,3 (1,5–2) (рис. 10.6), наявність градієнта тиску при допплєрівській ехоКГ (рис. 10.7).
Рис. 10.6. ГКМП з обструкцією виносного тракту ЛШ, В-режим, парастернальна позиція, довга вісь
Рис. 10.7. ГКМП з обструкцією виносного тракту ЛШ. Апікальна п’ятикамерна позиція. Режим постійнохвильового допплєра
Для дистальної форми (апікальної ГКМП) при ехоКГ-дослідженні найбільш характерне потовщення та зменшення амплітуди руху міжшлуночкової перегородки у верхівковому сегменті по довгій осі у двовимірному зображенні, порожнина ЛШ у лівій апікальній чотирикамерній позиції пікоподібної форми за рахунок гіпертрофії дистальних відділів міжшлуночкової перегородки і відділів задньої стінки ЛШ, що прилягають до неї.
Концентрична (симетрична) форма характеризується потовщенням міжшлуночкової перегородки і задньої стінки ЛШ у діастолу при значному збільшенні загальної маси міокарда, зменшенням систолічного і діастолічного об’ємів ЛШ, підвищенням індексу співвідношення розмірів лівого передсердя і устя аорти.
Ізольована гіпертрофія ПШ при ехоКГ- дослідженні має наступні ознаки: збільшення діастолічної товщини і зменшення амплітуди руху міжшлуночкової перегородки у верхівковому сегменті, потовщення передньої стінки і зменшення діастолічного розміру ПШ.
При біопсії міокарда виявляють хаотичне розташування та вкорочення волокон міокарда, дегенеративні зміни із зникненням міофібрил, деформацію ядер клітин, фіброзне заміщення міокарда.
Катетеризацію порожнин серця зазвичай проводять при клінічно вираженій мітральній регургітації для оцінки можливості хірургічного лікування. Внутрішньошлуночкові градієнти тиску виявляють у ЛШ і рідше в ПШ. Градієнт підвищується після екстрасистол, під час проби Вальсальви і після інгаляції амілнітриту. Кінцево- діастолічний тиск підвищений внаслідок зниженої піддатливості шлуночка.
За даними вентрикулографії виявляють характерну деформованість камери, що залежить від форми ГКМП і також іноді підтверджують мітральну регургітацію. Коронарні артерії зазвичай широкі з адекватним кровотоком.
За допомогою МРТ можна найбільш точно оцінити морфологічні зміни, поширеність і вираженість гіпертрофії міокарда, особливо при діагностиці верхівкової форми і гіпертрофії нижньої частини міжшлуночкової перегородки і ПШ, визначити систолічну і діастолічну функцію ЛШ.
При підозрі на ГКМП діагноз встановлюють за даними генетичного дослідження (аналіз ДНК), що дозволяє виявити характерні мутації генів, відповідальних за синтез скорочувальних білків кардіоміоцитів.
Лікування
Повинне бути спрямоване на зменшення діастолічної дисфункції, гіпердинамічної функції ЛШ і усунення порушень ритму серця.
Загальні заходи включають обмеження фізичних навантажень, які збільшують гіпертрофію міокарда, підвищують внутрішньошлуночковий градієнт тиску і ризик раптової смерті.
Блокатори β-адренорецепторів є препаратами першої лінії у хворих незалежно від наявності або вираженості градієнта внутрішньошлуночкового тиску, що мають симптоми задишки або непереносимості фізичних навантажень, із зниженою скоротністю ЛШ, обмеженим латентним градієнтом виносного тракту, зниженим споживанням кисню міокардом і ішемією (схема 10.1). Блокатори β-адренорецепторів покращують симптоми у 70% хворих, знижуючи ЧСС і у такий спосіб покращуючи пасивне наповнення шлуночків і зменшуючи потребу міокарда в кисні.
Альтернативою може бути застосування верапамілу, який у дозі до 480 мг/добу у хворих як з необструктивною, так і обструктивною ГКМП зменшує вираженість симптоматики, особливо біль у ділянці серця, покращує розслаблення і наповнення шлуночків, зменшує ішемію міокарда і скоротність ЛШ. При застосуванні верапамілу може виникати погіршення гемодинаміки, збільшення обструкції виносного тракту, підвищення тиску в ЛА.
З обережністю слід давати навантаження хворим з обструкцією виносного тракту ЛШ у стані спокою.
При наявності порушень серцевого ритму доцільно призначати блокатори β-адренорецепторів і антиаритмічні засоби, проте слід зазначити, що застосування останніх не знижує ризик раптової смерті. У симптоматичних пацієнтів з обструкцією дизопірамід діє як антиаритмічний засіб (по відношенню як до суправентрикулярних, так і шлуночкових аритмій) і як засіб з негативною інотропною дією викликає зменшення вираженості симптомів. У дозах 300–600 мг/добу може зменшувати обструкцію виносного тракту і обсяг мітральної регургітації. Для зменшення вираженості побічних ефектів можна застосовувати в комбінації з блокаторами β-адренорецепторів у низьких дозах. Не слід застосовувати дизопірамід з соталолом/аміодароном внаслідок ризику проаритмогенної дії.
Наявність фібриляції передсердь зазвичай добре переноситься, проте у хворих з тяжкою діастолічною дисфункцією втрата передсердного «внеску» внаслідок аритмії може мати необоротні гемодинамічні наслідки, що вимагає невідкладного відновлення синусового ритму шляхом електричної або медикаментозної кардіоверсії за допомогою аміодарону. Останній ефективний для попередження пароксизмів фібриляції передсердь. Контроль ритму за допомогою блокаторів β-адренорецепторів або верапамілу покращує клінічний статус пацієнтів. Застосування варфарину показано як при пароксизмальній, так і при постійній формі фібриляції передсердь.
При лікуванні СН у хворих з ГКМП терапевтична стратегія повинна бути спрямована на стимуляцію регресії ГЛШ і усунення симптомів СН шляхом зниження тиску наповнення ЛШ без зменшення величини серцевого викиду. У цих випадках препаратами вибору можуть бути інгібітори АПФ і антагоністи рецепторів ангіотензину II у зв’язку з їх здатністю блокувати РААС і викликати зворотний розвиток ГЛШ.
Клінічні дослідження, проведені за останні роки, продемонстрували сприятливу дію інгібіторів АПФ на ряд важливих показників діастолічної функції, включаючи діастолічне наповнення, ізоволюмічне розслаблення і взаємозв’язок тиск — об’єм ЛШ і можливість зворотного розвитку процесів ремоделювання міокарда. При цьому покращання діастолічної функції (діастолічної розтяжності і здатності до розслаблення міокарда, зниження кінцево- діастолічного тиску наповнення ЛШ) було більш виражене у хворих з попередньо більш тяжким ступенем дисфункції.
Лікувальні заходи при ГКМП і СН у певній мірі мають парадоксальний характер. Діуретики слід застосовувати з обережністю, переважно при відсутності значної обструкції виносного тракту.
Засоби з інотропним ефектом, спрямовані на стимуляцію систолічного викиду (серцеві глікозиди і пресорні аміни), можуть спричинити несприятливий гемодинамічний ефект — вони посилюють обструкцію виносного тракту і не знижують підвищений кінцево-діастолічний тиск, можуть викликати розвиток асистолії. При збереженій систолічній функції може виникнути негативний ефект у зв’язку з посиленням скоротності шляхом підвищення внутрішньоклітинної концентрації іонів кальцію. Таким чином, при ГКМП «чистий» ефект від інотропних засобів, що мають позитивний ефект (як збільшення жорсткості міокарда, так і підвищення тиску наповнення ЛШ) призводить до погіршення діастолічної функції. Проте дигоксин можна застосовувати у хворих з діастолічною дисфункцією і фібриляцією передсердь для зниження ЧСС і/ або для відновлення синусового ритму.
Показання до проведення немедикаментозної терапії:
- значна обструкція виносного тракту ЛШ (максимальний градієнт ≥50 мм рт. ст.) і симптоми вираженої задишки;
- біль у ділянці серця і пресинкопальні або синкопальні стани;
- рефрактерність до максимальної медикаментозної терапії.
Останнім часом успішно апробований новий метод для зменшення обструкції виносного тракту у хворих, рефрактерних до медикаментозної терапії — перкутанна алкогольна абляція міжшлуночкової перегородки. Успішна алкогольна абляція супроводжується прогресивним зменшенням градієнта в період від 6 до 12 міс у 80% хворих, що супроводжується покращанням клінічного статусу, зменшенням вираженості симптомів і діастолічної дисфункції та збільшенням переносимості фізичних навантажень.
Метою хірургічного втручання при обструкції виносного тракту є усунення систолічного переднього руху мітрального клапана і септально-мітрального контакту шляхом розширення виносного тракту ЛШ. Найчастіше виконується септальна міотомія-міектомія, в результаті якої у 95% хворих визначають значне зменшення градієнта виносного тракту, мітральної регургітації, у 70% поліпшуються клінічні симптоми. Приблизно у 5% пацієнтів операція ускладнюється аортальною регургітацією, що зазвичай гемодинамічно незначима.
Попередження раптової смерті включає ідентифікацію маркерів ризику (включаючи синкопальні стани, раптову смерть родичів, наявність градієнта виносного тракту). Наявність множинних клінічних факторів ризику підвищує ризик раптової смерті; таким хворим необхідна імплантація кардіовертера-дефібрилятора.
Прогноз
Несприятливий; найчастіше хворі вмирають раптово, на фоні важкого фізичного навантаження, у тому числі при безсимптомному перебігу захворювання. ХСН розвивається не так часто.
Встановлені чинники ризику раптової смерті при ГКМП: маніфестація захворювання в молодому віці (до 16 років), наявність в сімейному анамнезі епізодів раптової смерті, часті синкопальні стани, нетривалі епізоди шлуночкової тахікардії, виявлені при 24-годинному моніторуванні ЕКГ, патологічна зміна рівня АТ при фізичному навантаженні. Ступінь ГЛШ або наявність обструкції виносного тракту ЛШ прогностичного значення не мають.
Читайте также:
