Эпидемиология болезни Шагаса. Trypanosoma rangeli
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Определение. Американский трипаносомоз — инфекция, вызываемая трипаносомой Т. cruzi, характеризуется длительным латентным периодом (иногда продолжительностью в несколько десятилетий), острым, часто бессимптомным течением и последующим медленным развитием хронических поражений миокарда и органов желудочно-кишечного тракта.
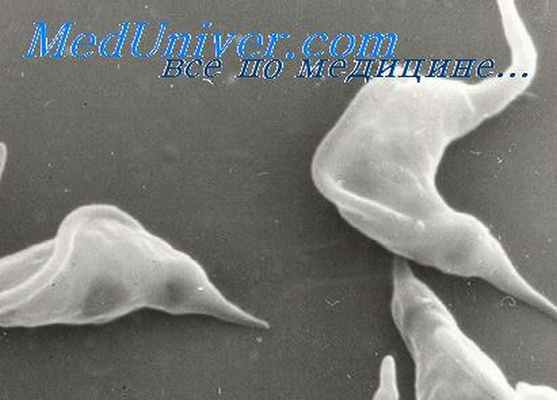
Этиология. Возбудитель циркулирует в крови в виде тонкой веретенообразной трипомастиготы длиной 20 мкм.-В окрашенных препаратах ее легко распознать по узкой ундулирующей мембране, большому кинетопласту и характерной С-образной форме. В отличие от возбудителя сонной болезни не размножается в кровотоке. Проникнув в тканевую клетку, трипомастигота теряет ундулирующую мембрану и жгутик, приобретает форму амастиготы и размножается бинарным делением. В итоге образуются новые жгутиковые формы, которые снова попадают в кровоток и дают начало новому циклу.
Штаммы Т. cruzi значительно различаются по кругу хозяев, географическому распространению, вирулентности и тропизму к тканям, а также по специфическим антисывороткам, зимотипам и типу рестриктивной ДНК.
Эпидемиология. Болезнь Шагаса встречается в разбросанных очагах от Чили и Аргентины до Мексики. В пределах указанных эндемичных районов она поражает от 15 до 20 млн человек и является ведущей причиной заболеваний сердца, ответственных за 25% всех случаев смерти в возрастной группе 25 — 44 лет. В ряде южных районов США трипаносомы находили у насекомых-переносчиков и у диких животных, причем серологические исследования показали, что в этих местах происходит передача инвазии человеку. Однако на сегодня описано всего лишь несколько клинически выраженных случаев болезни Шагаса местного происхождения в Техасе и Калифорнии.
Болезнь передается человеку клопами редувиидами («убийцами» или «поце луйными»), главным образом относящимися к родам Triatoma, Panstrongylus и Rhodnius. Эти крылатые кровососущие насекомые могут быть обнаружены в норах животных, в трещинах стен и тростниковых крышах плохо построенных сельских жилищ. «Поцелуйные» клопы нападают на человека в ночное время и обычно наносят укусы на лице в местах перехода кожи в слизистую оболочку (чаще всего в области губ или наружного угла глазной щели). Во время кровососания жгутиковые формы трипаносом заглатываются клопом, развиваются в желудке последнего в течение 8— 10 дней и затем выделяются с фекалиями при очередном кровососании; человек заражается при попадании трипаносом в ранку после укуса. Этот процесс получил название передача инфекции через «заднюю позицию». Редувииды могут оставаться инфицированными до 2 лет.
Резервуаром возбудителя инфекции могут служить люди, домашние животные (кошки и собаки) и дикие животные, особенно опоссумы и броненосцы. Важнейшее эпидемиологическое значение имеет тесная связь людей, домашних животных и переносчиков внутри жилища человека, однако болезнь передается также при переливаниях крови и через плаценту новорожденным детям. Описаны также случаи внутрилабораторного заражения.
Патогенез и клинические проявления. Клинические проявления болезни отмечаются только у 30% инфицированных лиц. В течение 1 — 3 нед на месте инокуляции трипаносом появляется местная воспалительная реакция, клинически проявляющаяся в" виде эритематозного узла, или «шагом ы». Если входными воротами инфекции служит конъюнктива, у больного развиваются односторонний, безболезненный конъюнктивит, отек век и оклоушная лимфаденопатия (симптом Романьи). Этот первичный комплекс может персистировать в течение 1 — 2 мес, в этот период трипаносомы" обнаруживаются в пораженных тканях.
После инкубационного периода длительностью около 2 нед трипаносомы попадают в кровь, вызывая паразитемию и острую фазу болезни. Затем трипаносомы инвазируют клетки мезенхимального происхождения, приобретают форму амастигот и размножаются, вызывая образование внутриклеточных псевдоцист. Через 4 — 6 дней псевдоцисты разрываются, высвобождая амастиготы и вновь образованные трипомастиготы. Амастиготы распадаются, вызывая интенсивную воспалительную реакцию, в то время как жгутиковые формы вновь попадают в кровоток, поддерживая инфекционный процесс и проникая в такие ткани, как миокард, поперечнополосатую, гладкую мышечную ткань и нервную ткань. Антигены возбудителя могут абсорбироваться на поверхности как нормальных, так и инфицированных клеток, возможно, делая их чувствительными к разрушению под воздействием гормональных и клеточных иммунных реакций макроорганизма.
Клинически у больных отмечаются постоянная или рецидивирующая лихорадка, генерализованная лимфаденопатия, гепатоспленомегалия и в некоторых случаях обширный студенистый отек лица и туловища. В раннем периоде острой фазы может возникать транзиторная кореподобная или уртикарная кожная сыпь. Хотя при этом трипаносомы часто могут быть обнаружены в спинномозговой жидкости, острый менингоэнцефалит встречается относительно редко. Чаще всего поражаются новорожденные и дети младшего возраста. Достаточно часто развивается миокардит, характеризующийся тахикардией и неспецифическими электрокардиографическими изменениями. В тяжелых случаях возможны нарушения проводимости, расширение сердца и сердечная недостаточность. Продолжительность острой фазы болезни варьирует. В 5— 10% случаев менингоэнцефалит или тяжелая сердечная недостаточность приводят к смертельному исходу в течение нескольких дней или недель. Однако чаще на фоне образования гуморальных антител заболевание медленно разрешается в течение нескольких недель. Уровень паразитемии и количество возбудителей в тканях снижаются, состояние больного улучшается, и наличие персистирующей инфекции выявляется только с помощью серологических реакций. Реже, при лейкозе или иммуносупрессии, паразитемия и клинические признаки инфекции проявляются вновь. Однако у подавляющего числа больных инфекция остается латентной в течение всей последующей жизни. Примерно в 10% случаев прогрессирующее иммунологическое разрушение мезенхимальных тканей ведет в конечном итоге к развитию хронических поражений органов. Большинство лиц с поздними клиническими проявлениями болезни отрицают наличие острой фазы в анамнезе, что свидетельствует о том, что субклиническая инфекция часто приводит к развитию хронического заболевания. Полагают, что высвобожденные во время острой фазы антигены клеток хозяина вызывают аутоиммунные воспалительные реакции; при этом были обнаружены антитела, реагирующие с эндокардом, поперечнополосатой мускулатурой и тканями сосудов. У экспериментальных животных были также обнаружены самореагирующие цитотоксические лимфоциты, причем у больных, погибающих от трипаносомозной кардиопатии, часто наблюдаются лимфоцитарные инфильтраты. Некоторые авторы считают, что поздние проявления инфекции обусловлены главным образом разрушением клеток нервных ганглиев в этот период болезни, что приводит к расширению и дисфункции пораженных органов.
Важнейшим из поздних клинических проявлений инфекции является заболевание сердца, сопровождающееся болями в области сердца, аритмией, блокадой сердца и застойной сердечной недостаточностью (преимущественно правосторонней). Относительно часто наблюдаются тромбоэмболические осложнения и внезапная остановка сердца. На ЭКГ отмечаются блокада правой ветви предсердно-желудочкового пучка (пучка Гиса) и левая передняя полублокада, преждевременное сокращение желудочков и инвертированный зубец Т. Эффективным методом отбора инфицированных больных с признаками поражения сердца и динамического наблюдения за больными с кардиомиопатией служит эхокардиография. На аутопсии в сердце умерших от болезни Шагаса можно увидеть характерное выпячивание эндокарда в мышечные пучки в области верхушки. В южных районах Южной Америки встречаются такие осложнения болезни, как мегаколон и мегаэзофагус. У больных с мегаэзофагусом часто отмечаются регургитация и аспирационная пневмония, а также повышенная заболеваемость раком пищевода. При болезни Шагаса описаны также неврологические нарушения, включая умственную отсталость и мозжечковые симптомы.
Диагностика. Диагностика основана на обнаружении трипаносом у больного или на положительных результатах серологических исследований. В острой фазе болезни трипаносомы могут быть обнаружены в пробах периферической крови теми методами, что и при африканском трипаносомозе. Эффективен микрогематокритный метод обогащения. Если указанные методы не дают положительных результатов, можно провести посевы крови на целый ряд искусственных сред или ввести ее крысам, мышам или морским свинкам.
Возбудители болезни Шагаса хорошо растут в кровяном бульоне при температуре 28°С. В эндемичных районах часто используется метод ксенодиагностики; выращенному в лаборатории свободному от трипаносом переносчику дают напиться крови у больного с подозрением на болезнь Шагаса, и через 2 нед содержимое кишечника насекомого проверяют на наличие возбудителя. Обнаружение трипаносом в крови иногда приводит к путанице. Дело в том, что многие дети в Венесуэле и других странах Южной Америки являются носителями безвредного вида трипаносом (Т. rangeli), который не вызывает болезни, но может находиться в крови в течение многих месяцев. При повторном применении методов культивирования и ксенодиагностики трипаносомы обнаруживаются у большинства больных в острой фазе и в 40% случаев в хронической фазе инфекции. С помощью биопсии пораженного лимфатического узла или икроножной мышцы возбудителей можно обнаружить в начальном периоде болезни, когда трипаносом не удается выделить из крови. Тест Машадо— Гуэррейро (реакция связывания комплемента) наиболее эффективен при диагностике хронических случаев и проведении специальных обследований. Реакция флюоресцирующих антител и реакция торможения гемагглютинации, по-видимому, более чувствительны, но менее специфичны. Ускоренная реакция агглютинации на предметном стекле была разработана для применения на станциях переливания крови. Во всех этих серологических реакциях используются неочищенные антигены эпимастигот, которые дают перекрестные реакции с сыворотками больных лейшманиозом или с инфекцией, вызванной Т. rangeli. Этих ложноположительных результатов можно избежать, применяя новую иммуноферментную реакцию с использованием очищенного гликопротеидного антигена.
Лечение и профилактика. Эффективных способов лечения Шагаса нет. Некоторые препараты уменьшают длительность периода паразитемии и клинических проявлений, предотвращают сероконверсию и снижают летальность; вместе с тем нет полной уверенности в том, что какой-либо из этих препаратов в переносимых дозах обладает способностью уничтожить внутриклеточно локализованных паразитов. Наибольшие надежды связывают с нифуртимоксом (Nifurtimox), производным нитрофуразона, который назначают в дозе 10 мг/кг в сутки дробно в 4 приема в течение 3 или 4 мес; однако этот препарат обладает выраженным побочным действием. Сходным по эффективности является бензнидазол (Benznidazole), препарат из группы нитроимидазола; в США не производится. При экспериментальных инфекциях значительная активность против внутриклеточных амастигот обнаружена у кетоцоназола (Ketoconazole), который, однако, не прошел еще клинических испытаний. Считается, что хронические поражения органов при болезни Шагаса необратимы.
Профилактика заключается в обработке инсектицидами остаточного действия стен и крыш домов — основных мест обитания переносчиков. При использовании инсектицидов с добавлением латекса образуется бесцветная пленка, которая существенно продлевает активность препарата. Использование фумигантов поможет предупредить повторное появление насекомых. Штукатурение стен, цементирование земляных полов, перенос на большое расстояние от жилых построек штабелей из дров также значительно уменьшают концентрацию переносчиков клопов редувиид в помещениях. Трансфузионную передачу инфекции можно предупредить, добавляя в препараты крови генциановиолет или его аналоги. В эндемичных районах больных с лейкозом перед началом иммуносупрессивной терапии следует, используя серологические методы, проверить на наличие трипаносомоза.
Эпидемиология болезни Шагаса. Trypanosoma rangeli
Эпидемиология болезни Шагаса. Trypanosoma rangeli
Т. cruzi способны также развиваться и доходить до инвазионной стадии в постельных клопах (Cimex spp.), а также в клещах Ornithodorus.
У клещей О. moubata они могут сохраняться в кишечнике личинок и взрослых клещей в течение нескольких лет.
В эндемичных очагах, где наблюдается массовое размножение переносчиков в стенах глинобитных домов, огромна» часть населения переносит начальную острую фазу инфекции в детском возрасте в большинстве случаев в слабо выраженной или в бессимптомной форме.
В эндемичных очагах инфекция может передаваться при переливании крови доноров, находящихся в хронической фазе инфекции.
Профилактика и меры борьбы. Борьба с переносчиками — клопами. Обработка мест их обитания препаратами ДДТ, диэлдрина, гексахлорана. заделка трещин в стенах помещений. Радикальным мероприятием является улучшение социально-бытовых условии, замена примитивных жилищ благоустроенными жилищами европейского типа, выявление и уничтожение зараженных домашних животных, уничтожение диких животных — носителей инфекции.
В местности, эндемичной по болезни Шагаса, при обследовании доноров реакция Машадо ставится обязательно.
Для предупреждения передачи Т. cruzi при переливании крови в кровь за сутки прибавляют генцианвиолет в концентрации 1:4000, в результате чего паразиты погибают (Schneider, 1963).
Географическое распространение. Очаги болезни Шагаса зарегистр и резаны в Бразилии, Венесуэле, Аргентине, Панаме, Гватемале, Боливии, Перу, Эквадоре, Чили, Сальвадоре, Уругвае, Колумбии, Мексике, Гвиане, Парагвае, Коста-Рике, Никарагуа. По данным Всемирной организации здравоохранения (1960). из 35 миллионов человек, проживающих на эндемичной по болезни Шагаса территории Южной Америки, поражено около 7 млн. человек. В США до 1955 г. больных не регистрировали, хотя были обнаружены зараженные животные и клопы. С 1955 г. начали выявляться единичные случаи этого заболевания.
Trypanosoma rangeli
В Центральной и Южной Америке у человека обнаружена инфекция T. rangeli. Встречаются и близкие или идентичные виды трипаносом, как, например, Т. ariari.
Трипаносомные формы Т. rangeli длиной 30u имеют более мелкий кинепласт. чем v T. cruzi. В периферической крови обнаруживаются делящиеся формы. Леишманиальные формы в организме человека не обнаружены Т. rangeli найдены также у животных (собаки, обезьяны). Переносчик — триатомовый клоп Rhodnius prolixus. В организме клопа обнаруживаются лептомонадные и критидиальпые формы. Передача инфекции происходит вероятнее всего через укус клопа. Клинические симптомы отсутствуют как при естественной инфекции, так и при экспериментальном заражении добровольцев. Часто встречаются случаи смешанного заражения Т. cruzi и T. rangeli.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Болезнь Шагаса
Болезнь Шагаса (Чагаса), встречается только в Центральной и Южной Америке и южных зонах США. Возбудитель Trypanosoma (Schizotrypanum cruzi), передающийся кровососущими триатомовыми клопами (редувиидами). Обнаруживают его не только у человека, но и у многих диких и домашних животных.
Кроме Т. cruzi, у человека и некоторых видов животных также выявляют непатогенный вид трипаносом Trypanosoma rangeli — один из представителей подрода Herpetozoma (бывшая группа Lewisi).
Распространение. Болезнь Шагаса повсеместно регистрируется в Перу, Колумбии, Мексике, Панаме, Сальвадоре, Венесуэле, Аргентине, Бразилии, Чили, Боливии, Парагвае, Уругвае, Эквадоре, а также в южных штатах США. По данным Всемирной организации здравоохранения (1980), около 7 млн. людей заражены Т. cruzi и примерно 35 млн. подвержены опасности заболевания.
Возбудитель Т. cruzi и вызываемая ею болезнь впервые была описана в 1909 г. Это небольшие изогнутые трипаносомы с очень крупным кинетопластом, выступающим с боков заостренного заднего конца.
Размножаются в крови теплокровных внутриклеточно в амастиготной (лейшманиальной) стадии. В клопах-переносчиках метациклические трипаносомы развиваются в заднем отделе кишечника и выделяются с фекалиями и при контаминации с поврежденной кожей или слизистой глаз вызывают заражение.
Из всех патогенных трипаносом Т. cruzi наиболее легко культивируется на двухфазных и жидких средах при температуре 25-28°С с появлением в старых культурах метациклических форм. Хорошо также поддерживается на куриных эмбрионах и в культуре тканей, где проходит те же стадии жизненного цикла, что и в организме позвоночного хозяина. Хорошо сохраняется при температуре —70 и —196 °С.
Эпизоотологические данные. Заражаются в основном жители сельской местности, где низкий социально-экономический уровень и антисанитарные условия сочетаются с жилищными постройками из глины, соломы и тростника, представляющие отличные места для выплода триатомид. Имеется два цикла передачи Т. cruzi — домовой и природный. В естественных условиях в домовом цикле заражаются собаки, кошки, свиньи, кролики, морские свинки, крысы и мыши. Доказана возможность заражения также крупного рогатого скота, овец и коз, но их значение в передаче инвазии в естественных условиях не определено.
В природном цикле Т. cruzi заражаются неполнозубые (броненосцы и муравьеды), сумчатые (опоссумы), плотоядные (хорьки, лисы и еноты), дикие грызуны (водяные крысы, агути, белки и др.), обезьяны (Cebus, Aloutta) и летучие мыши.
На эпидемиологию болезни Шагаса оказывает влияние температура окружающей среды. В странах Южной Америки, где температура воздуха изменяется по сезонам года, острые случаи болезни наблюдаются в летний период. Чаще всего люди заражаются ночью, во время сна. Имеются случаи внутриутробного инфицирования и при переливании крови. Не исключается возможность передачи возбудителя детям с молоком от больной матери. Люди могут быть инфицированы при работе с Т. cruzi. Летальный исход при острых случаях болезни Шагаса составляет 10%. Тяжело болеют преимущественно дети.
Патогенез. Проникая через кожу или слизистую оболочку, Т. cruzi вызывает острую воспалительную реакцию, проявляющуюся в виде шагомы или симптома Романьи. Затем царазиты достигают кровяного русла, разносятся в различные органы и ткани, проникают в клетки, превращаются в амастиготную форму и, размножаясь путем бинарного деления, превращают клетки хозяина в псевдоцисты. Как у человека, так и у животных наиболее поражаемыми тканями являются сердечная, скелетные и глазные мышцы. Однако паразитов можно обнаружить в клетках кожи, подкожной и жировой тканях, в подслизистой желудка, в яичках. Продолжительность эндогенного цикла 3—6 дней. Паразиты, кроме механического воздействия, связанного с внутриклеточным размножением, оказывают токсическое и ферментативное, приводящее к разрыву фибрилл сердечной мышцы и ответной воспалительной реакции. Считается также, что причиной некоторых патологических изменений при хронической кардиомиопатии является реакция антиген — антитело, доказательством чему служит обнаружение противосердечных антител и случаи артериита аллергического типа.
Клинические признаки. При остром течении болезни основными клиническими проявлениями являются увеличение сердца, иногда сопровождающееся сердечной недостаточностью, или непостоянными и преходящими изменениями электрокардиограммы, а также поражения ганглиозных клеток периферической нервной системы как результат действия продуктов распада паразита. В большинстве случаев наступает выздоровление. При хроническом течении болезни наблюдаются увеличение сердца и сердечная недостаточность, аритмия, нарушение сердечной проводимости и тромбоэмболия. Каждое из этих нарушений может вызвать внезапную смерть. Так же как и при остром течении, наблюдаются поражения ганглиозных клеток периферической нервной системы.
В Центральной Бразилии при хроническом течении болезни Шагаса, кроме изменений в сердце, наблюдают поражения пищеварительного тракта и дыхательной системы.
Патологоанатомические изменения. При макроскопии характерны признаки — гипертрофия, расширение и истончение стенок верхушек желудочка с образованием апикальной аневризмы и явлениями тромбоза. Гистологические исследования указывают на очаговый миокардит, фиброз и миоцитолиз, повреждение сердечного ганглия с воспалительной реакцией.
Диагноз. На ранней стадии болезни для выявления возбудителя исследуют кровь, пунктат из увеличенных лимфоузлов и из шагомы. Обнаружение в окрашенных мазках изогнутых небольшого размера трипаносом с крупным кинетопластом позволяет легко дифференцировать Т. cruzi от Т. rangeli и африканских видов.
Из серологических методов для постановки диагноза, оценки эффективности химиотерапии и отбора доноров широко применяют реакцию связывания комплемента, непрямой гемагглютинации и непрямой иммунофлуоресценции. Для эпидемиологических исследований также рекомендуется реакция латекс-агглютинации и прямой агглютинации.
Иммунитет и средства специфической профилактики для человека не разработаны. У животных иммунитет к Т. cruzi может развиться в результате применения живых трипаносомных штаммов с низкой естественной вирулентностью или дезинтегрированных убитых паразитов.
Профилактика и меры борьбы. Своевременное выявление больных животных и паразитоносителей, а также больных людей снижает зараженность триатомовых клопов. Основное мероприятие — повышение социально-экономического уровня сельского и городского населения в странах, неблагополучных по болезни Шагаса.
Болезнь Шагаса (известная также как американский трипаносомоз)
Болезнь Шагаса, известная также как американский трипаносомоз, — потенциально опасное для жизни заболевание, вызываемое простейшим паразитом Trypanosoma cruzi.
По имеющимся оценкам, паразитарным возбудителем болезни Шагаса T cruzi заражено от 6 до 7 млн человек в мире. Болезнь Шагаса встречается преимущественно в эндемичных районах 21 страны континентальной части Латинской Америки 1 , где ранее она в основном передавалась людям и другим млекопитающим через продукты жизнедеятельности триатомовых клопов (переносчиков), известных под разными названиями в зависимости от географической области, в том числе как «поцелуйные клопы».
Болезнь Шагаса названа именем бразильского врача и ученого Карлуса Рибейру Жустиниану Шагаса, который открыл эту болезнь в 1909 г. В мае 2019 г. по решению семьдесят второй сессии Всемирной ассамблеи здравоохранения был учрежден Всемирный день борьбы с болезнью Шагаса, отмечаемый 14 апреля (в этот день в 1909 г. Карлус Шагас диагностировал первый случай этой болезни у человека — двухлетней девочки по имени Беренис.
Распространение
Ранее распространение болезни Шагаса ограничивалось исключительно сельскими районами континентальной части Региона стран Америки — преимущественно Латинской Америки (за исключением островов Карибского бассейна). Однако в настоящее время, главным образом в результате роста мобильности населения за последние десятилетия, большинство лиц с данной инвазией проживают в городских районах (урбанизация заболевания), в результате чего она все чаще встречается в Соединенных Штатах Америки, Канаде, многих европейских странах, а также в некоторых странах Африки, Восточного Средиземноморья и Западной части Тихого океана.
Передача заболевания
В Латинской Америке паразиты T. сruzi передавались в основном в результате контакта с продуктами жизнедеятельности инфицированных кровососущих триатомовых клопов. В сельских или пригородных районах эти потенциальные переносчики паразитов, как правило, обитают в трещинах стен или крыш жилых домов и таких бытовых построек, как курятники, загоны для скота и складские помещения. В дневное время они обычно прячутся, а по ночам становятся активными и питаются кровью млекопитающих, в том числе людей. Обычно они кусают в открытые участки кожи, в частности на лице (отсюда распространенное название «поцелуйные клопы»), и выделяют продукты своей жизнедеятельности рядом с местом укуса. Паразиты проникают в организм человека, когда он инстинктивно втирает эти выделения в место укуса, глаза, рот или трещину на коже.
T. cruzi может также передаваться:
- при потреблении пищевых продуктов, загрязненных T. cruzi, например в результате их соприкосновения с продуктами жизнедеятельности триатомовых клопов или сумчатых (такая передача, как правило, вызывает вспышки с одновременным заражением целых групп людей и более высокой заболеваемостью и смертностью);
- от инфицированной матери новорожденному ребенку во время беременности или родов;
- при переливании крови или препаратов крови, полученных у инфицированных доноров;
- при трансплантации некоторых органов, взятых у инфицированных доноров;
- в случае лабораторных инцидентов.
Признаки и симптомы
Болезнь Шагаса протекает в двух стадиях. Первая — острая — стадия длится около двух месяцев после заражения. В острой стадии в крови циркулирует большое количество паразитов, однако в большинстве случаев симптомы болезни отсутствуют или протекают в легкой форме и являются неспецифическими. Менее чем у 50% людей, укушенных триатомовым клопом, характерными первыми видимыми признаками могут быть поражения кожи или багровый отек век на одном глазу. Кроме того, они могут включать лихорадку, головную боль, увеличение лимфатических узлов, бледность, мышечную боль, затрудненное дыхание, отеки и боль в области живота и груди.
На протяжении второй стадии паразиты концентрируются в основном в сердце или мускулатуре пищеварительного тракта. Спустя одно–три десятилетия до 30% пациентов начинают страдать нарушениями сердечной деятельности, а до 10% пациентов — желудочно-кишечными (обычно в виде гипертрофии пищевода или толстой кишки), неврологическими или комбинированными расстройствами. В последующие годы у таких пациентов инвазия может приводить к поражению сердечной мышцы и нервной системы с последующей сердечной аритмией или прогрессирующей сердечной недостаточностью и внезапной смертью.
Лечение
Болезнь Шагаса можно лечить бензнидазолом, а также нифуртимоксом, что позволяет уничтожить паразита. Если лечение обоими препаратами начато вскоре после инфицирования в начале острой стадии, его эффективность составляет почти 100%, в том числе в случаях врожденной инвазии. Однако, чем дольше сохраняется инвазия, тем менее эффективными становятся эти препараты, а в более пожилом возрасте чаще развиваются побочные реакции. Лечение показано также пациентам с реактивированной инфекцией (например, в результате подавления иммунитета) и пациентам в начальной хронической стадии, в том числе девочкам и женщинам детородного возраста (до или после беременности) для профилактики врожденной передачи инвазии.
Лечение следует предлагать взрослым пациентам с инвазией, особенно при отсутствии симптомов, поскольку лечение противопаразитарными препаратами может также предотвращать или сдерживать прогрессирование заболевания. В остальных случаях следует сбалансированно учитывать потенциальные преимущества лекарственного лечения для предотвращения или задержки развития болезни Шагаса и длительность лучения (до двух месяцев), а также возможные побочные реакции (которыми страдают до 40% взрослых пациентов, получающих лечение). Бензнидазол и нифуртимокс не должны принимать беременные женщины или пациенты с почечной или печеночной недостаточностью. Нифуртимокс также противопоказан людям с неврологическими или психиатрическими расстройствами. Дополнительно пациенту может потребоваться специфическое лечение нарушений сердечной деятельности, желудочно-кишечных или неврологических расстройств.
Борьба и профилактика
Изначально (более 9 000 лет назад) T. сruzi поражал только диких животных. Позднее эта инвазия распространилась на домашних животных и людей. Ликвидировать ее не представляется возможным в связи с наличием большого резервуара паразитов T. cruzi среди диких животных в странах Америки. Таким образом, целями борьбы являются элиминация передачи заболевания и своевременное оказание медицинской помощи лицам с инвазией.
Против болезни Шагаса не существует профилактической вакцины. T. cruzi может инфицировать несколько видов триатомовых клопов, большинство из которых встречаются в странах Америки. Самым эффективным способом профилактики болезни Шагаса в Латинской Америке является борьба с переносчиками. Во всех странах для предотвращения инвазий в результате переливания крови или пересадки органов, а также для более эффективной диагностики и оказания помощи затронутым группам населения необходимо проводить скрининг крови.
В зависимости от географического района ВОЗ рекомендует следующие методы профилактики заболевания и борьбы с ним:
- опрыскивание жилых помещений и придомовой территории инсектицидами остаточного действия;
- ремонт домов и поддержание чистоты в быту для предотвращения инфестации переносчиками болезни;
- принятие индивидуальных профилактических мер, таких как использование прикроватных сеток, соблюдение надлежащих мер гигиены при приготовлении, транспортировке, хранении и употреблении пищи;
- организация информационных, просветительских и разъяснительных мероприятий по вопросам принятия профилактических мер и методов эпиднадзора с учетом потребностей различных субъектов и различных сценариев;
- скрининг доноров крови;
- тестирование доноров и реципиентов органов, тканей и клеток;
- обеспечение доступа к диагностике и лечению лиц, которым по медицинским основаниям показано или рекомендовано проведение противопаразитарного лечения, особенно детей и женщин детородного возраста до наступления беременности; и
- скрининг новорожденных и детей более старшего возраста, рожденных инфицированными матерями, которые не получали противопаразитарного лечения, для обеспечения своевременной диагностики и лечения.
Согласно расчетам, расходы на оказание медицинской помощи пациентам с сердечной, желудочно-кишечной, неврологической или комбинированной формой заболевания более чем на 80% превышают стоимость мероприятий по опрыскиванию инсектицидами остаточного действия для борьбы с переносчиками и профилактики инфицирования.
Деятельность ВОЗ
С 1990-х гг. в рамках сотрудничества с Секретариатом Панамериканской организации здравоохранения достигнуты значительные успехи в борьбе с паразитами и переносчиками болезни в Латинской Америке, а именно на территории Южного конуса, Центральной Америки, стран Андского пакта и стран Амазонских межправительственных инициатив. Эти международные инициативы позволили существенно уменьшить масштабы передачи инвазии и повысить доступность средств диагностики и противопаразитарного лечения.
Кроме того, в континентальных странах Латинской Америки благодаря обеспечению всеобщего скрининга всеми банками крови существенно снижен риск передачи инвазии при переливании крови. Всеобщий скрининг крови введен также в банках крови Соединенных Штатов Америки и большинства стран Европы и Западной части Тихого океана, где регистрируются случаи заболевания.
Эти достижения стали возможны благодаря решительным усилиям государств-членов, затронутых болезнью, а также благодаря наращиванию потенциала их организаций в области научных исследований и борьбы с этой болезнью при поддержке со стороны многих международных партнеров.
В 2005 г. Всемирная организация здравоохранения включила болезнь Шагаса в число забытых тропических болезней. Это способствовало более широкому признанию заболевания как проблемы общественного здравоохранения на международной арене и позволило противодействовать дезинформации, укреплять социальный запрос и политический курс на решение проблем, связанных с болезнью Шагаса, и устранять пробелы в научных исследованиях и разработках в области ее профилактики, выявления и комплексного оказания помощи, в том числе для выработки средств диагностики и лечения, информирования о лекарственных препаратах, методов решения социальных вопросов, информационных, просветительских и коммуникационных инструментов.
В принятой в 2020 г. дорожной карте по забытым тропическим болезням на 2021–2030 гг. предусматривается пять целей в области борьбы с болезнью Шагаса:
- верификация ликвидации передачи болезни переносчиками в жилых помещениях;
- верификация ликвидации гемотрансфузионной передачи болезни;
- верификация ликвидации передачи болезни при пересадке органов;
- элиминация врожденной болезни Шагаса;
- повышение уровня охвата противопаразитарным лечением целевых категорий населения до 75%.
В то же время будет необходимо решить ряд дополнительных проблем. К ним относятся:
- трудности в сохранении и закреплении успехов, достигнутых в области профилактики и контроля инфекции, особенно в контексте санитарно-эпидемиологических и социально-экономических последствий пандемии COVID-19;
- появление болезни Шагаса в районах, ранее считавшихся свободными от нее, например в бассейне Амазонки;
- продолжение циркуляции болезни в регионах, где принимаются меры по контролю инфекции, например в регионе Чако в Аргентине или на территории Многонационального Государства Боливия;
- распространение болезни, преимущественно обусловленное растущим перемещением населения между Латинской Америкой и остальным миром;
- наличие контингента лиц с инвазией, проживающих в странах/районах, где учреждения здравоохранения имеют мало информации и опыта в отношении этой болезни;
- предупреждение последствий низкой осведомленности или нехватки знаний, стигматизация и/или дискриминация в связи с болезнью Шагаса;
- низкий уровень регистрации случаев болезни, слабый мониторинг и эпиднадзор и низкий уровень верификации успехов, достигнутых в области борьбы с заболеванием; и
- недостаточная доступность услуг по диагностике и лечению для миллионов лиц с инвазией.
Для достижения цели по элиминации передачи болезни Шагаса и предоставлению медицинской помощи инфицированным и больным людям как в эндемичных, так и в неэндемичных районах ВОЗ намерена расширять сетевое взаимодействие на глобальном уровне и усиливать региональный и национальный потенциал, уделяя основное внимание таким мерам, как:
- укрепление систем регистрации случаев, национальных информационных систем и глобального эпидемиологического надзора;
- повышение информированности о болезни Шагаса и о проблемах, с которыми сталкиваются затронутые ею группы населения;
- разработка инновационных стратегий, направленных на прерывание передачи болезни переносчиками (в рамках концепций «Единое здоровье» и «Экоздоровье»);
- предупреждение передачи заболевания при переливании крови и пересадке органов;
- содействие разработке наиболее эффективных и практичных диагностических тестов и алгоритмов/протоколов для расширения скрининга и диагностирования случаев инвазии;
- расширение мер первичной профилактики передачи врожденной инвазии и ведения случаев врожденной и приобретенной инвазии;
- формирование консенсуса относительно надлежащего ведения пациентов на основе актуальных данных, в том числе при сочетанных инфекциях и на фоне других болезней (таких как COVID-19, ВИЧ/СПИД, стронгилоидоз и т. д.);
- содействие разработке комплексных подходов с учетом широкого круга аспектов проблемы.
1 Аргентина, Белиз, Боливия (Многонациональное Государство), Бразилия, Чили, Колумбия, Коста-Рика, Эквадор, Сальвадор, Французская Гайана, Гватемала, Гайана, Гондурас, Мексика, Никарагуа, Панама, Парагвай, Перу, Суринам, Уругвай и Венесуэла (Боливарианская Республика).
Болезнь Чагаса
Болезнь Шагаса – это инфекционное заболевание, вызываемое Trypanosoma cruzi, которое передаётся при укусах триатомовых клопов либо, значительно реже, при употреблении сока сахарного тростника или пищи, зараженных инфицированными насекомыми или их фекалиями, трансплацентарно от инфицированной матери плоду либо при переливании крови или пересадке органов от инфицированного донора. Симптомы начинаются после укуса триатомового (Triatominae) клопа, обычно с поражения кожи или одностороннего периорбитального отека, затем прогрессируют до лихорадки, выраженного недомогания, генерализованного увеличения лимфатических узлов и гепатоспленомегалии, несколько лет спустя у 20-30% инфицированных пациентов развиваются аритмии, хроническая кардиомиопатия, или, реже, мегаэзофагус или мегаколон. У пациентов со СПИДом возможно поражение кожи и мозга. Диагноз ставится по обнаружению трипаносом в периферической крови или в пунктатах из зараженных органов. Анализы на антитела чувствительны и могут быть полезны. Лечение проводится нифуртимоксом или бензнидазолом, тем не менее противопаразитарные препараты не способствуют регрессии заболеваний сердца или кишечника, которые появились вследствие инфицирования. Эффективным может быть поддерживающее лечение.
T. cruzi передается триатомовыми клопами (клопы-убийцы, поцелуйные клопы или конусоносные клопы) в Южной и Центральной Америке, Мексике и очень редко в США. К носителям, помимо людей, относятся домашние собаки, опоссумы, броненосцы, крысы, еноты и многие другие животные. Значительно реже T. cruzi передаётся при употреблении в пищу зараженных инфицированными триатомовыми клопами или их испражнениями тростникового сока или пищи, трансплацентарно от инфицированной матери плоду либо при переливании крови или трансплантации органов от инфицированного донора.
Во всем мире приблизительно 8 миллионов человек хронически инфицированы T. cruzi. Большинство проживает в Латинской Америке, но около 300 тысяч из них, инфицированных в свое время в Латинской Америке, в настоящее время проживают в США; другие – в Европе или других местах. Частота инфицирования T. cruzi в Латинской Америке сокращается благодаря улучшению условий быта, скринингу доноров крови и органов и другим мерам контроля. Есть приблизительно 40 000 T. cruzi-инфицированных женщин детородного возраста в США. По оценкам, от 1 до 5% их детей рождаются с врожденной инфекцией.
Патофизиология болезни Шагаса
Болезнь Шагаса чаще всего распространяется, когда клоп вначале кусает инфицированного человека или животное, а затем кусает другого человека. При укусе зараженные клопы на коже откладывают экскременты, содержащие метациклические трипомастиготы. Они проникают в организм человека через ранку укуса, конъюнктиву или слизистые оболочки.
Паразиты фагоцитируются макрофагами и внутри их превращаются в амастиготы, которые размножаются делением. Амастиготы развиваются в трипомастиготы, выходят в кровоток, с которым разносятся в другие ткани. Обычно поражаются клетки ретикулоэндотелиальной системы (РЭС), миокарда, мышц и нервной системы.
Читайте также:
