МРТ при паранеопластической миелопатии
Добавил пользователь Евгений Кузнецов Обновлено: 18.01.2026
Диагноз РС — клинико-визуализационный, требует подтверждения диссеминации в пространстве (признаков многоочагового поражения головного мозга) и во времени (несколько обострений по данным клинической или иной оценки или очаги различной давности при МРТ с контрастным усилением).
При несоблюдении одного из условий, для своевременной постановки диагноза используются данные о наличии олигоклональных антител в ликворе.
МРТ — метод выбора для подтверждения клинического диагноза РС. Выявление на МРТ головного и спинного мозга очагов, гиперинтенсивных в Т2-режиме, накапливающих контраст, используется как суррогатный маркер обострения РС. МРТ имеет высокую чувствительность и специфичность — 87 и 73 %, соответственно и выявляет значительно больше очагов демиелинизации при РС, чем компьютерная томография (КТ). МРТ может выявить повреждения, расположенные в областях, изменения которых редко выявляются на КТ: ствол головного мозга, мозжечок и спинной мозг. Большинство очагов, выявленных на МРТ, подтверждается данными патологоанатомических исследований.
Очаги на МРТ, характерные для РС, обычно выявляются в перивентрикулярных областях, мозолистом теле, семиовальном центре и, реже, в структурах подкоркового белого вещества и подкорковых ядрах. Очаги РС (бляшки) обычно овальной формы. Очаги, как правило, распространяются от мозолистого тела под прямым углом; при оценке изображений на сагиттальных срезах, такой характер изменений называется пальцы Доусона. Очаги РС имеют повышенную интенсивность на протонной плотности и T2-взвешенных изображениях. Многие очаги, особенно которые отмечаются длительно, гипоинтенсивные на T1-взвешенных изображениях (так называемые, «чёрные дыры»); другие становятся совсем неразличимыми.
При использовании стандартных T2-взвешенных последовательностей МРТ, возможна недооценка размера бляшек РС, их общего количества, в особенности в корковых областях. Дополнительные последовательности МРТ, такие как диффузионно-взвешенные изображения и МР-спектроскопия, часто выявляют вовлечение участков белого вещества пациентов РС сигнал от которых, при использовании других последовательностей, нормальный. Однако, ввиду высокой частоты встречаемости неспецифических поражений головного мозга, высок риск ложноположительных результатов. Более того, изменение диагностических критериев McDonald в 2017 году, вероятно, сделает эту проблему более значимой.
МРТ спинного мозга
Очаги при проведении МРТ спинного мозга у больных РС выявляются также часто, как и очаги головного мозга, при этом, первые чаще бывают бессимптомными. У здоровых лиц, напротив, частота выявления патологических сигналов на МРТ спинного мозга составляет всего 2%, поскольку, не связанные с РС гиперинтенсивные изменения сигнала на МРТ головного мозга, характерные для пожилых людей, не отмечаются в спинном мозге.
МР-характеристики типичных очагов в спинном и головном мозге сходны.
Перифокальный отёк ткани спинного мозга незначителен или не отмечается.
- Очаги имеют чёткий гиперинтенсивный характер на T2-взвешенных последовательностях и отмечаются в двух срезах (аксиальном или сагиттальном).
- Размер очагов не менее 3 мм, но, как правило, меньше двух сегментов спинного мозга. Занимают только часть поперечника спинного мозга и, обычно, располагаются в дорсолатеральной части спинного мозга.
- Ограниченные (чётко отличаются от окружающих тканях на T2-взвешенных последовательностях)
Дополнительное проведение МРТ спинного мозга может увеличить вероятность выявления диссеминации очагов в пространстве и повысить диагностическую чувствительность, по сравнению с проведением только МРТ головного мозга. Возможная диагностическая ценность МРТ спинного мозга при РС показана в исследовании с участием 104 пациентов на ранней стадии РС, имеющих низкую степень инвалидизации (Bot JC, Barkhof F, 2004). Постановка диагноза РС проводилась в соответствии с критериями Poser с соавт. (1982). Патологические очаги на МРТ спинного мозга были выявлены у 83%, очаги были фокальными; фокальные очаги чаще были множественными (медиана количества 3), небольшого размера (медиана размера 0,8 позвоночного сегмента) и локализованными преимущественно в шейном отделе позвоночника (56%). Диффузное поражение было выявлено у 13%, обычно сочеталось с выявлением очагов. В этой группе пациентов, оценка спинного мозга, в дополнение к МРТ головного мозга, в сравнении с проведением только МРТ головного мозга, повышало диагностическую чувствительность оригинальных критериев McDonald (2001) с 66 до 85%.
Большая протяжённость очагов спинного мозга, особенно, если она превышает три сегмента спинного мозга; если поражение вовлекает преимущественно центральные отделы спинного мозга на аксиальных срезах МРТ, характерны для оптиконевромиелита или сходных заболеваний.
Сравнительные характеристики острых и хронических очагов
Острые очаги РС на МРТ, как правило, более крупные, чем хронические и имеют несколько размытые границы. По мере разрешения, они уменьшаются в размере, края становятся более ровными. Эти изменения отражают прежде всего уменьшение отёка и воспаления, возникающих при формировании активной бляшки; с достижением ремиссии; остаются только резидуальная область демиелинизации, глиоза и увеличенные межклеточные пространства. МР-картина первично-прогрессирующего рассеянного склероза представлена меньшей распространённостью изменений, большей встречаемостью небольших очагов, меньшим количеством новых очагов, накапливающих гадолиниевый контраст, для неё характерно менее активное появление очагов в единицу времени, чем при вторично-прогрессирующей форме РС (Ingle GT, Thompson AJ, 2002).
Гадолиний-ДТПА, парамагнитное контрастное вещество, которое может проникать только через повреждённый гематоэнцефалический барьер и помогает выявлять активные очаги повреждения. Гадолиний повышает интенсивность сигнала на T1-взвешенных изображениях. Нет однозначного мнения о том, что воспаление является провоцирующим фактором, вызывающим демиелинизацию и аксональную дегенерацию, однако интенсивность «окраски» гадолиниевым контрастом уменьшается или исчезает после лечения глюкокортикоидами, терапия восстанавливает целостность гематоэнцефалического барьера.
Очаги накопления гадолиниевого контраста на T1-взвешенных последовательностях МРТ часто соответствуют областям повышенного сигнала на T2-взвешенных изображениях и низкой интенсивности сигнала на T1-взвешенных изображениях без контрастного усиления, возможно, ввиду отёка. Важность очагов накопления гадолиниевого контраста при РС подтверждается следующими фактами:
- Накопление гадолиния в бляшках указывает на развитие новых и активизацию старых очагов РС, что подтверждается данными гистологических исследований.
- Большинство очагов, накапливающих контраст, не имеют клинических проявлений, однако, такие изменения указывают на сохраняющуюся активность заболевания, способствующую прогрессированию повреждения мозга.
- Гадолиниевое усиление — транзиторный феномен, обычно исчезающий через несколько недель, но в редких случаях, он может продолжать отмечаться в острых бляшках в течение восьми недель. В одном исследовании было установлено, что средняя продолжительность времени, когда отмечается усиление составляет три недели, медиана продолжительности — две недели. Длительное сохранение очагов, накапливающих контраст, требует пересмотреть диагноз РС (Cotton F, Weiner HL, 2003).
- В долговременных исследованиях показано сочетание активных очагов на сериях МР-изображений с высоким риском длительной активности заболевания (Molyneux PD, Filippi M, 1998; Simon JH. 1999).
Особенности гадолиниевого усиления дают ценную информацию о патологических механизмах развития очагов. Концентрические очаги накопления контраста без контрастирования центральных частей очагов на месте прежних очагов или в областях усиленного фокального воспаления. Они более крупных размеров и сохраняются более длительно, чем очаги с однородным усилением. Однако, кольцевидные усиления редко сочетаются с развитием гипоинтенсивных поражений на МРТ в T1 режиме.
Поэтому, кольцевидные очаги связываются с повышением активности заболевания и распространённым поражением ткани и могут быть признаком воспалительных изменений, более характерных для агрессивных форм заболевания. Кольцевидное усиление может развиваться в виде неполных (разомкнутых) колец, что более характерно для РС, чем для инфекционных и опухолевых заболеваний.
Большинство очагов РС изоинтенсивны по отношению к белому веществу на T1-взвешенных МР-изображениях, однако, некоторые из них, гипоинтенсивны или выглядят как «чёрные дыры», что особенно характерно для супратенториальных очагов. Эти гипоинтенсивные очаги не имеют определённых временных характеристик, приблизительно половина из них приобретают характеристики нормальной мозговой ткани через несколько месяцев. Исчезновение чёрных дыр наиболее вероятно связано с ремиелинизацией и регрессом отёка (Bitsch A, Kuhlmann T, 2001).
Несмотря на скудность доказательных данных, персистирующие чёрные дыры рассматриваются как признаки тяжёлой демиелинизации и гибели аксонов. На патогистологическом уровне, как было показано в исследовании, сопоставливавшем данные МРТ и патологоанатомических исследований, причиной накопления персистирующих чёрных дыр, является прежде всего аксональное повреждение. Такие очаговые повреждения аксонов, вероятно, способствуют Валлеровской дегенерации нейронов. В противоположность этим данным, в другом исследовании чёрные дыры рассматриваются как признаки ремиелинизации (Barkhof F, Bruck W, 2003).
Усовершенствованные методы МРТ
На основании данных стандартных (конвенционных) последовательностей трудно отличить отёк при развитии острых бляшек от глиоза и демиелинизации на месте хронических. Кроме того, стандартные последовательности МРТ не могут различить другие проявления патологического процесса при РС, такие как демиелинизацию, ремиелинизацию, гибель аксонов и глиоз.
Фосфорная магнитно-резонансная спектроскопия (МРС) может оценить показатели метаболизма фосфолипидов, протонная МРС предоставляет информацию о других метаболитах, таких как N-ацетиласпартат (NAA, вещество, которое находится только в нейронах), креатинфосфат (Cr, источник энергии), соединения, содержащие холин (компоненты мембраны), и молочная кислота (МК). Хроническое течение РС сопровождается уменьшением количества NAA, по сравнению с количеством холина и Cr в головном мозге. Наиболее часто, это оценивается при помощи отношения NAA/Cr. Уменьшенное отношение означает гибель нейронов или аксонов, что соответствует данным патологоанатомических исследований, и протекает одновременно с развитием функциональных нарушений при РС. Более того, концентрация NAA во всём головном мозге может быть чувствительным суррогатным маркером нейрональной гибели при РС (Rigotti DJ, Inglese M, 2007,2012).
Диффузионно-взвешенные и диффузионно-тензорные последовательности МРТ, как и МРС, могут обеспечить информацией о распространённости гибели аксонов и диффузных изменений нормального белого вещества, а также, о динамике изменений серого вещества, которое на стандартных последовательностях выглядит нормально. Количественные методики МРТ, такие как отношение переноса намагниченности, всё чаще используются для оценки содержания миелина и количества аксонов.
Диффузионно-тензорные последовательности помогают проводить оценку фракционной анизотропии, что отражает соотношение объёма однонаправленного движения молекул воды к объёму разнонаправленного движения. Эта методика пригодна для оценки целостности проводящих путей белого вещества, у которого, в норме высокая степень анизотропии по причине линейного расположения структур с преимущественным движением воды вдоль миелинизированных волокон. Повреждение аксонов или миелиновых оболочек повышает диффузию воды через структуры проводящих путей и повышает фракционную анизотропию.
Белое вещество с обычными характеристиками, которое непосредственно прилежит к бляшкам на T2 изображениях, может давать аномальный сигнал со сниженной анизотропией. Например, в исследовании, в котором проводилась оценка 36 бляшек белого вещества головного мозга у 20 пациентов с РС при оценке при помощи фракционной анизотропии было установлено, что средний размер бляшек, уменьшившийся на 40%, был значительно больше (145%) по сравнению с размером при оценке при помощи обычных T2-последовательностей на МРТ.
Несмотря на то, что при РС поражается преимущественно белое вещество, вовлечение коркового серого вещества встречается нередко. Стандартные (конвенционные) T2-взвешенные последовательности МРТ могут недооценивать размер бляшек РС, их общее количество, в особенности в корковых областях. Визуализация поражений серого вещества может быть улучшена при использовании методик МРТ с индукцией магнитного поля 7 Тл, двух — и трёхмерных изображений в режиме FLAIR (режим с подавлением сигнала свободной воды), импульсной последовательности с применением двойной инверсии T1-взвешенных изображений, и диффузионно-тензорных изображений.
Радиологически изолированный синдром
Радиологически изолированный синдром (РИС) определяется как случайная находка на МРТ головного (чаще) или спинного мозга. Как правило, причиной направления на МРТ служит другое состояние, не связанное с подозрением на РС, — головная боль или травма.
Кроме аномалий белого вещества, у отдельных пациентов с РИС на МРТ в режиме импульсной последовательности с применением двойной инверсии выявлялись демиелинизирующие поражения коры головного мозга.
Характерные изменения белого вещества, у пациента, даже в отсутствии неврологических нарушений, могут быть основой для подозрения на РС. Для описания случайных находок на МРТ — изменений белого вещества, характерных для рассеянного склероза Okuda с соавт (2009) был предложен термин «радиологически изолированный синдром» (РИС).
Очаги у пациентов без характерных для рассеянного склероза симптомов в анамнезе, должны соответствовать критериям по внешнему виду и признакам диссеминации в пространстве: овоидные, с чёткой границей или однородные очаги, как с вовлечением мозжечка, так и без; гиперинтенсивные на T2 >3 мм и соответствующие как минимум трём из четырёх критериев Barkhof
(1) девять и более очагов, или один или более очагов накапливающих контраст,
(2) три или более перивентрикулярных очага,
(3) один или более юкстакортикальных очага, и
(4) один или более инфратенториальных очага; и характер изменений белого вещества ЦНС не соответствует сосудистому.
РИС — относительно редкое состояние. В исследовании с участием госпитализированных пациентов, распространённость составила 0,15% у лиц в возрасте 15–40 лет которым проводилось МР головного мозга по различным медицинским показаниям (Granberg T, Martola J, Aspelin P, 2013). В Шведском регионе с высокой распространённостью рассеянного склероза (заболеваемость в Швеции составляет 10,2/100,000 человек в год), частота вновь выявленных случаев РИС составила 0,8 на 100,000 человек в год (Forslin Y, Granberg T, Jumah A. A. ). В течение последующих 5 лет после выявления РИС, демиелинизирующий эпизод с неврологическими нарушениями развивался у 30% пациентов с РИС, и у двух третей — отмечено прогрессирование появлением визуализационных признаков новых поражений на МРТ (Labiano-Fontcuberta A, Benito-Leon J. 2016). В настоящее время РИС не является показанием для назначения болезнь-модифицирующего лечения.
В ретроспективном исследовании с участием 326 пациентов (218 женщин, средний возраст 34,5 лет в диапазоне 10–55 лет) проводилось МРТ до и после контрастного усиления по причине головной боли без диагноза рассеянного склероза или клинически изолированного синдрома, распространённость гиперинтенсивности белого вещества составила 51.5%. [63] Картина соответствующая «контактному » критерию Barkhof выявлялась у 2,4% пациентов, а критерию Barkof 3 мм у 7,1%. Критериям McDonald соответствовали 24,4% (»контактные») и 34,5% — 3 мм. Соответствие «контактному» критерию предполагает перивентрикулярные очаги, прилежащие к желудочкам, а 3 мм критерии — перивентрикулярные очаги, отграниченные от желудочков 3 мм. Для сравнения, распространённость рассеянного склероза в общей популяции составляет 0,085% (Liu S, Kullnat J, Bourdette D, 2013).
МРТ критерии диагностики рассеянного склероза MAGNIMIS (2016)
Наличие очагов в двух из пяти типичных локализаций:
- ≥3 очагов перивентрикулярно
- ≥1 очага в зрительном нерве
- ≥1 очага юкстакортикально/кортикально
- ≥1 очага субтенториально
- ≥1 очага в спинном мозге
Не имеет значения симптомность очагов в стволе мозга, спинном мозге и зрительном нерве
Международный неврологический журнал 4 (90) 2017
Паранеопластические спинальные синдромы (научный обзор и личное наблюдение)
Авторы: Фурсова Л.А0.(1), Лихачева Е.М.(2)
(1) — Государственное учреждение образования «Белорусская медицинская академия последипломного образования», г. Минск, Республика Беларусь
(2) — 5-я городская клиническая больница, г. Минск, Республика Беларусь
Версия для печати
Поданий огляд літератури, присвяченої питанням клініки і діагностики паранеопластичних неврологічних синдромів (ПНС) при первинних злоякісних утвореннях внутрішніх органів. Описуються клініка і диференціальна діагностика спінальних форм ПНС: мієліту, некротичної мієлопатії, ураження рухового нейрона. Наводяться критерії діагностики ПНС і опис власного спостереження. Дана патологія здебільшого є передвісником ракового процесу. Виявлення ПНС може сприяти ранній діагностиці раку і дозволити вчасно почати протипухлинне лікування.
Представлен обзор литературы, посвященной вопросам клиники и диагностики паранеопластических неврологических синдромов (ПНС) при первичных злокачественных образованиях внутренних органов. Описываются клиника и дифференциальная диагностика спинальных форм ПНС: миелита, некротической миелопатии, поражения двигательного нейрона. Приводятся критерии диагностики ПНС и описание собственного наблюдения. Данная патология в большинстве случаев является предвестником ракового процесса. Выявление ПНС может способствовать ранней диагностике рака и позволить вовремя начать противоопухолевое лечение.
The article presents a survey of literature on the questions of clinical picture and diagnosis of paraneoplastic neurologic syndromes (PNS) in the primary malignant formations of internal organs. Clinical pattern and differential diagnosis of the following spinal forms of PNS are described: myelitis, necrotic myelopathy, lesion of motor neurons. The criteria for the diagnosis of PNS and the description of our own observation are given. This pathology in the majority of the cases is the warning sign of cancerous process. Detection of PNS can contribute to early diagnosis of cancer and make it possible to begin antitumor treatment in time.
паранеопластичний неврологічний синдром; антионконевральні антитіла; мієліт; мієлопатія
паранеопластический неврологический синдром; антионконевральные антитела; миелит; миелопатия
paraneoplastic neurologic syndrome; antionconeural antibodies; myelitis; myelopathy
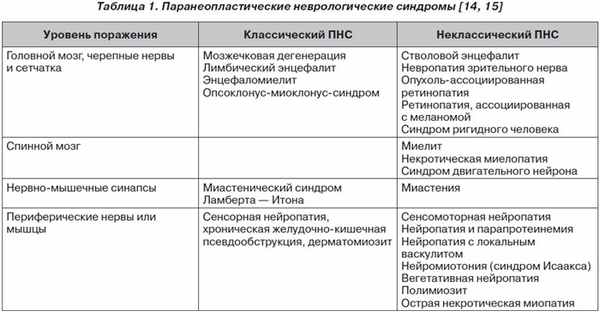
По определению Л.И. Дворецкого, паранеопластический синдром — клинико-лабораторное проявление злокачественной опухоли, обусловленное неспеци–фическими реакциями со стороны различных органов и систем или эктопической продукцией опухолью биологически активных веществ [4]. Согласно последним опубликованным данным [3], ПНС развиваются в 10–18,5 % случаев при мелкоклеточном раке легкого, яичников и молочной железы, толстой кишки, злокачественных лимфомах у лиц среднего и пожилого возраста. Наиболее часто используется классификация ПНС по системному признаку: эндокринные, нейромышечные или мышечно-скелетные, сердечно-сосудистые, дерматологические, гематологические, гастроэнтерологические, нефрологические, неспецифические, смешанные. Неврологические ПС включают поражения центральной и периферической нервной системы, нарушения нейромышечной передачи, вовлечение в процесс скелетных мышц [12, 16, 26]. Новые исследования в нейроонкологии привели к выделению классических и неклассических паранеопластических неврологических поражений (табл. 1).
Большинство авторов [1, 4, 6, 9, 19, 27] склонны считать, что ведущее место в патогенезе развития ПНС занимает иммунный механизм, в основе которого лежит ответная реакция на продукцию опухолью биологически активных веществ (полипептидов, факторов роста, интерлейкинов и др.) с формированием аутоиммунных и иммунных комплексов. Значительное место отводится образованию эктопических рецепторов в опухолевой ткани и блокированию действия нормальных (физиологических) гормонов [9, 27]. J. Wiley и соавт. полагают [27], что появление неврологических синдромов в рамках ПНС обусловлено иммунологическим механизмом антителообразования к антигенам, продуцируемым опухолью. В настоящее время известно около 30 паранеопластических антигенов, ассоциированных с поражением нервной системы у онкологических пациентов [6, 19, 24, 25, 27]. Антитела против подобных антигенов могут появляться в крови обследуемого задолго до того, как будет диагностирован органный рак, но наличие таких антител не обязательно приводит к развитию соответствующего неврологического ПНС. Обнаружение антител в цереброспинальной жидкости (ЦСЖ) и сыворотке крови пациентов является основой практических нейроонкологических диагностических тестов [6]. Согласно иммунным изменениям патогенетическая классификация ПНС различает антителопозитивные и антителонегативные синдромы [10].
Неврологические ПНС возникают в различные сроки развития онкологического заболевания. Клинические признаки ПНС, как правило, развиваются до появления симптомов опухоли или в тех случаях, когда опухоль имеет настолько маленький размер, что является излечимым заболеванием. Если ПНС являются предвестниками рака, клиническая картина пораженного органа протекает нетипично и предпринятая терапия часто не дает положительного результата [3]. К неврологическим ПНС относятся такие варианты, когда первичная локализация рака еще не определена, но есть неврологический дефицит, умеренно выраженные соматические жалобы и идентифицированные онкомаркеры [22]. Онкологическое и неонкологическое заболевание как паранеопластический процесс могут иметь и параллельное развитие [6]. Изучение клинических особенностей и иммунных механизмов послужило основой для разработки критериев диагностики ПНС.
Критерии диагностики пара–нео–пластического синдрома [12, 22]
1. Классический синдром (подострая сенсорная нейропатия, хроническая вегетативная нейропатия с желудочно-кишечной псевдообструкцией, поражение центральной нервной системы, нарушение нервно-мышечной передачи и мышц при онкологических заболеваниях) и злокачественное новообразование, проявляющееся в течение 5 лет после диагностики ПНС.
2. Неклассический синдром, который регрессирует или существенно улучшается после лечения злокачественного новообразования без сопутствующей иммунотерапии, притом что для данного синдрома не характерны спонтанные ремиссии.
3. Неклассический синдром с любыми онконевральными антителами и злокачественным новообразованием, которое проявляется в течение 5 лет после диагностики паранеопластической нейропатии.
4. Неврологический синдром (классический и неклассический) со специфическими онконевральными антителами (к антигенам Hu, Yo, CV2, Ma2, амфифизину) в отсутствие установленного злокачественного новообразования.
1. Классический синдром в отсутствие онконевральных антител или установленного злокачественного новообразования, но при высоком риске онкологического заболевания.
2. Паранеопластический синдром (классический или неклассический) с недостаточно изученными онконевральными антителами (к антигенам Tr, Zic4, mGluR1 и др.) в отсутствие установленного злокачественного новообразования.
3. Неклассический синдром в отсутствие онконевральных антител при наличии злокачественного новообразования, установленного в течение 2 лет после диагностики паранеопластической нейропатии.
В классификации неврологических ПНС представлены следующие формы поражения спинного мозга (СМ): 1) миелит; 2) некротическая миелопатия; 3) синдромы двигательного нейрона.
Миелит — воспалительное заболевание СМ, захватывающее часть его поперечника с поражением как серого, так и белого вещества. Этиология заболевания может быть различной: вирусный, параинфекционный, токсический, паранеопластический процесс, а также миелит при системных аутоиммунных процессах. В большинстве случаев при изолированном воспалении СМ причину заболевания выяснить не удается. К категориям поперечного миелита относят: острый парциальный поперечный миелит и острый полный поперечный миелит, продольный распространенный поперечный миелит. Острый парциальный поперечный миелит характеризуется асимметричным поражением СМ, не превышающим трех сегментов. Острый полный поперечный миелит сопровождается полным/почти полным неврологическим дефицитом ниже уровня повреждения СМ протяженностью не более трех сегментов. «Продольно распространенный поперечный миелит» (LETM — Longitudinally Extensive Transverse Myelitis) — относительно новый термин, под которым понимают идиопатический поперечный миелит. Наиболее частой формой LETM является оптиконейромиелит, при котором спинальные очаги характеризуются центральной локализацией, склонностью к слиянию и увеличением протяженности более чем на три сегмента в длину и более чем на 50 % площади поперечного среза [8]. Наиболее частая локализация подобного миелита — грудной отдел СМ. Доминируют двигательные спинальные нарушения: прогрессирующая спастическая параплегия сменяется вялым параличом в восходящем направлении. Расстройства чувствительности только вначале заболевания имеют диссоциированный, а затем приобретают тотальный характер. Они сопровождаются нарушениями функции тазовых органов (НФТО). Прогрессирование симптомов наблюдается в течение 2 недель. Со стороны ЦСЖ отмечается белково-клеточная диссоциация с легким/умеренным плеоцитозом. При нейровизуализации (магнитно-резонансная томография — МРТ) обнаруживается асимметричное или симметричное поражение трех или более спинальных сегментов СМ (при продольном распространенном миелите). Одним из наиболее важных диагностических тестов при оптиконейромиелите, чувствительность которого составляет 50–75 %, а специфичность — 90 %, является определение в крови антител к аквапорину-4 [5, 8].

Особым вариантом миелита является подострый некротический миелит, описанный Фуа и Алажуанином в 1926 г., который чаще наблюдается у людей пожилого возраста, нередко с хроническим легочным сердцем. Причиной этого миелита, как правило, служит тромбофлебит спинальных вен либо врожденная аномалия венозных сосудов СМ. Клиническая картина характеризуется нарастающим спастико-атрофическим парезом ног, вариабельными расстройствами чувствительности и тазовыми нарушениями. Поражение нижних отделов СМ и конского хвоста увеличивается в течение нескольких лет, постепенно распространяясь вверх. В ЦСЖ повышено содержание белка, однако при ликвородинамических пробах блокирование отсутствует. В крови отмечают увеличение скорости оседания эритроцитов (СОЭ) и лейкоцитоз со сдвигом формулы влево. Подострый некротический миелит почти никогда не диагностируется при жизни. Синдром спинального поражения, клинически не отличимый от подострого некротического миелита, может наблюдаться при паранео–пластической нейропатии, осложняющей висцеральную карциному. Сходную с миелитом картину могут давать злокачественные опухоли и спинальный инсульт.
Неопластические образования в СМ могут быть первичными опухолями и метастазами. Метастатические опухоли, вызывающие компрессию СМ, встречаются у пациентов (3–7,4 %), страдающих раком молочной железы, легких, предстательной железы. Источником метастазов также могут стать лимфомы, саркомы, опухоли яичка, рак почки, желудка, кишки, миеломная болезнь. Обычно опухоль, сдавливающая СМ, прорастает из позвонков, пораженных метастазами, и почти всегда располагается в экстрадуральном пространстве. Опухоли, вызывающие компрессию СМ, обнаруживают в грудном отделе позвоночника у 59–78 % пациентов, пояснично-крестцовом — у 16–33 %, шейном — у 4–15 %, примерное соотношение отделов составляет 4 : 2 : 1. У 25–49 % пациентов отмечаются множественные поражения позвонков [11]. Первым клиническим проявлением компрессии СМ у большинства пациентов являются боль в спине и/или корешковые боли. Локальная боль в спине обычно тупая, ноющая и локализируется в пределах нескольких сегментов. Корешковая боль может быть постоянной или возникать при движении. Болевой синдром часто усиливается при кашле, напряжении, поворотах шеи, в положении на спине. Дальнейшее сдавление СМ обычно проявляется слабостью преимущественно в проксимальных отделах ног и/или нарушением чувствительности в виде парестезий, сенситивной атаксией, которые возникают через недели или месяцы после начала болей. Пациент начинает жаловаться на трудности при вставании с низкого стула, унитаза или при ходьбе по лестнице. Тазовые нарушения обычно присоединяются позднее, однако при компрессии conus medullaris (метастазы в позвонки ТX–LI) нарушения мочеиспускания могут быть первым и единственным симптомом.
Частота интрамедуллярных опухолей среди пациентов всех возрастов составляет 10–18 % от общего числа опухолей СМ [8]. Боль в спине не столь типична. Опухоль, как правило, поражает несколько спинальных сегментов. Клиническая картина таких опухолей СМ развивается достаточно медленно, и на первое место выходят прогрессирующие двигательные расстройства, а чувствительные нарушения, согласно закону эксцентрического расположения длинных проводников, распространяются сверху вниз [17]. В случае кровоизлияния или инфаркта в опухоль симптомы могут развиться остро и имитировать острый поперечный миелит. МРТ регистрирует очаг, захватывающий несколько сегментов СМ, изо- или слабогипоинтенсивный в Т1-взвешенном изображении (ВИ), с неоднородным усилением сигнала от очага в Т2-ВИ. Типичны перифокальный отек, инфильтративный рост, увеличение в размерах СМ, чаще с неровными бугристыми краями. При введении контрастного вещества типично персистирующее накопление контраста, сохраняюще–еся месяцами, несмотря на лечение [7, 23]. Интрамедуллярные метастазы встречаются крайне редко, у 1–2 % больных с раком легких, молочной железы, почки, при меланоме [2]. Боль в спине чаще всего служит первым, хотя и не обязательным симптомом интрамедуллярного метастаза, вслед за ней развиваются нарастающий спастический парапарез и парестезии. Диссоциированное расстройство чувствительности наблюдается редко, обычно отмечаются асимметричный парапарез и частичная утрата чувствительности. При миелографии, компьютерной томографии (КТ) и МРT выявляется отечный СМ без признаков внешней компрессии; почти у 50 % пациентов КТ и миелография показывают нормальную картину.
В отдельных случаях спинальная симптоматика может быть обусловлена сосудистыми нарушениями ишемического типа вследствие сдавления опухолью корешковых и передней спинальной артерий, обычно на нижнем шейном или грудном уровнях. Апоплектиформное поражение СМ, обусловленное метастазом, обычно развивается на фоне анемии и резкого увеличения скорости оседания эритроцитов. Спондилограммы во многих случаях не выявляют деструкции при метастазах в позвоночник, и их роль в диагностике невелика. Подтверждается метастатическое поражение обнаружением висцеральной карциномы. Клиническая картина инфаркта СМ соответствует острому поражению передних отделов спинного мозга [21]: внезапно, на протяжении нескольких минут, развиваются центральный нижний парапарез (иногда — монопарез ноги), который в острой фазе заболевания может быть вялым, но спустя несколько недель трансформируется в спастический; задержка мочеиспускания, которая постепенно переходит в недержание мочи; снижение болевой и потеря температурной чувствительности. Тактильная и вибрационная чувствительность, способность локализовать раздражитель остаются сохранными. Нередко наблюдаются корешковые боли, соответствующие верхнему уровню поражения. На МРТ выявляется пролонгированный карандашеобразный очаг в передних отделах СМ.
«Миелопатия» — термин, применяемый для обозначения подострых и хронических поражений СМ, обусловленных различными патологическими процессами (вертеброгенный, атеросклеротический, посттравматический, интоксикационный, воспалительный, компрессионный, канцероматозный, радиационный, диабетический и др.). Спондилогенная миелопатия представляет собой хроническое ишемическое поражение СМ, связанное с компрессией его сосудов и структур при дистрофических изменениях позвоночника: остеохондрозе, спондилезе, спондилоартрозе. Этиологическими факторами хронической миелоишемии, помимо остеохондроза дисков, могут быть: атеросклероз аорты и ее ветвей, травма, гормональная спондилопатия, врожденный стеноз, хронический спаечный процесс и др. Спондилогенная миелопатия была впервые описана в 1952 г. W.R. Brain, D. Northfield, M. Wilkinson. Клиническая картина этого заболевания, характеризующегося чрезвычайным разнообразием, обусловлена выраженностью спондилогенных компримирующих факторов, компенсаторными возможностями СМ и состоянием его кровоснабжения. К особенностям клинической картины спондилогенной миелопатии относятся:
1) моторно-сенсорная диссоциация, когда на первый план выступают двигательные нарушения (преимущественно спастические или спастико-атрофические парезы; вялые парезы встречаются в 2 раза реже);
2) развитие синдрома бокового амиотрофического склероза или синдрома рассеянного склероза при дисгемии бассейна a. spinalis anterior; синдрома сирингомиелии или фуникулярного миелоза — в бассейне
3) полиморфные чувствительные расстройства: проводниковые, корешково-сегментарно-диссоциированные, полиневритические, мозаичные;
4) негрубые нарушения функции тазовых органов развиваются у 1/3 больных с цервикальной и 1/2 — с поясничной миелопатией;
5) наличие предвестников в виде преходящих двигательных, чувствительных или тазовых расстройств (миелогенная парестезия или симптом «электрического тока» Лермитта, миелогенной перемежающейся хромоты);
Дифференциальная диагностика спондилогенной миелопатии должна проводиться с различной спинальной патологией, но в практической неврологии наиболее часто приходится дифференцировать ее от следующих заболеваний, имитирующих компрессию спинного мозга [13]:
Некомпрессионные онкологические миелопатии
Миелопатии при злокачественных опухолях чаще всего вызывают сдавление спинного мозга. Но если с помощью дополнительной инструментальной диагностики на МРТ или КТ спинного мозга не удается обнаружить ликворный блок, то в дальнейшем так же сложно разграничить внутримозговые (интрамедуллярные) метастазы, паракарциноматозную миелопатию и лучевую миелопатию.
В случае выявления метастазов рака у пациента с прогрессирующей миелопатией без признаков сдавления спинного мозга при миелографии, КТ или МРТ спинного мозга, наиболее вероятен метастаз внутри паренхимы спинного мозга (интрамедуллярный метастаз). Паранеопластическая миелопатия встречается у пациентов значительно реже. Жалоба больного на боли в спине может быть первым (но не обязательным) симптомом метастаза опухоли внутрь паренхимы спинного мозга (интрамедуллярного метастаза). При таком виде расположения метастазов у больного может развиться нарастающий спастический парапарез или парестезии.
Интрадуральная интрамедуллярная опухоль, располагающаяся в центре спинного мозга.
Диссоциированное выпадение чувствительности или ее полное сохранение в крестцовых сегментах спинного мозга, характерно для внутренней компрессии спинного мозга. Такое состояние у больных наблюдаются редко. Чаще выявляются асимметричный парапарез и частичная утрата чувствительности.
При проведении пациенту диагностики с применением миелографии, КТ или МРТ будет виден отек спинного мозга без признаков внешней компрессии. В половине исследований спинного мозга у пациентов на КТ и миелографии может быть видна картина нормы. Поэтому МРТ спинного мозга как диагностический метод наиболее информативна при дифференцировании метастатического очага от первичной опухоли внутри паренхимы спинного мозга (интрамедуллярной опухоли).
Метастазы опухоли внутри паренхимы спинного мозга (интрамедуллярные метастазы) обычно происходят из бронхогенной карциномы, реже из раковой опухоли молочной железы и других солидных опухолей. Метастазы меланомы редко бывает причиной внешней компрессии спинного мозга. Метастазы меланомы чаще встречается в виде опухоли внутри паренхимы спинного мозга (интрамедуллярного объемного процесса). Метастаз меланомы представляет собой одиночный эксцентрически расположенный узел, образующийся в результате попадания в спинной мозг с током крови. Лучевая терапия метастаза меланомы в спинной мозга может эффективна.
Карциноматозный менингит
Менингит в результате карциномы — распространенная форма поражения ЦНС при онкологических заболеваниях. Карциноматозный менингит не вызывает миелопатии, если не происходит его распространения и инфильтрации под мягкую паутинную оболочку спинного мозга с прилежащих нервных корешков. Иначе это приводит к образованию узелков и вторичной компрессии или инфильтрации спинного мозга.
Неполный, не сопровождающийся болями синдром поражения конского хвоста может обусловливаться карциноматозной инфильтрацией образующих его корешков. Больные с карциноматозным менингитом часто жалуются на головные боли. В анализах спинномозговой жидкости (СМЖ, ликвора) в динамике у таких пациентов будут выявляться злокачественные клетки, повышенное содержание белка, снижение концентрации глюкозы.
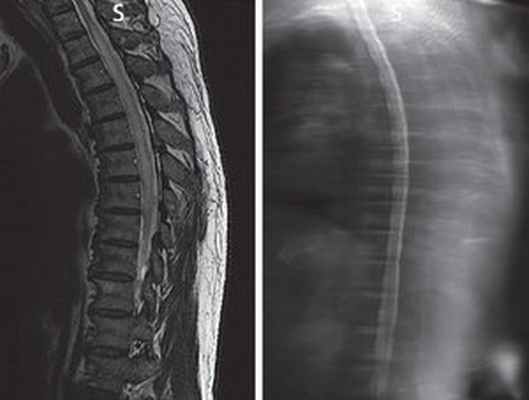
Прогрессирующая некротическая миелопатия
Прогрессирующая некротическая миелопатия, которая сочетает в себе невыраженное воспаление, встречается в качестве отдаленного эффекта рака при солидных опухолях. Миелографическая картина и спинномозговая жидкость (СМЖ, ликвор) обычно нормальные, с незначительным повышением уровня белка. Подострый прогрессирующий спастический парапарез развивается у больных в течение нескольких дней или недель и обычно характеризуется асимметричностью. Этому сопутствуют парестезии в дистальных отделах конечностей, распространяющиеся вверх до формирования уровня чувствительных расстройств, и позднее — нарушение функции тазовых органов (дисфункция мочевого пузыря). При прогрессирующей некротической миелопатии поражаются также несколько соседних сегментов спинного мозга.
Контрастное вещество, видимое при миелографии, вводится в субдуральное пространство посредством люмбальной пункции.
Лучевая (радиационная) миелопатия
Лучевая терапия онкологических заболеваний вызывает у пациентов отдаленную не остро протекающую, но прогрессирующую миелопатию. Она обусловлена гиалинизацией и закупоркой (окклюзией) сосудов. Лучевая (радиационная) миелопатия часто становится серьезной дифференциально-диагностической проблемой для нейрохирурга или невропатолога, когда спинной мозг оказывается в пределах зоны, подвергаемой лучевой терапии на другие структуры, например, на лимфатические узлы средостения. Отличие лучевой (радиационной) миелопатии от паракарциноматозной миелопатией и интрамедуллярным метастазом затруднено, за исключением тех случаев, когда в анамнезе больного имеются четкие сведения о проводимой ранее лучевой терапии.
Миелопатия
Миелопатия является собирательным термином, обозначающим любое повреждение спинного мозга имеющее различный генез. Например, миелопатия может быть канцероматозная (связана с дегенерацией спинного мозга, связанная с раковым процессом) компрессионная (вследствие давления на спинной мозг гематомы или тканей), радиационная миелопатия (происходит разрушение спинного мозга от воздействия ионизирующего излучения – к примеру, при лучевой терапии). Когда причиной повреждения спинного мозга являются заболевания, то миелопатия носит название этого заболевания – например диабетическая миелопатия.
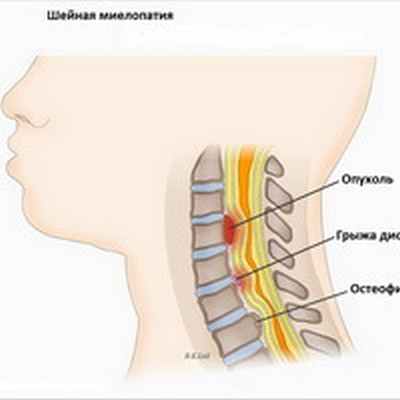
Миелопатия может быть вызвана травмой спинного мозга (перелом или вывих позвонков), грыжей межпозвоночного диска (межпозвонковый диск оказывает компрессионное воздействие на спинной мозг), остеоартрозом позвоночника (спондилез) или объемными поражениями, такими как опухоли. Миелопатия также может быть клиническим проявлением инфекционных или воспалительных процессов, а также нарушений кровообращения в сосудах спинного мозга о (спинальный инсульт). Синдром, который является результатом компрессии спинного мозга с одной стороны спинного мозга на уровне 10 грудного позвонка и сопровождающийся спастическим парезом на стороне повреждения спинного мозга и потерей проприорецепции и болевой и температурной чувствительности на противоположной стороне - называется Броун-Секаровским синдромом и тоже считается разновидностью миелопатии. Причинами миелопатии могут быть также вирусы, иммунные реакции, недостаточность кровообращения в сосудах спинного мозга. Кроме того миелопатия может развиться вследствие демиелинизации (потери нервным волокном защитной оболочки) или как реактивное осложнение на такие прививки как оспа, корь, ветрянка.
Факторы риска
Миелопатия вследствие травмы или заболевания может произойти в любом возрасте как у мужчин, так и у женщин. Степень нарушения функций зависит от уровня поражения спинного мозга.
Чаще всего первичные опухоли спинного мозга встречаются у людей в возрасте от 30 до 50 лет.
Травмы спинного мозга чаще встречаются у мужчин в возрасте от 15 до 35 лет.
Шейная спондилогенная миелопатия является наиболее распространенным повреждением спинного мозга в лиц в возрасте 55 лет и старше. Повышенный риск развития шейной спондилогенной миелопатии имеют люди, которые подвержены повторяющимся травмам - работа связана с переносом тяжестей или занятия такими видами спорта, как гимнастика. Пациенты с наличием сосудистых заболеваний подвержены большему риску закупорки спинальных артерий. Также у пациентов с рассеянным склерозом возможно развитие симптомов миелопатии.
Заболеваемость: Точной информации о частоте миелопатии на сегодняшний день нет. Тем не менее, информация о некоторых распространенных причинах миелопатии существует. К примеру, в США происходит от 12 до 15 000 травм спинного мозга ежегодно. Считается, что у 5% - 10% пациентов с раком велика вероятность роста опухолей в эпидуральное пространство, что приводит к более 25000 случаям миелопатии в год, из них 60% будет возникать в грудном отделе позвоночника, и 30% в пояснично-крестцовом отделе позвоночника.
Распространенность шейной спондилогенной миелопатии составляет 50% среди мужчин и 33% женщин в возрасте старше 60 лет.
Различные опухоли могут привести к компрессии спинного мозга, но первичные опухоли спинного мозга встречаются достаточно редко.
Симптомы и диагностика
История болезни: симптомы миелопатии варьируют в зависимости от причин, тяжести состояния, и является ли состояние являющейся причиной миелопатии острым или хроническим. В случае, когда причиной являются опухоли спинного мозга, компрессия или травмы могут быть боли (которые также могут иррадиировать в руки или ноги), нарушения чувствительности или движений, и / или контрактуры с одной, или с противоположной стороны тела. Если причиной является остеоартрит, могут быть жалобы на боли и болезненность, снижение амплитуды движений в позвоночнике, слабость, возможны деформации позвоночника. Миелопатия может также проявляться нарушением функции мочевого пузыря или кишечника или потерей чувствительности или онемением в области гениталий. Инфекции, вызывающие миелопатию, могут вызвать повышение температуры, покраснение, припухлость, повышенную болезненность. Если у человека синдром Броун-Секара, то может быть спастический паралич на стороне повреждения спинного мозга и потеря проприорецепции и боль, чувство жара на другой стороне тела.
Осмотр
Стандартный неврологический осмотр может выявить заболевания, связанные с компрессией корешков (например, шейная радикулопатия) или наличие спастичности в ногах. Клонусы мышц могут быть признаками расстройств верхнего двигательного нейрона в спинном мозге. Изучение рефлекторной активности позволяет отметить изменения рефлексов (которые могут быть повышенными или сниженными в зависимости от причины), а также потери или изменения чувствительности. Проверка сенсорной чувствительности (от нижних конечностей до лица) может быть необходима для определения уровня нарушений чувствительности. Кроме того, полезно определение активности брюшных рефлексов, что также позволяет уточнить уровень поражения. Также может быть паралич и / или уменьшение чувствительности в различных частях тела. Возможно также снижение объема произвольных движений. Оценка функции прямой кишки тоже имеет важную роль в диагностике миелопатии.
Диагностические методы
Диагностические методы зависят от истории заболевания и физикального обследования. Рентгенография, денситометрия, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) спинного мозга может обнаружить повреждения в пределах или вблизи спинного мозга. Лабораторные исследования могут быть назначены, чтобы исключить другие возможные причины (например, дефицит витамина В12 или отравления солями тяжелых металлов). Повышенное количества белых кровяных телец (лейкоцитов) предполагает наличие инфекции (менингит или остеомиелит позвоночника). Повышенная скорость оседания эритроцитов крови (СОЭ) может быть признаком воспаления, инфекции или опухоли. Спинномозговая пункция может быть проведена для получения спинномозговой жидкости (ликвора) для лабораторных исследований при подозрении на менингит или рассеянный склероз. Другие диагностические процедуры могут включать биопсию костной ткани или мягких тканей, а также посев культуры крови и цереброспинальной жидкости.
Лечение
Лечение зависит от причины миелопатии. Для перелома или вывиха позвонков - обезболивающие (анальгетики), тракция, иммобилизация в течение нескольких недель, и реабилитационная терапия (физиотерапия, ЛФК, массаж). Хирургическое лечение для исправления деформации позвоночника может включать в себя удаление части поломанного позвонка и / или фиксация отломков позвонков. Анальгетики, НПВС, (стероиды), и, возможно, физиотерапия может быть использована для лечения проблем связанных с артритом. Лекарственные препараты для лечения рассеянного склероза могут быть полезными, в том числе новые лекарственные препараты или стероиды. Инфекции требуют применения препаратов для устранения инфекции (антибиотики), для снижения температуры (жаропонижающие), и, возможно, противовоспалительные препараты (стероиды), чтобы минимизировать воспаление. Для лечения миелопатии в результате компрессии спинного мозга может потребоваться операция по удалению опухоли или грыжи межпозвонкового диска (ламинэктомия).
Прогноз
Прогноз зависит от причины миелопатии и наличия стойкого повреждения нервных структур. Тракция и иммобилизация могут привести к полному выздоровлению, если не было повреждения спинного мозга. Полное излечение возможно и при инфекциях. При хронических заболеваниях таких, как артрит или остеопороз, эффект от лечения может быть временным или если заболевание прогрессирует, то возможно стойкая потеря трудоспособности вплоть до инвалидной коляски Травма спинного мозга или компрессия может привести к необратимым изменениям в спинном мозге, включая потерю чувствительности в различных частях тела, а также потерю произвольных движений в конечностях. Восстановление после удаления опухоли зависит от остаточного повреждения и если это раковая опухоль, то от метастазирования. Восстановление после удаления грыжи диска (дискэктомия) дает хороший результат, но только если спинной мозг не подвергся необратимым изменениям в результате компрессии. Осложнениями миелопатии может быть зависимость от обезболивающих, постоянная нарушение чувствительности и / или произвольных движений, деформации позвоночника и нарушения функции мочевого пузыря и кишечника.
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
Миелопатия
Миелопатия — обобщенное понятие, используемое в неврологии для обозначения различных по своей этиологии поражений спинного мозга, обычно имеющих хроническое течение. Клинически они могут проявляться нарушениями силы и тонуса мышц, различными сенсорными расстройствами, дисфункцией тазовых органов. Задачей диагностического поиска при миелопатии является выявление причинного заболевания. С этой целью проводится рентгенография позвоночника, МРТ, ЭМГ, ЭНГ, ангиография, анализ ликвора, биохимические исследования крови, ПЦР-диагностика и др. Лечебная тактика основана на терапии основного заболевания, симптоматическом лечении и реабилитации при помощи ЛФК, механотерапии, массажа, иглоукалывания и физиотерапии.
Общие сведения
Миелопатия является комплексным понятием, включающим в себя любые дистрофические изменения спинного мозга, не зависимо от их этиологии. Как правило, это хронические или подострые дегенеративные процессы, происходящие в результате нарушения кровоснабжения и метаболизма отдельных спинномозговых сегментов. Зачастую миелопатия выступает в роли осложнения дегенеративно-дистрофических заболеваний позвоночника, сосудистой патологии, токсического воздействия, травмы позвоночника, дисметаболических изменений или инфекционных процессов. Поэтому в уточненном диагнозе перед термином «миелопатия» непременно должно стоять указание на природу поражения спинного мозга. Например, «ишемическая миелопатия», «компрессионная миелопатия» и т. д.
Этиология и патогенез миелопатии
В преобладающем большинстве случаев патологические процессы, приводящие к развитию миелопатии, локализуются вне спинного мозга. В первую очередь это дегенеративные изменения позвоночника (остеохондроз, спондилоартроз, спондилез, инволютивный спондилолистез) и травмы (перелом позвонка, подвывих или вывих позвонков, компрессионный перелом позвоночника). За ними следуют сосудистые заболевания (атеросклероз, тромбоз спинальных сосудов), аномалии развития позвоночника, опухолевые процессы в области позвоночника, метаболические нарушения (при диспротеинемии, сахарном диабете, фенилкетонурии, лизосомальных болезнях накопления), туберкулез и остеомиелит позвоночника. К патологическим изменениям спинного мозга может привести радиоактивное и токсическое воздействие на организм.
Реже встречаются миелопатии, обусловленные непосредственным поражением вещества спинного мозга. Первопричиной их возникновения могут являться: позвоночно-спинномозговая травма, инфекционные поражения и опухоли спинного мозга, гематомиелия, демиелинизация. Последняя может носить наследственный (при синдроме Русси-Леви, болезни Рефсума и пр.) или приобретенный (при рассеянном склерозе) характер. В исключительных случаях миелопатия развивается в качестве осложнения люмбальной пункции.
Среди патогенетических механизмов возникновения миелопатии преобладает компрессионный. Возможна компрессия межпозвоночной грыжей, остеофитами, отломками при переломе, опухолью, посттравматической гематомой, смещенным позвонком. При этом происходит как непосредственное сдавление спинного мозга, так и пережатие спинномозговых сосудов, следствием чего является гипоксия и нарушение питания, а затем дегенерация и гибель нервных клеток пораженного спинномозгового сегмента. Возникновение и развитие патологических изменений реализуется постепенно с увеличением компрессии. Результат — выпадение функции нейронов данного сегмента и блокировка проведения через него импульсов, идущих по проводящим путям спинного мозга.
Классификация миелопатии
В современной неврологии миелопатия традиционно классифицируется по этиологическому принципу.
- Спондилогенная (в т. ч. дискогенная) — связана с различными дегенеративными процессами позвоночного столба.
- Ишемическая (дисциркуляторная, атеросклеротическая, сосудистая) — развивается на фоне хронического нарушения спинномозгового кровообращения.
- Посттравматическая — обусловлена как непосредственной травмой спинного мозга (сотрясение, ушиб), так и с компрессионным воздействием гематомы, смещенных позвонков или их частей при переломе.
- Карциноматозная — является проявлением паранеопластического поражения ЦНС при лейкемии, лимфоме, лимфогранулематозе, раке легкого и др. онкологической патологии.
- Инфекционная — встречается при ВИЧ, сифилисе (нейросифилис), болезни Лайма, энтеровирусной инфекции у детей.
- Токсическая — обусловлена токсическим воздействием на ЦНС. Может наблюдаться при дифтерии.
- Радиационная — зависит от дозы и времени радиоактивного облучения. Радиационная миелопатия может возникать после лучевой терапии злокачественных новообразований.
- Метаболическая — редко встречающееся осложнение эндокринных и метаболических расстройств.
- Демиелинизирующая — результат наследственных или приобретенных демиелинизирующих процессов в ЦНС.
Симптомы миелопатии
Клинически миелопатия проявляется целым рядом неврологических симптомов, которые практически не имеют специфики, отражающей ее этиологию, и всецело зависят от уровня и степени поражения спинного мозга. В целом миелопатический симптомокомплекс включает периферический парез/паралич с мышечной гипотонией и гипорефлексией, развивающийся на уровне пораженных сегментов; центральный парез/паралич с мышечным гипертонусом и гиперрефлексией, распространяющийся ниже уровня локализации патологических изменений; гипестезиею и парестезию как на уровне поражения, так и ниже его; тазовые нарушения (задержка или недержание мочи и кала).
Ишемическая миелопатия
Спинномозговые сосуды гораздо реже подвергаются образованию атеросклеротических бляшек и тромбозу, чем церебральные (сосуды головного мозга). Как правило, это происходит у лиц старше 60 лет. Наиболее чувствительными к ишемии являются мотонейроны, находящиеся в передних рогах спинного мозга. По этой причине в клинической картине сосудистой миелопатии ведущее место занимают двигательные нарушения, что напоминает проявления БАС. Расстройства чувствительной сферы минимальны и выявляются лишь при тщательном неврологическом осмотре.
Посттравматическая миелопатия
Представляет собой развивающийся в зависимости от тяжести травмы и течения ближайшего посттравматического периода спинальный синдром. По клиническим проявлениям часто имеет много общего с сирингомиелией, в частности диссоциированный тип чувствительных расстройств: выпадение поверхностной (температурной, болевой и тактильной) чувствительности при сохранности глубокой (мышечно-суставной и вибрационной). Обычно посттравматическая миелопатия носит необратимый характер и составляет основу резидуальных (остаточных) явлений травмы. В отдельных случаях отмечается ее прогредиентное течение с прогрессированием сенсорных нарушений. Зачастую посттравматическая миелопатия осложняется интеркуррентными инфекциями мочевыводящих путей (циститом, уретритом, пиелонефритом); возможен сепсис.
Радиационная миелопатия
Наиболее часто наблюдается в шейных спинномозговых сегментах у пациентов, прошедших лучевую терапию рака глотки или рака гортани; в грудном отделе — у больных, получавших облучение по поводу опухолей средостения. Развивается в период от 6 мес до 3-х лет после лучевых нагрузок; в среднем спустя 1 год. В таких случаях миелопатия нуждается в дифференциальной диагностике со спинномозговыми метастазами имеющейся опухоли. Типично медленное прогрессирование клиники, обусловленное постепенным некрозом тканей спинного мозга. При неврологическом осмотре может выявляться синдром Броун-Секара. В цереброспинальной жидкости изменения не наблюдаются.
Карциноматозная миелопатия
Обусловлена токсическим влиянием опухоли и воздействием синтезируемых ею биологически активных веществ, что в конечном итоге приводит к некротическим изменениям спинномозговых структур. Клинический симптомокомплекс во многом повторяет неврологические нарушения при боковом амиотрофическом склерозе. Поэтому некоторые авторы относят этот вид миелопатии к особой форме БАС. В ликворе может выявляться плеоцитоз и умеренный гиперальбуминоз.
Диагностика миелопатии
Диагностический алгоритм при выявлении признаков миелопатии направлен на исключение другой, сходной по клиническим симптомам, патологии ЦНС и установление этиологического фактора, лежащего в основе дистрофических изменений спинного мозга. Он включает общий и биохимический анализ крови, рентгенографию позвоночника, МРТ позвоночника, электромиографию (ЭМГ), электронейрографию (ЭНГ), исследование вызванных потенциалов, МР- или КТ-ангиографию спинного мозга, люмбальную пункцию.
По показаниям при отсутствии возможности проведения МРТ в отдельных случаях могут быть выполнены миелография и дискография. При подозрении на инфекционную природу миелопатии проводится исследование крови на стерильность, RРR-тест, ПЦР-исследования, посев спинномозговой жидкости.
В ходе диагностического поиска невролог может привлекать к совместному консультированию других специалистов: вертебролога, фтизиатра, онколога, венеролога; при предположении о демиелинизирующей наследственной миелопатии — генетика.
Лечение миелопатии
Тактика лечения миелопатии зависит от ее этиологии и клинической формы. Она включает терапию причинного заболевания и симптоматическое лечение.
При компрессионной миелопатии первоочередным является устранение компрессии. С этой целью может быть показано удаление клина Урбана, дренирование кисты, удаление гематомы и опухоли. При сужении позвоночного канала пациент направляется к нейрохирургу для решения вопроса о возможном проведении декомпрессивной операции: ламинэктомии, фасетэктомии или пункционной декомпрессии диска. Если компрессионная миелопатия обусловлена грыжей межпозвоночного диска, то в зависимости от степени протрузии и состояния диска выполняется микродискэктомия или дискэктомия.
Лечение ишемической миелопатии заключается в устранении факторов компрессии сосудов и проведении сосудистой терапии. Поскольку сосудистый компонент присутствует в патогенезе практически любой миелопатии, подобное лечение входит в комплексную терапию большинства больных. Оно включает спазмолитические и сосудорасширяющие средства (дротаверин, ксантинола никотинат, папаверин, винпоцетин), препараты улучшающие микроциркуляцию и реологические свойства крови (пентоксифиллин).
При токсической миелопатии основу лечения составляет дезинтоксикация, при инфекционной — адекватная этиологии антибактериальная терапия. Большие трудности представляет лечение наследственной демиелинизирующей миелопатии и канцероматозной миелопатии при гемобластозах. Зачастую оно сводится к проведению симптоматической терапии.
Обязательными в лечении миелопатии являются препараты, улучшающие метаболизм нервной ткани и снижающие ее подверженность гипоксии. К ним относятся нейропротекторы, метаболиты и витамины (гидролизат мозга свиньи, пирацетам, гемодериват крови телят, вит В1, вит В6). Многим пациентам показана консультация физиотерапевта для оптимального подбора методов физиотерапевтического воздействия: диатермии, гальванизации, УВЧ, парафинотерапии и пр.
С целью увеличения объема двигательной активности, выработки навыков самообслуживания, предупреждения развития осложнений (мышечных атрофий, контрактур суставов, пролежней, застойной пневмонии) с ранних сроков заболевания больным миелопатией показано проведение ЛФК, массажа и реабилитационной физиотерапии (электростимуляция, электрофорез с неостигмином, рефлексотерапия, СМТ паретичных мышц, водолечение). При глубоких парезах ЛФК состоит в выполнении пассивных упражнений и механотерапии.
Прогноз и профилактика миелопатии
В случае своевременного устранения сдавления компрессионная миелопатия имеет благоприятное течение: при соответствующем лечении ее симптомы могут в значительной степени редуцироваться. Ишемическая миелопатия зачастую имеет прогрессирующее течение; повторные курсы сосудистой терапии могут на время стабилизировать состояние. Посттравматическая миелопатия, как правило, стабильна: ее симптомы не редуцируются и не прогрессируют. Неблагоприятный прогноз и неуклонно прогрессирующее течение имеют радиационная, демиелинизирующая и карциноматозная миелопатия.
Профилактика миелопатии заключается в предупреждении заболеваний, способных привести к ее развитию. Это своевременное выявление и лечение патологии позвоночника и сосудистых заболеваний; стабильная компенсация эндокринных и метаболических расстройств; предупреждение травматизма, инфекционных заболеваний, интоксикаций свинцом, цианидами, гексахлорофеном и др.
Читайте также:
