Факторы противоопухолевого иммунитета. Блокирующие опухоль факторы иммунитета.
Добавил пользователь Владимир З. Обновлено: 29.01.2026
• Доказательства существования
противоопухолевого иммунитета
• Антигены опухоли, понятие, классификация,
характеристика
• Механизмы противоопухолевого иммунитета
• Причины малой чужеродности опухолевых
клеток
• Современные подходы к иммунодиагностике и
иммунотерапии опухолей
3. Доказательства существования противоопухолевого иммунитета
Наличие специфических Т-эффекторов и антител
к антигенам опухолей;
Степень инфильтрации опухоли лимфоцитами
коррелирует с выживаемостью пациентов;
Подавление
иммунологической
реактивности
(радиация, цитостатики) увеличивает частоту
возникновения опухолей;
Заболеваемость раком увеличивается с возрастом,
т.е. параллельно с угасанием иммунологической
реактивности
4. Доказательства существования противоопухолевого иммунитета
У новорожденных животных в эксперименте с
незрелой иммунной системой экспериментальные
опухоли индуцируются легче, чем у взрослых особей
Лимфатические узлы,
дренирующие
области роста неметастазирующих
опухолей подвергаются гиперплазии,
аналогично узлам, отвечающим на
антигенное раздражение
Длительное
угнетение
иммунитета
иммунодепрессантами у реципиентов почек, сердца
повышает
частоту
возникновения
злокачественных опухолей.
Доказательство существования антигенов,
связанных с опухолью (Г.И. Абелев, Ю.С. Татаринов)
• Большинство опухолевых антигенов являются
нормальными продуктами генов организма
• В реализации противоопухолевого иммунитета
большое значение имеют опухолевые
трансплантационные антигены, наличие
которых на опухолевых клетках делает их
чувствительными к действию факторов
иммунной системы
(выделют опухоли иммунозависимые – вирусные, меланома,
рак почки, молочных желез и др.; иммунонезависимые
или слабозависимые – рак желудка, мелкоклеточный рак
легкого)
6. Антигены, ассоциированные с опухолями
• Вирусные – антигены вирусов, возбудителей опухоли
• Мутантные
–
продукты
мутантных
генов,
контролирующих в норме апоптоз клетки
• Эмбриональные – антигены, экспрессируемые в норме
только
в
эмбриональном
периоде
(некоторые
из
эмбриональных белков продолжают экспрессироваться в
семенниках - онкосеменниковые антигены)
• Дифференцировочные
–
органоспецифические
дифференцировочные антигены нормальных тканей (при
опухолях значительно возрастает их экпрессия, ведущая к
нарушению
аутотолерантности
и
развитию
паранеопластических процессов)
Кроме классических антигенов опухоли экспрессируют стрессорные
молекулы, кодируемые генами МНС1 класса, которые распознаются NK и
γδ Т-лимфоцитами
7. Онкогенные вирусы человека:
• Вирус Эпштейна-Барр
(лимфома Беркитта)
• Вирус папилломы человека
(карцинома шейки матки)
• Вирус гепатита В (гепатокарцинома)
• Саркома Капоши (ВГЧ-8)
Раково-эмбриональные антигены (РЭА) –
нормальные структуры тканей эмбриона,
репрессированные
в
процессе
их
дифференцировки и дерепрессированные в
процессе малигнизации.
Причина появления РЭА – реэкспрессия молчащих
генов, вызванная раковой трансформацией.
РЭА:
• α-фетопротеин
(первичный
рак
печени,
рак
предстательной железы);
• α2-ферроглобулин
(резко
возрастает
нейробластоме, тератоме и лейкозах)
при
• хорионический гонадотропин (трофобластические
опухоли матки, гонад)
9. Эффекторные механизмы противоопухолевого иммунитета Современная концепция иммунных взаимоотношений между опухолью и организмом «конце
Эффекторные механизмы противоопухолевого
иммунитета
Современная концепция иммунных взаимоотношений между
опухолью и организмом «концепция трех Е»
1. удаление (elimination) – успешная элиминация
трансформированных клеток и предотвращение
развития опухоли
2. равновесие (eguilibrium) – опухолевые клетки
избегают гибели под влиянием иммунных механизмов
(период равновесия между влиянием иммунной
системы и прогрессированием роста опухоли)
3. ускользание (escape) – прогрессирование роста
опухоли, ускользание из под контроля иммунной
системы
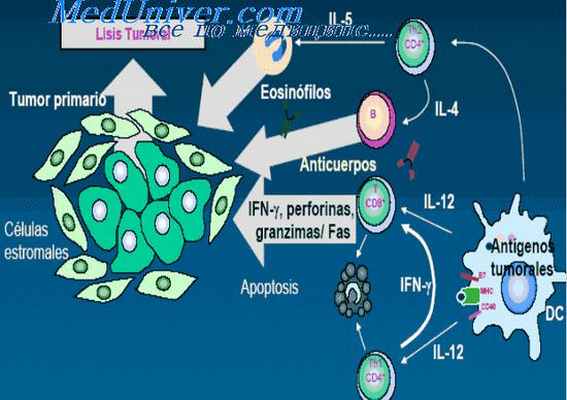
10. Стадии эффективного иммунного ответа на антигены опухолевой клетки
11. Эффекторные механизмы противоопухолевого иммунитета
Клеточные:
• естественные киллеры (NK-клетки)
• цитотоксические Т-лимфоциты – ключевые
клетки противоопухолевого иммунитета (механизм
действия – перфорин-гранзимовый контактный
цитолиз и Fas-зависимый апоптоз опухолевых клеток)
• CD4 лимфоциты (Th1) – инициация иммунного
воспаления→активация МФ →гибель опухолевой
клетки (нарушение кровотока, тромбозы)
• γδТ-клетки – прямой цитолиз опухолевой клетки
12. Эффекторные механизмы противоопухолевого иммунитета (эндогенные противоопухолевые факторы)
ИФН-γ:
- подавляет пролиферацию опухолевых клеток
(индукция апоптоза)
- индуцирует выработку опухолевыми и
стромальными клетками хемокинов, привлекающих
в опухоль Т-лимфоциты
- подавляет ангиогенез (усиление гибели опухолевых
клеток по механизму некроза)
- мощный активатор МФ и Th1 клеток,
необходимых для усиления противоопухолевого
иммунитета
13. Механизмы противоопухолевого иммунитета (основаны на Тh1-зависимом клеточном иммунном ответе, активирующем цитотоксические Т-лимфоциты, м
Механизмы противоопухолевого иммунитета
(основаны на Тh1-зависимом клеточном иммунном
ответе, активирующем цитотоксические Тлимфоциты, макрофаги, дендритные клетки, NK и
NKT-клетки. Роль гуморального противоопухолевого
иммунитета невелика)
Стадии противоопухолевого иммунитета
(Специфические факторы, повреждающие опухолевые клетки)
• Распознавание опухолевых АГ АПК (дендритными и Мф) и
представление Тh (CD4)
• Активация Тh1 и представление АГ наивным CD8+ Тлимфоцитам
• Дифференцировка CD8+ Т-лимфоцитов в цитотоксические
CD8 клетки→разрушение опухолевых клеток
14. Механизмы избегания опухолью защитных иммунных реакций
Механизмы избегания опухолью защитных
иммунных реакций
Опухолевые клетки экспрессируют специфический
эпитоп на своей поверхности в большом
количестве, что обеспечивает успешную атаку
ЦТЛ
Опухолеассоциированный эпитоп не
экспрессируется опухолевой клеткой , что
позволяет ей избежать цитолитического
действия Т-киллера
Антитела к опухолевому антигену связываются с
ним, что защищает опухолевую клетку от ЦТЛ
Опухоль продуцирует блокирующие факторы –
супрессорные цитокины ПГ и др.,
предотвращающие распознавание и цитолиз
опухолевой клетки
15. Механизмы избегания опухолью защитных иммунных реакций
16. Типы изменения антигенных свойств тканей при малигнизации - “антигенная альтерация”
Антигенное
упрощение
утрата
изоантигенов и
снижение синтеза других
антигенов.
Антигенная дивергенция - приобретение
данной
опухолевой
тканью
некоторых
антигенов, которые свойственны другим
тканям.
Реверсия антигенов - появление антигенов,
существовавших
в
данной
ткани
в
эмбриональном периоде.
17. Особенности изменения поверхности опухолевых клеток
• потеря органоспецифических антигенов;
• уменьшение экспрессии (вплоть до полного
отсутствия) антигенов МНС I класса;
• наличие гетерогенных антигенов;
• РЭА ;
• сиаломуциновое
покрытие
антигенов
опухоли
(гликокаликс)
маскировка
антигенов опухоли инертными веществами;
• низкая
концентрация
поверхностных
рецепторов и антигенов.
Факторы,
участвующие в развитии опухоли
1.
Антибластомные
2.
Иммунорезистентности опухоли
3.
Пробластомные, подавляющие иммунитет
4.
Пробластомные, усиливающие рост опухоли
19. Антибластомные иммунные факторы (факторы нормального иммунного ответа на появление опухолевой ткани)
I. Клеточные
Т- киллеры
ЕК- и К-клетки
активированные макрофаги
II. Гуморальные
специфические антитела
интерлейкин 1
интерлейкин 2
фактор некроза опухолей (ФНО)
интерфероны
20. Факторы иммунорезистентности опухоли
(позволяют ускользать развивающейся опухоли от
иммунного надзора)
• Слабая иммуногенность опухолевых АГ
• Постоянная модификация АГ опухоли
• Селекция иммунологически устойчивых клеток
• Потеря экспрессии АГ HLA 1 класса
• Выделение растворимых опухолевых АГ
• Экспрессия на поверхности опухолевых клеток
рецепторов к ростовым факторам
• Приобретение резистентности к апоптозу
(потеря рецепторов к ФНО, экспрессия FasL)
• Продукция опухолевыми клетками ИЛ-6, ИЛ-10,
ФНО
Пробластоматозные факторы,
подавляющие иммунитет
(продуцируются растущей опухолью, направлены
подавление иммунитета, усиливают рост опухоли)
на
Супрессивные вещества, продуцируемые
лимфоцитами и макрофагами
Блокирующие антитела
Циркулирующие иммунные комплексы
Простагландины ПГЕ2
ИЛ-10
Трансформирующий фактор роста бета (ТФР-β)
(подавляет синтез ИЛ-12, созревание Т-киллеров,
экспрессию рецепторов к цитокинам)
Пробластоматозные факторы,
усиливающие рост опухоли
• Фактор роста опухоли, продуцируемый
макрофагами
• ИЛ-2
• ИЛ-6
• ИФН-γ
• Фактор роста сосудистого эндотелия
• Иммунодефицитное состояние (нарушение
созревания Т-киллеров, нарушение функции
АПК)
23. Специфические АГ, выявляемые у больных определенным видом опухоли
(синтезируются опухолевой клеткой, экспрессируются на ее
поверхности, часть из них попадают в кровоток)
Опухолевый АГ
•Простатический
специфический АГ
(PSA)
•АГ
плоскоклеточного
рака (SCC)
•СА-19-9
•СА-125
•СА-15-3
Патология
Рак предстательной железы
Плоскоклеточный рак легкого,
пищевода, прямой кишки
Рак поджелудочной железы
Рак яичников
Рак молочной железы
24. Опухолеэмбриональные антигены
Опухолевый АГ
•Альфа-фетопротеин
Патология
Первичный рак печени, опухоли
яичников, рак предстательной
железы, цирроз печени
Рак толстой кишки,
•Раковоэмбриональный поджелудочной железы и др.
•Бета-хорионический
гонадотропин
Трофобластические опухоли
матки, яичников, яичек
25. Особенности иммунотерапии больных с онкопатологией
Воздействие на иммунную систему больного с
целью иммунореабилитации
• До операции: иммуномониторинг (определение
иммунного статуса и наличия специфического
опухолевого АГ), назначение иммуномодуляторов
широкого спектра действия.
• После операции и химиорадиотерапии:
иммуномониторинг (определение ИЛ-10, ИЛ-6),
детоксикация (плазмаферез, энтеросорбция),
назначение иммуномодуляторов длительными
курсами под контролем иммунограммы.
26. Иммунотерапия опухолей
(Впервые применена американским ученым Розенбергом)
1. Использование препаратов цитокинов (ИЛ-2,
ИФН; их комбинаций ИЛ-2 + ИФН-γ)
2. Использование иммуноцитов (ЛАК, ЛАК +
цитокины), лимфоцитов, инфильтрирующих
опухоль
3. Использование цитокинов в комбинации с
цитостатиками
4. Аппликационное применение ЛАК с малыми
дозами цитокинов
Эффективность иммунотерапии доказана при меланоме, раке
почки, прямой кишки, яичника, глиоме, саркоме мягких тканей.
27. Классификация видов иммунотерапии злокачественных опухолей
Виды иммунотерапии
Методы иммунотерапии
Активная
иммунотерапия
1.Вакцинотерапия.
2.Использование моноклональных антител
Пассивная
иммунотерапия
1. Клеточная:
• LAK-терапия
• TIL-терапия
• Терапия сенсибилизированными лимфоцитами
• Терапия с использованием дендритных клеток
2. Цитокинотерапия:
IL-2, 4, 10, 12; TNF-α, IFN-α, IFN-γ
Генная терапия
1.Введение генов апоптоза (р53, ВАХ)
2. Введение интерлейкиновых генов (IL-2)
3. Введение генов костимулирующих молекул (В7)
4. Введение генов главного комплекса
гистосовместимости (МНС)
Иммунотерапия в
сочетании с
химиотерапией или
дифференцировочной
терапией.
1.IFN-α + IL-2 + химиопрепарат
2. IFN-α + IL-2 + производные 13-цисретиноевой
кислоты (изотретиноин)
28. Карцинома плоскоклеточная
29. Базалиома (базально-клеточный рак), изъязвленная
30. Рак соска молочной железы (Педжета)
31. Карцинома плоскоклеточная
32. Литература:
• 1. Хаитов Р.М. Иммунология: учеб. для студентов мед
Вузов.- М.: ГЕОТАР-Медиа, 2011.- 311 с.
• 2. Хаитов Р.М. Иммунология. Норма и патология: учеб.
для студентов мед Вузов и ун-тов.- М.: Медицина,
2010.- 750 с.
• 3. Иммунология: учебник / А.А. Ярилин.- М.:
ГЕОТАР-Медиа, 2010.- 752 с.
• 4. Ковальчук Л.В. Клиническая иммунология и
аллергология с основами общей иммунололгии:
учебник. – М.: ГЕОТАР-Медиа, 2011.- 640 с.
Факторы противоопухолевого иммунитета. Блокирующие опухоль факторы иммунитета.
Факторы противоопухолевого иммунитета. Блокирующие опухоль факторы иммунитета.
В настоящее время одно из центральных мест в изучении противоопухолевого иммунитета, особенно в связи с опухолевой прогрессией, занимает вопрос о характере взаимодействия клеточных и гуморальных факторов. Большой интерес представляют опыты с испытанием сывороток, полученных от животных с прогрессирующей и регрессирующей опухолью. В качестве такой была выбрана папиллома Шоупа кроликов, которая у части животных переходит в карциному, а у части — подвергается регрессии и исчезает. Добавление в тест-систему (опухолевые клеткн+иммуиные лимфоциты) сыворотки кроликов с прогрессирующей опухолью приводит к блокаде цитотоксического действия иммунных лимфоцитов. Добавление сыворотки животных с регрессирующей папилломой не снимает противоопухолевое действие сенсибилизированных лимфоцитов.
Эти опыты легли в основу представлений о блокирующих антителах, которые, связывая антигенные детерминанты опухолевых клеток, экранируют их от цитотоксического действия иммунных лимфоцитов. Сами же блокирующие антитела цнтотоксическими свойствами не обладают.
Сравнительно недавно было показано, что блокирующие факторы, циркулирующие в крови опухоленосителя, представляют собой комплексы антител с опухолевыми антигенами. Установление этого факта позволило по-иному объяснить феномен усиления опухолевого роста. Допускают, что наряду с экранирующим действием антител, связывающих антигенные детерминанты опухолевых клеток, циркулирующие опухолевые антигены блокируют рецепторы иммунных лимфоцитов и тем самым отменяют их цитотоксическую направленность на опухолевые клетки. Очевидно, такие отношения между гуморальными и клеточными механизмами противоопухолевого иммунитета, с одной стороны, и между циркулирующими к фиксированными опухолевыми антигенами — с другой, создают ситуации неэффективности иммунного ответа, которые, по-видимому, становятся основой опухолевой прогрессии.
В связи с этим важно подчеркнуть, что морфологические картины лимфоидио-плазмоцитарной инфильтрации по границе роста опухоли, которые отражают реакции противоопухолевого иммунитета, не могут иметь однозначную трактовку «поведения» опухоли без учета всей совокупности сложных и динамичных иммунологических отношений, существующих между опухолью и различными популяциями лимфоцитов. Иммуноморфологический анализ подобных инфильтратов должен проводиться параллельно с морфологической оценкой характера роста опухоли, степени ее анаплазии и дифференцировки, в сопоставлении с клиническим течением опухолевой болезни.
В настоящее время учение о противоопухолевом иммунитете дополнилось новыми представлениями о популяционном делении лимфоцитов. Так, популяция Т-лимфоцнтов, с которой связаны явления клеточного иммунитета, оказалась неоднородной. Она подразделяется на субполуляцию с дифференциацией аитибластическнх функций на хелперную, эффекторную и супрессорную Т-хелперы (Тн) обеспечивают включение В-лимфоцитов в пролиферацию и дифференцировку, приводящую к накоплению клона зрелых плазматических клеток.
Отсутствие Тн-клона может определить низкий уровень включения в пролиферацию и дифференцировку соответствующих В-клеток и низкий уровень антителогенеза Т-супрессоры (Ts) тормозят включение В-лимфоцитов в пролиферацию и диффереицировку и тем самым тормозят образование антител. Они же оказывают тормозящее влияние на формирование Т-эффекторов. Таким образом, указанные субполуляции Т-лимфоцитов (хелперы и супрессоры) выступают в роли регуляторов силы иммунного ответа. При прочих равных условиях иммунный ответ может быть усилен активацией хелперов или угнетением супрессоров, а подавление иммунного ответа может быть достигнуто угнетением хелперов и активацией супрессоров.
Во всяком случае гипотеза активации Т-супрессоров как причина несостоятельности иммунного ответа при опухолевом росте уже имеет определенное экспериментальное обоснование.
Самым последним достижением иммунологии и иммуноморфологии в области популяционного деления лимфоцитов явилось открытие популяции лимфондных клеток, ответственных за естественную резистентность организма к опухоли. Последняя оказалась связанной с функцией так называемых нормальных киллеров (НК)—особой популяции Т-лимфоцитов, способных вызывать независимый от антител и комплемента лизис опухолевых клеток без предварительной активации (иммунизации) специфическим антигеном опухоли. Лимфоциты с подобной цитотокснческой активностью по отношению к опухолевым клеткам были обнаружены независимо в двух лабораториях мира.
По способности вызывать лизис клеток-мишеней они получили название естественных, или натуральных, киллеров (клеток-убийц). Широкое распространение получило также название «нормальные киллеры» НК являются популяцией не-рециркулирующих лимфоидных клеток типа больших и средних лимфоцитов, оседающих в тканях и органах. Ряд исследователей описывают НК как большой лимфоцит с азурофильными гранулами в цитоплазме.
В ряде работ, выполненных на экспериментальных моделях, убедительно показано, что резистентность организма к перевиваемым и спонтанным опухолям, включая опухоли, вызванные вирусами и канцерогенными веществами, зависит от активности НК. Имеются серьезные основания предполагать, что именно НК выполняют функцию элиминации мутантных клонов, а также клеток инфицированных вирусами. При дальнейшем изучении было показано, что цитотоксическая активность НК проявляется также по отношению к эмбриональным и гемопоэтическим клеткам.
Последнее обстоятельство, а именно способность повреждать неопухолевые эмбриональные и гемопоэтические клетки, позволило предложить гипотезу о центральной эффекторной роли НК в системе иммунологического надзора и распространить иммунологический надзор на процессы пролиферации и дифференцировки вообще. С общебиологических позиций противоопухолевая резистентность представляется частным случаем иммунологического надзора.
Наконец, новая информация получена в отношении иммуносупрессивного влияния опухоли на иммунную систему.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гуморальные факторы противоопухолевого иммунитета
РОЛЬ МИЕЛОИДНЫХ И ЛИМФОИДНЫХ КЛЕТОК В ПРОТИВООПУХОЛЕВОЙ ЗАЩИТЕ
ИНФИЛЬТРИРУЮЩИЕ ОПУХОЛЬ МИЕЛОИДНЫЕ КЛЕТКИ -ПРЕДШЕСТВЕННИЦЫ (CD11B+GR1+) ПОДАВЛЯЮТ АКТИВНОСТЬ CD8+ ЦИТОТОКСИЧЕСКИХ Т ЛИМФОЦИТОВ И CD56+CD16+ ЕСТЕСТВЕННЫХ КИЛЛЕРНЫХ (ЕК) КЛЕТОК, СПОСОБСТВУЮТ ОПУХОЛЕВОМУ АНГИОГЕНЕЗУ, ЗАЖИВЛЕНИЮ РАН, ОЧИЩЕНИЮ ПОВРЕЖДЕННЫХ ТКАНЕЙ.
ДЕНДРИТНЫЕ КЛЕТКИ В ПРОТИВООПУХОЛЕВОМ ИММУНИТЕТЕ
РЕАКЦИИ ОРГАНИЗМА НА ОПУХОЛЬ НА РАЗЛИЧНЫХ СТАДИЯХ ЗАБОЛЕВАНИЯ
Удаление – срабатывают иммунологические механизмы удаления клеток, чужеродных в антигенном отношении
Равновесие – иммунологические механизмы сдерживания и пролиферативный потенциал опухоли имеют приблизительно равные потенциалы
Ускользание – выход опухоли из-под иммунологического контроля с неконтролируемым делением ее клеток
СРЫВ МЕХАНИЗМОВ ПРОТИВООПУХОЛЕВОГО ИММУННОЛОГИЧЕСКОГО НАДЗОРА
СТИМУЛИРУЮЩЕЕ ДЕЙСТВИЕ ЦИТОКИНОВ НА ПРОТИВООПУХОЛЕВЫЙ ИММУНИТЕТ
Интерфероны, ИЛ-2, ИЛ-12, ИЛ-18 поддерживают преимущественно Th1-тип противоопухолевого иммунного ответа.
Время полужизни активированных CD8+ ЦТЛ составляет 2.3 дня. Цитокины ИЛ-2, ИЛ-4, ИЛ-7 повышают его до 12 дней.
Интерфероны снижают устойчивость опухолевых клеток к апоптозу и вызывают на них экспрессию Fas рецептора.
Цитокины (ФНО- , интерфероны) вызывают экспрессию костимуляторных молекул (CD80) и
молекул НLA - I и HLA - II на нормальных и опухолевых клетках.
ТРФ-β (суперсемейство трансформирующего росткового фактора) является на ранних стадиях канцерогенеза ингибитором опухолевых клеток, но позже, наоборот, вызывает опухолевую прогрессию
ОСНОВНЫЕ ПРИЧИНЫ НЕЭФФЕКТИВНОСТИ ПРОТИВООПУХОЛЕВОГО ИММУНИТЕТА
• локализация опухоли в иммунопривилегированных местах (костный мозг, нервная система, эндокринная система, половая система, тимус и др.) и/или наличие капсулы;
• отсутствие иммунодоминантных антигенов, позднее появление связанных с опухолевым ростом DAMPs;
• сниженная экспрессия HLA класса I на поверхности опухолевых клеток;
• сниженная экспрессия адгезивных молекул ICAM (CD54), LFA-1 (CD11a/CD18), LFA-3 (CD58), и др.;
• сниженная экспрессия костимуляторных молекул CD80, CD86, и др.;
• устойчивость к индукции клеточной смерти, экспрессия IAPs и KIRs;
• выделение растворимых иммуносупрессивных субстанций (ТРФ-β, ИЛ-10, p15e, VEGF, H 2 O 2 )
ИММУНОДИАГНОСТИКА ОПУХОЛЕЙ
Рак толстой кишки
Рак печени, почек, молочной, поджелудочной
Рак молочной железы
Рак поджелудочной железы
Рак желудка и ободочной кишки
Рак поджелудочной железы
Рак ободочной кишки, легких, молочной
Антиген плоско-эпителиального рака
Рак шейки матки
Кислая фосфотаза простаты
Трансфераза терминальных нуклеотидов
Хорионэпителиома, рак молочной железы
ДВОЙСТВЕННАЯ РОЛЬ ИММУННОЙ СИСТЕМЫ ПРИ
РАКЕ (SCHREIBER R. E.A., 2004, 2011).
«В настоящее время мы приходим к выводу о том, что иммунная система играет двойную роль в канцерогенезе: она способна не только подавлять рост опухоли за счет разрушения опухолевых клеток или подавления их избыточного роста, но также способствует опухолевой прогрессии путем селекции опухолевых клеток, которые более подготовлены к выживанию в условиях иммунокомпетентного хозяина, или путем создания условий микроокружения опухоли, которые облегчают избыточный опухолевый рост».
«Мы обсуждает объединяющую концепцию, названную «опухолевое иммунное обучение/cancer immunoediting,” которая объединяет двойную функцию иммунной системы при раке как функцию защиты хозяина и способствованию прогрессии опухоли».
Больная Г., 59 лет, прооперирована в 2001 году с диагнозом РМЖ стадия T2NMO справа, (ИГХ не проводилась) сектор + латеральная эксцизия правой М.Ж., лучевая терапия 60 грей, гормонотерапия 5 лет - блокаторы Ароматаз. Иммунологический мониторинг в течение 16 лет. Признаков МТС или рецидива в настоящее время нет.
Ответ организма на развитие опухоли
В большинстве случаев гуморальный ответ не может воспрепятствовать росту опухоли. Однако, эффекторные клетки, такие как Т-лимфоциты, макрофаги и естественные киллеры, обладают относительно высокой способностью уничтожать опухолевые клетки. Активность эффекторных клеток индуцируется клетками, презентирующими опухолевые специфические антигены (ОСА) или опухолеассоциированные антигены (ОАА) на своей поверхности (эти клетки называют антиген-презентирующими клетками), и поддерживается цитокинами Цитокины Иммунная система состоит из клеточных компонентов и молекулярных компонентов, которые работают совместно с целью уничтожения антигенов (АГ). (См. также Обзор иммунной системы (Overview of the. Прочитайте дополнительные сведения (напр., интерлейкинами, интерферонами). Несмотря на активность эффекторных клеток, иммунный ответ организма может быть недостаточен для контроля возникновения и роста опухоли.
Клеточный иммунитет
Т-лимфоциты – основные клетки, ответственные за непосредственное распознавание и уничтожение опухолевых клеток. Они осуществляют иммунологический надзор, затем пролиферируют и разрушают недавно трансформированные опухолевые клетки после распознавания ОАА. Т-клеточный ответ на формирование опухоли регулируется другими клетками иммунной системы; некоторым клеткам необходимо присутствие гуморальных антител против опухолевых клеток (антител-зависимая клеточная цитотоксичность) для инициации взаимодействий, приводящих к гибели опухолевых клеток. Напротив, супрессорные Т-лимфоциты подавляют иммунный ответ против развития опухоли.
Цитотоксические Т-лимфоциты (ЦТЛ) распознают антигены на клетках-мишенях и лизируют эти клетки. Эти антигены могут представлять собой белки клеточной мембраны или внутриклеточные белки (например, ОАА), которые экспрессируются на поверхность в комбинации с молекулами I класса главного комплекса гистосовместимости (МНС). Опухоль-специфические ЦТЛ были обнаружены при
Естественные киллеры (NK) – это еще одна популяция эффекторных клеток, обладающих активностью против опухолевых клеток. В отличие от ЦТЛ, NK-клетки не имеют рецепторов к антигенам, но все равно способны распознавать нормальные клетки, инфицированные вирусом, или опухолевые клетки. Их активность против опухолевых клеток названа естественной, поскольку не индуцируется никаким специфическим антигеном. Механизм, по которому NK-клетки различают нормальные и ненормальные клетки, в настоящее время исследуется. Существуют свидетельства того, что молекулы класса I главного комплекса гистосовместимости на поверхности нормальных клеток могут ингибировать активность NK-клеток и препятствовать лизису. Таким образом, сниженный уровень экспрессии молекул класса I, характерный для многих опухолевых клеток, может способствовать активации NK-клеток и последующему лизису опухолевых клеток.
Натуральные Т- киллеры (NKT) являются специализированными CD1d-рестриктированными Т-лимфоцитами, которые распознают липидные антигены. После стимуляции NKT-клетки активируют иммунные клетки как врожденного, так и приобретенного звеньев иммунитета в микроокружении опухоли. NKT-клетки являются врожденными Т-лимфоцитами, которые быстро реагируют на антигенную стимуляцию и незамедлительно продуцируют большое количество цитокинов и хемокинов.
Макрофаги, активированные комбинацией факторов, включая лимфокины (растворимые факторы, синтезируемые Т-лимфоцитами) и интерферон, могут уничтожать специфические опухолевые клетки. Они менее эффективны, чем цитотоксический механизм, опосредованный Т-клетками. При определенных условиях макрофаги могут презентировать ОАА Т-клеткам и стимулировать опухоль-специфичный иммунный ответ. Существует по крайней мере 2 поляризованных состояния опухоль-ассоциированных макрофагов (TAM):
клетки ТАМ-1 (M1) помогают Т-клеткам уничтожать опухоли
клетки ТАМ-2 (М2) способствуют опухолевой толерантности
Считается, что M1 и M2 существуют в недифференцированном состоянии до тех пор, пока не произойдет поляризация на два фенотипа: M1 и M2. Такая поляризация может изменяться с течением времени и зависит от их локализации внутри опухоли (более или менее гипоксические области), стадии и типа рака, и предшествующего лечения
Дендритные клетки – это специальные антиген-презентирующие клетки, присутствующие в барьерных тканях (например, в коже, лимфоузлах). Они играют основную роль в инициации опухоль-специфичного иммунного ответа. Эти клетки поглощают опухоль-ассоциированные белки, перерабатывают их и презентируют ОАА Т-клеткам для стимуляции ответа ЦТЛ против опухолевых клеток. Несколько классов дендритных клеток могут способствовать росту или подавлению опухоли.
Лимфокины синтезируются в иммунных клетках и стимулируют рост или индуцируют активность других иммунных клеток. К ним относятся интерлейкин-2 (IL-2), также известный как фактор роста Т-лимфоцитов, и интерфероны. ИЛ-2 синтезируется дендритными клетками и специфически активирует ЦТЛ, таким образом, усиливая противоопухолевый иммунный ответ.
Регуляторные Т-клетки в норме присутствуют в организме и препятствуют развитию аутоиммунных реакций. Они вырабатываются в активную фазу иммунного ответа на патогены и ограничивают мощные иммунные ответы, которые могли бы повредить здоровым клеткам организма. Накопление этих клеток в опухоли ингибирует противоопухолевый иммунный ответ.
Миелоид-зависимые супрессорные клетки представляют собой незрелые миелоидные клетки и их предшественники. Количество этих клеток увеличивается при раке, а также при наличии воспаления и инфекции. Клетки обладают мощной иммуносупрессивной активностью. Известно два вида данных клеток:
Супрессорные клетки миелоидного происхождения в большом количестве накапливаются в опухоли и прогнозируют плохие клинические результаты при различных видах рака.
Гуморальный иммунитет
В отличие от Т-клеточного цитотоксического иммунного ответа, гуморальные антитела не обеспечивают существенной защиты против опухолевого роста. Большинство антител не может распознать ОАА. Вне зависимости от этого, гуморальные антитела, реагирующие in vitro с опухолевыми клетками, были обнаружены в сыворотке крови пациентов с различными типами опухолей, включая
Карциномы желудочно-кишечного тракта
Действие цитотоксических антител направлено против поверхностных антигенов опухолевых клеток. Эти антитела могут проявлять противоопухолевые эффекты, посредством комплементарного связывания или действуя как метка для Т-клеток, которые разрушают опухолевые клетки (антител-зависимая клеточно-опосредованная цитотоксичность). Другая популяция гуморальных антител, называемых усиливающими антителами (блокирующими антителами), может скорее даже способствовать росту опухоли, чем подавлять его. Механизмы развития и относительная значимость такого иммунологического усиления пока не установлены. В настоящее время исследуются антитела, которые доставляют конъюгированные токсины к опухолевым клеткам для селективного воздействия на них.
Несостоятельность защитных сил организма
Хотя многие опухолевые клетки элиминируются иммунной системой из организма (и поэтому никогда не обнаруживаются), другие продолжают расти, несмотря на наличие ОАА. Предложено несколько механизмов, объясняющих недостаточный ответ организма на ОАА, в т ч:
Специфическая иммунологическая толерантность к ОАА в процессе взаимодействия антиген-презентирующих клеток и супрессорных Т-лимфоцитов, возможно, вторичная по отношению к пренатальной экспозиции антигена
Подавление иммунного ответа химическими, физическими или вирусными агентами (например, разрушение Т-хелперов под воздействием вируса иммунодефицита человека [ВИЧ])
Подавление иммунного ответа цитотоксическими лекарственными препаратами или радиацией
Подавление иммунного ответа самой опухолью посредством различных сложных и в большинстве своем неописанных механизмов, которые влекут за собой различные нарушения, в т. ч. ослабление функции Т-клеток, В-клеток и антиген-презентирующих клеток, снижение продукции IL-2, генерация истощенных Т-клеток и увеличение количества циркулирующих растворимых рецепторов IL-2 (которые связывают и, таким образом, инактивируют IL-2)
Наличие и активность TAM-2 (M2) поляризованных клеток, миелоидных супрессорных клеток и регуляторных Т-клеток, способствующих развитию опухолевой толерантности
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Иммунотерапия
По мере роста клеток злокачественных опухолей в них накапливается большое количество мутаций и генетических изменений, которые приводят к росту агрессивности опухоли, её прогрессирующему течению и нечувствительности к химиотерапии, лучевой терапии и «таргетным» препаратам. Чем больше мутаций накапливается в опухолевой клетке, тем более «непохожей» она становится на нормальные клетки. Эти мутации потенциально могут быть распознаны собственной иммунной системой организма. Если иммунная система организма распознает опухолевые клетки как чужеродные, она способна самостоятельно их уничтожить.
Однако, в случае злокачественных новообразований, врожденной реактивности иммунной системы оказывается недостаточно для элиминации опухоли. По всей видимости, это связано с тем, что раковые клетки становятся «невидимы» для иммунной системы. Они способны использовать разнообразные механизмы «ухода» от надзора иммунитета. Иммунотерапия – метод лечения злокачественных опухолей, основанный на восстановлении функционирования собственной иммунной системы организма пациента, а не на попытках прямого уничтожения опухолевых клеток.
Прошлое иммунотерапии
Попытки разработать эффективные иммунотерапевтические противоопухолевые препараты велись в течение долгих лет, однако, многие методы, которые показали свою эффективность «в пробирке» оказались неэффективными в реальной клинической практике. В качестве примера такой неудачной попытки можно привести препарат, который представляет собой рекомбинантную молекулу фактора некроза опухоли (ФНО). В соответствии с заявлением производителя, этот препарат способен увеличивать эффективность других противоопухолевых препаратов, повышать активность иммунной системы организма, блокировать в опухоли процессы образования кровеносных сосудов и т.д., однако это так и не было подтверждено в контролируемых клинических исследованиях. Все эти эффекты были обнаружены только в «пробирке» и/или в исследованиях на животных, но не у людей.
Несмотря на это, вследствие наличия определенных недостатков в системе государственной регуляции фармацевтического рынка в Российской Федерации, компания-производитель данного препарата смогла его зарегистрировать и по настоящий момент он находится в продаже.
Кроме того, существуют неспецифические иммунотерапевтические препараты, которые также способны стимулировать противоопухолевую активность иммунной системы организма. К ним относятся препараты интерферона-α (ИНФ-α) и интерлейкина (например, ИЛ-2), которые нашли свое применение в лечении некоторых злокачественных опухолей, например почечно-клеточного рака. Они умеренно эффективны, доступны, хорошо изучены и достаточно безопасны, однако их применение на современном этапе развития медицины становится все более ограниченным по мере появления более эффективных и менее токсичных противоопухолевых препаратов.
При некоторых формах рака мочевого пузыря применяется также внутрипузырное введение вакцины БЦЖ (вакцина, которая применяется для профилактики распространенных форм туберкулеза), которая также относится к разновидности иммунотерапии.
Современная иммунотерапия
Тем не менее, несмотря на первоначальный этап неудач, последние годы ознаменовались расцветом иммунотерапии – были открыты важнейшие механизмы, при помощи которых злокачественные клетки уходят от иммунного контроля. В частности, была открыта их способность воздействовать на «контрольные точки» иммунной системы, которые в норме ответственны за контроль силу и длительности естественного иммунного ответа и способны при необходимости его «выключать».
В нормальных условиях эти механизмы необходимы для того, чтобы ограничить повреждение собственных тканей в процессе иммунного ответа и предотвратить развитие так называемых аутоиммунных реакций – процессы повреждения и отторжения здоровых тканей. Подавление избыточной активности подобных механизмов является перспективным направлением разработки противоопухолевых препаратов.
Белок CTLA-4 и препараты, блокирующие его активность
Одним из примеров контрольных точек, регулирующих активность иммунной системы, является белок 4, ассоциированный с цитотоксическими Т-лимфоцитами (CTLA-4). Его основная функция - подавление процессов активации клеточного звена иммунной системы. Именно этот белок стал «мишенью» для первого современного эффективного противоопухолевого иммунотерапевтического препарата, который представляет собой моноклональное антитело к белку CTLA-4. В марте 2011 года этот препарат получил одобрение FDA (Food and Drug Administration – государственный регулятор фармацевтического рынка США).
Ингибиторы пути программируемой клеточной гибели (Programmed Cell Death)
Другим ключевым механизмом ухода опухолевых клеток от иммунного контроля является так называемый сигнальный путь программируемой клеточной гибели (Programmed cell Death pathway-1, PD-1). Его рецепторы («пусковые механизмы») были обнаружены на поверхности различных активированных клеток иммунной системы лимфоцитов. При активации данного рецептора его специфическим лигандом (PD-L1 и PD-L2), происходит подавление активности клеточного звена иммунитета.
В норме данные рецепторы служат звеном, предотвращающим развитие аутоиммунных реакций. Экспрессия PD-L1 опухолью приводит к подавлению активности иммунной системы. Было выдвинуто предположение, что инактивация PD-1 рецепторов или связывание их лигандов может усиливать противоопухолевую собственную активность иммунной системы, приводя к уничтожению злокачественных клеток.
В настоящее время на фармацевтическом рынке США и Европейского Союза присутствуют препараты, блокирующие активность PD-1, а также моноклональное антитело к PD-L1.
Иммунотерапевтические препараты оказываются эффективны не у всех пациентов и по этой причине не являются «панацеей». Тем не менее, примерно у 20-30% пациентов на фоне их применения удается достичь стойкого и длительного противоопухолевого эффекта.
На разработке эффективных иммунотерапевтических препаратов сосредоточены усилия крупнейших фармацевтических компаний во всем мире.
- О раке
- Рак и его типы
- Рак головы и шеи
- Рак желудка
- Рак кишечника
- Рак легкого
- Диагностика рака лёгкого
- Методы лечения рака лёгкого
- Разновидности рака молочной железы
- Симптомы рака молочной железы
- Тройной негативный рак молочной железы
- Лечении рака молочной железы. Анти-HER2 терапия
- Химиотерапия
- О лекарственных препаратах
- Анти-HER2 терапия в лечении рака молочной железы
- Иммунотерапия
- Ингибиторы ангиогенеза
- Хирургическое лечение
- Новые методы лечения рака
- Набор в клинические исследования
- Что такое клинические исследования и для чего они проводятся?
- Кто может принять участие в клиническом исследовании?
- Как проводятся клинические исследования?
- Что такое информированное согласие?
- Для чего используется плацебо при проведении клинических исследований?
- Где проводятся клинические исследования и как я могу получить информацию об исследованиях, в которых я могу принять участие?
- Ингибиторы ароматазы
- Препараты, подавляющие рецепторы эстрогена
- Другие модуляторы рецепторов эстрогена
- Обезболивание: что важно знать
- В Москве стартовала программа обучения психоонкологической помощи
- Алгоритм действий для эффективного обезболивания
- Анемия
- Инфекционные осложнения, лейкопения и нейтропения
- Кровотечения и тромбоцитопения
- Тошнота и рвота
- Выпадение волос
- Повреждение кожи и её придатков
- Стоматит
- Видео для пациентов
- Симптомы рака
- Диагностика
- Анализы крови
- Общий (клинический) анализ крови
- Биохимический анализ крови
- Мутации BRCA
- В каких случаях стоит проходить генетическое тестирование?
- Генетическое тестирование в России: национальная программа
- СА-125
- Возраст и наследственность
- Вредные привычки и образ жизни
- Хроническое воспаление и инфекции
- Гормоны
- Ультрафиолетовое и радиоактивное излучение
- Реабилитационные учреждения
- Денис Смоляков
- Психологическая помощь
- Проект СО-действие
- Психотерапевтическое отделение ГКБ №5
- Эмоционально-образная терапия онкологических пациентов
- Проект "О.П.О.Р.А"
- Установление инвалидности онкологическим больным
- Как оформить инвалидность
- Как получить льготные лекарства
- Как вернуть деньги за голосообразующий аппарат
- Инструкция о порядке прохождения и обжалования медико-социальной экспертизы (МСЭ) при установлении инвалидности
- АльфаСтрахование
- Реабилитационные учреждения
- ФГБУ "НМИЦ РК"
- Лечебно-реабилитационный клинический центр "Юдино"
- Реабилитационная школа-интернат № 32
- Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
- «Шередарь» г. Владимир
- «Лазори». г. Липецк
- «Барретстаун» Ирландия
- «Лесные пираты» Германия
- «Мираклион» г. Светлогорск
В рамках ОМС возобновилась реабилитация онкологических пациентов с лимфостазом верхних конечностей
Тульское отделение "Здравствуй" подписало соглашение о сотрудничестве между социально ориентированными пациентами некомерческими организациями в рамках социального партнёрства
Прошла экскурсия по проекту «Большие и маленькие друзья» для онковыздоравливающих и членов их семей
Читайте также:
- Анализы крови
- Рак и его типы
