Физика радиотерапии - ионизирующей радиации
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
ТЕРМИНЫ, ОПРЕДЕЛЕНИЯ, СОКРАЩЕНИЯ, ЕДИНИЦЫ ИЗМЕРЕНИЯ, ОБОЗНАЧЕНИЯ.
Формальное и упрощенное объяснение основных величин
Полезно договориться о смысле слов, а не то мы скоро перестанем понимать друг друга
Для терминов во многих науках: в физике, химии … и, особенно во всей медицине, греческий язык весьма надобен
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Термин (лат.Terminus – граница) – слово или словосочетание, точно обозначающее какое-либо понятие в данной науке.
Контактная (брахи-) лучевая терапия (КЛТ) – это метод лечения, при которомрадиоактивнаяматрицавгерметичнойкапсулеиспользуетсянамалых (до нуля) расстояниях от облучаемой ткани или органа. При этом различают поверхностные, внутриполостные и внутритканевые методики облучения, при которых можно создавать дозы облучения локально, например, в объеме опухоли, не переоблучая близлежащие здоровые ткани.
Ионизация (Ionization) – образование ионов при отрыве или присоединении электронов к атомам, а также при разделении молекул.
Ионизирующее излучение (Ionizingradiation) – излучение,взаимодей-
ствие которого со средой приводит к образованию ионов разных знаков. Видимый свет и ультрафиолетовое излучение общепринято не включать в понятие «ионизирующее излучение».
е - , р, α – непосредственно ионизирующие излучения;
γ,n, Х – косвенно ионизирующие излучения (РМГ78 - 2005).
Источник ионизирующего излучения – все, что может вызывать облуче-
ние при испускании ионизирующего излучения (BSS).
Радионуклидный источник (radionuclide source) – радиоактивное веще-
ство в определенном оформлении – на подложке, в капсуле, ампуле, кювете. Закрытый источник (sealed source) – любой источник ионизирующих
излучений, заключенный в оболочку достаточной механической прочности, которая исключает возможность соприкосновения с радиоизиотопом и попаданиярадиоактивногоматериалавокружающуюсредупривсехвероятныхусловиях использования и износа.
Бета-частица (beta particle) – электрон или позитрон, который испускается атомным ядром в процессе ядерного превращения (или в результате распада нейтрона или нестабильной частицы). (ISO 921\81), (МЭК 60050-393).
Изотоп (isotope) – один из ряда нуклидов, имеющий одинаковый атомный номер, но разные массовые числа. (ISO 921\639), (МЭК 60050-393).
Изотопы – разновидности данного химического элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, изотопы имеют одинаковое строение электронных оболочек, т.е. очень близкие химические свойства, и занимают одно и тоже место в периодической системе химических элементов.
Активность (А) – мера радиоактивности какого-либо количества радионуклида, находящегося в данном энергетическом состоянии в данный момент времени: А=, где dN – ожидаемое число спонтанных ядерных превращений из данного энергетического состояния, происходящих за промежуток времени dt. Единицейактивностиявляетсябеккерель(Бк).Использовавшаясяранеевнесистемная единица активности кюри (Ки) составляет 3,7х10 10 Бк.
Доза поглощенная (D) – величина энергии ионизирующего излучения, переданная веществу: D=, где dē – средняя энергия, переданная ионизирующим излучением веществу, находящемуся в элементарном объеме, а dm – масса вещества в этом объеме. Энергия может быть усреднена по любому определенному объему, и в этом случае средняя доза будет равна полной энергии, переданной объему, деленной на массу этого объема. В единицах СИ поглощенная доза измеряется в джоулях, деленных на кг (Дж х кг -1 ), и имеет специальное название – грей (Гр). Использовавшаяся ранее внесистемная единица рад равна
Средняя поглощенная доза в органе или ткани (Д Т,R ) – полная энергия,
переданная веществу объема (органу или ткани), деленная на массу этого вещества (органа или ткани).
Излучение гамма – коротковолновое электромагнитное излучение; является потоком частиц – гамма-квантов (фотонов) с энергией Е γ . Испускание γ-квантов сопровождает радиоактивный распад в тех случаях, когда образующиеся ядра находятся в возбужденных состояниях.
Излучениеионизирующие –потокичастициэлектромагнитныхквантов,вза- имодействиекоторыхсосредойприводиткионизацииееатомовимолекул.Ионизирующим излучением являются рентгеновское и γ-излучение, потоки α-частиц, электронов, позитронов, протонов, нейтронов. Заряженные частицы ионизируют среду непосредственно при столкновениях с ее атомами и молекулами (первичная ионизация). Выбиваемые при этом электроны, если они обладают достаточно большой энергией, также могут ионизировать (вторичная ионизация). В случае быстрых нейтронов ионизация обусловлена ядрами отдачи или другими частицами, возникающими при взаимодействии нейтронов со средой. Ионизация фотонами рентгеновского и γ-излучения может быть непосредственной – первичной (фотоионизация), а также, в большей степени, вторичной – обусловленной электронами, образующимися при взаимодействии фотонов с веществом.
Лицензия – разрешение на конкретный вид деятельности, которое выдается регулирующими органами на основе оценки полезности и безопасности данной деятельности, сопровождающееся предписаниями и условиями, которые должны выполняться юридическим лицом, получившим лицензию.
Месторабочее –местопостоянногоиливременногопребыванияперсонала для выполнения производственных функций в условиях воздействия ионизирующего излучения в течение более половины рабочего времени или двух часов непрерывно.
Мощность дозы – доза излучения за единицу времени (сек, мин, час). Нуклид – (nuclide) – вид атома, характеризиуемый массовым числом и
Облучение медицинское – облучение пациентов в результате медицинского обследования или лечения.
Протон – стабильная частица, имеющая положительный элементарный электирческий заряд +е и массу покоя ~1,008.
Фотон – photon – квант электромагнитного излучения, рассматриваемый как элементарная частица.
Период латентный – период времени, отделяющий воздействие ионизирующей радиации на организм от проявления эффекта в виде диагностируемого заболевания. Латентные периоды стохастических эффектов сравнимы с продолжительностью жизни человека. Как правило, детерминированные эффекты имеют значительно более короткие латентные периоды. Единица измерения латентного периода – год.
Радиоактивность – способность некоторых атомных ядер самопроизвольно (спонтанно) превращаться в другие ядра с испусканием частиц.
Средство индивидуальной защиты (СИЗ) – средство защиты персонала от внешнего облучения, поступления радиоактивных веществ внутрь организма и радиоактивного загрязнения кожных покровов.
Условные обозначения и сокращения
Р о ,β – мощность дозы бета-излучения на рабочей поверхности источника АБЕТ-1 – аппарат с бета-излучающими радионуклидами для лучевой тера-
пии ЭК2 – установка с экстраполяционной ионизационной воздушной камерой
СКД1 – сцинтилляционный дозиметр с качающимся датчиком ОА – офтальмоаппликатор
D – поглощенная доза
D T,R – поглощенная дозав органе или ткани Т излучения R ЗТИБИ – закрытый терапевтический источник бета-излучения ОДИБИ – образцовый дозиметрический источник бета-излучения
Открытие электрона представляет собой завершение длившегося несколько десятилетий исследования газового разряда, то есть процесса прохождения электрического тока через газ. В частности, приблизительно к середине прошлого века было выяснено, что если к электродам, впаянным в стеклянную трубку с газом, приложить достаточно высокое напряжение, то через газ проходит электрический ток, а сам газ при этом светится. Английские физики У.Крукс, А.Шустер, затем Дж.Дж. Томсон полагали, что из катода выходят не лучи, а какие-то отрицательно заряженные частицы и что именно под их воздействием возникает свечение стекла. Совсем как у Иоанна: «Вначале было слово». В 1894 г. Джонстон Стоней ввел слово «электрон». Решающие опыты были выполнены в 1987 году английским физиком Джозефом Джоном Томсоном. Опыты это состояли в наблюдении движения заряженных частиц в электрическом и магнитном полях. Поэтому теперь принято считать, что год открытия электрона – 1897, а автор этого важнейшего открытия Джозеф Джон Томсон. За теоретические и экспериментальные исследования прохождения электричества через газы, приведшие к открытию электрона, Дж.Дж.Томсон
в 1906 г. получил Нобелевскую премию по физике. Заряд электрона оказался равным1,6·10 -19 Кл.Отсюдадлямассыэлектронаполучаетсязначение9,1·10 -31 кг. Это самые маленькие значения заряда и массы в природе. Одна из состав- ныхчастейатома–отрицательнозаряженныйэлектрон–былаобнаруженаеще
в 19 веке. В 1987 г. удалось, хотя и грубо, измерить заряд электрона; позднее измерена было его масса и еще позже были обнаружены другие его свойства – вращательный и магнитный моменты. Эти единичные отрицательные заряды получили название электронов. Никогда и нигде не удавалось наблюдать зарядов,меньшихзарядаэлектронаилиравныхнецеломучислузарядовэлектрона.
В 1937 году И.Е. Тамм вместе с И.М. Франком создали теорию явления, которое тремя годами ранее найдено и исследовано П.А. Черенковым и С.И. Вавиловым. Было обнаружено слабое свечение жидкостей под действием радиоактивного излучения. Тамм и Франк указали, что источником свечения являютсябыстрозаряженныечастицы,пролетающиечерезпрозрачноевещество со скоростью, превосходящей скорость света в этом веществе. Очень красивая эта теория, как и само явление, сначала не привлекла к себе большого внимания, потому что свечение было очень слабым и казалось, что его невозможно использовать. Однако прошло полтора десятка лет после открытия, и появи- лисьприборы–черенковскиесчетчики,позволяющиерегистрироватьбыстрые заряженные частицы по излучаемому ими свечению.
СТРУКТУРНАЯ СХЕМА РАБОТЫ ПО СОЗДАНИЮ ЗТРИИ ДЛЯ КОНТАКТНОЙ ЛУЧЕВОЙ ТЕРАПИИ (БРАХИ).
1. О медицинской физике
«Вопрос кадров для нас важнейший. Во-первых, потому, что сегодня есть ряд специальностей, в которых мы испытываем острейший дефицит… Вторая специальность – медицинский физик… Нужны люди, которые должны разбираться в том, что такое…брахитерапия».
Руководитель ФМБА В.В. Уйба. «Пять лет ФМБА России: прорыв в медицину будущего»// Кто есть кто в медицине, №1, 2010.
В рекомендациях МАГАТЭ/ВОЗ раздел «Медицинская физика в радиотерапии» обозначен первым номером.
Всемирная организация здравоохранения еще в 1969 г. опубликовала доклад Объединенного комитета экспертов МАГАТЭ/ВОЗ в серии технических докладов №390 «Радиационная физика в медицине». Мы позволили себе привести некоторые выдержки из этой публикации, не потерявшей, с нашей точки зрения, актуальность и в наше время и для нашей практической деятельности.
-- «Доктор Dorolle подчеркнул растущую …потребность в помощи со стороны естественных наук при разработке и использовании различных диагностических и терапевтических методов. Он указал на важную роль физики, особенно в плане применения ионизирующей радиации….в радиотерапии».
-- «В минимальный круг его обязанностей (медицинского физика., прим. авт.) входит: а) ответственность за все аспекты радиационной дозиметрии при радиотерапии внешним пучком и брахитерапии; б) ответственность за все физические аспекты радиационной защиты».
-- «Кроме того, важной обязанностью физика является внедрение в практику радиотерапии новых научных или технических достижений».
-- «Медицинская физика как бы связывает медицину и физические дисциплины».
-- «Физик придает медицинским проблемам аналитический, количественный подход, что имеет большое положительное значение».
-- «При планировании курсов радиотерапии весьма полезным могут ока-
заться данные, опубликованные в литературе, особенно таблицы глубинных доз, карты изодоз и атласы распределения доз радиации».
-- «МАГАТЭ и ВОЗ должны продолжать совместно освещать различные аспекты применения физических дисциплин и техники в медицинской практике и научных исследованиях».
Поразительно близко к названию Центра, в котором автор данной книги работает уже много лет: МБФЦ (Медицинский био-физический центр).
“Россия, к сожалению, “знаменитыми” медицинскими физиками похвастаться не может”, пишет В.А. Костылёв ( Медицинская физика, краткая история. Серны “Высокие медицинские технологии” №6, М. 1999 г.) Толи дело США “ Имеется большое число американских учёных с мировым именем ( GL Brownell, R. Loevinger at all)”
Если Международная Организация Медицинской Физики была создана в 1963 году, то официально Ассоциация медицинских физиков России как периодически самостоятельная организация сформировалась в 1993 г. В буклете этой Ассоциации [19] за 1999 г сказано, что “пока мы надрываясь, соревновались в США и Европой в области ядерной физики, они выдержав это соревнование,оченьсильно(почтинаполвека)обошлинасвобластимедицинскойфизики, ядерно-физических технологий и аппаратуры для медицины”. Разрешите не во всём согласиться с автором буклета и на конкретных примерах, изложенных в предлагаемой монографии, продемонстрировать успехи отечественных ученых, пусть в частности, в контактной лучевой терапии (КЛТ).
Соглашаясьсавторомбуклета,спризывомработатьнамедицину не разрозненными группами, мы постараемся показать каким образом и кого удавалось соорганизовать и нацелить на решение конкретных задач, стоящих перед КЛТ.
Показать, говоря языком автора буклета, как и кого удалось “переориентировать физиков-оружейников на медицинских физиков”, а также привлечь химиков, биологов, радиобиологов, биохимиков, чиновников.
Очень хочется привеcти следующие слова из буклета: “Молодёжь ринется в эту область науки и практики с гораздо большим энтузиазмом, чем во многие другие.”
Выдержки из кники J.R.Mallard “Medical physics – what is it?”
“Медицинская физика как организованная профессия появилась недавно. У многих людей понятие «медицинской физики» неизменно ассоциируется с «радиологией».
Вторая мировая война вызвала в последующие годы развитие четырех направлений в медицинской физике. Во-первых, программа развития атомной
энергии сделала производство радиоактивных материалов сравнительно дешевым и доступным для диагностических центров и терапии. Во-вторых, она вызвала к жизни задачу радиационной защиты, которая внезапно приобрела большое значение для всего населения земного шара.
В смысле организованного коллектива ученых медицинская физика в Великобритании не имеет себе равных. Что касается международного масштаба, что Международная организация медицинской физики была создана в 1963 году, и я имел честь быть в первые ее годы генеральным секретарем. Организация получила в настоящее время официальное признание как одна из организаций, входящих в Международную организацию теоретической и прикладной биофизики.
Применение физики в целях радиотерапии.
Рассмотрим сначала ту область медицинской физики, которую некоторые называют областью обычного применения физики: применение в целях радиотерапии. Долгом медицинского физика является точно указать радиотерапевту, какого рода радиацию излучает его терапевтическая машина и в каком количестве, и помочь ему использовать ее наилучшим образом на пользу больного.
Медики имеют дело с телом человека, которое эволюционировало в течение миллионов лет. Мы же, со своей стороны, имеем дело с хитроумными приборами, основанными на идеях и представлениях, насчитывающих всего лишь пятьдесятлет,итехнологией,которуюнужноосуществитьнапрактикеинасчитывающей всго лишь каких-нибудь десять лет жизни или около того.
В настоящее время (1967 г.) в области медицинской физики встает вопрос об организации людей в определенные группы, причем каждая должна заниматься чем-то одним – либо клиническим применением, либо фундаментальными исследованиями.
Мне представляется также, что кроме того может также существовать ка- кая-либо работа, которую можно было бы осуществить только один раз за всю жизнь и которая могла бы помочь медицине и медицинским физикам, и в частности Абердину.
Но что же такое медицинская физика и кто такие медицинские физики? Во-первых, и, по-моему, в основном, мы физики, или, если использовать более подходящий термин, естествоиспытатели. Мы должны быть в первую очередь физикам, а затем уж применять нашу физику к медицине. Говоря словами одного из наших первых работников: «Мы хотим быть полезными». Итак, медицинская физика – это не специальный вид физики, а только направление для достижения определенной цели. Это важно, так как является тем главным вкладом, который мы должны сделать. Мы должны не только использовать методы физики, но мы должны также привнести понятия, идеи и образ мышления
физика в медицинские вопросы.
Определенная медицинская проблема, вероятно, может рассматриваться с различых точек зрения людьми, имеющими медицинское или биологическое
образование. Даже при выражении этой точки зрения в умах обеих сторон может появиться новый подход к проблеме.
Таким образом, медицинская физика – это прикладая наука, которая в своем развитии зависит от прогресса идей и технологии, давшей ей жизнь, причем ее прогресс направляется в итоге в основном уждам медицины. Однако, медицинская физика, наподобие ревущего ребенка, и обремененная своей службой медицине, также может иногда внести свой вклад в прогресс своего выдающегося родителя – науки, а именно физики. Классическим примером этого служит детектирование, определение и изменение ионизирующей радиации. Задача обеспечения того, чтобы наши технологические ресурсы были всегда наготове для ежедневного практического использования нашими коллегами – медиками.
Мы, как я надеюсь, помогаем медицине стать более количественной или цифровой.
И в конце концов, мне хотелось бы сказать, что в отношении этой розы я не могу не согласиться с Джульеттой, которая говорила: «Роза, названная другим именем, бедет все также сладко пахнуть».
Медицинская физика – это не лучшее название данного предмета. Один из университетских факультетов Великобритании называется «Применение физики в медицине» («Физика в применении к медицине»). Все они занимаются очень схожей работой. Мне представляется, что термин «био-медицинская физика» является, вероятно, самым близким и кратким названием.
Напечатано в Великобритании, университет в Абердине”.
2. Структурная схема работы
Человек,которыйотвечаетзапостановкузадачианализрезультатов,оказывается сам втянутым в процесс выявления взаимовлияния как активный участник, обладающий специфическими свойствами. Он становится ответственным за постановку экспериментов, “носителем целостного восприятия, сохранения целостности при расчленении проблемы, при распределении работ, носителем системы ценностей, критериев принятия решений”. [Волкова В.Н. Основы теории систем и системного анализа. – СПб, 1999г.
Схема, изображающая пути решения главных задач работы по созданию ЗТРИИ для КЛТ, взаимосвязь и последовательность получения наиболее важных промежуточных результатов приведена ниже.
Ионизирующее излучение, последствия для здоровья и защитные меры
Ионизирующее излучение — это вид энергии, высвобождаемой атомами в форме электромагнитных волн (гамма- или рентгеновское излучение) или частиц (нейтроны, бета или альфа). Спонтанный распад атомов называется радиоактивностью, а избыток возникающей при этом энергии является формой ионизирующего излучения. Нестабильные элементы, образующиеся при распаде и испускающие ионизирующее излучение, называются радионуклидами.
Все радионуклиды уникальным образом идентифицируются по виду испускаемого ими излучения, энергии излучения и периоду полураспада.
Активность, используемая в качестве показателя количества присутствующего радионуклида, выражается в единицах, называемых беккерелями (Бк): один беккерель — это один акт распада в секунду. Период полураспада — это время, необходимое для того, чтобы активность радионуклида в результате распада уменьшилась наполовину от его первоначальной величины. Период полураспада радиоактивного элемента — это время, в течение которого происходит распад половины его атомов. Оно может находиться в диапазоне от долей секунды до миллионов лет (например, период полураспада йода-131 составляет 8 дней, а период полураспада углерода-14 — 5730 лет).
Источники излучения
Люди каждый день подвергаются воздействию естественного и искусственного излучения. Естественное излучение происходит из многочисленных источников, включая более 60 естественным образом возникающих радиоактивных веществ в почве, воде и воздухе. Радон, естественным образом возникающий газ, образуется из горных пород, почвы и является главным источником естественного излучения. Ежедневно люди вдыхают и поглощают радионуклиды из воздуха, пищи и воды.
Люди подвергаются также воздействию естественного излучения из космических лучей, особенно на большой высоте. В среднем 80% ежегодной дозы, которую человек получает от фонового излучения, это естественно возникающие наземные и космические источники излучения. Уровни такого излучения варьируются в разных реогрфических зонах, и в некоторых районах уровень может быть в 200 раз выше, чем глобальная средняя величина.
На человека воздействует также излучение из искусственных источников — от производства ядерной энергии до медицинского использования радиационной диагностики или лечения. Сегодня самыми распространенными искусственными источниками ионизирующего излучения являются медицинские аппараты, как рентгеновские аппараты, и другие медицинские устройства.
Воздействие ионизирующего излучения
Воздействие излучения может быть внутренним или внешним и может происходить различными путями.
Внутренне воздействие ионизирующего излучения происходит, когда радионуклиды вдыхаются, поглощаются или иным образом попадают в кровообращение (например, в результате инъекции, ранения). Внутреннее воздействие прекращается, когда радионуклид выводится из организма либо самопроизвольно (с экскрементами), либо в результате лечения.
Внешнее радиоактивное заражение может возникнуть, когда радиоактивный материал в воздухе (пыль, жидкость, аэрозоли) оседает на кожу или одежду. Такой радиоактивный материал часто можно удалить с тела простым мытьем.
Воздействие ионизирующего излучения может также произойти в результате внешнего излучения из соответствующего внешнего источника (например, такое как воздействие радиации, излучаемой медицинским рентгеновским оборудованием). Внешнее облучение прекращается в том случае, когда источник излучения закрыт, или когда человек выходит за пределы поля излучения.
Люди могут подвергаться воздействию ионизирующего излучения в различных обстоятельствах: дома или в общественных местах (облучение в общественных местах), на своих рабочих местах (облучение на рабочем месте) или в медицинских учреждениях (пациенты, лица, осуществляющие уход, и добровольцы).
Воздействие ионизирующего излучения можно классифицировать по трем случаям воздействия.
Первый случай — это запланированное воздействие, которое обусловлено преднамеренным использованием и работой источников излучения в конкретных целях, например, в случае медицинского использования излучения для диагностики или лечения пациентов, или использование излучения в промышленности или в целях научных исследований.
Второй случай — это существующие источники воздействия, когда воздействие излучения уже существует и в случае которого необходимо принять соответствующие меры контроля, например, воздействие радона в жилых домах или на рабочих местах или воздействие фонового естественного излучения в условиях окружающей среды.
Последний случай — это воздействие в чрезвычайных ситуациях, обусловленных неожиданными событиями, предполагающими принятие оперативных мер, например, в случае ядерных происшествий или злоумышленных действий.
На медицинское использование излучения приходится 98% всей дозы облучения из всех искусственных источников; оно составляет 20% от общего воздействия на население. Ежегодно в мире проводится 3 600 миллионов радиологических обследований в целях диагностики, 37 миллионов процедур с использованием ядерных материалов и 7,5 миллиона процедур радиотерапии в лечебных целях.
Последствия ионизирующего излучения для здоровья
Радиационное повреждение тканей и/или органов зависит от полученной дозы облучения или поглощенной дозы, которая выражается в грэях (Гр).
Эффективная доза используется для измерения ионизирующего излучения с точки зрения его потенциала причинить вред. Зиверт (Зв) — единица эффективной дозы, в которой учитывается вид излучения и чувствительность ткани и органов. Она дает возможность измерить ионизирующее излучение с точки зрения потенциала нанесения вреда. Зв учитывает вид радиации и чувствительность органов и тканей.
Зв является очень большой единицей, поэтому более практично использовать меньшие единицы, такие как миллизиверт (мЗв) или микрозиверт (мкЗв). В одном мЗв содержится тысяча мкЗв, а тысяча мЗв составляют один Зв. Помимо количества радиации (дозы), часто полезно показать скорость выделения этой дозы, например мкЗв/час или мЗв/год.
Выше определенных пороговых значений облучение может нарушить функционирование тканей и/или органов и может вызвать острые реакции, такие как покраснение кожи, выпадение волос, радиационные ожоги или острый лучевой синдром. Эти реакции являются более сильными при более высоких дозах и более высокой мощности дозы. Например, пороговая доза острого лучевого синдрома составляет приблизительно 1 Зв (1000 мЗв).
Если доза является низкой и/или воздействует длительный период времени (низкая мощность дозы), обусловленный этим риск существенно снижается, поскольку в этом случае увеличивается вероятность восстановления поврежденных тканей. Тем не менее риск долгосрочных последствий, таких как рак, который может проявиться через годы и даже десятилетия, существует. Воздействия этого типа проявляются не всегда, однако их вероятность пропорциональна дозе облучения. Этот риск выше в случае детей и подростков, так как они намного более чувствительны к воздействию радиации, чем взрослые.
Эпидемиологические исследования в группах населения, подвергшихся облучению, например людей, выживших после взрыва атомной бомбы, или пациентов радиотерапии, показали значительное увеличение вероятности рака при дозах выше 100 мЗв. В ряде случаев более поздние эпидемиологические исследования на людях, которые подвергались воздействию в детском возрасте в медицинских целях (КТ в детском возрасте), позволяют сделать вывод о том, что вероятность рака может повышаться даже при более низких дозах (в диапазоне 50-100 мЗв).
Дородовое воздействие ионизирующего излучения может вызвать повреждение мозга плода при сильной дозе, превышающей 100 мЗв между 8 и 15 неделей беременности и 200 мЗв между 16 и 25 неделей беременности. Исследования на людях показали, что до 8 недели или после 25 недели беременности связанный с облучением риск для развития мозга плода отсутствует. Эпидемиологические исследования свидетельствуют о том, что риск развития рака у плода после воздействия облучения аналогичен риску после воздействия облучения в раннем детском возрасте.
Деятельность ВОЗ
ВОЗ разработала радиационную программу защиты пациентов, работников и общественности от опасности воздействия радиации на здоровье в планируемых, существующих и чрезвычайных случаях воздействия. Эта программа, которая сосредоточена на аспектах общественного здравоохранения, охватывает деятельность, связанную с оценкой риска облучения, его устранением и информированием о нем.
В соответствии с основной функцией, касающейся "установления норм и стандартов, содействия в их соблюдении и соответствующего контроля" ВОЗ сотрудничает с 7 другими международными организациями в целях пересмотра и обновления международных стандартов базовой безопасности, связанной с радиацией (СББ). ВОЗ приняла новые международные СББ в 2012 году и в настоящее время проводит работу по оказанию поддержки в осуществлении СББ в своих государствах-членах.
Лечение рака: лучевая терапия
Лучевая терапия является одним из наиболее широко используемых видов терапии для лечения рака. Ее принцип действия состоит в том, что ионизирующее излучение в различных формах (рентген, гамма-излучение, частицы) используется для разрушения и уничтожения опухоли, по отдельности или в сочетании с хирургией или химиотерапией. Лучевая терапия бывает либо внешней (дистанционная терапия), либо внутренней (брахитерапия).
Дистанционная лучевая терапия
Дистанционной лучевой терапией называют лучевую терапию, получаемую от внешнего источника излучения, находящегося на некотором расстоянии от тела человека. Это наиболее распространенный вид лучевой терапии, используемой при лечении рака. Как правило, лечение проводится при помощи кобальтовой установки, которая обеспечивает гамма-излучение высокой энергии, или линейного ускорителя, который может производить рентгеновское излучение или электроны высокой энергии. При использовании наиболее распространенной схемы лечение проводится ежедневно в течение 4-8 недель.
Для равномерного подведения дозы излучения к мишени, которая может быть толщиной несколько сантиметров, источник излучения помещают на некотором расстоянии от пациента (как правило, 80-150 см). Находящаяся на траектории пучка здоровая ткань, включая кожу, может также подвергнуться воздействию облучения. Чтобы уменьшить это воздействие, для более глубоко лежащих опухолей используются пучки более высокой энергии, и облучение направляется под несколькими углами, что максимизирует дозу на перекрещении пучков.
Современные методы дистанционной лучевой терапии
Самые современные методы, такие как 3D конформная лучевая терапия, лучевая терапия с модуляцией интенсивности и лучевая терапия с визуальным контролем позволяют добиться чрезвычайно точного формирования мишени, к которой подводится назначенная доза излучения. Эти методы лучевой терапии позволяют подводить более низкую дозу излучения к здоровым тканям и более высокую дозу к опухоли. Пациенты, получающие лучевую терапию, не испытывают при воздействии излучения физических ощущений; это очень напоминает рентгеновскую процедуру. Однако побочные эффекты все-таки имеют место. В тканях с быстро делящимися клетками, таких как слизистая оболочка и кожа, ранние реакции выглядят как "загар". В тканях с медленно делящимися клетками, например, в почках или сосудистой системе, снабжающей головной и спинной мозг, переносимость радиации ниже. Если они получают излучение выше определенного порога, у них возникает риск развития отдаленных последствий, которые, как правило, становятся очевидными через много месяцев после лечения.
Современная технология позволяет в значительной мере предотвратить облучение жизненно важных органов, находящихся рядом с опухолью. Еще одним важным инструментом является радиобиологические исследования, помогающие выбрать оптимальные схемы лечения. В медицинском учреждении должна существовать комплексная программа обеспечения качества.
Физика радиотерапии - ионизирующей радиации
Физика радиотерапии - ионизирующей радиации
В недавно вышедшем обзоре Королевского колледжа радиологов (Великобритания) была проведена оценка того, какой вклад в общую долю успешно пролеченных онкологических пациентов вносят те или иные способы лечения. Оказалось, что 49% падает на хирургическое вмешательство, 40% составляет успешное радиологическое лечение, а вклад химиотерапии составляет 11%.
Еще со времен открытия Рентгеном в 1895 г. излучения, названного его именем, постоянно предпринимались попытки не только изучить физическую природу этого излучения, но и применить его на практике как в биологии, так и в лечении болезней человека.
Изобретение рентгеновской трубки открыло целый ряд возможностей для ее клинического применения вначале только в диагностике, а затем и в лечении больных злокачественными новообразованиями. Открытие радия Марией и Пьером Кюри в 1898 г. дало в руки врачей ряд радиоактивных материалов, которые они пытались использовать в лечении рака, так как единственным способом помочь онкологическим больным в то время было хирургическое вмешательство.
За последующие 100 лет мы узнали много нового о физических характеристиках, биологических эффектах и возможностях клинического использования ионизирующего излучения. Ссылки на наиболее заметные работы в этой области приведены имеются в разделе книги по онкологии.
Для ясного понимания физической природы радиоактивности и радиоактивного распада очень важно иметь представление о составе спектра электромагнитных волн, каждая из которых несет энергию, обратно пропорциональную длине своей волны.
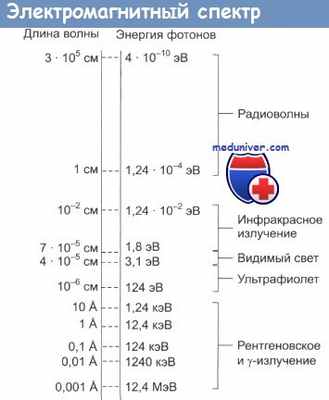
Шкала электромагнитных излучений включает в себя рентгеновское излучение (с высокой энергией и очень маленькой длиной волны), видимый свет (средняя энергия и длина волны) и радиоволны (малая энергия и большая длина волны), которые используются для передачи сигналов по радио и в телекоммуникациях. Из всего спектра электромагнитного излучения именно рентгеновские лучи и гамма-радиация (эти термины почти взаимозаменяемы) несут достаточную энергию для ионизации атомов при прохождении через биологические ткани.
В процессе ионизации электроны срываются со своих атомных орбит, что приводит к образованию нестабильных ионизированных атомов. Свободные электроны могут «захватываться» окружающими атомами, которые также становятся нестабильными, так как приобретают дополнительный отрицательный заряд.
При прохождении пучка излучения через живую ткань плотность и величину трека ионизации можно контролировать, изменяя характеристики источника излучения. Это позволяет избирательно повреждать определенные клетки, что происходит при терапевтическом использовании излучения (в радиотерапии).
Для диагностики применяется такое излучение, которое вызывает лишь кратковременные эффекты и не оказывает существенного биологического воздействия на ткани. Получение рентгеновских снимков возможно из-за разницы в степени поглощения излучения разными тканями, которые содержат атомы, отличающиеся по атомному весу.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Физика радиотерапии - ионизирующей радиации
Первое в мире специализированное учреждение рентгенорадиологического профиля было создано через несколько месяцев после Октябрьской революции 1917 года по инициативе профессора М.И. Неменова и профессора А.Ф. Иоффе при непосредственном участии Наркома просвещения А.В. Луначарского. Решение об организации нового института отражено в выписке из протокола 38 заседания малой областной комиссии по просвещению от 23 сентября 1918 года. Эта дата и считается днем основания Государственного рентгенологического и радиологического института. Создание этого уникального учреждения, в котором были объединены медики, биологи и физики происходило в период гражданской войны, голода, разрухи, отсутствия электроэнергии и тепла, саботажа специалистов.
Первым выборным президентом института был профессор А.Ф. Иоффе (в 1919 году), в 1920 году эту должность занял профессор М.И. Неменов и возглавлял это учреждения в течение 30 лет. Институт был задуман как мультидисциплинарное научное учреждение для решения широкого круга теоретических и практических вопросов действия ионизирующей радиации на биологические объекты и применения в медицине для диагностики и лечения.
Продуманная кадровая политика руководства института и оптимальная структура позволили с первых лет решать глобальные инновационные задачи: в этот период институт состоял из трех больших отделов: медико-биологического (руководитель М.И. Неменов), физико-технического (руководитель А.Ф. Иоффе) и радиевого (руководитель Л.С. Коловрат-Червинский). Такая структура оставалась адекватной в течение многих лет работы учреждения.
Благодаря невероятным усилиям и энергии профессора М.И. Неменова институт в короткий срок был укомплектован высококвалифицированными кадрами – учеными с мировым именем и оборудованием: рентгеновскими установками и всем необходимым для начала работы биологических лабораторий.
Уже 29 января 1919 года в клинику института, единственную на эту дату рентгенорадиологическую клинику в мире, был принят первый пациент – больная с саркомой левой верхней конечности. Начала работать детская клиника. К 1920 году деятельность нового института получила признание зарубежных ученых: сам В.К. Рентген высоко оценил его создание в письме М.И. Неменову в сентябре этого года. Дважды лауреат Нобелевской премии Мария Склодовская-Кюри лично подписывала сертификаты препаратов радия, высылаемых в институт для использования в лечебных и научных целях.
С самого начала научно-исследовательские разработки в институте планировались и осуществлялись на мировом уровне. Усилиями собранных в стенах института ученых были заложены основы отечественной рентгенологии и радиологии, радиобиологии и медицинской радиационной физики.
Несмотря на невыносимо тяжелые условия работы, ученым, врачам, сотрудникам института всего через 10 лет удалось продемонстрировать уникальные научные достижения и результаты лечения больных.
В институте впервые оформились новые научные направления. В 1925 году академиком Г.А. Надсоном и научным сотрудником Г.С. Филипповым было сделано крупнейшее научное открытие – мутагенное действие радиации, давшее начало развитию радиационной генетики. В эти годы были проведены исследования по изучению механизма действия ионизирующей радиации на разных уровнях интеграции. Г.А. Надсоном был введен сам термин «радиобиология», в работах его лаборатории были заложены ее основы и сформулированы главные проблемы этой науки, актуальные до настоящего времени. В стенах института начали развиваться научные исследования по радиационной биохимии (профессор Е.С. Лондон), микробиологии, иммунологии (профессор С.И. Златогоров), морфологические методы в приложении действия радиации на клеточном и тканевом уровнях (профессор А.А. Заварзин). В отделе патологической анатомии изучались пострадиационные морфологические изменения в нормальных и опухолевых тканях при местном и общем облучении (В.Г. Гаршин, М.А. Захарьевская). Здесь был создан уникальный патологоанатомический музей, который сохранился до настоящего времени.
С момента основания института актуальным направлением исследований стала экспериментальная онкология. В научных разработках ракового отдела, организованного в 1922 году профессором Г.В. Шором, принимали участие почти все экспериментальные подразделения института.
В эти годы разрабатывались фундаментальные основы клинических методов лучевой терапии. В институте были внедрены в медицинскую практику методы лечения злокачественных новообразований с использованием препаратов радия, радона, кобальта, фосфора и др. (Ф.С. Гроссман, В.А. Шаак, Е.Р. Новотельнова, М.И. Неменов и др.). Новым направлением стала лучевая терапия неопухолевых, воспалительных, эндокринных и системных заболеваний (А.М. Югенбург, Р.Я. Гасуль, Л.Р. Протас, М.И. Неменов).
Основы отечественной рентгенологии были заложены в институте с первых лет его существования, были разработаны новые методы рентгенодиагностики заболеваний различных органов и систем опухолевой и неопухолевой этиологии, в том числе с применением искусственного контрастирования (М.И. Неменов, С.А. Рейнберг, О.И. Арнштам, Г.Д. Рохлин, М.Г. Привес и др.).
В это же время начались разработки по физико-техническому обеспечению лучевой диагностики и терапии, были созданы новые диагностические и лечебные установки, дозиметрическая аппаратура, методы физического сопровождения лучевого лечения (А.И. Тхоржевский, В.А. Петров, В.И. Феоктистов, С.П. Яншек и др.).
В годы Великой отечественной войны основные кадры института были эвакуированы в Самарканд, многие сотрудники ушли на фронт. На базе института был организован эвакогоспиталь № 264.
В послевоенный период в связи с новыми задачами по использованию атомной энергии в мирных целях научная тематика института была изменена, основными направлениями стало изучение патогенеза, клиники, профилактики и лечения лучевой болезни, разработка методов применения радиоактивных изотопов и других видов ионизирующих излучений для диагностики и лечения. В этот период были созданы и внедрены в клиническую практику новые способы лечения широкого спектра опухолей и неопухолевых заболеваний с помощью телегамма-аппарата, при внутритканевом и комбинированном облучении изотопами радиоактивного Со60, цезия, церия, йода, фосфора и др.
Фундаментальные аспекты действия ионизирующей радиации на биологические объекты разного уровня организации стали основными направлениями деятельности экспериментальных подразделений института: отдела экспериментальной морфологии (профессор Г.С. Стрелин), бактериосерологической лаборатории (профессор П.Н. Киселев), отдела биохимии (профессор С.Е. Манойлов), экспериментально-ракового отдела (член-корр. АМН СССР, профессор Л.Ф. Ларионов).
Фундаментальные работы сотрудников экспериментальных лабораторий по выяснению механизмов биологического действия ионизирующей радиации, специфичности лучевого воздействия, регенерации клеток и тканей в облученном организме, радиационной гематологии, эндокринологии послужили основой для достижений в диагностике и терапии лучевой болезни, отдаленной лучевой патологии, обосновании лучевой терапии заболеваний различной этиологии. Результаты этих исследований выразились в большом количестве публикаций, изобретений, организации съездов, конференций, симпозиумов, посвященных этим проблемам.
В 60-е годы основные направления деятельности института и его структура принципиально не изменились. В ранее существующие отделы были введены лаборатории: радиационной генетики и отдаленной лучевой патологии, культуры тканей, радиационной фармакологии, изотопных методов исследования. В связи с изменением основных направлений работы института в послевоенный период НИР в области рентгенодиагностики фактически не проводилась. В 1963 году институт получил название «Центральный научно-исследовательский рентгенорадиологический институт», что предполагало развитие научно-исследовательских работ в области рентгенологии. В связи с этим в 1963 году был вновь создан рентгенодиагностический отдел (профессор К.Б. Тихонов).
В 1966 году был организован медико-биологический отдел (д.м.н. А.А. Волков), в котором совместно с Институтом ядерной физики РАН (Гатчина) был создан медицинский протонный комплекс для лучевой терапии на базе синхроциклотрона с энергией пучка протонов 1000 МэВ. В последующие годы в институте было организовано отделение протонной терапии, создана технология клинического применения протонного пучка для лечения больных с опухолями гипофиза и артерио-венозными мальформациями головного мозга (профессор Б.А. Коннов).
С 1971 года начался следующий важный этап в истории института – состоялся переезд в поселок Песочный. Новые здания, модернизация оборудования, пополнение специалистами различных профилей создали условия для превращения института в современный мультидисциплинарный центр.
В новых условиях продолжались научные разработки как по традиционным направлениям (лучевая диагностика и терапия, радиобиология, медицинская радиационная физика, так и по новым, получившим развитие в 80-90-е годы.
В 1980 году по инициативе профессора А.М. Гранова был создан отдел рентгенохирургических методов диагностики и лечения, в котором были разработаны новые оригинальные технологии эндоваскулярных вмешательств в гепатологии, онкоурологии и онкогинекологии, получившие мировое признание (защищены патентами России и США). Большой вклад в создание этих инновационных методов внесли: член-корр. РАН, профессор Д.А. Гранов, профессор П.Г. Таразов.
В 1982 году была образована лаборатория гибридомной технологии (профессор В.Б. Климович). В лаборатории создана уникальная коллекция реагентов, распознающих все известные разновидности антител (иммуноглобулинов) человека для диагностики иммунодефицитов, инфекционных, аллергических, аутоиммунных заболеваний и некоторых злокачественных опухолей; созданы уникальные панели реагентов для диагностики заболеваний почек, щитовидной железы. Разработаны тест-системы для выявления множественной миеломы, рассеянного склероза амилоидоза и других заболеваний.
В 1993 году директором института был назначен профессор А.М. Гранов. В кризисные 90-годы, благодаря энергии и выдающимся организационным способностям профессора А.М. Гранова, институт сохранил свой высокий статус и продолжал активную научную и клиническую деятельность.
Многолетний опыт работы в области хирургической гепатологии и интервенционной радиологии позволил, начиная с 1998 года развивать в институте программу по пересадке печени с результатами, соответствующими мировым стандартам. (академик РАН, профессор А.М.Гранов, член-корр. РАН, профессор Д.А. Гранов, к.м.н. Ф.К. Жеребцов и др. К настоящему времени сделано более 150 пересадок печени.
Одним из приоритетных направлений деятельности института стало создание диагностических и лекарственных препаратов на основе новейших методов биотехнологии. В 1990 году был организован отдел биотехнологии, в состав которого вошли лаборатория биотехнологии (профессор О.А. Розенберг), лаборатория доклинических испытаний биотехнологических продуктов (д.м.н. В.А. Волчков). В дальнейшем на базе института компании «Биосурф» создано производство препарата легочного сурфактанта БЛ, разрабатываются новые способы сурфактант-терапии при критических состояниях и заболеваниях органов дыхания, в том числе такой социально значимой болезни как туберкулез легких в случаях резистентности к стандартной терапии. Эти высокоэффективные препараты в настоящее время используются в лечебных учреждениях России и стран СНГ. На высоком современном технологическом уровне работает лаборатория генной инженерии (д.б.н. В.И. Евтушенко), в которой активно разрабатываются экспериментальные обоснования генотерапии опухолей.
Совместные научные разработки ученых клиники и отдела радиобиологии позволяли модернизировать диагностику и лечение ряда онкологических заболеваний.
В лаборатории радиационной и онкологической генетики (профессор И.Е. Воробцова) совместно с урологическим отделением (д.м.н. М.И. Школьник) и отделением опухолей малого таза (профессор Г.М. Жаринов) начато и продолжается изучение генетических маркеров предрасположенности к развитию рака мочевого пузыря и предстательной железы, молекулярно-цитогенетические изменения в опухолевых клетках, значимые для диагностики, прогноза и лечения.
Многолетнее сотрудничество лаборатории методов повышения эффективности лучевой терапии (профессор А.Н. Шутко) с учеными, работающими в области клинической онкологии и радиологии (д.м.н. Л.Е. Юркова, профессор В.Ф. Мус) и медицинскими физиками (к.ф-м.н. А.М. Червяков) позволили разработать принципиально новый компонент комбинированного лечения онкологических больных – системную лучевую терапию в нетуморицидных дозах и с успехом применять ее в лечении тяжелой категории больных с распространенным раком яичников и больных раком легкого.
В лаборатории биотестирования токсических факторов окружающей среды (профессор С.Д. Иванов) и отделе клинической радиологии (з.д.н., профессор Л.И. Корытова) разрабатывается метод предикции эффективности лучевой терапии на основе изучения показателя радиочувствительности ДНК крови с целью индивидуализации лучевого лечения.
2000-е годы ознаменовались настоящим технологическим прорывом в развитии лучевой диагностики, что было связано с внедрением новых высокотехнологических методов визуализации: высокопольной магнитно-резонансной томографии, магнитно-резонансной спектроскопии, спиральной и мультиспиральной компьютерной томографии, современных методов лучевой диагностики заболеваний различной этиологии. В этих разработках принимали участие научные сотрудники и врачи (руководитель отдела лучевой диагностики з.д.н., профессор Л.А. Тютин, д.м.н. А.А. Станжевский, д.м.н. Е.В. Розенгауз и др.).
В эти же годы были заложены основы нового перспективного направления деятельности института – ядерной медицины и молекулярной визуализации. После нескольких лет подготовки необходимого технического оснащения в 1998 году было создано отделение медицинского циклотрона, позже переименованного в Отделение циклотронных радиофармпрепаратов. В настоящее время циклотронный комплекс многоцелевого назначения включает два отечественных циклотрона (МГЦ-20 и СС 18/9), в 2016 году был введен в строй новый циклотрон GE PETtrace (к.б.н. С.В. Шатик, к.ф.-м.н. Д.С. Сысоев, В.В. Зайцев).
В 2002 году была создана лаборатория иммуногистохимии (профессор К.М. Пожарисский). Благодаря широкому использованию новейших методов морфологического исследования (иммуногистохимия, гибридизация in situ и др.) значительно усовершенствована гистогенетическая диагностика опухолей, изучаются прогностические и предсказательные иммуногистохимические маркеры, в ряде случаев превосходящие по клинической информативности традиционно исследуемые прогностические показатели.
Достижения клинических подразделений института с момента основания Института базировались на высоком уровне физико-технических разработок. В течение ряда лет Институт был головным учреждением по разработке радиотерапевтической техники, на его базе проводились испытания нескольких поколений линейных ускорителей (ЛУЭ-15, ЛУЭР-20), проводились уникальные разработки по созданию комплексов для использования узких фотонных пучков на серийных ускорителях (д.т.н. И.А. Ермаков, Р.В. Синицын, к.т.н. О.А. Штуковский, к.б.н. А.М. Червяков и др.). В 2009 году произошло капитальное переоснащение парка облучательной аппаратуры, в 2011 году запущен в клиническую эксплуатацию линейный ускоритель Axess, который позволяет реализовать любую методику конформного облучения; в 2012 году введен в строй линейный ускоритель Precise, c граничной энергией 20 МэВ. Система MOSAIQ Desktop позволяет осуществлять весь алгоритм облучения пациента. Институт был первым в мире учреждением, в котором разрабатывались и внедрялись в клиническую практику методы лучевой и комбинированной терапии опухолевых, системных и неопухолевых заболеваний, накоплен огромный клинический опыт. Подготовлен к эксплуатации «Гамма-нож» для высокоточного облучения патологических образований головного мозга.
Благодаря внедрению современной техники лучевое лечение в Центре вышло на качественно новый уровень, позволяющий осуществлять все виды конформной терапии, применять методы прецизионной предлучевой подготовки больных, осуществлять мониторинг результатов с использованием передовых технологий лучевой диагностики и комплексного клинико-лабораторного обследования больных.
В отделе клинической радиологии (з.д.н., профессор Л.И. Корытова) разрабатываются новые технологии, позволяющие повысить эффективность и расширить показания к проведению лучевой и комбинированной терапии.
В 2007 году в связи основных направлений деятельности Центральный научно-исследовательский рентгенорадиологический институт МЗ РФ был переименован в ФГУ Российский научный центр радиологии и хирургических технологий Минздрава России.
В 2012 году было организовано отделение сосудистой хирургии (д.м.н. Д.Н. Майстренко). Методы сосудистой хирургии широко используются при оперативных вмешательствах: разрабатываются новые виды гибридных реконструктивных операций при облитерирующем атеросклерозе сосудов нижних конечностей, проводится эндоваскулярное лечение аневризм аорты и подвздошных артерий.
В отделе интервенционной радиологии и оперативной хирургии за последние годы созданы и внедрены в практику инновационные технологии лечения опухолей гепатопанкреатодуоденальной области. На новые способы получены патенты на изобретение за последний год – 3 патента на способ лечения опухолей поджелудочной железы (член-корр. РАН, д.м.н. Д.А. Гранов, д.м.н. А.В. Павловский).
В отделении урологии интервенционной радиологии и оперативной урологии разработаны и широко используются лапароскопические методы лечения (д.м.н. М.И. Школьник).
О мировом уровне и новизне проводимых в Центре исследований свидетельствует высокая изобретательская активность: за последние 5 лет было получено 55 патентов на изобретения.
С первых лет с момента основания Института он стал кузницей кадров рентгенологов и радиологов для СССР и России. В 2015 году на базе Центра была организована кафедра радиологии и хирургических технологий, в 2017 году получено свидетельство о государственной аккредитации образовательной деятельности.
К 2017 году произошли некоторые изменения в структуре Центра: подразделения отделов радиобиологии и биотехнологии были объединены в отдел фундаментальных исследований, в состав которого вошли вновь организованные лаборатории: доклинических исследований радиофармпрепаратов, нейромоделирования, группа разработки и исследования рентгеноконтрастных препаратов для интервенционной радиологии, а также группа экспериментальной хирургии.
В 19 июля 2017 года ФГБУ «Российский научный центр радиологии и хирургических технологий» Приказом Минздрава России №180пк присвоено имя академика А.М. Гранова.
Результаты научно-исследовательской и клинической деятельности учреждения были высоко оценены на Федеральном уровне: ряд сотрудников были удостоены Государственной премии и Премии Правительства Российской Федерации в области науки и техники .
17-20 октября 2018 года в Санкт-Петербурге проходили юбилейные торжества, посвященные 100-летию со дня основания Государственного рентгенологического и радиологического института (ныне ФГБУ «Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова» Минздрава России) – первого в мире научно-клинического учреждения такого профиля.
Версия для слабовидящих Карта сайта
Читайте также:
