Функции ДНК центромер Saccharomyces cerevisiae
Добавил пользователь Владимир З. Обновлено: 29.01.2026
состоящую из фибрилл, которые формируют петли наподобие ламповых щеток(Brinkleyetal.,1986).Вконцемитоза кинетохор как специализированная структура исчезает.
похожим образом устроены, все же последовательности нуклеотидов в них не полностью идентичны.
Элемент, называемый CDEI, во всех хромосомах имеет 7 консервативных
Ñ молекулярно-биологической нуклеотидов TCACATG. Далее следует
стороны организация кинетохора изучена очень слабо. Однако известно, что кинетохор содержит ДНК, ДНКсвязывающие белки, возможно РНК и тубулин(Brinkleyetal.,1986).Показано,что обработка ДНКазой хромосом млекопитающих специфично конденсирует структуру пластинки кинетохора, тогда как обработка РНКазой не влияет на не¸.
 настоящее время изучение организации центромерного района хромосом эукариот вед¸тся лишь на некоторых объектах.
 1980-å годы в центромерах дрожжей Saccharomyces cerevisiae были обнаруженыпоследовательности,делеции которых приводят к утрате центромерной функции, что позволяет определить зону локализации центромеры на молекулярной карте. Центромерные районы у дрожжей называют районами CEN (от centromere) с добавлением цифры, обозначающей номер хромосомы. Сравнительный анализ центромер разных хромосом выявил важные закономерности в их структуре - центромерная ДНК всех хромосом дрожжей перекр¸стно гибридизуется, что свидетельствует об их гомологии. Результаты полного секвенирования всего генома дрожжей показали наличие в центромерных районах всех 16 хромосом консервативныхдоменовCDEI(centromere DNAelementI),CDEIIиCDEIII(Рис.9.46.). Хотя все центромеры имеют одну и ту же функцию, и центромерные районы очень
фрагмент из 76-86 п.н. (число нуклеотидов в разных хромосомах разное). Это CDEII. Собственно нуклеотидные последовательности в каждой хромосоме разные, но в каждой из них доля AT-пар превышает 90% (в среднем 93-94%).
Элемент CDEIII состоит из 25 п.н., из которых последовательность -G-----G-
---CCGAA--------, присутствует во всех 16 хромосомах (Рис. 9.46).
Делеционный анализ, выполненный на плазмидах, содержащих центромеры дрожжей, однозначно свидетельствует, что районы I-III необходимы для митотической стабильности автономно реплицирующихся последовательностей (ARS) плазмиды. Для осуществления центромерной функции необходимы не целые выше описанные элементы, а консенсусные группы. Так, делеция 5 левых нуклеотидов элемента I существенно не влияет на активность центромеры CENII, тогда как удаление АТбогатой области (CDEII) полностью инактивирует центромерную активность. Высоко консервативный третий элемент (CDEIII) также принципиально необходим для осуществления центромерной функции. В нескольких работах было показано, что даже единичные делеции в этом районе полностью инактивируют центромеру.
Центромерные последовательности ДНК определены для ряда других организмов. Они оказались отличными от тех, что были найдены у S. cerevisiae , и различаются у разных видов. Так, у
Функции ДНК центромер Saccharomyces cerevisiae
Это предположение подтверждается и проявлением центромерной активности за пределами нормальных центромер. Такие неоцентромеры ведут себя как обычные центромеры: образуют цитологически различимую перетяжку и формируют кинетохор, связывающий белки. Однако анализ ДНК двух неоцентромер человека и обычной центромеры общих последовательностей не выявил, что говорит о возможной роли других структурных компонентов хромосомы. Ими могут быть гистоновые и негистоновые белки, которые связываются с ДНК, формируя нуклеосомную структуру хроматина.
Функциональную роль центромерной структуры хроматина подтверждает присутствие специфических для каждого биологического вида варианта гистона Н3 в центромерном хроматине: у человека они названы CENP-A, у растений - CENH3. Среди множества имеющихся в кинетохоре белков только два, СЕNН3 и центромерный белок С (СЕNР-С), непосредственно связываются с ДНК. Возможно, именно CENH3, взаимодействуя с другими гистонами (Н2А, Н2В и Н4), формирует и определяет специфический для центромер тип нуклеосом. Такие нуклеосомы могут служить своего рода якорями для образования кинетохора. Варианты гистона Н3 в центромерах различных видов подобны канонической молекуле гистона Н3 в участках взаимодействия с другими гистоновыми белками (Н2А, Н2В, Н4). Однако участок центромерного гистона Н3, взаимодействующий с молекулой ДНК, видимо, находится под действием движущего отбора. Как уже говорилось, первичная структура центромерной ДНК отличается между видами, и было высказано предположение, что центромерный гистон Н3 коэволюционирует вместе с центромерной ДНК, в частности у дрозофилы и арабидопсиса [1].
Обнаружение центромерного гистона Н3 породило крайнюю точку зрения, согласно которой центромерная функция и ее полная независимость от первичной структуры ДНК определяется нуклеосомной организацией и этим гистоном. Но достаточно ли этих факторов для полноценной активности центромеры? Модели, игнорирующие роль первичной структуры ДНК, должны предполагать случайное распределение изменений в структуре центромерной ДНК в различных популяциях в отсутствие отбора. Однако анализ сателлитной ДНК в центромерах человека и Arabidopsis выявил консервативные районы, так же как и районы с более высокой, чем средняя, вариабильностью, что указывает на давление отбора на центромерную ДНК. Кроме того, искусственные центромеры удалось получить только с a-сателлитными повторами человека, амплифицированными из природных центромер, но не из a-сателлитов прицентромерных районов хромосом.
Меньше принципиальных трудностей для объяснения встречают модели, в которых решающим фактором в определении позиции центромеры (сохраняющейся от поколения к поколению) и ее функций служит третичная (или даже более высокого порядка) структура ДНК. Ее консерватизм допускает большие вариации в последовательности нуклеотидов и не исключает тонкую подстройку первичной структуры.
Хеникофф с коллегами [2] предложили модель, описывающую координированную эволюцию ДНК и белков и приводящую к появлению оптимально функционирующих центромер на примере деления женских половых клеток. Как известно, в процессе мейоза одна родительская клетка посредством следующих друг за другом двух делений дает начало четырем дочерним клеткам. Впоследствии только одна из них превращается в зрелую женскую половую клетку (гамету), передающую генетическую информацию следующему поколению, тогда как три других клетки отмирают. Согласно этой модели, в процессе эволюции вследствие мутаций и других механизмов в хромосомах могут возникать центромеры с более протяженными тяжами мономеров сателлитной ДНК или с первичной структурой нуклеотидов, более способствующей связыванию и координированной работе со специфическими формами гистонов CENH3 и СЕNР-С. При этом у одних организмов (арабидопсис, дрозофила) доказательства для положительного давления отбора получены для CENH3, тогда как для других видов (злаки, млекопитающие) для СЕNР-С (рис.4,а). В итоге такие центромеры с усовершенствованным кинетохором становятся “сильнее” и могут присоединять большее число микротрубочек веретена деления (рис.4,б). Если таких “сильных” центромер оказывается в гаметах больше, то происходит процесс мейотического драйва, который увеличивает количество таких центромер, и новый вариант фиксируется в популяции.
Рис. 4. Модель, объясняющая эволюцию центромер.
Вверху - центромеры (серые овалы) содержат специализированный набор белков (кинетохор), включающий гистоны CENH3 (H) и CENP-C (C), которые в свою очередь взаимодействуют с микротрубочками веретена деления (красные линии). В различных таксонах один из этих белков эволюционирует адаптивно и согласованно с дивергенцией первичной структуры ДНК центромер.Внизу - изменения в первичной структуре или организации центромерной ДНК (темно-серый овал) может создавать более сильные центромеры, что выражается в большем количестве присоединяемых микротрубочек.
Понять механизмы формирования и активности центромерных районов хромосом помогает сравнительная геномика. Уникальный пример разнообразной структуры центромер - хромосома 8 в геноме риса. В ней наряду с сателлитным повтором ДНК и ретротранспозонами обнаружены активно транскрибируемые гены; 48 из них имели последовательности с высокой гомологией к известным белкам [3]. Эти находки опровергают сложившееся на основе изучения центромер человека, дрозофилы и арабидопсиса мнение, что в центромерах нет активно работающих генов.
Если в молекулярной структуре центромер различных видов эукариот присутствуют некоторые универсальные характеристики (организация ДНК в виде тандемных, относительно коротких мономеров и специфические для данных локусов белки хроматина), то в размерах этих районов трудно выявить какие-либо закономерности. Так, у дрожжей Saccharomyces cerevisiae за минимальную функциональную центромеру принимают участок ДНК в 125 нп, а у дрожжей Schizosaccharomyces pombe она значительно сложнее и длиннее (от 40 до 120 тыс. нп), имеет несколько уровней организации. У человека основной компонент центромер хромосом - a -сателлитная ДНК - образует длинные тяжи тандемно организованных мономеров (от 250 тыс. до 4 млн нп). Среди 12 хромосом риса в хромосоме 8 длина тяжа с сателлитом CentO наименьшая (~64 тыс. нп); в ней определили позицию центромеры и ее примерный размер в 2 млн нп [3]. Удалось получить полную последовательность ДНК этого центромерного района и внутри него определить участок (~750 тыс. нп), где непосредственно формируется кинетохор. В этом районе находится основной кластер CentO.
Удивительная пластичность центромер, в частности активно работающие гены, обнаруженные в центромере хромосомы 8 риса, предполагает отсутствие строгой границы между центромерой и остальной частью хромосомы и даже возможность рассеянной структуры центромерного хроматина. Однако против существования нескольких кластеров в районе хромосомной перетяжки говорят недавно опубликованные данные о наличии хроматинового барьера между собственно центромерой и прицентромерным гетерохроматином у дрожжей Schizosaccharomyces pombe [4]. Барьер представляет собой ген тРНК аланина. Делеция или модификация барьерной последовательности ведет к выходу прицентромерного гетерохроматина за свои обычные границы. Более того, отсутствие барьера вызывает ненормальное расхождение хромосом в мейозе. Безусловно, следует помнить, что эти интереснейшие результаты касаются пока только одного вида дрожжей.
Термин “теломера” предложил Г.Мёллер еще в 1932 г. [5]. В его представлении она означала не только физический конец хромосомы, но и присутствие “терминального гена со специальной функцией запечатывания (пломбирования) хромосомы”, которое делало ее недоступной для вредных воздействий (хромосомных перестроек, делеций, действия нуклеаз и т.д.). Наличие терминального гена не подтвердилось в последующих исследованиях, однако функция теломеры была определена точно.
Позднее выявили еще одну функцию. Так как на концах хромосом обычный механизм репликации не работает, в клетке есть другой путь, поддерживающий стабильные размеры хромосом при клеточном делении. Эту роль выполняет специальный фермент, теломераза, которая действует подобно другому ферменту, обратной транскриптазе: использует одноцепочечную РНК-матрицу для синтеза второй цепи и восстановления концов хромосом. Таким образом, теломеры во всех организмах выполняют две важные задачи: защищают концы хромосом и поддерживают их длину и целостность.
Первые работы по определению природы ДНК теломер выявили тандемную организацию коротких мономеров у широкого спектра организмов (простейших, грибов, насекомых, растений и млекопитающих [6]), что вполне соответствовало универсальному характеру функций теломеры. Еще одна консервативная особенность теломерной ДНК - наличие относительно короткого одноцепочечного “хвоста”, состоящего из G-остатков с ориентацией 5’-3’ G-богатой цепи вперед к концу хромосомы. Считают, что такой выступ обеспечивает связывание теломер-специфических белков, образующих “колпак” (cap) для защиты конца хромосомы.
Однако по мере расширения изучаемых видов оказалось, что существуют альтернативные пути удлинения концов хромосом и их защита не зависит от короткого канонического повтора. Например, у Drosophila melanogaster ДНК теломер состоят из тандемных тяжей, образовавшихся в результате последовательных транспозиций ретротранспозонов, а одноцепочечных G-выступов пока не обнаружено. Несмотря на столь существенные различия в природе ДНК двух типов теломер, они имеют много общего. Например, и те, и другие поддерживают свою длину с помощью обратной транскрипции с РНК-матрицы и могут использовать для этой цели рекомбинацию (обмен генетическим материалом).
Список организмов, теломеры которых не имеют консенсусной последовательности, продолжает расширяться и сегодня включает некоторые виды из четырех отрядов насекомых: Diptera, Coleoptera, Heteroptera и Dermaptera . У комаров ( Diptera ) отмечен третий тип теломер: их ДНК представлена длинным тяжем регулярного тандемного повтора длиной 340 нп. Вероятно, здесь размеры поддерживаются подобно уже описанному механизму для первых двух типов, т.е. регенерация сложных повторов может происходить с помощью рекомбинации или опять-таки обратной транскрипцией РНК, продуцируемой с теломеры. Среди растений также описаны виды родов луковых и алое, не имеющих консенсусного теломерного повтора, TTTAGGG. Таким образом, подобно рассмотренным выше центромерам, теломеры выполняют исключительно важные и консервативные функции и имеют удивительно пластичную структурную организацию ДНК.
Согласно многим исследованиям, размер теломеры может колебаться при стрессовых воздействиях, укорачиваться при старении и онкогенезе. Вместе с тем другие работы демонстрируют относительное постоянство размеров теломеры у каждого конкретного вида, что указывает на функционирование регуляторного механизма, контролирующего теломеразу так, чтобы ее активность ограничивалась только компенсацией репликационных потерь теломерной ДНК. Следует отметить, что все приведенные количественные оценки носят относительный характер. Несмотря на это, можно определенно утверждать, что размеры теломер и центромер как среди различных видов эукариот, даже эволюционно близких, так и между различными хромосомами одного кариотипа характеризуются высокой гетерогенностью. В связи с этим возникает вопрос, а существует ли четкая, обусловленная различиями в молекулярной структуре граница, отделяющая эти районы от остальной хромосомы?
Анализ имеющихся данных показывает, что в случае теломер о существовании такой границы говорить трудно, если вообще возможно. Неясно, что считать настоящей (истинной) теломерой. Наиболее популярная точка зрения рассматривает в качестве теломеры весь тяж последовательности ДНК теломерного повтора вместе с многочисленными белками, связывающимися как с одно-, так и с двухцепочечной ДНК. Однако у многих видов эукариот (особенно если геномы большого размера) переход между тяжом теломерного повтора и субтеломерой характеризуется появлением мономеров с вырожденной структурой классического повтора и заканчивается копиями дегенеративных повторов с более чем одной нуклеотидной заменой. Более того, сам тяж теломерного повтора представляет собой отнюдь не такую гомогенную структуру, как было принято думать.
Мы с помощью флуоресцентной in situ гибридизации теломерного повтора на фибриллах ДНК показали, что наряду с гомогенными флуоресцирующими треками сигнала гибридизации присутствуют треки с разрывами, в которых, вероятно, помимо теломерного повтора находятся другие типы последовательностей ДНК (рис.5). Мы также обнаружили фибриллы с рассеянными одиночными сигналами теломерного повтора. Таким образом, теломерные повторы не всегда организованы как монотонные гомогенные тяжи мономеров. Они могут прерываться другими последовательностями ДНК и рассеиваться в виде коротких кластеров. Такая гетерогенная организация может приводить к завышенным количественным оценкам длины теломер и, кроме того, к неадекватной оценке участия соседних последовательностей в вариации размеров теломер.
Рис. 5. Гибридизация пробы ДНК на растянутых фибриллах ржи.
Различные типы организации теломерного повтора: монотонные треки ( вверху )
и треки с разрывами (спейсерами) различных размеров ( в середине и внизу ).
Теломерные повторы могут располагаться вдоль плеч в интерстициальных и даже в прицентромерных районах хромосом, но сами по себе не образуют функциональную теломеру. Вполне логично думать, что для ее формирования необходимы специализированные белки, обволакивающие теломерную ДНК и защищающие концы хромосомы от нежелательных воздействий. Теломерную ДНК можно рассматривать как платформу для сборки больших комплексов белков, ключевой среди которых - комплекс теломеразы. Кроме того, в реализации ее функций участвуют другие системы: ДНК-белковый комплекс, формирующийся на одноцепочечном G-выступе, и белковые комплексы на двухцепочечной ДНК теломерного повтора. Некоторые белки специфически локализованы на теломерах, но основная их часть присутствует и в других участках хромосом.
Предложена модель белкового комплекса из шести теломер-специфических белков, формирующегося на теломерах хромосом человека [7]. ДНК образует t-петлю, а одноцепочечный выступ внедряется в двухцепочечный участок ДНК, расположенный дистально (рис.6). Белковый комплекс позволяет клеткам отличать теломеры от мест разрыва хромосом (ДНК). Не все белки теломер входят в состав комплекса, который избыточен на теломерах, но отсутствует в других районах хромосом. Защитные свойства комплекса вытекают из его способности воздействовать на структуру теломерной ДНК по крайней мере тремя способами: определять структуру самого кончика теломеры; участвовать в образовании t-петли; контролировать синтез теломерной ДНК теломеразой. Родственные комплексы найдены и на теломерах некоторых других видов эукариот.
Рис. 6. Модель образования t-петлевой структуры на конце хромосомы.
Вверху - теломера в момент репликации хромосомы, когда ее конец доступен для комплекса теломеразы, который осуществляет репликацию (удвоение цепи ДНК на самом кончике хромосомы). После репликации теломерная ДНК (черные линии) вместе с находящимися на ней белками (показаны разноцветными овалами) образует t-петлю ( нижняя часть рисунка ).
Итак, у подавляющего большинства организмов основной тип последовательностей ДНК в центромерных и теломерных районах - это тандемно организованные мономеры короткой длины. Очевидно, что столь короткие последовательности (особенно в теломерах) обладают крайне ограниченной кодирующей способностью в первичной структуре и не соответствуют концепции Мёллера о терминальном гене [5].
В последние годы стало очевидным, что универсальных последовательностей ДНК, непосредственно определяющих функции центромер и теломер, нет. В этих районах хромосом ДНК служит платформой для сборки сложных, многокомпонентных ДНК-белковых комплексов, которые и обеспечивают выполнение этих функций. Более подробно о комплементарной организации этих комплексов и их координированного функционирования можно прочитать в нашем обзоре [2]. Наряду со специфическими для центромер и теломер компонентами этих комплексов в их состав входят и такие, которые участвуют в выполнении нескольких функций, иногда даже противоположных. Например, Ku70/80-гетеродимер входит в состав теломер и работает как позитивный регулятор длины теломер у дрожжей и негативный регулятор - у растения арабидопсис. В тоже время этот белок участвует в распознавании разрывов хромосом и их восстановлении. Без сомнения, одно из наиболее актуальных направлений исследований - выявление молекулярной природы механизмов регуляции разнообразных молекулярных комплексов, обеспечивающих активность центромер и теломер.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 04-04-48813), INTAS (03-51-5908)
и Программы интеграционных проектов СО РАН (проект 45/2).
1. Talbert P.B., Bryson T.D., Henikoff S. // J. Biol. 2004. V.3. Article 18.
2. Вершинин А.В. // Генетика. 2006. V.42. P.1200-1214.
3. Wu J., Yamagata H., Hayashi-Tsugane M. et al. // Plant Cell. 2004. V.16. P.967-976.
4. Scott K.C., Merrett S.L., Willard H.F. // Curr. Biol. 2006. V.16. P.119-129.
5. Muller H.J. Further studies on the nature and causes of gene mutations // Proc. Sixth Int. Congr. Genet. 1932. V.1. P.213-255.
Функции ДНК центромер Saccharomyces cerevisiae
Функции ДНК центромер Saccharomyces cerevisiae
• В S. cerevisiae идентифицированы CE/V-элементы по способности плазмиды к сегрегации в митозе
• CE/V-элементы состоят из коротких консервативных последовательностей CDE-I и CDE-III, которые фланкируют регион CDE-II, обогащенный АТ-элементами
Если в сегрегации ДНК участвует центромерная последовательность, то любая молекула ДНК, обладающая такой последовательностью, при митозе должна мигрировать в нужном направлении. Если последовательность отсутствует, то ДНК не способна к сегрегации. Исходя из этого предположения, из дрожжей S. cerevisiae была выделена центромерная ДНК. В отличие от высших эукариот хромосомы дрожжей не содержат видимых кинетохоров, однако делятся при митозе и сегрегируют при мейозе по тому же механизму.
Можно получить плазмиды, которые содержат точку начала репликации и реплицируются подобно хромосомным последовательностям. Однако в митозе и мейозе они нестабильны, и из-за ошибочной сегрегации большинство клеток их выбрасывает. По способности обеспечивать таким плазмидам устойчивость в митозе были выделены фрагменты хромосомной ДНК, содержащей центромеры.
CE/V-фрагмент идентифицируется как последовательность минимального размера, которая при введении в плазмиду обеспечивает ее устойчивость. Еще один способ охарактеризовать функцию таких последовательностей состоит в их модификации in vitro и повторном введении в дрожжевые клетки, где они заменяют соответствующие центромеры хромосомы.
Это позволяет ввести непосредственно в состав хромосомы последовательность, необходимую для функционирования СЕК Фрагмент CEN, полученный из одной хромосомы, может заменить центромеру в другой хромосоме, причем это не сопровождается какими-либо последствиями. Это позволяет предполагать, что центромеры взаимозаменяемы. Они функционируют только в качестве инструментов присоединения хромосом к веретену и не играют никакой роли в обеспечении различий между хромосомами.
Последовательность, необходимая для функционирования центромеры, составляет около 120 пн. Область центромеры устойчива к действию нуклеаз и способна связываться с одной микротрубочкой. Поэтому в центромерной области 5. cerevisiae мы можем обнаружить белки, которые связывают центромерную ДНК, и белки, присоединяющие хромосому к веретену.
В области фрагмента CEN различают три типа последовательностей:
• CDE-I — последовательность длиной 9 пн. Эта последовательность, незначительно варьируя по составу, присутствует на левой границе всех центромер.
• CDE-II — последовательность длиной 80-90 пн, более чем на 90% состоящая из АТ-блоков и обнаруженная во всех центромерах. Функции этой последовательности определяются длиной, а не нуклеотидным составом. По структуре она приближается к коротким тандемным повторам (сателлитным) ДНК.
• CDE-III последовательность длиной 11 пн, которая высококонсервативна и обнаруживается на правой границе всех центромер. Последовательности, расположенные по сторонам этого фрагмента, менее консервативны и, возможно, также необходимы для функционирования центромеры.
Мутации в CDE-I и в CDE-II приводят к частичной утрате функции центромеры, однако точечные мутации в центральной CCG области последовательности CDE-III полностью лишают центромеру ее функции.
Поиск гомологии между элементами CEN дрожжей позволил идентифицировать три консервативных последовательности.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биология и медицина
Исследования, проведенные на дрожжах S. cerevisiae в 1980-е годы, привели к первому клонированию и анализу эукариотной центромеры. Было показано, что структура размером 125 п.н., присутствующая на всех 16 хромосомах S. cerevisiae, необходима и достаточна для нормального функционирования центромеры ( Bloom et al., 1989 ); даже однонуклеотидные изменения в высококонсервативных элементах I и III приводили к полной утрате функции. Таким образом, идентичность и воспроизведение центромеры у этого одноклеточного эукариотического организма определяются нуклеотидной последовательностью ДНК.
Надежда на то, что аналогичные механизмы, базирующиеся на нуклеотидной последовательности, могли бы регулировать идентичность центромеры у других эукариот, впервые была развеяна исследованиями на другом "простом" эукариотическом организме, S. pombe . Центромерные последовательности у этих дробянковых дрожжей структурно более крупные и более сложные, чем у S. cerevisiae ( Clarke et al., 1986 ; Nakaseko et al., 1987 ). He гомологичные последовательности "центрального кора" длиной 4-5 т.п.н., являющиеся сайтами формирования кинетохора , фланкированы инвертированными повторами различных классов, общими для трех хромосом. Минимум 25 т.п.н., содержащие неповторяющийся центральный кор, внутренние повторы и часть внешних повторов, абсолютно необходимы для функционирования центромеры и стабильной передачи хромосом ( Baum et al., 1994 ). Достаточная центромерная функция наблюдается для трансфицированных плазмидных конструктов, несущих центральный кор плюс внутренние повторы (т.е. центральный домен) и два фланкирующих внешних повтора. Интересно, что делеция внутренних повторов нарушает расхождение сестринских хроматид в мейозе, демонстрируя тем самым, что центромерные районы играют роль в процессах, отличающихся от сборки кинетохора. Действительно, и кинетохор, и домены когезии тесно сцеплены и важны для правильного расхождения хромосом.
Хотя центромерные районы у многоклеточных эукариот даже больше и более сложные, чем у S. pombe (сотни или тысячи тысяч пар оснований повторяющихся ДНК), общая организация и функционирование центромер дробянковых дрожжей послужили превосходной моделью центромер у млекопитающих, растений и насекомых. Центромеры у этих организмов заключены в крупные гетерохроматиновые блоки, присутствующие на каждой хромосоме, которые преимущественно состоят из сателлитных ДНК (простые, короткие повторы) и транспозонов. Эти центромерные районы составлены из субдоменов, отвечающих за различные функции, прежде всего за формирование кинетохора и сестринскую когезию. Центромерные последовательности, однако, не консервативны у эукариот или даже у разных хромосом отдельного вида. Именно эпигенетический состав функциональных субдоменов центромеры демонстрирует консерватизм, особенно по составу гистоновых вариантов и паттернам модификаций гистонов, которые, по-видимому, регулируются эпигенетически.
У нематоды С. elegans и у других видов голоцентрические хромосомы рекрутируют и собирают центромерные белки по всей длине хромосомы ( Dernburg, 2001 ). Специфические для червя последовательности не являются, очевидно, необходимыми, поскольку конкатемеры лямбда и ДНК многих других типов стабильно передаются. Белки рекрутируются "пакетами" ["bundles"] в профазе, но к метафазе распределяются ровным слоем на обращенной к полюсу поверхности хромосомных плеч, заставляя предполагать, что многие области генома С. elegans могут поддерживать сборку кинетохора в эпигенетическом режиме. Несмотря на очевидные различия с моноцентрическими хромосомами, возможно, что организационные и структурные атрибуты, такие как ЗD-спирализация или выпетливание ДНК CEN , являются консервативными (подробно далее в разделе " Необычный состав центромерного хроматина ").
Центромера
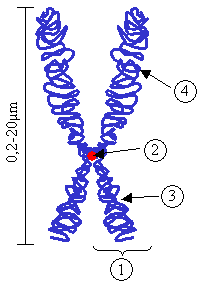
Хромосома.
(1) Хроматида . Каждая из них образована цепочкой родительской ДНК и цепочкой вновь образованной ДНК, полученной после репликации во время S-фазы; (2) Центромера. Точка контакта двух хроматид и точка разделения во время митоза; (3) короткое плечо; (4) Длинная рука
Центромеры является областью контакта двух хроматидов хромосомы.
Резюме
Типология
Есть два типа центромер.
Центромеры моноцентрических хромосом - это «региональные» центромеры, занимающие определенную область внутри хромосомы. Обычно они видны как сужение метафазной хромосомы. Размер этой области варьирует между видами, от 125 п.н. у S. cerevisiae до нескольких мегабаз для центромер человека. Обычно существует только одна региональная центромера на хромосому (отсюда и термин «моноцентрический»), но хромосомные перестройки могут привести к образованию двух центромер на одной и той же хромосоме (это называется дицентрической хромосомой ).
Центромеры холоцентрических хромосом простираются на всю длину хромосом. Холоцентрические хромосомы, редко встречающиеся у обычно изучаемых видов (за исключением C. elegans ), никогда не наблюдаемые у позвоночных, широко распространены у простейших, некоторых типов беспозвоночных и некоторых растений.
Состав ДНК
У S. pombe центромеры имеют размер от ~ 35 т.п.н. на хромосоме I до 110 т.п.н. на хромосоме III. Каждая центромера состоит из центрального домена, окруженного двумя внешними доменами. Центральный домен сам по себе состоит из центрального 4 до 7 кб CNT элемента из не-ДНК повторяется, в окружении двух инвертированных повторяющихся ДНК элементов, то IMR элементов ( сокровенные повторов ). Последовательность всех элементов центрального домена, cnt и imr , уникальна на каждой хромосоме, только организация центрального домена сохраняется от одной хромосомы к другой. Внешние домены, otr для внешних повторов , по существу состоят из переменного числа копий двух повторяющихся элементов ДНК, dg и dh .
У многоклеточных животных центромерная ДНК по существу состоит из различных форм повторяющейся ДНК, которая может охватывать несколько мегабаз. Этот состав представляет собой препятствие для их детального анализа, так как секвенирование и сборка длинных участков повторяющейся ДНК затруднены. У дрозофилы, например, единственная центромера, минихромосома Dp1187 , была изучена в масштабе нуклеотидной последовательности. Он охватывает 420 т.п.н., разделенных на две области, состоящие из двух разных типов сателлитной ДНК, перемежающихся мобильными элементами .
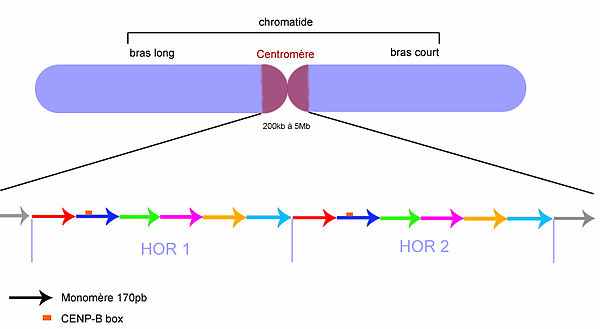
Организация центромерной ДНК.
Стрелки соответствуют мономерам. Цвета указывают на пробелы идентичности (полиморфизмы) последовательностей. HOR очень похожи, но мономеры внутри HOR очень разные.
Отсутствие консервативности центромерных ДНК привело к предположению, что функция центромеры и ее положение на хромосоме не определяется нуклеотидной последовательностью. За исключением S. cerevisiae , где вышеупомянутые элементы CDE достаточны для образования функциональной центромеры, центромерная ДНК у других эукариот не кажется ни необходимой, ни достаточной для поддержки функции центромеры: не обязательно, потому что функциональная центромера может образовывать на участках, не показывающих никакого сходства с центромерными последовательностями ( неоцентромеры ); этого недостаточно, поскольку простое присутствие последовательностей центромерного типа не приводит систематически к функциональной центромере. В настоящее время принято, что идентичность и функция центромеры определяются эпигенетически и зависят от специализированной структуры хроматина скорее, чем от лежащей в основе последовательности ДНК. В отличие от последовательности ДНК, хроматин, связанный с центромерами, демонстрирует относительно хорошо сохраненные характеристики у эукариот.
Центромерный хроматин
Хроматина в центромерах имеет особые характеристики , которые отличают обе эухроматином и гетерохроматина , поэтому мы можем квалифицировать как центромерная (иногда centrochromatine или, особенно на английском языке, хроматин ЕКС ).
Возможно, наиболее важной характеристикой, сохраненной у всех изученных эукариот, является присутствие белка CenH3 ( центромерного H3 ), варианта гистона H3, специфически и исключительно локализованного в центромерном хроматине. Этот гистон (также называемый Cse4p у S. cerevisiae , Cnp1p у S. pombe , CENP-A у большинства млекопитающих) позволяет формировать вариантную нуклеосому , точная структура которой еще не установлена, но во всех случаях достаточно отличается от этой обычной нуклеосомы для придания центромерному хроматину отличительных свойств.
Другими особенностями центромерного хроматина являются гипоацетилирование гистонов (свойство, часто связанное с гетерохроматином ) и диметилирование гистона H3 на лизине-4 (H3K4me2, метка, часто ассоциируемая с промоторными областями Генуи).
Центромерный хроматин обычно фланкирован с обеих сторон гетерохроматином , называемым перицентромерным или перицентрическим . Он несет типичные признаки гетерохроматина, в частности ди- и три-метилирование гистона H3 по лизину-9 (H3K9me2 / 3) и присутствие белка HP1. Он также обогащен вариантом H2A.Z, вариантом гистона H2A.
Основа кинетохоры
Основная функция центромеры - служить платформой для сборки кинетохор во время митоза . Центромерный белок хроматина CenH3 является одним из ключевых факторов в этой функции. Его отсутствие предотвращает образование кинетохор, а его избыточная экспрессия и эктопическая локализация приводят к плохой локализации по крайней мере части белков кинетохор.
CenH3 обеспечивает сборку кинетохоры через белки комплекса CCAN ( конститутивная сеть , связанная с центромерой, «сеть [белков], конститутивно связанная с центромерой»), которые распознают особую структуру нуклеосом, содержащих CenH3. CCAN представляет собой интерфейс между центромерным хроматином и внутренней кинетохорой и позволяет рекрутировать различные комплексы, составляющие кинетохору.
У человека CCAN можно разделить на два субкомплекса: комплекс CENP-A NAC ( комплекс , связанный с нуклеосомой CENP-A , «комплекс, связанный с нуклеосомой CENP-A»), который, как следует из названия, находится в непосредственном контакте с Нуклеосома CENP-A; и комплекс CENP-A CAD ( дистальный комплекс CENP-A ), который взаимодействует не напрямую с CENP-A, а с белками комплекса CENP-A NAC . У S. cerevisiae и S. pombe функциональными гомологами человеческого CCAN являются комплексы Ctf19 и Sim4 соответственно. Аналоги CCAN у других модельных эукариот пока не идентифицированы.
Читайте также:
- Лимфогенное метастазирование опухоли. Опухолевые маркеры
- Синдром фето-фетальной трансфузии. Диагностика и лечение синдрома фето-фетальной трансфузии.
- ЭхоКГ при врожденной корригированной транспозиции магистральных артерий
- Рентгенограмма, МРТ при остеонекрозе лучезапястного сустава
- Анатомия: Пояснично-крестцовое сплетение, plexus lumbosacralis. Поясничное сплетение, plexus lumbalis. Ветви поясничного сплетения.
