Функции глюкагона. Влияние глюкагона на гликогенолиз
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Глюкагон*- 29-членный одноцепочечный полипептид (мол. масса 3485), состоящий из 29 аминокислотных остатков. Он образуется в альфа-клетках островкового аппарата поджелудочной железы, а также в желудочно-кишечном тракте и выполняет важную роль прежде всего в регуляции углеводного обмена и жирового обмена.
В кишечнике наряду с глюкагоном есть ряд глюкагоноподобных веществ - энтероглюкагонов, близких по структуре и некоторым свойствам к глюкагону.
По некоторым иммунологическим и физиологическим свойствам глюкагон аналогичен энтероглюкагону - пептиду, экстрагированному из слизистой оболочки двенадцатиперстной кишки. Кроме того, 14 из 27 аминокислотных остатков глюкагона идентичны таковым в молекуле секретина.
Инсулин способствует запасанию энергии, стимулируя гликогенез, липогенез и синтез белка, то глюкагон, стимулируя гликогенолиз и липолиз, вызывает быструю мобилизацию источников потенциальной энергии с образованием глюкозы и жирных кислот соответственно.
Глюкагон: биосинтез и метаболизм
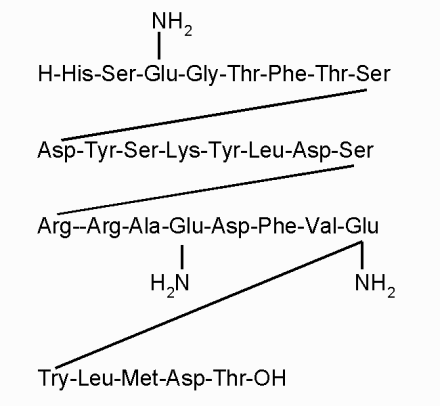
Глюкагон синтезируется в виде крупного предшественника - проглюкагона (мол. масса около 9 000). Обнаружены и более крупные молекулы, однако не ясно, являются ли они предшественниками глюкагона или близкородственными пептидами. Лишь 30-40% иммунореактивного "глюкагона" в плазме приходится на долю панкреатического глюкагона. Остальная часть - это более крупные молекулы, лишенные биологической активности.
В плазме глюкагон находится в свободной форме. Поскольку он не связывается с транспортным белком, период полужизни глюкагона мал (около 5 мин).
Инактивация этого гормона происходит в печени под действием фермента, который, расщепляя связь между Ser-2 и Gln- 3, удаляет с N-конца две аминокислоты. Печень - первый барьер на пути секретируемого глюкагона, и, поскольку она быстро инактивирует этот гормон, содержание его в крови воротной вены гораздо выше, чем в периферической крови.
Глюкагон: эффекты
Эффекты глюкагона, как правило, противоположны эффектам инсулина. Если инсулин способствует запасанию энергии, стимулируя гликогенез, липогенез и синтез белка, то глюкагон, стимулируя гликогенолиз и липолиз, вызывает быструю мобилизацию источников потенциальной энергии с образованием глюкозы и жирных кислот соответственно. Глюкагон - наиболее активный стимулятор глюконеогенеза; кроме того, он обладает и кетогенным действием.
Печень - основная мишень глюкагона. Связываясь со своими рецепторами на плазматической мембране гепатоцитов, глюкагон активирует аденилатциклазу. Генерируемый при этом сАМР в свою очередь активирует фосфорилазу, которая ускоряет распад гликогена, а одновременное ингибирование гликогенсинтетазы тормозит образование последнего. Для этого эффекта характерна и гормональная, и тканевая специфичность: глюкагон не влияет на гликогенолиз в мышце, а адреналин активен и в мышцах и в печени.
Повышенное содержание сАМР индуцирует ряд ферментов глюконеогенеза, стимулируя превращение аминокислот в глюкозу. Главная роль среди этих ферментов принадлежит ФЕПКК. Глюкагон опосредованно через сАМР повышает скорость транскрипции гена ФЕПКК, стимулируя тем самым синтез больших количеств ФЕПКК. Этот эффект противоположен действию инсулина, который подавляет транскрипцию гена ФЕПКК.
Суммарный эффект глюкагона в печени сводится к повышенному образованию глюкозы. Поскольку большая ее часть покидает печень, концентрация глюкозы в крови под влиянием глюкагона повышается.
Глюкагон - мощный липолитический агент. Повышая содержание сАМР в адипоцитах, он активирует гормон-чувствительную липазу. Образующиеся при этом в большом количестве жирные кислоты могут использоваться в качестве источников энергии или превращается в кетоновые тела (ацетоацетат и бета-гидроксимасляная кислота). Это важный аспект метаболизма при диабете, поскольку при инсулиновой недостаточности содержание глюкагона всегда повышено.
Функции глюкагона. Влияние глюкагона на гликогенолиз
Регуляция углеводного обмена
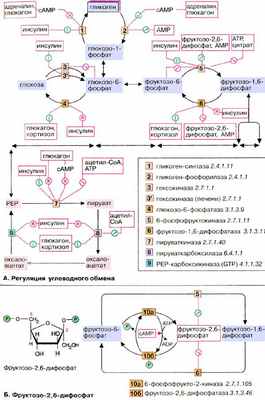
А. Регуляция углеводного обмена
У высших организмов обмен углеводов подвержен сложным механизмам регуляции, в которых участвуют гормоны, метаболиты и коферменты . Представленная здесь схема относится к печени , которая занимает в углеводном метаболизме центральное место (см. с. 302). Некоторые из представленных механизмов не действуют в других тканях.
Одной из важнейших функций клеток печени является накопление избыточной глюкозы в виде гликогена и ее быстрое высвобождение по мере метаболической необходимости (буферная функция) . После полной мобилизации запасов гликогена печень может поставлять глюкозу за счет синтеза de novo ( глюконеогенез , см. сс. 156, 232). Кроме того, как и все ткани, она потребляет глюкозу путем гликолиза. Функции накопления (синтеза) глюкозы в виде гликогена и его распада должны быть взаимосогласованы. Таким образом, совершенно невозможно одновременное протекание гликолиза и глюконеогенеза, как и синтеза и деградации гликогена. Согласование процессов обеспечивается тем, что синтез (анаболизм) и распад (катаболизм) катализируются двумя различными ферментами и контролируются независимо. На схеме показаны только эти ключевые ферменты .
Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин и глюкагон , глюкокортикоид кортизол и катехоламин адреналин (см. сс. 362, 368). Инсулин индуцирует (см. с. 120) синтез de novo гликоген-синтазы [ 1 ], а также некоторых ферментов гликолиза [ 3, 5, 7 ]. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза ( репрессия, [ 4, 6, 8, 9 ]). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза [ 4, 6, 8, 9 ] и репрессирует пируваткиназу [ 7 ], ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ (сАМР, см. с. 114). По этому механизму тормозится синтез гликогена [ 1 ] и активируется расщепление гликогена [ 2 ]. Подобным образом действует и адреналин. Торможение пируваткиназы [ 7 ] глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол (см. с. 362), индуцируют все ключевые ферменты глюконеогенеза [ 4, 6, 8, 9 ]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфо фруктокиназы. Кроме того, АТФ тормозит пируваткиназу . Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы ( торможение конечным продуктом ). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Важную роль в обмене веществ в печени играет фруктозо-2,6-дифосфат . Это сигнальное вещество образуется в незначительных количествах из фруктозо-6-фосфата и выполняет чисто регуляторную функцию: стимулирует гликолиз путем активации фосфофруктокиназы и подавляет глюконеогенез с помощью торможения фруктозо-1,5-дифосфатазы.
Образование и распад фруктозо-2,6-дифосфата катализируются одним и тем же белком [ 10а и б ]. В нефосфорилированной форме этот белок вызывает образование фруктозо-2,6-дифосфата [ 10а ]. После фосфорилирования цАМФ-зависимой киназой он действует как фосфатаза [ 10б ] и катализирует превращение фруктозо-2,6-дифосфата в фруктозо-6-фосфат. В присутствии адреналина и глюкагона в клетках печени повышается уровень цАМФ (см. с. 122), т.е. оба гормона воздействуют как на гликолиз, так и на глюконеогенез. Суммарным результатом является быстрое повышение уровня глюкозы в крови.
Функции глюкагона. Влияние глюкагона на гликогенолиз
Функции глюкагона. Влияние глюкагона на гликогенолиз
Глюкагон — гормон, секретируемый альфа-клетками островков Лангерганса при снижении уровня глюкозы в крови. Он выполняет функции, диаметрально противоположные функциям инсулина. Наиболее важная из них — увеличение уровня глюкозы в крови, т.е. действие, прямо противоположное влиянию инсулина.
Подобно инсулину глюкагон является крупным полипептидом. Его молекулярная масса — 3485, он состоит из цепочки из 29 аминокислот. Введение чистого глюкагона животным сопровождается выраженной гипергликемией. Инъекция 1 мкг/кг глюкагона способна увеличить концентрацию глюкозы в крови на 20 мг/дл крови (увеличение на 25%) в течение 20 мин. По этой причине глюкагон также называют гипергликемическим гормоном.
а) Влияние на метаболизм глюкозы. Главные влияния глюкагона на метаболизм глюкозы заключаются в:
(1) расщеплении гликогена печени (гликогенолиз);
(2) увеличении глюконеогенеза в печени.
Оба этих эффекта приводят к существенному увеличению глюкозы в других органах.
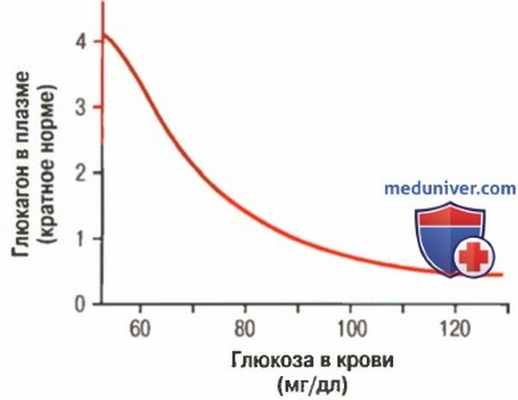
Приблизительная концентрация глюкагона при различных уровнях глюкозы в крови
б) Глюкагон вызывает гликогенолиз и увеличивает концентрацию глюкозы в крови. Наиболее мощный эффект глюкагона опосредован его способностью вызывать гликогенолиз в печени, увеличивая таким образом концентрацию глюкозы в крови в течение нескольких минут.
Это достигается комплексом последовательных событий.
1. Глюкагон активирует аденилатциклазу в мембране гепатоцитов.
2. Это приводит к образованию циклического аденозинмонофосфата.
3. цАМФ активирует белок-регулятор протеинкиназы.
4. Белок-регулятор протеинкиназы активирует протеинкиназу.
5. Это, в свою очередь, приводит к активации киназы фосфорилазы В.
6. Киназа фосфорилазы В превращает фосфорилазу в фосфорилазу А.
7. Это обеспечивает расщепление гликогена и появление глюкозо-1-фосфата.
8. Глюкозо-1-фосфат дефосфорилируется, затем глюкоза выделяется из клеток печени.
Эта последовательность событий чрезвычайно важна по нескольким причинам: во-первых, это один из наиболее тщательно изученных процессов, где циклический аденозинмонофосфат функционирует как вторичный посредник; во-вторых, это демонстрация каскадной системы, в которой каждый последующий продукт производится в большем количестве, чем предшествующий, поэтому данный процесс дает представление о возможностях механизма биологического усиления. Такой тип механизма усиления используется повсеместно в организме для управления многими, если не большинством клеточных метаболических систем, т.к. часто усиливающий эффект этого механизма возрастает в миллион раз. Это объясняет способность всего нескольких микрограмм глюкагона буквально за несколько минут обеспечить увеличение концентрации глюкозы в крови в 2 раза по сравнению с исходным уровнем.
Инъекция глюкагона всего через 4 ч может вызвать столь интенсивный гликогенолиз, что это приведет к опустошению депо гликогена в печени.
Видео физиология гормонов поджелудочной железы и регуляции уровня глюкозы - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Воздействие глюкагона на организм
Глюкагон, секретируемый б-клетками островков Лангерганса, вначале попадает в межклеточное пространство и интерстициальную жидкость, а затем с током крови через портальную вену - в печень, где он увеличивает гликогенолиз, снижает утилизацию глюкозы и синтез гликогена, повышает глюконеогенез и образование кетоновых тел. Суммарным эффектом этих воздействий является увеличение образования и выхода глюкозы из печени. В периферических тканях глюкагон оказывает липолитическое действие, повышая липолиз, снижая дипогенез и белковый синтез. Липолиз активируется гормон-чувствительной липазой.
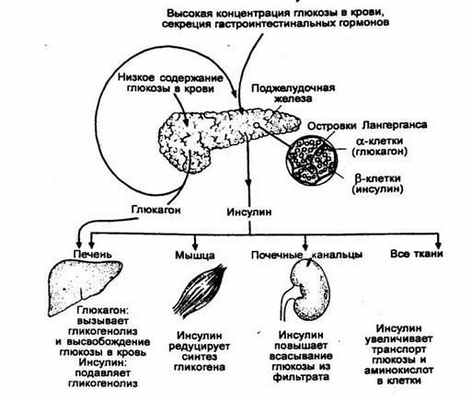
Глюкагон, как было сказано, обладает гликогенолитическим и глюконеогеническим свойствами. В связи с этим его основная роль в организме заключается в регулировании образования и выхода глюкозы из печени в целях поддержания гомеостаза глюкозы и крови для адекватного снабжения тканей ЦНС, которые используют её в качестве энергетического материала со скоростью 4 г/ч. б-клетки, так же как и в-клетки, чувствительны к минимальным изменениям уровня глюкозы в крови и во внеклеточном пространстве; соответственно в зависимости от этого изменяется скорость секреции инсулина или глюкагона. Эти взаимоотношения представлены на рис.
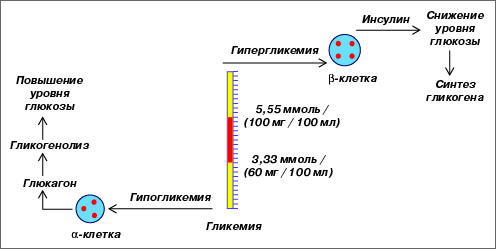
Рис. Участие инсулина и глюкагона в гомеостазе глюкозы
Таким образом, уровень глюкозы в крови в основном поддерживается секрецией инсулина и глюкагона. В период голодания или ограничения приема углеводов уже через 40-48 ч содержание глюкагона в крови возрастает на 50-100% по сравнению с его концентрацией натощак. Эти изменения в секреции глюкагона сопровождаются уменьшением концентрации в крови инсулина, в связи с чем соотношение уровней инсулина и глюкагона снижается до 0,4 (в нормальных условиях - 3,0). Увеличение образования глюкагона приводит к повышению гликогенолиза, а также глюконеогенеза и уменьшению запасов гликогена. Снижение секреции инсулина стимулирует липолиз, а повышенная секреция глюкагона необходима для конверсии свободных жирных клеток в кетоновые тела. В нормальном состоянии при адекватной функции a- и b-клеток гипогликемия не развивается даже при длительном голодании.
Помимо влияния на углеводный обмен, глюкагон стимулирует кетогенез в печени, скорость которого зависит от поступления свободных жирных кислот в печень. Скорость кетогенеза печени определяется соотношением глюкагон/инсулин в крови, поступающей в печень. J. D. McGarry и D. W. Foster установили, что высокое соотношение глюкагон/инсулин повышает внутриклеточный уровень цАМФ, уменьшает гликогенолиз и активность ацетил-СоА карбоксилазы. Это снижает внутриклеточное содержание малонил-СоА, что сопровождается в свою очередь почти полной блокадой синтеза жирных кислот, вызывает угнетение карнитинацилтрансферазы и последующую стимуляцию липолиза с избыточным образованием кетоновых тел (ацетоацетата и 3-гидроксимасляной кислоты). G. Paolisso и соавт. в исследованиях на человеке показали, что пульсирующее введение глюкагона (а не его введение с постоянной скоростью) оказывает более выраженное гипергликемическое, липолитическое действие и влияние на скорость кетогенеза. Кроме того, это действие более выражено проявляется в условиях инсулиновой недостаточности, вызванной соматостатином. У пожилых лиц четко выявляется уменьшение липолитического и кетогенного действия глюкагона, тогда как гипергликемический эффект глюкагона у них остается интактным. Недавние исследования М. G. Carlson, выполненные на добровольцах, четко подтвердили, что умеренная гиперглюкагонемия стимулирует скорость повышения в плазме крови СЖК и глицерина. В эксперименте при условии блокады или угнетения образования глюкагона скорость образования глюкозы и кетоновых тел печенью остается в норме или близкой к норме, несмотря на тотальное отсутствие инсулина. Эти наблюдения позволяют считать, что при сахарном диабете типа 1 необходимо хотя бы временно перевести инсулинозависимое состояние в инсулиннезависимое.
Таким образом, глюкагон в организме выполняет в первую очередь функцию обеспечения источниками энергии, защищая, таким образом, организм от гипогликемии. Эту функцию он осуществляет путем влияния на углеводный, белковый и жировой обмен. В печени он стимулирует образование глюкозы как из гликогена (гликогенолиз), так и из аминокислот (глюконеогенез), что сопровождается увеличением продукции глюкозы печенью. Увеличивая липолиз жира, он способствует увеличению поступления СЖК в печень и повышению образования кетоновых тел. Среди всех контринсулиновых гормонов глюкагону принадлежит первое место. Помимо защитной функции от возможной гипогликемии, глюкагон также восстанавливает нормогликемию при уже развившейся гипогликемии.
Помимо поддержания энергетического гомеостаза, глюкагон умеренно снижает уровень холестерина и триглицеридов в сыворотке крови, а также стимулирует высвобождение инсулина. Вместе с инсулином он участвует в процессах регенерации печени. Вот почему предложенное в свое время оперативное лечение сахарного диабета в виде проведения хирургического вмешательства, направленного на изменение оттока венозной крови от поджелудочной железы, при котором панкреатическая вена, в нормальных условиях впадающая в портальную систему печени, трансплантировалась в нижнюю полую вену (операция депортализация), не может считаться физиологическим и вызывает значительные изменения функции печени, практически не приводя к улучшению течения диабета и не позволяя отказаться от заместительной терапии инсулином. Операция депортализация была предложена для лечения сахарного диабета 1 типа, исходя из бигормональной теории сахарного диабета, в соответствии с которой развитие сахарного диабета 1 типа считалось следствием относительной гиперглюкагонемии. Для ликвидации гиперглюкагонемии, которая почти постоянно встречается при сахарном диабете и лишь отражает степень декомпенсации углеводного обмена, и была предложена депортализация, при которой глюкагон, избыточно образующийся в этом случае, поступает в большой круг кровообращения и отводится от печени в целях предотвращения его гипергликемического действия. В результате такой операции уровень глюкагона в крови почти не изменяется. Это связано с тем, что, как показал J. Bringer, после панкреатэктомии, проведенной по поводу различных заболеваний поджелудочной железы, уровень глюкагона в сыворотке крови больных изменяется незначительно в связи с активированием вне-панкреатической секреции глюкагона. В условиях депортализации ослабляется или прерывается гепатотропное действие глюкагона, имеющее большое значение для сохранения нормальной функции печени.
Глюкагон увеличивает почечный кровоток и скорость клубочковой фильтрации, способствует экскреции различных ионов, в первую очередь натрия. Глюкагон обладает спазмолитическими свойствами и может быть использован при почечной и печеночной коликах, спастическом колите в случае необходимости проведения рентгенографии кишечника. Он также оказывает положительное инотропное и хронотропное действие на сердце, что позволяет рекомендовать его для лечения кардиодепрессивных состояний, наблюдаемых при передозировке b-блокаторов. Описан положительный эффект глюкагона, применяемого для купирования тяжелых приступов стенокардии.
Физиологическое значение глюкагона изучено явно недостаточно, так же как и возможности его клинического использования. Так, например, сообщалось о благоприятном действии глюкагона при сердечной недостаточности и о снижении гиперлипидемии под его влиянием.
Глюкагон оказывает сильное инотропное и хронотропное действие на миокард вследствие увеличения образования цАМФ (то есть оказывает действие, подобное действию агонистов в-адренорецепторов, но без вовлечения в-адренергических систем в реализацию этого эффекта). Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений.
В высоких концентрациях глюкагон вызывает сильное спазмолитическое действие, расслабление гладкой мускулатуры внутренних органов, в особенности кишечника, не опосредованное аденилатциклазой.
Глюкагон участвует в реализации реакций типа «бей или беги», повышая доступность энергетических субстратов (в частности, глюкозы, свободных жирных кислот, кетокислот) для скелетных мышц и усиливая кровоснабжение скелетных мышц за счёт усиления работы сердца. Кроме того, глюкагон повышает секрецию катехоламинов мозговым веществом надпочечников и повышает чувствительность тканей к катехоламинам, что также благоприятствует реализации реакций типа «бей или беги».
Разрушается глюкагон в печени и почках. Ферментная система, разрушающая глюкагон, по данным одних авторов, отличается от глутатионинсулинтрансгидрогеназы, по данным других - инсулинспецифическая протеаза принимает участие в разрушении как инсулина, так и глюкагона. Около 0,5 мг/сут глюкагона, секретируемого в-клетками, выделяется желчью.
Синтез и распад гликогена реципрокны
Метаболизм гликогена в печени, мышцах и других клетках регулируется несколькими гормонами, одни из которых активируют синтез гликогена, а другие – распад гликогена. При этом в одной клетке не могут идти одновременно синтез и распад гликогена – это противоположные процессы с совершенно с разными задачами. Синтез и распад исключают друг друга или, по-другому, они реципрокны .
Активность ключевых ферментов метаболизма гликогена гликогенфосфорилазы и гликогенсинтазы изменяется в зависимости наличия в составе фермента фосфорной кислоты – они активны либо в фосфорилированной, либо в дефосфорилированной форме.
Присоединение фосфатов к ферменту производят протеинкиназы , источником фосфата является АТФ:
- фосфорилаза гликогена активируется после присоединения фосфатной группы,
- синтаза гликогена после присоединения фосфата инактивируется.
Скорость фосфорилирования указанных ферментов повышается после воздействия на клетку адреналина, глюкагона и некоторых других гормонов. В результате адреналин и глюкагон вызывают гликогенолиз , активируя фосфорилазу гликогена.
- во время мышечной работы адреналин вызывает фосфорилирование ферментов обмена гликогена в мышцах и в печени. В результате фосфорилаза гликогена активируется, синтаза инактивируется. В мышце и печени происходит распад гликогена, образуется глюкоза для обеспечения энергией мышечного сокращения.
- при голодании в ответ на снижение глюкозы крови из поджелудочной железы секретируется глюкагон. Он воздействует на гепатоциты и вызывает фосфорилирование ферментов обмена гликогена, что приводит к гликогенолизу и повышению глюкозы в крови.
Изменение активности ферментов обмена гликогена в зависимости от условий
Способы активации синтазы гликогена
Аллостерическая активация гликогенсинтазы осуществляется глюкозо-6-фосфатом.
Еще одним способом изменения ее активности является химическая (ковалентная) модификация. При присоединении фосфата гликогенсинтаза прекращает работу, т.е. она активна в дефосфорилированном виде. Удаление фосфата от ферментов осуществляют протеинфосфатазы , которые активируются при действии на клетку инсулина – в результате он повышает синтез гликогена.
Вместе с этим, инсулин и глюкокортикоиды ускоряют синтез гликогена, увеличивая количество молекул гликогенсинтазы.
Способы активации фосфорилазы гликогена
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами:
- ковалентная модификация,
- кальций-зависимая активация,
- аллостерическая активация с помощью АМФ.
Ковалентная модификация фосфорилазы
При действии некоторых гормонов на клетку происходит активация фермента через аденилатциклазный механизм, который является так называемым каскадным регулированием. Последовательность событий в данном механизме включает:
- Молекула гормона (адреналин, глюкагон) взаимодействует со своим рецептором;
- Активный гормон-рецепторный комплекс воздействует на мембранный G-белок;
- G-белок активирует фермент аденилатциклазу;
- Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер);
- цАМФ аллостерически активирует фермент протеинкиназу А;
- Протеинкиназа А фосфорилирует различные внутриклеточные белки:
- одним из этих белков является синтаза гликогена , ее активность угнетается,
- другим белком – киназа фосфорилазы , которая при фосфорилировании активируется;
- Киназа фосфорилазы фосфорилирует фосфорилазу "b" гликогена, последняя в результате превращается в активную фосфорилазу "а";
- Активная фосфорилаза "а" гликогена расщепляет α-1,4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Аденилатциклазный способ активации фосфорилазы гликогена
Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные способы регуляции этого механизма. Например, после воздействия инсулина активируется фермент фосфодиэстераза, которая гидролизует цАМФ, прерывает каскад активации ферментов и, следовательно, снижает активность гликоген-фосфорилазы.
Кальций-зависимая активация
Некоторые гормоны влияют на углеводный обмен посредством кальций-фосфолипидного механизма. Активация ионами кальция заключается в активации киназы фосфорилазы не протеинкиназой, а ионами Ca 2+ и кальмодулином . Этот путь работает при инициации кальций-фосфолипидного механизма. Такой способ оправдывает себя, например, при мышечной нагрузке, если гормональные влияния через аденилатциклазу недостаточны, но в цитоплазму под влиянием нервных импульсов поступают ионы Ca 2+ .
Суммарная схема способов активации фосфорилазы
Аллостерическая (метаболическая) активация
Также существует активация гликогенолиза с помощью АМФ – такая аллостерическая активация происходит благодаря присоединению АМФ к молекуле фосфорилазы "b".
Молекулы АМФ, стимулирующие гликогенолиз, образуются в реакции фермента аденилаткиназы, активируемой при снижении количества АТФ и накоплении АДФ. Особенно ярко значение такой регуляции проявляется при интенсивной мышечной работе:
Читайте также:
