Функция и репликация теломер хромосом
Добавил пользователь Skiper Обновлено: 07.01.2026
В октябре 2009 года в Стокгольме были объявлены имена лауреатов Нобелевской премии по физиологии и медицине: Элизабет Блэкбёрн, Кэрол Грейдер и Джек Шостак. Эти американские учёные удостоились самой престижной научной награды за «открытие того, как теломеры и фермент теломераза защищают хромосомы»: проведенные ими исследования позволили не только определить, чем обусловлена продолжительность жизни клеток, но и объяснить некоторые особенности их злокачественного перерождения, что, по мнению ученых, в будущем поможет создать эффективные лекарства от неизлечимых болезней. «Полит.ру» публикует статью кандидатов химических наук Марии Зверевой и Марии Рубцовой, в которой речь пойдет о том, что такое теломеры, из чего состоит теломераза, а также какова связь между ними и продолжительностью человеческой жизни. Материал опубликован в журнале «Наука и жизнь» (2010. № 1).
ХРОМОСОМЫ НУЖДАЮТСЯ В ЗАЩИТЕ
Генетическая информация хранится в ядрах клеток в виде дезоксирибонуклеиновой кислоты (ДНК), которая плотно упакована в линейные хромосомы. В середине 1970-х годов Джек Шостак в своей лаборатории в Медицинской школе Гарварда провёл эксперимент. Он добавил в дрожжевые клетки фрагменты чужеродных молекул ДНК и обнаружил, что они не могут долго оставаться в клетке в исходном виде и встраиваются в хромосомы. Так выяснилось, что обломки хромосом нестабильны: они постоянно обмениваются участками с другими хромосомами, перестраиваются, в их нуклеотидных цепочках образуются разрывы, в то время как сами хромосомы остаются в неизменном виде. К счастью, клетки обладают функцией репарации — в них имеется система молекулярной «починки» случайных разрывов в хромосомных цепочках.

Всё же оставалось неясным, почему ДНК в составе хромосом стабильна, а обломки без концевых последовательностей подвержены перестройкам. Исследования Пауля Германа Мюллера (лауреат Нобелевской премии по физиологии и медицине 1946 года) и Барбары Мак-Клинток (лауреат Нобелевской премии по физиологии и медицине 1983 года) в начале 1940-х годов показали, что концевые участки защищают хромосомы от перестроек и разрывов. Мюллер назвал эти особые участки теломерами — от двух греческих слов: telos — конец и meros — участок. Но что представляют собой эти участки и какую функцию они выполняют в клетке, учёные тогда ещё не знали.
ТЕЛОМЕРЫ СТАБИЛИЗИРУЮТ ХРОМОСОМЫ
В 1975 году Элизабет Блэкбёрн в лаборатории Джозефа Гала в Йельском университете, изучая внехромосомные молекулы ДНК инфузории, обнаружила, что концевые участки этих молекул содержат тандемные повторяющиеся последовательности, состоящие из шести нуклеотидов: на каждом конце таких повторов было от 20 до 70.

В дальнейших экспериментах Блэкбёрн и Шостак добавили в дрожжи молекулы ДНК с присоединёнными к ним повторами из инфузории и обнаружили, что молекулы ДНК стали стабильнее. В 1982 году в совместной публикации они предположили, что эти повторяющиеся последовательности нуклеотидов и есть теломеры.
Их догадка подтвердилась. Теперь уже точно известно, что теломеры состоят из повторяющихся нуклеотидных участков и набора специальных белков, особым образом организующих эти участки в пространстве. Теломерные повторы — весьма консервативные последовательности, например, повторы всех позвоночных состоят из шести нуклеотидов — TTAGGG, повторы всех насекомых из пяти — TTAGG, повторы большинства растений из семи — TTTAGGG. Благодаря наличию в теломерах устойчивых повторов клеточная система репарации не путает теломерный участок со случайным разрывом. Таким путём обеспечивается стабильность хромосом: конец одной хромосомы не может соединиться с разрывом другой.
ТЕЛОМЕРЫ ПОСТОЯННО УКОРАЧИВАЮТСЯ
Теломерные повторы не просто стабилизируют хромосомы, они выполняют ещё одну важную функцию. Как известно, воспроизведение генетического материала от поколения к поколению происходит за счёт удвоения молекул ДНК с помощью специального фермента (ДНК-полимеразы). Этот процесс называется репликацией. Проблему «концевой репликации» ещё в 1970-х годах независимо сформулировали Алексей Матвеевич Оловников и нобелевский лауреат Джеймс Уотсон. Она заключается в том, что ДНК-полимераза неспособна полностью скопировать концевые участки линейных молекул ДНК, она лишь наращивает уже имеющуюся полинуклеотидную нить.
ТЕЛОМЕРАЗА НЕ ДАЁТ ТЕЛОМЕРАМ УКОРАЧИВАТЬСЯ
Чтобы клетки не растеряли при делении часть генетического материала, теломерные повторы обладают способностью восстанавливать свою длину. В этом и заключается суть процесса «концевой репликации». Но учёные не сразу поняли, каким образом наращиваются концевые последовательности. Было предложено несколько различных моделей. Российский учёный А. М. Оловников предположил существование специального фермента (теломеразы), наращивающего теломерные повторы и тем самым поддерживающего длину теломер постоянной.
В середине 1980-х годов в лабораторию Блэкбёрн пришла работать Кэрол Грейдер, и именно она обнаружила, что в клеточных экстрактах инфузории происходит присоединение теломерных повторов к синтетической теломероподобной «затравке». Очевидно, в экстракте содержался какой-то белок, способствовавший наращиванию теломер. Так блестяще подтвердилась догадка Оловникова и был открыт фермент теломераза. Кроме того, Грейдер и Блэкбёрн определили, что в состав теломеразы входят белковая молекула, которая, собственно, осуществляет синтез теломер, и молекула РНК, служащая матрицей для их синтеза.

БЕЗ ТЕЛОМЕРАЗЫ КЛЕТКА СТАРЕЕТ, А С ТЕЛОМЕРАЗОЙ — ПЕРЕРОЖДАЕТСЯ
Позднее в лаборатории Шостака обнаружили, что определённые мутации в некоторых генах дрожжей приводят к быстрому укорочению теломер после каждого цикла деления клеток, в результате чего хромосомы становятся нестабильными, а клетки переходят в состояние старения (сенессенса). Теперь мы знаем, что эти гены кодируют теломеразу. Полученные данные подтвердили ещё одну гипотезу А. М. Оловникова о том, что потеря длины теломерных повторов в каждом раунде репликации хромосом зависит от числа делений клетки.
Итак, теломераза решает проблему «концевой репликации»: синтезирует повторы и поддерживает длину теломер. В отсутствие теломеразы с каждым клеточным делением теломеры становятся короче и короче, и в какой-то момент теломерный комплекс разрушается, что служит сигналом к программируемой гибели клетки. То есть длина теломер определяет, какое количество делений клетка может совершить до своей естественной гибели.
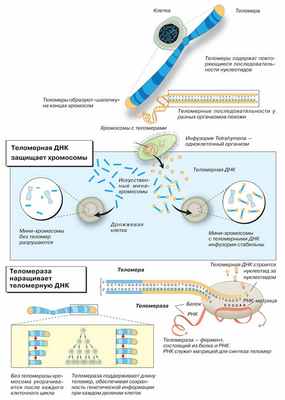
На самом деле у разных клеток могут быть разные сроки жизни. В эмбриональных стволовых клеточных линиях теломераза очень активна, поэтому длина теломер поддерживается на постоянном уровне. Вот почему эмбриональные клетки — «вечно молодые» и способны к неограниченному размножению. В обычных стволовых клетках активность теломеразы ниже, поэтому укорачивание теломер скомпенсировано лишь отчасти. В соматических клетках теломераза вовсе не работает, поэтому теломеры укорачиваются с каждым клеточным циклом. Укорочение теломер приводит к достижению предела Хайфлика — к переходу клеток в состояние сенессенса. После этого наступает массовая клеточная смерть. Уцелевшие клетки перерождаются в раковые (как правило, в этом процессе задействована теломераза). Раковые клетки способны к неограниченному делению и поддержанию длины теломер.
Наличие теломеразной активности в тех соматических клетках, где она обычно не проявляется, может быть маркёром злокачественной опухоли и индикатором неблагоприятного прогноза. Так, если активность теломеразы появляется в самом начале лимфогранулематоза, то можно говорить об онкологии. При раке шейки матки теломераза активна уже на первой стадии.
Мутации в генах, кодирующих компоненты теломеразы или других белков, участвующих в поддержании длины теломер, являются причиной наследственной гипопластической анемии (нарушения кроветворения, связанные с истощением костного мозга) и врождённого Х-сцеплённого дискератоза (тяжёлое наследственное заболевание, сопровождающееся умственной отсталостью, глухотой, неправильным развитием слёзных каналов, дистрофией ногтей, различными дефектами кожи, развитием опухолей, нарушениями иммунитета и др.).
ЗАЧЕМ ИЗУЧАТЬ ТЕЛОМЕРЫ И ТЕЛОМЕРАЗУ
Сейчас многие учёные заняты поиском взаимосвязи между активностью теломеразы и старением. Тут необходимо осознать, что длина теломер может контролировать продолжительность жизни клеток, но не всего организма. Старение как биологическое явление — более сложный многофакторный процесс. Гораздо более важна взаимосвязь между активностью теломеразы и риском развития раковых заболеваний. Учёные ищут вещества, влияющие на активность теломеразы и на структуру теломер, с целью создания новых противоопухолевых лекарственных препаратов.
Вот мы и пришли к заключению, что «открытие того, как теломеры и фермент теломераза защищают хромосомы» — это, безусловно, великое достижение современной науки, позволяющее понять, как генетическая информация передаётся от материнской клетки к дочерней без потерь, чем определяется продолжительность жизни клеток, а также некоторые особенности их злокачественного перерождения. Обретённые знания помогут в будущем создать лекарственные препараты, избавляющие людей от неизлечимых болезней. Это действительно выдающееся научное открытие. Но не стоит забывать о выдающихся гипотезах русского учёного А. М. Оловникова, которые подтвердились в работах нынешних нобелевских лауреатов.
Детальное описание иллюстраций:
Теломераза активна не во всех клеточных популяциях. Максимальная активность наблюдается в «вечно молодых» эмбриональных клетках. В стволовых клетках теломераза работает не в полную силу. В большинстве соматических клеток теломераза «молчит», поэтому теломеры постоянно укорачиваются, что приводит к программируемой гибели клеточной популяции. При злокачественной трансформации теломераза активируется и клетки раковой опухоли начинают неконтролируемо делиться.
Редакция
X Международная студенческая научная конференция Студенческий научный форум - 2018

Вся информация о строении и функционировании любого организма содержится в закодированном виде в его генетическом материале, основу которого у подавляющего числа организмов составляет ДНК. Роль ДНК заключается в хранении и передаче генетической (наследственной) информации в живых организмах. Чтобы эта информация могла передаваться от одного поколения клеток (и организмов) к другому, необходимо её точное копирование и последующее распределение её копий между потомками. Процесс, с помощью которого создаются копии молекулы ДНК, называется репликацией. Реплика́ция (от лат. replicatio — возобновление) — процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15—20 различных белков, называемый реплисомой.
Клетки, растущие в культуре, могут делиться только определённое число раз, после чего переходят в стадию старения. Такие клетки характеризуются снижением интенсивности энергообмена, замедлением синтеза РНК и белков, понижением эффективности репарации ДНК и накоплением мутаций. Часто наблюдается разбалансировка клеточной регуляции. Признаками клеточного старения считаются накопление специфического гликолипопротеида липофусцина и активация бета-галактозидазы. Стареющие клетки могут долгое время оставаться жизнеспособными. Нередко после остановки деления и торможения клеточного цикла у них не наступает программируемой клеточной гибели. Обычно они уничтожаются клетками иммунной системы. С возрастом в организме происходит накопление старых клеток, вероятно, вследствие ухудшения выполнения иммунной системой своих функций. Клеточное старение — явление, которое обычно связывают с потерей способности клетки к делению. Этот процесс также называется репликативным старением (снижение функциональной активности клеток по мере увеличения их возраста).
Стареющие клетки могут оказывать влияние как на соседние клетки, так и на весь организм, выделяя определённые сигнальные молекулы. Влияние это разнообразно, изучено недостаточно и, в общем, скорее отрицательно. Похоже, что клеточное старение является одним из механизмов старения организма.
ДНК-полимераза не может начинать цепочку ДНК, для этого существует фермент праймаза, который на матрице ДНК синтезирует РНК-фрагмент (праймер, 10-20 нуклеотидов), от 3'-конца которого начинает работать ДНК-полимераза. Праймер затем удаляется, а это место достраивается ДНК-полимеразой следующего по счету фрагмента Оказаки.
На конце хромосомы у последнего фрагмента Оказаки нет «следующего», поэтому некому достроить ДНК на пустом месте, получившемся после удаления праймера. Поэтому после каждой репликации у дочерних хромосом укорачиваются оба 5'-конца (концевая недорепликация).
На концах хромосом имеются участки, не несущие наследственной информации – теломеры. Их укорочение не приносит вреда; у человека они рассчитаны примерно на 60 репликаций. Больше 60 раз (число Хейфлика) клетки человека поделиться не могут, поскольку концевая недорепликация начинает затрагивать гены.
Стволовые клетки (в коже, красном костном мозге, семенниках) должны делиться гораздо больше, чем 60 раз. Поэтому в них функционирует фермент теломераза, который после каждой репликации удлиняет теломеры.
Теломераза удлиняет выступающий 3'-конец ДНК, так что он увеличивается до размера фрагмента Оказаки. После этого праймаза синтезирует на нем праймер, и ДНК-полимераза удлиняет недореплицированный 5'-конец ДНК.
Теломеры — концевые участки хромосом. Теломерные участки хромосом характеризуются отсутствием способности к соединению с другими хромосомами или их фрагментами и выполняют защитную функцию. У большинства организмов теломерная ДНК представлена многочисленными короткими повторами. Их синтез осуществляется необычным РНК-содержащим ферментом теломеразой.
В клетках человека теломеры обычно представлены одноцепочечной ДНК и состоят из несколько тысяч повторяющихся единиц последовательности ТТАГГГ. Эти последовательности с высоким содержанием гуанина стабилизируют концы хромосом, формируя очень необычные структуры, называемые
G-квадруплексами и состоящие из четырёх, а не двух взаимодействующих оснований. Четыре гуаниновых основания, все атомы которых находятся в одной плоскости, образуют пластинку, стабилизированную водородными связями между основаниями и хелатированием в центре неё иона металла (чаще всего калия). Эти пластинки располагаются стопкой друг над другом.
Теломерная ДНК имеет определенный состав, а для поддержания ее длины, как правило, используется специальный фермент — теломераза.
Нуклеотидная структура теломерных последовательностей ДНК нам уже известна. Более высокие уровни организации образуются за счет специфических белков. Благодаря этим белкам, теломеры имеют плотную упаковку, т. е. относятся к фракции гетерохроматина. С помощью теломерных белков теломеры крепятся к компонентам ядерного матрикса, в т. ч., возможно, к ядерной ламине.
Полагают также, что теломерная ДНК образует несколько петель (в виде «лепестков ромашки»), фиксированных на матриксе; и по мере укорочения теломер число «лепестков» постепенно уменьшается.
Функции теломер:
механические: теломеры участвуют в фиксации хромосом к ядерному матриксу. Это важно для правильной ориентации хромосом в ядре, и данное обстоятельство особенно проявляется в мейозе;
стабилизационные: в присутствии теломеразы к местам разрыва присоединяется теломерная ДНК. Это стабилизирует хромосомные фрагменты и позволяет им функционировать;
отсчет количества клеточных делений: отсчитывает количество делений клетки после исчезновения теломеразной активности.
У человека длина теломерной ДНК обычно убывает за год на 15-65 пар нуклеотидов. Значительное сокращение длины теломер (достижение критического уровня, при котором клетка неспособна делиться) запускает процессы клеточного старения и резко снижает способность тканей к регенерации. Такое положение дел типично также для для пациентов группы риска в отношении атеросклероза, гипертонии, сердечно-сосудистых и инфекционных заболеваний, диабета, метаболического синдрома, болезни Альцгеймера и некоторых других патологий. Длина теломер (у человека ее часто определяют в лейкоцитах) может служить полезным маркером общего статуса старения организма, а удлинение теломер может коррелировать, согласно первым клиническим наблюдениям, с процессами клеточного омоложения в организме. В одном из исследований Тима Спектора было показано, что курение, избыточный вес и социо-экономический статус также оказывают влияние на длину теломер и продолжительность жизни.
Результаты другого исследования Спектора показали, что длина теломер у физически активных участников исследования была на 200 п.н. длиннее, чем у малоподвижных. Можно сделать вывод, что для предотвращения старения клеток важно поддерживать организм в тонусе с помощью физических упражнений и ведения здорового образа жизни. Исследования, проводимые компанией THINC , показали, что условия, связанные с психологическими нагрузками, в том числе, стрессы, депрессии, тревоги, могут влиять на сокращение длины теломер. До сих пор до конца не ясно, как именно стресс укорачивает теломеры.
В 1961 г. Хейфлик и Мурхиад показали, что культура соматических клеток имеет ограниченный период жизни (предел Хейфлика). В 1973 г. Оловников предположил, что возможное число делений клетки определяется укорачиванием концов хромосом - теломер, играющих роль «клеточных часов». Теломеры защищают геном клетки от деградации, участвуют в мейотическом спаривании хромосом и регуляции транскрипции генов прителомерной области. В клетках, способных размножаться бесконечно (бессмертных), существует механизм, компенсирующий укорачивание теломер. В 1985 г. Блекберн и Грейдер открыли теломеразу - фермент, удлиняющий одну из цепей теломеры. Теломераза представляет собой РНК- белковый комплекс, основные компоненты которого - РНК-матрица для синтеза теломер (TERC), выполняющая также структурную функцию, и обратная транскриптаза (TERT).
Активность теломеразы рассматривается как потенциальный маркер физиологического резерва организма: длительность активного функционирования клетки, пролиферативного потенциала, а длину теломер – «клеточными часами», ограничивающими число возможных делений клетки. Физические нагрузки приводят к увеличению активности теломеразы и количества теломеразной обратной транскриптазы и белка TRF в миокарде, лейкоцитах и эндотелиальных клетках и к предотвращению укорочения теломер в них. При миопатическом синдроме у спортсменов, сопровождающимся усталостью, средняя длина теломер в мышцах спортсменов меньше, чем у здоровых спортсменов, при этом у некоторых индивидов наблюдались экстремально короткие теломеры, что может объясняться повышенной частотой регенерации мышц у интенсивно тренирующихся спортсменов. Было установлено, что физические нагрузки силового характера также приводят к незначительному укорочению теломер в скелетных мышцах индивидов. Одним из открытых вопросов на сегодня остается поиск биологических маркеров эффективности тренировок. Изменения теломеразной активности можно рассматривать как маркер пролиферативного потенциала, что отражается на эффективности тренировок. Другой очень важной проблемой является оценка предела, до которого можно увеличивать интенсивность нагрузок, в частности, чтобы не возникало синдрома перетренированности. С целью поиска таких показателей предлагается оценка средней длины теломер в скелетных мышцах, поскольку именно теломеры определяют резерв числа делений клеток. Таким образом, применение данных о теломеразной активности и длине теломер с целью определения физиологического резерва позволяет значительно повысить эффективность подготовки спортсменов.
Функция и репликация теломер хромосом
Функция и репликация теломер хромосом
• Для стабилизации концов хромосомы необходимы теломеры
• Теломера состоит из простых повторов, Ц+А-обогащенная цепь которых характеризуется последовательностью
Еще одной характерной чертой строения всех хромосом является теломера, которая «замыкает» их концы. Мы знаем, что теломера должна обладать особой структурой, поскольку концы хромосомы, образовавшиеся в результате разрыва, являются «липкими» и могут воссоединяться с другими хромосомами, в то время как естественные концы хромосом отличаются устойчивостью
При идентификации теломерной последовательности необходимо принимать во внимание два критерия: • Последовательность должна быть расположена на конце хромосомы.
• Она должна придавать линейной молекуле ДНК устойчивость.
Методический подход, который позволил отбирать последовательности ДНК по функциональному критерию, был разработан опять-таки с использованием дрожжей. Все плазмиды, которые способны существовать в клетках дрожжей (и обладающие ARS- и CEN-элементами), представляют молекулы циркулярной ДНК. Линейные плазмиды нестабильны и деградируют.
Теломеры можно отбирать как последовательности, способные обеспечивать стабильность плазмид. Так можно идентифицировать фрагменты дрожжевой ДНК, локализованные на концах хромосом. Аналогичным образом, стабильность линейных форм дрожжевых плазмид обеспечивается концевыми участками природных линейных молекул ДНК — экстрахромосомной рДНК Tetrahymena.
Типичная теломера характеризуется простой повторяющейся структурой,
ГТ-богатая цепь которой выходит за пределы ЦА-богатой цепи.
Г-богатый концевой участок образуется при ограниченной деградации ЦА-богатой цепи.
Теломерные последовательности были обнаружены в хромосомах самых разных представителей высших и низших эукариот. Для хромосом клеток растений и человека обнаружен одинаковый тип последовательности. Это свидетельствует о том, что в основе структурной организации теломеры лежит общий принцип. Каждая теломера состоит из протяженного участка коротких последовательностей, расположенных тандемно. В зависимости от организма он может содержать 100-1000 повторов.
Все теломерные последовательности могут быть представлены в виде общей формулы Сn(А/Т)m, где n > 1 и m = 1 - 4. На рисунке ниже представлен типичный пример.
Необычным свойством теломерной последовательности является продолжение ГТ-цепи в виде одиночной, длиной 14—16 оснований. По-видимому, Г-конец образуется за счет специфической ограниченной деградации ЦА-богатой цепи.
Теломерный участок реплицируется по специфическому механизму. Фермент теломераза представляет собой рибонуклеопротеид, который содержит матричную РНК, с той же последовательностью, что и в ЦА-богатой цепи. РНК присоединяется к теломере, образуя праймер, с которого начинается рост цепи с участием обратной транскриптазы, входящей в теломеразный комплекс. Процессивность фермента и число добавляемых повторов контролируются другими белками комплекса.
Поскольку репликация ДНК не может начаться с самого конца линейной молекулы, при репликации хромосомы количество повторов в теломере снижается. Это можно продемонстрировать, заблокировав активность теломеразы. Как следует из рисунка ниже, мутация по гену теломеразы приводит к укорачиванию теломерных участков с каждым делением клетки. Рисунок ниже показывает, что длина теломеры на протяжении 120 клеточных поколений снижается с 400 пн до нуля.
Способность теломеразы добавлять повторы к теломере при синтезе de novo, компенсирует их потерю за счет невозможности протекания репликации до конца хромосомы. Удлинение и укорачивание теломер находятся в динамическом равновесии. Если эти участки постоянно удлиняются (и укорачиваются), то их первичная последовательность не играет роли. Необходимо всего лишь, чтобы конец последовательности признавался подходящим субстратом для удлинения теломеры.
Теломеразная активность присутствует во всех делящихся клетках, и фермент обычно не обнаруживается в терминально дифференцированных, т. е. неделящихся клетках.
Мутации в теломеразе вызывают укорочение теломер после каждого цикла деления.
Полная потеря теломеры вызывает разрывы и перегруппировки хромосом. В диком штамме дрожжей длина теломеры составляет около 350 пн,
однако у мутанта по гену trt1, кодирующего компонент РНК теломеразы, длина ее быстро сокращается до нуля.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Функция и репликация теломер хромосом
Это предположение подтверждается и проявлением центромерной активности за пределами нормальных центромер. Такие неоцентромеры ведут себя как обычные центромеры: образуют цитологически различимую перетяжку и формируют кинетохор, связывающий белки. Однако анализ ДНК двух неоцентромер человека и обычной центромеры общих последовательностей не выявил, что говорит о возможной роли других структурных компонентов хромосомы. Ими могут быть гистоновые и негистоновые белки, которые связываются с ДНК, формируя нуклеосомную структуру хроматина.
Функциональную роль центромерной структуры хроматина подтверждает присутствие специфических для каждого биологического вида варианта гистона Н3 в центромерном хроматине: у человека они названы CENP-A, у растений - CENH3. Среди множества имеющихся в кинетохоре белков только два, СЕNН3 и центромерный белок С (СЕNР-С), непосредственно связываются с ДНК. Возможно, именно CENH3, взаимодействуя с другими гистонами (Н2А, Н2В и Н4), формирует и определяет специфический для центромер тип нуклеосом. Такие нуклеосомы могут служить своего рода якорями для образования кинетохора. Варианты гистона Н3 в центромерах различных видов подобны канонической молекуле гистона Н3 в участках взаимодействия с другими гистоновыми белками (Н2А, Н2В, Н4). Однако участок центромерного гистона Н3, взаимодействующий с молекулой ДНК, видимо, находится под действием движущего отбора. Как уже говорилось, первичная структура центромерной ДНК отличается между видами, и было высказано предположение, что центромерный гистон Н3 коэволюционирует вместе с центромерной ДНК, в частности у дрозофилы и арабидопсиса [1].
Обнаружение центромерного гистона Н3 породило крайнюю точку зрения, согласно которой центромерная функция и ее полная независимость от первичной структуры ДНК определяется нуклеосомной организацией и этим гистоном. Но достаточно ли этих факторов для полноценной активности центромеры? Модели, игнорирующие роль первичной структуры ДНК, должны предполагать случайное распределение изменений в структуре центромерной ДНК в различных популяциях в отсутствие отбора. Однако анализ сателлитной ДНК в центромерах человека и Arabidopsis выявил консервативные районы, так же как и районы с более высокой, чем средняя, вариабильностью, что указывает на давление отбора на центромерную ДНК. Кроме того, искусственные центромеры удалось получить только с a-сателлитными повторами человека, амплифицированными из природных центромер, но не из a-сателлитов прицентромерных районов хромосом.
Меньше принципиальных трудностей для объяснения встречают модели, в которых решающим фактором в определении позиции центромеры (сохраняющейся от поколения к поколению) и ее функций служит третичная (или даже более высокого порядка) структура ДНК. Ее консерватизм допускает большие вариации в последовательности нуклеотидов и не исключает тонкую подстройку первичной структуры.
Хеникофф с коллегами [2] предложили модель, описывающую координированную эволюцию ДНК и белков и приводящую к появлению оптимально функционирующих центромер на примере деления женских половых клеток. Как известно, в процессе мейоза одна родительская клетка посредством следующих друг за другом двух делений дает начало четырем дочерним клеткам. Впоследствии только одна из них превращается в зрелую женскую половую клетку (гамету), передающую генетическую информацию следующему поколению, тогда как три других клетки отмирают. Согласно этой модели, в процессе эволюции вследствие мутаций и других механизмов в хромосомах могут возникать центромеры с более протяженными тяжами мономеров сателлитной ДНК или с первичной структурой нуклеотидов, более способствующей связыванию и координированной работе со специфическими формами гистонов CENH3 и СЕNР-С. При этом у одних организмов (арабидопсис, дрозофила) доказательства для положительного давления отбора получены для CENH3, тогда как для других видов (злаки, млекопитающие) для СЕNР-С (рис.4,а). В итоге такие центромеры с усовершенствованным кинетохором становятся “сильнее” и могут присоединять большее число микротрубочек веретена деления (рис.4,б). Если таких “сильных” центромер оказывается в гаметах больше, то происходит процесс мейотического драйва, который увеличивает количество таких центромер, и новый вариант фиксируется в популяции.
Рис. 4. Модель, объясняющая эволюцию центромер.
Вверху - центромеры (серые овалы) содержат специализированный набор белков (кинетохор), включающий гистоны CENH3 (H) и CENP-C (C), которые в свою очередь взаимодействуют с микротрубочками веретена деления (красные линии). В различных таксонах один из этих белков эволюционирует адаптивно и согласованно с дивергенцией первичной структуры ДНК центромер.Внизу - изменения в первичной структуре или организации центромерной ДНК (темно-серый овал) может создавать более сильные центромеры, что выражается в большем количестве присоединяемых микротрубочек.
Понять механизмы формирования и активности центромерных районов хромосом помогает сравнительная геномика. Уникальный пример разнообразной структуры центромер - хромосома 8 в геноме риса. В ней наряду с сателлитным повтором ДНК и ретротранспозонами обнаружены активно транскрибируемые гены; 48 из них имели последовательности с высокой гомологией к известным белкам [3]. Эти находки опровергают сложившееся на основе изучения центромер человека, дрозофилы и арабидопсиса мнение, что в центромерах нет активно работающих генов.
Если в молекулярной структуре центромер различных видов эукариот присутствуют некоторые универсальные характеристики (организация ДНК в виде тандемных, относительно коротких мономеров и специфические для данных локусов белки хроматина), то в размерах этих районов трудно выявить какие-либо закономерности. Так, у дрожжей Saccharomyces cerevisiae за минимальную функциональную центромеру принимают участок ДНК в 125 нп, а у дрожжей Schizosaccharomyces pombe она значительно сложнее и длиннее (от 40 до 120 тыс. нп), имеет несколько уровней организации. У человека основной компонент центромер хромосом - a -сателлитная ДНК - образует длинные тяжи тандемно организованных мономеров (от 250 тыс. до 4 млн нп). Среди 12 хромосом риса в хромосоме 8 длина тяжа с сателлитом CentO наименьшая (~64 тыс. нп); в ней определили позицию центромеры и ее примерный размер в 2 млн нп [3]. Удалось получить полную последовательность ДНК этого центромерного района и внутри него определить участок (~750 тыс. нп), где непосредственно формируется кинетохор. В этом районе находится основной кластер CentO.
Удивительная пластичность центромер, в частности активно работающие гены, обнаруженные в центромере хромосомы 8 риса, предполагает отсутствие строгой границы между центромерой и остальной частью хромосомы и даже возможность рассеянной структуры центромерного хроматина. Однако против существования нескольких кластеров в районе хромосомной перетяжки говорят недавно опубликованные данные о наличии хроматинового барьера между собственно центромерой и прицентромерным гетерохроматином у дрожжей Schizosaccharomyces pombe [4]. Барьер представляет собой ген тРНК аланина. Делеция или модификация барьерной последовательности ведет к выходу прицентромерного гетерохроматина за свои обычные границы. Более того, отсутствие барьера вызывает ненормальное расхождение хромосом в мейозе. Безусловно, следует помнить, что эти интереснейшие результаты касаются пока только одного вида дрожжей.
Термин “теломера” предложил Г.Мёллер еще в 1932 г. [5]. В его представлении она означала не только физический конец хромосомы, но и присутствие “терминального гена со специальной функцией запечатывания (пломбирования) хромосомы”, которое делало ее недоступной для вредных воздействий (хромосомных перестроек, делеций, действия нуклеаз и т.д.). Наличие терминального гена не подтвердилось в последующих исследованиях, однако функция теломеры была определена точно.
Позднее выявили еще одну функцию. Так как на концах хромосом обычный механизм репликации не работает, в клетке есть другой путь, поддерживающий стабильные размеры хромосом при клеточном делении. Эту роль выполняет специальный фермент, теломераза, которая действует подобно другому ферменту, обратной транскриптазе: использует одноцепочечную РНК-матрицу для синтеза второй цепи и восстановления концов хромосом. Таким образом, теломеры во всех организмах выполняют две важные задачи: защищают концы хромосом и поддерживают их длину и целостность.
Первые работы по определению природы ДНК теломер выявили тандемную организацию коротких мономеров у широкого спектра организмов (простейших, грибов, насекомых, растений и млекопитающих [6]), что вполне соответствовало универсальному характеру функций теломеры. Еще одна консервативная особенность теломерной ДНК - наличие относительно короткого одноцепочечного “хвоста”, состоящего из G-остатков с ориентацией 5’-3’ G-богатой цепи вперед к концу хромосомы. Считают, что такой выступ обеспечивает связывание теломер-специфических белков, образующих “колпак” (cap) для защиты конца хромосомы.
Однако по мере расширения изучаемых видов оказалось, что существуют альтернативные пути удлинения концов хромосом и их защита не зависит от короткого канонического повтора. Например, у Drosophila melanogaster ДНК теломер состоят из тандемных тяжей, образовавшихся в результате последовательных транспозиций ретротранспозонов, а одноцепочечных G-выступов пока не обнаружено. Несмотря на столь существенные различия в природе ДНК двух типов теломер, они имеют много общего. Например, и те, и другие поддерживают свою длину с помощью обратной транскрипции с РНК-матрицы и могут использовать для этой цели рекомбинацию (обмен генетическим материалом).
Список организмов, теломеры которых не имеют консенсусной последовательности, продолжает расширяться и сегодня включает некоторые виды из четырех отрядов насекомых: Diptera, Coleoptera, Heteroptera и Dermaptera . У комаров ( Diptera ) отмечен третий тип теломер: их ДНК представлена длинным тяжем регулярного тандемного повтора длиной 340 нп. Вероятно, здесь размеры поддерживаются подобно уже описанному механизму для первых двух типов, т.е. регенерация сложных повторов может происходить с помощью рекомбинации или опять-таки обратной транскрипцией РНК, продуцируемой с теломеры. Среди растений также описаны виды родов луковых и алое, не имеющих консенсусного теломерного повтора, TTTAGGG. Таким образом, подобно рассмотренным выше центромерам, теломеры выполняют исключительно важные и консервативные функции и имеют удивительно пластичную структурную организацию ДНК.
Согласно многим исследованиям, размер теломеры может колебаться при стрессовых воздействиях, укорачиваться при старении и онкогенезе. Вместе с тем другие работы демонстрируют относительное постоянство размеров теломеры у каждого конкретного вида, что указывает на функционирование регуляторного механизма, контролирующего теломеразу так, чтобы ее активность ограничивалась только компенсацией репликационных потерь теломерной ДНК. Следует отметить, что все приведенные количественные оценки носят относительный характер. Несмотря на это, можно определенно утверждать, что размеры теломер и центромер как среди различных видов эукариот, даже эволюционно близких, так и между различными хромосомами одного кариотипа характеризуются высокой гетерогенностью. В связи с этим возникает вопрос, а существует ли четкая, обусловленная различиями в молекулярной структуре граница, отделяющая эти районы от остальной хромосомы?
Анализ имеющихся данных показывает, что в случае теломер о существовании такой границы говорить трудно, если вообще возможно. Неясно, что считать настоящей (истинной) теломерой. Наиболее популярная точка зрения рассматривает в качестве теломеры весь тяж последовательности ДНК теломерного повтора вместе с многочисленными белками, связывающимися как с одно-, так и с двухцепочечной ДНК. Однако у многих видов эукариот (особенно если геномы большого размера) переход между тяжом теломерного повтора и субтеломерой характеризуется появлением мономеров с вырожденной структурой классического повтора и заканчивается копиями дегенеративных повторов с более чем одной нуклеотидной заменой. Более того, сам тяж теломерного повтора представляет собой отнюдь не такую гомогенную структуру, как было принято думать.
Мы с помощью флуоресцентной in situ гибридизации теломерного повтора на фибриллах ДНК показали, что наряду с гомогенными флуоресцирующими треками сигнала гибридизации присутствуют треки с разрывами, в которых, вероятно, помимо теломерного повтора находятся другие типы последовательностей ДНК (рис.5). Мы также обнаружили фибриллы с рассеянными одиночными сигналами теломерного повтора. Таким образом, теломерные повторы не всегда организованы как монотонные гомогенные тяжи мономеров. Они могут прерываться другими последовательностями ДНК и рассеиваться в виде коротких кластеров. Такая гетерогенная организация может приводить к завышенным количественным оценкам длины теломер и, кроме того, к неадекватной оценке участия соседних последовательностей в вариации размеров теломер.
Рис. 5. Гибридизация пробы ДНК на растянутых фибриллах ржи.
Различные типы организации теломерного повтора: монотонные треки ( вверху )
и треки с разрывами (спейсерами) различных размеров ( в середине и внизу ).
Теломерные повторы могут располагаться вдоль плеч в интерстициальных и даже в прицентромерных районах хромосом, но сами по себе не образуют функциональную теломеру. Вполне логично думать, что для ее формирования необходимы специализированные белки, обволакивающие теломерную ДНК и защищающие концы хромосомы от нежелательных воздействий. Теломерную ДНК можно рассматривать как платформу для сборки больших комплексов белков, ключевой среди которых - комплекс теломеразы. Кроме того, в реализации ее функций участвуют другие системы: ДНК-белковый комплекс, формирующийся на одноцепочечном G-выступе, и белковые комплексы на двухцепочечной ДНК теломерного повтора. Некоторые белки специфически локализованы на теломерах, но основная их часть присутствует и в других участках хромосом.
Предложена модель белкового комплекса из шести теломер-специфических белков, формирующегося на теломерах хромосом человека [7]. ДНК образует t-петлю, а одноцепочечный выступ внедряется в двухцепочечный участок ДНК, расположенный дистально (рис.6). Белковый комплекс позволяет клеткам отличать теломеры от мест разрыва хромосом (ДНК). Не все белки теломер входят в состав комплекса, который избыточен на теломерах, но отсутствует в других районах хромосом. Защитные свойства комплекса вытекают из его способности воздействовать на структуру теломерной ДНК по крайней мере тремя способами: определять структуру самого кончика теломеры; участвовать в образовании t-петли; контролировать синтез теломерной ДНК теломеразой. Родственные комплексы найдены и на теломерах некоторых других видов эукариот.
Рис. 6. Модель образования t-петлевой структуры на конце хромосомы.
Вверху - теломера в момент репликации хромосомы, когда ее конец доступен для комплекса теломеразы, который осуществляет репликацию (удвоение цепи ДНК на самом кончике хромосомы). После репликации теломерная ДНК (черные линии) вместе с находящимися на ней белками (показаны разноцветными овалами) образует t-петлю ( нижняя часть рисунка ).
Итак, у подавляющего большинства организмов основной тип последовательностей ДНК в центромерных и теломерных районах - это тандемно организованные мономеры короткой длины. Очевидно, что столь короткие последовательности (особенно в теломерах) обладают крайне ограниченной кодирующей способностью в первичной структуре и не соответствуют концепции Мёллера о терминальном гене [5].
В последние годы стало очевидным, что универсальных последовательностей ДНК, непосредственно определяющих функции центромер и теломер, нет. В этих районах хромосом ДНК служит платформой для сборки сложных, многокомпонентных ДНК-белковых комплексов, которые и обеспечивают выполнение этих функций. Более подробно о комплементарной организации этих комплексов и их координированного функционирования можно прочитать в нашем обзоре [2]. Наряду со специфическими для центромер и теломер компонентами этих комплексов в их состав входят и такие, которые участвуют в выполнении нескольких функций, иногда даже противоположных. Например, Ku70/80-гетеродимер входит в состав теломер и работает как позитивный регулятор длины теломер у дрожжей и негативный регулятор - у растения арабидопсис. В тоже время этот белок участвует в распознавании разрывов хромосом и их восстановлении. Без сомнения, одно из наиболее актуальных направлений исследований - выявление молекулярной природы механизмов регуляции разнообразных молекулярных комплексов, обеспечивающих активность центромер и теломер.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект 04-04-48813), INTAS (03-51-5908)
и Программы интеграционных проектов СО РАН (проект 45/2).
1. Talbert P.B., Bryson T.D., Henikoff S. // J. Biol. 2004. V.3. Article 18.
2. Вершинин А.В. // Генетика. 2006. V.42. P.1200-1214.
3. Wu J., Yamagata H., Hayashi-Tsugane M. et al. // Plant Cell. 2004. V.16. P.967-976.
4. Scott K.C., Merrett S.L., Willard H.F. // Curr. Biol. 2006. V.16. P.119-129.
5. Muller H.J. Further studies on the nature and causes of gene mutations // Proc. Sixth Int. Congr. Genet. 1932. V.1. P.213-255.
Система «теломеры-теломераза» как молекулярно-генетический индикатор старения у человека
Достижения медицинской науки за последние 100 лет почти удвоили продолжительность жизни населения в развитых странах. Так, ожидаемая продолжительность жизни в 2015 г. составляла 71,4 года (73,8 года для женщин и 69,1 года для мужчин). В период между 2000 и 2015 гг. средняя продолжительность жизни увеличилась на 5 лет, что является самым быстрым ростом с 1960-х гг. По статистическим оценкам, этот бум долголетия приведет к тому, что к 2025 г. численность популяции людей в возрасте старше 60 лет достигнет 1,2 млрд.
Резкое старение населения во всем мире и развитие хронических заболеваний с возрастом приводит к значительному вложению средств в программы лечения пожилых людей [1].
Для повышения качества жизни при снижении реальных темпов старения и увеличении продолжительности активной трудоспособности необходима разработка точных количественных методов диагностики процессов, связанных со старением.
Чтобы поддержать здоровье и благополучие указанной популяции, обязательно нужно понимать молекулярные механизмы и биологические процессы, лежащие в основе старения и ассоциированных с ним заболеваний.
Старение представляет собой процесс, вызываемый комплексом регуляторных факторов, и является генетически детерминированным.
Существуют различные подходы к оценке биологического возраста [2]. Последний определяется на основании известных для данной популяции зависимостей между специфическими биомаркерами и хронологическим возрастом по индивидуальным значениям указанных показателей у человека.
Для этого предложены различные тесты (около 600), которые могут служить индикаторами старения. Пока не удается однозначно ответить на вопрос, какое число показателей оптимально для определения биологического возраста.
В настоящее время существуют 2 основные теории механизмов старения: теломерная и окислительная (свободнорадикальная или митохондриальная). Тем не менее появляется все больше доказательств того, что центральная роль в возрастной дегенерации тканей и уменьшении резервов стволовых клеток принадлежит именно теломерам. Ряд исследователей считают теломерную теорию наиболее убедительной.
Теломеры
В 1938 г. американский генетик H. J. Müller, работая в Эдинбургском институте генетики животных (Великобритания), проводил опыты с мухами вида Drosophila melanogaster, подвергая их воздействию рентгеновских лучей [3]. Он заметил, что гены, расположенные на концах облученных хромосом, в отличие от других генов, не претерпевают изменений в виде делеции или инверсии благодаря наличию защитного «колпачка», который он назвал «защитный ген», а позже «теломера» (от греч. telos – конец и meros – часть) (рис. 1).
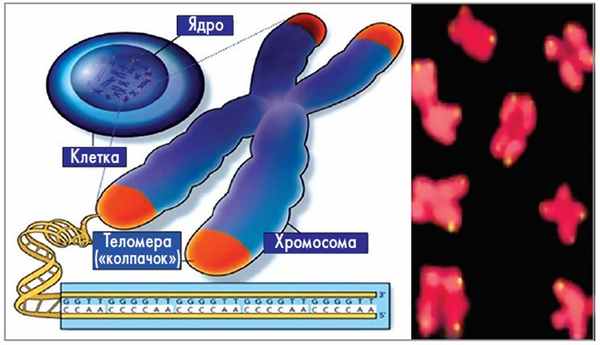
Рис. 1. Схема строения теломеры в составе хромосомы (а)
и митотические хромосомы с теломерами, меченными
флуоресцеином на концах (б)
Два года спустя исследователь из Миссурийского университета (США) B. McClintock [4], работа которой была посвящена изучению генетики кукурузы (Zea mays), обнаружила, что разрыв хромосом приводит к адгезии и слиянию их концов с последующим образованием дицентрических хромосом. Независимо от повреждения, концы могут быть восстановлены благодаря новой теломере. Согласно ее выводам теломеры играют решающую роль в целостности хромосом, поскольку они предотвращают появление циклов «разрывслияниемост», которые катастрофичны для выживаемости клеток.
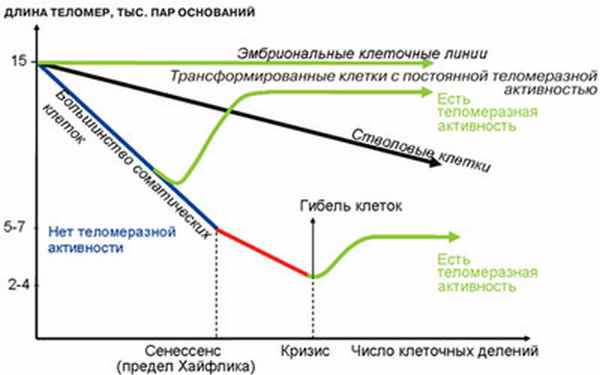
В 1961 г. L. Hayflick, профессор анатомии Калифорнийского университета (США), и P. Moorhcad [5] представили данные о том, что даже в идеальных условиях культивирования фибробласты эмбриона человека способны делиться только ограниченное число раз (50±10), после чего их способность к пролиферации исчерпывается. Данное свойство, получившее название «клеточное старение» («предел Хейфлика»), наследуется генетически и не зависит от условий культивирования клеток (рис. 2).
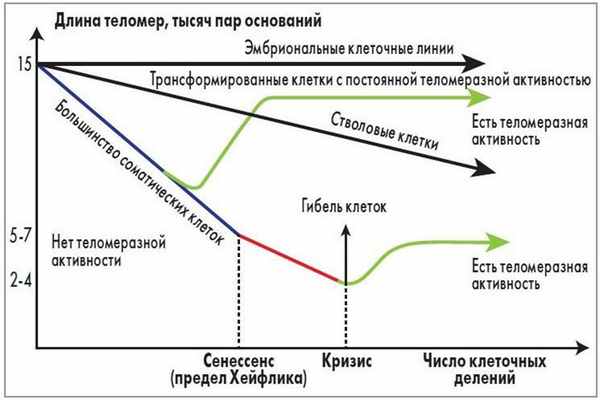
Рис. 2. Связь между длиной теломерной ДНК и числом клеточных
делений
В 1971 г. А. Оловников [7, 8] на основании оригинальных работ J. Watson [6] предложил теорию маргинотомии (отсчета клеточных делений и старения), которая объясняла механизм работы теломер. При матричном синтезе полинуклеотидов ДНК-полимераза не в состоянии полностью воспроизвести линейную матрицу, и реплика получается всегда короче в ее начальной части.
Таким образом, при каждом делении ДНК клетки укорачивается, что ограничивает пролиферативный потенциал клеток и является т. н. счетчиком количества делений и, соответственно, продолжительности жизни клетки. При каждой репликации хромосом теломеры укорачиваются, т. е. дочерняя ДНК оказывается несколько короче материнской (рис. 3).
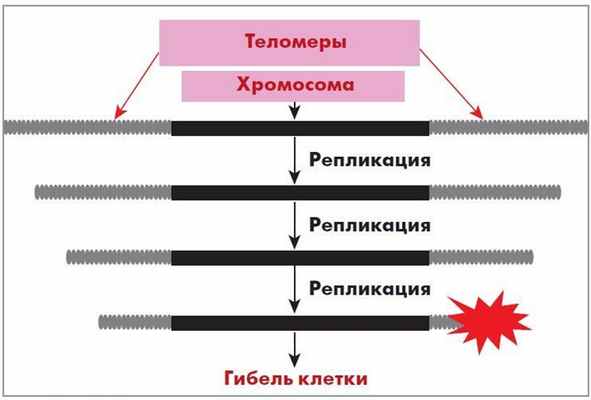
Рис. 3. Укорочение участков теломер в процессе деления
соматической клетки
Теломеры
Теломеры человека – это нуклеопротеидные концевые участки хромосом, содержащие от 4 до 14 тыс. высококонсервативных пар оснований и состоящие из повторов TTAGGG.
Длина участков TTAGGG варьирует от вида к виду. Так, теломеры человека имеют размер 414 kbр (килобазная пара представляет собой единицу длины нуклеиновых кислот, равную 1000 пар оснований), в то время как лабораторные мыши имеют теломеры более длинные – 36150 kbр. Теломера заканчивается однонитевым нависающим 3`-концом, завернутым в структуру, называемую Тпетлей, которая не позволяет концам хромосом соединяться друг с другом. При этом однонитевый конец теломеры проникает в прилегающий к Т-петле двунитевый участок, образуя D-петлю (displacement loop), закрепляющую T-петлю.
Функции теломер зависят от минимальной длины теломерных повторов и активности связанного с ними белкового комплекса.
Этот комплекс (шелтерин) состоит из 6 белков [9, 10]:
1. TIN2 (TRF1interacted nuclear protein 2) – препятствует присоединению теломеразы к теломере.
2. TPP1 (Telomere protected protein 1) – образуя гетеродимер с POT1, присоединяется к однонитевой теломерной ДНК, защищая ее от повреждений.
3. POT1 (Protection of telomeres) защищает G-богатую нависающую нить ДНК, располагаясь в олигонуклеотид/олигосахаридном связующем сгибе в теломерах, препятствует слиянию теломер «конецвконец»;
4. TRF2 (Telomere repear binding factor 2) – поддерживает целостность теломер, защищая от слияния друг с другом.
5. TRF1 (Telomere repeat binding factor 1) – отрицательный регулятор длины теломер, не допускающий теломеразу к теломере.
6. RAP1 (Rifassociated protein) – с С-концом этого белка связывается белок (белки) RIF1 и RIF2 (Relaxing insulinlike factors), препятствующие работе теломеразы. Он удерживает Т-петлю, образуя поперечные сшивки с теломерной ДНК.
Функции теломер:
- сохранение целостности генома;
- облегчение гомологичной рекомбинации при мейозе;
- участие в архитектонике клеточного ядра;
- регуляция экспрессии генов (эффект положения гена);
- определение репликативного потенциала клетки.
Хромосомы, лишенные теломер из-за разрывов, подвергаются слиянию, деградации и перестают выполнять свои функции.
Причины и следствия дисфункции теломер представлены в таблице.
Теломераза
В конце 1980-х гг. теорию А. Оловникова подтвердили исследователи из США E. H. Blackburn, J. W. Szostak и C. W. Greider (Нобелевская премия 2009 года с формулировкой «за открытие механизмов защиты хромосом теломерами и фермента теломеразы»).
Им удалось выяснить механизм, благодаря которому хромосомы копируются во время деления клетки и каким образом они защищены от деградации. Учеными было обнаружено, что чем короче теломеры, тем старее клетка, и наоборот, если активность теломеразы, достраивающей теломеры, высокая и постоянно поддерживается одинаковая длина теломер, клетка не стареет.
Теломераза – это большой рибонуклеопротеиновый комплекс, ответственный за синтез ДНК повторов теломер (TTAGGG) на 3`-концах линейных хромосом, что предотвращает потерю ДНК при каждой репликации. Теломераза представляет собой обратную транскриптазу, которая состоит из каталитической белковой субъединицы, называемой обратной транскриптазой теломеразы (TERT) и кодируемой геном hTERT, которая расположена на хромосоме 5p15.33; РНКкомпонента, известного как теломераза РНК человека или теломеразный РНКкомпонент человека (TERC), кодируемого геном hTERC на хромосоме 3q26 и дискерина (кодируется геном DKC1). TERT содержит 1131 аминокислоту и имеет молекулярную массу >100 кД. По своей структуре TERT напоминает форму рукавицы, что позволяет этому ферменту прикрепляться к хромосоме и добавлять в нее участки теломер, состоящие из одной цепочки. TERT захватывает TERC (имеющую длину 451 нуклеотид), которая не транслируется [11].
Теломераза имеет полимеразную активность, при этом она строит цепь ДНК комплементарно своей собственной определенной РНК-матрице.
Последняя, как и вся РНК в клетке, транскрибируется со своего гена, претерпевает изменения, созревает, узнается теломеразой и образует с ней комплекс, который распознает теломерные участки ДНК и удлиняет 3`-конец ДНК на 8 нуклеотидов, комплементарных РНКматрице.
Затем она пересаживается на только что синтезированный 3`-конец и удлиняет его снова. Таких удлинений может быть много, поэтому теломерные участки состоят из множественных повторов.
После этого на удлиненную цепь отжигается праймер и ДНК-полимераза комплементарно достраивает короткую цепь ДНК.
Метод измерения теломер Длина теломер клеток человека, в частности лейкоцитов, наиболее часто используется в качестве биомаркера старения [12, 13]. Для измерения их длины применяется метод FISH (Fluorescence In Situ Hybridization), или флюоресценция на месте гибридизации, – цитогенетический метод, используемый для детекции и локализации специфических последовательностей ДНК на хромосомах, мРНК и др. В основе методики лежит гибридизация флуоресцентно меченого ДНК/РНК зонда с комплементарной последовательностью ДНК/РНК. Выявление метки происходит с помощью флуоресцентного микроскопа.
Одним из вариантов FISH является QFISH (Quantitative FISH), разработанный U. Lansdorp и соавт. [14]. QFISH – это количественный метод, который применяется для работы с проточной цитометрией. Изначально использовался для измерения длины хромосом (разрешение 200 bp) путем подсчета числа теломерных повторов. На данный момент QFISH является важным инструментом в изучении роли теломер в процессах старения.
Используя метод QFISH и проточную цитометрию, можно измерить общее количество флуоресценции в клетке, чтобы оценить среднюю длину теломер в хромосомах.
Наиболее быстрое снижение длины теломер происходит в течение первых нескольких лет жизни, но продолжается до конца полового созревания. У взрослых скорость укорочения теломер замедляется. Это более заметно в гранулоцитах, что отражает деление клеток в кроветворных стволовых клетках по сравнению с лимфоцитами.
Теломеразная теория старения Факт о том, что теломеры человека укорачиваются с возрастом, стал известен более 20 лет назад. Люди с короткими теломерами входят в группу риска преждевременной смертности. R. Cawthon и соавт. [15] продемонстрировали, что для 25% 60-летних участников исследования, имевших наиболее длинные теломеры, был характерен в 2 раза более низкий риск смерти, чем для 25% участников с наиболее короткими теломерами. R. Cawthon имел доступ к уникальной базе данных, содержащей законсервированные образцы крови 20-летней давности. В течение многих лет никому не удалось ни воспроизвести, ни опровергнуть эти результаты.
Исследования молекулярных механизмов старения осложняются тем фактом, что последнее не является уникальным клеточным процессом. Механизмы старения существенно отличаются у клеток, полученных от различных видов животных.
Мутации в генах, кодирующих фермент теломеразу, включая TERT, TERC и DKCI, приводят к таким заболеваниям, как врожденный дискератоз, апластическая анемия, легочный фиброз, цирроз печени, остеопороз, опухоли. При этих мутациях происходит сборка дисфункционального теломеразного комплекса, который сохраняет частичную активность, или фермента с полностью утраченной каталитической активностью. Обычно только одна аллель теломеразного гена отвечает за неактивность теломеразно-ферментативного комплекса.
Инактивация теломеразы приводит к мутациям в генах. Клинические проявления при недостаточности теломеразы могут быть различной природы. Недостаточность теломеразы не является причиной патологии, но отражается на поддержании гомеостаза теломер.
Ограничения теломеразной теории старения В настоящее время проводятся исследования связи между длиной теломер и старением у человека [16]. Однако уже сейчас по результатам этих работ можно сделать заключение о том, что длина теломер и скорость их укорочения сильно варьируют в популяции. Предполагается, что длина теломер выступает в качестве надежного биомаркера старения не на всех, а только на определенных стадиях жизни [17]. Остается открытым вопрос, является ли она показателем нормального процесса старения или только маркером заболеваний, связанных с ним [18]. Из-за недостаточности знаний о процессе старения до сих пор трудно это установить [19, 20]. Кроме того, пока отсутствуют научные работы о вероятном влиянии предшествующих заболеваний, таких как вирусные инфекции, на длину теломер, а также информация о том, нужно ли это рассматривать в качестве потенциальных факторов, которые будут влиять на оценку результатов. Возможно, длину теломер можно считать биомаркером старения только на определенных этапах жизни [21].
Связь длины теломер и некоторых заболеваний
Сердечно-сосудистые заболевания
У пациентов с более короткими лейкоцитарными теломерами наблюдалось повышение смертности от сердечно-сосудистых заболеваний в 3 раза, от инфекционных – в 8,5 раза [15].
Хронический стресс
Для людей, живущих в условиях хронического стресса, характерна меньшая продолжительность жизни и раннее развитие возрастных болезней. Причиной стремительного укорочения теломер в данном случае может быть активация вегетативной нервной и нейроэндокринной систем с последующим выбросом глюкокортикоидных гормонов.
Наследственные дегенеративные заболевания
Результаты изучения особенностей хромосом пациентов с наследственными дегенеративными заболеваниями, характеризующимися преждевременным старением организма, в т. ч. аутосомно-доминантным врожденным дискератозом (синдром Цинссера-Энгмена-Коула), прогерией взрослых (синдром Вернера) и атаксией-телеангиэктазией (синдром Луи-Бар), указывают на важную роль, принадлежащую теломерам в процессах старения.
Приобретенные дегенеративные заболевания
Существуют доказательства роли теломер в развитии приобретенных дегенеративных заболеваний. Наиболее показательным примером является цирроз печени, при котором значительное повышение скорости обновления гепатоцитов сопровождается прогрессивным укорочением теломер. В результате клетки утрачивают способность к делению и погибают, что приводит к развитию печеночной недостаточности.
Риск развития слабоумия и сахарный диабет
В работах L. Hong и M. Sampson продемонстрирована взаимосвязь между длиной теломер и риском развития слабоумия, а также сахарным диабетом [25, 26].
Выводы
1. Концы линейных хромосом с 3`-конца ДНК заканчиваются повторяющимися последовательностями нуклеотидов – теломерами, которые синтезируются рибонуклеиновым ферментом теломеразой.
2. Структуры теломер одинаковы у всех позвоночных – (TTAGGG)n.
3. Укорочение теломер – ключевой фактор, запускающий развитие дегенеративных заболеваний и уменьшающий продолжительность жизни.
4. Длина теломер является прогностическим показателем риска заболеваний, их прогрессирования и преждевременной смертности, а также характеристикой снижения выживаемости у пациентов с ишемической болезнью сердца и инфекционными заболеваниями.
5. Измерение активности теломеразы может обеспечить более ранний прогноз геномной стабильности долгосрочной жизнеспособности, чем длина теломер.
6. Оценка различных аспектов состояния теломер может помочь в прогнозировании течения различных заболеваний и предоставить новые возможности для профилактических и терапевтических вмешательств, в т. ч. временной активации эндогенной теломеразы.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 5 (426), березень 2018 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Компанія Berlin Chemie глибоко засмучена трагічною ситуацією в Україні, руйнуванням і жертвами серед мирного населення. Ми категорично засуджуємо всі акти агресії в Україні та світі, докладаємо значних зусиль для допомоги в розв’язанні гуманітарної кризи та забезпеченні доступу пацієнтів до лікарських засобів. .
При складанні плану ведення пацієнта з хронічним болем старшої вікової групи слід розглянути можливість комбінованого застосування фармакологічного та нефармакологічного втручань. Вибір лікарських засобів для фармакологічного контролю болю в осіб старших вікових груп потребує суворого персоніфікованого підходу.
В Україні розпочали роботу мобільні медичні команди (ММК) україно-швейцарського проєкту «Діємо для здоров’я», створені за фінансової підтримки Швейцарської агенції з розвитку та співробітництва та за технічної допомоги Університетського госпіталю Женеви. ММК працюватимуть над забезпеченням гострих медичних і психологічних потреб цивільного населення в чотирьох цільових областях проєкту – Полтавській, Дніпропетровській, Львівській та Рівненській. Потреба в такій допомозі виникла з початком повномасштабної війни росії проти України, коли пацієнти залишилися без доступу до життєво необхідних ліків, медичної допомоги та були змушені переривати лікування. .
Жиророзчинний вітамін К, вперше виявлений Карлом Петером Генріком під час дослідження зсідання крові, було названо першою літерою німецького терміна «коагуляція» (Raju T., 1999). Зазначені особливості його відкриття зумовили виникнення хибного ставлення до вітаміну К як до речовини, потрібної виключно для забезпечення гемостазу.
Читайте также:
