Галактоземия. Врожденные нарушения обмена аминокислот
Добавил пользователь Alex Обновлено: 30.01.2026
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Галактоземия: причины появления, симптомы, диагностика и способы лечения.
Определение
Галактоземия – группа наследственных нарушений обмена углеводов, вызывающих в организме накопление избытка галактозы и ее метаболитов. Галактоза (от греч. galaktos – молоко) – это моносахарид, который входит в состав лактозы (молочного сахара) и содержится во всех молочных продуктах, включая грудное молоко.
В течение дня люди потребляют продукты, содержащие лактозу, из которой в кишечнике в результате гидролиза образуется галактоза.
Кроме того, галактоза может образовываться эндогенным путем, и подавляющее ее количество синтезируется в процессе ферментативных реакций.
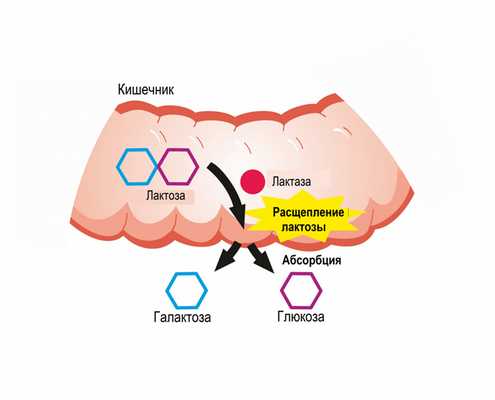
В норме молочный сахар, поступающий в организм человека, расщепляется на глюкозу и галактозу, затем галактоза всасывается и в печени превращается в глюкозу под воздействием ферментов.
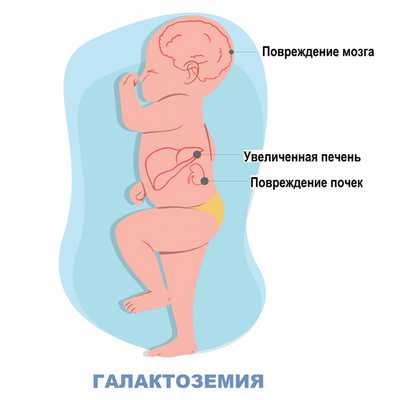
В основе галактоземии лежит недостаточность одного из трех ферментов, участвующих в метаболизме галактозы: галактозо-1-фосфатуридилтраснферазы (ГАЛТ), галактокиназы (ГАЛК) или уридин-дифосфат-галактозо-4-эпимиразы (ГАЛЭ). Из-за мутации в генах, отвечающих за синтез этих ферментов, у больных галактоземией они не вырабатываются, вследствие чего в организме накапливается избыток галактозы и ее производных – метаболитов. Это оказывает токсический эффект и приводит к повреждению органов и тканей (печени, глаз, центральной нервной системы).
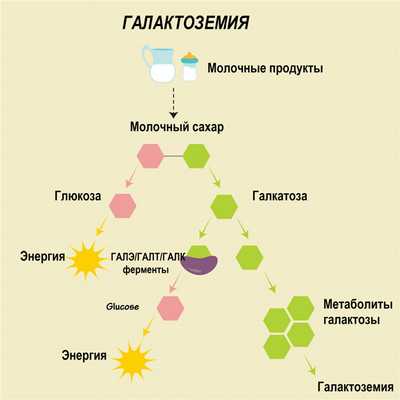
Патологические процессы обусловлены не только токсическим воздействием, но и гипогликемическим синдромом, вызванным недостаточной активностью других ферментов, участвующих в углеводном обмене.
При галактоземии в организме больного кроме галактозы может накапливаться галактозо-1-фосфат. Кроме этого, в отсутствии необходимых ферментов метаболизм галактозы протекает иначе: она превращается в галактитол. У больных всегда наблюдается накопление галактитола в крови и тканях и повышение его выделения с мочой.
Галактоземия всегда наследуется по аутосомно-рецессивному типу. Дефектный ген появляется, когда у ребенка оба родителя являются носителями заболевания. Если оба родителя здоровы, но имеют копию гена с мутацией, галактоземия у ребенка проявится с вероятностью 25%, а в 50% случаев ребенок будет просто носителем генного дефекта.
Классификация заболевания
Выделяются следующие варианты заболевания:
- I тип – классическая галактоземия – обусловлена дефицитом фермента ГАЛТ. Вариант классической галактоземии – форма Дуарте. Это более легкая форма, активность фермента ГАЛТ при таком варианте может достигать 25%, а иногда и выше;
- II тип – недостаточность галактокиназы – характеризуется мутацией в гене, кодирующем фермент ГАЛК;
- III тип – дефицит эпимеразы – характеризуется мутацией в гене, кодирующем фермент ГАЛЭ. Выделяют доброкачественный и тяжелый фенотипы. Легкая форма считается доброкачественной и связана с дефицитом фермента только в циркулирующих клетках крови. При тяжелой форме недостаточность фермента наблюдается во всех тканях организма.
В зависимости от степени тяжести выделяются такие виды заболевания:
- легкий тип, который обычно диагностируется случайно и проявляется непереносимостью молока;
- средний тип – симптомы появляются сразу после кормления грудным молоком либо молочными смесями;
- тяжелый тип – характеризуется серьезными поражениями органов и тканей.
При галактоземии симптомы отличаются в зависимости от степени тяжести заболевания. Если болезнь протекает легко, то может наблюдаться плохая переносимость молока и достаточно ранний отказ ребенка от грудного вскармливания.
При классической галактоземии в течение нескольких дней или недель потребления грудного молока или продуктов, содержащих лактозу, у ребенка могут появиться:
- симптомы отравления: тошнота, рвота, диарея, вялость;
- быстрое снижение веса;
- желтуха и гепатомегалия, свидетельствующие о развитии поражения печени;
- скопление жидкости в брюшной полости;
- мышечные судороги;
- непроизвольные движения глазных яблок;
- снижение тонуса мышц;
- отставание в физическом и психическом развитии;
- катаракта;
- кровоточивость, связанная с гипокоагуляцией (нарушением свертываемости крови);
- в редких случаях – гемолитическая анемия;
- геморрагическая сыпь на коже в результате повреждения стенок сосудов;
- отеки в результате нарушения функции почек.
Пациенты с вариантом Дуарте имеют более легкие проявления, включающие желтуху, увеличение печени и задержку физического развития.
У пациентов с дефицитом галактокиназы (галактоземия типа II) основным симптомом является катаракта из-за образования галактитола, который повреждает волокна хрусталика. Идиопатическая внутричерепная гипертензия (псевдоопухоль мозга) встречается редко. Симптомы выражены слабее, чем при классической галактоземии.
При дефиците эпимеразы (галактоземия типа III) доброкачественная форма заболевания ограничивается изменениями в эритроцитах и лейкоцитах и не вызывает каких-либо клинических проявлений. Симптомы при тяжелой форме те же, что и при классической галактоземии, но иногда присоединяется потеря слуха.
Диагностика галактоземии
Диагноз классической галактоземии обычно ставится в течение первой недели жизни ребенка по анализу крови в рамках стандартного скрининга новорожденных. Уровень тотальной галактозы (сумма концентраций галактозы и галактозы-1-фосфата) в сыворотке крови не должен превышать 7,2 мг/дл. Если показатели выше, проводят подтверждающую диагностику:
- определение активности фермента ГАЛТ;
- ДНК исследование состоит из двух этапов:
Синонимы: Анализ кала на углеводы; Содержание сахаров в кале; Анализ на содержание углеводов в кале. Fecal sugar; Reducing Substance, Feces; Stool sugar; Reducing substances faeces; Stool (or faecal) reducing subs.
Галактоземия
Галактоземия - наследственная ферментопатия, характеризующаяся нарушением нормального процесса углеводного обмена, а именно – метаболизма галактозы. Признаками галактоземии являются непереносимость грудного молока и молочных смесей, рвота, анорексия, гипотрофия, желтуха, цирроз печени, спленомегалия, отеки, катаракта, задержка психомоторного развития. Скрининг на галактоземию проводится всем новорожденным; дополнительное обследование включает определение уровня галактозы в крови и моче, проведение нагрузочных проб с галактозой и глюкозой, генетическое тестирование, УЗИ брюшной полости, ЭЭГ и др. Основу терапии галактоземии составляет безлактозная диета, назначаемая с первых дней жизни ребенка.

Общие сведения
Галактоземия – наследственная патология обмена веществ, обусловленная недостаточностью активности ферментов, принимающих участие в метаболизме галактозы. Неспособность организма утилизировать галактозу приводит к тяжелым поражениям пищеварительной, зрительной и нервной системы детей в самом раннем возрасте. В педиатрии и генетике галактоземия относится к редким генетическим заболеваниям, встречающимся с частотой один случай на 10 000 - 50 000 новорожденных.
Впервые клиника галактоземии была описана в 1908 году у ребенка, страдавшего сильным истощением, гепато- и спленомегалией, галактозурией; при этом заболевание исчезло сразу после отмены молочного питания. Позднее, в 1956 г. ученый Герман Келкер определил, что в основе заболевания лежит нарушение метаболизма галактозы.

Причины галактоземии
Галактоземия является врожденной патологией, наследуемой по аутосомно-рецессивному типу, т. е. заболевание проявляется только в том случае, если ребенок наследует две копии дефектного гена от каждого из родителей. Лица, гетерозиготные по мутантному гену, являются носителями заболевания, однако у них тоже могут развиваться отдельные признаки галактоземии в легкой степени.
Превращение галактозы в глюкозу (метаболический путь Лелуара) происходит при участии 3-х ферментов: галактоза-1-фосфатуридилтрансферазы (GALT), галактокиназы (GALK) и уридиндифосфат-галактозо-4-эпимеразы (GALE). В соответствии с дефицитом этих ферментов различают 1 (классический вариант), 2 и 3 тип галактоземии.
Выделение трех типов галактоземии не совпадает с порядком действия ферментов в процессе метаболического пути Лелуара. Галактоза поступает в организм с пищей, а также образуется в кишечнике в процессе гидролиза дисахарида лактозы. Путь метаболизма галактозы начинается с ее превращения под действием фермента GALK в галактозо-1-фосфат. Затем при участии фермента GALT галактозо-1-фосфат преобразуется в УДФ-галактозу (уридилдифосфогалактозу). После этого с помощью GALE метаболит превращается в УДФ – глюкозу (уридилдифосфоглюкозу).
При недостаточности одного из названных ферментов (GALK, GALT или GALE) концентрация галактозы в крови значительно повышается, в организме накапливаются промежуточные метаболиты галактозы, которые вызывают токсическое поражение различных органов: ЦНС, печени, почек, селезенки, кишечника, глаз и др. Нарушение метаболизма галактозы и составляет суть галактоземии. Наиболее часто в клинической практике встречается классический (1 тип) галактоземии, обусловленный дефектом фермента GALT и нарушением его активности. Ген, кодирующий синтез галактоза-1-фосфатуридилтрансферазы, находится в околоцентромерном участке 2-ой хромосомы.
Симптомы галактоземии
По тяжести клинического течения выделяют тяжелую, среднюю и легкую степени галактоземии.
Первые клинические признаки галактоземии тяжелой степени развиваются очень рано, в первые дни жизни ребенка. Вскоре после кормления новорожденного грудным молоком или молочной смесью возникает рвота и расстройство стула (водянистый понос), нарастает интоксикация. Ребенок становится вялым, отказывается от груди или бутылочки; у него быстро прогрессируют гипотрофия и кахексия. Ребенка могут беспокоить метеоризм, кишечные колики, обильное отхождение газов.
В процессе обследования ребенка с галактоземией неонатологом выявляется угасание рефлексов периода новорожденности. При галактоземии рано появляется стойкая желтуха различной степени выраженности и гепатомегалия, прогрессирует печеночная недостаточность. К 2-3 месяцу жизни возникают спленомегалия, цирроз печени, асцит.
Нарушения процессов свертывания крови приводит к появлению кровоизлияний на коже и слизистых оболочках. Дети рано начинают отставать в психомоторном развитии, однако степень интеллектуальных нарушений при галактоземии не достигает такой тяжести, как при фенилкетонурии. К 1-2 месяцам у детей с галактоземией выявляется двусторонняя катаракта. Поражение почек при галактоземии сопровождается глюкозурией, протеинурией, гипераминоацидурией. В терминальной фазе галактоземии ребенок погибает от глубокого истощения, тяжелой печеночной недостаточности и наслоения вторичных инфекций.
При галактоземии средней тяжести также отмечается рвота, желтуха, анемия, отставание в психомоторном развитии, гепатомегалия, катаракта, гипотрофия. Галактоземия легкой степени характеризуется отказом от груди, рвотой после приема молока, задержкой речевого развития, отставанием ребенка в массе и росте. Однако даже при легком течении галактоземии продукты обмена галактозы токсическим образом воздействуют на печень, приводя к ее хроническим заболеваниям.
Галактоземия может протекать в моносимптомной форме, при которой обнаруживается только поражение ЦНС, катаракта или диспепсические расстройства. Описан вариант бессимптомной (асимптоматической) галактоземии Дюарте, при которой недостаточность ферментов выявляется только при биохимическом исследовании крови.
Осложнения галактоземии включают цирроз печени, сепсис, кровоизлияния в стекловидное тело, первичную аменорею, синдром истощения яичников. При галактоземии у 50% детей дошкольного возраста выявляется моторная алалия, характеризующаяся трудностью организации и координации речевых движений, бедностью словарного запаса, обилием парафазий и персевераций при сохранном понимании обращенной речи.
Диагностика
Для снижения риска развития осложнений при галактоземии необходимо как можно более раннее выявление патологии. Возможна пренатальная диагностика галактоземии, включающая проведение биопсии хориона, амниоцентеза с последующим исследованием ворсин и амниотической жидкости. В России, согласно современным стандартам, осуществляется скрининг новорожденных на следующие наследственные заболевания: фенилкетонурию, врожденный гипотиреоз, галактоземию, адрено-генитальный синдром и муковисцидоз. Неонатальный скрининг проводится на 3-5 сутки у доношенных детей и 7-10 сутки – у недоношенных. С этой целью производится забор капиллярной крови, которая переносится на фильтровальную бумагу и виде высушенных пятен отправляется в генетическую лабораторию.
Если при неонатальном скрининге у ребенка выявляется подозрение на галактоземию, проводится повторное решающее тестирование. В случае повторного обнаружения высокого уровня галактозы в крови или низкого уровня исследуемого фермента, ребенку устанавливается диагноз галактоземии. Сведения о таком ребенке сообщаются участковому педиатру, а семья новорожденного приглашается на консультацию генетика в медико-генетическую консультацию. Врач-генетик проводит подробный анализ родословной, выполняет генетическое тестирование для выявления мутантного гена, объясняет специфику питания ребенка с галактоземией.
Иногда для диагностики галактоземии прибегают к определению уровня галактозы в моче, проведению нагрузочных проб с галактозой и глюкозой. Мониторинг биохимических показателей крови и общего анализа крови и мочи при галактоземии позволяет определить степень повреждения внутренних органов (почек, печени и др.).
Дети с галактоземией нуждаются в консультации детского невролога, детского офтальмолога, проведении электроэнцефалографии, УЗИ органов брюшной полости, биомикроскопии глаза. В некоторых случаях показана пункционная биопсия печени. Галактоземию следует дифференцировать от других гликогенозов, сахарного диабета I типа, врожденной атрезии желчных протоков, гепатита, гемолитической болезни новорожденных.
Лечение галактоземии
Основная роль в лечении галактоземии принадлежит диетотерапии. Особенность питания при галактоземии заключается в пожизненном исключении из рациона продуктов, содержащих лактозу и галактозу: любого молока (женского, коровьего, козьего, детских молочных смесей, низколактозных смесей и пр.), всех молочных продуктов, хлеба, выпечки, колбас, конфет, маргаринов и др. При галактоземии запрещается употребление растительных и животных продуктов, содержащих потенциальные источники галактозы - галактозиды (бобовые, соя) и нуклеопротеины (почки, печень, яйца и др.).
Дети, страдающие галактоземией, обеспечиваются специальными смесями на основе изолята соевого белка, гидролизата казеина, синтетических аминокислот, а также безлактозными казеинпредоминантными молочными смесями. С 4-х месячного возраста вводятся фруктовые и ягодные соки; с 4,5 месяцев - фруктовое пюре; с 5 месяцев – овощное пюре; с 5,5 месяцев – безмолочные каши из кукурузной, гречневой или рисовой муки в разведении специализированной смесью; с 6 месяцев - мясной прикорм на основе мяса кролика, цыпленка, индейки, говядины; с 8 месяцев – рыба. Альтернативным источником углеводов для пациентов с галактоземией служат продукты на основе фруктозы.
Для улучшения метаболических процессов назначаются поливитамины, кокарбоксилазу, АТФ, оротат калия. Лицам с галактоземией противопоказан прием спиртовых настоек и гомеопатических препаратов, поскольку последние содержат лактозу. Дети с речевыми нарушениями нуждаются в консультации логопеда и целенаправленной работе по коррекции ОНР.
Прогноз и профилактика галактоземии
Лечение галактоземии, начатое с первых дней жизни позволяет избежать развития цирроза, катаракты, олигофрении. Если лечение начато в более поздние сроки, когда уже произошло поражение печени и ЦНС, с помощью рациональной диетотерапии прогрессирование заболевания можно замедлить. При тяжелых формах галактоземии может быть летальный исход. Диспансерное наблюдение ребенка с галактоземией осуществляется педиатром, генетиком, диетологом, детским окулистом и детским неврологом. Детям с галактоземией присваивается инвалидность.
Учитывая наследственную обусловленность галактоземии, медико-генетическое консультирование рекомендуется пройти будущим родителям, в чьих семьях есть родственники или дети с данным заболеванием. Беременным с высоким риском рождения ребенка с галактоземией, следует ограничить употребление молочных продуктов.
Фенилкетонурия ( Болезнь Феллинга , Фенилпировиноградная олигофрения )
Фенилкетонурия – это наследственное нарушение аминокислотного обмена, обусловленное недостаточностью печеночных ферментов, участвующих в метаболизме фенилаланина до тирозина. Ранними признаками фенилкетонурии служат рвота, вялость или гиперактивность, запах плесени от мочи и кожи, задержка психомоторного развития; типичные поздние признаки включают олигофрению, отставание в физическом развитии, судороги, экзематозные изменения кожи и др. Скрининг новорожденных на фенилкетонурию проводится еще в родильном доме; последующая диагностика включает молекулярно-генетическое тестирование, определение концентрации фенилаланина в крови, биохимический анализ мочи, ЭЭГ, МРТ головного мозга. Лечение фенилкетонурии заключается в соблюдении специальной диеты.
МКБ-10
Фенилкетонурия (болезнь Феллинга, фенилпировиноградная олигофрения) – врожденная, генетически обусловленная патология, характеризующаяся нарушением гидроксилирования фенилаланина, накоплением аминокислоты и ее метаболитов в физиологических жидкостях и тканях с последующим тяжелым поражением ЦНС. Фенилкетонурия впервые описана А. Феллингом в 1934 г.; встречается с частотой 1 случай на 10 000 новорожденных.
В неонатальном периоде фенилкетонурия не имеет клинических проявлений, однако поступление фенилаланина с пищей вызывает манифестацию заболевания уже в первом полугодии жизни, а в дальнейшем приводит к тяжелым нарушениям развития ребенка. Именно поэтому пресимптоматическое выявление фенилкетонурии у новорожденных является важнейшей задачей неонатологии, педиатрии и генетики.
Причины фенилкетонурии
Фенилкетонурия является заболеванием с аутосомно-рецессивным характером наследования. Это означает, что для развития клинических признаков фенилкетонурии ребенок должен унаследовать по одной дефектной копии гена от обоих родителей, являющихся гетерозиготными носителями мутантного гена.
Чаще всего к развитию фенилкетонурии приводит мутация гена, кодирующего фермент фенилаланин-4-гидроксилазу и расположенного на длинном плече 12 хромосомы (локус12q22-q24.1). Это, так называемая, классическая фенилкетонурия I типа, составляющая 98% всех случаев заболевания. Гиперфенилаланинемия может достигать 30 мг% и выше. При отсутствии лечения данный вариант фенилкетонурии сопровождается глубокой умственной отсталостью.
Кроме классической формы, различают атипичные варианты фенилкетонурии, протекающие с той же клинической симптоматикой, но не поддающиеся коррекции диетотерапией. К ним относятся фенилкетонурия II типа (недостаточность дегидроптеринредуктазы), фенилкетонурия III типа (дефицит тетрагидробиоптерина) и другие, более редкие варианты. Вероятность рождения ребенка, больного фенилкетонурией, повышается при заключении близкородственных браков.
Патогенез
В основе классической формы фенилкетонурии лежит недостаточность фермента фенилаланин-4-гидроксилазы, участвующего в конверсии фенилаланина в тирозин в митохондриях гепатоцитов. В свою очередь, производный тирозина – тирамин является исходным продуктом для синтеза катехоламинов (адреналина и норадреналина), а дийодтирозин – для образования тироксина. Кроме этого, результатом метаболизма фенилаланина служит образование пигмента меланина.
Наследственная недостаточность фермента фенилалаиин-4-гидроксилазы при фенилкетонурии приводит к нарушению окисления фенилаланина, поступающего с пищей, в результате чего его концентрация в крови (фенилаланинемия) и спинномозговой жидкости значительно возрастает, а уровень тирозина соответственно падает. Избыточное содержание фенилаланина устраняется путем повышенной экскреции с мочой его метаболитов - фенилпировиноградной, фенилмолочной и фенилуксусной кислот.
Нарушение обмена аминокислот сопровождается нарушением миелинизации нервных волокон, снижением образования нейромедиаторов (дофамина, серотонина и др.), запускающими патогенетические механизмы задержки умственного развития и прогредиентное слабоумие.
Симптомы фенилкетонурии
Новорожденные с фенилкетонурией не имеют клинических признаков заболевания. Обычно манифестация фенилкетонурии у детей происходит в возрасте 2-6 месяцев. С началом кормления в организм ребенка начинает поступать белок грудного молока либо его заменителей, что приводит к развитию первых, неспецифических симптомов – вялости, иногда – беспокойства и гипервозбудимости, срыгивания, мышечной дистонии, судорожного синдрома. Одним из ранних патогномоничных признаков фенилкетонурии служит упорная рвота, которая нередко ошибочно расценивается как проявление пилоростеноза.
Ко второму полугодию становится заметным отставание ребенка в психомоторном развитии. Ребенок становится менее активным, безучастным, перестает узнавать близких, не пытается садиться и вставать на ножки. Аномальный состав мочи и пота обусловливают характерный «мышиный» запах (запах плесени), исходящий от тела. Часто наблюдается шелушение кожи, дерматиты, экзема, склеродермия.
У детей с фенилкетонурией, не получающих лечения, выявляется микроцефалия, прогнатия, позднее (после 1,5 лет) прорезывание зубов, гипоплазия эмали. Отмечается задержка речевого развития, а к 3-4 годам выявляется глубокая олигофрения (идиотия) и практически полное отсутствие речи.
Дети с фенилкетонурией имеют диспластическое телосложение, нередко - врожденные пороки сердца, вегетативные дисфункции (потливость, акроцианоз, артериальную гипотонию), страдают запорами. К фенотипическим особенностям детей, страдающих фенилкетонурией, следует отнести светлую кожу, глаза и волосы. Для ребенка с фенилкетонурией характерны специфическая поза «портного» (согнутые в суставах верхние и нижние конечности), тремор рук, шаткая, семенящая походка, гиперкинезы.
Клинические проявления фенилкетонурии II типа характеризуются тяжелой степенью умственной отсталости, повышенной возбудимостью, судорогами, спастическим тетрапарезом, сухожильной гиперрефлексией. Прогрессирование заболевание может приводить к гибели ребенка в возрасте 2-З лет. При фенилкетонури III типа развивается триада признаков: микроцефалия, олигофрения, спастический тетрапарез.
В настоящее время диагностика фенилкетонурии (а также галактоземии, врожденного гипотиреоза, адрено-генитального синдрома и муковисцидоза) входит в программу неонатального скрининга, осуществляемого всем новорожденным. Основные и дополнительные методы диагностики:
- Скрининг-тест. Проводится на 3-5 день жизни доношенного и 7 день жизни недоношенного ребенка путем забора образца капиллярной крови на специальный бумажный бланк. При обнаружении гиперфенилаланемии более 2,2 мг% ребенка направляют к детскому генетику для повторного обследования.
- Биохимические исследования. Для подтверждения диагноза фенилкетонурии проверяется концентрация фенилаланина и тирозина в крови, определяют активность печеночных ферментов (фенилаланингидроксилазы), выполняется биохимическое исследование мочи (определение кетоновых кислот), метаболитов катехоламинов в моче и др.
- Неврологическое обследование. Дополнительно проводится ЭЭГ и МРТ головного мозга, осмотр ребенка детским неврологом.
- Пренатальная диагностика. Генетический дефект при фенилкетонурии может быть обнаружен еще на этапе беременности в ходе инвазивной пренатальной диагностики плода (хорионбиопсии, амниоцентеза, кордоцентеза). В остальных случаях окончательный диагноз выставляется по результатам ДНК-диагностики после рождения.
Дифференциальный диагноз фенилкетонурии проводят с внутричерепной родовой травмой новорожденных, внутриутробными инфекциями, другими нарушениями обмена аминокислот.
Лечение фенилкетонурии
Основополагающим фактором в лечении фенилкетонурии является соблюдение диеты, ограничивающей поступление белка в организм. Лечение рекомендуется начинать при концентрации фенилаланина >6 мг%. Для грудных детей разработаны специальные смеси - Афенилак, Лофенилак; для детей старше 1 года – Тетрафен, Фенил-фри; старше 8 лет - Максамум-ХР и др. Основу диеты составляют низкобелковые продукты - фрукты, овощи, соки, белковые гидролизаты и аминокислотные смеси. Расширение диеты возможно после 18 лет в связи с возрастанием толерантности к фенилаланину. В соответствии с российским законодательством обеспечение лиц, страдающих фенилкетонурией, лечебным питанием, должна осуществляться бесплатно.
Больным назначается прием минеральных соединений, витаминов группы В и др.; по показаниям - ноотропные средства, антиконвульсанты. В комплексной терапии фенилкетонурии широко используется общий массаж, ЛФК, иглорефлексотерапия. Атипичные формы фенилкетонурии, не поддающиеся лечению диетой, требуют назначения гепатопротекторов, противосудорожных средств, заместительной терапии леводопой, 5-гидрокситриптофаном.
Дети, страдающие фенилкетонурией, находятся под наблюдением участкового педиатра и психоневролога; нередко нуждаются в помощи логопеда и дефектолога. Необходим тщательный мониторинг нервно-психического статуса детей, контроль уровня фенилаланина в крови и показателей электроэнцефалограммы.
Прогноз и профилактика
Проведения массового скрининга на фенилкетонурию в неонатальном периоде позволяет организовать раннюю диетотерапию и предотвратить тяжелые церебральные повреждения, нарушения функции печени. При раннем назначении элиминационной диеты при классической фенилкетонурии прогноз развития детей хороший. При поздно начатом лечении прогноз в отношении умственного развития неблагоприятный.
Профилактика осложнений фенилкетонурии заключается в проведении массового скрининга новорожденных, раннего назначения и длительного соблюдения диетического питания.
С целью оценки риска рождения ребенка с фенилкетонурией предварительное генетическое консультирование должны пройти супружеские пары, уже имеющие больного ребенка, состоящие в кровнородственном браке, имеющие родственников с данным заболеванием. Женщины с фенилкетонурией, планирующие беременность, должны соблюдать строгую диету до зачатия и во время беременности для исключения повышения уровня фенилаланина и его метаболитов и нарушения развития генетически здорового плода. Риск рождения ребенка с фенилкетонурией у родителей-носителей дефектного гена, составляет 1:4.
Нарушения обмена галактозы
Галактоземия (ГАЛ) – группа наследственных нарушений обмена углеводов, при котором в организме накапливается избыток галактозы и ее метаболитов, что обусловливает клиническую картину заболевания и формирование отсроченных осложнений. Тип наследования всех форм галактоземии - аутосомно-рецессивный.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
E74.2 - Нарушения обмена галактозы (Недостаточность галактокиназы. Галактоземия)

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
В зависимости от дефекта одного из трех основных ферментов, участвующих в обмене галактозы выделяют три типа ГАЛ:
I. Классический - галактоземия I типа, обусловленная дефицитом фермента галактозо-1-фосфат-уридилтрансферазы (ГАЛТ) и наличием гомозиготных или компаунд-гетерозиготных мутаций в гене GALT (G/G). Отдельно выделяют вариант Дуарте (D/D) и галактоземию- Дуарте (G/D), при которых полиморфный вариант находится в гомозиготном состоянии или компаунд-гетерозиготном состоянии с патогенной мутацией.
Этиология и патогенез
Галактоза (от греческого слова galaktos - молоко) - моносахарид из группы гексоз, изомер глюкозы. Несмотря на большое сходство молекул глюкозы и галактозы, превращение последней в глюкозу требует нескольких ферментативных реакций, которые протекают в цитоплазме клетки (рис. 1). Галактоза имеет важнейшее значение для роста и развития организма и является компонентом грудного молока.
Галактоза не только является значимым источником энергии для клетки, она играет важную пребиотическую роль, служит необходимым пластическим материалом для образования гликопротеидов, гликолипидов и других сложных соединений, используемых организмом для формирования клеточных мембран, нервной ткани, процессов миелинизации нейронов и др. Нарушение метаболизма галактозы, наблюдаемое при галактоземии, неизбежно приводит к расстройству функционирования многих органов и систем организма.
Большое количество потребляемых в течение дня пищевых продуктов (в первую очередь молочные продукты) содержат лактозу, из которой в кишечнике в результате гидролиза образуется галактоза; некоторые продукты питания содержат галактозу в чистом виде. У человека галактоза может образовываться эндогенным путем, подавляющее ее количество синтезируется в процессе ферментативных реакций между уридиндифосфатглюкозой (УДФ-глюкозой) и УДФ-галактозой, а также в процессе обмена гликопротеинов и гликолипидов.
Галактоземия относится к наследственным болезням углеводного обмена и объединяет несколько генетических форм заболеваний. Галактоземия тип I (ГАЛ I) обусловлена мутациями в гене GALT, картированном на 9p13.3, что приводит к дефициту галактозо-1-фосфатуридилтрансферазы (ГАЛТ). Галактоземия тип II (ГАЛ II) обусловлена мутациями в гене GALK1, картированном на 17q25.1, что приводит к дефициту галактокиназы (ГАЛК). Галактоземия тип III (ГАЛ III) обусловлена мутациями в гене GALE, картированном на 1р36.11, что приводит к дефициту уридин-дифосфат (УДФ)-галактозо-4-эпимеразы (ГАЛЭ) (рис 1).
В результате недостаточности любого из трех ферментов – ГАЛТ, ГАЛК или ГАЛЭ – в крови повышается концентрация галактозы. При снижении активности ферментов ГАЛТ и ГАЛЭ, помимо избытка галактозы, в организме пациента накапливается также избыточное количество галактозо-1-фосфата, что на сегодняшний день считается основным патогенетическим фактором, обусловливающим большинство клинических проявлений ГАЛ и формирование отсроченных осложнений. Избыток галактозы в организме может метаболизироваться в других биохимических путях: она может превращаться в галактитол. Накопление галактитола в крови и тканях и повышение его экскреции с мочой наблюдается при всех формах ГАЛ; в хрусталике глаза избыток галактитола способствует формированию катаракты. Имеются сведения о том, что высокое содержание галактитола в тканях мозга способствует набуханию нервных клеток и формированию псевдоопухоли мозга у отдельных пациентов.
Патологические процессы при ГАЛ обусловлены не только токсическим действием указанных продуктов, но и их тормозящим влиянием на активность других ферментов, участвующих в углеводном обмене (фосфоглюкомутазы, глюкозо-6-фосфатдегидрогеназы), следствием чего является гипогликемический синдром. Предполагается также, что предрасположенность к сепсису у новорожденных с ГАЛ тип I обусловлена ингибированием бактерицидной активности лейкоцитов.
Наиболее частой формой ГАЛ является ГАЛ I. Ген GALT состоит из 11 экзонов, охватывающих 4,3 т.п.н. хромосомы 9p13. В базе данных по мутациям человека Human Genetic Mutaton Database (HGMD Professional, Version 2020.3) описано 346 патогенных вариантов в гене GALT [47]. К наиболее распространенным патогенным вариантам относятся две мутации: c.563A>G (p.Q188R) и c.855G>T (p.K285N), обуславливающие развитие ГАЛ I. Среди пациентов европейского происхождения наиболее частой является мутация c.563A> G (p.Q188R), составляющая 64% всех наблюдаемых патогенных вариантов. Вариант c.404C> T (p.S135L) связан с «мягким» фенотипом ГАЛ I и встречается почти исключительно у пациентов африканского происхождения. Другие распространенные патогенные варианты включают: c.855G> T (p.K285N), c.626A> G (p.Y209C), c.413C> T (p.T138M), c.584T> C (p.L195P) и IVS2-2А> G. У евреев-ашкенази часто встречается делеция размером около 5,5 kb. Все эти варианты связаны с почти или полной потерей активности фермента.
Галактоземии II типа (ГАЛ II) обусловлена мутациями в гене GALK1, картированном на 17q25.1. Описано около 50 мутаций, частых мутаций не описано. Известна одна мутация, p.P28T, которая часто встречается у цыган [17].
Галактоземия тип III (ГАЛ III) обусловлена мутациями в гене GALE, картированном на 1р36.11. Одна из самых редких форм ГАЛ. Известно около 30 мутаций, частых мутаций не описано.
Нарушение обмена серосодержащих аминокислот (гомоцистинурия) у детей
Гомоцистинурия (ГЦУ) – гетерогенная группа наследственных болезней обмена веществ, относящаяся к аминоацидопатиям, обусловленная нарушением метаболизма серосодержащих аминокислот, в первую очередь метионина. Их общие проявления – повышение уровня общего гомоцистеина (tHcy), при том, что аминокислотный профиль при разных формах ГЦУ значительно отличается.
Выделяют несколько форм гомоцистинурии, из которых частой является классическая ГЦУ, которая обусловлена мутациями в гене CBS, и характеризуется признаками поражения соединительной ткани (астеническое телосложение, деформация грудной клетки, кифосколиоз, подвывих хрусталика, миопия, грыжи и др.), тромбозами, снижением интеллекта и психиатрической симптоматикой. Также известны другие формы гомоцистинурии, которые проявляются патологией нервной системы с вариабельным возрастом манифестации и/или других систем [1–4].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
- Гомоцистинурия, обуcловленная нарушением транссульфурации (классическая гомоцистинурия, подразделяющаяся на В6-чувствительную и В6-резистентную)
- Гомоцистинурия, обусловленная нарушением реметилирования
Выделяют несколько форм заболевания в зависимости от первичного биохимического и молекулярно-генетического дефекта.
Нарушение пути транссульфурации (классическая гомоцистинурия: В6 –зависимая форма гомоцистинурии или В6 –резистентная форма) или нарушения в процессе реметилирования метионина.
Гомоцистеин превращается в метионин в процессе, известном как реметилирование, при участии витамина B12. Впоследствии метионин может расщепляться до S-аденозилметионина, который преобразовывается в гомоцистеин. В реакции, называемой транссульфурацией, гомоцистеин превращается в цистеин, катализируемый пиридоксаль-5'-фосфатом (PLP) и цистатион-β-синтазы. Повышение уровня tHcy предполагает нарушение одного из компонентов этой реакции.
Гомоцистинурия I или классическая форма заболевания вызвана дефицитом фермента цистатион-β-синтазы (CbS), участвующего в преобразовании метионина в цистеин, проявляется при наличии гомозиготных или компаунд-гетерозиготных мутаций в гене CBS, локализованном на длинном плече хромосомы 21 (21q22). Тип наследования аутосомно – рецессивный [4].
При классической ГЦУ вследствие недостаточности цистатион-β-синтазы нарушается цикл преобразования серосодержащей аминокислоты метионина.
Накопление tHcy приводит к активации фактора Хагемана, способствуя процессу тромбообразования. Также гипергомоцистеинемия является причиной эндотелиальной дисфункции из-за снижения биодоступности эндогенного вазодилататора -оксида азота и окислительного стресса. Эти изменения нарушают стабильность артериальной стенки и являются причиной интраартериальных тромбозов, продольных надрывов стенки артерий с проникновением крови из просвета артерии в еѐ стенку с формированием в последней интрамуральной гематомы и артериопатии, повышая предрасположенность к возникновению инсультов [4–6].
Имеются также данные, свидетельствующие об изменении обмена соединительной ткани у пациентов с ГЦУ. Повышение концентрации гомоцистеина приводит к нарушению сшивания сульфгидрильных групп в белках, таких как эластин, что объясняет дислокацию хрусталика и скелетные аномалии [7,8].
Фермент цистатион-β-синтаза (CbS) является пиридоксин (витамин В6) зависимым ферментом, поэтому в классической ГЦУ выделяют В6-чувствительную и В6-резистентную формы заболевания. Возможно также нарушение активности следующего фермента в этой метаболической цепи – цистатионазы (Приложение А3.3),
Другие формы ГЦУ связаны с генетически детерминированными дефектами реметилирования метионина, возникающими вследствие нарушения активности метионин синтазы редуктазы, которая катализирует реметилирование гомоцистеина в метионин, некоторыми дефектами синтеза кобаламина и нарушением активности фермента N(5,10)-метилентетрагидрофолатредуктазы (MTHFR). Указанные формы сопровождаются не повышением, а снижением концентрации метионина в крови [1].
Некоторые генетические нарушения внутриклеточного транспорта и процессинга кобаламина (cbl) (cblC, cblD, cblF и cblJ) вызывают недостаточный синтез не только метилкобаламина, но и аденозилкобаламина, кофактора метилмалонил-КоА мутазы. Эти комбинированные нарушения реметилирования связаны с повышенным содержанием tHcy и метилмалоновой кислоты (ММК) [9].
В данных клинических рекомендациях рассматривается подробно классическая гомоцистинурия, и вариант связанный с дефицитом MTHFR, а формы метилмалоновой ацидурии с гомоцистинурией, более подробно рассматриваются в клинических рекомендациях по метилмалоновой ацидурии, поскольку подходы к их терапии отличаются от ГЦУ.
Эпидемиология
Средняя частота классической ГЦУ по данным литературы составляет в среднем 1:100000-1:200000, варьируя от 1:1800 до 1:900000 в зависимости от этнической принадлежности [10]. Наиболее распространено данное заболевание в Катаре. с частотой носительства примерно 2% [11,12].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания варьирует от легких до тяжелых форм, манифестирующих на первом году жизни. Выделяют В6-чувствительную и В6-резистентную формы.[2,4,13–16].При В6-чувствительной форме пациенты имеют более мягкий фенотип с более поздним возрастом начала заболевания [14,17]. Наиболее легко заболевание протекает у пациентов, которые дают выраженную положительную динамику уже при применении низких доз пиридоксина**. Большинство из них являются гомозиготами по замене p.I278T в гене CBS [18].
Манифестация заболевания при В6-резистентной форме происходит раньше, и клинические проявления болезни тяжелее, чем при В6-чувствительной форме.
При классической ГЦУ отмечаются поражения со стороны нервной, сосудистой, скелетной систем и органа зрения.
Типичным симптомом классической ГЦУ, который часто появляется на втором году жизни является миопия, которая предшествует развитию дислокации или эктопии хрусталика. При заболевании происходит деструкция богатых фибриллином микрофибрилл цилиарной связки и нарушением ее структуры и функции. Степень смещения хрусталика варьирует от незаметного подвывиха до полного вывиха.
Наиболее часто у пациентов с ГЦУ встречается подвывих хрусталика («ectopia lentis») (более 50% нелеченых пациентов, обычно проявляется к возрасту 8 лет). Иридодонис (дрожание радужки) - частый признак вывиха хрусталика. Миопия, связанная с ослаблением хрусталика, приводит к пассивной сферической деформации (сферофакии). Миопия становится заметной при подвывихе хрусталика. Подвывих хрусталика может быть первым признаком болезни, описан случай манифестации в возрасте 4 недель у одного пациента. Сроки появления этого признака широко варьируют, но примерно на 2 году жизни отмечают появление подвывиха хрусталика у многих пациентов. После этого возраста пациенты с B6- резистентной формой, имеют более высокий уровень вывихов хрусталика, чем пациенты, отвечающие на терапию пиридоксином** [7,8,19].
Частым осложнением эктопии хрусталика является острая глаукома, обусловленная смещением хрусталика в переднюю камеру глаза[20].
Вторым по частоте при классической форме ГЦУ является поражение сосудов. При этом венозные тромбозы встречаются чаще, чем артериальные, и могут возникать в любом органе и системе, включая сосуды головного мозга, коронарные и легочные артерии. Тромбозы встречаются в любом возрасте. Почти у 50 % пациентов отмечаются сосудистые осложнения, представленные тромбозами, к возрасту 29 лет. В ряде случаев поражение сосудов может являться единственным симптомом заболевания, возникающим на 2-3 десятилетии жизни (особенно у пациентов с наиболее частой гомозиготной миссенс мутацией с.833Т>С в гене CBS)[21].
Нарушения со стороны костной системы нередко представлены высоким ростом, долихостеномелией, арахнодактилией, сколиозом, деформацией грудной клетки по типу килевидной или воронкообразной, вальгусной деформацией конечностей, высоким сводом твердого неба, полой стопой, остеопорозом/остеопенией. Остеопороз наблюдается почти у половины пациентов ко второму десятилетию жизни [5,22] и является серьезным осложнением со стороны костной системы. У пациентов с В6 резистентной формой заболевания остеопороз развивается в более раннем возрасте, чем при В6 -зависимых чувствительных формах.
Наиболее частым клиническим проявлением поражения ЦНС является задержка психоречевого развития, умственная отсталость. Достаточно часто когнитивные нарушения могут являться первым симптомом заболевания.
Интеллектуальные способности пациентов могут достаточно сильно различаться в зависимости от возраста начала терапии. По данным международного опроса, показатели IQ варьировали от 10 до 138, при этом медиана составляла примерно 64. Пациенты с В6-чувствительной формой при раннем начале терапии имеют более высокие показатели значения IQ (медиана 78) по сравнению с пациентами, резистентными к витамину В6 (медиана, 56) [23].
На втором десятилетии жизни у пациентов часто возникают эпизоды депрессии, тревожность, обсессивно-компульсивные нарушения, психозы. Характерными для классической ГЦУ являются различные нарушения поведения: агрессия, алкоголизм, наркомания. Психиатрические проблемы более часто встречаются среди пациентов с В6 резистентной формой и при отказе пациентов от лечения и диетотерапии.
В 21% случаев у нелеченных пациентов с классической ГЦУ наблюдаются эпилептические приступы в раннем младенческом возрасте, наиболее часто генерализованные тонико-клонические судороги. Другими неврологическими нарушениями являются различные экстрапирамидные нарушения, в частности, дистония. Очаговые неврологические нарушения соответствуют зоне поражения во время перенесенного острого нарушения мозгового кровообращения [4] .
Описаны случаи классической ГЦУ, протекающей с острым панкреатитом [26–31] и хронической диареей, гипопигментацией кожи и волос, «румянцем» на лице.
Нарушения реметилирования
При нарушениях реметилирования не выявляют каких-либо особых симптомов, которые позволили бы на клиническом уровне предположить эту патологию. Заболевания из этой группы являются мультисистемными, наиболее часто происходит поражение нервной и кроветворной системы, сосудов и почек. Именно сочетание неврологических и гематологических симптомов, часто сопровождающихся задержкой физического развития, должно вызывать подозрение на нарушение реметилирования. У большинства пациентов отмечаются нарушения психического, умственного и физического развития, полиневропатия, судороги, двигательные расстройства, нарушения мышечного тонуса, патология зрения. Они могут сопровождаться макроцитарной анемией, атипичным гемолитико-уремическим синдромом (ГУС) или гломерулопатией, которые в основном связанны с микроангиопатией.
Гомоцистинурия, обусловленная тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR), манифестирует в неонатальном периоде неврологическими нарушениями, сходными с органическими ацидуриями - угнетение сознания вплоть до сомноленции и комы, генерализованной мышечной гипотонией, приступами апноэ. Также отмечают проблемы со вскармливанием, плохую прибавку веса и микроцефалию.
Описана более поздняя форма заболевания, манифестирующая в детском и взрослом возрасте. Ее клиническая картина более вариабельна и представлена задержкой и регрессом психического развития, нарушениями поведения, психиатрическими симптомами, атаксией, полиневропатией, спастичностью. Из экстраневральных нарушений частыми являются тромбозы. Мегалобластная и/или макроцитарная анемия обычно отсутствует.
Среди 24 описанных в литературе подростков/взрослых пациентов с дефицитом MTHFR клинические проявления включали нарушение походки (96%, из моторного центрального или периферического происхождения), снижение когнитивных функций (74%), эпилептические синдромы (50%), энцефалопатию (30%), психотические симптомы (17%) и тромботические события (21%). У 41% было одно неврологическое проявление, которое могло оставаться изолированным в течение как минимум 3 лет, что отсрочивало постановку диагноза. МРТ головного мозга выявила в 71% случаев изменения в основном перивентрикулярного белого вещества. Все пациенты стабилизировались или улучшились после метаболического лечения [32]. Несмотря на то, что дефицит MTHFR в подростковом/взрослом возрасте встречается редко, его следует включать в дифференциально диагностический поиск при различных необъяснимых нейропсихиатрических синдромах, эпилепсии и спастическом парапарезе, поскольку при дефиците MTHFR показан хороший эффект метаболической терапии.
Возраст проявления и клиническая картина дефицита MTHFR коррелируют с остаточной активностью фермента. В исследовании, включающем 33 пациента, показано, что средний возраст появления симптомов составлял 1,25 месяца (средний 21 год; диапазон от 0,1 до 216 месяцев). У 14 пациентов первые симптомы наблюдались в течение первого месяца жизни; и еще у 11 пациентов симптомы наблюдались к 6-му месяцу жизни. У остальных пяти пациентов симптомы проявились в возрасте 2, 5, 11, 13 и 18 лет [33].
Тяжелый дефицит MTHFR биохимически характеризуется гипергомоцистеинемией, гомоцистинурией, повышенным содержанием цистатионина и низким или низко-нормальным уровнем метионина в крови, в отличие от дефицита CBS, который проявляется повышенным уровнем метионина. В культивируемых фибробластах остаточная активность составляет менее 20% от среднего контрольного значения [34].
Клинические проявления комбинированных нарушений реметилирования (cblC, cblD-MMA / HC, cblF, cblJ)
При нарушениях реметилирования с метилмалоновой ацидурией (cblC, cblD-MMA / HC, cblF, cblJ) часто встречаются задержка физического развития и нарушения вскармливания в младенчестве. В большинстве случаев первые симптомы проявляются в неонатальном периоде или в раннем детстве. У новорожденных заболевание может дебютировать остро - нарушениями сознания (летаргия, кома), также характерны судороги и мышечная гипотония, при лабораторных исследованиях часто выявляют мегалобластную анемию, нейтропению или панцитопению. В 50% случаев отмечают нистагм, на фоне ретинопатии или атрофии зрительного нерва [35,36]. Микроангиопатическое заболевание почек или легких чаще всего проявляется на ранней стадии болезни, но может также присутствовать у детей старшего возраста и у взрослых [37,38]
У детей, подростков и взрослых отмечаются острые или хронические поведенческие или психические проявления, когнитивные нарушения, признаки периферической невропатии и атаксии [37,39,40]. Часто выявляют бледность зрительного нерва, но другие глазные проявления редко возникают при поздней форме заболевания [36,41].
Клинические проявления комбинированных нарушений реметилирования (cblD-HC, cblE, cblG)
Клинические проявления дефицита cblE и cblG сходны. Заболевание обычно манифестирует в младенчестве, в основном с гематологическими нарушениями, мышечной гипотонией и остро возникающими неврологическими симптомами. У трети пациентов наблюдают нарушения сознания, судороги, у четверти - нарушения зрения. У детей старшего возраста и взрослых могут проявляться признаки, отражающие поражение спинного мозга (подострая дегенерация спинного мозга) или психиатрические симптомы [42]. Сообщалось об единичных случаях изолированной макроцитарной анемии без нейрокогнитивных нарушений [43] .
Беременность при классической гомоцистинурии и гомоцистинурии, обусловленной тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR)
При ГЦУ, как классической, так и обусловленной тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR), выявляется высокий риск развития тромбозов и тромбоэмболических нарушений у матерей, как на протяжении всей беременности, так и в послеродовой период. К ним относятся множественные артериальные тромбозы, илеофеморальный тромбофлебит, тромбозы верхнего сагиттального синуса и кортикальных вен. Есть данные о развитии преэклампсии у матерей, с гомоцистинурией. Однако большинство беременностей у матерей с классической гомоцистинурией протекали без акушерских осложнений.
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Для классической ГЦУ критериями диагностики служат: повышение уровня метионина в крови, tHcy и fHcy в крови и моче, а также выявление мутаций в гене CBS.
Для MTHFR критериями диагностики являются: высокий уровень tHcy и fHcy в крови и моче, сниженный или нормальный уровень метионина, нормальный уровень метилмалоновой кислоты в крови и выявление мутаций в гене MTHFR .
Алгоритм диагностики нарушений реметилирования представлен в Приложении Б2
Тромбозы возникают преимущественно у пациентов подросткового и молодого возраста, являются главной причиной инфаркта миокарда или инсульта с формированием очаговой неврологической симптоматики.
Тяжесть клинических проявлений болезни при В6 -резистентной форме более выражена, чем при В6-зависимой. Интеллект пациентов с классической ГЦУ чаще снижен: IQ (коэффициент интеллектуального развития) колеблется от 32 до 85 ед. (норма 85-115 ед.). У детей с В6 – зависимой формой гомоцистинурии умственное развитие может быть нормальным
Читайте также:
- Исследование слуха при головокружении. Головокружение и тугоухость
- Рецидив рака: что это такое в онкологии, негативная ремиссия, как избежать
- Диагностика рака ободочной кишки. Лечение рака ободочной кишки
- Избегающее/ограничивающее расстройство потребления пищи
- Операция внутриматочного заменного переливания крови. Катетеризация пупочной артерии
