Гематоэнцефалический барьер мозга - гистология, проницаемость, функции
Добавил пользователь Alex Обновлено: 30.01.2026
1. Cuddapah V.A., Zhang S.L., Sehgal A. Regulation of the Blood-Brain Barrier by Circadian Rhythms and Sleep. Trends Neurosci. 2019.- Jul;42(7):500-510. doi: 10.1016/j.tins.2019.05.001.
2. Mazzei T., Novelli A., Mini E., Periti P. Concentrazioni plasmatiche e tissutali degli antibiotici: qual è il loro valore predittivo? [Plasma and tissue antibiotic concentrations: what is their prognostic value?]. Ann Ital Med Int. 1992.- Jul-Sep;7(3 Suppl):67S-73S.
4. Grabrucker A.M., Ruozi B., Belletti D., Pederzoli F., Forni F., Vandelli M.A., Tosi G. Nanoparticle transport across the blood brain barrier. Tissue Barriers. 2016.- Feb 25;4(1):e1153568. doi: 10.1080/21688370.2016.1153568.
5. Abbott N.J., Patabendige A.A., Dolman D.E., Yusof S.R., Begley D.J. Structure and function of the blood-brain barrier.//Neurobiol Dis. 2010 Jan;37(1):13-25. doi: 10.1016/j.nbd.2009.07.030.
7. Maĭzelis M.Ia., Zabludovskiĭ A.L. Vliianie vnutriutrobnoĭ gipoksii na sintez belka v raznykh otdelakh mozga i funktsiiu gisto-gematicheskikh bar'erov v pozdnem ontogeneze u krys [Influence of intrauterine hypoxia on protein synthesis in different regions of the brain and on functioning of the histo-hematic barrier during late ontogenesis in rats]. Biull Eksp Biol Med. 1977.- Oct;84(10):416-9.
8. Uvarova T.M. Changes in the incorporation of labeled amino acids into separate protein fractions of the cerebral tissue in rats after intrauterine hypoxia.//Biull Eksp Biol Med.- 1990.- Oct;110(10):351-2.
9. Pardridge W.M. Neuropeptides and the blood-brain barrier.//Annu Rev Physiol. 1983;45:73-82. doi: 10.1146/annurev.ph.45.030183.000445.
10. Pardridge W.M.Transport of nutrients and hormones through the blood-brain barrier.//Diabetologia. 1981.- Mar;20 Suppl:246-54.
11. Sweeney M.D, Zhao Z., Montagne A., Nelson A.R., Zlokovic B.V. Blood-Brain Barrier: From Physiology to Disease and Back. Physiol Rev. 2019.- Jan 1;99(1):21-78. doi: 10.1152/physrev.00050.2017.
12. Erdő F., Denes L., de Lange E. Age-associated physiological and pathological changes at the blood-brain barrier: A review. J Cereb Blood Flow Metab. 2017.- Jan;37(1):4-24. doi: 10.1177/0271678X16679420.
Актуальность. Возрастное снижение неврологических и когнитивных функций становится все более серьезной проблемой для развитых стран в связи с увеличением числа пожилых людей. Морфологические и биохимические изменения в стареющем мозге уже долгое время являются предметом многих расширенных исследовательских проектов по всему миру. Однако решение вопроса о роли нарушения гематоэнцефалического барьера (ГЭБ) в патологических процессах при возрастных нейродегенеративных расстройствах остается нерешенным. Основные элементы гематоэнцефалического барьера и его поддерживающие механизмы, как и их изменения в процессе физиологического процесса развития и старения, а также возрастных нейродегенеративных расстройств (болезнь Альцгеймера, рассеянный склероз, болезнь Паркинсона, фармакорезистентная эпилепсия) изучены недостаточно. Требуют пересмотра в свете новых данных морфологические изменения клеточных элементов, таких, как эндотелиальные клетки, астроциты, перициты, микроглия, нейронные элементы) ГЭБ и нервно-сосудистые элементы, а также изменения барьера на молекулярном уровне, включая белки плотных контактов, адгезивные соединительные белки, мембранные транспортеры, базальные мембраны и внеклеточный матрикс.
Цель исследования. Изучить особенности гематоэнцефалического барьера мозга.
Материал и методы. В работе использованы наиболее показательные работы по динамике совершенствования представлений о гематоэнцефалическом барьере мозга и его особенностях в возрастном аспекте, а также микробной контаминации и малигнизации.
Результаты собственных исследований и их обсуждение.
Гематоэнцефалический барьер (ГЭБ) – это эволюционно законсервированное структурное и функциональное разделение между циркулирующей кровью и центральной нервной системой (ЦНС). Гематоэнцефалический барьер (ГЭБ) предотвращает попадание нейротоксичных компонентов плазмы, клеток крови и патогенов в мозг. В то же время ГЭБ регулирует транспорт молекул в центральную нервную систему (ЦНС) и из нее, что поддерживает строго контролируемый химический состав нейрональной среды, необходимый для правильного функционирования нейронов. Контролируя проницаемость нервной системы и из нее, ГЭБ играет решающую роль в точном регулировании нервных процессов. Однако очень мало известно о том, как регулируется гематоэнцефалический барьер (ГЭБ). Последние публикации и соответствующая литература позволили нам суммировать возрастные изменения ГЭБ по основным показателям: проникновение веществ, участвующих в регуляции трофического обеспечения нейронов; циркадный ритм функции ГЭБ; влияние и последствия дисфункции ГЭБ, вызванной нейродегенерацией и аутоиммунными заболеваниями ЦНС. Молекулярные и клеточные механизмы, лежащие в основе функционирования ГЭБ, влияют на физиологию транспорта через ГЭБ, эндотелий и перициты, а также регулируют периваскулярный и параваскулярный транспорт. Неврологические расстройства с первичным генетическим дефектом в клетках, ассоциированных с ГЭБ, являются яркой демонстрацией связи между распадом ГЭБ и нейродегенерацией. Многие авторы указывают на влияние генов, лежащих в основе наследования и / или повышенной восприимчивости к болезни Альцгеймера (AD), болезни Паркинсона (PD), болезни Хантингтона и бокового амиотрофического склероза (ALS), на ГЭБ в отношении других патологий и неврологических нарушений. Имеются данные о дисфункции ГЭБ, связанной с неврологическим дефицитом и другими патологиями, как рассеянный склероз, другие нейродегенеративные расстройства и острые расстройства ЦНС, таких как инсульт, черепно-мозговая травма, повреждение спинного мозга и эпилепсия. Следует подчеркнуть, что несмотря на технологические достижения в исследовании функций ГЭБ в живом человеческом мозге, а также на молекулярном и клеточном уровнях, остаются ключевые вопросы, на которые пока нет ответа.
Имеются данные, что сон способствует выведению метаболитов через ГЭБ. Огромную роль ГЭБ играет в метаболизме железа в нервной ткани. Железо необходимо практически для всех типов клеток и организмов. О высоком значении железа для функции мозга свидетельствует наличие рецепторов трансферрина на эндотелиальных клетках капилляров головного мозга. Транспортировка железа в мозг из системы кровообращения регулируется для извлечения железа эндотелиальными клетками капилляров головного мозга в условиях поддержания постоянства его концентрации, особенно в условиях дефицита железа, необходимого особенно во время развития мозга. Установлено, что ретроградный аксональный транспорт в черепно-двигательном нерве зависит от возраста и варьируется от почти незначительного в мозге новорожденного до высокого в мозге взрослого человека. На сегодняшний день отсутствуют данные о том, что пептиды, такие как инсулин, энкефалины проходят через ГЭБ с помощью определенных транспортных систем. Поскольку площадь поверхности ГЭБ в 5000 раз больше, чем площадь поверхности барьера гемато-спинномозговая жидкость, маловероятно, что транспорт через барьер гемато-спинномозговая жидкость обеспечивает быстрое распределение циркулирующих пептидов в интерстициальном пространстве головного мозга. Циркулирующие нейропептиды могут потенциально быстро влиять на активность мозга, не пересекая ГЭБ и не проникая в интерстициальные или синаптические пространства мозга. Понимание механизмов транспорта циркулирующих питательных веществ и гормонов через стенку капилляров головного мозга через ГЭБ важно, поскольку наличие этих веществ в мозге влияет на ряд церебральных метаболических путей. Например, использование мозгом глюкозы, кетоновых тел и аминокислот с разветвленной цепью или производство моноаминов, ацетилхолина, карнозина и нуклеозидов может при определенных условиях зависеть от транспорта через ГЭБ циркулирующих питательных веществ-предшественников. Стероидные гормоны и гормоны щитовидной железы легко проходят через ГЭБ благодаря липидной связи и посреднической роли носителя, соответственно. Хотя стероидные гормоны и гормоны щитовидной железы прочно связаны белками плазмы, гормон, связанный с белками, а не свободная (диализируемая) часть, является основной фракцией плазмы, транспортируемой через ГЭБ. Что касается циркулирующих пептидов, имеющиеся данные указывают на то, что пептиды быстро распределяются в интерстициальном пространстве головного мозга околожелудочковых органов головного мозга, то есть примерно в шести небольших областях вокруг желудочков, в которых отсутствует ГЭБ. И наоборот, отсутствие пептидных носителей предотвращает быстрое распределение пептидов в подавляющем большинстве интерстициальных или синаптических пространств мозга.
Однако недавние исследования показывают, что некоторые пептиды, например, инсулин, могут связывать специфические рецепторы на кровяной стороне ГЭБ и, таким образом, влиять на клетки нейральной поверхности ГЭБ, без прохождения пептида через стенку капилляров.
Заключение Признание новых участников и инициаторов процесса нейродегенерации на уровне ГЭБ может открыть новые возможности для новых терапевтических подходов к лечению многочисленных хронических нейродегенеративных расстройств, в настоящее время не имеющих патогенетически эффективных лекарств. В то время как роль гематоэнцефалического барьера (ГЭБ) все больше признается в разработке методов лечения нейродегенеративных расстройств, на сегодняшний день существует несколько стратегий, которые позволяют доставлять лекарства, не пересекающиеся с ГЭБ, непосредственно к месту их действия, мозгу. Подходы к влиянию на ГЭБ глубоко исследуются в связи с патологией: среди основных важных заболеваний ЦНС внимание уделяется применению наномедицинских препаратов для лечения нейродегенеративных расстройств (болезнь Альцгеймера, Паркинсона и Хантингтона) и на другие патологии головного мозга, такие как эпилепсия, инфекционные заболевания, рассеянный склероз, лизосомные нарушения накопления, инсульты. Передача нервных сигналов в центральной нервной системе (ЦНС) требует строго контролируемой микросреды. Клетки на трех ключевых интерфейсах образуют барьеры между кровью и ЦНС: гематоэнцефалический барьер (ГЭБ), гематоэнцефалический барьер и паутинный барьер. ГЭБ на уровне эндотелия микрососудов головного мозга является основным местом обмена между кровью и ЦНС. На современном этапе обобщены структура и функция ГЭБ, физический барьер, образованный эндотелиальными плотными контактами, и транспортный барьер, являющийся результатом мембранных транспортеров и везикулярных механизмов. Также установлены роли ассоциированных клеток, особенно астроцитарных глиальных клеток, перицитов и микроглии. Имеются данные по эмбриональному развитию ГЭБЮ но его изменения при патологии изучены недостаточно. ГЭБ подвержен краткосрочному и долгосрочному регулированию, которое может нарушаться при патологии. Любая программа по таргетной доставке лекарств в ЦНС должна учитывать особенности ГЭБ.
Работа выполнена при финансовой поддержке Международного Медицинского Научно-образовательного Центра, (Владивосток, Россия)
Гематоэнцефалический барьер мозга - гистология, проницаемость, функции
Гематоэнцефалический барьер разграничивает нервную систему от общего кровотока, обеспечивая постоянную и оптимальную по химическому составу среду для ее функционирования.
Межклеточная жидкость занимает 15 % общего объема мозга и окружает нейроны и нейроглию. Схема межклеточных пространств представлена на рисунке ниже. Секретируемая сосудистыми сплетениями спинномозговая жидкость циркулирует в системе желудочков и субарахноидальном пространстве и через пахионовы грануляции проникает в синусы твердой мозговой оболочки.
Затем спинномозговая жидкость путем пассивного транспорта через выстилающую стенки желудочков эпендимоглиальную мембрану проходит во внеклеточные пространства мозга, где смешивается с межклеточной жидкостью, продуцируемой клетками капилляров, и в процессе клеточного метаболизма распространяется через пиаглиальную мембрану в субарахноидальное пространство. «Стекание» спинномозговой жидкости компенсирует отсутствие лимфатических сосудов в ЦНС.
Единственная составляющая спинномозговой жидкости, которая не проникает через гематоэнцефалический барьер,— метаболическая жидкость. В ее состав входят нейромедиаторы, высвобожденные нейронами и не подвергнувшиеся обратному захвату, что обусловливает наличие неспособных преодолеть гематоэнцефалический барьер медиаторов и их метаболитов в субарахноидальном пространстве.
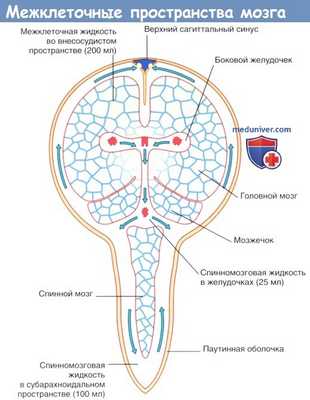
Межклеточные пространства головного мозга.
Стрелками показаны направления циркуляции спинномозговой жидкости.
Компоненты спинномозговой жидкости распределены следующим образом (по результатам поясничной пункции):
• жидкость, продуцированная клетками сосудистых сплетений, — 60 %;
• жидкость, продуцированная клетками капилляров, — 30 %;
• метаболическая жидкость — 10%.
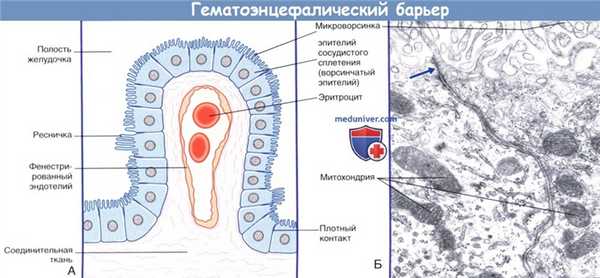
(А) Схематическое изображение барьера между кровью и спинномозговой жидкостью.
(Б) Ультраструктура эпителия сосудистого сплетения. В эпителиальных клетках расположены множество митохондрий и гранулярная эндоплазматическая сеть.
Клетки соединены плотными контактами в апикальной части.
Гематоэнцефалический барьер состоит из двух компонентов. Первый представлен барьером между кровью и спинномозговой жидкостью на уровне сосудистых сплетений, а второй — барьером между кровью и межклеточной жидкостью на уровне капилляров ЦНС.
а) Барьер между кровью и спинномозговой жидкостью. Барьер между кровью и спинномозговой жидкостью представлен эпендимальным эпителием сосудистых сплетений, который характеризуется следующими особенностями строения.
1. Практически все реснички замещены микроворсинками.
2. Клетки образуют плотные контакты. Именно эти места плотного соединения мембран клеток разграничивают кровь и спинномозговую жидкость.
3. Клетки эпителия содержат ферменты, обеспечивающие транспорт ионов и продуктов метаболизма.
б) Барьер между кровью и межклеточной жидкостью. Барьер между кровью и межклеточной жидкостью представлен эндотелием капилляров ЦНС, который характеризуется следующими особенностями строения.
1. Эндотелиоциты образуют плотные контакты.
2. В состав клеток входит небольшое количество пиноцитозных пузырьков, а также отсутствуют фенестрации.
3. Транспортные системы в клетках аналогичны таковым в эпителии сосудистых сплетений.
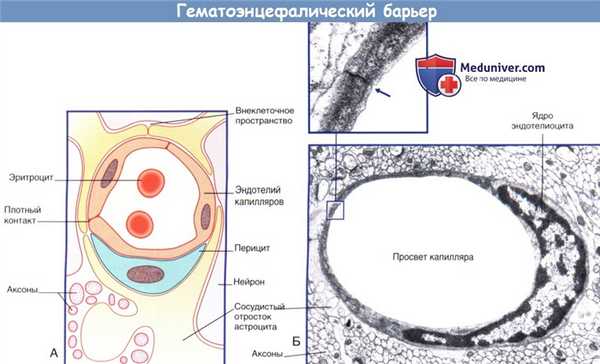
(А) Схема барьера между кровью и межклеточной жидкостью.
(Б) Капилляр центральной нервной системы. На поперечном срезе показан одиночный эндотелиоцит, полностью окружающий просвет сосуда.
Края эндотелиоцитов образуют плотный контакт. Эндотелиоцит окружен базальной мембраной. Капилляр окружен отростками астроцитов.
в) Функции перицитов капиллярного русла. Перициты и клетки эндотелия связаны с помощью щелевидных контактов. В ходе исследований культур клеток было достоверно доказано, что перициты играют ключевую роль в ангиогенезе капилляров, а также в формировании и поддержании плотных контактов между эндотелиоцитами.
Перициты принимают участие в саморегуляции мозгового кровотока за счет того, что на их поверхности экспрессируются рецепторы к вазоактивным медиаторам: норадреналину, вазопрессину, ангиотензину II. При хронической артериальной гипертензии развиваются гипертрофия и гиперплазия перицитов, а также происходит внутриклеточная продукция цитоплазматических сократительных филаментов, что обеспечивает компенсаторное расширение капилляров.
Поверхность клеточной стенки перицитов способна обеспечивать связывание протромбинового комплекса, за счет чего перициты могут принимать участие в процессе свертывания крови.
Кроме того, перициты обладают способностью к фагоцитозу и свойствами иммунорегуляторных цитокинов.
Общая площадь капиллярного русла головного мозга соответствует размерам теннисного корта! Наличие такой огромной поверхности объясняет тот факт, что мозг потребляет 20 % поступающего кислорода. Плотность капилляров коры головного мозга можно оценить на изображении латексного слепк.
г) Функции гематоэнцефалического барьера:
• Контроль проникновения метаболических веществ. Основной источник питания нейронов — глюкоза. При повышении уровня глюкозы в крови специфический белок-переносчик связывает ее, а при низком уровне — обеспечивает более активный захват.
• Контроль транспорта ионов. Nа + /К + -АТФ-аза клеток гематоэнцефалического барьера осуществляет транспорт ионов Na + в спинномозговую жидкость, а ионов К + —в кровь.
• Предотвращение поступления в мозг токсических веществ и периферических нейромедиаторов, выделяемых вегетативными нервными окончаниями в системный кровоток.

Латексный слепок сосудов препарата мозга.
Корковые капилляры имеют вид извилистых белесоватых нитей.
д) Состояния, связанные с нарушением гематоэнцефалического барьера:
1. Пациенты с артериальной гипертензией подвержены приступам гипертонической энцефалопатии в связи с тем, что степень повышения давления превосходит компенсаторные способности стенок артериол. Вследствие такого повышения давления может произойти нарушение плотных межклеточных контактов эндотелия капилляров, что приводит к отеку мозга за счет быстрого выхода плазмы. Клинически эта ситуация проявляется сильной головной болью, рвотой и, в некоторых случаях, появлением судорог и развитием комы.
2. У пациентов с повышенным содержанием углекислого газа в крови (при заболеваниях дыхательной или сердечно-сосудистой системы, а также после хирургических вмешательств) причиной отека мозга даже при нормальном уровне артериального давления может стать расслабление мышечного слоя артериол. Данная ситуация клинически проявляется спутанностью сознания и сонливостью, в дальнейшем переходящими в кому.
3. Повреждения мозга (травмы или спонтанные кровоизлияния) приводят к отеку мозга вследствие осмотического повреждения тканей мозга (и других факторов).
4. Инфекционные заболевания мозга или его оболочек сопровождаются нарушением гематоэнцефалического барьера, предположительно из-за усиленного перемещения лейкоцитов в капиллярном русле мозга. Несостоятельность гематоэнцефалического барьера играет и положительную роль: стенки капилляров проницаемы для жирорастворимых антибиотиков.
Кроме того, капилляры опухолей мозга характеризуются наличием фенестраций, что позволяет идентифицировать злокачественное новообразование при помощи рентгеноконтрастного вещества, неспособного пройти через капилляры непораженных отделов мозга.
е) Резюме. Гематоэнцефалический барьер - барьер между кровью и спинномозговой жидкостью представлен эпителием сосудистых сплетений (видоизмененным эпендимным эпителием) желудочков мозга. Барьер между кровью и межклеточной жидкостью представлен эндотелием капилляров мозга.
Гематоэнцефалический барьер
физиологический механизм, избирательно регулирующий обмен веществ между кровью, цереброспинальной жидкостью и центральной нервной системой и обеспечивающий постоянство внутренней среды головного и спинного мозга.
Г. б., осуществляя защитную функцию, препятствует проникновению в мозг некоторых чужеродных веществ, попадающих в кровь, и промежуточных продуктов обмена веществ, образующихся при некоторых патологических состояниях, причем роль Г. б. в процессе филогенеза возрастает. Так., некоторые вещества легко проникают из крови в мозг у низкоорганизованных, но задерживаются Г. б. у более высокоорганизованных организмов. Отмечена также более высокая проницаемость Г. б. у эмбрионов и новорожденных по сравнению со взрослым организмом.
Морфологическим субстратом Г. б. являются анатомические элементы, расположенные между кровью и нервными клетками (так называемые межэндотелиальные контакты, охватывающие клетку в виде тесного кольца и препятствующие проникновению веществ из капилляров). Отростки глиальных клеток (концевые ножки астроцитов), окружающие капилляр, стягивают его стенку, что уменьшает фильтрационную поверхность капилляра, препятствует диффузии макромолекул. Согласно другим представлениям, глиальные отростки являются каналами, способными избирательно экстрагировать из кровотока вещества, необходимые для питания нервных клеток, и возвращать в кровь продукты их обмена. Важное значение в функции Г. б. придается так называемому ферментному барьеру. В стенках микрососудов мозга, окружающей их соединительнотканной стромы, а также в сосудистом сплетении обнаружены ферменты, способствующие нейтрализации и разрушению поступающих из крови веществ. Распределение этих ферментов неодинаково в капиллярах разных структур мозга, их активность изменяется с возрастом, в условиях патологии.
Г. б. рассматривают в качестве саморегулирующейся системы, состояние которой зависит от потребностей нервных клеток и уровня метаболических процессов не только в самом мозге, но и в других органах и тканях организма. Проницаемость Г. б. неодинакова в разных отделах мозга, селективна для разных веществ и регулируется нервными и гуморальными механизмами. Важная роль в нейрогуморальной регуляции функций Г. б. принадлежит изменению интенсивности метаболических процессов в ткани мозга, что доказывается угнетающим влиянием ингибиторов метаболических процессов на скорость транспорта аминокислот в мозг и стимуляцией их поглощения субстратами окисления.
Различают два пути поступления веществ в ц.н.с. — через кровеносные капилляры и ликворную систему. При этом одни вещества проникают главным образом через капилляры, другие используют оба пути, третьи — преимущественно через цереброспинальную жидкость.
Снижение проницаемости Г. б. способствует проникновению в ц.н.с. разнообразных чужеродных веществ, продуктов нарушенного метаболизма. В то же время направленное снижение проницаемости Г. б. используют в клинической практике для повышения эффективности химиотерапевтических препаратов, антибиотиков, а также введения антител, гормонов, медиаторов, в обычных условиях не попадающих в мозг, благодаря функционированию Г. б.
Проникновение в мозг в области Гипоталамуса, где Г. б. «прорван», различных патологических агентов сопровождается разнообразной симптоматикой нарушений вегетативной нервной системы (Вегетативная нервная система).
Имеются многочисленные доказательства снижения защитной функции Г. б. под влиянием алкоголя, в условиях эмоционального стресса, перегревания и переохлаждения организма, воздействия ионизирующего излучения и т. д.
В то же время экспериментально установлена способность некоторых препаратов, например пентамина, этаминал-натрия, витамина Р. уменьшать проникновение в мозг определенных веществ.
Библиогр.: Бредбери М. Концепция гемато-энцефалического барьера, пер. с англ., М., 1983; Майзелис М.Я. Современные представления о гематоэнцефалическом барьере: нейрофизиологические и нейрохимические аспекты, Журн. высш. нервн. деятельн., т. 36, вып. 4, с. 611, 1986.
гистогематический барьер между кровью, с одной стороны, и цереброспинальной жидкостью и нервной тканью — с другой.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг .
Открыть ворота гематоэнцефалического барьера
В последнее десятилетие всё чаще врачи сталкиваются с инсультом новорождённых, но лечить его пока не очень получается. Трудности связаны с гематоэнцефалическим барьером — одной из самых загадочных систем мозга, «перегородкой» между кровью, циркулирующей в теле, и мозгом. Именно он решает, что допустить в мозг, а что — нет. Сегодня тема преодоления гематоэнцефалического барьера нужными лекарствами стала одной из горячих и «денежных» в нейрофизиологии.
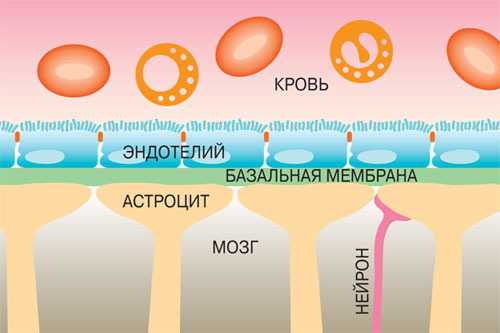
130 лет назад человечеству приоткрылся один из механизмов работы мозга: была обнаружена «перегородка» между мозгом и кровеносной системой тела — гематоэнцефалический барьер. Он состоит из нескольких слоёв: со стороны тела кровеносный капилляр мозга выложен клетками эндотелия на базальной мембране. Со стороны ткани мозга находится слой нейронов, так что они переплетаются в трёхмерную сеть. Такая структура позволяет регулировать проникновение из крови в мозг биологически активных веществ, метаболитов, но препятствует поступлению в мозг чужеродных веществ, микроорганизмов, токсинов
Гематоэнцефалический барьер — тонкая физиологическая организация — оставался вне поля зрения учёных до тех пор, пока не стало очевидно, что именно он тормозит успехи современной медицины и именно в его работе скрыты ресурсы для новой эпохи в фармакологии. За последние 20 лет в мире было синтезировано более 40 новых препаратов, из которых всего два — для лечения болезней мозга. Гематоэнцефалический барьер создаёт для некоторых веществ «зелёный» коридор, но для целого ряда препаратов он остаётся непроницаемым, и потому врачи безоружны в борьбе со многими неврологическими патологиями, такими, например, как инсульт мозга. Задача проницаемости барьера встала, когда было признано, что у новорождённых это заболевание встречается так же часто, как у взрослых.
Десять лет назад диагноз «инсульт» детям ставили крайне редко. Сегодня прогресс в развитии безопасных технологий для внутреннего исследования мозга (визуализация) позволил исследователям увидеть серьёзность проблемы. Особенность детского инсульта в том, что он проходит зачастую бессимптомно или «маскируется» под другие заболевания. Последствия катастрофичны для ребёнка. У большинства маленьких пациентов возникают серьёзные нарушения: задержка умственного и речевого развития, гиперреактивность, затруднения в концентрации внимания, у них страдают логика и адаптация к стрессам, что не сразу и не очевидно проявляется в первые дни жизни.
Но диагностика инсульта мозга у новорождённых — лишь первый этап. Главный вопрос — как лечить и как предупредить это заболевание. Детский и взрослый инсульты — разные! Мы знаем, какие факторы провоцируют развитие инсульта у взрослых — к примеру, гипертензия. Но для малышей эти факторы не так актуальны, и даже такие очевидные на первый взгляд причины, как родовые травмы, не вошли в лидирующую десятку провокаторов инсульта у детей.
Почему инсульты мозга у новорождённых и взрослых так различаются? После появления на свет мозг ребёнка ещё продолжает развиваться, причём особенно интенсивно в первые дни после рождения. В настоящий момент не существует тактики лечения инсульта мозга у новорождённых. Мало зная об этом заболевании у младенцев, врачи вынуждены применять к ним терапию, показанную для взрослых. Она оказывается неэффективной, а иногда даже мешает выздоровлению. Успех в лечении таких детей — зачастую случайность, а не результат заранее спланированной тактики врача.
Возникло предположение, что многие препараты, которые существуют в арсенале врача для лечения инсульта, просто не доходят до мозга новорождённого из-за капризного гематоэнцефалического барьера, который закрывается и не даёт поработать препаратам.
Несмотря на прорывные технологии в визуализации структур мозга, решения проблем детского инсульта не было, потому что не хватало подходящего инструментария для исследования «ворот», пропускающих лекарства в гематоэнцефалическом барьере.
В экспериментальной медицине платформа для изучения любых болезней — моделирование патологии на животных. Среди существующих на сегодняшний день моделей инсульта ни одна не пригодна для новорождённых.
Есть два типа инсульта — ишемический, когда сосуды мозга сужаются, что ограничивает его питание и кровоснабжение, и геморрагический, когда сосуды рвутся без явных на то причин. У новорождённых преобладает второй тип инсульта. Однако модели, традиционно применяемые для изучения геморрагического инсульта, работают по принципу механического введения крови в мозг экспериментальных животных, что сильно ограничивает исследовательские возможности.
На биологическом факультете Саратовского государственного университета им. Н. Г. Чернышевского разработали модель инсульта, с помощью которой можно увидеть, как сосуды мозга разрываются самостоятельно, без дополнительных вмешательств. Для этого используется звуковой стресс (120 дБ, 7 Гц). Звуковые волны за счёт способности глубоко проникать в мозг нарушают центры регуляции его кровотока.
Сосудистые «катастрофы» у новорождённых случаются не сразу, а через два-три дня после рождения. Аналогичные изменения происходят с сосудами лабораторных животных после влияния звукового стресса. И хотя звук — это неадекватный провоцирующий фактор для детского инсульта, на сегодняшний день это единственная модель, которая позволяет изучать развитие данной патологии без инвазивных вмешательств, запуская внутренние патологические процессы, максимально приближенные к естественному ходу событий.
Однако для взрослых животных простого стресса недостаточно, чтобы вызвать инсульт головного мозга. Для них требуется наличие хронически высокого артериального давления, изнашивающего сосуды и делающего их стресс-неустойчивыми. Для того чтобы изучать, как работает «барьер» на первых этапах жизни и на последующих этапах развития, мы вооружились современными методами флуоресцентного обнаружения белков окклудин и клаудин-5, работающих «таможенниками» на границе между мозгом и кровью. Воспользовались и старым методом изучения прохождения барьера красителем Evans blue (голубой Эванса), связывающимся с белками крови. Именно этот краситель в 1885 году помог открыть гематоэнцефалический барьер немецкому нейрофизиологу Паулю Эрлиху. Когда он ввёл краситель в кровь, то обнаружил, что все внутренние органы окрасились, а мозг нет. Позже опыты повторил его ученик Эдвин Голдман, но он вводил краситель уже непосредственно в спинномозговой канал лабораторного животного. Мозг становился синим, при этом вся краска оставалась в нём, не проникая на периферию. И по сей день краситель Evans blue — надёжный способ проверки работы гематоэнцефалического барьера. Конечно, появились и другие, более точные способы тестирования проницаемости барьера, например светящиеся метки, закреплённые на полисахаридах — декстранах разной массы (3 кДа и 70 кДа).
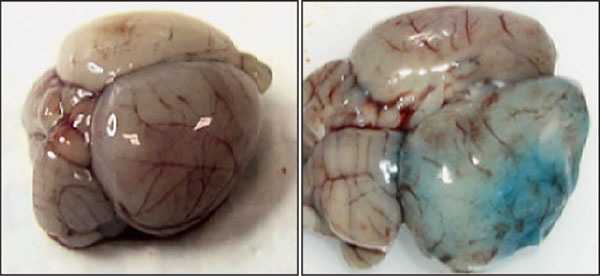
Появление голубого окрашивания тканей мозга у взрослой (справа) и у новорождённой (слева) крыс на фоне развития инсульта и введения красителя Evans blue
А теперь посмотрим, как работает гематоэнцефалический барьер при развитии геморрагического инсульта и как эти процессы отличаются друг от друга в первые дни после рождения лабораторного животного и в последующем его развитии.
Оказалось, внутривенное введение красителя крысам на фоне развития инсульта сопровождается появлением голубой окраски тканей мозга только у взрослых, но не у новорождённых особей.
Мы исследовали, какие вещества проходят через гематоэнцефалический барьер в условиях, когда организму необходимо бороться с инсультом. Для этого использовали флуоресцентные метки — лёгкие (декстран 3 кДа) и тяжёлые (декстран 70 кДа), которые своим свечением подсказывают нам их местонахождение и помогают определить путь движения.
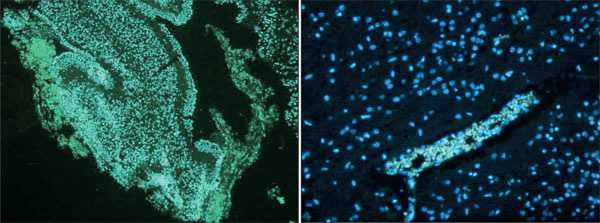
Лёгкие флуоресцентные метки (декстран 3 кДа) распределены по-разному: у взрослой крысы (слева) — распределение по всему мозгу, а у новорождённой (справа) — концентрирование в сосуде на фоне развития инсульта мозга
Как оказалось, у взрослых крыс мозг при инсульте как решето: пропускает даже высокомолекулярные соединения (декстран 70 кДа). А у новорождённых декстрановые флуоресцентные метки застревают в сосудах: барьер закрывается так плотно, что даже низкомолекулярные соединения (декстран 3 кДа) остаются в пределах сосудов и не попадают в мозг.
Используя метод иммуноблоттинга (метод определения специфических белков), удалось увидеть белки, которые и делают барьер непроницаемым. Мы наблюдали за двумя критически важными белками — клаудином-5 и окклудином. У новорождённых крыс этих белков в разы больше, чем у взрослых. Вот почему краситель Evans blue и флуоресцентные метки у новорождённых особей «застревают» в барьере, в то время как у взрослых он становится более «лояльным» — проницаемым для веществ, которые в обычных условиях в мозг не попадают.
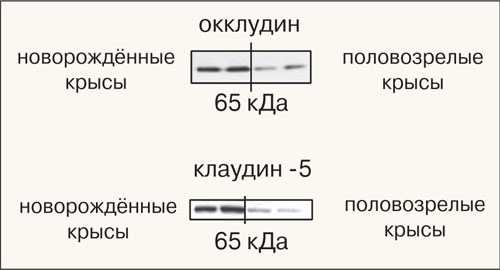
Экспрессия структурных белков гематоэнцефалического барьера — окклудина и клаудина-5 у новорождённых и взрослых крыс (более тёмные полоски отражают более высокую экспрессию)
Возможно ли найти объяснение разного поведения мозга в момент его начального развития и когда статус организма уже сформировался? Мозг развивается по принципу избыточности. Он старается иметь сразу всё и много и только потом разбирается, что с этим делать. Часть его структур, к примеру адренергические нейроны, у которых медиаторами служат норадреналин и адреналин, образуется задолго до рождения, но созревает только к двум годам жизни. Другие структуры, альфа2-адренорецепторы, наоборот, созревают до рождения в огромном количестве, а после их плотность заметно снижается. Но так или иначе, многие молекулярные структуры мозга, равно как и его биохимия, формируются заведомо с избытком. Возможно, это одна из причин, почему у новорождённых наблюдается повышенная экспрессия «барьерных» белков, препятствующих проникновению многих «взрослых» препаратов, которые применяют при лечении инсульта мозга.
Тайна гематоэнцефалического барьера — как грань между небом, землёй и воздухом. Его можно «увидеть», но трудно постичь. Нужны бойцы-невидимки, которые могли бы обмануть строгих стражей барьера, пронести необходимую «гуманитарную помощь» страдающему мозгу маленького пациента и помочь ему в борьбе с инсультом. Такими помощниками могут стать транспортные системы — липосомы, капсулы, углеродные нанотрубки, которые активно разрабатываются с этой целью во всём мире.
Исследования проводились на биологическом факультете Саратовского государственного университета им. Н. Г. Чернышевского в рамках проекта Российского научного фонда (№14-15-00128) и гранта Президента РФ (МД-2216.2014.4).
Гемато - энцефалический барьер
Гематоэнцефалический барьер (ВВВ) является критической границей между центральной нервной системой (ЦНС) и периферией. ВВВ одновременно и "друг", и "враг" врачу - клиницисту. Защищая ЦНС от воздействия потенциально вредных веществ, находящихся в системном кровообращении, ВВВ одновременно представляет собой серьезное препятствие для доставки и поступления лекарств в ЦНС.
Анатомически, BBB представляет собой обширную сеть микрокапилляров протяженностью ~ 650 км, каждый из которых имеет диаметр просвета ~ 6 мм и окружен одиночной, эндотелиальной клеткой, люминесцентная и абламинальная (мозговая оболочка) мембраны разделены на 300-500 нм цитоплазмы. Вещества, пытающиеся перейти из системного кровообращения в ткань мозгуа должны либо пройти через парацеллюлярный путь ( как бы между влеток) или через трансцеллюлярный путь, проходя через микрососудистые эндотелиальные клетки. Парацеллюлярная диффузия водорастворимых веществ и малых ионов строго ограничена плотными соединениями (TJs), которые как бы соединяют мембраны эндотелиальных клеток для , чтобы физически закрыть межэндотелиальный разрыв. Вещества , пытающиеся пройти через мембрану микрососудистых эндотелиальных клеток, активно высвобождаются обратно в капиллярный просвет с помощью встроенных транспортеров оттока или воздействуют на различные метаболизирующие фермент - совокупные усилия "пассивной обструкции" (TJs).
Гематоэнцефалический барьер (BBB) - это не статическая анатомическая граница, а динамический интерфейс, способный быстро реагировать на стрессоры, включая гипоксию, воспаление, травму и боль. Повреждение целостности ВВВ подвергает мозг потенциально опасным концентрациям веществ , находящихся в периферическом кровообращении (например, ионы, аминокислоты, нейротрансмиттеры, белки и другие макромолекулы), которые могут нарушать гомеостаз мозга и отрицательно влиять на активность нейронов. Поврежденный парацеллюлярный проход лекарственных средств, нутрицевтиков или ксенобиотиков в мозг после нарушения "пассивной обструкции" (TJ) может привести к значительным побочным эффектам препарата и / или неблагоприятным взаимодействиям лекарственных средств. Альтернативно, нарушение BBB может включать патологически повышенный "отток" лекарственного средства из тканей мозга через микрососудистую (просветную ) мембрану, что приводит к снижению концентрации и эффективности лекарственного средства, находящегося в тканях мозга.
На целостность и функцию ВВВ оказывает сильное влияние то, что сейчас называют «расширенной нейрососудистой единицей или блоком» (“extended neurovascular unit”), которая включает в себя не только микрососудистые эндотелиальные клетки и смежные перициты, астроциты и нейроны, но также соседние клетки гладкой мускулатуры и микроглии в мозге, а также клетки крови, находящиеся в капиллярном просвете, например, таких как полиморфноядерные клетки, лимфоциты и моноциты. У
Учитывая наличие множества типов клеток, внутри- и внеклеточных сигнальных путей и взаимодействующих белков, липидов и углеводов, участвующих в образовании, поддержании и нарушении различных барьерных функций, выполняемых ВВВ, сегодня разработано и множество подходов к диагностике нарушений ВВВ и терапевтическому воздействию на гематоэнцефалический барьер ( BBB) как в области патологии , так и в аспекте терапии болезней с целью оптимизации доставки лекарств в ЦНС. На молекулярном уровне предложен подход, направленный на воздействие на функции конкретного белка, важного для биохимии ВВВ (например, транспортера эффлюка, компонента TJ), что является прямой модуляцией его активности и / или транскрипции генов. Альтернативным подходом улучшения доставки лекарств для ЦНС через ВВВ , является нацеленность на обмен белками и их местоположением , в результате чего изменение местоположения белка используется в качестве средства модуляции его активности. Можно привести два примера с участием P-гликопротеина-транспортера, используемого для "оттока" лекарственного средства и транслюмбронного белка окклюдина TJ, которые демонстрируют потенциал терапевтической модуляции индуцированных патологией изменений в обмене белками BBB с целью оптимизации доставки лекарственного средства в ЦНС в присутствии стрессоров (например, периферическая воспалительная боль, гипоксия).
P-гликопротеин (ABCB1 / MDR1) является выдающимся молекулярным открытием доставки лекарственного средства в ЦНС через ВВВ. Стратегически обогащенный на мембране церебральных микрососудистых эндотелиальных клеток, P-гликопротеин использует энергию от АТФ-гидролиза, чтобы вытеснить лекарства обратно в микрокапиллярный просвет против крутых градиентов концентрации.
P-гликопротеиновые субстраты имеют массу от 300-4000 Да и включают анальгетики, противораковые препараты и иммунодепрессанты, психотропные средства, антибиотики, антиаллергенные средства, противоэпилептические препараты , бета-блокаторы, стероидные гормоны и ингибиторы протеазы ВИЧ-1. Несмотря на интенсивные исследования, усилия сосредоточенные на разработке ингибиторов Р-гликопротеина, а также клинические испытания включающие прямое ингибирование Р-гликопротеина в значительной степени оказались неудачными в плане повышения терапевтической эффективности. Высокие дозы ингибитора, по-видимому, здесь необходимы, но , к сожалению, приводят к системному токсикозу. Более того, полное ингибирование P-гликопротеина может быть опасным для жизни из-за отсутствия защиты от потенциально опасных веществ, передающихся через кровь. В настоящее время усилия ученых направлены на выявление целевых показателей терапии в рамках нескольких сигнальных путей, которые способствуют связанным с болезнями изменениям активности P-гликопротеина.
Исследователями было обнаружено, что начало периферической воспалительной боли (экспериментально вызванное инъекцией λ-каррагинана в задней лапы животного ) наблюдается в течение трех часов за счет увеличения оттока морфина, связанного с P-гликопротеином, через гематоэнцефалический барьер ( BBB). Эти данные показали , что боль, вызванная процессом воспаления, сама по себе препятствует способности клинически значимых антиболевых препаратов , таких как морфин , поступать в ткани мозга. Воспаление, вызванное повреждением ткани, способствует выраженности послеоперационной боли, и поэтому вывод об увеличении оттока морфина с помощью P-гликопротеина через BBB может частично объяснить трудности с достижением послеоперационной опиоидной анальгезии.
Эволюционный выбор P-гликопротеина, который является основным «привратником» , регулирующим проход через BBB, можно определить из-за того, что микрососуды на BBB содержат самые высокие уровни P-гликопротеина в организме и что in vivo исследования дозирования с использованием P-гликопротеиновых субстратов показывают, что поглощение мозга существенно увеличивается у животных с нокаутом P-гликопротеина .
Учитывая тот факт , что диета, воздействие окружающей среды или внешние стрессоры могут быстро повышать концентрацию потенциально вредных веществ в системном кровообращении, можно предположить , что по мере развития P-гликопротеина для выполнения столь значимой барьерной роли для ВВВ, этот механизм должен также обеспечить своевременную доставку достаточного количества P-гликопротеина в микрососудистую люминесцентную мембрану для борьбы с какой-либо угрозой.
Трансмембранный протеин - окклюдин является значимым для барьерной функции при TJs между микрососудистыми эндотелиальными клетками гематоэнцефалического барьера (BBB), а изменение концентрации окклюдина от TJs является чувствительным, ранним и надежным признаком открытия TJ и дисфункции ВВВ. Способность быстро закрывать нарушения ВВВ (т. е. его повышенной проницаемости ) при TJs, которые наблюдаются во время окислительного стресса (например, вследствие инсульта), будет препятствовать развитию опасного для жизни отека головного мозга и проникновению в ткани ЦНС нейротоксичных веществ, передающихся через кровь. Периферическая воспалительная боль, индуцированная в трех разных экспериментальных моделях (формалин, каррагенан и полный адъювант Фрейнда), способствовала развитию дисфункции ВВВ, характеризующейся повышенной проницаемостью парацеллюлярных клеток к сосудистым маркерам, таким как сахароза. Было также обнаружено, что периферическая воспалительная боль способствует увеличению проницаемости парацеллюлярной расщелины для опиоидного анальгетического кодеина.
Кодеиновая анальгезия опосредованно централизована, что требует ее накопления в головном мозге, что и происходит при пассивной парацеллюлярной диффузии. Неконтролируемое увеличение потребления мозгом кодеина во время периферической воспалительной боли из-за патологического увеличения парацеллюлярной проницаемости может привести к значительным побочным эффектам ЦНС, связанным с опиоидами, такими как угнетение дыхания, зависимость и повышенная толерантность.
Гематоэнцефалический барьер (ВВВ) представляет собой физический и метаболический барьер, который отделяет ЦНС от периферического кровообращения. Доставка лекарств в ЦНС (CNS) через BBB является сложной задачей, в первую очередь из-за физического ограничения парацеллюлярной диффузии между эндотелиальными клетками, которые содержат микрососуды ВВВ, и активности транспортеров оттока, которые быстро вытесняют обратно в капиллярный просвет широкий спектр ксенобиотиков. В заключении отметим, что терапевтическое манипулирование трафиком P-гликопротеинов представляет собой относительно недорогой и неспецифический подход для усиления доставки лекарств в ЦНС (множества лекарств) и выбора оптимальных комбинаций лекарственных средств. Субстратами, влияющими на активность Р-гликопротеиновой транспортной системы, являются дигоксин, циметидин, такролимус, нифедипин, кетоконазол и амитриптилин.
Нифедипин - селективный блокатор кальциевых каналов II класса, производное дигидропиридина. Тормозит поступление кальция в кардиомиоциты и клетки гладкой мускулатуры сосудов. Оказывает антиангинальное и гипотензивное действие.
Читайте также:
