Гематология: Лимфопоэз
Добавил пользователь Владимир З. Обновлено: 27.01.2026
1. Белянин В.Л., Цыплаков Д.Э. Диагностика реактивных гиперплазий лимфатических узлов. – СПб – Казань, 1999. – 328 с.
2. Райт Д., Эддис Б., Леонг Э. Морфологическая диагностика патологии лимфатических узлов. – М.: Мед. лит., 2008. – С. 42-86.
3. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. – СПб.: Коста., 2006. – С. 45-48.
4. Шерстнева Е.С., Исаева Н.В., Загоскина Т.П. и др. Клиническое значение внутриклеточного ИЛ-8 у больных В-клеточным хроническим лимфолейкозом // Вестник гематологии. – 2007. – Т. 3, № 2. – С. 49-50.
5. Леенман Е.Е., Мухина М.С. и др. Место дендритных клеток в микроокружении при лимфоме Ходжкина. – СПб, 2010.
6. Киселева М.В. Морфо-функциональное состояние стромы лимфатических узлов при некоторых лимфопролиферативных заболеваниях. Диссертация. Санкт-Петербург, 2001.
7. Semenova N., Bessmeltsev S., Rugal V. Stromal microenvironment lymph nodes in CLL // Haematologica.17 Congress EHA Amsterdam. Abstract Book. – 2012. – Vol. 97, № S1. – Р. 521.
8. Семенова Н.Ю., Ругаль В.И. Морфофункциональные особенности стромы лимфатических узлов при ХЛЛ // Вестник гематологии. – 2011. – Т. VII, № 4. – С.45-46.
9. Tsuda H., Nishimura H., Sawada T., Takatsuki K. The roles of lymph node stromal cells in proliferation of lymphoid leukemia cells // Br.J.Cancer. – 1990. – Vol. 61. – Р. 362-364.
10. Park C-S., Choi Y.S. How do follicular dendritic cells interact intimately with B cells in the germinal centre? // Immunology. – 2005. – Vol. 114. – Р. 2-10.
11. Caligaris-Cappio F. Role of the microenvironment in chronic lymphocytic leukaemia // Br J Haematol. – 2003. – Vol. 123. – Р. 380-388.
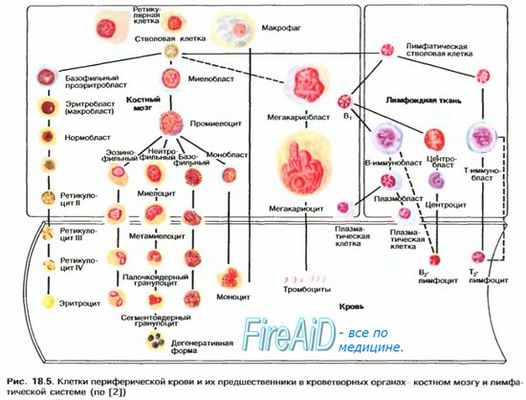
В функциональном отношении клетки лимфоидной системы могут быть разделены на три типа: стволовые кроветворные клетки, клетки-предшественники первичных лимфоидных органов, клетки вторичных лимфоидных органов. По темпу клеточного обновления лимфоидная ткань занимает одно из первых мест в организме. Развитие лимфоидных клеток не прекращается всю жизнь – это необходимо для “подстройки” иммунитета к постоянно изменяющейся иммунологической ситуации.
Особенность всей лимфоидной системы состоит в том, что в течение всей жизни ее органы объединяют интенсивные клеточные миграции, в ходе которых осуществляется пролиферация и дифференцировка иммунокомпетентных клеток. Эти процессы происходят при условии упорядоченной миграции клеток-предшественников из одних органов кроветворной системы в другие, включая костный мозг, тимус и периферические лимфоидные органы. Стоит отметить, что дифференцировка общих предшественников в разных направлениях (например, в Т- и В-клетки) требует различных несовпадающих местных условий.
Основная функция лимфоузлов состоит в обеспечении взаимодействия антигена, который поступает туда по афферентным лимфатическим сосудам, с иммунокомпетентными клетками. В ходе иммунного ответа в структуре лимфоузла происходит ряд изменений, благодаря которым обеспечивается возможность для наибольшего количества лимфоцитов проконтактировать с антигеном и между собой. Структуры лимфатического узла создают условия для направленного, а не случайного взаимодействия разных субпопуляций лимфоцитов и для развития стимулированных антигеном клонов иммунокомпетентных клеток.
Группой экспертов ВОЗ (Котье и соавт., 1973) предложено выделять в лимфоузле следующие функциональные зоны и структуры:
1. Кортикальный слой с залегающими в нем фолликулами.
2. Паракортикальную зону.
3. Мозговое вещество с мозговыми тяжами.
Фолликулы и мозговые тяжи являются тимуснезависимыми областями (В-зона), паракортикальная зона – тимусзависимой областью (Т-зона). В-зависимые зоны – это зоны лимфоидных фолликулов лимфоузлов, селезенки, аппендикса, миндалин, лимфоидных агрегатов кишечника. Т-зависимые зоны – это паракортикальная зона лимфоузлов, периартериальные зоны селезенки, интерфолликулярные зоны в аппендиксе, миндалинах, пейеровых бляшках.
Структура и клеточный состав лимфоузлов человека исследовались многими авторами. Непаренхиматозный компонент лимфатических узлов представлен стромальными образованиями, выполняющими, в основном, опорную и трофическую функцию – фибробласты, фиброциты, миоциты, эндотелиоциты сосудов, нейральные элементамы. Также непаренхиматозные структуры лимфоидной ткани включают в себя группу ретикулярных клеток и экстрацеллюлярный матрикс, которые играют ключевую роль в формировании лимфоидного микроокружения, отвечающее за развитие лимфоидных клеток. Остальные элементы стромы играют вспомогательную роль.
Термин ретикулярные клетки носит собирательный характер и включает 4 основных морфофункциональных типа: гистиоцитарные, дендритные, интердигитирующие и фибробластические ретикулярные клетки. На светооптическом уровне с использованием рутинных окрасок дифференцировать указанные типы достаточно сложно. Определение принадлежности к определенному варианту требует гистохимических и иммуногистохимических методов анализа.
Гистиоцитарные ретикулярные клетки имеют вид фиксированных макрофагов, почти неотличимых от гистиоцитов и макрофагов костномозгового происхождения, особенно находящихся в лимфатических фолликулах.
Дендритные ретикулярные клетки преобладают в корковом веществе, главным образом в центрах первичных и вторичных лимфатических фолликулов, являясь антиген-представляющей субпопуляцией клеточных элементов лимфатического узла. Эти клетки способны длительное время удерживать антиген на своей поверхности, регулируя образование В-клеток памяти и предшественников антителоформирующих плазмоцитов. Кроме того, дендритные ретикулярные клетки образуют правильную сеть в первичных и вторичных лимфоидных фолликулах. Реализации этих функций способствуют длинные отростки цитоплазмы, которые соединены с такими же отростками соседних дендритных ретикулярных клеток. Они имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются на срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Их отростки также выявляются окрашиванием на CD21 и CD23. Дендритные клетки помимо длинных отростков, которыми они соединяются между собой, имеют отчетливо различимые замыкательные комплексы – десмосомы, отличающие эти клетки от интердигитирующих ретикулярных клеток.
Интердигитирующие ретикулярные клетки в наибольшем количестве присутствуют в паракортикальной зоне, определяя стимуляцию Т-клеточного ответа. Интердигитирующие ретикулярные клетки имеют бледно окрашивающиеся ядра овальной или удлиненной формы, иногда с инвагинациями довольно сложной конфигурации, и широкую цитоплазму. Эти клетки имеют большое сходство с клетками Лангерганса, но не содержат гранул Бирбека. При иммуноцитохимическом исследовании в них определяется белок S-100 и антиген HLA-DR. Интердигитирующие ретикулярные клетки, в отличие от дендритных, соединяются между собой и другими клеточными элементами при помощи пальцевидных отростков цитоплазмы, входящих между такими же структурами других клеток.
Фибробластические ретикулярные клетки характеризуются наличием в цитоплазме волокнистых структур, идущих на формирование ретикулиновых волокон.
Как и в костном мозге, система кровеносных сосудов является важным компонентом лимфатического узла, поскольку из крови в его ткань и обратно осуществляется интенсивная миграция лимфоцитов. Проникшие в узел через его ворота кровеносные сосуды ветвятся в мозговом и корковом слоях. В корковом слое располагаются мелкие венулы, в которые переходят капилляры. Эндотелий посткапиллярных венул построен из высоких клеток, в их цитоплазме часто обнаруживаются лимфоциты. В ходе миграции лимфоциты проходят как между эндотелиальными клетками, так и через их цитоплазму, затем через базальную мембрану и попадают в ткань глубокого кортекса. Эмиграция лимфоцитов из лимфоузлов осуществляется через эфферентные лимфатические сосуды, по которым лимфоциты возвращаются в кровоток. В этих взаимодействиях участвуют селектины, CD44 и интегрины, экспрессированные на лимфоцитах.
Имеется небольшое количество работ по морфологии некоторых клеточных элементов лимфоидного микроокружения при лимфопролиферативных заболеваниях. Так, при исследовании морфологических особенностей дендритных ретикулярных клеток при неходжкинских лимфомах отмечено изменение ультраструктуры ретикулярных клеток. При этом, происходило уменьшение количества лимфоцитов, контактирующих с дендритными ретикулярными клетками, увеличение межклеточных расстояний, перестройки плазматических мембран, изменения ультрацитохимических свойств клеток, в частности, снижение или полное отсутствие реакции на кислую фосфатазу. Отмечено уменьшение количества дендритных ретикулярных клеток в зависимости от гистологического варианта лимфом. Так, лимфомы фолликулярного типа сопровождаются увеличением количества ретикулярных клеток, в то время как при диффузных лимфомах отмечено уменьшение их числа и значительные деструктивные изменения. Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях.
Известно, что строма реализует свое воздействие на гемопоэтические клетки, как путем непосредственных межклеточных контактов, так и опосредованно, с помощью гуморальных механизмов. При лимфоидных неоплазиях происходят значительные нарушения в системе межклеточных взаимодействий. Клетки микроокружения являются главным источником цитокинов – пептидов, обеспечивающих регуляцию пролиферации, дифференцировки и апоптоза гемопоэтических клеток. Отмечено, что роль цитокинов в патогенезе лимфопролиферативных заболеваний весьма значительна. К примеру, известно, что пролиферативная активность стромы лимфоузлов у больных неходжкинскими лимфомами не зависит от морфологического варианта заболевания, а связана с продукцией цитокинов, в частности ФНО-α стромальными элементами лимфатических узлов. У пациентов с хроничесским лимфолейкозом повышена секреция стромой лимфатических узлов ИЛ-6 и ИЛ-4 in vitro, что отражает участие данных веществ в патогенезе заболевания. Применение химиотерапии снижает продукцию ИЛ-4 in vivo, что может быть благоприятным фактором, учитывая особенность ИЛ-4 ингибировать апоптоз опухолевых клеток. Также были показаны различия в экспрессии внутриклеточного ИЛ-8 клетками опухолевого клона и нормальными В-лимфоцитами, что имеет клиническое значение.
Работы, посвященные изучению дендритных клеток (ДК) при некоторых формах опухолей, показали, что количество и иммунофенотип ДК, их распределение в опухолевой и непораженной ткани отражаются на прогнозе этих новообразований. ДК считаются наиболее важным фактором, определяющим состав лимфоидной популяции и влияющим на регулирование функциональной активности лимфоидных клеток. Они могут создавать не только противоопухолевые, но и проопухолевые стимулы.
Согласно данным Цыплакова Д.Э. и соавт. (1995), исследовавших влияние кровеносного микроциркуляторного русла на клеточный иммунный ответ в лимфатических узлах, регионарных к злокачественным опухолям, сосудистое русло лимфатических узлов играет двоякую роль. С одной стороны, на ранних этапах развития опухоли происходит активация Т-клеточных иммунных реакций с усилением рециркуляции лимфоцитов через посткапиллярные венулы и превращением их путем бласттрансформации в цитотоксические Т-киллеры, что, вероятно, сдерживает процесс метастазирования. С другой стороны, на более поздних стадиях опухолевого роста изменения сосудистой стенки и циркуляторные расстройства сопровождаются отложением внутри- и внесосудистого фибрина, затрудняя тем самым рециркуляцию лимфоцитов и, следовательно, приводят к уменьшению числа трансформированных Т-киллеров, способных уничтожать попадающие в лимфатический узел опухолевые клетки, что, по мнению авторов, предопределяет процесс метастазирования. При появлении в лимфатических узлах метастазов фибрин уже способствует их закреплению в лимфоидной ткани, а также изолирует от цитотоксического действия оставшихся в небольшом количестве Т-эффекторов.
На сегодняшний день накопилось достаточное количество данных, свидетельствующих о роли стромального микроокружения в становлении лимфопролиферативных заболеваний. При этом отсутствует целостное представление о структурных особенностях лимфоидной стромы при нарушениях пролиферации и дифференцировки В-лимфоцитов. Дальнейшее изучение лимфоидного микроокружения, его морфофункциональных особенностей, адгезивных взаимодействий с использованием современных методов структурного анализа может способствовать поискам новых методов лечения гемобластозов и лимфопролиферативных заболеваний.
Гематология: Лимфопоэз
Гематология: Лимфопоэз
Предшественники, коммитированные к В- и Т-клеточному пути развития, являются прямыми потомками плюрипотентной стволовой клетки (CD34+).
Лимфопоэз у эмбриона и плода происходит транзиторно в различных эмбриональных тканях. Лимфоидные предшественники присутствуют уже в желточном мешке. К 5-6-й неделе гестации предшественники В- и Т-клеток появляются в печени, где формируются участки В-лимфопоэза. Формирование большинства Т-клеток происходит в вилочковой железе.
После рождения основным местом развития миелоидных клеток и В-лимфоцитов становится костный мозг. Т-лимфоциты развиваются в вилочковой железе, куда перемещаются костномозговые предшественники, и происходит процесс, называемый Т-лимфопоэзом. Селезенка у взрослых функционирует как вторичный лимфоидный орган, в котором располагаются зрелые Т- и В-клетки.
Развитие В-лимфоцитов при лимфопоэзе
Развитие лимфоцита у взрослого проходит две различные фазы. Первая фаза — антигеннезависимая, когда В-лимфоциты развиваются до стадии, в которой они экспрессируют на поверхности иммуноглобулин IgM, — происходит в костном мозге. Вторая фаза — антигензависимая, протекает во вторичных лимфоидных органах (селезенка и лимфатические узлы) в ответ на клеточные и гуморальные сигналы, поступающие от Т-клеток, макрофагов и других популяций акцессорных клеток.
При использовании специфических моноклональных антител, которые распознают иммуноглобулины и другие поверхностные и цитоплазматические детерминанты, можно различать промежуточные степени развития В-клеток.
Клетки-предшественники, коммитированные к дифференцировке в В-лимфоциты, имеют иммуноглобулиновые гены в зародышевой конфигурации и называются про-В-клетки. Затем в цитоплазме появляется белок тяжелой цепи иммуноглобулина М (ц), и с этого момента клетка обозначается как пре-В-клетка. Как только в клетке происходит экспрессия белков легкой цепи, начинается сборка молекул иммуноглобулинов, и после их появления на поверхности клетки определяются как В-лимфоциты.
Популяции В-клеток при лимфопоэзе
Предполагается, что существуют три различные линии В-клеток, определяемые по фенотипическим и функциональным свойствам: Bla, B1b и В2. Bla-клетки экспрессируют CD5; Bib-клетки не экспрессируют CD5, характеризуются высокими уровнями поверхностного IgM и низкими уровнями мембранного IgD. Распространение этих популяций у взрослых в основном ограничено перитонеальной и плевральной полостями.
Этим они отличаются от стандартных (или В2) В-клеток, которые преобладают во вторичных лимфоидных органах, таких как лимфоузлы и селезенка.
Характерной особенностью Bl-клеток является их способность продуцировать аутоантитела класса IgM (среди которых наиболее частыми являются антитела к ДНК и ревматоидный фактор). Это делает понимание природы данных клеток клинически важным вопросом. Популяция Bl-клеток является, вероятно, основным источником естественных ауто-антител, представленных в сыворотке крови здоровых лиц.
Естественные аутоантитела встречаются в крови взрослых, детей, новорожденных и даже у плода. Они присутствуют в малых количествах, почти всегда связываются со многими антигенами (мультиреактивные аутоантитела) и имеют низкую аффинность к их лигандам. Пока неизвестно, продуцируются ли естественные аутоантитела только Bl-клетками или их способны производить также девственные В2-клетки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гематология: Лимфопоэз
1 ГБОУ ВПО «Саратовский Государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Белоцкий С.М., Авталион Р.Р. Воспаление. Мобилизация клеток и клинические эффекты. – М.: Изд–во БИНОМ, 2008. – 240 с.
2. Гематология / Рукавицын О.А., Павлов А.Д., Морщакова Е.Ф. [и др.]; Под ред. О.А. Рукавицына. – СПб.: ООО «Д.П.», 2007. – 912 с.
3. Жаворонок Т.В. Участие системы глютатиона в поддержании функционального состояния нейтрофилов при остром воспалении // Бюллетень сибир. медицины. – 2010. – № 5. – С. 28–32.
4. Зайчик АШ. Механизмы развития болезней и синдромов // А.Ш. Зайчик, Л.П. Чурилов. – СПб.: ЭЛБИ, 2002. – Т. 3. – 507 с.
7. Коротина О.Л., Генералов И.И. Нейтрофильные внеклеточные ловушки: механизмы образования, функции // Иммунология, аллергология, инфектология. – 2012. – № 4. – С. 23–32.
8. Клиническая онкогематология: руководство для врачей / Под ред. проф. М.А. Волковой (2-е изд.). – М.: ОАО Изд-во Медицина, 2007. – 1120 с.
9. Луговская С.А., Почтарь М.Е. Гематологический атлас. 3–е издание. – Москва – Тверь: ООО «Изд–во Триада», 2011. – 368 с.
10. Патологическая физиология: учебник / под общ. ред. В.В. Моррисона, Н.П. Чесноковой. – 4-е изд. – Саратов: Изд-во Сарат. мед. ун-та, 2009. – 679 с.
11. Патологическая физиология: учебник / Н.Н. Зайко, Ю.В. Быць, А.В. Атаман [и др.] / под ред. Н.Н. Зайко, Ю.В. Быця. – 3-е изд. – М.: МЕДпресс – информ, 2008. – 644 с.
12. Пинегин Б.В., Маянский А.Н. Нейтрофилы: структура и функция // Иммунология. – 2007. – Т. 28, № 6. – С. 374–382.
13. Тотолян А.А. Клетки иммунной системы / А.А. Тотолян, И.С. Фрейдлин. – СПб.: Наука, 2000. – 231 с.
15. Abbas A.K. Diseases of immunity / Robbins and Cotran pathologic basis of disease. – 7 th ed. / Editet by V. Kumar, A.K. Abbas, N. Fausto. – Philadelphia, Pennsylvania. Elserier, 2005. – P. 193–267.
Лейкоцитозы. Классификация, общая характеристика. Лейкоцитоз – вторичное симптоматическое увеличение количества лейкоцитов в периферической крови более 10 000 в 1 мкл, а при постоянно низком исходном уровне лейкоцитов (3 000–5 000 в 1 мкл) – более 8 000–9 000 в 1 мкл.
Классификация лейкоцитозов. В соответствии со сдвигом лейкоцитарной формулы выделяют следующие виды лейкоцитозов:
1) нейтрофильный лейкоцитоз,
2) эозинофильный лейкоцитоз,
3) базофильный лейкоцитоз,
4) эозинофильно – базофильный лейкоцитоз,
5) нейтрофильно – эозинопенический лейкоцитоз,
6) нейтрофильно – эозинофильный лейкоцитоз,
9) лимфоцитарно – нейтропенический,
10) моноцитарно – лимфоцитарный лейкоцитоз.
Увеличение содержания лейкоцитов в периферической крови может носить физиологический и патологический характер.
Физиологический лейкоцитоз возникает в здоровом организме, как правило, носит перераспределительный характер и, соответственно, не связан с усилением костномозгового кроветворения.
Различают следующие разновидности физиологического лейкоцитоза:
а) лейкоцитоз новорожденных. При рождении ребенка количество лейкоцитов составляет 9 000–30 000 в 1 мкл, а спустя неделю после рождения содержание лейкоцитов колеблется от 5 000 до 25 000 в 1 мкл. Однако в ряде случаев спустя 6 и даже 13 лет после рождения отмечается лейкоцитоз до 13 000 в мкл;
б) пищеварительный лейкоцитоз, который развивается спустя 2–3 часа после приема пищи;
в) миогенный лейкоцитоз;
г) лейкоцитоз при эмоциональном напряжении;
д) лейкоцитоз при переходе из горизонтального положения в вертикальное (ортостатический лейкоцитоз).
К физиологическому относят и лейкоцитоз, имеющий место во второй половине беременности. В его развитии участвуют как перераспределительные механизмы, так и интенсификация процессов лейкопоэза.
В ряде случаев перераспределительный лейкоцитоз может возникать после введения лекарственных препаратов (адреномиметиков). Однако при длительном введении адреномиметических препаратов лейкоцитоз может быть обусловлен не только перераспределением лейкоцитов, но и усилением костномозгового кроветворения.
Касаясь особенностей гематологической картины при перераспределительном лейкоцитозе, следует отметить его кратковременность, быструю нормализацию содержания лейкоцитов в крови после устранения действия этиологического фактора, а также нормальное соотношение лейкоцитов в лейкоцитарной формуле.
В отличие от физиологического лейкоцитоза патологический лейкоцитоз носит вторичный симптоматический характер, развивается при различных формах патологии инфекционной и неинфекционной природы.
В основе патологического лейкоцитоза лежит активация миелопоэза и усиление выхода лейкоцитов из костного мозга в системную циркуляцию. Гиперплазия миелоидной или лимфоидной ткани может возникать под влиянием токсических и ферментных факторов бактериальной природы, продуктов распада тканей, а также лейкоцитов крови, гормональных и гуморальных стимуляторов негормональной природы.
Как известно, наиболее значимыми регуляторами лейкопоэза являются колониестимулирующие факторы (КСФ), действующие не только на уровне коммитированных клеток-предшественников, но и стимулирующие процессы пролиферации и созревания морфологически идентифицируемых грануломоноцитарных клеток костного мозга. В связи с этим очевидно, что в условиях патологии усиливается продукция КСФ, облегчающих выход в кровь из костного мозга нейтрофильных лейкоцитов, а также стимулирующих процессы созревания и пролиферации элементов грануломоноцитарного ряда.
В механизмах развития истинного лейкоцитоза, связанного с гиперплазией миелоидной ткани, важная роль должна быть отведена изменениям гормонального баланса, свойственным различным заболеваниям инфекционной и неинфекционной природы.
Как известно, важнейшими гормонами адаптации, интенсивно продуцирующимися в условиях действия стрессорных раздражителей (болезнетворных факторов), являются адренокортикотропный гормон, глюкокортикоиды, катехоламины. Последние стимулируют процессы миелопоэза опосредованно за счет увеличения продукции КСФ клетками моноцитарно-макрофагальной и лимфоидной системы.
Изменения, касающиеся качественного и количественного состава лейкоцитов, часто отражают характер возбудителя инфекции, степень распространенности воспалительного процесса, реакцию организма на соответствующий этиологический фактор, поэтому выявление характера лейкоцитоза может иметь не только диагностическое, но и прогностическое значение.
Лейкоцитоз чаще наблюдается при остро развивающейся инфекции и значительно реже – при хронических заболеваниях.
Гематологическая характеристика отдельных видов лейкоцитозов. Нейтрофильный лейкоцитоз возникает при бактериальных инфекциях и интоксикациях генерализованного или преимущественно локального характера, чаще при инфекциях, вызывающих развитие гнойного воспаления (стрептококковой, стафилококковой, менингококковой). Однако нейтрофильный лейкоцитоз может возникать как следствие кровопотерь, острого гемолиза, у лиц со злокачественными новообразованиями, при гипоксиях, при интоксикациях эндогенного происхождения. Патологический нейтрофильный лейкоцитоз, как правило, обусловлен увеличением миелопоэза, а также усилением выхода в кровь из костномозгового гранулоцитарного резерва нейтрофилов.
Важнейшими стимуляторами гранулоцитопоэза являются колониестимулирующие факторы, продуцируемые моноцитарно-макрофагальными элементами. Ингибиторами митотической активности клеток лейкоцитарного ряда являются кейлоны – продукты жизнедеятельности зрелых нейтрофилов, а также лактоферрин, простагландины Е, синтезируемые макрофагами. Таким образом, интенсивность гранулоцитопоэза регулируется колониестимулирующими факторами и комплексом ингибиторов, продуцируемых фактически одними и теми же клетками, по принципу обратной связи. Нарушение этой взаимосвязи в условиях патологии приводит к интенсификации гранулоцитопоэза.
Как указывалось выше, возможно развитие нейтрофильного лейкоцитоза при различных стрессорных состояниях, сопровождающихся развитием гипоксии, болевой травмы, воздействием эмотогенных факторов. Естественно, что возникающий в подобных условиях лейкоцитоз может носить перераспределительный характер и возникать под влиянием гормонов адаптации.
Для оценки степени выраженности нейтрофильного лейкоцитоза используют так называемый ядерный индекс сдвига нейтрофилов влево, представляющий собой отношение суммы всех несегментированных нейтрофилов к количеству сегментоядерных клеток. В норме величина индекса сдвига составляет 0,06–0,08. При благоприятном течении заболевания отмечается так называемый регенеративный сдвиг, при котором индекс сдвига не превышает 0,25–0,45. При этом в периферической крови появляются в избыточном количестве палочкоядерные лейкоциты, метамиелоциты. Гиперрегенеративный ядерный индекс сдвига отмечается при тяжелых инфекционных и гнойносептических процессах, его величина возрастает до 1,0 –2,0.
При этом лейкоцитоз нередко приобретает характер лейкемоидной реакции, когда количество лейкоцитов увеличивается до 20 000–30 000 в 1 мкл, а в периферической крови увеличивается не только содержание палочкоядерных и юных, но и миелоцитов.
Появление в крови миелобластов на фоне высокого уровня лейкоцитов следует рассматривать как признак лейкемоидной реакции или чаще лейкоза.
Количественные изменения со стороны нейтрофилов периферической крови в условиях патологии нередко сочетаются с их качественными сдвигами. Так, при гнойносептических процессах, в частности при перитоните, флегмоне, в цитоплазме нейтрофилов обнаруживается токсигенная зернистость – интенсивно окрашивающиеся зерна в результате коагуляции белков цитоплазмы под влиянием инфекционно-токсических факторов.
К другим дегенеративным признакам нейтрофилов относятся анизоцитоз, пикноз и набухание ядер, вакуолизация цитоплазмы или сморщивание всей клетки.
Эозинофильный лейкоцитоз характеризуется увеличением количества эозинофилов в периферической крови более 5 % и сопутствует разнообразным заболеваниям, однако очень часто он является одним из проявлений аллергизации организма. Так, эозинофилия типична для атопических (анафилактических) реакций, в частности бронхиальной астмы, сенной лихорадки, аллергического дерматита, медикаментозных реакций, ангионевротического отека Квинке.
В ряде случаев эозинофилия как проявление сенсибилизации возникает при глистных инвазиях и паразитарных заболеваниях (при трихинеллезе, эхинококкозе, аскаридозе, фасциолезе).
Эозинофилия при аллергических заболеваниях носит защитно-приспособительный характер, поскольку характерной особенностью эозинофилов является способность к адсорбции и инактивации чрезмерных концентраций гистамина, накапливающихся в патохимической фазе аллергических реакций во внеклеточной среде.
Механизмы развития эозинофилии при аллергических заболеваниях остаются невыясненными. Однако необходимо принять во внимание тот факт, что состояние сенсибилизации нередко возникает на фоне измененного гормонального баланса, в частности при недостаточности уровня АКТГ и глюкокортикоидов, а как известно, указанные гормоны обладают способностью усиливать процессы лизиса эозинофилов и их миграцию из системного кровотока в ткани. В связи с этим очевидно, что эозинофильный лейкоцитоз возникает и как одно из проявлений недостаточности коры надпочечников.
Эозинофильный лейкоцитоз свойствен ряду аутоиммунных, а также злокачественных заболеваний, в частности хроническому миелолейкозу и лимфогранулематозу. При миелопролиферативных заболеваниях увеличение количества эозинофилов в крови обусловлено усилением эозинофилопоэза в связи с опухолевой трансформацией клеток костного мозга.
В ряде случаев эозинофильный лейкоцитоз отмечается у недоношенных детей и доношенных новорожденных в первые 3 месяца жизни.
Базофильный лейкоцитоз встречается крайне редко и в связи с незначительным содержанием базофилов в периферической крови (0,5–1,0 %) существенно не отражается на общем содержании лейкоцитов в единице объема крови.
Увеличение количества базофилов может иметь место при микседеме, неспецифическом язвенном колите, аллергических реакциях. Однако в ряде случаев базофилия является одним из грозных симптомов развития опухолевой трансформации клеток и миелопролиферативных процессов в костном мозге. Базофильный лейкоцитоз возникает при эритремии, а в комплексе с гиперэозинофилией при хроническом миелолейкозе. Возрастание количества базофилов в периферической крови при лейкозе является прогностически неблагоприятным признаком, свидетельствующим о возможности развития терминальной стадии патологии.
Лимфоцитарный лейкоцитоз характеризуется увеличением содержания лимфоцитов в периферической крови свыше 35 %. Лимфоцитоз, как и другие виды лейкоцитоза, может носить абсолютный и относительный характер. Абсолютный лимфоцитоз обусловлен усилением лимфопоэза, увеличением количества лимфоцитов в лейкоцитарной формуле на фоне повышенного содержания лейкоцитов в периферической крови. Относительный лимфоцитоз отмечается, как правило, на фоне общего уменьшения количества лейкоцитов в периферической крови и преобладания лимфоцитов, хотя абсолютное содержание лимфоцитов остается неизменным.
Абсолютный лимфоцитоз является признаком некоторых острых и хронических инфекций (коклюш, вирусный гепатит, инфекционный мононуклеоз, туберкулез, сифилис, бруцеллез). В ряде случаев лимфоцитоз является симптомом злокачественных заболеваний – острого и хронического лимфолейкоза, лимфосаркомы, а также эндокринопатий – тиреотоксикоза, надпочечниковой недостаточности.
Относительный лимфоцитоз возникает как следствие угнетения костномозгового кроветворения, в частности гранулоцитопоэза, под влиянием бактериальных, токсических, вирусных, иммуноаллергических факторов, лекарственных препаратов, воздействия ионизирующей радиации и рентгеновского облучения на костный мозг. Относительный лимфоцитоз в сочетании с нейтропенией может иметь место при дефиците фолиевой кислоты и витамина В12, когда подавляется костномозговое кроветворение.
Моноцитоз – увеличение количества моноцитов в периферической крови свыше 8 % – возникает как проявление стимуляции моноцитопоэза под влиянием колониестимулирующих факторов, продуцируемых моноцитарно-макрофагальной системой; наблюдается при бактериальных заболеваниях (туберкулез, бруцеллез, подострый септический эндокардит), а также при мононуклеозе, саркоидозе, коллагенозах, раке молочной железы и яичника в фазе начавшегося выздоровления у лиц с агранулоцитозом.
Лимфопоэз. Развитие B-лимфоцитов. Популяции B-клеток

Лимфопоэз у эмбриона и плода происходит транзиторно в различных эмбриональных тканях. Лимфоидные предшественники присутствуют уже в желточном мешке. К 5-6 неделе гестации предшественники B- и T-клеток появляются в печени, где формируются участки B-лимфопоэза. Другие эмбриональные ткани, включая сальник и плаценту, также содержат предшественники В-клеток.
Селезенка становится очагом гемопоэза в третьем триместре беременности и остается местом гемопоэза до момента рождения. У взрослых селезенка функционирует как вторичный лимфоидный орган, в котором располагаются зрелые T- и B-клетки. После рождения костный мозг становится основным местом развития миелоидных клеток и B-лимфоцитов.
Формирование большинства T-клеток происходит в тимусе. На 7-8 неделе эмбрионального развития формирующийся тимус заселяется принесенными с кровью предшественниками, у взрослых в этот орган перемещаются костномозговые предшественники, где из них развиваются Т-лимфоциты, а процесс называется Т-лимфопоэзом.
В настоящее время предполагается, что предшественники, коммитированные к B- и T-клеточному пути развития, являются прямыми потомками плюрипотентной стволовой клетки (CD34 + ).
Развитие B-лимфоцитов
Развитие лимфоцита у взрослого проходит две фазы. Первая фаза – антигеннезависимая, когда B-лимфоциты развиваются до стадии, в которой они экспрессируют на поверхности иммуноглобулин (Ig) М, происходит в костном мозге. Вторая фаза – антигензависимая – протекает во вторичных лимфоидных органах, таких как селезенка и лимфатические узлы, в ответ на клеточные и гуморальные сигналы, поступающие от T-клеток, макрофагов и других популяций акцессорных клеток.
При использовании специфических моноклональных антител, которые распознают иммуноглобулины и другие поверхностные и цитоплазматические детерминанты, можно различать промежуточные степени развития B-клеток (таблица 1).
Клетки-предшественники, коммитированные к дифференцировке в B-лимфоциты, имеют иммуноглобулиновые гены в зародышевой конфигурации и называются про-B-клетки. По мере созревания этих клеток они экспрессируют на поверхности антиген CD45RA, тирозинфосфатазу, чья функция в развитии B-клетки пока неизвестна. Затем в цитоплазме появляется белок тяжелой цепи иммуноглобулина М (), и с этого момента клетка обозначается как пре-B-клетка. Как только в клетке происходит экспрессия белков легкой цепи, начинается сборка молекул иммуноглобулинов, и после их появления на поверхности клетки определяются как B-лимфоциты.
Наиболее незрелая человеческая B-клетка-предшественник экспрессирует CD34 и CD19. Последний антиген представлен на B-клетках всех стадий развития. На стадии клетки-предшественника происходит потеря экспрессии CD34, и на поверхности клеток появляется антиген CD10. Далее пре-B-клетки, определяемые по присутствию цитоплазматического протеина , экспрессируют CD20. В течение перехода от пре-B к B-клетке происходит потеря CD10 и начинается сборка CD21, CD22 и поверхностного иммуноглобулина М (рис.1).
B-лимфопоэз характеризуется высокой клеточной пролиферацией, которая наиболее активна на стадии клеток-предшественников. К тому времени, когда клетки созревают до малых пре-B-лимфоцитов, которые экспрессируют цитоплазматический протеин , деление клеток прекращается. Однако имеется и значительная потеря клеток на стадии пре-B-лимфоцитов. Удаляются клетки, в которых произошла дефектная реаранжировка (перестройка) иммуноглобулиновых генов или экспрессируются аутореактивные гены тяжелых цепей. Клетки, которые прогрессируют до стадии экспрессии IgM, покидают костный мозг и мигрируют в селезенку, где они подвергаются дальнейшему созреванию. Если эти клетки не получают антигенного стимула, они проживают только несколько дней, после чего подвергаются апоптозу.
Популяции B-клеток
Предполагается, что существуют три различные линии B-клеток, определяемые по фенотипическим и функциональным свойствам: B1a, B1b и В2. B1a-клетки отличаются том, что экспрессируют CD5, B1b-клетки не экспрессируют CD5, а характеризуются высокими уровнями поверхностного IgM и низкими уровнями мембранного IgD. Распространение этих популяций у взрослых в значительной степени ограничено перитонеальной и плевральной полостями, причем В1-клетки секретируют преимущественно антитела IgA и IgM, которые обеспечивают защиту против окружающей микрофлоры. Этим они отличаются от стандартных (или B2) B-клеток, которые преобладают во вторичных лимфоидных органах, таких как лимфоузлы и селезенка.
Характерной особенностью B1-клеток является их способность производить аутоантитела класса IgM, что делает понимание их природы клинически важным вопросом. Популяция B1-клеток является, вероятно, основным источником естественных аутоантител, представленных в сыворотке крови здоровых лиц. Естественные аутоантитела встречаются в крови взрослых, детей, новорожденных и даже у плода. Они присутствуют в малых количествах и почти всегда связываются со многими антигенам (мультиреактивные аутоантитела) и имеют низкую аффинность к их лигандам. Пока не определено однозначно, продуцируются ли естественные аутоантитела исключительно B1-клетками, или их способны производить также B2-клетки.
Миеломная болезнь
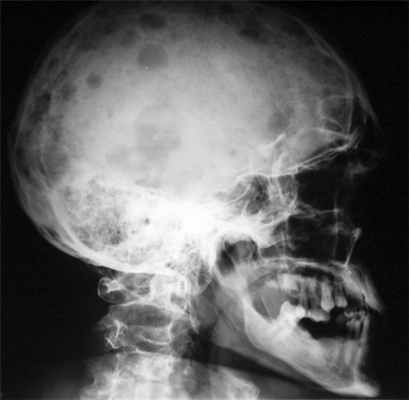
Миеломная болезнь – патологическое состояние кровеносной системы, которое характеризуется наличием новообразования из лимфоцитарных плазмоцитов злокачественной этиологии. Оно является причиной скопления в крови больного аномальных антител “Ig”, что приводит ко сбоям гуморального иммунитета и деструкционным процессам костных тканей. Чаще всего заболевание поражает костный мозг и кости, намного реже – лимфатические узлы, селезёнку, кишечник. Среди всех новообразований злокачественной природы, поражающих лимфатические и кроветворные ткани, доля миеломы не превышает 10%. Ею страдают пациенты старше сорока лет, намного чаще – мужчины.
Миелома: причины
Причины развития миеломы до сих пор не выяснены. Специалисты выдвигают разные теории. Достаточно часто у пациентов выявляют хромосомные мутации разного типа, а также врождённую предрасположенность, которая передаётся по наследству от родителей к детям. Последние годы наблюдается увеличение числа больных, что связывают с воздействием разного рода канцерогенов и радиоактивного облучения. Довольно часто злокачественные опухоли диагностируют у пациентов, работа которых предусматривает контакт с нефтепродуктами, а также у фермеров и столяров.
Неконтролируемый рост миеломной ткани в костном мозге провоцирует разрушение кроветворной ткани и угнетение ростков миело- и лимфопоэза. В результате число красных и белых кровяных телец, а также тромбоцитов в крови уменьшается. Плазматические клетки не могут выполнять иммунную функцию в полной мере из-за серьёзного снижения синтеза и аномально быстрой деструкции нормальных антител. Вокруг новообразования появляются очаги растворения костной ткани: она становится мягкой и ломкой, в кровь поступает большой объём кальция.
Миеломная болезнь: симптомы
Начальные этапы развития заболевания протекают практически без симптоматики. Больной чувствует себя хорошо, а новообразование выявляют случайно при проведении лабораторного исследования крови. Клинические проявления множественной миеломы, поражающей красный костный мозг позвоночника, рёбра, кости таза и бёдер, начинаются с ощущения боли в них. Последняя возникает во время выполнения движений или ощупывания. Спонтанные переломы костей – не редкость. Особенно опасны компрессионные переломы позвоночника, которые провоцируют:
- компрессию спинного мозга;
- нарушения чувствительности конечностей;
- сбои в работе кишечника и органов мочевыводящей системы.
Симптоматика миеломного амилоидоза заключается в проявлениях поражения разных внутренних органов, включая сердце, желудочно-кишечный тракт, а также глаза, язык, суставные сочленения, кожу:
- нарушения сердечного ритма в виде тахикардии;
- сердечная недостаточность;
- увеличение тканей языка;
- затруднённое и болезненное пищеварение;
- дистрофические процессы роговой оболочки;
- деформационные процессы суставов;
- системные поражения периферических нервов.
Тяжёлое течение миеломы характеризуется:
- увеличенным образованием урины;
- тошнотой и рвотой;
- обезвоживанием организма;
- ощущением слабости в мышцах;
- быстрой утомляемостью и сонливостью;
- в ряде случаев – комой.
Из-за того, что кровь становится более вязкой, нарушается её микроциркуляция. Больной становится восприимчивым к воздействию патогенных бактериальных агентов, поэтому даже на ранней стадии миеломы он может заболеть воспалением лёгких или пиелонефритом, течение которого будет достаточно тяжёлым. Осложнения после инфекционных заболеваний являются одними из самых главных причин смерти при миеломе.
Миеломная болезнь: диагностика
При подозрении на миеломную болезнь специалисты нашей клиники назначают пациенту комплексную диагностику. В первую очередь проводится осмотр, во время которого врач пальпирует болезненные области. После этого требуется:
- рентгенография таза, черепа, грудной клетки;
- лабораторные исследования крови;
- цитогенетическое исследование лимфоцитарных плазмоцитов;
- гистологические и цитологические исследования костного мозга.
Как лечить миеломную болезнь?
Для того, чтобы получить наилучшие результаты и повысить качество жизни пациента, гематологи ЦЭЛТ разрабатывают тактику лечения сразу же после постановки диагноза. Они руководствуются данными диагностических исследований и индивидуальными показаниями пациента. Если миелома развивается медленно, показана выжидательная тактика со внимательным наблюдением вплоть до периода повышения интенсивности симптомов.
| Методы лечения | Когда показаны? В чём заключаются? |
| Химиотерапия | Является основным способом при множественной миеломе. Заключается в полихимиотерапии с применением «Мелфалана», «Леналидомида», «Циклофосфана». У молодых пациентов с плохим прогнозом миеломной болезни проводят терапию высокими дозами препаратов с последующей трансплантацией. |
| Хирургические вмешательства | Показаны при компрессиях жизненно важных органов и направлены на удаление злокачественного новообразования. |
| Лучевая терапия | Показана больным, которые серьёзно ослаблены и имеют осложнения в виде почечной недостаточности. Её рекомендуют пациентам с новообразованиями, резистентными к химической терапии и при местных поражениях костной ткани. |
После завершения курса лечения заболевание рецидивирует в течение следующих двенадцати месяцев. Каждая последующая ремиссия длится меньше предыдущей и достигается с большим трудом. Для того, чтобы продлить её, больному назначают поддерживающую терапию с применением препаратов интерферона «А». Полное выздоровление возможно лишь в 10% случаев.
В отделении гематологии ЦЭЛТ ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на консультацию онлайн или обратившись к операторам нашей информационной линии. Являясь многопрофильной, наша клиника предлагает услуги отоларингологов высокой квалификации. Нашим пациентам доступна септопластика, благодаря которой они смогут повысить качество своей жизни.
Читайте также:
