Генотерапия генетических болезней. Требования
Добавил пользователь Евгений Кузнецов Обновлено: 30.01.2026
- Если у вас есть вопросы:
- 8 (495) 215-15-14
Описание наследственных заболеваний
Всего известно около 7000 генетических, или наследственных, заболеваний. Они вызваны нарушениями наследственного аппарата клеток: мутациями ядерной или митохондриальной ДНК. Слово «наследственный» при описании таких патологий означает способность передаваться по наследству. Иногда применяют термин «врожденный» к таким болезням, подразумевая присутствие их явной или скрытой форме при рождении.
Генетическая патология чаще всего проявляется рано, когда ребенок новорожденный или младенец. Она может нарушать работу органов и приводить к преждевременной смерти. Описаны наследственные патологии, проявляющиеся только у взрослых. Изучением наследственных нарушений занимается медицинская генетика.
Передача генетических болезней связана с типом наследования: аутосомный (доминантный, рецессивный) и сцепленный с половыми хромосомами (X, Y). Аутосомное нарушение находится в неполовых хромосомах (22 пары аутосом). Доминантность или рецессивность определяется тем, достаточно для проявления болезни мутации на одной хромосоме из пары (доминантный тип) или обязательно мутация должна быть на обеих хромосомах (рецессивный тип). При аутосомно-рецессивном наследовании носитель мутации на одной хромосоме обычно здоров, но может передать нарушение детям. Отдельную группу составляют митохондриальные болезни: мутация присутствует в ДНК энергетических станций клетки (митохондрий). Митохондрии человек получает только от матери (клеточные структуры сперматозоида при оплодотворении не проникают в яйцеклетку, только ДНК), поэтому наследование таких патологий происходит по материнской линии: от матери ребенку любого пола.
Частота встречаемости генетических болезней
Среди разных стран отличается список наиболее распространенных и редких генетических болезней. В России можно назвать самыми частыми муковисцидоз, галактоземию, спинальную мышечную атрофию (СМА). Среди генетических есть редкие болезни. В России такими считаются заболевания с частотой встречаемости не более 10 случаев на 100 тысяч человек. Например, перечень редких болезней России включает из генетических такие патологии как фенилкетонурию (ФКУ), глазной альбинизм, липофусциноз.
Причины наследственных заболеваний
Наследственное заболевание возникает при наличии у человека изменения генетического материала (мутация). Мутации подразделяют на генные (нарушение наблюдается внутри одного гена), хромосомные (нарушение наблюдается внутри одной хромосомы), геномные (изменяется число хромосом). Генные мутации, например, замена, добавление, исчезновение одного или нескольких нуклеотидов, нарушают генетический код организма: систему кодирования трех нуклеотидов в одну аминокислоту белка. Мутации, затрагивающие большие участки ДНК, например, когда появляется одна лишняя хромосома, чаще всего не совместимы с жизнью, поэтому приводят к самопроизвольному прерыванию беременности на ранних сроках. Например, эмбрионы с лишней хромосомой (трисомией) во всех парах (кроме 13, 18, 21 пары и половых хромосом) не жизнеспособны.
Мутация может быть унаследована от родителей или возникнуть в клетках зародышевой линии, зиготе (оплодотворенной яйцеклетке), на ранних этапах развития эмбриона (в таком случае говорят о возникновении мутации de novo). Некоторые мутации проявляются только, когда присутствуют на двух хромосомах (аутосомно-рецессивные). Здоровый человек может быть носителем мутации в одной хромосоме (гетерозиготная форма). Если у второго родителя такой же ген содержит мутацию, то у ребенка может произойти объединение двух нарушений и развиться заболевание. Это верно, если вариант генный. Если вариант геномный, то есть происходит увеличение или уменьшение количества хромосом в геноме, то он всегда приводит к нарушению развития органов.
Неонатальный скрининг
В России бесплатно проводят обследование новорожденных на 5 наследственных заболеваний: фенилкетонурия (нарушение обмена аминокислот), муковисцидоз (поражает органы дыхания и пищеварения), врожденный гипотиреоз (заболевание щитовидной железы), адреногенитальный синдром (избыточная выработка гормонов надпочечников), галактоземия (нарушение обмена углеводов). Это неонатальный скрининг, целью которого является ранняя диагностика болезней у детей. Неофициально его называют "пяточным тестом", так как для него врач берет кровь из пяточек новорожденного, когда младенец еще не покинул роддом. Пальчики ребенка слишком малы, чтобы брать периферическую кровь, поэтому используется пятка. Для анализа требуется несколько капель крови, которые наносят на специальный тест-бланк. Обычно анализ проводится на 4 (доношенный ребенок) или 7 (недоношенный ребенок) день жизни. Если тест не успевают сделать в роддоме, то анализ проводит патронажная медсестра в первые дни после выписки малыша.
Если результат этого анализа отклоняется от нормы, то родитель узнает об этом. В таком случае проводят повторное исследование. Если повторный результат оказался таким же, как и первый, то врач начинает разрабатывать программу лечения. Несмотря на небольшое число случаев в год заболеваний, входящих в неонатальный скрининг, их раннее выявление и начало лечения крайне важно, так как позволяет снизить проявления болезни или даже спасти жизнь. Ранняя постановка диагноза также важна для определения того, как лечить ребенка, построения схемы терапии. Заниматься лечением наследственных болезней будут несколько врачей разных специальностей, так как нарушения развиваются в разных системах органов.
Молекулярная диагностика у новорожденных является основным способом предположить болезнь, так как у маленьких детей симптомы либо еще не проявились, либо проявились не полностью, что может не позволять провести диагностику по клиническим признакам. В дальнейшем развитие симптомов приведет к постановке диагноза, но лечение уже может оказаться неэффективным. Примером служит фенилкетонурия: без раннего назначения диеты, исключающей аминокислоту фенилаланин, у ребенка развиваются необратимые поражения головного мозга.
Генетический тест на заболевания ребенка
Ребенку может быть проведено расширенное генетическое тестирование для того, чтобы определить риск развития других наследственных болезней, помимо тех пяти, что выявляет при рождении неонатальный скрининг. Медико-генетический центр Genotek проводит тест «Риски заболеваний» для того, чтобы определить предрасположенность к более чем 180 болезней. А будущие родители могут пройти тест «Заболевания ребенка», который поможет определить риск развития патологий до того, как наступила беременность. Врач генетик после проведения тестирования расскажет о рисках. Поэтому рекомендуется консультация генетика после анализа. Это тестирование можно проводить на этапе, когда супруги осуществляют планирование беременности. Такое обследование является важной частью подготовки. Чтобы осуществить рождение здорового ребенка, делать его необходимо обоим супругам.
Неинвазивный пренатальный тест
Также может проводиться исследование генетических болезней плода неинвазивным способом. Метод проведения такого анализа называется НИПТ (неинвазивное пренатальное тестирование). Он позволяет выявлять крупные нарушения 21, 18, 13, половых хромосом в циркулирующей ДНК плода. НИПТ предполагает взятие венозной крови матери, перед процедурой не требуется специальной подготовки. Проводить анализ можно, начиная с 10 недели беременности. Тест не исследует весь геном, а только крупные перестройки определенных хромосом. Это метод скрининга, выявления группы риска, а не постановки диагноза. Поэтому при положительном результате такого исследования рекомендуется проведение инвазивного анализа (амниоцентеза или кордоцентеза) для подтверждения того, что плод действительно имеет нарушение. Проведение инвазивной процедуры может сопровождаться риском прерывания беременности (1-2%), так как беременный организм воспринимает вмешательство как стрессовый фактор. Поэтому женщина может отказаться сдавать инвазивный тест после НИПТ, но пройти консультацию врача-генетика и обсудить различные варианты дальнейшего ведения беременности.
Генотерапия генетических болезней. Требования
Генная диагностика. Генная терапия. Что такое генная диагностика и генная терапия? Виды генной терапии.
Генная диагностика имеет большое будущее в экспресс-диагностике инфекционных болезней. На ранних этапах инфекции, когда AT в организме ещё не выработаны, диагностика основана на идентификации Аг, в том числе специфических генов возбудителя. Для этого выявления наиболее часто применяют методы гибридизации и амплификации ДНК (см. также главу 11).
Генная терапия — метод лечения заболеваний, основанный на переносе в клетки организма определённых генов. Основная проблема генной терапии — разработка эффективного и безопасного способа переноса необходимых генов в дефектные клетки организма. В качестве «средств доставки» генов используют различные векторы, наиболее часто — различные вирусы (см. ниже). В настоящее время разработки генной терапии касаются только соматических клеток.
14 сентября 1990 г. была проведена первая успешная попытка коррекции генных дефектов при наследуемом Т-клеточном иммунодефиците, связанном с недостаточностью фермента аде-нозин дезаминазы. Двум больным девочкам провели пересадку собственных Т-лимфоцитов, в которые был внесён трансген — нормальный ген недостающего фермента. В результате нескольких проведённых инфузий у обеих пациенток наступило полное выздоровление. В настоящее время несколько тысяч больных несут в своём организме клетки, генетически изменённые искусственным путём.
В 1992 г. в США осуществили введение в клетки печени человека гена белка-рецептора, адсорбирующего липопротеины низкой плотности в гепатоциты женщины, страдающей выраженным атеросклерозом (патология была связана с дефицитом липопротеинов вследствие генных нарушений). Посредством трансфекции ген был введён в гомогенизированные клетки печени, которые затем переносили в печень пациентки. После такой процедуры состояние женщины улучшилось, хотя до пересадки «генно-инженерной печени» она перенесла инфаркт (в 16 лет) и операцию на сердце (в 26 лет).
Виды генной терапии
В настоящее время разработаны три основных вида генной терапии, различаемых по способу доставки вектора в поражённые клетки.
Генная терапия ex vivo. Поражённые клетки выделяют из организма пациента, инкубируют с вектором, после чего генно-инженерные (генетически изменённые) клетки вносят в организм. Наиболее часто метод применяют в отношении клеток крови. Это связано с простотой их выделения и последующего обратного введения.
Генная терапия in situ. В этом случае вектор вводят непосредственно в поражённые ткани. Например, пациентам с муковисцидозом аденовирусные векторы доставляют непосредственно в трахею и бронхи; в некоторые опухоли непосредственно инъецируют вектор, несущий цитокин или токсин; в мышцу больного, страдающего мышечной дистрофией, производят инъекцию вектора, несущего ген дистрофина.
Генная терапия in vivo — вектор вводят в кровоток. До настоящего времени на практике этот метод не применяли, однако метод прост и удобен, поэтому его считают наиболее перспективным.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
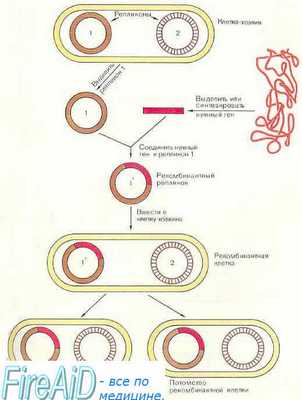
Технология рекомбинантной ДНК предоставила замечательные возможности лечения генетических болезней на наиболее фундаментальном уровне — уровне непосредственно гена. Принцип генотерапии достаточно прост: ввести в клетку ген для достижения терапевтического эффекта.
При наследственных болезнях наиболее частое применение генотерапии — введение функциональных копий важного гена в соответствующие клетки пациента с мутацией, приводящей к утрате функции (поскольку такими мутациями вызвано большинство генетических болезней). Таким образом, возможна коррекция обратимых признаков для многих генетических заболеваний.
В действительности эта простая, предложенная уже десятилетия назад концепция оказалась неожиданно сложной в практическом применении. Однако первые успехи генотерапии у человека показаны на примере продолжительного (более 5 лет) эффекта коррекции двух форм тяжелого комбинированного иммунодефицита у детей (обсуждаемого позже) и на больших исследованиях животных моделей нескольких других болезней.
Минимальные требования, необходимые для использования переноса генов при лечении генетических заболеваний, представлены ниже.

Требования, необходимые для генотерапии наследованных заболеваний
• Сущность молекулярного дефекта. Должна быть известна сущность патологического гена или, по крайней мере, биохимическая природа заболевания.
• Функциональная копия гена. Должна быть доступны кДНК клона гена или сам ген. Если ген или к ДНК слишком велики для текущего поколения векторов, может оказаться достаточной функциональная версия гена с удаленными несущественными компонентами для уменьшения его размера.
• Знание патофизиологического механизма. Знание патофизиологического механизма болезни должно быть достаточным, чтобы понимать, как передача гена будет улучшать или корректировать патологический процесс и предохранять, замедлять или восстанавливать важные фенотипические отклонения. Мутации с потерей функции требуют введения функционального гена; для болезней с доминантным аллелем может потребоваться инактивации мутантного гена или его продуктов.
• Благоприятное соотношение риск/польза. Должны быть реальная тяжесть болезни и благоприятное соотношение потенциальных риска и пользы по сравнению с альтернативными методами лечения.
• Подходящие регулирующие компоненты для переносимого гена. Точное регулирование уровня экспрессии гена сравнительно неважно при некоторых болезнях и критично при других. Например, при талассемии избыточная экспрессия переданного гена будет вызывать новый дисбаланс цепей глобина в эритроцитах, а низкий уровень экспрессии окажется нерезультативным.
При некоторых энзимопатиях даже несколько процентов нормальной экспрессии могут вызвать терапевтический эффект, а аномально высокие уровни экспрессии могут не обладать вредными последствиями.
• Подходящая целевая клетка. Считают, что целевая клетка должна иметь длинный период жизни или хороший репликативный потенциал in vivo. Она также должна быть доступной для прямого введения гена или иметь возможность доставлять к ней (например, через кровоток) число копий гена, достаточное для достижения терапевтического эффекта.
Возможности для генотерапии часто увеличиваются, если целевые клетки могут культивироваться in vitro, что облегчает перенос гена; в этом случае необходима возможность введения достаточного количества клеток пациенту и их функционально интегрировать в соответствующем органе.
• Надежное подтверждение эффективности и безопасности. Необходимы доказательства как эффективности, так и безопасности используемых векторов и генов исследованиями на животных и культурах клеток. В идеале должно быть показано, что генотерапия эффективна, безопасна и имеет длительный эффект в генетических исследованиях на модели болезни у крупных животных.
В настоящее время многочисленные животные модели существуют только для нескольких моногенных болезней. Более широко используются искусственно созданные или спонтанные мутации у мышей.
• Разрешение регулирующих органов. Важно наличие одобрения протокола лечения соответствующими государственными организациями. В большинстве стран исследования по генотерапии человека требуют разрешения правительства.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фетальная генная терапия: от теории — к практике

Обзор
Фетальная терапия плода уже совсем скоро может позволить успешно лечить генетические аномалии, рак и другие заболевания
Автор
Редактор
Статья на конкурс «био/мол/текст»: «Миша родился 12 февраля здоровым ребенком. Но в 1,5 месяца я стала замечать, что на всех фотографиях малыш занимает одну и ту же позу, как будто его ножки неподвижны. Уже через несколько недель нам поставили диагноз, посочувствовали и посоветовали начать планировать второго, здорового ребенка». Из-за роковой комбинации генов Миша, как и остальные дети с этим заболеванием, был вынужден всю свою короткую жизнь бороться за каждое движение. Бороться отчаянно, изо всех сил, но в конце концов проиграть. Спинальная мышечная атрофия (СМА) относится к числу генетических аномалий, перед которыми человечество пока бессильно. Однако успехи генной терапии, за которыми сегодня наблюдает медицинский мир, могут перевести и СМА, и другие тяжелые наследственные патологии в разряд излечимых. Более того — излечимых еще внутриутробно.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Природа ошибается, человек исправляет
Концепция генной терапии элегантна и красива, как все гениальное . Она заключается в доставке с помощью векторных систем [1] здорового генетического материала в клетку с целью заменить им «ошибочные» гены, с которыми сопряжены различные заболевания (рис. 1).
«Биомолекула» уже писала подробно о том, какие возможности открывает генная терапия в лечении рака [2] и наследственных аномалий, в частности, пигментного ретинита [3].
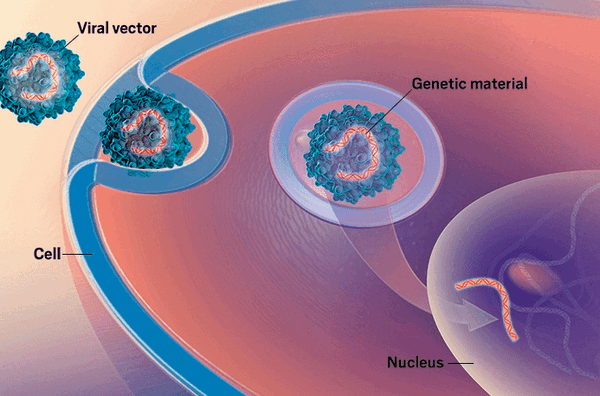
Рисунок 1. Перенос генетического материала в клетку с помощью вирусного вектора
Тем не менее очевидно, что генная терапия имеет ряд ограничений, особенно когда речь идет о наследственных заболеваниях. Прежде всего, патологический процесс в таких случаях может начаться еще внутриутробно. К моменту, когда заболевание, наконец, диагностируют, — а это порой происходит спустя годы после рождения ребенка, — могут развиться необратимые повреждения клеток и органов, что значительно сужает терапевтические возможности или вообще сводит их на нет [4].
Шанс решить эту проблему появился благодаря современной пренатальной диагностике, которая позволяет обнаружить хромосомные дефекты уже на ранних стадиях беременности. Получив любой фетальный материал с помощью инвазивных методик, можно быстро и достоверно диагностировать генетические заболевания. А в случаях с гемоглобинопатиями необходимость в инвазивных манипуляциях и вовсе отпадает: чтобы их выявить, достаточно исследовать фетальные ДНК, полученные из клеток крови матери [5].
Идея фетальной генной терапии далеко не нова: всего через несколько лет после первой попытки проведения генной терапии у взрослых, в 1994 году исследователи начали всерьез обсуждать применение инновационной методики внутриутробно [6]. Сегодня, когда лечение генетических заболеваний в утробе матери уже практически превратилось из фантастической перспективы в реальность, опубликована масса работ, где подробно изучена фетальная генная терапия и ее преимущества по сравнению с генной терапией взрослых.
Пренатально vs постнатально
Предваряя вопросы о целесообразности внутриутробной коррекции генетической аномалии, сразу же остановимся на преимуществах генной терапии плода по сравнению с постнатальной генной терапией.
Широкие возможности воздействия на органы и системы
Известно, что при многих генетических заболеваниях (к примеру, буллезном эпидермолизе или кистозном фиброзе) бывает довольно сложно повлиять на основные звенья патологического процесса практически сразу после рождения. Коррекция же мутантных генов у развивающегося плода позволяет быстро увеличить популяцию стволовых клеток, обеспечив большой пул трансфицированных клеток и, как следствие, выраженный терапевтический эффект.
Упрощенное производство клинического вектора, переносящего генетический материал
Дозировка вирусного вектора, с помощью которого переносят генетический материал, зависит от массы тела. Благодаря малому размеру плода удается достигнуть гораздо более высокого биораспределения вектора при той же его дозировке, что в ходе генной терапии взрослого. Это позволяет сэкономить и время, и средства. Представить, насколько существенна экономия, помогают простые сравнительные данные: так, плод в 14–16 недель беременности (оптимальный срок индуцирования вектора) весит около 100 г, в то время как средняя масса тела взрослого составляет около 60 кг.
Повышение эффективности терапии за счет неполноценного иммунного ответа
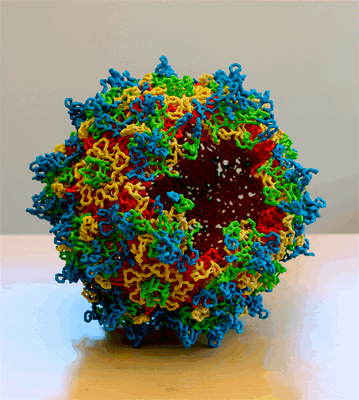
Рисунок 2. Трехмерная модель капсида аденоассоциированного вируса, содержащего 60 белковых субъединиц
Ряд исследований продемонстрировал, что гуморальный иммунитет к аденовирусам и аденоассоциированным вирусам (AAV) (рис. 2) определенных серотипов, которые обычно используются в качестве векторов, может приводить к неудаче при экспрессии трансгена [7]. Это может стать одним из критических барьеров для успешной трансплантации.
В группу риска попадают около 50% взрослых, имеющих приобретенный иммунный ответ к этим вирусным векторам [8]. Но даже при отсутствии чувствительности введение вектора у взрослых нередко приводит к развитию иммунного ответа, снижающего длительность и уровень трансгенной экспрессии. Так, после внутримышечной инъекции аденовирусного вектора с геном белка дистрофина взрослым мышам с миодистрофией Дюшенна образуются антитела к дистрофину [9], что сопряжено со значительным снижением эффективности экспрессии. В то же время плод в утробе матери иммунологически незрел, что позволяет доставлять вирусный вектор и трансгенный продукт без ограничения, которое накладывает иммунный ответ [10].
Очевидные преимущества фетальной терапии по сравнению с постнатальной коррекцией обеспечивают ее более высокую эффективность и целесообразность, особенно при тяжелых, опасных для жизни заболеваниях. Даже в случаях, когда полного излечения достигнуть невозможно, фетальная генная терапия может влиять на патологические звенья заболевания, облегчая его течение и улучшая прогноз. А, следовательно, именно она может стать единственной терапевтической альтернативой прекращению беременности для тысяч семей. Тем более что число заболеваний, которые потенциально могут оказаться под контролем при внедрении генной терапии плода в клиническую практику, поистине огромно.
Перспективы и возможности
Генная терапия плода, предположительно, способна взять под контроль множество опасных патологий. Лишь малая их толика представлена в таблице 1.
| Заболевание | Геннотерапевтический препарат | Целевые клетки и/или орган | Возраст манифестации заболевания | Распространенность | Продолжительность жизни |
|---|---|---|---|---|---|
| Кистозный фиброз | CFTR (трансмембранный регулятор) | Эпителиальные клетки дыхательных путей и кишечника | Третий триместр беременности | 1:4000 | Около 35 лет |
| Мышечная дистрофия Дюшенна | Дистрофин | Миоциты | 2 года | 1:4500 | 25 лет |
| Спинальная мышечная атрофия | Белок SMN | Мотонейроны | 6 месяцев (тип I) | 1:10 000 | 2 года |
| Гемофилия [12] | Фактор свертывания крови VIII или IX | Гепатоциты | 1 год | 1:6000 | При корректной терапии нормальная продолжительность жизни |
| Бета-талассемия | Глобин | Прекурсоры эритроцитов | До года | 1:2700 | До 20 лет |
| Болезнь Гоше | Глюкоцереброзидаза | Гепатоциты | 9,5 лет | 1:59 000 | Менее 2 лет |
| Дефекты цикла мочевины | Орнитина транскарбамилаза | Гепатоциты | 2 дня | 1:30 000 | 2 дня |
| Буллезный эпидермолиз | Коллаген тип VII | Кератиноциты | Рождение | 1:40 000 | При корректной терапии нормальная продолжительность жизни |
| Гипоксическая ишемическая энцефалопатия | Нейротрофические факторы | Кортикальные нейроны | Рождение | 1:1000 | При корректной терапии нормальная продолжительность жизни |
| Тяжелая внутриматочная задержка роста | Плацентарные факторы роста | Трофобласт | Плод | 1:500 | Несколько дней |
Кроме того, к числу патологий, которые, предположительно, могут поддаваться контролю с помощью фетальной терапии, относятся [5]:
- Иммунодефицитные расстройства — синдром «голых» лимфоцитов, гипоплазия хряща, синдром Чедиака—Хигаши, хроническая гранулематозная болезнь, синдром Костмана, дефицит адгезии лейкоцитов, синдром Оменна, синдром Вискотта—Олдрича.
- Гемоглобинопатии — резус-болезнь, врожденная эритропоэтическая порфирия.
- Заболевания, сопряженные с дефицитом активности ферментов, — болезнь Гоше, болезнь Краббе, метахроматическая лейкодистрофия, мукополисахаридозы, болезнь Волмана, болезнь Ниманна—Пика.
- Другие — конгенитальный дискератоз, семейный гемафагоцитический лимфогистиоцистоз, инфантильный остеопетроз, синдром Швахмана—Даймонда и др.
Список заболеваний, которые могут оказаться «по плечу» фетальной генной терапии, поражает воображение: предположительно, эта методика позволит вмешаться в ранее неподвластные человеку патологические процессы, обусловленные моногенными заболеваниями. Их количество, по данным Всемирной организации здравоохранения, достигает десяти тысяч [10]. Тем не менее важно учитывать существование ряда ограничений, и в первую очередь рисков для матери и плода, сопряженных с проведением внутриутробной генной терапии.
Страхи и риски
Специфические риски пренатального переноса генов кардинально отличаются от рисков постнатальной генной терапии. Они включают краткосрочные неблагоприятные реакции и долгосрочные постнатальные эффекты. Их актуальность обостряется в связи с тем, что гипотетически экспрессия генов плода может оказывать непредсказуемое действие как на пренатальное, так и на постнатальное развитие [13].
Прежде всего, непосредственно сама процедура переноса связана с увеличением вероятности выкидыша, хориоамнионита и преждевременных родов. В исследованиях зафиксированы воспалительные реакции на вектор, в частности, инфильтрация печени и некроз печени при фетальной генной терапии овец [4].
Одна из чрезвычайно важных проблем фетальной генной терапии заключается в потенциальном риске, который возникает при передаче плоду донорских последовательностей ДНК. Поскольку векторная интеграция в зародышевые клетки, по всей вероятности, будет носить случайный характер, она теоретически может иметь катастрофические последствия для плода. По сути, ребенок, получивший внутриутробно донорский генетический материал, рождается мутантом. Этическая составляющая генной терапии тревожит умы ученых и богословов. Последние еще со времен рождения самой известной в истории науки овечки предупреждают об опасностях, которые несет человечеству вмешательство в замысел божий.
Еще один важный аспект обусловлен вероятностью мутагенеза в клетках плода, приводящего к дефекту какого-либо функционального гена, что в конечном счете может стать причиной теперь уже нового, приобретенного генетического заболевания или злокачественной опухоли. Ее вероятность выглядит еще более реальной с учетом данных исследования на мышах, в ходе которого экспрессия генов у зародышей мышей дала толчок развитию опухоли печени [14].
В этом контексте могут оказаться далеко не случайными результаты двух исследований, продемонстрировавших развитие серьезных побочных эффектов после успешной генной терапии Х-сцепленного комбинированного иммунодефицита: в первом случае была зафиксирована манифестация моноклонального лимфопролиферативного заболевания, а во втором — альфа/бета Т-клеточной пролиферации. И в первом, и во втором случаях ретровирусный вектор интегрировался в непосредственной близости от гена LMO2 в пролиферирующих Т-клетках [15].
Теоретически генная терапия ex vivo может быть более безопасной по сравнению с in vivo фетальным введением вектора. Хотя это и не исключает вероятность мутагенеза в клетках, которые ретровирально трансдуцируются in vitro, введение мутагена можно легче определять и контролировать. Тем не менее полностью исключить эти осложнения, увы, нельзя.
И, наконец, фетальная генная терапия повышает восприимчивость клеток зародыша к трансдукции. Низкоуровневая ретровирусная трансдукция в предшественники зародышевых клеток наблюдалась в мужских и женских гонадах после внутрибрюшинного введения вектора эмбрионам овец и обезьян соответственно [13]. Анализ факторов, приводящих к непреднамеренной трансдукции, показал, что восприимчивость зародышевой ткани к ней зависит от гестационного возраста с более высокими показателями трансдукции на ранней стадии беременности [10].
С точки зрения потенциальных рисков очевидно, что фетальная генная терапия может быть обоснованным методом лечения только тяжелых генетических заболеваний, других вариантов коррекции которых не существует. И среди них, безусловно, болезнь Гоше, возможность внутриутробной генной терапии которой продемонстрировали в исследовании, опубликованном совсем недавно.
Первый пошел: болезнь Гоше
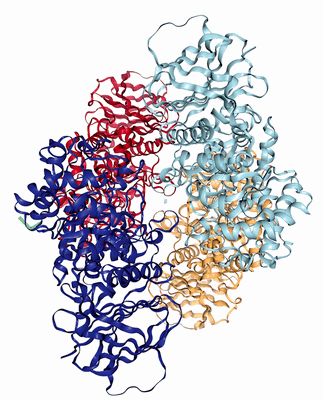
Рисунок 3. Структура димера глюкозоцереброзидазы — фермента, уровень которого патологически снижается при болезни Гоше
В июле 2018 года журнал Nature Medicine опубликовал результаты исследования на мышах, проведенного под руководством Симона Уоддингтона (Simon Waddington) из лондонского Института женского здоровья. Результаты работы продемонстрировали эффективность фетальной генной терапии в лечении нейродегенеративных заболеваний и, в частности, болезни Гоше [16]. Это самая частая форма среди редких наследственных ферментопатий, в основе которой лежит дефицит активности лизосомного фермента глюкозоцереброзидазы (рис. 3), обусловленный мутациями в гене глюкозилцерамидазы. В зависимости от характера мутаций, может развиваться тяжелая нейропатическая форма заболевания, манифестирующая с младенчества, или форма с более постепенным началом и менее выраженными симптомами. В то время как более легкие формы болезни Гоше хорошо поддаются заместительной терапии, тяжелая форма пока остается летальной. Признаки неизлечимой формы болезни Гоше появляются в первые месяцы жизни и включают прогрессирующую мышечную гипотонию, задержку и регресс психомоторного развития и другие неврологические признаки.
В ходе исследования Уоддингтон с соавторами продемонстрировал, что интракраниальное введение аденоассоциированного вирусного вектора 9 (AAV9) эмбриону мышей на 16 день гестации приводило к повышению экспрессии глюкозоцереброзидазы, что останавливало нейродегенерацию. При этом активность фермента в головном мозге была сравнима с таковой у здоровых мышей. Несмотря на то, что у больных грызунов все же диагностировался воспалительный процесс в головном мозге, они развивались достоверно лучше, чем мыши из группы контроля, которых пришлось усыпить через две недели после лечения из-за тяжести заболевания.
Мыши, подвергшиеся фетальной генной терапии, жили, по крайней мере, 18 недель, были фертильными и мобильными. Интересно, что введение вектора постнатально также облегчало течение заболевания, однако было менее эффективным, чем пренатальная экспрессия.
Поскольку AAV9 был способен проникать в мозг из кровотока, команда Уоддингтона провела еще один эксперимент, в ходе которого ввели значительно более высокую дозу вектора не в головной мозг, а непосредственно в кровь зародышей мышей. Мыши после экспрессии были в основном неотличимы от здоровых особей, но, поскольку по условиям эксперимента продолжительность их жизни составила только 55 дней, ученые не смогли сделать выводы о долгосрочной эффективности внутривенной генной терапии.
Эксперимент Уоддингтона стал самой сложной на сегодня работой, в ходе которой была проведена фетальная генная терапия у животных. Сегодня команда работает с корпорацией Apollo Therapeutics, объединившей усилия трех британских университетов и трех крупнейших фармацевтических компаний. Уоддингтон с коллегами преследуют новую цель: на сей раз перед ними стоит задача получить доклинические данные и потенциально протестировать лечение людей. И пока скептики размышляют над кругом возможностей применения фетальной генной терапии у человека, который может значительно сужаться из-за того, что болезнь Гоше не входит в пренатальные тесты, команда Уоддингтона уверенной поступью шагает в будущее. Будущее, где смогут выздоравливать дети с болезнью Гоше, миодистрофией Дюшенна, СМА и многими другими редкими, но сегодня, увы, неизлечимыми заболеваниями.
Принципы генотерапии. Цели генной терапии
Цель генотерапии — улучшить здоровье пациента путем коррекции мутантного фенотипа. Для этого необходимо введение в соматические клетки нормального гена. Помимо этических и технических трудностей, не нужно и нежелательно изменять половые клетки пациента, получающего лечение по поводу генетической болезни.
Одно из опасений — то, что любая попытка внедрить нормальную копию гена в половые клетки (или в оплодотворенное яйцо) несет высокий риск ввести новую мутацию.
В таких случаях обычно не важно, в какой участок генома клетки включается пересаженный ген. В некоторых долгоживущих типах клеток стабильная продолжительная экспрессия может не требовать интеграции введенного гена в основной геном. Например, если переданная ДНК стабилизируется в клетке в форме эписомы (стабильная ядерная, но не хромосомная, молекула ДНК, формируемая, например, аденовирусным вектором, обсуждаемым далее) и если целевая клетка долгоживущая (например, нейрон, миоцит, гепатоцит), то продолжительная экспрессия может происходить без интеграции ДНК в геном.
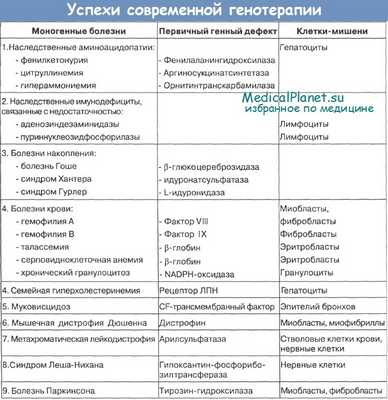
Чтобы функционировать в клетке, продукт перенесенного гена должен иметь возможность усваивать кофакторы или другие молекулы, необходимые для его функции. Например, если ген ФАГ внести в клетки костного мозга или мышечные клетки, в норме не синтезирующие кофактор фермента ВН4, этот кофактор следует давать дополнительно перорально.
Во-вторых, генотерапия может использоваться для замены или инактивации доминантного мутантного аллеля, аномальный продукт которого вызывает болезнь. При болезни Гентингтона, например, необходимо заменить ген болезни, содержащий экспансию повторов тринуклеотида CAG или, по крайней мере, сам участок экспансии. Кроме того, можно попытаться разрушить мутантную РНК, не удаляя кодирующий ее ген.
Например, избирательное разложение мутантной мРНК, кодирующей доминантный коллаген pro-альфа-11(I), вызывающий несовершенный остеогенез, в принципе должно уменьшать костные аномалии при этом заболевании. Как уже упоминалось, в лабораторных исследованиях показано, что для избирательного разрушения мутантной мРНК может использоваться синтетический ген, кодирующий небольшую интерферирующую РНК.
Наконец, в-третьих, генотерапия может быть наиболее широко использована для получения фармакологических эффектов. От этого метода, вероятно, получат пользу пациенты с опухолями.
Стратегии передачи генов в генотерапии
Для передачи соответствующего искусственного гена в целевые клетки используют одну из двух основных стратегий. Во-первых, используют введение гена в полученные от пациента клетки ex vivo (т.е. за пределами организма), а затем вновь вводят их в организм. При втором методе ген вводят непосредственно в ткань или внеклеточную жидкость (из которых он выборочно усваивается целевыми клетками).
«Нацеливание» при этом типе передачи обычно достигают модификацией оболочки вирусного вектора, так чтобы вирусные частицы связывались только определенными клетками.
Читайте также:
- Микроорганизмы. Типы микроорганизмов. Классификация микроорганизмов. Прионы.
- Клиника и диагностика панариция (гнойного воспаления кисти)
- КТ при надпочечниковой недостаточности
- Осложнения обрезания у мальчиков - циркумцизии
- Как лечить аллергический ринит? Лекарства для лечения аллергического насморка
