Гидравлическая препаровка плевральных сращений. Техника гидропрепаровки плевральных спаек
Добавил пользователь Владимир З. Обновлено: 30.01.2026
ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России
ФКУ «Центральный военный клинический госпиталь им. П.В. Мандрыка» МО РФ
Традиционное и новое в дренировании плевральной полости (аналитический обзор)
Журнал: Оперативная хирургия и клиническая анатомия. 2021;5(2): 58‑66
В хирургическом лечении заболеваний грудной клетки дренирование плевральной полости занимает ведущую, а порой и решающую роль. Травмы и заболевания грудной клетки сопровождают человечество на протяжении всего его существования. Первые письменные свидетельства о лечении больных с повреждениями грудной клетки датируются периодом строительства Большой пирамиды Хеопса. В классические греческие времена упомянуто открытое дренирование как метод лечения. Пункционное лечение было предложено в 1873 г. Boerhaave. Пассивно-гравитационное дренирование с применением «водяного замка» было внедрено в медицинскую практику в последней четверти XIX века. С середины прошлого века в торакальной хирургии стали активно внедрять устройства для дренирования плевральной полости, такие как антирефлюксный клапан, торакальный троакар-катетер, катетер Сельдингера и др. К недостаткам многочисленных устройств можно отнести сложность использования и большую продолжительность в осуществлении манипуляций (многоэтапность). Коллективом авторов предложен способ одновременного дренирования пневмо- и гидроторакса и создано устройство для этого способа. Достоинством этого метода является возможность одномоментного дренирования верхнего и нижнего этажей плевральной полости с топографо-анатомическим позиционированием дренажей в условиях неотложной помощи. Троакар-адаптер позволяет выполнить торакоцентез в условиях ургентной хирургии, в стационарах без привлечения специалистов торакальной хирургии, в военно-полевой хирургии.
Дата принятия в печать:
Введение
Травмы и заболевания грудной клетки сопровождают человечество на протяжении всего существования. Первые доказательства перенесенной и пережитой травмы грудной клетки нам представляют археологи, которыми было обнаружено два скелета неандертальцев в местечке Шанидар в Ираке. У одного скелета имелись следы зажившей проникающей раны в области IX ребра, а у другого — консолидированные множественные переломы ребер [11]. К первым письменным свидетельствам попыток лечения больных с повреждениями грудной клетки можно отнести папирус, представленный мировой общественности американским археологом Эдвином Смитом в 1862 г. Его авторство датируется 3000—2500 гг. до нашей эры, периодом строительства Большой пирамиды Хеопса [12].
Самую старую ныне известную ссылку о дренировании грудной клетки можно датировать V веком до нашей эры в трудах Гиппократа (ок. 460—370 гг. до нашей эры) [13]. При эмпиеме у больного описаны попытки консервативного лечения медикаментами из растительных материалов и лечебной физкультурой, а в отсутствие улучшения состояния больного описана техника открытого дренирования эмпиемы. При применении этой техники предлагается использовать трубку из жести не только для оттока, но и для промывания подогретым вином или маслом [14]. Следующим письменным упоминанием о дренировании плевральной полости можно считать Parzival Wolfram von Eschenbach, датируемой предположительно первой четвертью XIII века, где в стихотворной форме средневековой поэзии описано лечение рыцаря с применением торакостомии трубкой [13]. В 1395 г. Guy de Chauliac, ведущий хирург Франции, завершает свою знаменитую работу «Chirurgia Magna», в которой при ранениях грудной клетки рекомендованы ежедневное закапывание в рану теплого вина или смеси меда и речной воды, ротация пациента и перевязки ран [15]. В XVI веке военный хирург Ambroise Paré внес особый вклад в лечение проникающих ранений грудной клетки попыткой установить руководящие принципы для определения открытого или закрытого метода лечения [15]. Paré считал, что рану следует оставить открытой, если в груди была кровь, потому что если она будет закрыта, кровь будет «разлагаться и вызывать лихорадку, свищ и другие осложнения» [16]. Вера в важность удаления оставшейся крови при ранении грудной клетки сохранилась в XVII и XVIII веках и привела к практике оральной аспирации — метод «сосания ран» [16]. В 1707 г. Dominique Anel описал применение серебряной трубки, прикрепленной к поршневому шприцу, который заменил человеческий рот. С помощью этого устройства хирург смог выполнить эту процедуру, и она была переименована в аспирацию [16, 17]. Затем D. Anel разработал канюлю, которая позволяла вводить катетер в плевральную полость, а не просто прикладывать ее к краям раны [16]. Несмотря на эти достижения, все еще не было единодушного мнения об оптимальном лечении ран и заболеваний органов грудной клетки [16, 18]. Так, в 1835 г., когда у личного врача Наполеона Дюпюитрена развилась эмпиема, он заявил: «Лучше смерть по воле Божьей, чем от рук хирурга» и отказался от операции [19, 20]. Спустя 12 дней так и случилось. В настоящее время торакостомия, торакоабсцессостомия применяются как этапные, органосохраняющие вмешательства у ослабленных больных [21, 22].
Пункционное лечение было предложено в 1873 г. Boerhaave [цит. по 21]. Его дальнейшее развитие шло по пути создания пункционных игл с клапанным механизмом (рис. 1).
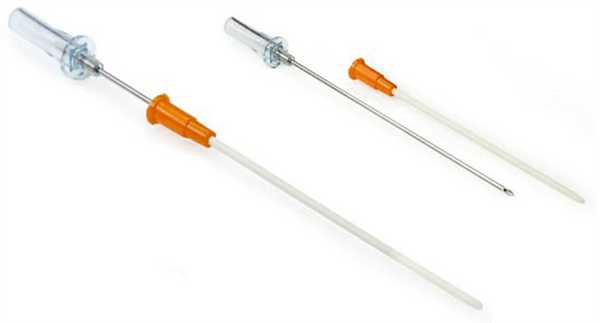
Рис. 1. Декомпрессионная игла для устранения напряженного пневмоторакса.
В 1968 г. H. Heimlich запатентовал флотирующий Heimlich клапан [26—29]. Клапан выполнен в виде резинового рукава в пластиковом корпусе, расположенного таким образом, что при прохождении через него воздуха рукав открывается и пропускает воздух, при этом препятствует его движению в обратном направлении. Таким образом антирефлюксный клапан (рис. 2) предотвращает обратный отток жидкости и воздуха к пациенту.

Рис. 2. Клапан антирефлюксный (Heimlich).
К преимуществам такого метода можно отнести миниинвазивность, простоту использования, мобильность больного (раненого), использование метода на догоспитальном этапе и в амбулаторном лечении [27, 30—32]. К недостаткам метода относятся трудности при эвакуации больших объемов жидкости, высокая вероятность развития эмфиземы, отсутствие возможности определения объема воздуха [33—36].
Другим устройством, предназначенным для оперативного и безболезненного дренирования плевральной полости, является торакальный троакар-катетер, который представляет собой катетер с одним либо несколькими отверстиями на дистальном конце, надетый на металлический троакар (рис. 3) [37, 38]. Он изготовлен из медицинского полихлорвинила, препятствующего тромбообразованию и окклюзии просвета. Катетер имеет маркировку, что обеспечивает точное расположение, наличие рентгеноконтрастной полоски облегчает послеоперационный контроль положения катетера [39—41].
Рис. 3. Торакальный троакар-катетер.
К недостаткам можно отнести маленькую площадь режущей каймы. Это требует применения больших физических усилий при введении троакара, что чревато неконтролируемым проникновением в плевральную полость и повреждением внутренних органов [42, 43]. Набор для плеврального дренирования по Сельдингеру (Seldinger) представляет собой катетер по форме «свиного хвостика» [44]. Показан в случае гемопневмоторакса, гидроторакса с экссудатом низкой вязкости. Однако и это устройство тоже имеет ряд недостатков: многокомпонентность приводит к потере времени при сборке, небольшой диаметр — к окклюзии дренажа и невозможности эвакуировать вязкий плевральный выпот.
Первое описание пассивно-гравитационного дренирования с применением «водяного замка» можно датировать 1873 г., когда G. Playfair [45] использовал его при лечении ребенка с эмпиемой [46—48]. В 1875 г. Gotthard Bulau [цит. по 50] описал использование сифонного подводного дренажа для лечения эмпиемы как альтернативу стандартной резекции ребра и открытого дренирования [50—56]. В основе этого метода лежит дренирование по принципу сифона: содержимое плевральной полости по дренажу за счет сил гравитации отходит в емкость, расположенную ниже плоскости легкого (рис. 4) [57—59]. К недостаткам метода относится то, что стеклянная бутылка не только является емкостью для плеврального экссудата, но и служит одновременно «водяным замком», что может привести к забросу содержимого из емкости в дренируемую полость. Так, в 20-х годах XX века H. Lilienthal [60] стал использовать двухкамерную систему (рис. 5) для лечения больных после резекции легкого [61, 62].
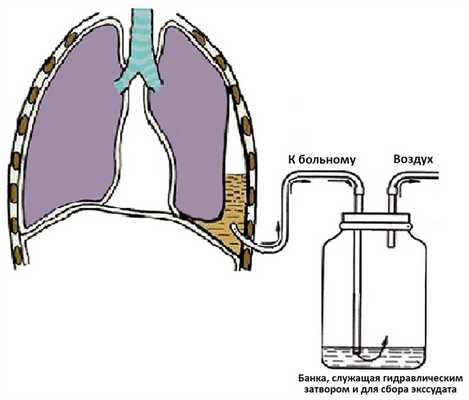
Рис. 4. Плевральное дренирование однокамерной системой с «водяным замком».
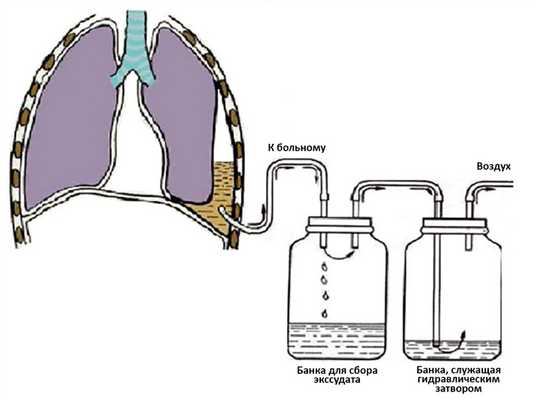
Рис. 5. Плевральное дренирование двухкамерной системой.
Двухкамерная система позволила разделить емкость для сбора жидкости и емкость, служащую гидравлическим замком. Современная трехкамерная система (рис. 6) была впервые описана B. Howe в 1952 г. [63]. Трехкамерная система позволяет поддерживать отрицательное давление на постоянном уровне вне зависимости от объема плеврального отделяемого и проводить постоянный мониторинг уровня давления [64]. К недостаткам всех систем можно отнести громоздкость и, как следствие, немобильность больного, зависимость от расположения тела пациента, громкое «пузырение» при активном сбросе воздуха [65—68].
Это привело к созданию новых современных устройств, применяющих принцип трехкамерной системы в едином блоке, в котором объединены 3 основные камеры: собирающая, «водяного замка» и вакуумного контроля (рис. 7) [69—72].
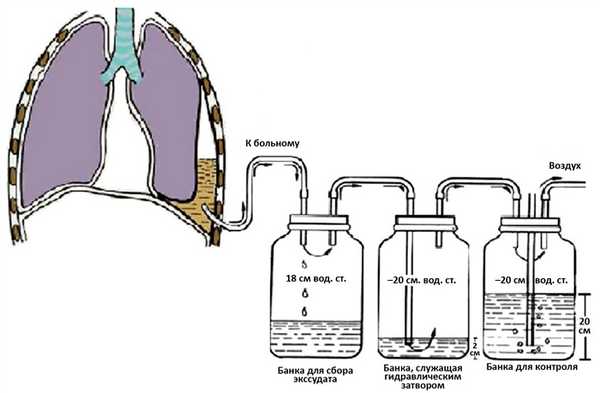
Рис. 6. Плевральное дренирование трехкамерной системой.
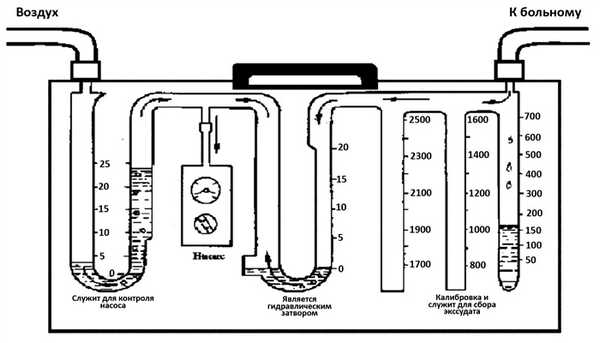
Рис. 7. Схема портативной системы дренирования грудной клетки.
Собирающая камера, к которой подключен плевральный дренаж, градуирована и откалибрована, что облегчает контроль за объемом отделяемого. Средняя камера выполняет роль антирефлюксного клапана в камере «водяного замка». Третья камера также заполнена водой и предназначена для контроля давления. Однако для эффективной работы подобные дренажные системы нуждаются в надежной вертикальной фиксации и постоянном контроле уровня жидкости (испарение во второй и третьей камерах) [73, 74]. Поэтому нашли свое применение в торакальной хирургии системы с сухим дренированием плевральной полости (drysuction). Современные системы устанавливают высокие стандарты лечения в торакальной хирургии, позволяют создать надежное и контролируемое отрицательное давление в грудной полости [75, 76]. Наличие цифровых дисплеев дают возможность осуществлять мониторинг в реальном времени, а также следить за динамикой процесса посредством суточных графических изображений [77—79]. Эти системы контролируют динамику утечки воздуха и объема жидкости, что делает возможным медицинскому персоналу принимать объективно обоснованные и своевременные решения при дренировании плевральной полости [80—82]. Все это позволяет получить ряд преимуществ: 1) непрерывность аспирации вне зависимости от местоположения и пространственного ориентирования пациента (отсутствие зависимости от водяного замка, который заменен на запорный клапан, препятствующий обратному поступлению воздуха в грудную клетку); 2) легкость в использовании и возможность обслуживания средним и младшим медицинским персоналом; 3) повышение комфорта пациента, сокращение сроков пребывания больного в стационаре; 4) точный контроль, фиксирование точных показаний и ключевых параметров лечения [83—87].
К недостатками многочисленных устройств для устранения угрожающих жизни последствий травм и ранений грудной клетки относятся их невысокая эффективность, сложность использования и большая продолжительность в осуществлении манипуляций (многоэтапность) [88—91].
Коллективом авторов был опробован способ одновременного дренирования пневмо- и гидроторакса с созданием устройства для одновременного дренирования пневмо- и гидроторакса (способ одновременного дренирования пневмо- и гидроторакса и устройство для одновременного дренирования пневмогидроторакса) (№2709131 от 16.12.19. Приоритет от 12.03.19; рис. 8) [91].
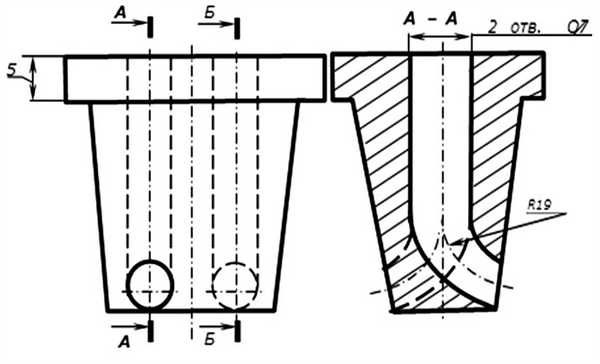
Рис. 8. Двухпросветный троакар-адаптер для дренирования плевральной полости.
Двухпросветный троакар-адаптер выполнен из инертного материала, имеет форму усеченного корпуса, с наружной стороны имеется бортик-ограничитель шириной 5 мм, предупреждающий чрезмерно глубокое погружение троакара-адаптера, тем самым минимизируя вероятность повреждения органов грудной клетки. В троакаре выполнены два направляющих отверстия 7—10 мм, позволяющие без технических сложностей проведение дренажей. Выходное отверстие левого канала изогнуто в поперечной плоскости вверх с радиусом искривления 19°, соответственно правый канал изогнут вниз также с радиусом искривления 19°, и на конце, обращенном к плевральной полости, каналы открываются на противоположных торцах троакара-адаптера для придания направления движения дренажей: левого — вверх, правого — вниз.
Торакоцентез выполняют в положении больного на спине. После обработки операционного поля в условиях анестезии по верхнему краю V ребра осуществляется разрез по средней подмышечной линии [92, 93]. При помощи инструмента мягкие ткани пятого межреберья тупо разводят, в плевральную полость вводят троакар-адаптер до упора бортика-ограничителя в кожу. Расположение входных отверстий должно быть параллельно ребрам. Во входные отверстия вводят трубки до ощущения сопротивления, что указывает на правильное расположение дренажей: нижнего — в плевральном синусе, верхнего — в области купола плевральной полости. После установки дренажей корпус троакара-адаптера извлекают, операционный доступ ушивают, дренажи фиксируют лигатурами от кожных швов. Затем налаживают систему активной или пассивной аспирации плевральной полости. Через предложенное устройство возможна стимуляция внутриплеврального адгезиогенеза [94].
С целью контроля правильности положения дренажей и полноты эвакуации патологического содержимого обязательно выполняется обзорная рентгенография груди. Достоинством этого метода является возможность выполнения одномоментного дренирования верхнего и нижнего этажей плевральной полости с топографо-анатомическим позиционированием дренажей в условиях неотложной помощи. Троакар-адаптер позволяет выполнить торакоцентез в условиях ургентной хирургии в стационарах без привлечения специалистов торакальной хирургии, в военно-полевой хирургии.
Несмотря на тысячелетнюю историю дренирования плевральной полости, глубокого понимания физиологии и патологии легких, освоения принципов эвакуации гноя, крови, воздуха и жидкости из плевральной полости, все еще остается актуальным вопрос дальнейшего изучения, совершенствования методов и оборудования для лечения больных с патологическим содержимым в плевральной полости [95, 96].
Плевральные спайки
Плевральные спайки — шварты или синехии — соединительно-тканные образования, сформированные между листками париетальной и висцеральной плевры.
Плевра представляет собой тонкую серозную оболочку, покрывающую лёгкие и грудную полость.
- париетальная плевра, выстилающая внутреннюю поверхность грудной полости, делится на грудную, диафрагмальную и медиастинальную части в зависимости от локализации.
- висцеральная плевра, покрывающая лёгкие и проникающая между долями лёгких.
Между париетальной и висцеральной плеврой образуется узкая полость (плевральная полость), в которой циркулирует серозная жидкость, уменьшающая трение листков плевры.
Плевральные спайки чаще возникают как следствие острого или хронического воспаления.
Спайки плевры могут быть локальными, если они соединяют отдельные участки серозных оболочек, или тотальными, если занимают всю или большую часть плевральной полости. Помимо этого, плевральные шварты могут быть единичными или множественными, локализоваться с одной или обеих сторон.
- между висцеральным и париетальным листком плевры;
- между отдельными участками париетальной плевры (рёберно-диафрагмальные спайки, рёберно-апикальные спайки — в области верхушки лёгкого);
- между отдельными участками висцеральной плевры (междолевые шварты);
- между средостением и плеврой (плевро-медиастинальные спайки) и др.
Выраженные спайки могут соединять несколько областей и быть рёберно-диафрагмо-перикардиальными, плевро-перикардо-медиастинальными и т.п.
В зависимости от объёма поражения, локализации сращений клинические проявления могут носить бессимптомный характер или, наоборот, значимо ухудшать состояние пациента.
При массивном спаечном процессе отмечается выраженное нарушение функции лёгких.
Причины плевральных спаек
Чаще всего причиной образования плевральных синехий является воспаление инфекционного или неинфекционного происхождения: экссудативный плеврит, пневмония, туберкулёз, аутоиммунные заболевания, опухоль, травма (в том числе, хирургическое вмешательство).
Механизм возникновения плевральных спаек
Конечная фаза любой воспалительной реакции — пролиферация, т.е. образование ткани, которая замещает повреждённый участок.
Воспаление плевры — плеврит — любого происхождения сопровождается выпотом в плевральную полость воспалительного экссудата, содержащего белок фибриноген. Фибриноген трансформируется в фибрин и откладывается в виде нитей в плевральной полости. Нити фибрина образуют сначала «молодые» рыхлые спайки. Если фибринолиз не происходит, то фибробласты на месте фибринового матрикса синтезируют коллаген. Коллагеновые спайки начинают прорастать сосудами и нервными окончаниями, так образуются плотные фиксированные сращения — шварты. С течением времени спайки могут подвергаться склерозу, кальцификации.
Не у всех пациентов, перенесших плеврит, образуются плевральные шварты. К их формированию предрасполагают хронические заболевания: обструктивная болезнь лёгких, частые бронхиты, пневмонии, паразитарные поражения лёгких, туберкулёз, рак, курение, муковисцедоз, саркоидоз, полисерозиты, инфаркт лёгкого и др.
Хирургические операции на органах грудной клетки — торакальная хирургия — выполняются по поводу заболеваний, являющихся причиной спаечного процесса в плевральной полости, но и сами по себе вмешательства являются причиной развития спаек, усугубляя существующий рубцово-спаечный процесс.
Признаки плевральных спаек
- боли в грудной клетке разной интенсивности на стороне синехий;
- сухой кашель;
- одышка;
- учащённое сердцебиение;
- субфебрилитет (при хроническом воспалении).
Длительное существование спаек, ограничивающих полноценную функцию лёгких, приводит к развитию кислородного голодания — гипоксии.
Диагностика плевральных шварт
При наличии описанных выше жалоб доктор может заподозрить у пациента наличие плевральных спаек.
Для подтверждения диагноза проводятся дополнительные методы обследования:
- флюорография;
- динамическая рентгенография органов грудной клетки (на вдохе и выдохе) в двух проекциях (прямой и боковой);
- ультразвуковое исследование;
- компьютерная томография;
- лечебно-диагностическая пункция при наличии плеврита.
Однако описанные методы дают лишь косвенную информацию о наличии или отсутствии плевральных спаек. Шварты визуализируются при описанных методиках только в случае выраженной толщины или наличии кальцинатов, поэтому врач обращает внимание на косвенные признаки: деформацию грудной клетки, сужение межрёберных промежутков, смещение средостения в больную сторону, искривление позвоночника в здоровую сторону.
Достоверной диагностикой плевральных спаек является торакоскопия, при которой хирург визуально оценивает локализацию, вид и степень влияния на функцию лёгких плевральных спаек. Некоторые виды локализации шварт сложно диагностировать даже при торакоскопии.
Лечение и профилактика
- антибиотикотерапия (при наличии гнойного воспаления);
- обезболивающие и противовоспалительные препараты;
- противокашлевые средства;
- кислородотерапия при наличии выраженной гипоксии;
- физиотерапия (при отсутствии противопоказаний);
- массаж, ЛФК;
- дыхательная гимнастика.
Показаниями к хирургическому лечению плевральных спаек являются выраженные дыхательная и сердечная недостаточность. Наиболее щадящим хирургическим методом иссечения спаек плевральной полости является торакоскопический адгезиолизис. Во время операции хирург рассекает спайки между плевральными листками или удаляет часть плеврального листка, к которому крепятся спайки, проводит санацию плевральной полости. Однако в месте образования раневой поверхности возникает риск образования новых соединительно-тканных сращений.
Снизить риск повторного образования плевральных спаек можно с помощью применения противоспаечного геля Антиадгезин.
Карбоксиметилцеллюлоза в составе геля Антиадгезин создаёт тонкую плёнку, покрывающую париетальную и висцеральную плевру. Вводить гель в плевральную полость лучше в области верхних долей лёгкого, чтобы гель постепенно стекал, обволакивая все участки плевры. Дыхательные движения лёгких способствуют равномерному распределению геля между листками.
Гиалуроновая кислота в составе геля Антиадгезин оказывает противовоспалительный, увлажняющий и регенерационный эффекты на ткань плевры.
Биодеградация в течение 7 дней после введения обеспечивает элиминацию геля из плевральной полости после выполнения своей функции.
Обсудите с хирургом возможность применения противоспаечного барьера при Вашем хирургическом вмешательстве.
В некоторых случаях (при гнойном процессе, кровотечении) применение противоспаечного геля противопоказано. Только врач может принять окончательное решение относительно возможности использования того или иного метода с учётом особенностей Вашего здоровья.
Обязательным элементом профилактики плевральных спаек после хирургического лечения являются физическая активность и дыхательная гимнастика, улучшающие кровоснабжение тканей и функциональное состояние лёгких.
Гидравлическая препаровка плевральных сращений. Техника гидропрепаровки плевральных спаек
Короткие массивные сращения или сращения с вытяжением легочной ткани почти до самой грудной стенки считаются недоступными пережиганию ввиду возможности нарушения целости легочной ткани, которое влечет за собой самые тяжелые осложнения. Для борьбы с такими сращениями Богуш разработал методику гидравлической их препаровки.
Для этой цели им сконструирована специальная игла, представляющая собой длинную полую трубку, на конец которой навинчивается игла с крутым срезом. В другой конец вставляется шприц «Рекорд». Иглу подводят к основанию спайки у грудной стенки и прокалывают париетальную плевру. Ассистент, надавливая на поршень шприца, медленно вводит 0,5% раствор новокаина в количестве 20—50 см3, который, проникая между париетальной плеврой и эндоторакальной фасцией, отодвигает сращение от грудной клетки.
Таким образом удлиняется вся спайка, а следовательно, увеличивается расстояние между грудной стенкой и втянутым в сращение легким. После этого приступают к пережиганию. Петлю каутера кладут на место перехода сращений в париетальную плевру. Плевру пережигают по всей видимой части сращения, после чего обнаруживается рыхлая клетчатка, которая пронизана отдельными тяжами, натянутыми между легким и грудной стенкой. Затем футляром каутера осторожно отслаивают легкое от грудной стенки, а более плотные тяжи пережигают каутером. Каутером же пережигают костальную плевру, покрывающую сращение с противоположной стороны.
Ввиду того что во время операции удаляется значительный участок плевры, на грудной стенке остается большая раневая поверхность.
Операция переносится больными хорошо, и каких-либо операционных осложнений Богуш не наблюдал. В послеоперационном периоде наблюдаются длительные пневмоплевриты, причем несколько чаще, чем после обычных пережиганий. Кроме того, наблюдались послеоперационные кровотечения.
Метод гидравлической препаровки несколько расширяет показания к пережиганию тех сращений, которые не могут быть пережжены обычными путем.
Богуш считает, что эта операция показана при массивных коротких и многогранных сращениях, при сращениях с включением легочной ткани, а также при коротких сращениях, идущих к крупным сосудам и к медиастинальной плевре.
Однако следует всегда помнить, что в коротких массивных: сращениях и особенно в тех сращениях, где легочная ткань доходит до грудной стенки, может локализоваться инфекция в латентном состоянии. Введение новокаинового раствора между костальной плеврой и внутригрудной фасцией может привести к мобилизации этой инфекции.
Поскольку же во время пережигания жидкость изливается в плевральную полость, не исключена возможность инфицирования ее. Быть может, этим объясняется более частое развитие длительных пневмоплевритов с температурной реакцией, чем при обычном пережигании.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Показания к вылущиванию плевральных спаек. Маурер об обработке плевральных сращений
Необходимость такого вылущения спаек обосновывается следующим образом. Все сращения делятся на три группы: 1. Сращения, показанные для гальванокаустики, т. е. спайки, достигающие в диаметре пальца, в которых длина соединительнотканной части не меньше 1 см.
Осложнения, наблюдающиеся при пережигании таких спаек (перфорации и эмпиемы), сравнительно редки, но все же, по новейшим данным, они достигают 3%. Спайки эти встречаются в одном из 7 случаев. 2. Сращения толщиной от большого пальца до кисти руки с париетальным прикреплением, приподнятым в виде палатки.
Несмотря на глубокое втяжение легочной ткани в сращение, легкое все же не прилегает непосредственно к грудной клетке. Эти сращения не могут быть оперированы гальванокаутером без опасности ранения легкого, поэтому в таких случаях показано экстраплевральное вылущение. Вторая группа сращений встречается чаще, чем первая. 3. Сращения, вообще недоступные для операции, т. е. непосредственные синехии легкого с грудной стенкой.
Таким образом, Mayрep полагает, что пользование только гальванокаустическим методом должно в значительной степени сузить показания к операции.
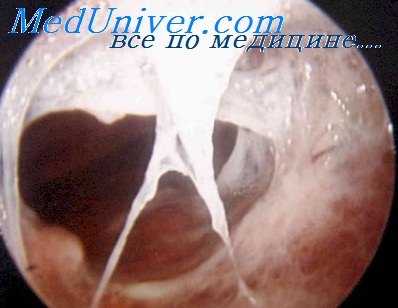
Якобеус отделяет с помощью гальванического тока те же сращения, которые Маурер вылущивает по своему методу, и считает, что вылущение спаек бесполезно удлиняет время операции. Якобеус делает вывод, что в принципе нет никакой разницы между методом Маурера и другими методами. Унферрихт категорически возражает против метода Маурера, считая, что он не имеет никаких преимуществ перед другими методами, поскольку коагуляция может достигаться и при помощи гальванического тока. Кроме того, метод Маурера, вызывая глубокую коагуляцию, может привести к нарушениям на расстоянии, например, к параличу диафрагмального и возвратного нервов.
Мисталь, наоборот, считает, что метод Маурера является значительным шагом вперед и требует особого внимания, так как он позволяет расширить показания к отделению спаек; недостаток этого этого метода заключается в том, что он требует значительно больше времени, а это заставляет иногда оперировать в несколько моментов.
Маурер рекомендует при вылущении сращений пользоваться комбинированным методом диатермии и гальванокаустики; для этой цели им был сконструирован аппарат с педалями, при нажимании которых можно попеременно применять диатермию или гальванокаустику.
Имея некоторый опыт в диатермокоагуляции сращений, мы считаем, что целый ряд недостатков этого метода заставляет безусловно предпочесть обычную гальванокаустику, которая опытному хирургу позволяет оперировать самые сложные сращения. Предложенный Маурером метод вылущения сращений путем диатермокоагуляции может иметь лишь самое ограниченное применение.
Прижигание плевральных сращений. Положение каутера для прижигания плевральных спаек
Если торакоскопия выявляет сращения, при которых показано пережигание, то через второе отверстие грудной клетки вводят каутер. Перед введением в плевральную полость накал каутера должен быть проверен. Рекомендуется пережигать только тёмнокрасным каутером, так как он вызывает хорошую коагуляцию и предохраняет от кровотечения.
Все манипуляции каутером после введения его в плевральную полость должны совершаться исключительно под контролем торакоскопа. Движения каутером вслепую ни в коем случае не допустимы, так как легко могут привести к ранению легкого. До тех пор, пока каутер не доведен до сращения, он должен быть спрятан в футляре; выдвигать каутер следует только тогда, когда он подведен непосредственно к сращению.
Очень большую пользу приносят занятия на фантоме, во время которых начинающие приучаются манипулировать каутером под контролем торакоскопа. Когда футляр каутера подведен к сращению, каутер выдвигают и кладут на спайку или подводят под нее. Сращение всегда нужно пережигать как можно ближе к грудной стенке. Если это имеет небольшое значение при длинных тонких тяжах, то для тяжей толстых й коротких это является обязательным условием.
При массивных сращениях лучше сначала произвести коагуляцию, наджигая сращение вокруг места прикрепления его к грудной стенке: образуется белая полоса, которая расширяется в одну и другую сторону. На такое же расстояние коагуляция проникает и в глубину. После этого сращение медленно пережигается, причем в более плотных частях сращения пережигание идет медленнее; там же, где сращение более рыхло, пережигание происходит быстрее.
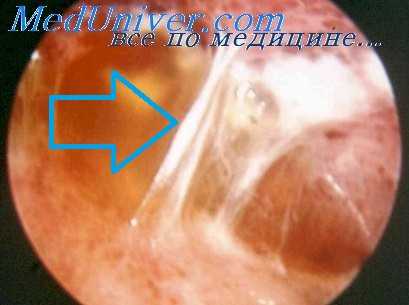
Если сращение очень массивно и для пережигания его требуется много времени, следует делать время от времени перерыв, чтобы не вызывать перегревания плевральной полости. Операцию всегда следует начинать с самых тонких сращений. Если пережечь сначала массивные сращения, которые удерживают легкое, тонкие тяжи, натягиваясь под влиянием его тяжести, могут разорваться у места прикрепления к легкому, а это ведет к кровотечению и образованию спонтанного пневмоторакса.
Каково должно быть положение каутера по отношению к спайке? Мы предпочитаем всегда класть петлю каутера на спайку; при таких условиях пережигание будет все время происходить под контролем глаза и сразу будет замечено кровотечение, если оно начнется. В тех случаях, когда удается пережечь все сращения, легкое тут же на глазах начинает медленно спадаться и могут обнаружиться новые сращения, которые до того времени не были натянуты.
По окончании операции ранки грудной стенки зашивают каждую одним швом и накладывают давящую повязку. Если больной в это время жалуется на значительную одышку, следует тут же, на операционном столе, отсосать 300—500 см3 воздуха. Мы разрешаем больным итти из операционной в палату самостоятельно, за исключением случаев, когда операция осложняется кровотечением.
Несколько слов относительно частичного пережигания сращений. Мы не являемся сторонниками частичного пережигания, так как считаем, что имеет значение только полный коллапс; там же, где оставшиеся сращения мешают уничтожению эластического напряжения легкого, пневмоторакс не может считаться действительным даже в тех случаях, когда прекращается выделение бацилл Коха, ибо успех этот временный.
Частичное пережигание мы производим только в тех случаях, когда остающиеся верхушечные сращения при наличии сращения основания легкого с диафрагмой создают положение, при котором дополнительная операция на диафрагмальном нерве уничтожит эластическое напряжение легкого в апико-каудальном направлении. Что касается наджигания сращений, один край которых свободен, а другой переходит в плоскостное сращение, то мы являемся решительными противниками этого метода, ибо сращение может продолжать разрываться и давать тяжелое кровотечение и спонтанный пневмоторакс.
Мы прибегаем к наджиганию сращений только в тех случаях, когда массивное сращение, вообще доступное пережиганию, не может быть пережжено в один сеанс. Повторное пережигание делается через 10 — 12 дней.
Читайте также:
