Гипертрофическая кардиомиопатия
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
В статье представлен клинический случай развития обструктивной гипертрофической кардиомиопатии трансплантированного сердца у мужчины 66 лет в течение 5 лет после ортотопической трансплантации сердца, обсуждаются особенности данного заболевания, в результате которых это стало возможным.
Ключевые слова
Для цитирования:
For citation:
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное заболевание миокарда, характеризующееся гипертрофией левого желудочка (ЛЖ) (ГЛЖ) (>1,5 см) и/или правого желудочка, чаще асимметрического характера за счёт утолщения межжелудочковой перегородки (МЖП), что не может объясняться исключительно повышением нагрузки давлением, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с ГЛЖ [1]. Несмотря на хорошую осведомлённость кардиологов об этой форме кардиомиопатии, она продолжает преподносить немало сюрпризов. Мы представляем случай развития классического фенотипа ГКМП с клинической симптоматикой, обусловленной латентной обструкцией выходного тракта ЛЖ (ВТЛЖ), у пациента 66 лет спустя 5 лет после ортотопической трансплантации сердца (ОТС).
Пациенту Н. в возрасте 61 года 19.04.2015 выполнена ОТС по поводу терминальной стадии ишемической кардиомиопатии. На момент ОТС пациент страдал гипертонической болезнью 1 степени с хорошим контролем артериального давления. Донором была 43-летняя женщина, эхокардиографическое (ЭхоКГ) исследование патологии донорского сердца не выявило. Посттрансплантационная иммуносупрессия состояла из такролимуса 3,0 мг/сут. с поддержанием целевого уровня в крови 5-10 нг/мл, микофенолата мофетила 2000 мг/сут. и метилпреднизона 4 мг/сут.
Наблюдение за пациентом проводилось в соответствии с клиническими рекомендациями по ведению пациентов, перенесших трансплантацию сердца [2]. Трансторакальное ЭхоКГ выполнялось на аппаратах Acuson Simens SC 2000 и PHILIPS IE 33 согласно стандартному протоколу.
После ОТС состояние пациента было удовлетворительным. Спустя год после ОТС пациента начали беспокоить головокружения при переходе в ортостаз, одышка при подъёме на третий этаж, быстрая утомляемость. Толерантность к физическим нагрузкам постепенно снижалась. С 2019г пациент жаловался на нарушение зрения, головокружение и желание лечь после перехода в вертикальное положение или через несколько шагов после вставания, одышку при ходьбе через 50-100 м. В 2020г пациент периодически отмечал отёки стоп и нижних третей голеней, удушье после перехода в горизонтальное положение, одышка возникала при ходьбе через 50 м, сохранялись симптомы ортостатической интолерантности.
При физикальном обследовании в январе 2021г выявлены избыточная масса тела с индексом массы тела 29 кг/м 2 (рост 170 см, вес 86 кг), малоинтенсивный систолический шум в точке Боткина. Активная ортостатическая проба была в норме, дистанция шестиминутной ходьбы составила 180 м.
Электрокардиограмма у пациента после ОТС была без отклонений, с января 2021г регистрировалась преходящая атриовентрикулярная блокада 1 степени (PQ 200-240 мс).
Таблица 1
Параметры ЭхоКГ пациента Н. в период 2015-2021гг

Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ФВ — фракция выброса.
Таблица 2
Показатели диастолической функции пациента Н. в период 2015-2021гг

Сокращения: МК — митральный клапан, пик А — пик позднего диастолического наполнения, пик Е — пик раннего диастолического наполнения, пик Em — ранняя диастолическая скорость движения кольца митрального клапана, DT — время замедления пика раннего диастолического наполнения, Е/Еm — соотношение
пиков раннего диастолического наполнения к ранне-диастолическому смещению тканей боковой части митрального кольца, IVRT — время изволюметрического
расслабления.
Таблица 3
Параметры трансторакальной ЭхоКГ у пациента Н. в январе 2021г

Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, МК — митральный клапан, ФВ — фракция выброса.
По данным коронароангиографии, включая исследование в январе 2021г, гемодинамически значимых препятствий кровотоку в коронарных артериях не было выявлено. Эндомиокардиальные биопсии проводились в соответствии с установленным протоколом. У пациента наблюдался один эпизод острого клеточного отторжения степенью 2R в мае 2015г, купированный внутривенной пульс-терапией кортикостероидами. Гистологические и иммуногистохимические признаки отторжения отсутствовали. Последняя эндомиокардиальная биопсия была выполнена в июле 2016г. Результаты эндомиокардиальных биопсий были пересмотрены в январе 2021г, однако признаков, характерных для ГКМП, в имеющихся образцах ткани из области верхушки правого желудочка не было выявлено.
Таким образом, у пациента в течение 5 лет после трансплантации сердца развилась асимметрическая ГЛЖ, преимущественно за счёт базального отдела МЖП, сопровождающаяся возникновением обструкции на уровне ВТЛЖ и обратимой митральной недостаточности при физических нагрузках, провокационных пробах. Пациенту выставлен диагноз асимметрической формы ГКМП донорского сердца с латентной обструкцией ВТЛЖ.
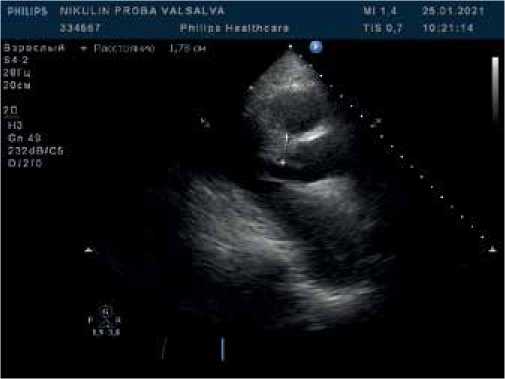
Рис. 1. В-режим. Парастернальная позиция по длинной оси ЛЖ. Асимметричная гипертрофия миокарда ЛЖ с утолщением миокарда в базальном сегменте.
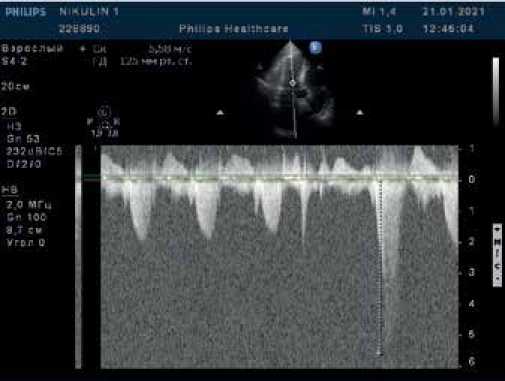
Рис. 2. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ в постоянно-волновом доплеровском режиме (CW-допплер): в покое обструкция отсутствует, во время экстрасистолы повышение градиента давления до 125 мм рт.ст.
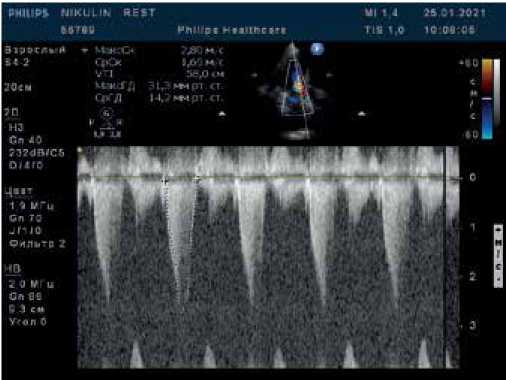
Рис. 3. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ при поведении пробы Вальсальвы. Прирост систолического градиента, максимальный систолический градиент 82,8 мм рт.ст.
ГКМП считается наиболее распространенным наследственным сердечно-сосудистым заболеванием (рис. 4) [5][6]. Она характеризующееся гипертрофией преимущественно ЛЖ с отсутствием дилатации камер сердца без признаков другой кардиальной патологии или системных заболеваний, ответственных за развитие гипертрофии. Имеющаяся у нашего пациента артериальная гипертония первой степени хорошо контролировалась гипотензивной терапией и не могла объяснить развитие ГЛЖ. Также у нашего пациента в анамнезе отсутствовали заболевания, которые могли бы вызвать развитие ГЛЖ как часть синдрома.
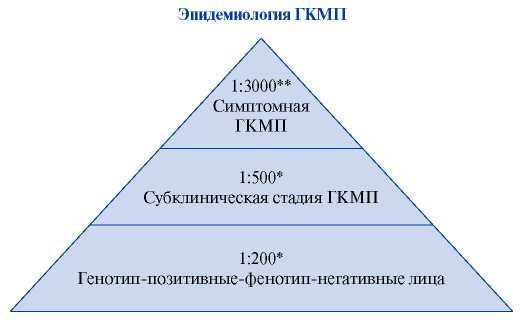
Рис. 4. Распространённость ГКМП в общей популяции взрослых людей.
Примечание: * — 1:200 взрослых людей — минимальная распространённость мутантных генов саркомера в общей популяции, 1:500 взрослых людей — распространённость необъяснимой ГЛЖ как главного фенотипического проявления ГКМП, определяемая ЭхоКГ [3]. ** — 1:3000 — распространённость симптомной ГКМП у взрослых в США [4].
Сокращения: ГКМП — гипертрофическая кардиомиопатия, ГЛЖ — гипертрофия левого желудочка, ЭхоКГ — эхокардиография.
Известно, что приём такролимуса может быть причиной ГЛЖ у детей и взрослых. У детей симметричная ГЛЖ развивалась в сроки от 2-3 мес. до четырёх лет после начала приёма такролимуса по поводу трансплантации печени и/или кишечника, почки 7. ГКМП у взрослых реципиентов, получающих такролимус, посвящены описания отдельных случаев и специально спланированные исследования 12. Как у детей, так и у взрослых ГКМП вследствие приёма такролимуса отличали симметрический характер ГЛЖ, как правило без обструкции ВТЛЖ, и её обратимость после отмены такролимуса. У нашего же пациента имелся морфологически иной тип гипертрофии донорского сердца.
За время наблюдения у нашего пациента развился “классический фенотип” ГКМП донорского сердца с симптомами, обусловленными латентной обструкцией ВТЛЖ. Электрокардиография после ОТС длительное время была без патологии, что наблюдается у 5-25% пациентов с ГКМП. Асимметрическая ГЛЖ с небольшим утолщением стенок и более выраженной гипертрофией единичных сегментов, как в нашем случае, встречается у 1/3 пациентов с ГКМП [16]. Латентный характер обструкции ВТЛЖ в покое у симптомных пациентов с ГКМП продемонстрирован не только в течение нескольких дней между ЭхоКГ исследованиями, но и в течение нескольких минут во время катетеризации сердца 17. По данным исследования Geske JB, et al. (2011), вариабельность спонтанного градиента в ВТЛЖ составила 49,0±53,1 мм рт.ст. в диапазоне от 0 до 210,8 мм рт.ст., а вариабельность градиента в ВТЛЖ после желудочковых экстрасистол значительно коррелировала с вариабельностью градиента ВТЛЖ в покое [19].
На момент проведения ОТС ЭхоКГ донорского сердца не выявила его структурной патологии, что можно объяснить особенностями фенотипических проявлений при ГКМП. В настоящее время определены более тысячи мутаций примерно в 30 генах, ответственных за развитие ГКМП [20]. Большинство форм ГКМП наследуются по аутосомно-доминантному типу, но также описаны митохондриальные и аутосомно-рецессивные паттерны 23. Следствием выраженной генетической гетерогенности является клиническая гетерогенность ГКМП с широким спектром проявлений от носительства мутантных генов (генотип-позитивные-фенотип-негативные лица), бессимптомной ГЛЖ до клинических синдромов сердечной недостаточности, аритмий и внезапной смерти. Например, проспективное исследование Maron BJ, et al. (2001) продемонстрировало разнообразие фенотипических проявлений ГКМП у лиц с мутацией миозин-связывающего протеина С (MYBCP), а также возможность манифестации заболевания в среднем возрасте [24]. Неполная пенетрантность заболевания с отсутствием ГЛЖ во взрослом возрасте наиболее характерна для мутаций гена MYBCP, гена тяжёлых цепей миозина (MYN7) и гена тропонина Т 26. В медицинской литературе уже описан случай, когда, несмотря на адекватный скрининг донора, у женщины 66 лет спустя 19 лет после трансплантации сердца развилась идиопатическая ГКМП со средне-желудочковой обструкцией [27]. В то же время, несмотря на типичную клинико-морфологическую картину обструктивной ГКМП в нашем случае, нельзя полностью исключить влияние такролимуса, хотя в литературе до настоящего времени не описано развитие асимметрической гипертрофии при его применении. Запланирован перевод пациента на эверолимус.
Заключение
Данный клинический случай демонстрирует постепенное развитие асимметрической ГКМП донорского сердца с латентной обструкцией ВТЛЖ в течение 5 лет после трансплантации.
С учётом высокой распространённости в общей популяции мутантных генов, ответственных за развитие ГКМП, неполной пенетрантности и наличия догипертрофической стадии ГКМП, необходимо быть готовым встретиться с этой патологией у реципиентов сердечного трансплантата.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Габрусенко С.А., Гудкова А.Я., Козиолова Н.А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
3. Semsarian C, Ingles J, Maron MS, Maron BJ. New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol. 2015;65(12):1249-54. doi:10.1016/j.jacc.2015.01.019.
4. Maron MS, Hellawell JL, Lucove JC, et al. Occurrence of clinically diagnosed hypertrophic cardiomyopathy in the United States. Am J Cardiol. 2016;117:1651-4. doi:10.1016/j.amjcard.2016.02.044.
5. Martinez HR, Beasley GS, Miller N, et al. Clinical insights into heritable cardiomyopathies. Front Genet. 2021;12:663450. doi:10.3389/fgene.2021.663450.
6. Maron BJ, Rowin EJ, Maron MS. Global Burden of Hypertrophic Cardiomyopathy. JACC Heart Fail. 2018;6(5):376-8. doi:10.1016/j.jchf.2018.03.004.
7. Atkison P, Joubert G, Barron A, et al. Hypertrophic cardiomyopathy associated with tacrolimus in paediatric transplant patients. Lancet. 1995;345(8954):894-6. doi:10.1016/s0140-6736(95)90011-x.
8. Turska-Kmieć A, Jankowska I, Pawłowska J, et al. Reversal of tacrolimus-related hypertrophic cardiomyopathy after conversion to rapamycin in a pediatric liver transplant recipient. Pediatr Transplant. 2007;11(3):319-23. doi:10.1111/j.1399-3046.2006.00633.x.
9. Jarzembowski TM, John E, Panaro F, et al. Reversal of tacrolimus-related hypertrophic obstructive cardiomyopathy 5 years after kidney transplant in a 6-year-old recipient. Pediatr Transplant. 2005;9(1):117-21. doi:10.1111/j.1399-3046.2005.00260.x.
10. Pappas PA, Weppler D, Pinna AD, et al. Sirolimus in pediatric gastrointestinal transplantation: the use of sirolimus for pediatric transplant patients with tacrolimus-related cardiomyopathy. Pediatr Transplant. 2000;4(1):45-9. doi:10.1034/j.1399-3046.2000.00083.x.
11. Dehghani SM, Haghighat M, Imanieh MH, et al. Tacrolimus related hypertrophic cardiomyopathy in liver transplant recipients. Arch Iran Med. 2010;13(2):116-9.
12. Coley KC, Verrico MM, McNamara DM, et al. Lack of tacrolimus-induced cardiomyopathy. Ann Pharmacother. 2001;35(9):985-9. doi:10.1345/aph.10299.
13. Seino Y, Hori M, Sonoda T. Multicenter prospective investigation on cardiovascular adverse effects of tacrolimus in kidney transplantations. Cardiovasc Drugs Ther. 2003;17(2):141-9. doi:10.1023/a:1025339819051.
14. Liu T, Gao Y, Gao YL, et al. Tacrolimus-related hypertrophic cardiomyopathy in an adult cardiac transplant patient. Chin Med J (Engl). 2012;125(7):1352-4. doi:10.3760/cma.j.issn.0366-6999.2012.07.030.
15. Kushwaha SS, Raichlin E, Sheinin Y, et al. Sirolimus affects cardiomyocytes to reduce left ventricular mass in heart transplant recipients. Eur Heart J. 2008;29(22):2742-50. doi:10.1093/eurheartj/ehn407.
17. Kizilbash AM, Heinle SK, Grayburn PA. Spontaneous variability of left ventricular outflow tract gradient in hypertrophic obstructive cardiomyopathy. Circulation. 1998;97:461-6. doi:10.1161/01.cir.97.5.461.
18. Geske JB, Sorajja P, Ommen SR, Nishimura RA. Left ventricular outflow tract gradient variability in hypertrophic cardiomyopathy. Clin Cardiol. 2009;32:397-402. doi:10.1002/clc.20594.
19. Geske JB, Sorajja P, Ommen SR, Nishimura RA. Variability of left ventricular outflow tract gradient during cardiac catheterization in patients with hypertrophic cardiomyopathy. JACC Cardiovasc Interv. 2011;4(6):704-9. doi:10.1016/j.jcin.2011.02.014.
20. Roma-Rodrigues C, Fernandes AR. Genetics of hypertrophic cardiomyopathy: advances and pitfalls in molecular diagnosis and therapy. Appl Clin Genet. 2014;7:195-208. doi:10.2147/TACG.S49126.
21. Jarcho JA, McKenna W, Pare JA, et al. Mapping a gene for familial hypertrophic cardiomyopathy to chromosome 14q1. N Engl J Med. 1989;321(20):1372-8. doi:10.1056/NEJM198911163212005.
22. Konno T, Chang S, Seidman JG, Seidman CE. Genetics of hypertrophic cardiomyopathy. Curr Opin Cardiol. 2010;25(3):205-9. doi:10.1097/HCO.0b013e3283375698.
23. Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124:e783-831. doi:10.1161/CIR.0b013e318223e2bd.
25. Maass A, Konhilas JP, Stauffer BL, Leinwand LA. From sarcomeric mutations to heart disease: understanding familial hypertrophic cardiomyopathy. Cold Spring Harb Symp Quant Biol. 2002;67:409-15. doi:10.1101/sqb.2002.67.409.
26. Moolman JC, Corfield VA, Posen B, et al. Sudden death due to troponin T mutations. J Am Coll Cardiol. 1997;29(3):549-55. doi:10.1016/s0735-1097(96)00530-x.
27. Abbasi SA, Cheezum MK, Ghosh N, et al. Multimodality imaging of hypertrophic cardiomyopathy in a transplanted heart. Circulation. 2014;130(12):1010-3. doi:10.1161/CIRCULATIONAHA.114.01080
Об авторах
Головина Галина Алексеевна — кандидат медицинских наук, врач кардиолог кардиологического отделения № 3
Конфликт интересов не заявляется.
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Ставенчук Татьяна Владимировна — кандидат медицинских наук, врач отделения функциональной диагностики, ассистент кафедры терапии № 1 ФПК и ППС
Конфликт интересов не заявляется.
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Кижватова Наталья Владимировна — кандидат медицинских наук, зав. кардиологическим отделением № 3, доцент кафедры терапии № 1 ФПК и ППС
Конфликт интересов не заявляется.
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Космачёва Елена Дмитриевна — доктор медицинских наук, зам. главного врача по лечебной работе, зав. кафедрой терапии № 1 ФПК и ППС, главный кардиолог Южного федерального округа, главный кардиолог Краснодарского края
Конфликт интересов не заявляется.
Дополнительные файлы
Рецензия
Для цитирования:
For citation:
Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Г. А. Головина
ГБУЗ НИИ — ККБ № 1 им. проф. С. В. Очаповского Минздрава России
Россия
Головина Галина Алексеевна — кандидат медицинских наук, врач кардиолог кардиологического отделения № 3
Т. В. Ставенчук
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Ставенчук Татьяна Владимировна — кандидат медицинских наук, врач отделения функциональной диагностики, ассистент кафедры терапии № 1 ФПК и ППС
Н. В. Кижватова
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Кижватова Наталья Владимировна — кандидат медицинских наук, зав. кардиологическим отделением № 3, доцент кафедры терапии № 1 ФПК и ППС
Е. Д. Космачёва
ГБУЗ НИИ — ККБ №1 имени профессора С.В. Очаповского Минздрава России; ФГБОУ ВО КубГМУ Минздрава России
Россия
Космачёва Елена Дмитриевна — доктор медицинских наук, зам. главного врача по лечебной работе, зав. кафедрой терапии № 1 ФПК и ППС, главный кардиолог Южного федерального округа, главный кардиолог Краснодарского края
Гипертрофическая кардиомиопатия
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
Отделение кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова
Кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого МГМУ им. И.М. Сеченова (зав. — д.м.н. Р.Н. Комаров), Российский научный центр хирургии им. акад. Б.В. Петровского (дир. — акад. РАН Ю.В. Белов), Москва, Россия
кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого Московского медицинского университета им. И.М. Сеченова, Москва, Россия
ФГАОУ ВО «ПМГМУ им. И.М. Сеченова», Москва, Россия
ФГАОУ ВО «ПМГМУ им. И.М. Сеченова», Москва, Россия
РНЦХ им. акад. Б.В. Петровского РАМН
Современный взгляд на диагностику и лечение гипертрофической кардиомиопатии
Журнал: Кардиология и сердечно-сосудистая хирургия. 2019;12(1): 38‑44
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
Гипертрофическая кардиомиопатия является распространенным генетическим заболеванием с частотой встречаемости около 0,2%. Естественное течение заболевания может приводить к возникновению и прогрессированию сердечной недостаточности, внезапной сердечной смерти. В статье рассматривается исторический аспект, описаны современные методы диагностики, в том числе молекулярно-генетический, дана интерпретация актуальным методам консервативного и хирургического лечения этой патологии. Особое внимание уделено перспективным направлениям развития методов диагностики и лечения заболевания.
Первый МГМУ им. И.М. Сеченова;
Московский НИИ педиатрии и детской хирургии
Отделение кардиохирургии клиники аортальной и сердечно-сосудистой хирургии Первого МГМУ им. И.М. Сеченова
Кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого МГМУ им. И.М. Сеченова (зав. — д.м.н. Р.Н. Комаров), Российский научный центр хирургии им. акад. Б.В. Петровского (дир. — акад. РАН Ю.В. Белов), Москва, Россия
кафедра сердечно-сосудистой хирургии и инвазивной кардиологии Первого Московского медицинского университета им. И.М. Сеченова, Москва, Россия
ФГАОУ ВО «ПМГМУ им. И.М. Сеченова», Москва, Россия
ФГАОУ ВО «ПМГМУ им. И.М. Сеченова», Москва, Россия
РНЦХ им. акад. Б.В. Петровского РАМН
Гипертрофическая кардиомиопатия (ГКМП) является распространенным генетическим заболеванием, причиной возникновения которого являются около 1400 мутаций в более чем 11 генах [1—9]. Согласно данным исследования CARDIA [10], частота ГКМП составляет 1:500, и естественное течение заболевания может приводить к сердечной недостаточности и внезапной сердечной смерти. ГКМП проявляется гипертрофией миокарда при отсутствии дилатации полости левого желудочка (ЛЖ), а также аномалиями хорд и папиллярных мышц. Выделяют группы пациентов с обструктивной и необструктивной формой ГКМП. Среди пациентов с обструктивной ГКМП наиболее часто (50—75% случаев) встречается обструкция выходного отдела ЛЖ, которая возникает на фоне переднего систолического движения (systolic anterior motion, SAM-синдром) передней створки митрального клапана и ее соприкосновением с гипертрофированной межжелудочковой перегородкой (МЖП) [11].
Хирургическое вмешательство является «золотым стандартом» лечения обструктивной ГКМП. В 1961 г. A. Morrow и E. Brockenbrough [13] описали алгоритм выполнения септальной миоэктомии (МЭ), однако выполнена данная операция была впервые еще в 1958 г. английским кардиохирургом W. Cleland [14].
В целом, вопрос эффективной диагностики и лечения ГКМП, а также проблема определения факторов, потенцирующих ее развитие, остаются открытыми. Данный вопрос требует комплексного подхода и дальнейшего изучения.
История
В 50-е годы ХХ века R. Brock, A. Morrow и E. Braunwald [15—17] сообщили о функциональной обструкции ЛЖ, которая имитировала аортальный стеноз. В последующем эта патология была названа «идиопатическим гипертрофическим субаортальным стенозом». Приблизительно в то же время английский патологоанатом D. Teare [18] отметил наличие асимметричной гипертрофии сердца с вовлечением в процесс МЖП и передней стенки ЛЖ у молодых пациентов. Зачастую симптоматически эта патология никак себя не проявляла, но иногда приводила к внезапной смерти. Морфологическая картина была одинаковой у всех пациентов и обусловливалась дезорганизацией пучков сердечной мышцы («миокардиальный беспорядок») с гипертрофией отдельных мышечных волокон и их ядер. Нередко морфологи и патологоанатомы обнаруживали участки фиброза в центре гипертрофированного миокарда. Генез этого проявления был определен, как постишемический. В то же время подозревали генетическую природу ГКМП, основанную на выявлении аутосомно-доминантного типа наследования данной патологии в семье у одного из погибших пациентов [19]. Крайне вариабельные морфологические проявления ГКМП приводили к трудностям в диагностике заболевания и, в итоге, к путанице в терминологии, которая зачастую основывалась на концепции подклапанного аортального стеноза или обструкции выходного отдела Л.Ж. Актуальный в настоящее время термин «гипертрофическая кардиомиопатия» был принят, когда выяснилось, что только у части пациентов патология проявляется обструкцией выходного отдела ЛЖ [20].
Новаторские исследования, проведенные в 60-е годы XX века, ознаменовали начало обширных клинических, морфологических, генетических и молекулярных исследований в этой области. Были получены знания, позволившие изучить процесс течения ГКМП и стратифицировать риски ее развития. В то время из-за отсутствия неинвазивных методов визуализации сердца применяли катетеризацию ЛЖ, что позволяло оценивать лишь такой гемодинамический показатель, как аорто-желудочковый градиент давления, однако данная методика не давала возможности определить причину его возникновения. Внедрение в конце 60-х годов эхокардиографии (ЭхоКГ) и широкое использование ультразвуковой кардиовизуализации помогли установить причину градиента давления между ЛЖ и аортой у больных с ГКМП, определить фенотипическую гетерогенность и патофизиологические последствия заболевания, установить истинную распространенность патологии. Исследование пациентов с помощью ЭхоКГ подтвердило эффективность хирургической миоэктомии и определило важную роль SAM-синдрома в патогенезе обструкции выходного отдела ЛЖ [21].
С эпидемиологической точки зрения, ЭхоКГ позволила оценить распространенность ГКМП в общей популяции и провести скрининг семей, в которых были отмечены случаи ГКМП [22].
Для диагностики ГКМП также применяли позитронно-эмиссионную и компьютерную томографию, которые позволяли определять перфузию миокарда и процесс ремоделирования коронарных сосудов [23—25].
С 1980 г. появился такой метод визуализации, как магнитно-резонансная томография (МРТ), которая в настоящее время является «золотым стандартом» диагностики ГКМП и позволяет оценить наличие фиброза миокарда и визуализировать различные фенотипические проявления ГКМП [26].
Инструментальная диагностика
Обструктивная ГКМП характеризуется гипертрофией миокарда ЛЖ при отсутствии дилатации полости желудочка, а также наличием обструкции его выходного тракта. Это приводит к возникновению и прогрессированию хронической сердечной недостаточности и повышает риск внезапной сердечной смерти. Основными причинами обструкции выходного отдела ЛЖ при ГКМП являются SAM-синдром и гипертрофия МЖП, а также аномальное расположение хорд и папиллярных мышц [27—33]. ЭхоКГ является одним из важнейших методов диагностики данной патологии и позволяет визуализировать причину обструкции выходного отдела ЛЖ, степень гипертрофии ЛЖ, а также с помощью допплеровского анализа оценить внутрижелудочковый и аорто-желудочковый градиенты давления [34—36]. Последний используют в качестве основного диагностического критерия для определения стратегии лечения заболевания. B. Maron [34] выделил 3 формы ГКМП:
1) обструктивная форма, при которой градиент давления в покое ≥ 30 мм рт.ст.;
2) латентная обструкция, при которой градиент давления составляет 30 мм рт.ст. в покое и ≥30 мм рт.ст. при нагрузке или провокационных пробах;
3) необструктивная форма, при которой градиент давления 30 мм рт. ст. как в покое, так и при применении провокационных проб или физической нагрузки [34].
Согласно M. Maron и соавт. [37], у пациентов с обструктивной формой ГКМП риск внезапной сердечной смерти гораздо выше, чем при необструктивной форме. Стоит отметить, что в 90% случаев обструктивной формы ГКМП выявляют утолщение МЖП до 13—15 мм [27]. Оценить толщину МЖП можно и с помощью чреспищеводной ЭхоКГ [38, 39]. При оценке переднего систолического движения передней створки митрального клапана обнаруживается неполная коаптация створок, что приводит к митральной регургитации [40].
С помощью допплеровского анализа можно получить достоверные данные о существующем градиенте давления между ЛЖ и аортой по пиковой скорости кровотока в выходном тракте ЛЖ [26, 41]. Однако стоит иметь в виду, что митральная регургитация может искажать данные о градиенте давления и приводить к гипердиагностике [42, 43].
МРТ сердца
Важным инструментальным методом диагностики является МРТ сердца. Данный метод имеет существенное преимущество перед традиционной ЭхоКГ, которое заключается в отсутствии ограничений доступа в виде узкого акустического окна [44]. МРТ позволяет более четко визуализировать митральный клапан, подклапанный аппарат и выводной отдел Л.Ж. Также МРТ оказалась более перспективной методикой в определении степени и распространенности гипертрофии ЛЖ, особенно, если гипертрофия имеет локальный характер — верхушка сердца, задняя часть МЖП.
Продольные и поперечные срезы выходного отдела ЛЖ позволяют в полной мере оценить переднее систолическое движение передней створки митрального клапана, установить турбулентный характер кровотока, а также точно рассчитать диаметр и площадь сечения выходного тракта Л.Ж. Площадь последнего ≤2,7 см 2 в систолу со 100% чувствительностью свидетельствует об обструктивной форме ГКМП [45]. Комбинация режимов кино-МРТ с исследованием внутрисердечной перфузии позволяет рассчитать градиент давления до и после места обструкции и установить степень митральной регургитации [46].
МРТ с контрастным усилением гадолинием позволяет выявить фиброз миокарда и оценить его степень. Миокардиальный фиброз можно обнаружить у 2 из 3 пациентов с ГКМП [47—49]. Гадолиний накапливается в участках фиброзированного миокарда и виден ярким участком на фоне нормального миокарда. Степень фиброза миокарда в настоящее время рассматривают как серьезный и независимый предиктор внезапной сердечной смерти [50]. В ближайшее время именно МРТ может занять лидирующие позиции в диагностике ГКМП, а также в прогнозировании течения заболевания.
Генетические аспекты диагностики

Семейная ГКМП, обусловленная появлением патологических вариантов генов саркомера сердечной мышцы, наследуется по аутосомно-доминантному типу. Гены, патологические варианты которых наиболее часто вовлечены в патогенез ГКМП, приведены в таблице Встречаемость патологии белков саркомеров миокарда при ГКМП [51, 54]. Эти гены обнаруживают у 50—60% пациентов с семейным анамнезом ГКМП, а также у 20—30% пациентов без него [52]. Примерно 6% пациентов имеют более 1 варианта саркомерного гена (являются либо гомозиготами по одному из генов, либо гетерозиготами по нескольким), и значительно меньшее число пациентов будут иметь более 1 патологического варианта всех приведенных генов [53]. Известно более 1500 определенных индивидуальных патологических вариантов генов для данной нозологии [50]. Генетическая диагностика ГКМП базируется на ряде принципов. Крайне важно собрать подробный семейный анамнез трех—четырех поколений. Особое внимание должно быть направлено на выявление у родственников любого из следующих факторов: сердечной недостаточности, ГКМП, трансплантации сердца, внезапной смерти (особенно в молодом возрасте), сердечно-сосудистых заболеваний и/или аритмий, необъяснимого инсульта, других тромбоэмболических событий. Доступны многоэлементные панели, содержащие гены, которые, как известно, связаны с ГКМП. Развитие ГКМП чаще связано с мутацией гена MYH7, кодирующего синтез миозина 7-го типа, и MYBPC3, кодирующего синтез сердечного типа миозин-связывающего белка С [51].
Возможные результаты генетического исследования: положительный, предполагающий подтверждение диагноза; отрицательный, показывающий лишь то, что из предложенных в данной панели генов ни один не вовлечен в патогенез у данного пациента; вариант неизвестного значения — лаборатория обнаружила аллельный вариант, патологичность которого вызывает сомнение, следовательно, необходимо более детальное изучение данного случая с целью верификации значимости данного варианта.
Важно отметить, что в современной клинической практике принято считать, что родственники больного c ГКМП, у которых не было обнаружено патологических вариантов какого-либо из генов, приведенных выше, не нуждаются в дальнейшем наблюдении кардиолога [44].
Консервативное лечение
Пациентам с ГКМП рекомендуется придерживаться определенного образа жизни, а именно: избегать дегидратации, приема нитратов, поддерживать оптимальную массу тела [44]. Относительно медикаментозной терапии, Американская ассоциация кардиологов рекомендует использовать неселективные адреноблокаторы (бисопролол) и недигидропиридиновые блокаторы кальциевых каналов (верапамил) [52]. Часть больных c ГКМП нуждаются в имплантации кардиовертера-дефибриллятора. Показаниями для установки данного устройства служат перенесенный инфаркт миокарда, зафиксированная фибрилляция желудочков или гемодинамически значимая желудочковая тахикардия. Стоит рекомендовать пациентам имплантацию кардиовертера-дефибриллятора при максимальной толщине ЛЖ ≥30 мм, периодически возникающих синкопальных состояниях и в том случае, если его ближайшие родственники умерли от внезапной сердечной смерти [55].
Хирургическое лечение
Стандартом хирургического лечения пациентов с обструктивной формой ГКМП, у которых аорто-желудочковый градиент давления составляет 50 мм рт.ст. и более (в покое или при физической нагрузке), вот уже почти 50 лет является септальная миоэктомия (МЭ) [35, 52, 56]. В течение последних лет послеоперационная выживаемость после септальной МЭ составляет 99, 98 и 95% в течение 1, 5 и 10 лет соответственно [57]. Такого результата удалось добиться благодаря совершенствованию хирургических и диагностических методик, а также анестезиологического пособия и методов защиты миокарда. Стоит отметить, что результат септальной МЭ тем лучше, чем больше было выполнено хирургом данных операций, поэтому наилучшие исходы подобных операций достигаются небольшим количеством хирургов в нескольких крупнейших центрах по лечению ГКМП Северной Америки и Европы [58, 59].
В середине 90-х годов была предложена методика чрескожной алкогольной септальной аблации (АСА), которая является альтернативой миоэктомии [60]. Данная процедура заключается в введении 1—4 мл 96% этанола в септальные перфоранты передней межжелудочковой артерии, что провоцирует локальный инфаркт миокарда, способствует уменьшению толщины МЖП и снижению аорто-желудочкового градиента давления [52, 60]. Несмотря на кажущуюся простоту и эффективность АСА, результаты лечения послужили поводом для обширных дебатов, начало которым было положено сразу после широкого введения аблации в практику [61]. Основными осложнениями данной процедуры являются жизнеугрожающие желудочковые тахиаритмии [52]. В недавно опубликованном Европейском исследовании [62] было отмечено, что после АСА желудочковые тахиаритмии и фибрилляция желудочков возникают в 8 раз чаще, чем после септальной М.Э. Также было выявлено, что АСА сопровождается 10-кратным увеличением частоты полной поперечной блокады, что требует установки постоянного двухкамерного кардиостимулятора [17, 63—66].
На сегодняшний день роль АСА в лечение пациентов с обструктивной ГКМП еще не определена окончательно, что создает необходимость дальнейших исследований. Учитывая количество и серьезность осложнений, возникающих после выполнения АСА, данную методику не рекомендуется выполнять рутинно. Предпочтение стоит отдавать септальной МЭ, которая на сегодняшний день является «золотым стандартом» хирургического лечения обструктивной формы ГКМП.
Перспективные направления в диагностике и лечении ГКМП
МРТ с контрастированием является перспективной методикой для определения миокардиального фиброза. Однако эффективность данной методики зависит от наличия вокруг зоны фиброза здорового миокарда, что представляет сложность в диагностике у пациентов с диффузным фибротическим процессом. Использование режима Т1-взвешенных изображений позволяет нивелировать данное ограничение [67]. Не так давно были проведены исследования, которые показали, что использование данного режима до и после контрастирования позволяет разграничить участки диффузного фибротического поражения и нормального миокарда [68].
Ранолазин показал свою эффективность в снижении коронарогенных болей, симптомов сердечной недостаточности. Его механизм действия обусловлен ингибированием медленных натриевых каналов, что уменьшает расход энергии миокардом и таким образом сдерживает развитие ГКМП. Эффективность данного препарата была подтверждена в эксперименте на белых мышах, в то время как на человеке исследования еще не проводились.
Препарат MYK-461 является новым селективным молекулярным ингибитором АТФ-азы миозина. Механизм действия препарата основан на снижении сократимости саркомеров миокарда при отсутствии влияния на общую сократимость сердца. На сегодняшний день препарат проходит клинические испытания. Существуют результаты исследований in vitro, показавшие высокую метаболическую стабильность препарата в микросомах печени изученных видов (исследование проводилось на клеточных культурах печени мышей, крыс, собак, обезьян и человека); исследования in vivo (препарат вводился перорально и парентерально мышам, крысам, собакам и обезьянам) позволили предположить удовлетворительные фармакокинетические характеристики препарата, особенно в случае перорального применения. В том случае, если данный препарат покажет свою клиническую эффективность, он станет дополнением или хорошей альтернативой привычной консервативной терапии β-адреноблокаторами и блокаторами кальциевых каналов.
Заключение
ГКМП — патология, имеющая важное значение для современной медицины ввиду частой встречаемости среди населения и сложности выявления до проявления клинических симптомов. Механизм развития данного заболевания до конца не ясен, известна лишь часть генетических маркеров, коррелирующих с возникновением ГКМП. В связи с этим, крайне важным и перспективным выглядит развитие генетической диагностики этого заболевания, поскольку она позволит проводить полноценные скрининговые исследования для его раннего выявления.
Другими важными задачами являются разработка эффективного консервативного лечения и совершенствование хирургических методов коррекции обструктивной формы заболевания с учетом индивидуальных особенностей каждого пациента (персонифицированный подход в терапии и хирургии ГКМП).
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Гипертрофическая кардиомиопатия
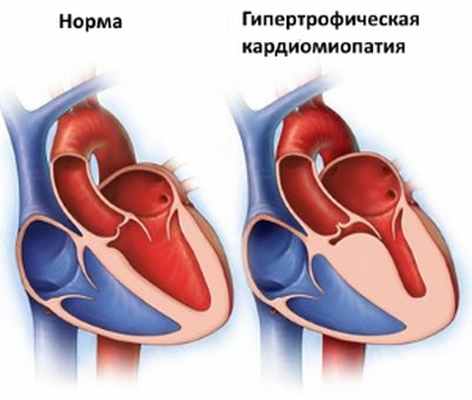
Гипертрофическая кардиомиопатия - это заболевание, при котором сердечная мышца (миокард) становится аномально толстой или гипертрофированной. Это утолщение сердечной мышцы значительно усложняет работу сердца по перекачиванию крови. Гипертрофическая кардиомиопатия может также негативно влиять на состояние электрической системы сердца.
Гипертрофическая кардиомиопатия часто остается не выявленной, так как у многих пациентов протекает бессимптомно. Симптомами этой патологии являются: одышка, нарушения ритма, вплоть до развития угрожающих жизни состояний (аритмий).
Симптомы включают в себя следующее:
- одышка, особенно во время физических упражнений или напряжения;
- боль в груди, особенно во время физических упражнений;
- обмороки, особенно во время физических упражнений;
- головокружение;
- усталость;
- учащенное сердцебиение.
Причины развития болезни
Гипертрофическая кардиомиопатия как правило, вызвана генными мутациями. Считается, что эти мутации заставляют сердечную мышцу расти аномально толстой. У людей с гипертрофической кардиомиопатией также обнаруживается измененное расположение мышечных волокон сердца. А клетки в волокнах перестают сокращаться синхронно, что часто приводит к нарушениям ритма сердечных сокращений.
Тяжесть гипертрофической кардиомиопатии колеблется в широких пределах. Большинство людей с гипертрофической кардиомиопатией имеют форму заболевания при которой значительно увеличивается межжелудочковая перегордка (перегородка между двумя нижними камерами сердца), что и затрудняет кровоток. Это состояние носит название гипертрофической обструктивной кардиомиопатии.
Другой распространенной формой заболевания является кардиомиопатия без существенных препятствий потоку крови. Однако в данном случае страдает эластичность сердечной мышцы, миокард становится жестким, что снижает количество крови выбрасывемое сердцем в сосудистую систему с каждым сокращением.Данная форма носит название необструктивной гипертрофической кардиомиопатии.
Факторы риска
Гипертрофической кардиомиопатии подвержены мужчины и женщины в равной степени.
Заболевание передается, как правило, по наследству. Существует 50% вероятность того, что дети тех, кто страдает гипертрофической кардиомиопатией будет наследовать генетическую мутацию приводящую впоследствии к развитию заболевания. Братья и сестры тех, кто страдает гипертрофической кардиомиопатией, также подвержены риску. Как следствие, близким родственникам тех, кто страдает гипертрофической кардиомиопатией, настоятельно рекомендуется обратиться к врачу для исключения заболевания.
Жалобы
У многих людей гипертрофическая кардиомиопатия не вызывает серьезных проблем со здоровьем. Тем не менее, в некоторых случаях, данная патология может вызвать серьезные неудобства, такие как одышка, боль в груди или обморок.
Людей с гипертрофической кардиомиопатией высока вероятность развития опасных нарушений сердечного ритма (аритмий), таких как желудочковая тахикардия или фибрилляция желудочков. Эти нарушения ритма могут привести к внезапной сердечной смерти. Гипертрофическая кардиомиопатия является основной причиной смерти, людей в возрасте до 30 лет. К счастью, таких смертей не очень много.
Возможные осложнения гипертрофической кардиомиопатии включают в себя:
- Аритмии. Утолщение сердечной мышцы, а также аномальное расположение клеток сердца, может нарушать нормальное функционирование электрической системы сердца, в результате чего наблюдается учащенное или неритмичное сердцебиение. Фибрилляция предсердий, желудочковая тахикардия и фибрилляция желудочков – самые распространенные среди аритмий, которые могут быть вызваны гипертрофической кардиомиопатией.
- Самое страшное осложнение гипертрофической кардиомиопатии - это внезапная смерть от остановки сердца из-за желудочковой тахикардии или фибрилляции желудочков. К сожалению, это состояние трудно предсказать. Если у вас бывают обмороки, сильное головокружение или длительное сердцебиение, вы должны не откладывать визит к врачу и обратиться за медицинской помощью.
- Затрудненный приток крови. У многих людей, утолщенный миокард вызывает замедление кровотока, увеличивая нагрузку на сердце. Это может привести к одышке при физической нагрузке, боли в груди, головокружению и обморокам.
- Проблемы с митральным клапаном. Утолщение сердечной мышцы может снижать объем левого желудочка, уменьшая свободное пространство для крови, что в свою очередь заставляет возвращаться кровь через митральный клапан обратно в предсердие. Это называется регургитацией митрального клапана. Регургитация митрального клапана может привести к другим осложнениям, таким как сердечная недостаточность или аритмии.
- Сердечная недостаточность. Сердечная недостаточность означает, что ваше сердце не может перекачивать достаточно крови, чтобы удовлетворить потребности организма. Утолщенная сердечная мышца при гипертрофической кардиомиопатии в конечном итоге становится слишком жесткой, чтобы работать эффективно, что приводит к одышке и сердечной недостаточности.
- Дилатационная кардиомиопатия. С течением времени, гипертрофированная сердечная мышца, которая сначала стала жесткой, теряет упругость и становится слабой и растягивается. Объем желудочка увеличивается, но «больная» мышца уже не в состоянии адекватно перекачивать кровь. Результатом является сердечная недостаточность.
Диагностика
- Эхокардиограмма (УЗИ сердца) -это наиболее распространенный тест для диагностики гипертрофической кардиомиопатии. С помощью эхокардиограммы врач может увидеть толщину вашей сердечной мышцы, является ли поток крови нарушенным, и состояние клапанов вашего сердца.
Эхокардиограмма использует звуковые волны для получения изображения сердца. Эхокардиография позволяет врачу увидеть сердце в движении – когда сокращаются желудочки, открываются и закрываются клапаны.
Типы эхокардиограммы включают в себя:
- Трансторакальная эхокардиография. Это стандартный эхокардиограмма. Врач УЗД работает с помощью датчика УЗ волн, перемещая его по поверхности грудной клетки. Датчик обнаруживает звуковые волны, отраженные от сердца. Компьютер преобразует их в движущиеся изображения на мониторе.
- Чреспищеводная эхокардиография. При этом типе эхокардиографии, гибкая трубка, содержащая датчик, проводится в пищевод. Оттуда можно получить более детальные изображения вашего сердца. Ваш лечащий врач может назначить чреспищеводную эхокардиографию если трудно получить ясную картину вашего сердца во время стандартного УЗИ.
Если у вас родители, родные братья и сестры, или дети - страдают гипертрофической кардиомиопатией, эксперты рекомендуют, чтобы вы регулярно обследовались на наличие признаков этого состояния у вас.
Рекомендация заключается в том, чтобы выполнять эхокардиографию (УЗИ сердца) и электрокардиограмму один раз в год. С течением времени эту диагностику можно проходить 1 раз в 5 лет.
Лечение
Цели лечения гипертрофической кардиомиопатии - облегчение симптомов и профилактика внезапной сердечной смерти у лиц с высокой степенью риска.
Варианты лечения гипертрофической кардиомиопатии разнообразны.
Резекция межжелудочковой перегородки
- Лечение препаратами. Различные медицинские препараты помогают расслабить миокард и привести к замедлению ЧСС так, что сердце начинает работать более эффективно. В настоящее время распространены бета-блокаторы, блокаторы кальциевых каналов и антиаритмические препараты.
- Резекция межжелудочковой перегородки. Это открытая операция на сердце, при которой хирург удаляет часть утолщенной межжелудочковой перегородки. Данная операция улучшает кровоток и снижает митральную регургитацию. Ее используют, если препараты не облегчают симптомы.
- Электрическая абляция – процедура, при которой токами низкой частоты разрушаются зоны в сердечной мышце, участвующие в развитии нарушений ритма сердечных сокращений. Редко во время данной манипуляции появляется необходимость в установке искусственного водителя ритма, регулирующего частоту сокращений сердца. В наше время этот вид лечения очень распространен.
- Установка искусственного водителя ритма – процедура, выполняемая под местной анестезией и заключающаяся в подкожной установке аппарата регулирующего частоту сердечных сокращений. Часто используется у пациентов с тяжелыми сопутствующими заболеваниями, для которых риск открытой операции на сердце очень высок.
- Установка дефибриллятора – манипуляция, похожая на установку искусственного водителя ритма, но в данном случае действие дефибриллятора направлено на восстановление нормальной частоты сердечных сокращений при развитии жизнеугрожающих нарушений ритма.
Кандидатами для хирургического лечения могут быть лица:
- перенесшие остановку сердца;
- один или более членов семьи которых умерли внезапной смертью вследствие гипертрофической кардиомиопатии;
- с необъяснимыми обмороками;
- с крайне сильным утолщением стенки левого желудочка.
Рекомендации
Среди рекомендаций врача могут быть:
- отказ от курения;
- снижение массы тела (поддержание адекватного веса предотвращает чрезмерную нагрузку на сердце);
- употребление пищи с ограничением поваренной соли;
- разработка оптимальной программы физических нагрузок;
- ограничение употребления алкоголя (Чрезмерное употребление алкоголя может вызвать нарушения сердечного ритмов, такие как
- фибрилляция предсердий).
Преодоление трудностей
Диагноз - гипертрофическая кардиомиопатия – не вызывает положительных эмоций. Однако причиной депрессии тоже служить не должен. Кардиомиопатия – излечимое заболевание, метод терапии зависит от его типа и степени тяжести.
Потому что гипертрофическая кардиомиопатия наследуется, оно не может быть предотвращено. Тем не менее, врачи и ученые узнают больше о генетических мутациях, которые вызывают данное заболевание. И важно определить это состояние как можно раньше, чтобы лечение и профилактика осложнений оказали существенную помощь вашему здоровью.
Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия (ГКМП) - аутосомно-доминантное заболевание, характеризующееся гипертрофией (утолщением) стенки левого и/или (изредка) правого желудочка. Это приводит к жесткости стенок сердца и аорты и способствует тому, что передняя створка митрального клапана оказывается близко к поверхности перегородки и поток крови подтягивает её к ней благодаря эффекту Вентури, создавая таким образом препятствие выбросу крови.
Симптомы гипертрофической кардиомиопатии
Многие люди с ГКМП не имеют либо никаких признаков болезни, либо только незначительные симптомы, и живут нормальной жизнью. У других же пациентов симптомы могут прогрессировать и обостряться, ухудшая тем самым работу сердца. Симптомы гипертрофической кардиомиопатии могут возникнуть в любом возрасте и включают в себя:
- боль или давление в груди (происходит обычно при физической нагрузке на организм, но также может произойти во время отдыха или после еды)
- затруднённое дыхание (одышка)
- усталость (чувство чрезмерной усталости)
- обморок (возникающий в связи с нерегулярными сердечными ритмами, неправильной работой кровеносных сосудов, или вовсе без какой либо причины)
- учащенное сердцебиение (из-за нарушения ритма сердца, обычно - желудочковые экстрасистолы, пароксизмы желудочковой тахикардии, часты также наджелудочковые нарушения ритма)
- внезапная смерть (примерно 30% больных вообще не предъявляют жалоб, внезапная смерть может быть первым и единственным проявлением заболевания.
Причины гипертрофической кардиомиопатии
ГКМП может быть как наследственной болезнью, связанной с мутацией генов, кодирующих синтез сократительных белков, так и болезнь, появляющаяся в процессе старения или из-за высокого кровяного давления. В некоторых случаях причины остаются неизвестными.
Диагностика гипертрофической кардиомиопатии
ГКМП диагностируется как на основе истории болезни (симптомы и семейная история), так и на основе медицинского осмотра и клинических анализов, таких как анализы крови, ЭКГ, рентген грудной клетки, эхокардиография (УЗИ сердца), стресс-тест, катетеризация сердца, КТ и МРТ.
Лечение гипертрофической кардиомиопатии
Лечение ГКМП показано лишь при наличии клиники либо факторов риска внезапной смерти. Лечение направлено на предотвращение симптомов и осложнений, и включает в себя выявление рисков, изменения образа жизни, приём лекарств. Также, по мере необходимости, врач кардиолог может назначить вам различные процедуры.
Рекомендации
Диета
Употребление большого количества жидкости имеет очень важное значение. Выпивайте по крайней мере от 6 до 8 стаканов воды в день. В жаркую погоду, следует увеличить потребление жидкости. Жидкость и ограничения в употреблении соли, необходимы для пациентов с сердечной недостаточностью. Посоветуйтесь с вашим лечащим врачом о принципах воздействия на ваш организм конкретных жидкостей и диетических напитков, включая информацию о воздействии алкоголя и кофеина.
Физические упражнения
Ваш врач подскажет, рекомендуется ли вам заниматься спортом или нет. Большинству людей с кардиомиопатией предлагаются легкие занятия аэробикой. Тем не менее, ваш врач, основываясь на симптомах и тяжести вашей болезни, может попросить вас воздержаться от каких либо физических нагрузок. Так же, как и при дилатационной кардиомиопатии, не рекомендуется поднятие тяжестей
Регулярное посещение врача
Пациенты с ГКМП минимум раз в год должны посещать врача кардиолога и контролировать свое состояние. Посещения врача могут быть более частыми, в том случае, когда гипертрофическая кардиомиопатия была диагностирована впервые.
Какие препараты используются для лечения гипертрофической кардиомиопатией?
Препараты, используемые для лечения симптомов и предотвращения дальнейшего осложнения ГКМП, снимают нагрузку с сердца и уменьшают препятствия для эффективной циркуляции крови в организме. При лечении гипертрофической кардиомиопатии используются также лекарства, в основе которых лежат бета-адреноблокаторы, способные снижать нагрузку на сердце за счет снижения давления и пульса, уменьшая гипертрофию миокарда. Также бета-блокаторы обладают антиаритмическим действием, в том числе способны уменьшить риск развития фатальных аритмий и внезапной смерти.
Врач может попросить вас избежать применения некоторых лекарственных препаратов, таких, как нитраты (они понижают кровяное давление) или дигоксин (он увеличивает силу сокращений сердца).
Ваш врач посоветует, какие лекарства вам больше всего подходят.
Хирургические процедуры, используемые для лечения гипертрофической кардиомиопатии
Хирургические методы, используемые для лечения ГКМП включают в себя:
Чрезаортальная септальная миэктомия. Данная методика предполагает уменьшение обструкции путем уменьшения толщины межжелудочковой перегородки.
Транскатетерная септальная алкогольная абляция. Введение склерозирующих веществ типа спиртовых растворов, создание в межжелудочковой перегородке зон инфаркта.
Имплантация искусственного митрального клапана сердца. Этот тип операции предлагается пациентам с высоким риском опасных для жизни аритмий и внезапной сердечной смерти. Митральный клапан постоянно отслеживает сердечный ритм. Когда он обнаруживает неправильный, очень быстрый ритм сердца, поставляя энергию в сердечную мышцу, он заставляет сердце биться в нормальном ритме.
Внезапная смерть и эндокардит при гипертрофической кардиомиопатии
Небольшое количество людей с HCM, подвержены повышенному риск внезапной сердечной смерти. Люди, которые входят в эту группу риска:
- родственники умерших от внезапной сердечной смерти
- молодые люди с ГКМП с несколькими эпизодами потери сознания
- пациенты с повышенным кровяным давлением и аритмией
- больные с тяжелыми симптомами и сердечной недостаточностью
Если у вас присутствуют два или более факторов риска внезапной сердечной смерти, врач пропишет вам лекарства для предотвращения аритмии. У большинства пациентов с ГКМП риск внезапной сердечной смерти невелик. Поговорите со своим врачом о всех проблемах, с которыми вы можете столкнутся при гипертрофической кардиомиопатии.
Как предотвратить эндокардит?
Люди с обструктивным ГКМП могу быть подвержены повышенному риску инфекционного эндокардита, потенциально опасного для жизни состояния. Чтобы защитить себя, говорите на приёме у любого врача, в том числе у стоматолога, что у вас есть заболевание сердца.
Позвоните своему врачу, если у вас появились симптомы инфекции (боль в горле, слабость, лихорадка).
Позаботьтесь о ваших зубах и деснах, чтобы защититься от инфекций.
Принимайте антибиотики перед тем как подвергнуться каким-либо процедурам, которые могут вызвать кровотечение, таких как: стоматологическая помощь, анализы (любые анализы, которые могут быть связаны со сбором крови или которые могут вызвать кровотечение), хирургические операции. Проконсультируйтесь со своим врачом о типе и количестве антибиотика, который вам следует принять.
Читайте также:
