Глюкокортикоиды для лечения хронического лимфолейкоза - показания, эффективность
Добавил пользователь Alex Обновлено: 28.01.2026
Хронический лимфоцитарный лейкоз — это злокачественная опухоль, произрастающая из малых В-лимфоцитов. Она характеризуется накоплением опухолевого клона клеток в костном мозге, лимфоидных тканях (лимфоузлы, селезенка) и крови. К этому же виду заболевания относится лимфома из малых лимфоцитов (ЛМЛ). Биологически она идентична ХЛЛ, но отличается клинической картиной. При хроническом лейкозе поражается костный мозг, и, как следствие, в крови повышается уровень лимфоцитов, а при ЛМЛ в основном поражаются лимфатические узлы и селезенка. Содержание опухолевого клона в крови менее 5×10 9 /л.
Классификация ХЛЛ
Хронический лейкоз классифицируется по стадиям и по группам риска.
Стадия заболевания определяется на основании клинического обследования и результатах анализа крови:
- Стадия А — уровень гемоглобина более 100 г/л, тромбоцитов более 100 × 10 9 /л, и поражено менее 3 областей лимфатических узлов.
- Стадия В — уровень гемоглобина более 100 г/л, тромбоцитов более 100 × 10 9 /л, и поражено более 3 областей лимфатических узлов.
- Стадия С уровень гемоглобина менее 100 г/л или уровень тромбоцитов менее 100 × 10 9 /л.
Классификация по группам риска
Для данной классификации был разработан международный прогностический индекс, учитывающий следующие параметры:
- мутация TP53 (17p).
- мутация IGHV.
- Уровень β2-микроглобулина >3,5 мг/л.
- Стадия B/С.
- Возраст старше 65 лет.
Каждому из этих параметров присваивается определенное количество баллов, при их суммировании пациент определяется в одну из 4 групп риска:
- 0-1 балл — группа с низким риском прогрессирования.
- 2-3 балла — промежуточный риск прогрессирования.
- 4-6 баллов — высокий риск прогрессирования.
- 7-10 баллов — очень высокий риск прогрессирования.
Симптомы ХЛЛ
Первоначально заболевание протекает бессимптомно, каких-то четких жалоб нет, но отмечаются частые респираторные инфекции, потливость, слабость. Может наблюдаться некоторое увеличение лимфатических узлов. Иными словами, ничего конкретного. На этой стадии хронический лейкоз обнаруживают случайно, когда пациент сдает общий анализ крови по поводу рутинного обследования или при диагностике другого заболевания. При доброкачественном течении такое состояние может продолжаться годами, но потом неизбежно наступает прогрессирование и наступает развернутая стадия процесса.
При развернутой стадии заболевания пациенты предъявляют следующие жалобы:
- Общая слабость.
- Снижение работоспособности.
- Ночная потливость.
- Резкое похудение без особых причин.
- Повышение температуры без признаков инфекции.
- Лимфаденопатия.
Развернутая стадия сменяется терминальной. Здесь уже наблюдается истощение, выраженная интоксикация, тяжелые генерализованные инфекции, нарушение работы внутренних органов (почечная недостаточность, кардиомиопатии и др). При инфильтрации головного мозга опухолевыми клетками, происходит нарушение сознания, вплоть до комы.
Причины возникновения хронического лимфоцитарного лейкоза
Причины возникновения хронического лимфолейкоза до конца не ясны. Многие факторы риска, которые имеют ключевое значение при развитии других злокачественных новообразований и гемобластозов, здесь не актуальны (воздействие ионизирующего излучения, химических канцерогенов, хронических инфекций). В то же время обнаружено увеличение заболеваемости среди лиц, занятых в обслуживании высоковольтных линий электропередач. Также доказана роль наследственной предрасположенности. Риски развития ХЛЛ при наличии в семье родственника с такой патологий увеличиваются в 30 раз по сравнению со среднепопуляционными показателями.
Диагностика хронического лимфолейкоза
Всем пациентам с подозрением на хронический лейкоз, а также с уже подтвержденным диагнозом во время каждого визита к гематологу проводят опрос и уточнение жалоб. Это важно не только для оценки текущего статуса, но и для прогнозирования тактики дальнейшего ведения больного. Особое внимание уделяется наличию неспецифических симптомов интоксикации (повышение температуры более 38 градусов в течение более, чем 2-х недель, ночная потливость и снижение массы тела более, чем на 10% за последние 6 месяцев). Также проводится физикальный терапевтический осмотр, включающий определение размеров печени и селезенки, а также пальпацию доступных лимфатических узлов. Для постановки диагноза назначается ряд специальных тестов:
- Иммунофенотипирование лимфоцитов. Диагноз хронический лимфоцитарный лейкоз выставляется, если уровень В-лимфоцитов в крови превышает 5000/мкл.
- При подозрении на ЛМЛ, когда нет специфической клинической симптоматики и увеличения лимфоцитов в крови, проводят биопсию увеличенного лимфатического узла с последующим морфологическим и иммуногистохимическим исследованием полученного материала.
- Для того чтобы оценить степень поражения костного мозга и отследить динамику изменений после терапии, проводят исследование его пунктата и биоптата. Аналогичные исследования проводят при подозрении на трансформацию лейкоза.
Для подбора терапии выполняются молекулярно-генетические исследования методом FISH для определения делеций 17р, мутаций ТР 53, а также других генетических аномалий.

После окончания терапии необходимо провести исследование крови методом проточной цитометрии для определения минимальной остаточной болезни. Полученные результаты позволят спрогнозировать время до рецидива и общую выживаемость. Например, уровень злокачественных клеток в крови, превышающий 1%, свидетельствует о высокой вероятности раннего рецидива и требует пересмотра протокола лечения. Если уровень опухолевых клеток находится в пределах 0.01-0.9%, ожидаемая продолжительность жизни без прогрессирования составляет 3 года. И при уровне опухолевых клеток менее 0.01% высока вероятность длительной безрецидивной выживаемости (более 5 лет).
Лечение хронического лимфоцитарного лейкоза
Лечение хронического лимфоцитарного лейкоза начинается только по показаниям. Это связано с тем, что около трети всех больных имеют вялотекущую форму заболевания, которая практически не сказывается на продолжительности их жизни.
Показаниями к назначению специфической терапии являются:
- Наличие симптомов интоксикации — повышение температуры более 38 градусов в течение 2 недель, снижение веса на 10% и более за пол года, ночные поты в течение месяца.
- Прогрессирующая анемия и/или тромбоцитопения.
- Прогрессирующее увеличение лимфатических узлов.
- Увеличение количества лимфоцитов в 2 раза и более в течение полугода.
- Увеличение селезенки (более 6 см по краю реберной дуги).
Цели лечения будут зависеть от возраста пациента и наличия у него сопутствующих заболеваний. В этой связи все пациенты с ХЛЛ делятся на три группы:
- 1 группа — пациенты младше 65 лет, у которых нет других серьезных заболеваний, и которые имеют благоприятный молекулярно-генетический профиль лейкоза. В этом случае ставится задача достижения полной ремиссии и редукции минимальной остаточной болезни.
- 2 группа — пациенты старше 65 лет либо молодые пациенты, у которых есть болезни, ограничивающие применение некоторых химиопрепаратов. Целью лечения данной группы является контроль над течением болезни при минимальной токсичности лечения.
- Третья группа — это пациенты с неблагоприятным молекулярно-генетическим профилем лейкоза (наличие делеции 17р, мутации ТР 53), независимо от возраста и общего статуса. Главным компонентом их лечения является ибрутиниб. Сохранным больным без тяжелых сопутствующих патологий может быть показана трансплантация аллогенных стволовых клеток (ТГСК).
Терапия первой линии пациентов первой группы
Стандартом лечения таких больных является режим FCR, включающий ритуксимаб, флударабин и циклофосфамид. Эта схема дает хорошие результаты, но сопряжена с высоким риском токсических и нейтропенических осложнений.
Пациентам, которым такой режим лечения провести невозможно, назначается схема RB — ритуксимаб и бендамустин. Этот режим менее токсичен, но вместе с тем и отличается чуть меньшей эффективностью. Также в качестве варианта лечения для достижения ремиссии может применяться ибрутиниб в качестве монотерапии.
Лечение пациентов второй группы
При терапии пациентов второй группы применяются менее токсические режимы и лечение таргетными препаратами. Могут использоваться следующие схемы:
- BR.
- FCR-lite.
- Хлорамбуцил + ритуксимаб.
- Монотерапия хлорамбуцилом.
- Хлорамбуцил + обинутузумаб.
- Монотерапия ибрутинибом.
Пациентам старше 80 лет, у которых ожидается невысокая продолжительность жизни, применяются максимально щадящие схемы. Как правило, это монотерапия хлорамбуцилом, ритуксимабом или ибрутинибом.

Лечение пациентов третьей группы
Пациентам из группы высокого риска может быть рекомендовано следующее лечение:
- Терапия ибрутинибом как в монорежиме, так и в составе полихимиотерапии с ритуксимабом или бендамустином. Лечение проводят до прогрессирования заболевания или развития токсических осложнений.
- Комбинированное лечение венетоклаксом и обинутузумабом в течение 12 месяцев.
- Молодым пациентам без сопутствующей патологии проводят лечение ибрутинибом до достижения объективного ответа, а затем рассматривается вариант донорской ТГСК для консолидации ремиссии.
- Пациентам, которым по каким-либо причинам невозможно назначение ибрутиниба, проводят монотерапию венетоклаксом.
Лечение рецидивов
При определении схемы лечения рецидива учитываются следующие данные:
- Схема лечения, выбранная для терапии первой линии.
- Время развития рецидива.
- Особенности течения рецидива.
Пациентам, у которых рецидив развился через 2 года после последней терапии (поздний рецидив), можно повторить выбранный режим, использовавшийся при предыдущем лечении или рассмотреть другой вариант ХТ первой линии, предусмотренной для лечения.
Пациентам с ранним рецидивом, который развился менее, чем через 2 года после окончания последней терапиии, не получавшим лечение ибрутинибом, рекомендовано назначать схемы лечения, содержащие этот препарат. Если они получали ибрутиниб, назначается схема венетоклакс+ритуксимаб. Пациентам младше 65 лет, при невозможности назначения ибрутиниба и неэффективнсти венетоклакса и ритуксимаба необходимо рассматривать аллогенную трансплантацию гемопоэтических стволовых клеток.
Лечение сопутствующих осложнений
Одной из основных причин смерти больных хроническим лимфоцитарным лейкозом являются инфекции. Их причиной является замещение нормальных иммунокомпетентных клеток опухолевым клоном и снижение уровня иммуноглобулинов. В этой связи пациентам с хроническим лимфолейкозом при уровне Ig G ниже 5 г/л рекомендуется заместительная терапия иммуноглобулином. Его вводят внутривенно раз в месяц в течение года. Также показана вакцинация против сезонных инфекций: гриппа, пневмококка, гемофильной инфекции, менингококковой инфекции.
Последствия хронического лимфоцитарного лейкоза
У 3-10% больных хроническим лимфоцитарным лейкозом возможна трансформация заболевания в крупноклеточную иммунобластную лимфому. Для подтверждения диагноза необходимо проведение биопсии пораженных лимфоузлов. Также возможна трансформация ХЛЛ в острый лимфобластный лейкоз. Вероятность такого события составляет менее 2%. Очень редко хронический лимфоцитарный лейкоз трансформируется в миеломную болезнь.
Прогноз при хроническом лимфоцитарном лейкозе
Хронический лимфоцитарный лейкоз на сегодняшний день является неизлечимым заболеванием. Однако возможности современной терапии позволяют существенно продлить жизнь таких больных, сохранив ее качество на приемлемом уровне. В целом продолжительность жизни таких пациентов стремится к общепопуляционным показателям.
В «Евроонко» лечение хронического лимфолейкоза проводится согласно современным стандартам с использованием новейших препаратов. Пациентами занимаются опытные врачи, в сложных случаях решение принимается коллегиально консилиумом специалистов. Благодаря такому подходу в каждом случае нам удается достичь максимально возможных результатов.
Глюкокортикоиды для лечения хронического лимфолейкоза - показания, эффективность
Современное лечение хронического лимфолейкоза - химиотерапия
Основным методом лечения хронического лимфолейкоза является химиотерапия. Верификация диагноза хронического лимфолейкоза не всегда является показанием для проведения противоопухолевой терапии. В ряде случаев (обычно в дебюте заболевания) оправдана выжидательная тактика, так как доказано, что раннее начало лечения не увеличивает выживаемость больных хроническим лимфолейкозом.
Показания к началу химиотерапии:
1) синдром опухолевой интоксикации (проливные ночные поты, лихорадка выше 38 °С, снижение массы тела);
2) анемия или тромбоцитопения, обусловленные опухолевой инфильтрацией костного мозга;
3) аутоиммунная гемолитическая анемия или тромбоцитопения (при отсутствии ответа на глюкокортикостероиды);
4) выраженная лимфоаденопатия и/или спленомегалия с компрессией органов и тканей с нарушением их функций;
5) время удвоения абсолютного лимфоцитоза в периферической крови меньше 12 месяцев;
6) гипогаммаглобулинемия, сопровождающаяся рецидивирующими инфекционными осложнениями;
7) массивная лимфоцитарная инфильтрация костного мозга;
8) лейкоцитоз больше 150 • 10 9 /л;
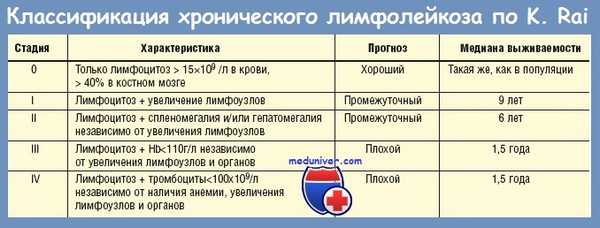
9) стадия III—IV по классификации К. Rai.
Основным препаратом для лечения хронического лимфолейкоза является хлорбутин (хлорамбуцил, лейкеран). Существует 2 основных режима назначения препарата:
1) малые дозы (0,07 мг/кг массы тела через день в течение 14 дней; курс повторяется каждые 28 дней);
2) большие дозы (0,7 мг/кг один раз в неделю).
Эффект достигается у 2/3 больных, побочное действие практически отсутствует. После получения ответа на лечение проводится поддерживающая терапия в дозе 10-15 мг 1-3 раза в неделю.
Применение хлорбутина позволяет быстро снизить количество лейкоцитов, однако уменьшение лимфатических узлов и селезенки достигается не всегда. Поэтому при преобладании в клинической картине лимфоаденопатии и спленомегалии с умеренным лейкоцитозом может использоваться комбинированная терапия хлорбутином и преднизолоном (преднизолон 30-70 мг в сутки + хлорбутин 10-20 мг в сутки) курсами по 5-14 дней с перерывами 2-4 недели.
При непереносимости хлорбутина, резистентности к препарату, а также у лиц моложе 60 лет можно применять циклофосфан в дозе 2-3 мг/кг в сутки ежедневно внутрь или 1000 мг внутривенно каждые 2 недели. Эффективность препарата сравнима с хлорбутином, однако возможны побочные эффекты (диспепсия, геморрагический цистит).
Преднизолон в дозе 30-60 мг/м2 внутрь ежедневно назначается при аутоиммунной гемолитической анемии или тромбоцитопении. После достижения эффекта доза глюкокортикостероидов постепенно уменьшается до полной отмены препарата.
При неэффективности монотерапии и прогрессировании заболевания (а в ряде случаев — и в качестве индукционного курса) возможно проведение полихимиотерапии по программам СОР (циклофосфан, винкристин, преднизолон) или CHOP (СОР+адриабластин). У пожилых пациентов с сопутствующими заболеваниями сердечно-сосудистой системы доза адриабластина редуцируется (программа мини-СНОР).
Непосредственный эффект комбинированного лечения хороший, однако достоверного увеличения медианы выживаемости по сравнению с пациентами, получавшими монохимиотерапию, не отмечено. Следует иметь в виду также более выраженную токсичность программ полихимиотерапии по сравнению с монотерапией.
Стандартные режимы монохимиотерапии и полихимиотерапия увеличивают продолжительность жизни больных в среднем на 2-3 года.
В последние годы в клиническую практику внедрено новое поколение цитостатических препаратов для лечения хронического лимфолейкоза — аналоги пуриновых нук-леозидов (флударабин, пентостатин, кладрибин).
Основным побочным эффектом является выраженная миелосупрессия с возможным развитием инфекционных осложнений, реже отмечаются аутоиммунная гемолитическая анемия и нейротоксичность. В целом флударабин переносится хорошо и в настоящее время рассматривается как наиболее эффективный препарат для лечения больных хроническим лимфолейкозом как в виде монотерапии, так и в сочетании с другими препаратами (чаще всего с циклофосфаном, митоксантроном и ритуксимабом).
Последние несколько лет характеризуются активным внедрением для лечения хронического лимфолейкоза моноклональных антител: анти-CD20 (Mabthera, Rituximab) и анти-CD52 (Campath-1, Alemtuzumab). Мабтера в настоящее время используется в комбинации с флударабином и алкилирующими агентами при проведении химиотерапии первой линии. При проведении химиотерапии второй линии применяются комбинация мабтеры, пентостатина и циклофосфана и другие режимы.
Анти-CD52 (Campath-1, Alemtuzumab) рекомендуется для проведения химиотерапии второй линии в виде монотерапии или в сочетании с другими цитостатиками.

Современные химиотерапевтические подходы к лечению хронического лимфолейкоза:
I. Химиотерапия 1-й линии:
— Флударабин ± ритуксимаб
— Хлорбутин ± преднизолон
— Циклофосфан ± преднизолон
— СОР (циклофосфан. винкристин, преднизолон)
— FC (флударабин, циклофосфан) ± ритуксимаб
II. Химиотерапия 2-й линии:
— Алемтузумаб
— PC (пентостатин, циклофосфан) ± ритуксимаб
— Полихимиотерапия ± ритуксимаб или алемтузумаб
В последние годы при хроническом лимфолейкозе изучается эффективность трансплантации аллогенных гемопоэтических стволовых клеток и биологических методов лечения.
Трансплантация аллогенных гемопоэтических стволовых клеток используется у больных моложе 55 лет при наличии неблагоприятных прогностических факторов (в частности, высокого уровня ZAP-70). Этот метод лечения используется редко, так как большинство пациентов старше 60 лет и имеют большое количество сопутствующих заболеваний.
После трансплантации достоверно увеличивается общая выживаемость, однако это нивелируется высокой смертностью, обусловленной лечением. При внедрении немиелоаблативных режимов кондиционирования количество больных хроническим лимфолейкозом, которым показана трансплантация, может существенно увеличиться, а совершенствование метода позволит уменьшить количество осложнений.
В ряде случаев у больных хроническим лимфолейкозом могут применяться паллиативные методы лечения (лучевая терапия, спленэктомия, лейкоцитаферез).
Лучевая терапия используется при наличии выраженной спленомегалии или конгломерата лимфатических узлов с признаками компрессии окружающих органов.
Необходимость в спленэктомии у больных хроническим лимфолейкозом возникает редко. Показания к спленэктомии:
а) аутоиммунная гемолитическая анемия, резистентная к терапии глюкокортикостероидами и цитостатическими препаратами;
б) выраженная спленомегалия, не поддающаяся консервативным методам лечения, в том числе лучевой терапии.
Лейкоцитаферез может использоваться для профилактики и лечения лейкостаза у больных с гиперлейкоцитозом, при резистентном к терапии хронического лимфолейкоза или при наличии противопоказаний к химиотерапии.
Лечение осложнений хронического лимфолейкоза (инфекционных, аутоиммунных) проводится по общим принципам онкогематологии.
К новым методам лечения, эффективность которых изучается у больных хроническим лимфолейкозом, относятся:
1) антисмысловые олигонуклеотиды (в частности, направленные против BCL-2);
2) генная терапия, направленная на изменение иммунофенотипа хронического лимфолейкоза;
3) комбинированная терапия мабтерой и ингибиторами ZAP-70;
4) моноклональные антитела к детерминантам опухолевых клеток (HLA-DR, CD40 и др.).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиника доброкачественных моноклональных гаммапатий - диагностика, лечение
Пациенты с доброкачественными моноклональными гаммапатиями не представляют никакого клинического симптома, а лишь биологические изменения сывороточных протеинов. В плазме этих лиц обнаруживается при электрофорезе один глобулин в большем количестве. Иммунохимические исследования показали, что речь идет о гомогенном, монотипном Ig, состояшем из одной тяжелой цепи и одной легкой цепи. Описывались случаи с компонентом IgG, IgA и IgM. He известны случаи доброкачественных моноклональных гаммапатии с IgE или IgD. В известных случаях наблюдается преобладание Ig с легкой цепью ламбда по отношению к каппа.
При доброкачественной моноклональной гаммапатии, моноклональный компонент существует в малом количестве (1—3 г/100 мл сыворотки), не сопровождается сокращением остальных Ig и не изменяется количественно в течение долгих периодов времени. Кроме этого, пациенты не представяют протеинурии Бене-Джонса (Вепсе-Jones).
Остальные лабораторные исследования нехарактерны. Гемограмма обычно нормальная. СОЭ может быть нормальной, но бывает и весьма ускоренной.
Исследование костного мозга показывает обычно слегка повышенное число плазмоцитов, но не превышающее 10—15% общего количества миэлоидных элементов.
Дифференциальная диагностика доброкачественных моноклональных гаммапатий производится в первую очередь с множественной миэломой в начальной фазе. Ritzmann и сотр. попытались определить клинические или биологические признаки, которые могут способствовать дифференциации этих двух заболеваний. Они обнаружили, что ни один из биологических тестов (количество IgM, отсутствие или наличие протеина Бене-Джонса, нормальное или пониженное количество остальных Ig) не может давать точное указание. Единственно верный метод дифференциации состоит в наблюдении больного в течение долгого времени.
При доброкачественной моноклональной гаммапатии, количество моноклонального компонента остается без изменений в течение нескольких лет, в то время как при множественной миэломе, патологический протеин представляет явный рост от одного анализа к другому.
Эволюция и прогноз доброкачественных моноклональных гаммапатий. Как показывает и самое название, доброкачественная моноклональная гаммапатия имеет обычно долгую эволюцию и хороший прогноз.
Однако в литературе по специальности отмечаются случаи, которые после многолетнего типично стационарного аспекта, эволюировали в дальнейшем как множественная миэлома. Отсюда вытекает необходимость для таких больных находиться под тщательным медицинским надзором в течение долгих периодов времени.
Лечение доброкачественных моноклональных гаммапатий. Пациенты с доброкачественной моноклональной гаммапатией не нуждаются в лечении. Однако существует необходимость тщательного медицинского надзора в течение долгих периодов и применения лечения при первых же признаках эволютивности, особенно в случае повышения количества компонента М.
Глюкокортикоидная терапия сегодня: эффективность и безопасность
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
- Заместительная терапия, проводимая при надпочечниковой недостаточности, должна имитировать как базальную секрецию надпочечников и ее суточный ритм, так и ее усиление при стрессе; при этом используемые дозы близки к суточной секреции гормона. Здесь предпочтительнее применять естественный гормон — гидрокортизон (солу кортеф), обладающий глюкокортикоидной и определенной минералокортикоидной активностью, в дозе от 20-25 до 30-37,5 мг в сутки. При незначительном выпадении минералокортикоидной функции (небольшие потери соли) бывает достаточно его одного. При выраженной потере соли или при использовании эквивалентных доз преднизолона (от 5 до 7,5 мг), который может оказаться более эффективным, добавляется кортикостероид с выраженной минерало- и некоторой глюкокортикостероидной активностью — флудрокортизон (кортинефф, кортеф). На практике применяются те минимальные дозы, которые обеспечивают хорошее самочувствие и работоспособность, нормальный уровень АД и электролитов крови. При стрессе доза гидрокортизона может достигать 250-300 мг в сутки. Для имитации ритма секреции 2/3 дозы назначаются в 8 часов и 1/3 — в 16.
- При блокирующей (подавляющей) терапии используется эффект, чаще всего рассматриваемый как побочный, — блокада оси гипоталамус-гипофиз-кора надпочечников (ГГКН). Так, при терапии адреногенитального синдрома вводимые извне ГКС кроме заместительной выполняют и блокирующую функцию в отношении гиперсекреции АКТГ и андрогенов. ГКС подавляют и секрецию ТТГ, что наряду со снижением уровня тиреоидсвязывающего глобулина и торможением конверсии Т4 в Т3 уменьшает тиреоидную активность и используется при лечении тиреотоксических кризов. Наиболее активно ось ГГКН подавляется естественными ГКС или препаратами с длительным тканевым периодом полураспада (фторированные гормоны — дексаметазон, бетаметазон); при этом применяются как физиологические, так и более высокие (фармакодинамические) дозы.
- Большинство показаний к фармакодинамической терапии базируются на одной особенности ГКС — уникальном сочетании противовоспалительного и иммунодепрессивного эффектов. Это сочетание лежит в основе традиционных представлений о том, что так называемые ревматические болезни, где воспаление является следствием иммунопатологического процесса, служат чуть ли не абсолютным показанием к ее проведению.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
- начиная с наименьшей возможной дозы, увеличивают ее при недостаточном эффекте до оптимальной; при этом возникает опасность увеличения сроков лечения, потери эффективности и развития побочного действия;
- начиная с максимальных суточных доз, их снижают после получения клинического эффекта; при этом достигается скорейший эффект, уменьшаются длительность лечения и суммарная доза ГКС.
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
- в ситуациях, непосредственно угрожающих жизни, назначается интенсивная терапия сверхвысокими (до 500–4000 мг внутривенно) или средними/высокими (25–150 мг внутрь) дозами (пероральная доза преднизолона эквивалентна примерно 1/6 внутривенной) — такая терапия может проводиться несколько дней и не требует постепенной отмены;
- при тяжелых обострениях или при хроническом течении тяжелых заболеваний (лейкозы, некоторые коллагенозы, гемолитическая анемия, тромбоцитопении) проводится лимитированная терапия, ограниченная неделями при использовании внутрь высоких доз (80–200 мг) и неделями или месяцами в случае применения средних доз (25–60 мг); максимальные дозы, назначаемые вначале, по мере улучшения состояния ступенчато уменьшаются с последующим переходом на поддерживающие;
- при ряде хронических заболеваний (бронхиальная астма, ревматоидный артрит) проводится длительная терапия низкими дозами (до 10 мг), однако дозы менее 5 мг скорее всего являются лишь заместительными и дают клинический эффект только при атрофии коры надпочечников, индуцированной длительной глюкокортикоидной терапией.
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
- соотносить эффективность и безопасность различных препаратов можно только на основе их эквивалентных доз. Между тем, если для различных побочных эффектов отдельных ГКС имеются характеристики относительной активности, из всех лечебных эффектов сравнивается только противовоспалительный, в соответствии с которым и рассчитывается эквивалентная доза;
- о соотношении доз при пероральном и парентеральном применении конкретных препаратов отсутствуют однозначные данные даже тогда, когда речь идет о противовоспалительном эффекте, не говоря уже о других лечебных или побочных свойствах.
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Хронический лимфолейкоз
Хронический лимфолейкоз — злокачественное лимфопролиферативное заболевание, при котором опухолевыми клетками являются патологические В-лимфоциты, способные накапливаться в костном мозге, периферической крови и лимфатических узлах. В норме В-лимфоциты в течение своей жизни превращаются в иммуноглобулинсекретирующую клетку, которая обеспечивает приобретённый иммунитет. Опухолевые В-лимфоциты такой функции лишены, и, таким образом, иммунитет больного страдает, и повышается риск присоединения инфекционных заболеваний. Помимо этого, по мере прогрессирования заболевания нарушается выработка эритроцитов, нейтрофилов и тромбоцитов, возможно развитие аутоиммунных процессов. Наконец, хронический лимфолейкоз может трансформироваться в В-клеточный пролимфоцитарный лейкоз, в высокодифференцированную неходжкинскую лимфому, в частности — в диффузную В-крупноклеточную лимфому.
Причины развития лимфолейкоза
Хронический лейкоз является самым распространённым видом лейкоза, составляя до 30% в общей структуре заболеваемости. Частота встречаемости составляет 4 случая на 100 тысяч населения; у лиц старше 80 лет частота составляет более 30 случаев на 100 тысяч населения.
Факторами риска развития хронического лимфолейкоза являются:
- Пожилой возраст. До 70% всех выявленных случаев приходится на людей старше 60 лет,
- Мужской пол. Мужчины заболевают в два раза чаще женщин,
- Воздействие ионизирующего излучения,
- Контакт с бензолом и бензином.
Симптомы
Для хронического лимфолейкоза характерно длительное бессимптомное течение; основной причиной обращения к врачу являются изменения в общем анализе крови, сданном в рамках профилактического осмотра или по поводу иного заболевания. Активных жалоб на момент первичного осмотра пациент может и не предъявлять, но при этом зачастую даже в этой ситуации уже выявляется увеличение лимфатических узлов и изменение их консистенции до тестоватой. Сами лимфоузлы не уплотнены, сохраняют подвижность относительно окружающих тканей. В случае присоединения инфекции лимфатические узлы значительно увеличиваются; по мере прогрессирования хронического лимфолейкоза лимфоузлы — в первую очередь брюшной полости — способны
образовывать конгломераты.
Первые возникающие жалобы обычно не носят специфического характера: повышенная утомляемость, слабость, выраженная потливость. По мере развития заболевания могут возникнуть аутоиммунные проявления, в первую очень гемолитические анемии (в 10-25% случаев) и тромбоцитопении (в 2-3% случаев). Гемолитическая анемия развивается в связи с разрушением самим организмом эритроцитов; чаще всего развивается, как и сам хронический лимфолейкоз, постепенно, но может проявиться и острым кризом — с повышением температуры, появлением желтухи, потемнения мочи. Тромбоцитопения может быть гораздо более опасным состоянием в связи с развитием кровотечений, в том числе и жизнеугрожающих (например, кровоизлияния в головной мозг).
Кроме того, так как В-лимфоциты относятся к клеткам, обеспечивающим иммунитет, типичным является присоединение инфекционных осложнений, в том числе оппортунистических, то есть вызванных микроорганизмами, постоянно находящимися в человеческом организме и не проявляющими себя при адекватном иммунном ответе. Чаще всего оппортунистическими инфекциями поражаются лёгкие.
Диагноз хронического лимфолейкоза может быть заподозрен при оценке результатов обычного клинического анализа крови — обращает на себя внимание увеличение абсолютного количества лимфоцитов и лейкоцитов. Основным диагностическим критерием является абсолютное количество лимфоцитов, превышающее 5×10 9 \л и прогрессивно увеличивающееся по мере развития лимфолейкоза, достигая цифр 100-500×10 9 \л. Важно обращать внимание не только на абсолютное число, — если в начале заболевания лимфоциты составляют до 60-70% от всего количества лейкоцитов, то при его дальнейшем развитии они могут составлять 95-99%. Другие показатели крови, такие, как гемоглобин и тромбоциты, могут быть в норме, но при прогрессировании заболевания может быть выявлено их снижение. Абсолютным критерием для установки диагноза «хронический лимфолейкоз» является выявление более 5000 клональных В-лимфоцитов в 1 мкл периферической крови.
В биохимическом анализе крови может быть выявлено снижение общего белка и количества иммуноглобулинов, но это характерно для более поздних стадий заболевания. Обязательным этапом в диагностическом поиске является трепанбиопсия костного мозга. При гистологическом исследовании полученного пунктата на ранних этапах заболевания так же, как и в общем анализе крови, обнаруживается небольшое содержание лимфоцитов (40–50%), но при высоком лейкоцитозе лимфоциты могут составлять 95–98% костномозговых элементов.
Так как изменения в костном мозге являются неспецифическими, окончательный диагноз хронического лимфолейкоза устанавливается на основании данных иммуногистохимического исследования. Характерный иммунофенотип хронического лимфолейкоза включает экспрессию антигенов CD19, CD5, CD20, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов IgM (нередко одновременно с IgD) и антигенов CD20 и CD22. Главным цитогенетическим маркером, непосредственно влияющим на выбор терапии, является делеция 17p. Желательно выполнять анализ, направленный на выявлении этой делеции, до начала лечения, так как её выявление приводит к изменению тактики ведения пациента. Помимо биопсии костного мозга, в случае значительного увеличения отдельных лимфатических узлов показана пункция и их с целью исключения лимфомы.
Из инструментальных методов диагностики проводятся рентгенография органов грудной клетки и УЗИ наиболее часто поражаемых групп лимфоузлов и органов брюшной полости – в первую очередь печени и селезёнки, так как именно эти органы чаще всего поражаются при хроническом лимфолейкозе.

Стадии заболевания
В настоящее время стадирование осуществляется согласно классификации, предложенной Binet:
- A — содержание гемоглобина более 100 г\л, тромбоцитов — более 100×10 9 \л, поражено менее трёх лимфатических областей (к ним относятся: шейные лимфоузлы, подмышечные лимфоузлы, паховые лимфоузлы, печень, селезёнка),
- B — содержание гемоглобина более 100 г\л, тромбоцитов — более 100×10 9 \л, поражено более трёх лимфатических областей,
- C — содержание гемоглобина менее 100 г\ или тромбоцитов — менее 100×10 9 \л.
Помимо классификации по Binet, используется классификация по Rai, используемая преимущественно в США. Согласно ей, выделяют четыре стадии заболевания:
- 0 — клинические проявления включают в себя только повышение лимфоцитов более 15×10 9 в периферической крови и более 40% в костном мозге,
- I — повышено количество лимфоцитов, диагностируется увеличение лимфоузлов,
- II — повышено количество лимфоцитов, диагностируется увеличение печени и\или селезёнки вне зависимости от увеличения лимфоузлов,
- III — наблюдается повышение количества лимфоцитов и снижение уровня гемоглобина менее 110 г\л вне зависимости от увеличения селезёнки, печени и лимфоузлов,
- IV — наблюдается повышение количества лимфоцитов и снижение числа тромбоцитов менее 100×10 9 вне зависимости от уровня гемоглобина, увеличения органов и лимфоузлов.
0 стадия характеризуется благоприятным прогнозом, I и II — промежуточным, III и IV — неблагоприятным.
Лечение
В настоящее время хронический лимфолейкоз хорошо поддаётся лечению благодаря широкому спектру химиотерапевтических препаратов. Важно отметить, что современные руководства не рекомендуют начинать агрессивное лечение сразу же после установки диагноза — в случаях, когда клинические проявления минимальны, возможно активное динамическое наблюдение до момента возникновения показаний к проведению специфического лечения, к коим относятся:
- Возникновение или нарастание интоксикации, которая проявляется потерей массы тела более чем на 10% за полгода, ухудшением общего состояния; появление лихорадки, субфебрильной температуры, ночных потов.
- Нарастание явлений анемии и/или тромбоцитопении;
- Аутоиммунная анемия и/или тромбоцитопения — в случае, если состояние не корректируется преднизолоном;
- Значительные размеры селезёнки — нижний край на расстоянии >6 см и более ниже рёберной дуги;
- Размер поражённых лимфатических узлов более 10 см или его прогрессивное увеличение;
- Увеличение количества лимфоцитов более, чем на 50% за 2 месяца, или вдвое за 6 месяцев.
Основным методом лечения хронического лимфолейкоза на данный момент является химиотерапия. Один из первых химиотерапевтических агентов, показавших свою эффективность в лечении хронического лимфолейкоза, хлорамбуцил, используется и в настоящее время, хоть и ограниченно. С течением времени вместо хлорамбуцила стали использовать циклофосфамид, в комбинации с другими препаратами, и соответствующие схемы (например, CHOP, COP, CAP) на данный момент применяются у пациентов молодого возраста с хорошим соматическим статусом.
Впервые введённый в клиническую практику в 80-х годах прошлого века флударабин показал эффективность в отношении достижения стойкой ремиссии, превышающую эффективность хлорамбуцила, особенно в сочетании с циклофосфамидом. Важно отметить, что эта схема эффективна даже в случае развития рецидива заболевания. Последним словом в лечении хронического лейкоза в настоящее время является применение иммунотерапевтических средств — препаратов из группы моноклональных тел. В рутинную клиническую практику прочно вошел ритуксимаб. Данный препарат взаимодействует с антигеном CD20, который ограниченно экспрессируется при хроническом лимфолейкозе, поэтому для эффективного лечения требуется сочетание ритуксимаба с какой-либо из принятых схем химиотерапии, чаще всего с флударабином или COP. Ритуксимаб в монорежиме может применяться как поддерживающая терапия при частичном ответе на лечение.
Перспективным выглядит применение препарата алемтузумаб, который взаимодействует с антигеном CD52. Его также используют как в монорежиме, так и в комбинации с флударабином.
Отдельно хотелось бы упомянуть хронический лимфолейкоз с делецией 17p. Этот подтип лимфолейкоза часто бывает резистентен к стандартным схемам химиотерапии.
Определённые успехи в лечении этого подвида лимфолейкоза достигнуты благодаря применению упомянутого выше алемтузумаба. Кроме того, перспективным средством в этой ситуации является ибрутиниб. В настоящее время этот препарат применяется в монорежиме, сочетание его с различными схемами химиотерапии исследуется; определённое преимущество показала схема, включающая ибрутиниб, ещё одно моноклональное тело — ритуксимаб, и бендамустин.
Лучевая терапия, которая столетие назад была практически единственной возможностью лечения таких больных, и по сей день не утратила актуальности: рекомендуется её проведение в рамках комплексного подхода на область поражённых лимфоузлов, если наблюдается их продолженный рост на фоне стабилизации остальных проявлений заболевания. В этом случае необходимая суммарная доза составляет 20-30 Гр. Также лучевой метод может быть применён при рецидивах заболевания.
В лечении хронического лимфолейкоза нашёл своё место и хирургический метод, заключающийся в удалении поражённой селезёнки. Показаниями к данному вмешательству являются:
- Увеличение селезёнки в сочетании с тяжелой анемией и/или тромбоцитопенией, особенно если наблюдается химиорезистентность,
- Массивное увеличение селезёнки при условии отсутствия ответа на химиотерапию,
- Тяжёлая аутоиммунная анемия и/или тромбоцитопения при резистентности к медикаментозному лечению.
При развитии резистентности к применяемым ранее химиотерапевтическим агентам или же при быстром прогрессировании после проведённого лечения может быть проведена трансплантация костного мозга. Трансплантация костного мозга показана в первой ремиссии пациентам из группы высокого риска, молодым пациентам в отсутствие эффекта от проводимого лечения, пациентам с делецией 17p/мутацией TP53 при наличии прогрессии заболевания. Важно отметить, что после проведённой трансплантации рекомендуется применение ритуксимаба и леналидомида в качестве поддерживающей терапии с целью предотвращения рецидива.
Наконец, пациентам требуется проведение и поддерживающей терапии, которая включает:
- Переливание эритроцитарной массы при анемии;
- Переливание тромбоцитарной массы при кровотечении, вызванном тромбоцитопенией;
- Противомикробные средства при присоединении бактериальной, грибковой или вирусной инфекции, а также для её профилактики;
- Применение преднизолона в дозе 1-2 мг/кг при развитии аутоиммунных процессов.
В случае развития рецидива заболевания тактика лечения зависит от ряда факторов, таких как: проведённая ранее терапия, срок наступления рецидива, клиническая картина. В случае раннего (то есть возникшего в периоде 24 месяцев и ранее) рецидива основным препаратом является ибрутиниб. Он применяется как самостоятельно, так и в составе упомянутой выше схемы лечения (ибрутиниб+ритуксимаб+бендамустин).
Альтернативным препаратом выбора может быть алемтузумаб. Демонстрируя сопоставимую с ибрутинибом эффективность, он, однако, демонстрирует значительно большую токсичность.
Наконец, у ряда пациентов по поводу раннего рецидива хронического лимфолейкоза может быть выполнена трансплантация костного мозга.
В случае позднего (возникшего в срок более 24 месяцев с момента завершения лечения) рецидива основным критерием выбора является проведённая ранняя терапия.
- Если проводимая ранее терапия на основе флударабина не сопровождалась значительной токсичностью, то можно вернуться к этой схеме, а также дополнить её ритуксимабом.
- В случае выявления цитопении возможно применение ритуксимаба в сочетании с высокими дозами глюкокортикостероидов.
- При проведённом ранее лечении хлорамбуцилом показано применение схем с флударабином или сочетанием бендамустина и ритуксимаба.
- Монотерапия ибрутинибом или его сочетание с одной из схем полихимиотерапии также может быть эффективна при рецидиве хронического лимфолейкоза.
Оценка эффективности лечения
Диагностические исследования, направленные на оценку эффекта от проведённого лечения, проводятся не ранее, чем через 2 месяца после окончания последнего курса химиотерапии. Результат может быть оценён следующим образом:
- Полная ремиссия: уменьшение до нормальных размеров печени, селезёнки, лимфоузлов (допустимо их увеличение в размере не более чем 1,5 см), снижение числа лимфоцитов менее 4×10 9 \л в периферической крови и менее 30% в костном мозге, повышение числа тромбоцитов более 100×10 9 \л, гемоглобина — более 110 г\л, нейтрофилов — более 1,54×10 9 \л.
- Частичная ремиссия: уменьшение размеров лимфоузлов, печени и селезёнки на 50% и более, снижение количества лимфоцитов в периферической крови на 50%, повышение числа тромбоцитов более 100×10 9 \л, гемоглобина — более 110 г\л, нейтрофилов — более 1,54×10 9 \л или же повышение любого из этих параметров более чем на 50% от исходного уровня.
- Признаками прогрессирования заболевания являются, напротив, увеличение размеров лимфоузлов, печени и селезёнки на 50% и более, а также уменьшение количества тромбоцитов на 50% и более от исходного уровня и уменьшение количества тромбоцитов на 20 г\л и более.
Для установления полной ремиссии необходимо соблюдение всех перечисленных критериев, частичной — по крайней мере 2 критерия, касающихся состояния внутренних органов, и минимум одного критерия, касающегося клеточного состава крови.
Следует учитывать, что терапия ибрутинибом может привести к полному ответу со стороны лимфатических узлов и селезёнки, но с сохранением лейкоцитоза в периферической крови. Это состояние обозначается, как частичный ответ с лимфоцитозом.
Прогноз
Значительные успехи в терапии хронического лимфолейкоза позволили сделать это заболевание потенциально излечимым или же достаточно долго поддерживать жизнь человека без прогрессирования основного заболевания с сохранением её качества.
Напротив, без лечения заболевание медленно, но неуклонно прогрессирует, что способно стать причиной гибели пациента спустя несколько лет после дебюта заболевания, поэтому своевременное обращение к врачу и начало адекватной терапии очень важны.
Читайте также:
