Глюкокортикоиды при глазных болезнях. Противопоказания к назначению глюкокортикоидов в офтальмологии
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Авторы: Николаенко В.П. 1, 2 , Белов Д.Ф. 3
1 ФГБОУ ВО СПбГУ, Санкт-Петербург, Россия
2 СПб ГБУЗ «ГМПБ No 2», Санкт-Петербург, Россия
3 СПб ГБУЗ «Городская многопрофильная больница № 2», Санкт-Петербург, Россия
Данный обзор литературы посвящен роли фиксированных комбинаций (ФК) антибактериальных препаратов (АБП) и глюкокортикоидов (ГК) в хирургии катаракты. Послеоперационное медикаментозное сопровождение факоэмульсификации (ФЭ) призвано решить две основные задачи: контроль воспаления и предотвращение инфекционных осложнений. В этой связи закономерно встает вопрос о роли ФК АБП и ГК, способных решить обе стоящие перед офтальмохирургом задачи, но при непременном соблюдении основополагающих принципов. На данный момент наиболее эффективным способом профилактики острого эндофтальмита является внутрикамерное введение антибиотика на заключительном этапе операции. Однако уже через 10 ч концентрация препарата снижается до уровня, не способного предотвратить контаминацию водянистой влаги бактериями. Поэтому топическое применение АБП (как в варианте монопрепарата, так и в составе ФК) оправдано вплоть до полной эпителизации хирургических разрезов, наступающей примерно через 1 нед. после ФЭ.
На основании анализа данных литературы предложен алгоритм послеоперационного сопровождения неосложненной ФЭ, заключающийся в 4-кратных инстилляциях комбинированного препарата 0,5% левофлоксацина и 0,1% дексаметазона в течение 1-й недели. При сохранении воспалительных явлений — гиперемии конъюнктивы и клеточной взвеси в передней камере рекомендуется переход на монотерапию дексаметазоном (с той же частотой применения) на протяжении 2-й недели, в дальнейшем — без постепенной отмены препарата.
Ключевые слова: факоэмульсификация, эндофтальмит, профилактика, воспаление, антибиотик, глюкокортикоид, дексаметазон, фиксированная комбинация, глазные капли, синдром отмены.
V.P. Nikolaenko 1,2 , D.F. Belov 1
1 City Multidisciplinary Hospital No. 2, St. Petersburg, Russian Federation
2 St. Petersburg State University, St. Petersburg, Russian Federation
This paper reviews the relevance of fixed-dose combinations (FDC) of antibiotics (AB) and steroids in cataract surgery. Postoperative pharmacotherapy of phacoemulsification addresses two main issues — reducing inflammation and preventing infectious complications. Therefore, the question arises about the role of FDCs of ABs and steroids addressing both issues but in compliance with baseline principles. The most effective measure to prevent acute endophthalmitis is an intracameral injection of antibiotics at the end of surgery. Meanwhile, as early as after 10 hours, drug concentration reduces to a level that fails to prevent aqueous humor contamination with bacteria. Therefore, topical ABs, either monotherapy or FDC, are reasonable up to complete healing of phaco incisions (approximately after one week).
The authors suggest a postoperative management algorithm after uneventful phaco involving topical administration of an FDC containing 0.5% levofloxacin and 0.1% dexametha sone QID at week 1. If inflammation (conjunctival redness and cells/flare) persists, switching to dexamethasone as monotherapy QID during week 2 (and withdrawal without tapering) is recommended.
Keywords: phacoemulsification, endophthalmitis, prevention, inflammation, antibiotic, steroid, dexamethasone, fixed-dose combination, eye drops, withdrawal syndrome.
Введение
Ведущей корректируемой причиной слепоты во всем мире является катаракта, распространенность которой неуклонно возрастает по мере увеличения численности и продолжительности жизни населения земного шара [1]. Факоэмульсификация (ФЭ) стала наиболее распространенным хирургическим вмешательством, что во многом обусловлено быстрой зрительной реабилитацией из-за минимального разреза, не требующего наложения швов [2, 3].
Однако любая, даже такая отработанная в технологическом отношении операция, как ФЭ, вызывает местную воспалительную реакцию, проявляющуюся гиперемией конъюнктивы, той или иной степенью вовлечения роговицы, а также ответом переднего отдела сосудистой оболочки глаза (опалесценцией камерной влаги и клеточной взвесью) [4, 5]. Кроме того, первые 7 сут после операции, требующиеся для эпителизации роговичного разреза, сопровождаются реальной угрозой контаминации водянистой влаги (ВВ) микроорганизмами [6, 7]. Таким образом, послеоперационное медикаментозное сопровождение хирургии катаракты призвано решить две основные задачи: контроль воспаления и предотвращение инфекционных осложнений.
В международных практических рекомендациях по ведению пациентов после ФЭ [4, 5, 8] основная роль в профилактике острого эндофтальмита (ОЭ) отводится предоперационному использованию антисептиков (повидон-йод) и внутрикамерному введению антибиотиков (ВВА) на заключительном этапе вмешательства. Произошедшее в последние годы в Европейском союзе кардинальное изменение алгоритмов профилактики инфекционных осложнений в хирургии катаракты поставило под сомнение целесообразность местного применения антибактериальных препаратов (АБП), попутно затронув проблему назначения и безопасной отмены топических глюкокортикоидов (ГК) у офтальмологических пациентов. В этой связи закономерно встает вопрос о роли фиксированных комбинаций (ФК) АБП и ГК, способных решить обе стоящие перед офтальмохирургом задачи, но при непременном соблюдении основополагающих принципов. Данный обзор преследует цель определить алгоритм рационального применения ФК в современной хирургии катаракты.
Антибиотикопрофилактика внутриглазной инфекции
Острый эндофтальмит (ОЭ) является наиболее тяжелым осложнением офтальмологических операций, поскольку способен вызывать выраженное и необратимое снижение остроты зрения [9]. Факторами риска возникновения ОЭ являются роговичный разрез [10], наружная фильтрация [6], разрыв задней капсулы, потребовавший выполнения передней витрэктомии [11], имплантация интраокулярной линзы из силикона [12].
Исследование ESCRS [8] наглядно продемонстрировало эффективность профилактического внутрикамерного введения цефуроксима, снизившего частоту ОЭ с 0,226% до 0,050%, а в сочетании с предоперационной аппликацией повидон-йода и инстилляцией 0,5% левофлоксацина до и после ФЭ — до 0,025%.
Однако однократное ВВА не может поддерживать стерильность камерной влаги на протяжении всего периода эпителизации роговичного разреза. Установлено, что концентрация цефуроксима в ВВ снижается до бесконечно малой (приблизительно 0,0027 мг/л) уже через 10 ч после вмешательства, что существенно ниже минимальной подавляющей концентрации (МПК) для любого микроорганизма [13]. Таким образом, антибактериальный эффект ВВА цефуроксима исчезает в течение 1-х суток после операции. Как следствие, избежать контаминации ВВ в последующие 7 дней можно либо путем безукоризненного соблюдения пациентами рекомендаций, предотвращающих наружную фильтрацию (что не всегда осуществимо [14]), либо назначать после ФЭ топическую антибиотикотерапию [15].
Поскольку несвоевременно начатое и/или неадекватное лечение ОЭ приводит к катастрофическим последствиям, крайне важно использовать наиболее эффективный АБП [14], обеспечивающий значительно превышающую МПК концентрацию в конъюнктивальной полости и передней камере на протяжении недели, требующейся для эпителизации роговичного разреза [6, 16]. К сожалению, оптимальный и рекомендуемый европейскими экспертами по местной послеоперационной профилактике эндофтальмита (EUREQUE) [14] антибиотик для предупреждения внутриглазной инфекции до сих пор не определен.
В повседневной офтальмологической практике нередко используются аминогликозиды, но они обладают меньшей способностью проникать через строму роговицы [17, 18], а также имеют более узкий антибактериальный спектр по сравнению с фторхинолонами [19]. В исследованиях H.M. de Kaspar et al. [20] и F.A. Bucci Jr. [21] представитель именно класса фторхинолонов — левофлоксацин 0,5% (Офтаквикс ® ) выступил эталонным топическим АБП, так как эффективно подавлял рост патогенной флоры в конъюнктивальной полости, а также достигал в ткани роговицы и ВВ адекватной концентрации для предотвращения роста входящих в нормальную биоту слизистой оболочки, но представляющих опасность при попадании в полость глаза микроорганизмов.
Особенности применения фиксированных комбинаций
Контроль воспаления является второй основной задачей послеоперационного лечения, наиболее эффективным способом решения которой служит применение топических ГК — в частности, дексаметазона с его мощным противовоспалительным потенциалом [22]. Фиксированные комбинации дексаметазона и АБП могут стать действенным инструментом повышения комплаентности, особенно среди пожилых пациентов [14, 23]. Однако рациональные алгоритмы использования ФК АБП и ГК до сих пор не выработаны, многие офтальмологи удлиняют лечение до 2 нед. и более, нередко с постепенным уменьшением частоты инстилляций комбинированного лекарственного средства. Однако применение местного АБП после эпителизации роговичного тоннеля не имеет убедительного обоснования, а постепенное снижение дозы антибиотика не только бессмысленно, но и способствует развитию бактериальной резистентности [24, 25].
Выработке оптимальной схемы ведения пациентов после ФЭ было посвящено многоцентровое рандомизированное слепое клиническое исследование LEADER7 [26]. Оценивалась эффективность двух алгоритмов противовоспалительного лечения — 4-кратных инстилляций ФК 0,5% левофлоксацина и 0,1% дексаметазона в течение 1-й недели с переходом на монотерапию дексаметазоном на протяжении 2-й недели, а также 14-дневного использования ФК 0,3% тобрамицина и 0,1% дексаметазона с той же (4 р/сут) частотой инстилляций. Оба алгоритма продемонстрировали одинаковый профиль активности — исчезновение клеточной взвеси и опалесценции влаги у 85% пациентов, конъюнктивальной инъекции — у 90% пациентов после 7 сут лечения.
Предложенные в рамках клинического исследования схемы фармакологического сопровождения ФЭ закономерно поднимают вопрос о незыблемости принципа постепенного уменьшения частоты инстилляций ГК во избежание синдрома отмены. В понимании патофизиологов и фармакологов синдром отмены — это надпочечниковая недостаточность, возникающая по механизму обратной связи при системном приеме ГК [27]. Но клиницисты обычно подразумевают под синдромом отмены возвращение или усугубление тех симптомов и клинических признаков, на устранение которых была направлена глюкокортикостероидная терапия.
В офтальмологии длительное (на протяжении недель и месяцев) применение ГК входит в схемы лечения герпетического стромального кератита и макулярного отека на фоне хронического увеита, также гормональные препараты составляют основу алгоритмов поддержания фильтрации после синустрабекулэктомии и сохранения прозрачности трансплантата роговицы [28]. Во всех перечисленных выше случаях залогом успеха терапии является постепенное, иногда очень медленное, уменьшение дозировки дексаметазона, тогда как его ранняя отмена чревата обострением процесса [28–30].
Однако результаты исследования LEADER7 [26] наглядно продемонстрировали, что лечение, направленное на подавление, как правило, минимальной воспалительной реакции после неосложненной ФЭ, не требует соблюдения подобных мер. Учитывая результаты данного исследования [26] вкупе с преимуществами фторхинолоновых АБП III и IV поколения (более высокая биодоступность, расширенный по сравнению с аминогликозидами спектр активности, меньший риск развития антибиотикорезистентности) [17, 18, 31, 32], представляется целесообразным внедрение в повседневную клиническую практику следующей схемы ведения пациентов после неосложненной ФЭ:
В течение 1-й недели после операции (до эпителизации наружного края роговичного разреза) использовать ФК АБП и ГК.
В рамках очередного контрольного осмотра через 7 дней после ФЭ оценить состояние переднего отдела глаза.
При наличии клеточной взвеси и опалесценции камерной влаги продолжить лечение еще на протяжении 1 нед., но в виде инстилляций 0,1% дексаметазона 4 р/сут [26].
Заключение
Таким образом, с учетом широкого применения ФЭ вопрос профилактики послеоперационных осложнений является крайне актуальным. Применение ФК АБП и ГК для купирования воспаления после неосложненной ФЭ обладает рядом преимуществ перед комбинированным лечением теми же препаратами, что в свое время было более чем наглядно продемонстрировано на примере пациентов с глаукомой. Среди преимуществ ФК — уменьшение количества используемых флаконов и минимизация неудобств, связанных с многократными инстилляциями нескольких препаратов, что повышает приверженность лечению [33, 34]. Помимо улучшения комплаентности, ФК обеспечивают правильность дозировки и лучшую переносимость используемого препарата, также за счет уменьшения воздействия консервантов нивелируют эффект «вымывания» лекарства [28, 35].
Благодарность
Авторы и редакция благодарят ООО «Сантэн» за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Acknowledgements
The authors and Editorial Board are grateful to Santen LLC for providing full-text foreign articles required to write the review.
Сведения об авторах:
1 Белов Дмитрий Федорович — врач-офтальмолог; ORCID iD 0000-0003-0776-4065.
1 СПб ГБУЗ ГМПБ № 2. 194354, Россия, г. Санкт-Петербург, пер. Учебный, д. 5.
2 ФГБОУ ВО СПбГУ. 199034, Россия, г. Санкт-Петербург, наб. Университетская, д. 7/9.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.12.2021.
About the authors:
1 Dmitrii F. Belov — ophthalmologist; ORCID iD 0000-0003-0776-4065.
1 City Multidisciplinary Hospital No. 2, 5, Uchebnyy lane, St. Petersburg, 194354, Russian Federation.
2 St. Petersburg State University, 7/9, Universitetskaya emb., St. Petersburg, 199106, Russian Federation.
There is no conflict of interests.
Received 07.12.2021.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Глюкокортикостероиды в терапии воспалительных заболеваний глаз
Для цитирования: Ставицкая Т.В. Глюкокортикостероиды в терапии воспалительных заболеваний глаз. Клиническая офтальмология. 2000;1(4):120.
Воспалительные заболевания глаз являются серьезной медико-социальной проблемой практической офтальмологии, так как воспаление приводит к опасным, подчас необратимым изменениям тканей глаза. Первое место в терапии воспалительных заболеваний глаз занимают глюкокортикостероиды (ГКС). ГКС образуются из холестерина в корковом веществе надпочечников. Механизм действия стероидных гормонов сводится к регулированию активности некоторых генов. ГКС проникают внутрь клетки-мишени, в цитоплазме взаимодействуют со специфическим белковым рецептором и проникают в ядро клетки, где соединяются с участком ДНК. Их эффект развивается медленно, в течение нескольких часов, поскольку он является следствием синтеза новых РНК и новых функциональных белков, в частности, микрокортина, который тормозит активность фосфолипазы А2 и благодаря этому уменьшается образование из фосфолипидов арахидоновой кислоты – предшественника простагландинов и лейкотриенов. Противовоспалительный и противоаллергический эффекты ГКС связаны также с торможением миграции и выделения тучными клетками различных медиаторов воспаления (гиалуронидазы, гистамина и т.д.). В отличие от других противовоспалительных средств, у ГКС наиболее четко выражено антипролиферативное действие: ГКС угнетают пролиферацию фибробластов и синтез ими коллагена.
Иммуносупрессивное действие ГКС обусловлено избирательным торможением функции и развития иммунокомпетентных лимфоидных клеток, а не неспецифическим цитостатическим действием, которое свойственно другим иммунодепрессантам. Под их влиянием происходит уменьшение размеров лимфоидных органов, разрушение средних и малых лимфоцитов тимуса, угнетение антителообразования и образования иммунных комплексов.
Таким образом, ГКС обладают несколькими эффектами:
• стабилизируют клеточные мембраны тучных клеток
• уменьшают проницаемость капилляров, оказывают антиэкссудативный эффект
• стабилизируют мембраны лизосом
• обладают антипролиферативным и иммунодепресивным действием
• ингибируют экспрессию генов, кодирующих синтез белков, участвующих в развитии воспаления.
История открытия лечебного эффекта ГКС началась в 1929 г., когда Хенч обратил внимание на улучшение течения ревматоидного артрита в период заболевания желтухой. В 1948 г. был получен продукт метаболизма природного глюкокортикостероида кортизола – кортизон и начато применение ГКС.
Синтетические аналоги природных ГКС, содержащие фтор и метильную группу, более активны в связи с тем, что они медленнее метаболизируются в организме. Кроме того, они не вызывают задержку ионов натрия и воды в тканях (не оказывают минералкортикоидного действия). Сравнительная характеристика ГКС представлена в табл. 1.
Лекарственные формы, используемые в офтальмологии, содержат практически все группы ГКС:
1. ГКС короткого действия (6–8 ч) – гидрокортизона 0,5% глазная мазь (“Гидрокортизон”); 1 и 2,5% глазная мазь (“Гидрокортизон ПОС№1” и “Гидрокортизон ПОС№2,5”).
2. ГКС средней продолжительности действия (12–36 ч) – преднизолона 0,5% глазная суспензия (“Преднизолон”) и 1% глазные капли (“Инфранефран форте”).
3. ГКС длительного действия (до 72 ч) – дексаметазона 0,1% глазные капли (“Дексапос”) и 0,1% глазная мазь (“Максидекс”); бетаметазон 0,1% глазные капли (“Бетакортал”) и 0,1% глазная мазь (“Бетамофталь”).
Показания к использованию ГКС в офтальмологии довольно широки:
• аллергические заболевания глаз (дерматиты век, блефариты, конъюнктивиты и кератоконъюнктивиты)
• увеиты
• симпатическая офтальмия
• профилактика и лечение воспалительных явлений после травм и операций
• восстановление прозрачности роговицы и подавление неоваскуляризации после перенесенных кератитов, химических и термических ожогов (после полной эпителизации роговицы).
Однако подходы к использованию различных лекарственных форм зависят от выраженности противовоспалительного действия и всасываемости ГКС, входящего в состав препарата.
Например, гидрокортизон плохо проникает через роговицу во внутриглазную жидкость, и поэтому он используется для лечения аллергических и воспалительных заболеваний век и конъюнктивы. Кроме того, противовоспалительная активность гидрокортизона значительно ниже по сравнению с другими ГКС, поэтому наиболее целесообразно использование препаратов, содержащих более высокие концентрации гидрокортизона (Гидрокортизон ПОС №1% и Гидрокортизон ПОС№2,5% глазные мази). Следует отметить, что эта глазная мазь имеет мелкодисперсную структуру, поэтому лучше переносится больными при закладывании ее в нижний конъюнктивальный свод.
Наиболее широко в офтальмологии используют ГКС длительного действия, обладающие высокой эффективностью и хорошо проникающие в ткани глаза – дексаметазон и бетаметазон. Дексаметазон используется в виде глазной суспензии (“Дексаметазон”) или глазных капель (раствор – “Офтан-дексаметазон”). При выборе лекарственной формы дексаметазона следует учитывать, что продолжительность их действия одинакова, но суспензия раздражает ткани глаза и хуже переносится больными.
Более длительным противовоспалительным действием обладают растворы дексаметазона, содержащие гидроксиметилцеллюлозу (“Дексапос” 0,1% глазные капли) и мазевые формы дексаметазона (“Максидекс” 0,1% глазная мазь). При их назначении необходимо учитывать, что раствор лучше переносится больными, не вызывает затуманивания зрения и его использование предпочтительнее в раннем послеоперационном периоде.
Для профилактики и лечения воспалительных осложнений после травм и операций в практической офтальмологии широкое использование получили комбинированные лекарственные средства, содержащие глюкокортикостероид и антибиотик. Одним из препаратов данной группы является “Дексагентамицин” (глазные капли и мазь). Данный препарат содержит один из наиболее активных ГКС – дексаметазон. Вторым составляющим препарата “Дексагентамицин” является антибиотик гентамицин. Гентамицин - аминогликозид II поколения, обладающий широком спектром противомикробного действия. В зависимости от выраженности воспалительного процесса частота применения препарата может быть различной. В случае тяжелого воспаления возможно применение препарата каждые 1–2 часа. По мере уменьшения выраженности воспаления частота инстилляций снижается до 3–4 раз в день.
При использовании комбинированных препаратов необходимо помнить о возможности развития побочных эффектов, связанных с использованием как ГКС, так и антибактериального средства. Терапия ГКС может привести к повышению внутриглазного давления с последующим развитием глаукомы, помутнению хрусталика, замедлению заживления ран и развитию вторичной, в том числе и грибковой, инфекции. Длительное использование антибиотиков вызывает развитие резистентной по отношению к данному антибиотику флоры и приводит к неэффективности дальнейшей терапии.
В заключение следует отметить, что применение глюкокортикостероидных препаратов позволяет активно подавлять воспалительную реакцию в тканях глаза, и тем самым предотвращает развитие тяжелых осложнений, которые могут привести к инвалидизации больных. Клинический эффект глюкокортикостероидных средств зависит от противовоспалительной активности, продолжительности действия и всасываемости препарата. Их длительное применение может привести к серьезным побочным эффектам.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Стероидные мази в современной офтальмологической практике
Для цитирования: Лоскутов И.А. Стероидные мази в современной офтальмологической практике. РМЖ. 1999;7:14.
Принято считать, что впервые о противовоспалительном действии глюкокортикоидных гормонов (в частности, кортизона) сообщил P. Hench и соавт. [1], применивший препарат у больных ревматоидным артритом. С тех пор стероидные гормоны получили широчайшее распространение как мощные противовоспалительные средства. Глюкокортикоиды представляют собой адренокортикоидные стероидные гормоны. В практической врачебной деятельности могут быть использованы как естественно встречающиеся гормоны (например, гидрокортизон), так и синтетические аналоги (например, дексаметазон).
Классические признаки воспаления - краснота, отек, повышение температуры, боль и потеря функции - определяются изменениями сосудистой проницаемости, инфильтрацией тканей лейкоцитами. В процесс вовлекаются сразу несколько типов клеток, доказано принципиальное значение ряда специфических медиаторов воспаления. Глюкокортикоиды реализуют свое противовоспалительное действие сразу несколькими путями. Они способны подавлять образование и в некоторой степени активность медиаторов воспаления, миграцию лейкоцитов, а также функционирование иммунокомпетентных клеток в области воспаления.
Назначение стероидных глазных мазей, как и стероидных мазей вообще, имеет вполне четкие основания. Так, с одной стороны, включение любого лекарственного препарата в мазевую основу эффективно обеспечивает постепенное и длительное высвобождение действующего начала, сохранение средства на поверхности. С другой стороны, очевидны и недостатки мазевых препаратов, особенно в офтальмологической практике, выражающиеся, например, в меньшем удобстве использования.
Показания к назначению стероидных мазей определяются следующим образом. Препараты доказано эффективны при воспалительных поражениях конъюнктивы век и глазного яблока, роговицы. Используют их и при воспалительном поражении переднего отрезка глазного яблока, например, при аллергическом конъюнктивите, acne rosacea, поверхностном точечном кератите, ирите, иридоциклите, поражениях роговицы при химических или термических ожогах.
Проблема использования стероидных мазей при инфекционных конъюнктивитах остается в известной мере открытой. Так, если риск утяжеления состояния глазного яблока вследствие, например, резкого отека, очевиден, то при некоторых инфекционных поражениях конъюнктивы использование стероидных мазей показано.
Отдельно стоит вопрос о назначении стероидных мазей после проведения хирургических вмешательств на глазном яблоке и его придатках. После целого ряда вмешательств целесообразно назначение стероидных препаратов, в том числе и в виде мазей.
Под воздействием различных факторов возможно развитие новообразованных сосудов в ткани роговицы. Процесс неоваскуляризации может быть весьма интенсивным и создать серьезную угрозу зрению. Стероидные препараты обладают способностью выступать в роли весьма эффективных ингибиторов сосудистой пролиферации [2].
К сожалению, нельзя не остановиться и на тех состояниях, при которых назначение стероидных мазей противопоказано. Это, в первую очередь, эпителиальный древовидный кератит, острая инфекционная стадия практически всех вирусных заболеваний роговицы и конъюнктивы, а также грибковое поражение тканей глаза.
Всегда следует помнить о том, что длительное применение стероидных мазей, как и стероидных препаратов вообще, подавляет местный иммунный ответ. Это может привести к присоединению вторичной инфекции. Еще одна опасность длительного применения стероидных мазей состоит в возможности развития вторичной глазной гипертензии или так называемой стероидной глаукомы. Такая глаукома при отсутствии компенсации внутриглазного давления приводит к появлению дефектов в поле зрения и атрофии зрительного нерва. Поэтому при необходимости длительного применения стероидных мазей необходим контроль уровня внутриглазного давления по крайней мере 1 раз в 2 нед независимо от того, взрослый это человек или ребенок. Следует быть особенно осторожным при назначении стероидных препаратов при состояниях, сопровождающихся истончением ткани роговицы, так как стероиды могут вызвать перфорацию. Описано развитие заднекапсулярных катаракт после длительного назначения стероидов.
Итак, рассмотрим некоторые состояния, при которых использование, например, наиболее распространенной глазной мази гидрокортизона 0,5% представляется целесообразным.
Весьма распространенным патологическим состоянием является блефарит - воспаление краев век, вызванное дисфункцией мейбомиевых желез, поражением краев век паразитом Demodex folliculorm и рядом других причин. В зависимости от причинного фактора проводят основную терапию, но для более эффективного купирования таких неприятных симптомов, как отек и гиперемия краев век, чувство жжения и зуд, эффективным является назначение 0,5% гидрокортизоновой мази [3, 4, 5].
У пациентов с атопическим дерматитом или экземой часто диагностируется атопический кератоконъюнктивит. Симптоматика складывается из чувства жжения, появления слизистого отделяемого, гиперемии конъюнктивы и светобоязни. Мелкие сосочки на конъюнктиве отличаются от таковых при весеннем конъюнктивите прежде всего размерами, а также местом расположения. Так, сосочки при атопическом конъюнктивите мельче и располагаются чаще на конъюнктиве нижнего века. Возможно развитие поверхностного периферического кератита с последующей неоваскуляризацией. Короткий курс закладывания гидрокортизоновой мази облегчает клиническую симптоматику [6, 7].
У светлокожих людей с acne rosacea возможно развитие глазных осложнений в виде блефароконъюнктивита. Иногда поражается роговица. Появляются умеренная инъекция глазного яблока, серые узелки на бульбарной конъюнктиве вблизи лимба, которые могут изъязвляться.
Периферическая роговица также может изъязвляться с развитием неоваскуляризации. Заболевание носит хронический характер с частыми рецидивами.
Воспалительное поражение эписклеры развивается, как правило, только на одном глазу. Этиология эписклеритов остается невыясненной, хотя правомерно ассоциировать развитие данного заболевания с такими системными заболеваниями, как ревматоидный артрит, туберкулез. Возможно развитие эписклерита при синдроме Шегрена [8].
Симптомами эписклерита являются гиперемия, боль, светобоязнь, слезотечение. При осмотре выявляется локальная гиперемия, инфильтрация, отек эписклеры, прилежащей конъюнктивы. Как правило, заболевание протекает благоприятно, хотя возможно развитие рецидивов.
Гораздо более опасно появление склерита - гранулематозного поражения белочной оболочки глаза с развитием деструкции коллагена, клеточной инфильтрацией и сосудистыми изменениями. В таких случаях местное использование стероидных мазей целесообразно, но только как дополнение к системному назначению кортикостероидных средств.
Важной проблемой в офтальмологии была и остается проблема лечения увеитов. По расположению пораженной увеальной ткани выделяют, в частности, передние увеиты или иридоциклиты. В зависимости от тяжести поражения заболевание характеризуется болевым синдромом, светобоязнью и снижением зрения. Появляется отек и гиперемия радужной оболочки, клеточная реакция во влаге передней камеры, преципитаты на эндотелии роговицы. Наряду с мидриатиками практически во всех случаях иридоциклитов требуется назначение стероидных капель или мазей.
Одной из форм поражения увеальной ткани являются так называемые хронические циклиты или парс-планиты. В этом случае воспаление охватывает зону условной границы передней и задней части увеальной ткани. Чаще всего заболевание возникает у лиц молодого возраста с жалобами на наличие плавающих точек в поле зрения. В большинстве случаев поражаются оба глаза. Типично отсутствие жалоб на боли, светобоязнь, покраснение глаз. Пациент может и не догадываться о наличии воспалительного поражения в глазу. Патологию может выявить лишь специалист при детальном осмотре периферии глазного дна.
Стероидные мази могут быть назначены на первом этапе терапии. В легких случаях этого может быть достаточно, хотя, как правило, более эффективными оказываются инъекции стероидных препаратов местно [9].
Таким образом, очевидно, что спектр эффективного применения глазных стероидных мазей, в частности, 0,5% мази гидрокортизона, весьма широк.
1. Hench PS, Kendall EC, Slocumb CH, Polley HS. Effect of hormone of adrenal cortex on rheumatoid arthritis. Preliminary report. Mayo Clinic Proc. 1949;24:181-97.
2. Leopold I. Nonsteroidal and steroidal anti-inflammatory agents. In Surgical Pharmacology of the Eye. 1985;83-133.
3. Shimazaki J, Goto E, Masafumi O, et al Meibomian gland disfunction in patients with Sjogrens Syndrome. Ophthalmology 1998;105 (8):1485-8.
4. Loskoutov IA. Metronidazole treatment for ocular demodicosis. European Journal of Ophthalmology. 1995; (Suppl, 5) N 2a:247.
5. Ильин И.И., Лоскутов И.А., Локтина В.И. Глазные проявления демодикоза. Вестник дерматол. и венерол. 1992;2:50-2.
6. Gareis O, Lang G. Allergic diseases of the lid, conjunctiva and cornea. Current Opinion in Ophthalmology 1993;4 (4):34-40.
7. Leonardi A, Borghesan F, Avarello A. et al. Effect of lodoxamide and disodium cromglycate on tear eosinophil cationic protein in vernal keratoconjunctivitis. Br J Ophthalmology 1997;81:23-6.
8. Лоскутов И.А., Павлова М.Л., Симонова М.В. Диагностика и лечение болезни Шегрена. Глаз 1988;4:30-2.
9. Chatzistefanou K, Markomichelakis N, Christensen W, et al. Characteristics of uveitis presenting for the first time in the elderly. Ophthalmology 1998;105 (2):347-52.
Глюкокортикоиды при глазных болезнях. Противопоказания к назначению глюкокортикоидов в офтальмологии
Лечение окклюзии вен сетчатки. Применение глюкокортикоидов
В определении точных патогенетических механизмов окклюзии центральной вены сетчатки (ОЦВС) за последние два десятилетия был достигнут очень незначительный прогресс; спорной до сих пор является роль артериальной компрессии центральной вены сетчатки, а также тромбоза. Менее противоречивыми являются представления о патогенезе окклюзии ветвей центральной вены сетчатки (ОВЦВС); роль в ее развитии пережатия сосуда артериальной ветвью является общепризнанной, но роль тромбоза остается неясной.
Хотя многие врачи при обследовании пациентов проводят целый комплекс лабораторных исследований, результатами метаанализа связь с окклюзией вен сетчатки (ОВС) была подтверждена только для гомоцистеина и антикардиолипиновых антител. Артериальная гипертензия, атеросклеротические сердечно-сосудистые заболевания и факторы риска их развития также являются факторами риска развития окклюзии вен сетчатки (ОВС). Терапия системных заболеваний не приводит к излечению окклюзии вен сетчатки (ОВС), хотя роль их профилактики для предотвращения развития окклюзии вен сетчатки (ОВС) несомненна.
Системное применение антикоагулянтов не предотвращает возникновение окклюзии вен сетчатки (ОВС); многие пациенты с окклюзией вен сетчатки (ОВС) получали адекватную антикоагулянтную терапию. В настоящее время нет результатов рандомизированных клинических исследований, подтверждающих эффективность лечения окклюзии вен сетчатки (ОВС) с помощью системного приема антикоагулянтов.
Ранее для лечения окклюзии вен сетчатки (ОВС) использовали йодид калия и пилокарпин (местно), антигиперлипидемические препараты, антикоагулянты, фибринолитические и гиперосмотические препараты, ингаляции карбогена (95% кислорода и 5% СО2), а также изоволемическую гемодилюцию. Данная схема лечения демонстрировала незначительную эффективность, и поэтому от нее отказались.
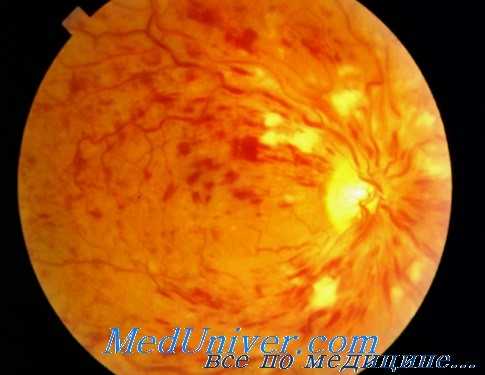
Эра современной фармакотерапии окклюзии вен сетчатки (ОВС) началась в 1990-х годах с момента внедрения в клиническую практику интравитреального введения триамцинолона ацетонида (Кеналог, «Bristol Myers Squibb») для лечения макулярного отека. На фоне его применения многими врачами было отмечено заметное уменьшение толщины сетчатки по данным ОКТ и в то же время небольшое увеличение остроты зрения с максимальной коррекцией, по-видимому, из-за индуцированной ишемией сетчатки гибели нейронов и необратимых изменений в ма-кулярной зоне. До широкого использования интравитреального введения триамцинолона ацетонида считалось, что возникновение стероидной глаукомы происходит примерно в 6% случаев, и обозначалось как стероидный ответ.
Данная точка зрения была основана на исследованиях, в ходе которых применяли местно 1,0% преднизолона ацетат. Возникновение стероидной глаукомы после интравитреального введения триамцинолона ацетонида было отмечено примерно в 30% случаев, к сожалению, эффективность препарата прямо пропорциональна частоте развития побочных эффектов в виде стероидной глаукомы и катаракты. До начала использования интравитреального введения триамцинолона ацетонида считалось, что стероидная глаукома обратима и разрешается после отмены препарата, однако у многих пациентов возникала перманентная глаукома. Стероидная катаракта после интравитреального введения триамцинолона ацетонида возникает не менее чем в 50% случаев.
Дексаметазон (Декадрон) может быть использован для лечения макулярного отека, вызванного ОВС, но он имеет очень короткую продолжительность действия, так как период его полувыведения равен примерно 4 ч. Кратковременность действия снижает риск развития стероидной катаракты и глаукомы, однако единственным потенциальным преимуществом использования препарата является уменьшение толщины сетчатки за несколько дней до проведения ее лазерной коагуляции. Имплантат с постоянным высвобождением дексаметазона (Ozurdex, «Allergan») недавно был выведен на рынок лекарственных веществ в США.
Продолжительность его действия больше, чем у препаратов триамцинолона ацетонида, вводимых интравитреально, при его однократном применении происходит статистически значимое повышение остроты зрения с максимальной коррекцией в течение 90 дней после лечения. Kuppermann и соавт. при исследованиях эффектов на нервные клетки сетчатки человека, глиальные клетки и клетки ПЭС в тканевой культуре показали, что дексаметазон менее токсичен, чем триамцинолона ацетонид (даже препараты, не содержащие консервантов).
Интравитреальное применение имплантата с постоянным высвобождением флуоцинолона ацетонида в дозе 0,59 мг (Retisert, «Bausch & Lomb», США) одобрено FDA для лечения задних увеитов, а также используется некоторыми хирургами для лечения макулярного отека. К сожалению, Retisert в 90% случаев приводит к возникновению глаукомы и по крайней мере в 30% случаев пациентам в конечном итоге требуется антиглаукомная операция. Такой уровень побочных эффектов делает недопустимым его использование для лечения макулярного отека, возникающего при окклюзии вен сетчатки (ОВС).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Преднизолон, дексаметазон в лечении эндокринной офтальмопатии
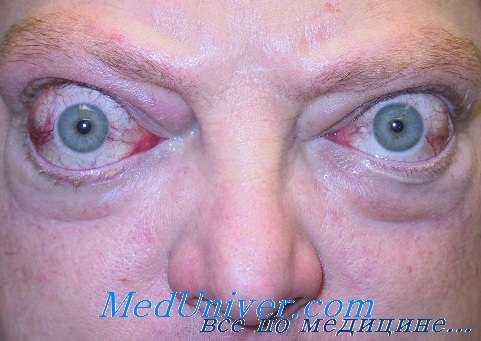
Преднизолон впервые использовали в 1963 г. J. Brown и соавт. при тяжелой (инфильтративной) форме эндокринной офтальмопатии у 19 больных. Через 24 48 ч после начала лечения исчезли хемоз и гиперемия конъюнктивы, через неделю увеличился объем движений глаз, уменьшился экзофтальм. Поскольку преднизолои обладает большей глюкокортикоидной и умеренно выраженной минералокортикоидной активностью, его, как правило, назначают для длительного пероралыюго лечения.
Несмотря на появление новых поколений глюкокортикостероидов, преднизолои и в настоящее время продолжает широко применяться при лечении эндокринной офтальмопатии. Доза глюкокортикоидов вариабельна и зависит от индивидуальных особенностей организма. Лечение начинают с больших суточных доз (45-90 мг), далее дневную дозу уменьшающие 5 мг в день в течение 4 нед.
Сложилось мнение, что, если глюкокортикоиды назначают впервые и в стадии субкомпенсации, доза может быть умеренная (40-45 мг в сутки). Во время повторного курса в случае рецидива или при резкой декомпенсации процесса ее следует увеличивать. Суточную дозу делят па равные порции, предпочтительнее, чтобы больной принимал ее в первую половину дня. Общую дозу рассчитывают таким образом, чтобы больной получил не более 1100-1300 мг на весь курс, который длится от 5 до 7 нед.
Уменьшение суточной дозы следует начинать с отмены приема вечером, если она рассчитана на весь день, или с последней дневной части, т. к. прием препарата в вечерние часы угнетает увеличивающуюся ночью секрецию адреиокортикотропного гормона, которая максимальна утром и препятствует развитию недостаточности или атрофии коры надпочечников, индуцируемых глюкокортикоидами. Для профилактики синдрома отмены после длительного курса последние 5-6 дней больной должен принимать 5-2,5 мг препарата в день.
Следует иметь в виду, что при приеме внутрь 20% преднизолона выводится из организма в неизмененном виде, а период его полураспада составляет 3,5 ч. Преднизолон быстро всасывается из желудочно-кишечного тракта, максимальная концентрация его достигается через 1-1,5 ч при 80% абсорбции, а биодоступность не зависит от приема пищи. Поэтому совершенно неоправданно стремление некоторых врачей назначать преднизолон по возрастающей, начиная с малых доз, или использовать интермиттирующий курс лечения.
По мнению L. Bartalena и соавт., появление рецидивов заболевания можно объяснить лечением эндокринной офтальмопатии первоначально низкими дозами глюкокортикоидов. При назначении глюкокортикоидной терапии следует руководствоваться правилом: сроки применения препаратов, их дозировка определяются быстротой получения терапевтического эффекта. При отсутствии терапевтического эффекта в течение первых 3 сут дальнейшее использование глюкокортикоидной терапии бесперспективно.
Эффективность лечения кортикостероидами зависит от стадии болезни. В стадии клеточной инфильтрации при отечном экзофтальме мы практически всегда отмечали положительный результат. При переходе процесса в стадию фибротизации эффективность лечения значительно снижается. Что касается больных с эндокринными миопатиями, то врачу редко удастся обнаружить заболевание в стадии клеточной инфильтрации, т. к. она длится не более 4 мес.
Как известно, одна из тяжелейших форм отечного экзофтальма — сочетание протрузии глаза с оптической нейропатией. В подобных случаях эффективны ретробульбарные инъекции раствора дексазона и одновременный пероральный прием препарата. Подобная комбинация позволяет уменьшить суточную дозу и сократить курс лечения.
Кроме того, расширяются показания к использованию глюкокортикоидов у больных, страдавших в прошлом язвенной болезнью желудочно-кишечного тракта или имевших склонность к повышению артериального давления. Однако, консультируя больных из других лечебных учреждений, мы убедились, что врачи иногда чрезмерно увлекаются ретробульбарными инъекциями раствора дексазона, часто не получая положительного эффекта. Необходимо еще раз подчеркнуть, что ретробульбарные инъекции дексазона результативнее в ранней стадия болезни, когда налицо все признаки отечного экзофтальма, особенно если в процесс вовлечен зрительный нерв.
Однако парентеральное введение глюкокортикоидов характеризуется более кратковременным действием, чем при приеме внутрь. Кроме того, в стадии фиброза или эндокринной миопатии ретробульбарные инъекции дексаметазона не дают желаемого результата.
Дексаметазон привлек внимание своей большей терапевтической активностью (0,75 мг дексаметазона соответствуют 5 мг преднизолона), минимальной способностью задерживать натрия хлорид и воду. При приеме внутрь суточная и курсовая дозы дексаметазона значительно уменьшаются, т. к. противовоспалительная активность его в 6,25 раза выше преднизолона, а эквивалентная доза в миллиграммах - в 6,7 раза. При резкой декомпенсации процесса с угрозой утраты зрительных функций можно рекомендовать прием дексаметазона по 4 мг каждые 6-8 ч в течение 3-4 сут или назначать пульс-терапию.
Целестон (бетамстазон) — новое поколение глюкокортикоидов - обладает большей противовоспалительной активностью, чем дексаметазон. Для парентерального введения используется в последнее десятилетие. Ретробульбарно можно вводить ежедневно в количестве 1 мл, на курс 5-6 инъекций.
Читайте также:
