Диагностические проблемы кариотипирования плода. Маркерные хромосомы. Мозаицизм хромосом.
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
НИИ охраны материнства и младенчества, Екатеринбург
Цитогенетические нарушения у эмбриона при неразвивающейся беременности
Журнал: Российский вестник акушера-гинеколога. 2013;13(4): 18‑21
Башмакова Н.В., Третьякова Т.Б., Демченко Н.С. Цитогенетические нарушения у эмбриона при неразвивающейся беременности. Российский вестник акушера-гинеколога. 2013;13(4):18‑21.
Bashmakova NV, Tret'iakova TB, Demchenko NS. Cytogenetic disorders in embryos during non-developing pregnancy. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(4):18‑21. (In Russ.).
С целью изучения частоты и структуры хромосомной патологии был исследован 71 образец эмбриональных тканей у женщин с неразвивающейся беременностью I триместра. Ворсины хориона, полученные из абортного материала, были подвергнуты цитогенетическому анализу для определения кариотипа плода. В результате были обнаружены все типы хромосомных нарушений: трисомии, моносомии, триплоидия, мозаичные кариотипы. Наиболее распространенной аномалией кариотипа абортусов были трисомии - 71% случаев. Чаще всего встречались трисомии 21-й и 160-й хромосом. Интересной особенностью полученных результатов является высокая частота мозаичных форм хромосомных нарушений, которые составили 34% от числа аномальных кариотипов.
Проблема невынашивания беременности продолжает оставаться актуальной и социально значимой в практике акушера-гинеколога. Самопроизвольные аборты составляют 15-20% от всех желанных беременностей. Среди различных форм невынашивания беременности особое место занимает несостоявшийся аборт (неразвивающаяся беременность) - гибель эмбриона в раннем сроке беременности с длительной задержкой в полости матки. В структуре репродуктивных потерь число случаев неразвивающейся беременности составляет 10-20%. Причины неразвивающейся беременности многочисленны и нередко комплексны [3]. Особую роль в этиологии невынашивания беременности играет хромосомный дисбаланс. Так, в 6-7 нед беременности 60-75% абортусов имеют аномальный кариотип, в 12-17 нед - 15-20%, и в 17-28 нед - только 2-7% [14].
Таким образом, если около 50% эмбрионов I триместра беременности погибают вследствие естественного отбора зачатий с аномальным кариотипом, то причина гибели других эмбрионов имеет мультифакториальную природу, т.е. является результатом аддитивного действия многих факторов, связанных как с зародышем, так и с матерью, а также комплекса неблагоприятных условий внешней среды. Среди факторов внешней среды к причинам самопроизвольного аборта относится ряд социальных (курение, стрессы, вредные профессиональные факторы) и медицинских факторов (эндокринные, инфекционные, иммунные). Однако, по данным ряда авторов, в 20-40% случаев невынашивания беременности причина остается невыясненной. В настоящее время особое внимание уделяется изучению молекулярных вариантов ряда генов, модулирующих риск широко распространенных мультифакториальных заболеваний, к которым относится и синдром невынашивания беременности.
Описано около 7 различных групп генов, ассоциированных с риском невынашивания беременности. К ним относятся следующие генные сети: гены II фазы детоксикации (GSTM1, GSTT1, GSTP1); гены плазменного гемостаза (FGB, PTM, FVL, XII); гены иммунной системы (DQA1, DQB2, DQB1, HLA-G, ILIB); гены метаболизма гормонов (PGR, ER); гены факторов роста хориона и плаценты (VEGF, IGF1, TNFA, TGFB); гены метаболизма фолиевой кислоты и витамина В12 (MTHFR, MTRR, MTR) [1]. Влияние полиморфизма перечисленных генов на систему мать-плацента-плод осуществляется как со стороны матери, так и со стороны плода. Особая роль в этиологии ранней эмбриональной гибели отводится нарушениям самого эмбриона: эпигенетической регуляции, не выявленным, редким мозаичным вариантам хромосомных аномалий, однородительской дисомии, повышенной частоте мутаций повторяющихся последовательностей [4-7, 9, 12, 13].
Цель данного исследования - изучение частоты и структуры хромосомной патологии среди абортированных эмбрионов у женщин с неразвивающейся беременностью и анэмбрионией.
Материал и методы
Абортивный материал для исследования был получен в гинекологическом отделении ФГБУ НИИ «Охраны материнства и младенчества» в Екатеринбурге с 2010 по 2011 г. С помощью стандартного цитогенетического анализа исследован материал 71 абортуса при неразвивающейся беременности. Среди них 63 образца получены у женщин с клиническим диагнозом неразвивающейся беременности, поставленным в ходе динамического ультразвукового обследования, и характеризовались наличием в полости плодного мешка внутриутробно погибшего эмбриона. Остальные 8 образцов абортного материала представляли собой случаи анэмбрионии, характеризовавшейся отсутствием эмбриональных структур в полости плодного мешка. Эмбриональные ткани получали из полости матки методом вакуум-аспирации. Гестационный возраст эмбрионов составил 4-11,5 нед (7,5±1,8 нед).
В 56 случаях беременность наступила естественным образом, в 15 случаях - в результате применения вспомогательных репродуктивных технологий. Женщины получили полную информацию о цели проводимого исследования и подписали информационное согласие на его проведение.
Фрагменты плодного мешка тщательно отмывали от крови и децидуальной ткани в среде RPMI-1634 комнатной температуры. Отобранные отдельные ворсины хориона обрабатывали по стандартному протоколу ускоренного «прямого» метода приготовления препаратов хромосом из ворсин хориона. Приготовленные препараты окрашивали стандартным дифференциальным методом G-окраски с применением 0,25% раствора трипсина и раствора красителя Гимза [1]. Кариотипирование проводили на микроскопе Leica DM4000B c программным обеспечением LeicaCW 4000 Karyo.
Результаты и обсуждение
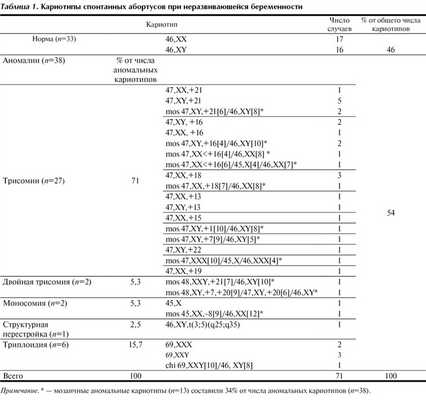
Стандартный цитогенетический анализ был успешно проведен в 71 случае спонтанных абортусов. В результате цитогенетического исследования в 33 (46%) случаях был выявлен нормальный кариотип и в 38 (54%) случаях - аномальный кариотип абортуса (табл. 1). Установленная доля аномальных кариотипов согласуется с проведенными ранее исследованиями других авторов. По обобщенным данным, число случаев хромосомных аномалий у абортусов при неразвивающейся беременности до 10 нед гестации составляет около 60% [1, 5, 11].
Среди выявленных 38 случаев аномального кариотипа у эмбрионов были обнаружены все типы хромосомных нарушений, описанных ранее другими авторами при ранней эмбриональной гибели, за исключением тетраплоидии и маркерных хромосом [1, 4].
В 2 случаях обнаружен сложный вариант двойной трисомии, с участием дополнительной половой хромосомы (Х) и 21-й в первом случае, 7-й и 20-й хромосом - в другом случае (см. табл. 1). Частота отдельных трисомий согласуется с наблюдениями других авторов [2].
Хромосомный дисбаланс половых хромосом был обнаружен в 3 случаях (см. табл. 1). В одном случае имела место дисомия Х хромосомы в мужском кариотипе (mos 48,ХХY,+21[7]/46,ХY[10]), в другом - трисомия Х в женском кариотипе (mos 47,ХХХ[10]/45,Х[4]/46,ХХ[4]). Оба варианта выявлены в мозаичной форме. Полная моносомия Х хромосомы выявлена также в 1 случае.
Как следует из табл. 1, полиплоидия в проведенном исследовании была представлена только триплоидией у 6 (15,8%) абортусов, распространенность которой согласуется с данными по другим популяциям [6, 11]. Триплоидия является либо результатом нарушения созревания половых клеток (отсутствие редукции диплоидного набора), либо оплодотворения одной яйцеклетки двумя сперматозоидами [1, 15]. Один случай представлял собой химерный вариант кариотипа (chi 69,XXY[10]/46,XY[8]).

Определенный интерес представляет изучение структуры хромосомных аномалий у абортусов с наиболее тяжелой морфологической формой нарушений эмбриогенеза - анэмбрионией. По результатам собственных исследований, среди 8 случаев анэмбрионии нами были выявлены 3 случая анеуплоидного кариотипа с трисомией по 15, 16 и 19-й хромосоме (табл. 3). В ряде исследований методом сравнительной геномной гибридизации (CGH) показано, что у абортусов с анэмбрионией имели место как моносомии (7, 15, 21 и 22-й хромосом), так и трисомии (1, 2, 15 и 19-й хромосом) [1, 8].
Интересной особенностью полученных результатов является высокая частота мозаичных форм хромосомных нарушений, которые составили 34% (13 случаев) от числа аномальных кариотипов (см. табл. 1). По данным исследований других популяций [6], проведенных с использованием стандартного цитогенетического анализа, число случаев мозаицизма по всем хромосомам колеблется от 0 до 14%. Следует учитывать, что стандартный цитогенетический анализ не позволяет отличить истинную трисомию и моносомию от потери хромосомы при приготовлении препаратов, особенно при мозаицизме низкого уровня. Кроме того, количество метафазных пластин часто ограничено, что не позволяет объективно судить о доле аномального клона клеток. Более достоверные результаты о наличии мозаичного варианта кариотипа можно получить методами молекулярной цитогенетики, например, методом FISH (fluorescence in situ hy bridization), который позволяет многократно увеличить количество анализируемых метафаз. Исследователи из Томска FISH-методом обнаружили высокую частоту мозаичных форм кариотипа спонтанных абортусов (37%) [10]. В работе С.Г. Ворсановой [2] с применением метода FISH обнаружен мозаицизм у 50,3% абортусов с аномальным кариотипом. Поэтому мы склонны считать выявленный мозаицизм в экстраэмбриональных тканях абортусов истинным, характерным для этиологии неразвивающейся беременности. Для исключения ложноположительного мозаицизма, обусловленного погрешностями техники приготовления цитогенетических препаратов, мы постоянно совершенствуем мастерство и контролируем качество обработки биологического материала.
Мозаичные нарушения кариотипа являются результатом соматического мутагенеза в тканях самого зародыша на постзиготических этапах развития. Другими словами, хромосомные аномалии у плода могут возникать не только на этапе гаметогенеза у родителей погибшего плода, но и в процессе имплантации, морфогенеза и развития эмбриона с исходно нормальным кариотипом. В настоящее время одной из причин хромосомного мозаицизма на ранних этапах онтогенеза человека рассматриваются нарушения эпигенетической регуляции экспрессии генов, выполняющих различные функции в ходе клеточного цикла. Исследования некоторых авторов указывают на взаимосвязь цитогенетических нарушений с аномалиями эпигенетического репрограммирования [10].
Следует отметить, что частота хромосомных аномалий среди абортусов при неразвивающейся беременности, по данным ряда авторов, выше, чем при самопроизвольных абортах [6, 10]. Следовательно, можно предположить, что гибель эмбриона при несостоявшемся аборте, вероятно, чаще вызвана генетическими факторами. Это ставит новые вопросы об этиологии и механизмах внутриутробной задержки погибшего эмбриона при несостоявшемся аборте и причинах гибели плода с нормальной хромосомной конституцией, о роли генетических и эпигенетических факторов в индивидуальном развитии человека.
Выводы
1. Наиболее распространенным нарушением кариотипа у абортусов при неразвивающейся беременности была трисомия (71%).
2. Значительная часть аномальных кариотипов абортусов была представлена мозаичными вариантами (34%).
3. В большинстве мозаичных кариотипов имеет место невысокая частота анеуплоидных клеток, что свидетельствует о митотических ошибках на постзиготическом этапе развития эмбриона.
Диагностические проблемы кариотипирования плода. Маркерные хромосомы. Мозаицизм хромосом.
Данные эхографии и пренатальное кариотипироваиие.
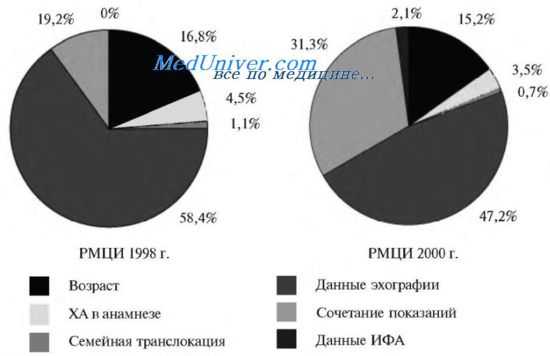
Эхография является высоко информативным методом в формировании группы пациенток для пренатального кариотипирования. Большинство грубых ХА внешне проявляют себя пороками развития или, так называемыми, ультразвуковыми маркерами хромосомных аберраций (ЭГМ ХА). Во II триместре ЭГМ ХА разнообразны и многочисленны. В целом частота ХА у плодов при наличии эхографических отклонений варьирует в широких пределах. Отечественные исследователи сообщают о выявлении 11,3—30,9% ХАуплодовс ЭГМ. В наших исследованиях этот показатель составил 21,6%, если эхогра-фические изменения сочетались с другими факторами риска (возрастом, отягощенным анамнезом, изменениями уровней биохимических маркеров), и 15,2%, если ультразвуковые изменения были изолированными. Поданным J. Murotsuki и соавт., N. Rizzo и соавт, ХА у плодовс ЭГМ былинайденыв 18,0и31,7% случаев.
При ретроспективном анализе пренатально диагностированных случаев грубых ХА оказалось, что при ультразвуковом исследовании различные аномалии развития регистрируются в среднем у 70% плодов. Таким образом, понятие ХАи эхографические отклонения тесно связаны между собой.
Впервые понятие «ультразвуковой маркер хромосомной патологии» было введено в 1985 г. В. Benacerraf и соавт, которые описали утолщение шейной складки у плодов с синдромом Дауна. После этой работы последовали многочисленные исследования, посвященные ЭГМ ХА. В настоящее время перечень пренатальных ЭГМ ХА очень широк. Основные ультразвуковые изменения, которые могут быть основанием для решения вопроса о пренатальномкариотипировании, атакже наиболее частые эхографические находки при наличии у плода хромосомных синдромов представлены в таблицах.
Отличия впоказателяхв основном объясняются разным количеством наблюдений в разных исследованиях и отсутствием единых критериев в оценке некоторых ЭГМ (например, гиперэхогенного кишечника, аномального количества вод, аномальной формы головы). Тем не менее, эти цифры ярко демонстрируют, что прогностическая значимость ЭГМ ХА различна и это необходимо учитывать при формировании показаний к пренатальному кариотипированию.
Структура показаний к пренатальному кариотипированию у плодов с грубыми хромосомными аномалиями
Хромосомная природа любого порока развития, даже подлежащего хирургической коррекции в неонатальном периоде, делает бесперспективным пролонгирование беременности. Исследование кариотипа плода позволяет определить акушерскую тактику, а иногда в корне изменить план ведения беременности, например, решить вопрос о прерывании по медицинским показаниям в большом сроке. В III триместре, когда в любой ситуации прерывание беременности невозможно, знание врачом хромосомной причины аномалии плода корректирует тактику ведения родов и позволяет избежать неоправданных оперативных вмешательств. Если в ходе пренатального обследования исключена хромосомная причина порока развития плода, неонатологи получают возможность заранее определить план наблюдения за новорожденным и быть готовыми к своевременной хирургической коррекции в неонатальном периоде,
Многие ВНЗ, в том числе и хромосомные, не сопровождаются грубыми анатомическими изменениями и не имеют вызусловно, расширяет рамки общепринятых показаний к пренатальному кариотипированию и дает возможность обследования большего количества пациенток.
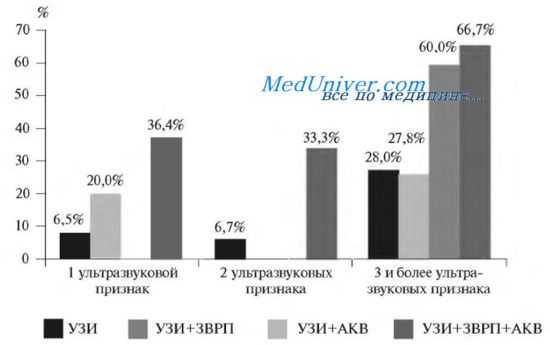
Изучая закономерности в выявлении хромосомной аномалии у плода, мы пришли к выводу, что частота хромосомных дефектов выше в группе тех пациенток, где показаниями к исследованию были, так называемые,, «мягкие» ЭГМ (19,7%), а не пороки развития (13,1%).
Для практического здравоохранения этот факт имеет принципиальное значение. «Мягкие» признаки - гиперэхогенный кишечник, вентрикуломегалия, аномальная форма головы и тд.- могут встречаться не только при ХА, но и при отсутствии каких бы то ни было отклонений в развитии плода. Следовательно, выявление такого рода эхографичсских находок служит поводом только для пренатального кариотипирования с целью уточнения дальнейшей тактики ведения беременности. В случае нормального кариотипа ведение беременности не нуждается в коррекции, поскольку наличие «мягких» признаков не влияет на качество жизни и здоровья ребенка. При обнаружении ХА у плода, несмотря на отсутствие грубых пороков развития, целесообразно решить вопрос о прерывании беременности по медицинским показаниям в связи с плохим прогнозом для жизни и здоровья.
Частота хромосомной аномалии в зависимости от количества ЭГМ и их сочетания с аномальным количеством вод
При выявлении пороков развития, пренатальное кариотипирование преследует совершенно другие цели. В случае диагностики аномалий, не совместимых с жизнью, показано прерывание беременности по медицинским показаниям. Информация о кариотипе плода в этих случаях необходима для уточнения генеза патологии и прогностического медико-генетического консультирования. При наличии пороков развития, совместимых с жизнью (например, омфалоцеле, атрезия двенадцатиперстной кишки, диафрагмальная грыжа, расщелины лица), нормальный кариотип является залогом хорошего прогноза и, соответственно, показанием к хирургической коррекции в полном объеме.
Помимо характера эхографических изменений, частота выявления ХА у плода зависит и от количества найденных ультразвуковых признаков. Чем больше ЭГМ, тем чаще диагностируется хромосомная патология у плода. По данным J. Murotsuki и соавт, при единственном ЭГМ частота ХА не превысила 8,2%, а при наличии нескольких ультразвуковых отклонений составила 52,7%. В исследованиях R. Snijders и К. Nicolaides также была подтверждена такая зависимость.
Связь частоты хромосомной аномалии и количества ЭГМ, а также зависимость этого показателя от наличия задержки внутриутробного развития плода и аномального количества вод была подтверждена и нашими исследованиями.
Таким образом, эхография является действенным методом борьбы с хромосомной аномалией у плода. РМЦИ доказали значительное преимущество этого метода в формировании показаний к пренатальному кариотипирова-нию по сравнению с традиционными факторами риска - возрастом, отягощенным анамнезом, данными иммуноферментного анализа крови. Частота выявления ХА у плода при наличии эхографических отклонений, как изолированных, так и в сочетании с другими факторами риска, в несколько раз выше, чем при нормальной ультразвуковой картине.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Псевдомозаицизм. Мозаицизм хромосом, ограниченный плацентой.
Под псевдомозаицизмом понимают мозаицизм, который не отражает истинной хромосомной конституции индивидуума и обусловлен наличием отдельных клеток с хромосомным набором, отличающимся от кариотипа основной клеточной популяции. При этом хромосомную аномалию может иметь единичная клетка (одноклеточный псевдомозаицизм) или различные хромосомные аномалии могут встречаться в нескольких клетках (многоклеточный псевдомозаицизм).
На препаратах из культивированных клеток, фиксированных методом in situ, псевдомозаицизм регистрируется, если аномальный кариотип демонстрирует клетка на одном участке колонии, либо все метафазные пластинки одной колонии, либо несколько колоний. При flask-методе псевдомозаицизмом обозначают наличие многочисленных клеток с однотипной хромосомной аномалией в пределах одного флакона.
Частота псевдомозаицизма, по суммарным данным разных лабораторий, варьирует в пределах 0,6-1,0%.
Мозаицизм, ограниченный плацентой
Как уже отмечалось выше, ПД хромосомных аномалий проводится по клеткам либо плода, либо провизорных органов. Для интерпретации результатов ПД особенности происхождения анализируемого материала могут иметь принципиальное значение. Так, цитотрофобласт хориона, будучи производным трофэктодермы, атакже мезодермальная строма ворсин хориона/плаценты обособляются от внутренней клеточной массы на стадии бластоцисты, т.е. имеютэк-страэмбриональное происхождение. Амнион, формирующийся из первичной эктодермы, является эмбриональной структурой. Эмбриональное происхождение имеют все эпителиальные клетки АЖ, а также лимфоциты пуповинной крови.
На постимплантационных стадиях развития человека хромосомный набор в клетках плодных оболочек, как правило, соответствует кариотипу плода. Однако в некоторых случаях возможна дискордантность кариотипов в клетках экстраэмбриональных тканей и плода. При этом несоответствие хромосомных наборов может быть полным или иметь мозаичную форму. Клеточные линии с аномальным кариотипом могут быть локализованы в тканях как внезародышевых оболочек, так и плода. Присутствие аномального клеточного клона в тканях плода при его наличии в плаценте (т.е. истинный или генерализованный мозаицизм) подтверждается в 10% случаев плацентарного мозаицизма, или составляет 0,1% от всех развивающихся беременностей. По обобщенным результатам ПД, случаи мозаичной анеуплоидии в тканях плода, имеющего нормальный кариотип в клетках провизорных органов, единичны. Приблизительно в 2% случаев прогрессирующих беременностей цитогенетические аномалии, чаще мозаичные трисомии, ограничены плацентой.
Классификация типов ограниченного плацентой мозаицизма приведена в табл. Предполагается, что плацентарный мозаицизм является неблагоприятным фактором для развития плода. Риск внутриутробной задержки развития плода, самопроизвольного выкидыша, антенатальной гибели или преждевременных родов характерен для случаев плацентарного мозаицизма с достаточно высокой долей анеуплоидных клеток в цитотрофобласте, в экстраэмбриональной мезодерме или сразу во всех тканях плаценты (типы 1, 2 и 3 плацентарного мозаицизма соответственно). Однако различные подходы к оценке акушерско-клинических проявлений плацентарного мозаицизма не позволяют в настоящее время считать его влияние на развитие плода абсолютно доказанным.
Очевидно, что принципиально вопрос о типе мозаицизма может быть решен только в случае параллельного анализа цитотрофобласта и мезодермы, т.е. комбинировании прямого метода приготовления препаратов с культивированием образцов хориона или плаценты. Необходимыми этапами диагностики в случаях мозаицизма должны быть также установление происхождения трисомной линии (стадия и механизм возникновения), а также исключение однородительскойдисомии. Эти исследования особенно важны, когда в мозаицизм вовлечены хромосомы, для которых установлен феномен хромосомного импринтинта.
Лимфоциты крови плода. Для хромосомного анализа крови плода используют стандартную методику стимулирования лимфоцитов фитогемагглютинином. Обычно анализируют 11—20 метафазных пластинок.
Этот метод дает наиболее адекватное представление о хромосомном статусе плода и настоятельно рекомендуется для кари-отипирования плода в случае хромосомного мозаицизма в плаценте, а также при наличии пороков развития не только во II триместре, но, как показывает наш опыт, и в поздние сроки беременности. В последнем случае кариотипирование плода позволяет решить вопрос о тактике ведения беременности, родов и неонатального периода.
Диагностические проблемы кариотипированая плода
К диагностическим ошибкам при цитогенетической ПД могут привести структурные перестройки хромосом, возникшие de novo, сверхчисленные маркерные хромосомы и мозаицизм хромосом.
Структурные перестройки хромосом, возникшие de novo
Структурные перестройки хромосом, не унаследованные от кого-либо из родителей при подтвержденном отцовстве, встречаются довольно редко (0,06-0,20% от всех пренатальных исследований). При обнаружении перестройки хромосом, действительно возникшей de novo, невозможно полностью исключить микроперестройки и, следовательно, несбалансированность хромосомного набора у плода. В этой ситуации риск рождения ребенка с аномалиями развития составляет 10%.
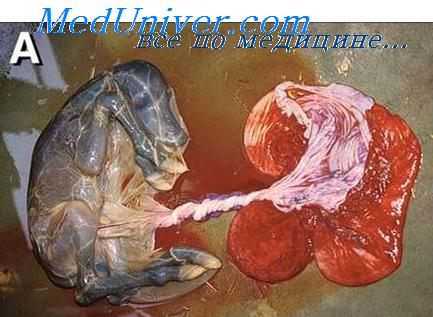
Маркерные хромосомы
Сверхчисленные маркерные хромосомы в пренатальном периоде выявляются с частотой 0,6-0,96/1000. Все маркерные хромосомы делятся на несколько классов: возникшие de novo и семейные, мозаичные и немозаичные, спутничные и лишенные спутников. Риск рождения ребенка с аномалиями развития зависит от хромосом, принимающих участие в их образовании, а также от их принадлежности к тому или иному классу. Поэтому обнаружение в кариотипе плода маркерной хромосомы требует не только ее идентификации всеми доступными методами, но и кариотипирования родителей для установления происхождения маркера и формы анеуплоидии (полная или мозаичная).
Прогноз в отношении плода более благоприятен, если один из фенотипически нормальных родителей является носителем идентичной маркерной хромосомы.
Общий риск аномалий развития у плода при сверхчисленных маркерных хромосомах, возникших de novo, составляет около 8% для сателлитных маркеров (содержащих короткие плечи акроцентрических хромосом, несущих рибосомные гены) и 27% —для несателлитных. При этом наличие эухроматинового материала, выявленного методами дифференциального окрашивания (G-,Q-,NOR-,DA/DAPI) или FISH с использованием наборов цельнохромосомных ДНК-зондов, свидетельствует о частичной трисомии и существенно увеличивает вероятность аномалий развития.
Мозаицизм хромосом
Проблеме хромосомного мозаицизма в ПД уделяется особое внимание в связи с тем, что накопленные к настоящему времени данные свидетельствуют о совместимости с внутриутробным развитием и живорождением многих аутосомных трисомии. При этом тяжесть проявления синдромов не зависит от формы анеуплоидии (полная или мозаичная) и доли анеупло-идных клеток в исследуемой ткани.
Вероятность обнаружения клеток с разным хромосомным набором существенно различается в зависимости от используемого метода приготовления препаратов. Однако в любом случае необходимо определить, является ли мозаицизм артефактным, т.е. возникающим в процессе приготовления хромосомных препаратов, или он действительно отражает кариотип плода. В отличие от аутосомных моносомий, которые, как правило, обусловлены методическими моментами, моносомия X, а также трисомии по любым хромосомам набора требуют самого пристального внимания.
Наиболее частыми источниками диагностических ошибок являются контаминация образца и псевдомозаицизм.
Контаминация образца материнскими клетками
Образцы любого эмбрионального материала могут быть контаминированы клетками материнского происхождения.
При длительном культивировании материнские клетки могут пролиферировать и приводить к диагностическим ошибкам. Риск ошибок, обусловленных контаминацией , составляет 0,16% при культивировании клеток АЖивыше (до 0,4%) при культивировании клеток ворсин хориона. Избежать ошибочных результатов можно лишь при сокращении времени культивирования или использовании «прямого» метода приготовления препаратов.
Во избежание диагностических ошибок при анализе лимфоцитов пуповинной крови необходимо контролировать чистоту образца в соответствии с методикой, основанной на отличиях реакции фетального гемоглобина от окраски гемоглобина взрослых эритроцитов в щелочной среде.
Информационное письмо Международного общества ПГД от 27 мая 2019 г.
Журнал: Проблемы репродукции. 2019;25(4): 8‑12
Цель данного документа — оценка накопленной информации о переносе эмбрионов с мозаицизмом.
Введение
Основной задачей преимплантационной генетической диагностики на анеуплоидию (ПГТ-А) является повышение эффективности переносов в программе экстракорпорального оплодотворения (ЭКО) путем отбора эмбрионов без анеуплоидии. Доказано, что перенос эуплоидных эмбрионов повышает частоту имплантации, наступления беременности, живорождения. В последние годы в клиническую практику внедрены новые молекулярно-генетические методы исследования бластоцист на хромосомную патологию — анеуплоидию, такие как aCGH, SNP и NGS.
В настоящее время большинство лабораторий ЭКО культивируют эмбрионы до стадии бластоцисты с целью выявления жизнеспособных эмбрионов, а затем проводят биопсию небольшого числа клеток трофэктодермы для исследования на анеуплоидию. Анализ многоклеточных биоптатов дает возможность получить даже промежуточные результаты, определить состояние между полной анеуплоидией и эуплоидией (частично мозаичные эмбрионы).
Под хромосомным мозаицизмом принято понимать наличие в единичной пробе двух клеток или более с разным хромосомным набором, что иногда наблюдается и у незначительного количества здоровых эмбрионов на всех стадиях преимплантационного развития. При применении высокочувствительных методов исследования, таких как матричная CGH и NGS, основанных на методике подсчета числа копий, можно дифференцировать простую равномерную анеуплоидию, затрагивающую все клетки в биоптате, от частичной (мозаичной) анеуплоидии, затрагивающей только часть клеток в биоптате, а также подсчитать степень изменений количества копий [2]. При использовании высокоразрешающих методов NGS также можно выявить сегментарный мозаицизм и благодаря этому идентифицировать небольшие делеции или дупликации хромосом (обычно более 10 Мб).
Обзор новых данных
Частота эмбрионов с мозаицизмом
На стадии бластоцисты частота мозаицизма, установленная методами NGS, очень различается по данным разных клинических учреждений, варьирует от наименьшей — 2% и доходит до 40%. Тем не менее большинство клиник сообщают о частоте эмбрионов с мозаицизмом 5—10% среди всех протестированных эмбрионов [2—4]. Стабильная высокая частота мозаичных эмбрионов в некоторых клиниках может быть результатом методов лечения, особенностей культивирования, подходов к диагностике; имеет значение и контингент пациентов [4]. В таких случаях необходимо провести аудит клинической и лабораторной работы. Все клиники, которые отправляют эмбрионы в лаборатории для исследования на ПГТ-А, имеют право запросить у лаборатории информацию о частоте выявления мозаицизма и показателях пороговых данных.
Результаты переноса эмбрионов с мозаицизмом
Генетический анализ бластоцист с мозаицизмом
В исследованиях, в которых проведен повторный анализ непригодных бластоцист после NGS, продемонстрировано соответствие (более 95%) начальным результатам анеуплоидии при исследовании других участков эмбрионов, включая внутреннюю клеточную массу (ВКМ) и другие участки трофэктодермы [7, 10, 11]. С недавних пор в результате исследований эмбрионов с мозаицизмом стала более понятной хромосомная организация бластоцист с мозаицизмом [12]. В целом, если уровень мозаицизма при начальной биопсии был высоким (более 40—80%), при последующей биопсии трофэктодермы и анализе ВКМ также обнаруживали некоторый уровень мозаицизма. Однако если уровень мозаицизма изначально был низким (менее 40%), то при последующем анализе трофэктодермы и ВКМ также обнаруживали его снижение, при этом некоторые эмбрионы были равномерно эуплоидными.
Технические вопросы
В процессе проведения ПГТ-А появляются косвенные доказательства того, что NGS и конвейер анализа данных для измерения количества копий хромосом могут неправильно указывать на мозаицизм в некоторых эмбрионах как следствие влияния различных методик [4]. Вероятные причины подобных артефактов следующие:
— методика проведения биопсии: некачественная техника биопсии, при которой получены клетки в малом количестве, с повреждениями или частичным разрушением и потерей клеточной ДНК, что влияет на хромосомный профиль;
— анализ: алгоритмы нормализации ячеек картирования хромосом также могут потенциально искажать результат, особенно если количество ячеек, используемое для нормализации профилей, является переменным или низким. Кроме того, искажения в построении библиотеки из-за исходной ДНК худшего качества (включая нарушения амплификации целого генома) могут привести к недооценке или избыточному накоплению хромосом (мозаицизм целых хромосом) или субхромосомных областей (сегментарный мозаицизм). При NIPT-анализе свободно-клеточной ДНК, при котором используется похожая методика NGS, выдвинуто предположение, что искажения могут возникать на этапе подготовки библиотеки, что приводит к неправильному копированию участков, особенно для хромосомных сегментов.
Как это влияет на исследование анеуплоидии в клинической практике?
Большинство (более 90%) результатов биопсии трофэктодермы показывает неравномерную эуплоидию для всех хромосом или полную анеуплоидию, включая одну хромосому или более. Тем не менее у небольшого количества эмбрионов может быть промежуточное количество изменений в одной или нескольких хромосомах, что свидетельствует о возможном мозаицизме. Иногда это могут быть единственные эмбрионы, доступные для переноса. Мозаицизм в биоптатах трофэктодермы теоретически может оказывать клиническое влияние на беременность, в том числе на функцию плаценты или на развитие синдромов заболеваний новорожденных, поэтому перенос подобных эмбрионов может проводиться только с согласия пациентов и после рассмотрения всех других вариантов.
Рекомендации для лаборатории
1. Следует понимать, какое влияние на последующий результат может оказывать плохая техника биопсии. В идеале для биопсии нужно брать 5 клеток и более, чтобы провести точную и сбалансированную амплификацию. Количество клеток менее 5 может влиять на профиль амплификации (шум) и степень диагностики мозаицизма. Рекомендуется проводить биопсию не более 10 клеток, чтобы свести к минимуму влияние самой процедуры на оставшийся эмбрион. Необходимо уменьшить вероятность повреждения клеток, чтобы снизить отклонения в амплификации и получить ДНК, соответствующую оригиналу в клетке. Если для биопсии используется лазер, то точки контакта должны быть минимальными и предпочтительно располагаться в местах соединения клеток. Если у когорты эмбрионов выявляется достаточно высокая частота мозаицизма, то необходимо провести оценку эмбриологических протоколов и методики проведения ПГТ-А для выяснения причины такого явления.
2. По техническим причинам при отчете об уровне мозаицизма в образце биопсии следует использовать только аналитическое оборудование, которое способно воспроизводимо измерять количество копий. Различное аналитическое оборудование может обладать меньшим (или большим) диагностическим и количественным потенциалом для диагностики мозаицизма, а также внутренним шумовым уровнем. Сервисные лаборатории могут проводить собственные контрольные эксперименты как для эуплоидных, так и для анеуплоидных продуктов WGA из различного набора проб. Значения, лежащие вне этого эуплоидного или анеуплоидного разброса, считаются мозаичными. Диагностику и количественное определение уровня мозаицизма можно при необходимости осуществлять в экспериментах по перемешиванию клеток. Эксперименты по смешиванию небольшого количества ДНК могут быть не такими информативными из-за теоретических проблем с отбором небольшого количества копий, приводящих к смещению относительного хромосомного соотношения. Эмбрионы в избранном низшем значении могут быть определены как эуплоидные, тогда как эмбрионы над верхней установленной границей могут считаться анеуплоидными. Типичный нижний предел в ряде публикаций установлен как 20%, тогда как верхний — 80% [13—17]. На эти предельные значения от референсной группы должна опираться сервисная группа. Рекомендуется, чтобы любая клиника, использующая коммерческие наборы для ПГТ-А, учитывала эти референсные показатели для четкой диагностики мозаицизма и консультирования пациентов.
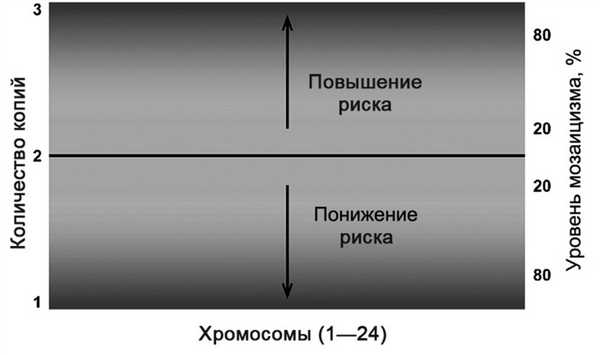
3. Принимая во внимание биологию и развитие мозаицизма, следует учитывать, что любой биопсированный фрагмент, расцененный как мозаичный, может четко не отображать состояние окружающей трофэктодермы в остальной части эмбриона. В связи с широким разбросом данных полученные значения нужно рассматривать только как ориентир для консультирования пар относительно переноса (или уничтожения) эмбриона с подозрением на мозаицизм. Мы предлагаем рассматривать мозаичный спектр как непрерывный градиент риска неблагоприятного результата — от относительно низкого уровня (20%) до высокого риска, когда показатель приближается к 80% (см. рисунок). Взаимосвязь между степенью мозаицизма и повышением риска неблагоприятных результатов после переноса эмбриона с мозаицизмом. Тем не менее в клиниках должны сами принимать решение при оценке величины риска неблагоприятных результатов после переноса эмбриона с мозаицизмом.
4. В формат лабораторной отчетности необходимо включать отчет о мозаицизме, референсные показатели для мозаицизма и описание природы выявленной хромосомной аномалии.
Рекомендации для клиницистов
1. Пациентам следует сообщать, что любой генетический анализ, проводимый на выборке из одной или небольшого числа клеток из биоптата преимплантационного эмбриона, не может иметь стопроцентной точности по причине технических и биологических факторов, включая хромосомный мозаицизм.
2. Консультирование пациентов и информированное согласие на исследование анеуплоидии (если проводится) должны затрагивать вопросы влияния мозаицизма на исходы переноса и имплантации. Это должен объяснять пациенту врач, который рекомендует ПГТ-А.
3. Переносу бластоцист с нормальным эуплоидным набором должно отдаваться предпочтение перед переносом мозаичного эмбриона.
4. При рассмотрении вопроса о переносе бластоцисты с мозаицизмом необходимо обсудить с пациентом следующие возможности:
— возобновление дальнейших циклов ПГТ-А для повышения шанса получения эуплоидной бластоцисты для переноса;
— перенос бластоцисты с более низким уровнем мозаицизма после соответствующего консультирования.
Рекомендации по очередности переноса мозаичных эмбрионов
Основываясь на наших текущих знаниях о репродуктивных исходах для плода и плацентарном мозаицизме при пренатальной диагностике и на новой информации, полученной в результате недавних исследований по анализу и переносу эмбрионов, предлагаем клиницистам (или генетическим консультантам, если таковые имеются) руководствоваться следующими положениями:
1. Эмбрионы с низким уровнем мозаицизма (низкий риск неблагоприятного результата переноса эмбриона) предпочтительнее эмбрионов с высоким риском мозаицизма, который в свою очередь может обусловливать дальнейший неблагоприятный исход. Относительный процент мозаицизма является более благоприятным прогностическим фактором, нежели вовлечение конкретной хромосомы (хромосом). Конкретные хромосомы связаны с конкретными синдромами, и это должно обсуждаться при консультировании. Эмбрионы с высоким риском мозаицизма нужно переносить с осторожностью и только после соответствующей генетической консультации.
2. Если принято решение о переносе эмбриона с мозаицизмом по одной хромосоме, то в первую очередь нужно делать выбор на основании уровня мозаицизма, а затем — конкретно задействованной хромосомы. Выбор в отношении мозаичного эмбриона должен основываться на информации о хромосомных синдромах, а также на уровне мозаицизма в биопсийной пробе. Если есть выбор между переносом 2 эмбрионов с мозаицизмом одинакового уровня, то наименьший приоритет отдается эмбрионам с мозаицизмом по хромосомам, связанным с непарной дисомией, тяжелой задержкой внутриматочного развития или жизнеспособными синдромами. Для получения более подробной информации о специфических осложнениях развития плаценты и о синдромах плода, а также о вероятной связи хромосом с различными аномалиями можно обратиться к обзору F. Grati и соавт. [18]. Для справки по вопросам переноса эмбрионов с мозаицизмом можно использовать последние рекомендации Американского общества репродуктивной медицины (American Society for Reproductive Medicine — ASRM) [19].
Заключение
Развитие геномных технологий для преимплантационной генетической диагностики произвело революцию в нашей способности обнаруживать на уровне отдельных клеток или небольшого количества клеток генетические аномалии различных типов. Повышение чувствительности и разрешающей способности этих методов позволит также идентифицировать более полный спектр хромосомных аномалий, включая хромосомный и сегментарный мозаицизм — область, в которой наши знания неполны и все еще развиваются. Предыдущие результаты экстракорпорального оплодотворения указывают на отсутствие повышенного риска хромосомных аномалий по сравнению с естественной беременностью, и поэтому, исходя из имеющихся данных преимплантационной генетической диагностики на анеуплоидию, перенос эмбрионов с мозаицизмом представляется относительно безопасным вариантом для пар с низким или минимальным риском неблагоприятных исходов беременности. Тем не менее вопрос о переносе бластоцисты после определения в ней различной степени анеуплоидии должен решаться только на основании тщательного консультирования пациентов, в том числе генетического. Необходимо принимать во внимание лабораторные рекомендации при консультировании пациентов о риске неблагоприятного результата, связанном с переносом эмбриона с мозаицизмом. Пациент должен быть информирован о необходимости последующего наблюдения за течением беременности и проведения неинвазивной пренатальной диагностики или инвазивных исследований, таких как амниоцентез, при которых может быть выявлен мозаицизм. Чтобы лучше понять последствия переноса эмбрионов с мозаицизмом и представить ценную информацию для улучшения генетического консультирования пациентов, рассматривающих такую возможность, необходимо проводить долгосрочные исследования всех предполагаемых переносов эмбрионов с мозаицизмом. С широким внедрением неинвазивной пренатальной диагностики и появлением более точных технологий неинвазивного скрининга анеуплоидий можно легко наблюдать за развитием беременности после переноса эмбриона с мозаицизмом. Более того, поскольку показано, что неинвазивная диагностика дает возможность обнаруживать мозаицизм плода даже с вовлечением редких трисомий [20], теперь есть возможность проследить за конечным результатом исходного мозаицизма трофэктодермы. Получение этих данных, а также исследование плацентарной ткани при рождении помогут лучше понять, насколько безопасен перенос эмбриона с мозаицизмом. Что касается исследований, то генетический анализ методом NGS непригодных для переноса эмбрионов с мозаицизмом, переданных для исследований, поможет лучше понять значение оценки начальной биопсии и предоставить ценную информацию об их генетическом строении.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
* DS Cram, D Leigh, A Handyside, L Rechitsky, K Xu, G Harton, J Grifo, C Rubio, E Fragouli, S Kahraman, E Forman, M Katz-Jaffe, H Tempest, A Thornhill, C Strom, T Escudero, Q Jie, S Munne, JL Simpson, A Kuliev
Читайте также:
