Гормональные причины ановуляции и дисфункции яичников. Эндокринные нарушения
Добавил пользователь Morpheus Обновлено: 30.01.2026
Нарушения функции яичников как причина их дисфункции и ановуляции
Истощение пула фолликулов — частая причина изменений функционирования яичников в период перименопаузы. В раннюю фолликулярную фазу (3-й день) содержание ФСГ повышается из-за относительной резистентности оставшихся фолликулов к ФСГ-зависимой стимуляции и сопутствующего понижения количества ингибина в сыворотке крови.
Этот неизбежный процесс репродуктивного старения обычно начинается в конце третьего десятилетия и может клинически манифестировать в виде изменения менструальных циклов после 40 лет.
Этот же процесс, но в более раннем возрасте может происходить у молодых женщин, когда до 40 лет развивается преждевременная яичниковая недостаточность (ПЯН). У некоторых молодых женщин с этим состоянием развивается преждевременное фолликулярное истощение; у других, вероятно, присутствует достаточное количество фолликулов, но они нечувствительны к стимуляции гонадотропином, возможно, из-за аутоиммунных нарушений.
У молодых женщин с преждевременной яичниковой недостаточности (ПЯН) после постановки диагноза возможно спорадическое транзиторное восстановление функций яичников: от нерегулярных менструальных кровотечений на фоне пониженного содержания эстрогенов до нормальных овуляторных циклов с возможностью оплодотворения.
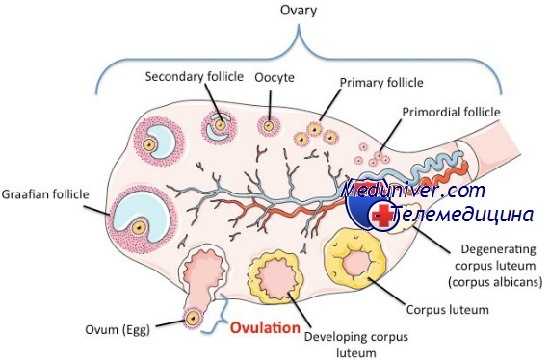
Самая частая причина дисфункции яичников — СПКЯ, комплексное патологическое состояние неясной этиологии. СПКЯ — самое частое эндокринное расстройство у женщин, характеризующееся гиперэстрогенной гиперандрогенной хронической ановуляцией, которая может клинически проявляться различными менструальными нарушениями, бесплодием, угрями, гирсутизмом и ожирением. С СПКЯ связаны многочисленные метаболические нарушения, включая ожирение, резистентность к инсулину, сахарный диабет типа 2, дислипидемия и сердечно-сосудистые заболевания.
Резистентность к инсулину играет основную роль в репродуктивной дисфункции и последующих долговременных нарушениях здоровья при СПКЯ.
Обследуя женщин с дисфункцией яичников, важно понимать, что СПКЯ — синдром с широким спектром клинических проявлений, и ни одна из существующих классификаций не охватывает все возможные фенотипы. В недавно опубликованном Роттердамском соглашении по определению СПКЯ пересмотрены критерии диагностики этого синдрома. После исключения других причин (ВГН, андроген-секретирующих опухолей, синдрома Кушинга) должны выявляться два из трех следующих критериев для постановки диагноза СПКЯ:
• олигоовуляция или ановуляция;
• клинические и/или биохимические признаки гиперандрогении;
• поликистоз яичников (наличие 12 и более фолликулов в каждом яичнике размерами 2-9 мм, и/или объем яичника не менее 10 мл).
Впрочем, ожирение, нередко связанное с СПКЯ, само по себе может способствовать дисфункции яичников. В многочисленных исследованиях, включая Исследование здоровья медсестер (Nurses Health Study), сообщают об увеличении частоты бесплодия с увеличением массо-ростового индекса. Считают, что ожирение приводит к функциональной гиперандрогении. Ожирение по центральному типу связано с резистентностью к инсулину и высоким содержанием циркулирующего инсулина.
Поскольку синтез ГСПГ в печени непосредственно ингибируется инсулином, у женщин с центральным типом ожирения более низкая концентрация ГСПГ на фоне более высокого количества свободного тестостерона, чем у женщин с периферическим ожирением и такими же массой тела и возрастом. Эта функциональная гиперандрогения в комбинации с повышением количества периферических ароматизированных эстрогенов в жировой ткани на периферии приводит к изменению баланса половых стероидов и в конечном счете способствует дисфункции яичников.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дисфункция яичников
Дисфункция яичников – расстройство гормональной функции яичников вследствие воспалительного процесса или эндокринных расстройств, проявляющееся целым рядом патологических состояний. Характеризуется нарушениями менструального цикла: его чрезмерным удлинением (более 35 дней), либо укорочением (менее 21 дня), сопровождающимися последующим дисфункциональным маточным кровотечением. Также может проявляться симптомокомплексом предменструального синдрома. Может повлечь за собой развитие эндометриоза, миомы матки, мастопатии, рака молочных желез, бесплодия.
МКБ-10

Общие сведения
Под дисфункцией яичников понимается расстройство гормонообразующей функции яичников, ведущее к отсутствию овуляции и нарушению менструального цикла. Проявлениями дисфункции яичников служат дисфункциональные маточные кровотечения, т. е. кровотечения продолжительностью свыше 7 дней после задержки менструации дольше 35 дней, или частые, нерегулярные, беспорядочные менструации, приходящие через разные интервалы времени (но менее 21 дня).
Нормальный менструальный цикл длится от 21 до 35 дней с менструальным кровотечением продолжительностью 3-7 дней. Физиологическая норма кровопотери при менструации обычно не превышает 100-150 мл. Поэтому, любые отклонения в ритмичности, длительности менструального цикла и объеме кровопотери расцениваются как проявление дисфункции яичников.
Симптомы дисфункции яичников
Регуляцию деятельности яичников осуществляют гормоны передней доли гипофиза: лютеинизирующий (ЛГ), фолликулостимулирующий (ФСГ) и пролактин. Определенное соотношение данных гормонов на каждом этапе менструального цикла обеспечивает нормальный яичниковый цикл, во время которого происходит овуляция. Поэтому в основе дисфункции яичников лежат регуляторные нарушения со стороны гипоталамо-гипофизарной системы, приводящие к ановуляции (отсутствию овуляции) в процессе менструального цикла.
При дисфункции яичников отсутствие овуляции и фазы желтого тела вызывает различные менструальные расстройства, связанные с недостаточным уровнем прогестерона и избытком эстрогенов. О дисфункции яичников могут свидетельствовать:
- Нерегулярные менструации, их скудость или, напротив, интенсивность, кровотечения в межменструальные периоды;
- Невынашивание беременности или бесплодие в результате нарушения процессов созревания яйцеклетки и овуляции;
- Тянущие, схваткообразные или тупые боли внизу живота и в пояснице в предменструальные и менструальные дни, а также в дни предполагаемой овуляции;
- Тяжело протекающий предменструальный синдром, проявляющийся вялостью, плаксивостью апатией, либо, напротив, раздражительностью;
- Ациклические (дисфункциональные) маточные кровотечения: частые (с перерывом менее 21 дня), редкие (с перерывом свыше 35 дней), обильные (с кровопотерей более 150 мл), длительные (более недели);
- Аменорея – ненаступление менструации в срок более 6 месяцев.
Таким образом, каждый из симптомов дисфункции яичников по отдельности является серьезным поводом для консультации гинеколога и обследования, так как ведет к бесплодию и невынашиванию плода. Кроме того, дисфункция яичников может свидетельствовать о злокачественных опухолевых заболеваниях, внематочной беременности, а также послужить толчком к развитию, в особенности у женщин старше 40 лет, миомы матки, эндометриоза, мастопатии, рака молочной железы.
Причины дисфункции яичников
Причинами дисфункции яичников служат факторы, ведущие к нарушению гормональной функции яичников и менструального цикла:
- Воспалительные процессы в яичниках (оофорит), придатках (сальпингоофорит или аднексит) и матке – (эндометрит, цервицит). Эти заболевания могут возникать в результате несоблюдения гигиены половых органов, заноса возбудителей с кровотоком и лимфотоком из других органов брюшной полости и кишечника, переохлаждения, простуды, нарушения правильной техники спринцевания влагалища.
- Заболевания яичников и матки (опухоли яичников, аденомиоз, эндометриоз, фибромиома матки, рак шейки и тела матки).
- Наличие сопутствующих эндокринных расстройств, как приобретенных, так и врожденных: ожирения, сахарного диабета, болезней щитовидной железы и надпочечников. Гормональный дисбаланс, вызываемый в организме данными заболеваниями, отражается и на репродуктивной сфере, вызывая дисфункцию яичников.
- Нервное перенапряжение и истощение в результате стрессов, физического и психологического переутомления, нерационального режима труда и отдыха.
- Самопроизвольное и искусственное прерывание беременности. Особенно опасен медицинский аборт или миниаборт при первой беременности, когда перестройка нацеленного на вынашивание беременности организма, резко обрывается. Это может вызвать устойчивую дисфункцию яичников, в будущем грозящую бесплодием.
- Неправильное расположение в полости матки внутриматочной спирали. Постановка внутриматочной спирали проводится строго при отсутствии противопоказаний с последующими регулярными контрольными обследованиями.
- Внешние факторы: смена климата, излишняя инсоляция, лучевые повреждения, прием некоторых лекарственных препаратов.
Иногда бывает достаточно даже единичного нарушения менструального цикла для того, чтобы развилась стойкая дисфункция яичников.
Диагностика дисфункции яичников
Обследованием и лечением дисфункции яичников занимается специалист гинеколог-эндокринолог. При подозрении на дисфункцию яичников врач, прежде всего, исключит хирургическую патологию: внематочную беременность и опухолевые процессы, проведет анализ менструального календаря женщины, выслушает жалобы, проведет гинекологический осмотр и составит план дальнейшей диагностики. Комплекс диагностических процедур, направленный на выявлении причин дисфункции яичников, может включать в себя:
- Ультразвуковые исследования органов малого таза, УЗИ надпочечников и щитовидной железы;
- Микроскопию и бакпосев секрета влагалища на флору, ПЦР-диагностику для исключения половых инфекций (кандидоза, уреаплазмоза, микоплазмоза, хламидиоз, трихомоноза и др.);
- Определение уровня содержания половых гормонов (пролактина, фолликулостимулирующего и лютеинизирующего гормонов, прогестерона, эстрогенов) в моче и крови;
- Анализ крови на содержание гормонов надпочечников и щитовидной железы;
- Рентгенографическое исследование черепа, МРТ и КТ головного мозга – для исключения поражений гипофиза;
- ЭЭГ головного мозга – для исключения локальных патологических изменений в нем;
- Гистероскопию с прицельной биопсией шейки матки или диагностическое выскабливание полости и канала шейки матки для последующего гистологического исследования кусочков эндометрия;
Схема обследования пациентки, страдающей дисфункцией яичников, составляется индивидуально в каждой конкретной ситуации и не обязательно включает в себя все выше перечисленные процедуры. Успех коррекции дисфункции яичников во многом определяется степенью выраженности расстройств, поэтому любые нарушения менструального цикла должны насторожить женщину и заставить ее пройти диагностику. Пациенткам с хронической дисфункцией яичников во избежание серьезных осложнений рекомендуется динамическое наблюдение и обследование у гинеколога-эндокринолога не реже 2-4 раз в году, даже при отсутствии субъективных изменений в состоянии.
Лечение дисфункции яичников
Комплекс лечебных мероприятий при дисфункции яичников преследует следующие цели: коррекцию неотложных состояний (остановку кровотечения), устранение причины дисфункции яичников, восстановление гормональной функции яичников и нормализацию менструального цикла. Лечение дисфункции яичников может осуществляться стационарно либо амбулаторно (при легком течении дисфункции яичников). На этапе остановки кровотечения назначается гормональная гемостатическая терапия, а в случае ее неэффективности проводится раздельное выскабливание слизистой оболочки полости матки с лечебно-диагностической целью. В зависимости от результата гистологического анализа назначается дальнейшее лечение.
Дальнейшее лечение дисфункции яичников зависит от причин, вызвавших заболевание. При выявлении хронических воспалительных процессов проводят лечение вызвавших их инфекций, в том числе и передающихся половым путем. Коррекция эндокринных нарушений, вызвавших дисфункцию яичников, проводится назначением гормонотерапии. Для стимуляции иммунитета при дисфункции яичников показано назначение витаминных комплексов, гомеопатических препаратов, БАДов. Важное значение в общем лечении дисфункции яичников отводится нормализации режима и образа жизни, питания и физической активности, а также физиотерапии, рефлексотерапии и психотерапевтической помощи.
С целью дальнейшей профилактики повторных маточных кровотечений и восстановления регулярного менструального цикла при дисфункции яичников применяют терапию препаратами прогестерона с 16 по 26 день цикла. После этого курса в течение семи дней начинается менструация, и ее начало расценивается как начало нового цикла. В последующем назначаются гормональные комбинированные контрацептивы для нормализации менструального цикла. Женщинам, у которых ранее наблюдалась дисфункция яичников, установка внутриматочной спирали (ВМС) противопоказана.
Дисфункция яичников и планирование беременности
Подготовку и осуществление беременности при дисфункции яичников необходимо проводить под контролем и при помощи гинеколога-эндокринолога. Для этого необходимо пройти курс терапии, направленной на восстановление овуляторного менструального цикла. При дисфункции яичников с этой целью назначается гормональное лечение препаратами хорионического гонадотропина, кломифена, менотропина, которые применяются, начиная с 5 дня менструального цикла по 9 день включительно.
Методы лечения дисфункции яичников, которые применяет современная гинекология, во многих случаях позволяют добиться стабилизации менструального цикла и регулярного наступления овуляции. Благодаря этому женщина может забеременеть и выносить ребенка. Если, несмотря на лечение, беременность не наступает, необходима консультация репродуктолога для решения вопроса о целесообразности искусственного оплодотворения с последующей подсадкой эмбрионов в полость матки. По показаниям для ЭКО могут использоваться донорская яйцеклетка или донорский эмбрион. Репродуктивные технологии также предусматривают криоконсервацию эмбрионов, не подвергшихся переносу в матку, для их использования при необходимости повторного ЭКО. У женщин с дисфункцией яичников ведение беременности должно проводиться с ранних сроков и с повышенным вниманием.
Женская репродуктивная система - это зеркало, в котором отражается общее здоровье организма, и она первой реагирует на возникающие патологические состояния нарушением менструальной и детородной функций. Ответ на вопрос: лечить или не лечить дисфункцию яичников в том случае, если общее самочувствие при этом страдает несильно – однозначен: лечить и как можно раньше! Дисфункция яичников иногда страшна не столько своими проявлениями, сколько отдаленными последствиями, среди которых самые частые - это бесплодие, мастопатия, миома матки, злокачественные новообразования половой системы и молочных желез, тяжелые эндокринные поражения.
Эндокринное бесплодие
Эндокринное бесплодие – это комплекс гормональных нарушений, ведущих к нерегулярности овуляции или ее отсутствию у женщин и нарушению качества спермы у мужчин. Характеризуется отсутствием желанной беременности в сочетании с нарушениями менструального цикла. Диагностика причин предполагает гинекологический осмотр, гормональное обследование, проведение РДВ с исследованием соскоба эндометрия. Лечение направлено на коррекцию выявленных гормональных отклонений терапевтическими или хирургическими способами. В случаях, не поддающихся лечению, показано ЭКО.
Понятие «эндокринного бесплодия» является собирательным, включающим различные нарушения механизмов гормональной регуляции менструального цикла: на гипоталамо-гипофизарно-яичниковом уровне, в системах ТТГ-щитовидная железа, АКТГ - кора надпочечников и др. Независимо от причин эндокринного бесплодия, в основе его развития лежит нарушение функции яичников, проявляющееся стойкой ановуляцией (отсутствием овуляции) или ее нерегулярностью.
Нормализация нарушенных функций приводит к наступлению беременности в 70-80% случаев эндокринного бесплодия. В остальных случаях в настоящее время перспективным считается устранение эндокринного бесплодия методом ЭКО. У каждой третьей бесплодной женщины причина бесплодия кроется в патологии эндокринной системы.
Причины
Ановуляция может возникать при заинтересованности центральной нервной и иммунной систем, желез внутренней секреции, репродуктивных органов-"мишеней". Ановуляция, ведущая к эндокринной форме бесплодия, может развиваться в результате:
- Гипоталамо-гипофизарной дисфункци. Обычно наблюдается после черепно-мозговых травм и травм грудной клетки, при опухолях гипоталамо-гипофизарной области и сопровождается гиперпролактинемией. Увеличение секреции пролактина ведет к торможению циклической продукции ЛГ и ФСГ гипофизом, угнетению функций яичников, редким менструациям (по типу олиго- и опсоменореи), развитию стойкой ановуляции и эндокринного бесплодия.
- Гиперандрогении яичникового генеза. Присутствие в организме женщины небольшого количества андрогенов – мужских половых гормонов необходимо для полового созревания и правильного функционирования яичников. Усиленная секреция андрогенов может осуществляться яичниками либо надпочечниками, а иногда обеими железами одновременно. Чаще всего гиперандрогения у женщин сопровождает синдром поликистозных яичников, вызывая эндокринное бесплодие, ожирение, гирсутизм, кровотечения, олиго- и аменорею, двустороннее поражение яичников с изменением их морфологической структуры.
- Надпочечниковая гиперандрогения. Чаще развивается в результате гиперплазии коры надпочечников с вторичным вовлечением яичников (вторичный поликистоз яичников).
- Нарушений функции щитовидной желез. Течение гипотиреоза и диффузного токсического зоба нередко сопровождается ановуляцией, вторичной гиперпролактинемий, эндокринным бесплодием, невынашиванием беременности, аномалиями плода.
- Дефицита эстрогенов и прогестерона (при недостаточности лютеиновой фазы. Недостаток женских половых гормонов вызывает неполноценную секреторную трансформацию эндометрия, изменение функции маточных труб, препятствует прикреплению плодного яйца в полости матки. Это приводит к невынашиванию беременности или эндокринному бесплодию.
- Тяжелых соматических патологий (цирроза, гепатитов с выраженным повреждением клеток печени, туберкулеза, аутоиммунных и системных заболеваний соединительной ткани, злокачественных новообразований различной локализации и т. д.).
- Ожирения или недостатка жировой ткани. Жировая ткань в организме также выполняет эндокринную функцию, оказывая влияние на метаболические процессы в тканях, в т. ч. репродуктивной системы. Избыток жировых отложений вызывает гормональный дисбаланс, нарушение менструальной функции и развитие эндокринного бесплодия. В то же время, ограничение потребления жиров или резкая потеря массы тела нарушают нормальное функционирование яичников.
- Синдрома резистентных яичников(синдрома Сэвиджа). В основе синдрома лежит нарушение гипофизарно-яичниковой связи - нечувствительность рецепторного аппарата яичников к гонадотропинам, стимулирующим овуляцию, что проявляется аменореей, эндокринным бесплодием при нормально развитых половых признаках и высоком уровне гонадотропных гормонов. Повреждение яичников могут вызывать инфицирование вирусами краснухи, гриппа, патология ранее развивавшейся беременности, авитаминоз, голодание, стрессовые ситуации.
- Преждевременной менопаузы (синдрома истощенных яичников. Вторичная аменорея, возникающая у молодых женщин до 35 - 38 лет, вызывает характерные для климактерического синдрома изменения и ведет к эндокринному бесплодию.
- Заболеваний, связанных с мутациями половых хромосом. При патологиях, вызванных хромосомными аномалиями, наблюдается недостаточность женских половых гормонов, половой инфантилизм, первичная аменорея и эндокринное бесплодие (синдромы Марфана, Тернера).
Симптомы эндокринного бесплодия
Основными проявлениями эндокринного бесплодие являются невозможность наступления беременности и отклонения в менструальном цикле. Менструации могут наступать с задержками различной выраженности (от недели до полугода), сопровождаться болезненностью и обильными выделениями либо отсутствовать совсем (аменорея). Нередко отмечаются мажущие кровянистые выделения в межменструальный период.
У 30% пациенток с эндокринной формой бесплодия менструальные циклы носят ановуляторный характер и по своей продолжительности соответствуют нормальному менструальному циклу (21-36 дней). В таких случаях речь идет не о менструации, а о менструальноподобном кровотечении.
У пациенток отмечаются боль в нижних отделах живота или пояснице, выделения из половых путей, диспареуния, циститы. Могут наблюдаться напряжение и тяжесть в молочных железах, галакторея (выделения молозива из сосков), связанные с повышением уровня пролактина. Характерен синдром предменструального напряжения – ухудшение состояния накануне менструации. При гиперандрогении, сопровождающей эндокринное бесплодие, развиваются акне, гирсутизм или гипертрихоз, алопеция. Наблюдаются колебания артериального давления, развитие ожирение или похудание, образование стрий на коже.
Диагностика
При сборе анамнеза у пациенток с эндокринным бесплодием уточняется время начала менструаций, их обильность, болезненность, наличие в анамнезе (в т. ч. матери пациентки) нарушений менструальной функции, наличие и длительность отсутствия беременностей, при наличии – исход и осложнения беременностей. Необходимо выяснить, проводились ли ранее гинекологические операции и манипуляции, тип и длительность использования контрацепции. Общий осмотр включает оценку роста пациентки, наличия ожирения, вирилизма, развития молочных желез и вторичных половых признаков.
- Консультация гинеколога. При гинекологическом осмотре выясняют форму и длину влагалища и матки, состояние шейки матки, параметрия и придатков. По данным общего и гинекологического осмотров выясняются такие причины эндокринного бесплодия, как половой инфантилизм, поликистоз яичников и др.
- Тесты функциональной диагностики. Оценку гормональной функции яичников и наличие овуляции при эндокринном бесплодии определяют с помощью функциональных тестов: построения и анализа базальной температурной кривой, мочевого теста на овуляцию, ультразвукового мониторинга созревания фолликула и контроля овуляции.
По графику базальной температуры определяется наличие или отсутствие свершения овуляции. Базальная температурная кривая отражает уровень постовуляторной выработки яичниками прогестерона, подготавливающего эндометрий матки к имплантации оплодотворенной яйцеклетки. Базальная кривая строится на основе показателей утренней температуры, измеряемой ежедневно в одно и то же время в прямой кишке. При овуляторном цикле график температуры двухфазный: в день овуляции ректальная температура падает на 0,2-0,3°С, а во второй фазе цикла, продолжающейся от 12 до 14 дней, поднимается в сравнении с температурой первой фазы на 0,5-0,6 °С. Ановуляторный менструальный цикл характеризуется монофазной температурной кривой (стойко ниже 37 °С), а недостаточность лютеиновой фазы проявляется укорочением второй фазы цикла менее 11-12 дней.
- Мониторинг овуляции. Подтвердить или опровергнуть факт совершения овуляции можно с помощью определения уровня прогестерона в крови и прегнандиола в моче. При ановуляторном цикле эти показатели во второй фазе крайне низки, а при недостаточной лютеиновой фазе - снижены в сравнении с овуляторным менструальным циклом. Проведение теста на овуляцию позволяет определить увеличение концентрации ЛГ в моче за 24 часа до совершения овуляции. Ультразвуковой мониторинг фолликулогенеза дает возможность проследить созревание в яичнике доминантного фолликула и высвобождение из него яйцеклетки.
- Исследование соскоба эндометрия. Отражением функционирования яичников служит состояние эндометрия матки. В соскобе или биоптате эндометрия, взятого за 2-3 дня до ожидаемой менструации, при ановуляции и эндокринном бесплодии обнаруживается гиперплазия разной степени выраженности (железисто-кистозная, железистая, полипоз, аденоматоз) или секреторная недостаточность.
- Гормональные исследования. Для выяснения причин эндокринного бесплодия определяют уровни ФСГ, эстрадиола, ЛГ, пролактина, ТТГ, тестостерона, Т3, Т4, ДЭА-С (дегидроэпиандростерон-сульфата) на 5-7-й день в течение нескольких менструальных циклов.
- Гормональные пробы. Проведение гормональных проб позволяет уточнить состояние различных звеньев репродуктивной системы при эндокринном бесплодии. Механизм проведения данных проб заключается в измерении уровня собственных гормонов пациентки после приема определенных стимулирующих гормональных препаратов.
- Инструментальная диагностика. При необходимости уточнения причин эндокринного бесплодия проводится рентген черепа, УЗИ щитовидной железы, яичников, надпочечников, диагностическая лапароскопия.
Диагноз эндокринного бесплодия женщине устанавливается только после исключения мужского фактора бесплодия (наличие нормальной спермограммы), а также патологии со стороны матки, иммунологической и трубной форм бесплодия.
Лечение эндокринного бесплодия
Гормональная стимуляция
Первый этап лечения эндокринного бесплодия включает нормализацию нарушенных функций эндокринных желез (коррекцию сахарного диабета, ожирения, деятельности надпочечников, щитовидной железы, удаление опухолей и т. д.). В дальнейшем проводится гормональная стимуляция созревания доминантного фолликула и овуляции. Для стимуляции овуляции назначается препарат кломифен цитрат, вызывающий увеличение секреции гипофизом фолликулостимулирующего гормона. Из наступивших после стимуляции кломифен цитратом беременностей 10% - многоплодные (чаще двойни и тройни).
В случае отсутствия беременности в течение 6 овуляторных циклов при стимуляции кломифен цитратом прибегают к лечению гонадотропинами: ЧМГ (человеческим менопаузальным гонадотропином), р-ФСГ (рекомбинантным фолликулостимулирующим гормоном), и ХГЧ (хорионическим гонадотропином человека). Лечение гонадотропинами повышает частоту наступления многоплодной беременности и развития побочных эффектов.
Хирургическое лечение
В большинстве случаев эндокринное бесплодие поддается гормональной коррекции, в остальных показано оперативное вмешательство. При синдроме поликистозных яичников прибегают к их клиновидной резекции лапароскопическим методом или лапароскопической термокаутеризации. После проведения лапароскопической термокаутеризации наблюдается наивысший процент наступления беременностей – от 80 до 90% случаев, т. к. исключается образование спаек в малом тазу.
Методы ВРТ
При эндокринном бесплодии, отягощенном трубно-перитонеальным фактором или снижением фертильности спермы, показано проведение метода экстракорпорального оплодотворения (ЭКО) с пересадкой готовых к развитию эмбрионов в полость матки. Добиться наступления и вынашивания беременности у женщин с эндокринным бесплодием возможно только при комплексном решении данной проблемы.
Прогноз
Сегодня эндокринное бесплодие не является приговором. Современная гинекология и эндокринология совместными усилиями успешно лечат 80% пациенток, применяя только медикаментозные методы. Если произошло восстановление овуляции и нет других факторов бесплодия, более 50% женщин беременеет на протяжении первых шести циклов стимулирующей гормональной терапии. Менее благоприятные результаты от медикаментозной терапии при эндокринном бесплодии, вызванном дисфункцией гипоталамо-гипофизарной регуляции.
Сразу после наступления беременности устанавливается тщательный контроль за ее развитием, госпитализация пациентки проводится при признаках самопроизвольного прерывания беременности. Нередко отмечаются дискоординация и слабость родовой деятельности.
Профилактика
Заботиться о профилактике эндокринных форм бесплодия необходимо с детского возраста. Уменьшение и предупреждение детских инфекций, хронического тонзиллита, ревматизма, гриппа, токсоплазмоза в детском и подростковом возрасте позволит избежать нарушений функции яичников и процессов гипоталамо-гипофизарной регуляции.
Превентивное значение имеет правильное эмоциональное и физическое воспитание девочек, т. к. функция яичников нередко страдает вследствие умственного перенапряжения, психологических и сексуальных травм. Неоспорим тот факт, что часто эндокринное бесплодие развивается после патологических родов, прерывания беременности, интоксикаций, воспалительных инфекций женской репродуктивной сферы, поэтому следует уделять внимание профилактике данных состояний.
Правильное ведение беременности, разумное использование некоторых лекарственных средств, в особенности гормонов во время беременности, помогут избежать врожденной гипофункции яичников и гиперплазии коры надпочечников у девочек.
Ановуляторный цикл
Ановуляторный цикл – это монофазный менструальный цикл, характеризующийся отсутствием овуляции и фазы развития желтого тела, с сохранением регулярности и ритмичности маточных кровотечений. В гинекологии выделяются состояния, сопровождающиеся физиологической ановуляцией (в периоды возрастных перестроек организма), и патологический ановуляторный цикл при бесплодии. В диагностике ановуляторного цикла используются физиологические тесты, трансвагинальное УЗИ, исследование соскоба эндометрия. При выявлении ановуляторного цикла лечение направлено на ликвидацию функционального бесплодия и подавление чрезмерной пролиферации эндометрия. Прогноз обусловлен причинами, вызвавшими монофазный цикл.

Ановуляторный цикл является однофазным, поскольку в нем отсутствует последовательная смена фаз, характерная для нормального менструального цикла. Практически весь ановуляторный цикл занимает фаза пролиферации, которая сменяется десквамацией и регенерацией эндометрия. При этом совершенно отсутствует секреторная фаза, обычно наступающая после овуляции в связи с развитием желтого тела. В отличие от дисфункциональных ановуляторных маточных кровотечений ановуляторный цикл характеризуется циклическими менструальноподобными кровотечениями.
У практически здоровых женщин в репродуктивном возрасте ановуляторный цикл наблюдается сравнительно редко (1-3%) и может чередоваться с овуляторным циклом. Ановуляция бывает обусловлена, к примеру, сменой климата при переезде в другой географический регион. Наиболее частыми физиологическими причинами ановуляторного цикла являются процессы возрастных изменений в женском организме – половое созревание и угасание репродуктивной функции (климакс). Как физиологический процесс, ановуляция в сочетании с аменореей характерна для беременности и послеродовой лактации. В случае возобновления ритмичных кровотечений у 40-50% кормящих женщин цикл имеет однофазный ановуляторный характер.
Как патологию, требующую коррекции, ановуляторный цикл клиническая гинекология рассматривает при бесплодии или маточных кровотечениях, вызванных нарушением фолликулогенеза, отсутствием овуляции и лютеиновой фазы. Причинами патологического ановуляторного цикла, как правило, являются:
- Нарушения гипоталамо-гипофизарной регуляции. Проявляются недостаточностью выработки ФСГ, приводящей к несозреванию фолликула и его неспособности к овуляции; недостаточностью ЛГ; изменением соотношения половых гормонов, иногда - избыточной продукцией пролактина гипофизом.
- Дисфункция яичников и других желез. Ановуляторный цикл может быть связан с воспалением яичников или придатков (аднексит), нарушением энзимной трансформации половых стероидов в яичниках, функциональными нарушениями в щитовидной железе или корковом слое надпочечников, нарушениями полового развития.
- Прочие причины: инфекции и интоксикации, нервно-психические расстройства, авитаминоз, другие нарушения алиментарного характера, врожденные пороки репродуктивной системы, генетической патологии.
Патогенез
В процессе ановуляторного цикла в яичниках могут наблюдаться различные по характеру и продолжительности периоды роста и обратного развития фолликула. Кратковременная ритмическая персистенция зрелого фолликула сопровождается гиперэстрогенией; атрезия невызревшего фолликула - относительной монотонной гиперэстрогенией. Наиболее типичен для ановуляторного цикла избыток действия эстрогенов, не сменяемый влиянием гестагенного гормона прогестерона. В отдельных случаях ановуляторный цикл протекает с гипоэстрогенией. В зависимости от уровня эстрогенного влияния развиваются изменения эндометрия различного характера – от гипоплазии до чрезмерной пролиферации – гиперплазии и полипоза.
Развитие менструальноподобного кровотечения при ановуляторном цикле, как правило, обусловлено спадом гормонального влияния, вызванного атрезией фолликулов. В функциональном слое эндометрия развиваются явления транссудации, кровоизлияния, участки некроза. Поверхностные слои эндометрия частично распадаются, что сопровождается кровотечением. При отсутствии отторжения эндометрия кровотечение развивается вследствие диапедеза эритроцитов через стенки сосудов. Иногда спада гиперэстрогении не происходит, и экскреция эстрогенов с мочой остается относительно стабильной весь ановуляторный цикл (от 13 до 30 мкг/сутки).
В пубертате, когда происходит становление менструальной функции, ановуляторный цикл обусловлен отсутствием необходимого уровня лютеинизирующего и лютеотропного гормонов, синтез которых достигает пика к 15 —16 годам. Схожие изменения, но в обратном порядке, развиваются при угасании репродуктивной функции: отмечается нарушение циклической секреции и увеличение гонадотропного влияния. Чередование овуляторных и ановуляторных циклов в климактерическом периоде сменяется изменением длительности цикла и характера менструаций.

Симптомы ановуляторного цикла
Клинически ановуляторный цикл может проявляться по-разному. Возникающее при ановуляторном цикле менструальноподобное кровотечение может не отличаться от обычной менструации по регулярности и количеству теряемой крови.
При гиперэстерогении кровотечение сопровождается длительными и обильными выделениями крови по типу меноррагии. В этом случае при двуручном исследовании обнаруживается увеличенная матка плотноватой консистенции с размягченной шейкой и приоткрытым внутренним зевом. Обильные кровотечения в итоге приводят к развитию анемии.
Для гипоэстрогении, напротив, характерны укороченные и скудные менструальные кровотечения. При влагалищном обследовании определяется уменьшенная матка, имеющая длинную коническую шейку, закрытый внутренний зев, узкое влагалище. Ановуляторный цикл у женщин репродуктивного возраста сопровождается невозможностью наступления беременности – гормональным бесплодием, в связи с чем пациентки обычно и обращаются к гинекологу.
Простейшим методом дифференциации овуляторного и ановуляторного циклов является определение ректальной (базальной) температуры (БТ). Для нормального овуляторного цикла характерно увеличение БТ в прогестероновую фазу. При ановуляторном цикле определяется однофазная температура.
- Функциональные тесты. Выраженное эстрогенное влияние в случае ановуляторного цикла обнаруживается с помощью функциональных тестов (положительный феномен папоротника и симптом «зрачка» в течение всего цикла), кольпоцитологических данных.
- УЗИ органов малого таза. Признаком ановуляционного менструального цикла при динамическом УЗИ яичников является отсутствие доминантного фолликула.
- РДВ. Решающим критерием определения ановуляторного цикла служит проведение диагностического выскабливания полости матки накануне менструации с гистологическим исследованием соскоба. Отсутствие в соскобе секреторных изменений эндометрия подтверждает наличие ановуляторного цикла.
- Гормональные исследования. Для выяснения этиологических предпосылок ановуляторного цикла проводится исследование гормонов гипоталамо-гипофизарной системы, щитовидной железы, коры надпочечников. Учитывая возможное чередование ановуляторного и овуляторного циклов, для окончательной диагностики проводится динамический контроль в течение полугода.

Лечение ановуляторного цикла
Поскольку стойкий ановуляционный цикл сопровождается бесплодием и выраженными пролиферативными изменениями эндометрия, основной задачей лечения является стимуляция овуляции и подавление чрезмерной пролиферации. Лечением ановуляторного цикла занимается гинеколог-эндокринолог.
Гормональную терапию ановуляторного цикла проводят прерывистыми циклами в зависимости от степени эстрогенной насыщенности. Для постадийной стимуляции правильного менструального цикла после предварительного выскабливания эндометрия назначаются препараты гонадотропного влияния на 3—6 месяцев с 11 по 14 день. За 6-8 дней до менструации подключают внутримышечные инъекции гестагенов. При ановуляторном цикле, протекающем с гиперэстрогенией и чрезмерной пролиферацией, в течение нескольких циклов показаны синтетические прогестины (с 5 по 25 день цикла).
При яичниковой недостаточности и гипоэстрогении используются эстрогенные препараты в малых дозах, стимулирующие трансформацию слизистой матки, функцию яичников, рост и развитие фолликула. Если причиной ановуляторного цикла является хронически протекающее воспаление придатков, проводится комплексное лечение аднексита, назначается витамин С, участвующий в синтезе стероидов и способствующий восстановлению овуляции.
С целью индукции овуляции при ановуляторном цикле назначается непрямая электростимуляция гипоталамо-гипофизарной области путем эндоназального электрофореза, электростимуляции шейки матки и т. д. Проводят гормональную стимуляцию овуляции. При гиперпролактинемии назначают агонисты дофаминовых рецепторов. Лечения физиологической ановуляции в периоды становления менструации, лактации, климакса не требуется.
Прогноз и профилактика
При правильно разработанном и проводимом лечении ановуляторного цикла беременность наступает у 30-40% женщин. Если добиться беременности не удается, женщинам рекомендуется прибегнуть к вспомогательным репродуктивным технологиям по программе ЭКО. В случае отсутствия у пациентки собственных зрелых яйцеклеток искусственное оплодотворение осуществляют с донорской яйцеклеткой, после чего проводят подсадку эмбриона в полость матки. Возможно использование донорского эмбриона.
Для профилактики ановуляторного цикла требуется уделять повышенное внимание здоровью девушек-подростков, полноценному питанию, рациональному режиму деятельности и отдыха, своевременному лечению генитальной и экстрагенитальной патологии; предупреждение инфекций, токсического воздействия на производстве.
1. Патофизиологическая характеристика нарушений менструального цикла/ Л.Е. Беляева, В.И. Шебеко, С.Н. Занько. - 2004.
2. Ановуляторное бесплодие: оптимизация диагностики и алгоритмов лечения/ Тихомиров А.Л., Манухин И.Б., Геворкян М.А., Манухина Е.И., Казенашев В.В.// РМЖ. Мать и дитя. - 2017.
3. Принципы терапии ановуляторного бесплодия у больных гипоталамическим синдромом/ Н. В. Артымук// Мать и дитя в Кузбассе. - 2003.
Гормональные причины ановуляции и дисфункции яичников. Эндокринные нарушения
Ряд эндокринных расстройств может приводить к дисфункции яичников посредством нарушения деятельности гипоталамо-гипофизарно-яичниковой системы. К примеру, при гиперпролактинемии происходит подавление секреции люлиберина. Точно так же повышенная активность ТРГ у женщин с гипотиреозом в конечном счете приводит к уменьшению пульсирующего выброса люлиберина вследствие непосредственного стимулирующего действия ТРГ на секрецию пролактина.
Гипертиреоз может привести к различным нарушениям менструаций: от частых тяжелых кровотечений до аменореи.
Врожденная гиперплазия надпочечников как причина ановуляции и дисфункции яичников. У женщин как с классической, так и с поздно проявившейся ВГН возможны нарушения функций яичников, подобные тем, что возникают при СПКЯ. Нарушения менструаций у этих женщин первоначально объяснялись подавлением синтеза глюкокортикоидов в надпочечниках, приводящим к подавлению гипоталамо-гипофизарно-яичниковой системы.
Отмечены, особенно при классической врожденной гиперплазии надпочечников (ВГН), признаки яичниковой гиперандрогении, аналогичные СПКЯ, даже при адекватном подавлении функции надпочечников с использованием дексаметазона.
Считают, что перинатальное воздействие повышенного количества андрогенов у женщин с врожденной гиперплазие надпочечников (ВГН) приводит к гиперсекреции ЛГ в ответ на стимуляцию люлиберином в пубертатном периоде. Это ведет к развитию яичниковой гиперандрогении, независимо от подавления чрезмерного синтеза андрогенов в надпочечниках. Об аналогичных расстройствах сообщают и при поздно проявившейся ВГН.
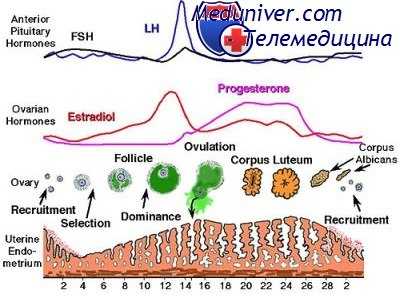
Дефекты лютеиновой фазы как причина ановуляции и дисфункции яичников. Дефект лютеиновой фазы — объединяющее понятие, вызывающее споры о правомерности его существования. Суть состоит в неправильном развитии эндометрия в лютеиновой фазе, что приводит к ослаблению способности эндометрия к имплантации эмбриона и ранним выкидышам. Качественный или количественный дефицит прогестерона — основной фактор патологического развития эндометрия. Вероятно, существует два варианта нарушений.
• Короткая лютеиновая фаза (менее 10 дней). Обычно ее идентифицируют с помощью определения количества ЛГ в моче или построения графика БТТ. Это вторичное подавление пульсирующей секреции люлиберина, приводящее к неадекватной лютеинизации и снижению продукции прогестерона. Короткую лютеиновую фазу встречают вместе с другими эндокринными нарушениями (например, гиперпролактинемией или гипотиреозом), а также во время гипоталамо-гипофизарной супрессии, сопровождающей лактационную аменорею, при использовании стероидных контрацептивов и интенсивных физических нагрузках. Устранение первопричины обычно приводит к нормализации лютеиновой фазы.
• Нарушение развития эндометрия. Гистологические исследования эндометрия показывают, что развитие его запаздывает на 2 дня или больше по сравнению с нормальной хронологией. Это состояние часто не зависит от продолжительности лютеиновой фазы. Такой вариант дефекта лютеиновой фазы, как выяснилось, возникает из-за недостаточной секреции прогестерона или неадекватного ответа эндометрия на прогестерон.
Хотя этиология до конца не изучена, этот дефект обычно возникает на фоне повышенной концентрации гормонов, что сопровождает стимуляцию яичников экзогенными гонадотропинами при терапии аналогами люлиберина (или без нее).
Однако роль дефекта лютеиновой фазы в бесплодии остается спорной. Исследования этой проблемы продемонстрировали значительную распространенность дефекта лютеиновой фазы у женщин фертильного возраста, имеются разногласия относительно диагностических критериев. Гистологические исследования эндометрия, взятого при повторных биопсиях, часто неинформативны, а результаты слишком вариабельны у разных патологов. Аналогичным образом не достигнуто согласие по вопросу о нормальных показателях содержания прогестерона сыворотки крови.
Наконец, недостаточная ясность результатов исследования эффекта от терапии прогестероном породила сомнения о важности дефекта лютеиновой фазы как причины бесплодия.
Этот феномен может возникать параллельно (по времени) с периовуляторным приемом НПВС, приводящим к отмене вызываемого простагландинами разрыва фолликула. В других случаях это происходит при инъекциях неадекватных доз гонадотропина хорионического с целью индукции овуляции. Кроме ятрогеных случаев, этиология точно неизвестна, нет общепринятого алгоритма лечения, спорными представляются диагностические критерии, которые широко варьируют и в части случаев основываются на различных подходах. В нашей стране только 8% работающих в университетских центрах врачей с сертификатами по репродуктивной эндокринологии проводят обследования с целью верификации данного диагноза.
Читайте также:
- Влияние пенициллина и гризина на глаза
- Реакция гипоталамуса на гипоксию. Морфология ядер гипоталамуса при кислородном голодании
- Синдромы с полипозом толстой кишки - диагностика
- Причины и профилактика тромбоэмболии легочной артерии. Бронхо-пульмональный артериальный шунт
- КТ, МРТ при гипоплазии улитки
