Хирургическое лечение эндогенной интоксикации при перитоните. Консервативное лечение эндогенной интоксикации при перитоните.
Добавил пользователь Morpheus Обновлено: 29.01.2026
В работе на основе изучения в динамике уровня токсических продуктов, степени мембранодестабилизирующих явлений в плазме крови и лимфе определена роль основного воспалительного очага и функционального состояния печени в прогрессировании эндотоксикоза при различной тяжести острого перитонита. Исследования показали, что при остром перитоните после санации брюшной полости (хирургического лечения) уменьшение уровня токсических продуктов в плазме крови происходит быстрее, чем в лимфе, что обусловлено быстрым восстановлением функциональной активности печени благодаря регрессу мембранодестабилизирующих явлений в ее тканях при сохранении их значительного уровня в тканях брюшины и кишечника. При нарастании воспалительного процесса в брюшной полости (без хирургического лечения) отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.

1. Брискин Б.С., Яровая Г.А., Савченко З.И. Иммунные и ферментные нарушения у больных с острым панкреатитом // Хирургия. Журнал им. Н.И. Пирогова. – 2001. – № 7. – С. 21–24.
2. Глушко В.А. Неотложные хирургические вмешательства при нагноившихся постнекротических кистах поджелудочной железы // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 126–127.
3. Кифус Ф.В., Пахомова Г.В., Береснева Э.А., Дубров Э.Я. Выбор лечебной тактики при забрюшинных флегмонах на основании клинико-экспериментальных исследований // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 42–43.
4. Купцова М.Ф., Васильков В.Г., Бегунов В.А., Чернова Т.В. Интенсивная терапия гнойно-септических заболеваний // Материалы четвертого Всероссийского съезда анестезиологов и реаниматологов. – М., 1994. – С. 203–204.
5. Малярчук В.И., Корольков А.Ю., Иванов В.А. Малоинвазивные вмешательства при осложненном панкреонекрозе // Материалы III конгресса Ассоциации хирургов имени Н.И. Пирогова. – М., 15–17 октября 2001 г. – С. 85–86.
6. Batalik B., Mydlo J. Peroperative peritoneal lavage and intra-abdominal instillation of antibiotics in an experiment // Rozhl. Chir. – 1991, mar. – Vol. 70. – № 5. – P. 300–303.
7. Cuesta M.A., Doblas M., Castaneda L. Sequential abdominal Reexplorations with Zipper Technique // World. J. Surg. – 1991. – Vol. 15. – P. 74–80.
8. Wahl W., Minkus A., Junginger T. Prognostisch relevante Faktoren bei der intraabdominalen Infektion // Langenbecks. Arch. Chir. – 1992. – Bd. 377 (4). – Р. 237–243.
Эндогенная интоксикация является ведущим синдромом у 85 % больных гнойно-септическими заболеваниями [4]. Одной из основных причин развития эндогенной интоксикации является перитонит. Актуальность гнойного воспаления брюшины перед современной хирургией обусловливает то, что оно является главенствующим осложнением многих заболеваний и встречается достаточно часто [1, 2, 5]. Кроме того, при остром перитоните сохраняется достаточно высокая летальность ‒ 20–30 %, которая в терминальной стадии заболевания достигает 50–70 %, а при генерализации инфекции и развитии полиорганной недостаточности 75,8–100,0 % [3, 6–8]. Поэтому особую значимость приобретает изучение факторов прогрессирования эндогенной интоксикации при остром перитоните с целью своевременного патогенетического влияния на них.
Цель работы. В эксперименте на основе изучения в динамике уровня токсических продуктов, степени мембранодестабилизирующих явлений в плазме крови и лимфе определить роль основного воспалительного очага и функционального состояния печени в прогрессировании эндотоксикоза при различной тяжести острого перитонита.
Материалы и методы исследования
В основу работы положены экспериментальные исследования на взрослых беспородных собаках обоего пола, разделенных для решения поставленных задач на 2 группы. Первая группа (n = 16) – животным моделировали острый перитонит по способу А.П. Власова (1991) путем введения каловой взвеси в брюшную полость, через сутки проводили лапаротомию, оценивали выраженность воспалительного процесса в брюшной полости, количество экссудата, макроскопическое состояние кишечника и печени, забирали образцы ткани печени и кишечника. Брюшную полость санировали. Вторая группа (n = 12) – животным моделировали острый перитонит по той же методике, однако брюшную полость не санировали.
В контрольные сроки проводили забор крови и лимфы, биопсию тканей печени и кишечника, исследовали выраженность эндогенной интоксикации по содержанию ее маркеров в плазме крови и лимфе, активность перекисного окисления липидов (ПОЛ), фосфолипазы А2 и супероксиддисмутазы в плазме крови, лимфе, тканях печени и кишечника.
В послеоперационном периоде животным проводилась антибактериальная (внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела) и инфузионная (внутривенные введения 5 % раствора глюкозы и 0,89 % раствора хлорида натрия из расчета 50 мл/кг массы животного) терапия.
Эксперименты поставлены под внутривенным наркозом с использованием тиопентал-натрия из расчета 0,04 г/кг массы тела животного. Научные изыскания проводились в соответствии с этическими требованиями к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1987 г.) и Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г.) и одобрены локальным этическим комитетом.
Уровень молекул средней массы (МСМ) в сыворотке крови и лимфы измеряли на спектрофотометре СФ-46 при длине волны 254 и 280 нм. Для характеристики физико-химических свойств альбумина оценивали эффективную и общую концентрацию альбумина (ЭКА и ОКА) в сыворотке крови флуоресцентным методом на специализированном анализаторе АКЛ-01 «Зонд». Резерв связывания альбумина (РСА) определяли по формуле РСА = ЭКА/ОКА; индекс токсичности (ИТ) плазмы – по формуле ИТ = ОКА/ЭКА – 1 (Грызунов Ю.А., Добрецов Г.Е., 1994).
Активность фосфолипазы А2 оценивали по каталитической деятельности фермента потенциометрическим методом. Диеновые и триеновые конъюгаты в липидах определяли спектрофотометрическим методом при длине волны 232 и 275 нм. Содержание малонового диальдегида выявляли в реакции с 2-тиобарбитуровой кислотой. Активность супероксиддисмутазы изучали в реакции с нитросиним тетразолием.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента, корреляционная зависимость оценена с помощью критерия r. Вычисления и построение диаграмм, отражающих динамику изученных показателей, совершали с поддержкой программы Microsoft Excel XP. Применен текстовый процессор Microsoft Word XP.
Результаты исследования и их обсуждение
Экспериментальные исследования показали, что через сутки (первая группа) после введения в брюшную полость каловой взвеси у животных развивался острый перитонит. Животные были вялые, адинамичные, жадно пили воду, у некоторых животных отмечено возникновение рвоты или рвотных движений. Температура тела была субфебрильной. При лапаротомии в брюшной полости имелся мутный с хлопьями фибрина и неприятным запахом выпот, количество которого достигало 114,40 ± 4,15 мл. Петли кишок были увеличены в диаметре за счет содержания в них кишечного содержимого и газа, стенка тонкой кишки была инфильтрирована, с налетом фибрина. Париетальная брюшина гиперемирована, инфильтрирована, с мелкоточечными кровоизлияниями.
В динамике развития патологического процесса отмечалось существенное увеличение в плазме крови содержания токсических продуктов как гидрофильной, так и гидрофобной природы (рис. 1).

Рис. 1. Показатели эндогенной интоксикации плазмы крови общего кровотока при остром перитоните (значения нормы приняты за 100 %). Примечание: здесь и далее: * – достоверность отличия от нормы при p < 0,001
В лимфе содержание токсических продуктов также возрастало. Однако в отличие от данных плазмы крови, где после санации брюшной полости отмечается снижение выраженности эндогенной интоксикации, в лимфе в течение всего эксперимента их уровень сохранялся на высоких цифрах (рис. 2).
При исследовании скорости лимфотока было выявлено снижение значения данного показателя на всех этапах динамического наблюдения. Так, на первые сутки эксперимента он был ниже нормы на 27,3 % (р < 0,05), на третьи – уже на 48,2 % (р < 0,05), а на пятые – на 45,3 % (р < 0,05).
В ходе проведения экспериментальных исследований при остром перитоните нами установлен факт интенсификации процессов перекисного окисления липидов и активации фосфолипазы А2 в динамике патологического процесса в плазме крови и лимфе.

Рис. 2. Показатели эндогенной интоксикации лимфы при остром перитоните (значения нормы приняты за 100 %)
В лимфе содержание продуктов ПОЛ и активность фосфолипазы А2 нарастали до третьих суток заболевания, к концу наблюдения данные показатели стабилизировались. Так, уровень первичных продуктов ПОЛ превышал норму на 68,1–124,5 % (р < 0,05), активность фосфолипазы А2 возрастала на 215,2–714,3 % (р < 0,05), активность супероксиддисмутазы снижалась на 24,5–49,3 % (р < 0,05).
Изучение мембранодеструктивных процессов в тканях кишечника показало, что при остром перитоните содержание первичных и вторичных продуктов перекисного окисления липидов в тканях органа существенно возрастало и было на 51,36–149,24 % (p < 0,001) выше нормы (рис. 3), а активность супероксиддисмутазы была на 28,12–64,23 % (p < 0,001) ниже нормальных значений.

Рис. 3. Динамика молекулярных продуктов липопереокисления в ткани тонкой кишки при остром перитоните на фоне стандартной терапии (ДК – диеновые, ТК – триеновые коньюгаты; МДА – малоновый диальдегид)
В ткани печени также существенно возрастала интенсивность ПОЛ, о чём свидетельствовало увеличение уровней его первичных и вторичных продуктов на фоне снижения активности супероксиддисмутазы более чем в 2 раза. В тканевых структурах органа отмечалась интенсификация фосфолипазы А2. Отметим, что в ткани печени положительная динамика изученных показателей регистрировалась уже с первых суток после проведения хирургического лечения перитонита.
Корреляционный анализ выявил сопряженность эндогенной интоксикации с выраженностью мембранодестабилизирующих явлений в тканевых структурах кишечника и печени. Отметим, что наиболее высокие значения коэффициента корреляции были зафиксированы при анализе взаимосвязи мембранодеструктивных процессов в кишечнике и содержания маркеров эндогенной интоксикации в лимфе, а также мембранодеструктивных процессов в печени и содержания маркеров эндогенной интоксикации в плазме крови.
Следует выделить, что восстановление гомеостатических констант в плазме крови при остром перитоните происходит быстрее, чем в лимфе, что обусловлено быстрым регрессом мембранодестабилизирующих явлений в тканях печени при сохранении их значительного уровня в тканях брюшины и кишечника.
В заключении данной серии экспериментов отметим, что в прогрессировании эндогенной интоксикации при остром перитоните важное значение имеют мембранодестабилизирующие явления не только в тканях брюшины и кишечника, но и печени. При остром перитоните после санации брюшной полости и уменьшения воспалительного процесса в ней происходит быстрое восстановление функциональной активности печени, что приводит к уменьшению уровня токсических продуктов в плазме крови при сохранении относительно высокого их уровня в лимфе.
Во второй группе, как указано выше, санация брюшной полости животным не проводилась, что способствовало прогрессивному течению заболевания с утяжелением клинической, макроскопической и биохимической симптоматики у подопытных животных.
Явления эндотоксикоза в данной группе исследования нарастали в течение всего периода наблюдения. Так, содержание молекул средней массы в плазме крови превышало норму на 125,3–412 % (p < 0,05). Индекс токсичности возрастал относительно нормы от 658,7 % (p < 0,05) на вторые сутки эксперимента до 974,3 % (p < 0,05) – на конечном этапе наблюдения.
В лимфе содержание токсических продуктов также возрастало на всех сроках эксперимента, но прирост (темп) был ниже такового в плазме крови. При исследовании скорости лимфотока было выявлено прогрессивное снижение значения данного показателя на всех этапах динамического наблюдения на 34,4–59,2 % (p < 0,05).
При прогрессировании перитонита регистрировалось динамическое увеличение интенсификации процессов перекисного окисления липидов и активации фосфолипазы А2 в плазме крови и лимфе.
В лимфе содержание продуктов ПОЛ и активность фосфолипазы А2 нарастали в течение всего эксперимента. Так, уровень первичных продуктов ПОЛ превышал норму на 148,3–226,4 % (р < 0,05), активность фосфолипазы А2 возрастала на 812,5–1121,5 % (р < 0,05), активность супероксиддисмутазы снижалась на 52,4–76,3 % (р < 0,05).
Изучение мембранодеструктивных процессов в тканях кишечника показало, что при остром перитоните содержание первичных и вторичных продуктов перекисного окисления липидов в тканях органа существенно возрастало и было на 154,3–235,7 % (p < 0,05) выше нормы, а активность супероксиддисмутазы была ниже нормы на 56,3–78,4 % (p < 0,05).
В ткани печени также прогрессивно возрастала интенсивность ПОЛ, о чем свидетельствовало увеличение уровней его первичных и вторичных продуктов на фоне снижения активности супероксиддисмутазы; отмечалось повышение фосфолипазной активности.
Отметим, что при прогрессировании острого перитонита при отсутствии хирургического лечения динамика содержания токсических продуктов в плазме крови и лимфе, а также в ткани кишечника и печени одинакова.
Таким образом, исследования показали, что при нарастании воспалительного процесса в брюшной полости отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.
1. При остром перитоните после санации брюшной полости (хирургического лечения) уменьшение уровня токсических продуктов в плазме крови происходит быстрее, чем в лимфе, что во многом обусловлено быстрым восстановлением функциональной активности печени благодаря регрессу мембранодестабилизирующих явлений в тканях органа при сохранении их значительного уровня в тканях брюшины и кишечника.
2. При нарастании воспалительного процесса в брюшной полости (без хирургического лечения) отмечается прогрессирующее увеличение мембранодестабилизирующих явлений не только в тканях брюшины и кишечника, но и печени, что сопровождается повышением уровня токсических продуктов в плазме крови и лимфе.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Хирургическое лечение эндогенной интоксикации при перитоните. Консервативное лечение эндогенной интоксикации при перитоните.
Хирургическое лечение эндогенной интоксикации при перитоните. Консервативное лечение эндогенной интоксикации при перитоните.
Хирургическое лечение. При активном вмешательстве на ранних стадиях ЭИ достаточно ликвидировать причину, чтобы прервать дальнейшее развитие эндотоксикоза. При запущенных формах продукты промежуточного обмена накапливаются в сосудистом русле и паренхиматозных органах, вызывая полиорганную недостаточность, поэтому хирургическое устранение очага воспаления и его санация способствуют ликвидации лишь отдельных компонентов ЭИ.
Консервативное лечение больных с ЭИ должно строиться с учетом степени эндотоксикоза (В. К. Гостищев и соавт., 1994). К общим методам воздействия на ЭИ относятся инфузионная терапия, различные способы экстракорпоральной детоксикации (см. выше), гипербарическая оксигенация.
Больному необходимо обеспечить полноценное парентеральное питание. Суточный каллораж должен быть не менее 3000 ккал/ сутки, 2/3 этой потребности рекомендуется обеспечивать за счет концентрированных растворов глюкозы, а 1/3 — за счет жировых эмульсий (20% раствор интралипида, липофундина).
Общий объем вводимой жидкости в период острой интоксикации — 4—5 л/сутки. Из этого количества 2,5—3 литра должно приходиться на кристаллоидные растворы, остальное — коллоиды и белковые препараты крови (плазма, альбумин, протеин). Выбор инфузионно-трансфузионных сред, их комбинация определяются характером волемических нарушений, дефицитом белкового и электролитного состава крови. Коррекцию водно-электролитного состава осуществляют с помощью солевых растворов типа Рингер-Локка. Коррекцию диспротеинемий проводят с помощью белковых гидролизатов, плазмы и протеинов.
Простым и широко используемым методом лечения эндогенной интоксикаци является форсированный диурез, основанный на использовании естественного процесса удаления токсических веществ из организма. Предварительно проводят умеренную гемодилюцию, для чего используют растворы кристаллоидов, низкомолекулярных декстранов, а при гиповолемии — белковые кровезаменители. Один из вариантов водной нагрузки: в/в вводится 1000 мл физиологического раствора, 200 мл 4% раствора бикарбоната натрия и 400 мл реополиг-люкина, затем маннитол из расчета 1 — 1,5 г/кг или 40—80 мг лазик-са; мосле этого продолжают вливание 5% раствора глюкозы, белковых препаратов (плазма крови, раствор альбумина, белковый гид-ролизат) в объеме 1000—1500 мл. Кроме того, в состав трансфузи-онных сред включают растворы хлорида калия (40—60 мл 10% раствора или 100—120 мл 4% раствора дробно), хлорида натрия (50 мл 10% раствора), хлорида кальция (30 мл 10% раствора) для коррекции неизбежной при проведении методики форсированного диуреза потери электролитов. Лечение осуществляется под контролем за почасовым диурезом и ЦВД, электролитным и белковым балансом организма, КЩС, остаточным азотом.

Антибактериальная терапия проводится препаратами широкого спектра действия в сочетании трех препаратов разных групп. При этом учитывается вид микроорганизма и его чувствительность к препарату.
В качестве иммунокоррегируюшей терапии используют иммуномодуляторы: Тактивин (синоним: Т-активин) по 1 мл 0,01% раствора п/к (ежедневно, курс 10—12 инъекций), тималин, взрослым по 5—20 мг ежедневно (30—100 мг на курс), левамизол (обычно 50 мг 3 раза в день в течение 4—5 дней, через 7 дней курс повторяют; или по 150 мг 1 раз/день, курс 5—7 дней), диуцифон по 0,1 г 3—4 раза в день или вводят в/м по 4 мл 5% р-ра (0,2 г) 1 раз в сутки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Хирургическое лечение эндогенной интоксикации при перитоните. Консервативное лечение эндогенной интоксикации при перитоните.
Власов А.П. 1 Чаматкина Е.М. 1 Абрамова С.В. 1 Мелешкин А.В. 1 Ганина Т.В. 1 Болотских В.А. 1 Глухова И.В. 1
В работе представлены результаты клинико-лабораторного исследования 40 больных острым гнойным пельвиоперитонитом, в основной группе которых хирургическое вмешательство выполнялось лапароскопически. Проведена оценка выраженности синдрома эндогенной интоксикации у больных острым пельвиоперитонитом при различных вариантах хирургической тактики и установлена его связь с оксидативным стрессом. Показано, что у больных острым гнойным пельвиоперитонитом вне зависимости от оперативного доступа в раннем послеоперационном периоде расстройства гомеостаза нарастают. Достоверно большие изменения гомеостатических констант возникают у больных, перенесших традиционное лапаротомное вмешательство. Одним из значимых патогенетических механизмов, обусловливающих сравнительно низкие гомеостатические нарушения при малотравматичных оперативных вмешательствах, является их способность вызывать меньшие явления синдрома эндогенной интоксикации и оксидативного стресса.

1. Абрамова С.В., Чаматкина Е.М., Лукьянова Я.С. Расстройства гомеостаза при тазовом перитоните / Актуальные проблемы медицинских наук. Сборник научных трудов III межрегионального студенческого научного форума с участием молодых исследователей. -Саранск. – 2014. – С. 91–93.
2. Балакшина Н.Г., Кох Л.И. Гнойные воспалительные заболевания придатков матки. – Изд-во Lambert Academic Publishing, 2011. — 132 с.
3. Власов А. П., Трофимов В. А., Крылов В. Г. Системный липидный дистресс-синдром в хирургии. – М.: Наука, 2009. – 224 с.
4. Заривчацкий М.Ф., Власов А.П., Куданкин Р.М. Метаболические нарушения у больных острым холецистопанкреатитом // Пермский медицинский журнал. – 2014. – Т. 31. – № 2. – С. 59–67.
5. Marshall J.C. Intra-abdominal infections // Microbes and infection. – 2004. – Vol. 6. – P. 1015-1025.
Гнойный пельвиоперитонит является тяжелой патологией, требующей экстренного лечения, которое позволит минимизировать крайне нежелательные последствия и осложнения со стороны органов малого таза, такие как развитие спаек, возникновение распространенного перитонита, сепсиса. Особенно остро эта проблема стоит у женщин детородного возраста, так как высока вероятность бесплодия, возникновения внематочной беременности. Безусловно, выраженность местных воспалительных явлений во многом зависит и от изменений показателей гомеостаза на организменном уровне [1, 2]. Важнейшим патогенетическим фактором при острых заболеваниях органов брюшной полости, который вносит свой «вклад» в их течение, является синдром эндогенной интоксикации. Его выраженность зависит не только от тяжести гнойно-воспалительного процесса, но и от характера и объема оперативного вмешательства [3, 5]. Бесспорно, применение миниинвазивных вмешательств при острых гнойных воспалительных заболеваниях с клинической точки зрения является наиболее целесообразным [4]. Однако до настоящего времени многие вопросы по особенностям ответной реакции организма на хирургическое воздействие во время операции остаются нерешенными [3].
Целью работы явилось установление выраженности синдрома эндогенной интоксикации у больных острым пельвиоперитонитом при различных вариантах хирургической тактики и определение его связи с оксидативным стрессом.
Материалы и методы исследования
В основу работы положены материалы клинико-лабораторных исследований 40 женщин, больных тазовым перитонитом различной этиологии (эндометрит, сальпингит, оофорит, аднексит, вульвовагинит, цервицит и др.), которым произведена экстренная операция. Хирургическое лечение заключалось в удалении гнойного содержимого из таза, во вскрытии гнойников, промывании (санации) полостей, дренировании малого таза. Объем оперативного вмешательства зависел от степени распространения воспалительного процесса, наличия пиосальпинкса или тубоовариального абсцесса и сопутствующей патологии шейки и тела матки, яичников. При одностороннем гнойном воспалительном образовании маточных труб и яичников их удаляли. Операция производилась в экстренном порядке, а также при отсутствии эффекта от интенсивной антибактериальной и дезинтоксикационной терапии через 18–24 ч после ее начала.
Первую группу (n=20) составили пациенты в возрасте от 17 до 45 лет (средний возраст 27,1±4,4 лет). Вторая группа (n=20) включала пациентов в возрасте от 16 до 43 лет (средний возраст 28,7±5,3 лет). В первой группе больных хирургическое вмешательство осуществлялось лапаротомным оперативным доступом, во второй – малотравматичным лапароскопическим. Рандомизированный подбор больных в группы осуществлялся по возрасту, полу, характеру повреждений, общепринятым лабораторным показателям, выраженности эндогенной интоксикации при поступлении больных в клинику.
В раннем послеоперационном периоде проводили базисную комплексную терапию, которая включала в себя дезинтоксикационный, антибактериальный, обезболивающий компоненты; антигистаминные препараты.
Методы исследования
Больным выполняли общеклинические и биохимические исследования (общий анализ крови и мочи, содержание билирубина, общего белка, сахара, мочевины, креатинина, активность трансаминаз в крови и др.). Кроме этих показателей, в работе использованы следующие методы исследования.
Определяли выраженность эндогенной интоксикации. Содержание молекул средней массы в сыворотке крови измеряли на спектрофотометре СФ-46 при длине волны 250 и 280 нм (Пикуза О.И., Шакирова Л.З., 1994). Для характеристики физико-химических свойств альбумина определяли эффективную и общую концентрацию альбумина в сыворотке крови флуоресцентным методом на специализированном анализаторе АКЛ-01 «Зонд». Рассчитывали резерв связывания альбумина, индекс токсичности плазмы (Грызунов Ю.А., Добрецов Г.Е., 1994).
Показатели интенсивности перекисного окисления липидов (ПОЛ) в эритроцитах: содержание малонового диальдегида (МДА) оценивали в реакции с 2-тиобарбитуровой кислотой. Активность супероксиддисмутазы (СОД) определяли по способности фермента тормозить аэробное восстановление нитросинего тетразолия до формазана (Гуревич В.С. и др., 1990; Досон Р. и др., 1991). Регистрацию каталитической деятельности фосфолипазы А2 проводили титрометрическим методом по мере образования свободных жирных кислот (Трофимов В.А., 1999). Диеновые и триеновые конъюгаты (ДК и ТК) в липидах определяли спектрофотометрическим методом при длине волны 232 и 275 нм.
Обследование больных обеих групп проводилось при поступлении и в динамике послеоперационного периода (1-е, 3-и, 5-е, 7-е и 10-е сутки после операции). Научные разработки проводились при информированном согласии больного в соответствии с международными нравственными требованиями ВОЗ (правила GCP – Good Clinical Practice), предъявляемыми к медицинским исследованиям с участием человека (Женева, 1993). Для получения данных, которые приняты за физиологическую норму, произведены соответствующие исследования у 12 здоровых добровольцев женского пола.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента и χ2.
Результаты исследования и их обсуждение
Проведенная сравнительная клинико-лабораторная характеристика больных при поступлении в клинику не выявила значительных различий по возрасту, полу, сопутствующей патологии, показателям общего анализа крови. Больным проведена экстренная операция, при которой диагностирована гнойно-деструктивная форма различных воспалительных заболеваний внутренних половых органов, главным образом сальпингоофорита, сопровождающихся гнойным тазовым перитонитом.
Для оценки расстройств гомеостаза, в частности эндогенной интоксикации, у больных острым пельвиоперитонитом использован блок физико-биохимических методов исследования, позволяющий определить их на молекулярном и клеточном уровнях. Такой методический подход позволяет оценить «участие» оперативного вмешательства (хирургической агрессии) в модификации метаболических процессов в раннем послеоперационном периоде.
Важнейшим интегральным показателем расстройств гомеостаза является эндоинтоксикация. Нами дана качественная и количественная оценка уровня гидрофильных и гидрофобных токсических продуктов в плазме крови, что позволило провести ее комплексный анализ. Оказалось, что при остром тазовом перитоните до операции эффективная концентрация альбумина уменьшалась на 31,1% (p<0,05), общая концентрация альбумина – на 11,4% (p<0,05), резерв связывающей способности альбумина – на 18,9% (p<0,05). Индекс токсичности плазмы повышался в 2,8 раза (p<0,05). Содержание молекул средней массы при λ=254 и 280 нм в плазме крови было повышено на 61,2 и 77,9% (p<0,05) (рис. 1).
При поступлении у больных острым пельвиоперитонитом диагностировано повышение активности процесса перекисного окисления мембранных липидов. Так, уровень ДК в плазме крови был выше нормы на 35,1% (p<0,05), ТК – на 38,6% (p<0,05), МДА – на 43,3% (p<0,05) (рис. 2). Отмечено снижение энзимного антиоксидантного потенциала, что выражалось, в частности, достоверным уменьшением активности СОД на 13,0% (p<0,05).
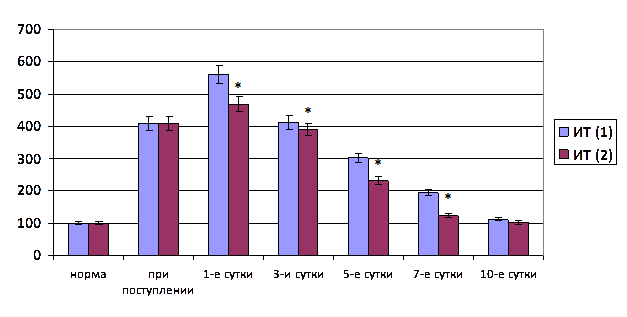
Рис. 1. Динамика индекса токсичности плазмы крови (ИТ) при остром тазовом перитоните на фоне хирургического лечения при лапаротомном (1) и лапароскопическом (2) оперативном доступе (* – достоверность отличия показателя первой и второй групп при р<0,05)
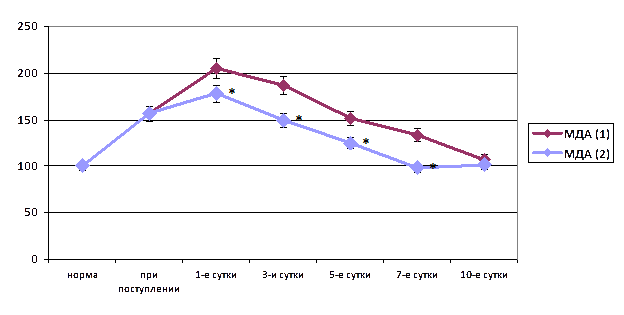
Рис. 2. Динамика малонового диальдегида крови при остром тазовом перитоните на фоне хирургического лечения при лапаротомном (1) и лапароскопическом (2) оперативном доступе (* – достоверность отличия показателя первой и второй групп при р<0,05)
Таким образом, у больных острым пельвиоперитонитом при поступлении в клинику возникают выраженные расстройства гомеостаза, важнейшим компонентом которого является синдром эндогенной интоксикации. Безусловно, немаловажное значение в насыщении организма токсическими веществами имеет процесс перекисного окисления липидов, продукты которого весьма токсичны. Немаловажное значение в развитии и прогрессировании эндогенной интоксикации имеет ее негативное влияние на функциональное состояние главного детоксицирующего органа – печени.
Лабораторными исследованиями выявлено, что в раннем послеоперационном периоде рост токсических продуктов в плазме крови больных, перенесших операцию лапаротомным доступом, сопровождался повышением активности процесса перекисного окисления мембранных липидов. Содержание молекулярных продуктов ПОЛ в плазме крови достоверно повышалось. Так, уровень ДК в первые сутки после операции увеличивался на 56,1% (p<0,05), ТК – на 65,0% (p<0,05), МДА – на 71,8% (p<0,05). Активность супероксиддисмутазы падала на 21,1% (p<0,05) (рис. 3).
У больных этой группы ранний послеоперационный период не сопровождался повышением активности процесса перекисного окисления мембранных липидов. Так, уровень диеновых конъюгатов в первые сутки после операции сохранялся повышенным относительно нормы на 39,4% (p<0,05), триеновых конъюгатов – на 42,7% (p<0,05), МДА – на 49,4% (p<0,05). Снижение активности супероксиддисмутазы было на 14,4% (p<0,05).
В раннем послеоперационном периоде в плазме крови отмечено значительное повышение интенсивности процесса перекисного окисления липидов и активности фосфолипазы. Уровень диеновых конъюгатов был повышен на 37,7% (p<0,05), триеновых конъюгатов – на 48,4% (p<0,05), МДА – на 91,5% (p<0,05). Активность супероксиддисмутазы падала на 23,3% (p<0,05), а фосфолипазы А2 возрастала в 3,7 раза (p<0,05) (рис. 3).
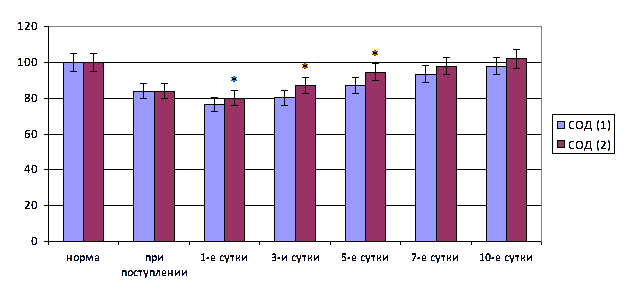
Рис. 3. Динамика активности супероксиддисмутазы в плазме крови при остром тазовом перитоните на фоне хирургического лечения при лапаротомном (1) и лапароскопическом (2) оперативном доступах (* – достоверность отличия показателя первой и второй групп при р<0,05)
Заключение
Полученные результаты оценки расстройств гомеостаза (на примере эндогенной интоксикации) у больных острым пельвиоперитонитом в раннем послеоперационном периоде свидетельствуют об их прогрессировании в первые сутки после вмешательства вне зависимости от характера операции. Одним из ведущих патогенетических механизмов больших гомеостатических расстройств в начальные сроки после операции является оксидативный стресс. В группе больных острым пельвиоперитонитом, которым оперативное вмешательство проведено малотравматичным лапароскопическим доступом, явления оксидативного стресса не нарастали столь стремительно, что и обусловило меньшее увеличение в плазме крови уровня токсических продуктов.
Таким образом, одним из центральных звеньев прогрессирования расстройств гомеостаза — проявления хирургической агрессии при остром тазовом перитоните — является оксидативный стресс. При уменьшении хирургической агрессии, что возможно при применении малотравматичных оперативных вмешательств, указанные патологические процессы проявляются в сравнительно меньшей степени, обусловливая лучшие клинико-лабораторные характеристики течения раннего послеоперационного периода.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Хирургическое лечение эндогенной интоксикации при перитоните. Консервативное лечение эндогенной интоксикации при перитоните.
В настоящий момент перитонит является одной из актуальных проблем в общей хирургии. Летальность при перитоните, по данным ведущих отечественных клиник, составляет от 6,2 до 42,2%, а при послеоперационном перитоните достигает 90-100% [1, 2]. Показатели летальности не имеют тенденции к снижению, несмотря на современные достижения в анестезиологии и хирургии. Проблема лечения перитонита усугубляется неуклонным ростом антибиотикорезистентности возбудителей [8]. В клинической практике для лечения распространенного гнойного перитонита широко применяется комбинированный способ, при котором на первом этапе производится традиционное хирургическое вмешательство, направленное на устранение источника перитонита, на втором - программированные видеоэндоскопические санации брюшной полости. Предшествующими исследованиями [4, 6] было установлено, что данный способ лечения показан больным при наличии абдоминального сепсиса без полиорганной недостаточности. Однако технология выполнения эндоскопических санаций имеет два серьезных недостатка. Во-первых, при промывании брюшной полости под видеоэндоскопическим контролем невозможно удалить плотные напластования фибрина на висцеральной и париетальной брюшине, так как традиционная технология предусматривает использование непрерывной струи антисептического раствора, которая плохо смывает фибрин. Вместе с тем из курса гнойной хирургии хорошо известно позитивное влияние пульсирующей струи антисептика при обработке гнойной полости. В оставленных в брюшной полости фибринозных наслоениях находят убежище микроорганизмы, что приводит к пролонгации перитонита и развитию спаечного процесса.
Во-вторых, применение традиционных антисептиков малоэффективно в связи с кратковременностью их действия и быстрой инактивацией в условиях воспаления [5]. Кроме того, антисептики зачастую оказывают альтерирующее действие на мезотелиальный покров и вызывают в дальнейшем спайкообразование [3, 9]. Указанное выше в значительной степени относится к гипохлориту натрия, одному из наиболее часто используемых антисептиков. К его преимуществам относятся широкий спектр действия (включая анаэробы, аэробы и грибки), отсутствие резистентности, потенцирование действия антибактериальных веществ на микробную клетку, низкая стоимость. Однако все это нивелируется нестойкостью данного вещества во внешней среде, повреждением мезотелия брюшины [3, 5]. Поэтому актуальной на сегодняшний день является оптимизация видеоэндоскопических санаций брюшной полости путем применения пульсирующей струи и создания новых форм антисептиков, которые оказывают более длительное действие, устойчивы во внешней среде и не повреждают мезотелиальный покров брюшины.
Цель исследования - улучшить результаты лечения больных распространенным гнойным перитонитом путем оптимизации методики видеоэндоскопических санаций брюшной полости.
Материал и методы
Объем комплексного лечения распространенного перитонита включал: предоперационную подготовку, направленную на коррекцию волемических нарушений; оперативное вмешательство для ликвидации источника перитонита, устранение синдромов интраабдоминальной гипертензии, системной воспалительной реакции, недостаточности кишечной стенки; интенсивную терапию в послеоперационном периоде по программе лечения абдоминального сепсиса.
До операции в обеих группах определяли тяжесть состояния больных по шкале APACHE II, степень эндогенной интоксикации и рассчитывали Мангеймский индекс перитонита (МИП).
Эффективность лечения в ближайшем послеоперационном периоде оценивали по динамике системного эндотоксикоза, моторно-эвакуаторной функции кишечника, частоте осложнений и летальности, а в отдаленном периоде - по качеству жизни больных. Для оценки выраженности эндотоксикоза определяли динамику лейкоцитарного индекса интоксикации (ЛИИ), уровня молекул средней массы (МСМ) на 1, 4, 7, 10, 14-е сутки послеоперационного периода. Через 24-48 ч после первого этапа операции при видеоэндоскопических санациях определяли сроки ремоделирования брюшины после снятия с нее фибринозных наслоений. О состоянии моторно-эвакуаторной функции кишечника судили на основании данных клинического и ультразвукового методов исследования. При клиническом обследовании учитывали время восстановления перистальтики, отхождения газов, потребность в медикаментозной стимуляции кишечника. При УЗИ на 3-и сутки послеоперационного периода определяли характер перистальтики, диаметр петель кишечника, наличие жидкости в брюшной полости. На 10-е сутки выявляли ультразвуковой признак послеоперационного спайкообразования - дистанцию скольжения кишечника, оценивавшуюся как продольную, которую проходят петли кишечника при форсированном вдохе и выдохе пациента (нормальная величина ≥1 см) [10].
В отдаленном послеоперационном периоде качество жизни больных изучали с помощью опросника MOS SF-36 [11]. Опросник заполнял больной на основе собственных переживаний. Результаты представляли в виде оценки по 8 шкалам, которые интегрировали в два показателя: 1) физический компонент здоровья; 2) психический компонент здоровья. В качестве контроля использовали показатели у 30 здоровых лиц, сопоставимых по возрастно-половому составу и сопутствующим заболеваниям с больными изучаемых групп. Результаты лечения оценивали по 4-балльной шкале: отлично - пациент здоров, не соблюдает диету, признаков нарушения функции желудочно-кишечного тракта (ЖКТ) нет; хорошо - возникновение кратковременных приступов дисфункции ЖКТ (вздутие живота, затруднение отхождения газов) после нарушения пищевого режима, которые не требуют медикаментозной коррекции, самостоятельно исчезают и не снижают трудоспособности; удовлетворительно - наличие стойких признаков спаечной болезни, требующих соблюдения диеты, медикаментозной поддержки. Трудоспособность больных снижена; неудовлетворительно - выраженные признаки спаечной болезни, рецидивы острой спаечной кишечной непроходимости, наличие вентральных грыж больших размеров. Больные нетрудоспособны.
Результаты и обсуждение

Обе группы были равнозначны по тяжести состояния и тяжести перитонита (табл. 1). Хирургическое лечение проводили больным распространенным гнойным перитонитом с признаками абдоминального сепсиса без органной недостаточности.

Динамика показателей эндотоксикоза у больных распространенным гнойным перитонитом представлена в табл. 2.
На 1-е сутки в основной группе происходит более выраженное снижение степени эндотоксикоза (по данным ЛИИ) - в 1,3 раза, на 3-и сутки - в 1,5 раза по сравнению с контрольной. Аналогичным образом реагируют МСМ, уровень которых в основной группе на 3-и сутки был в 1,5 раза ниже, чем в контрольной. Выравнивание показателей происходит к 10-м суткам. Однако разница показателей на всех сроках исследования между группами не является достоверной.
В контрольной группе у всех больных через 48 ч после первого этапа операции сохранялись участки десерозированной брюшины после снятия с нее фибринозных наслоений, на основании чего можно утверждать, что водный раствор гипохлорита натрия препятствует восстановлению мезотелиального слоя брюшины. В основной группе через 24 ч после введения иммобилизированных форм гипохлорита натрия в геле карбоксиметилцеллюлозы отмечено восстановление серозного покрова брюшины.

Сведения о нарушении моторно-эвакуаторной функции по данным клинического и ультразвукового методов исследования представлены в табл. 3.
Во 2-й группе имело место более раннее восстановление пропульсивной способности кишечника, чем в контрольной. При этом выраженность клинических симптомов дисфункции кишечника соответствовала ультразвуковым признакам. Положительное влияние пульсирующей струи антисептика и иммобилизированных форм гипохлорита натрия в геле карбоксиметилцеллюлозы на пропульсивную способность кишечника подтвердили результаты УЗИ на 10-е сутки послеоперационного периода. Дистанция скольжения внутренних органов брюшной полости, по данным УЗИ, в основной группе составила 1,7±0,22 см, в контрольной - 0,86±0,17см, т.е. в основной группе выраженность послеоперационного спайкообразования была в 2 раза меньше, чем в контрольной.
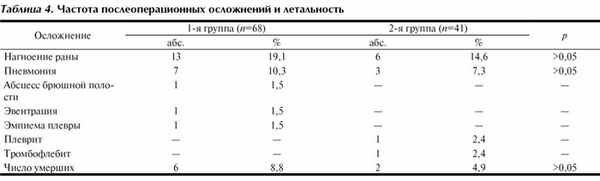
Частота послеоперационных осложнений и летальность при распространенном гнойном перитоните представлены в табл. 4.

При изучении результатов лечения больных в отдаленном послеоперационном периоде отмечается снижение показателей как физического, так и психического компонентов здоровья по сравнению с общей популяцией (табл. 5). При сравнении исследуемых групп установлено, что интегральный показатель физического компонента здоровья у пациентов основной группы в 1,3 раза (р<0,05), а психический компонент здоровья в 1,16 раза выше (р>0,05), чем в контрольной группе.

Количество больных с отличными результатами лечения в основной группе увеличилось на 7,6%, с хорошими - на 11,2%, с удовлетворительными результатами снизилось на 9% (табл. 6).
Проведенные исследования показали, что при использовании пульсирующей струи антисептика и иммобилизированных форм гипохлорита натрия в геле карбоксиметилцеллюлозы во время операции по поводу распространенного гнойного перитонита у больных быстрее снижается уровень эндогенной интоксикации, скорее восстанавливается моторно-эвакуаторная функция кишечника, наблюдается менее выраженный спаечный процесс в брюшной полости и лучший физический компонент здоровья в отдаленном периоде, чем при традиционном способе лечения. Эффект пульсирующей струи антисептика объясняется в основном механическим воздействием. В фазе «компрессии» струя жидкости с помощью микроудара освобождает слабо фиксированные участки фибрина, свертки крови и микробные тела, проникает в микрополости, разрушая их. В межпульсовой «декомпрессивной» фазе они отходят с потоком жидкости. Множественное повторение пульсаций позволяет эффективнее удалять фибрин. Депонирование в геле карбоксиметилцеллюлозы пролонгирует действие гипохлорита натрия и предупреждает инактивацию антисептика перитонеальным токсичным экссудатом. При этом достаточно высокие концентрации антисептика наблюдаются в брюшной полости до 3 ч, а следы препарата выявляются в течение суток. Этим более длительным действием гипохлорита натрия в брюшной полости можно объяснить положительное влияние последнего на течение воспалительного процесса при распространенном гнойном перитоните. В свою очередь гели карбоксиметилцеллюлозы оказывают «барьерное» действие в брюшной полости, т.е препятствует слипанию поверхностей органов брюшной полости и тем самым снижают выраженность спаечного процесса.
Таким образом, разработанная технология видеоэндоскопических санаций с помощью пульсирующей струи антисептика и введения в брюшную полость иммобилизированных форм гипохлорита натрия патогенетически обоснована, не вызывает специфических осложнений и может применяться в условиях общехирургического отделения городских, районных и областных больниц.
Оригинальная технология лечения позволяет в ближайшем послеоперационном периоде снизить показатели эндотоксикоза в 1,5 раза, улучшить моторно-эвакуаторную функцию кишечника в 2 раза, что способствует снижению летальности при распространенном гнойном перитоните.
В отдаленном послеоперационном периоде физический компонент здоровья пациентов повышается в 1,3 раза, отличные результаты возрастают на 7,6%, хорошие - на 11,2%, удовлетворительные результаты снижаются на 9% по сравнению с традиционным способом лечения.
Парез кишечника после операции
Парез кишечника – состояние, которое сопровождает многие тяжёлые заболевания и характеризуется постепенным уменьшением тонуса кишечной стенки, параличом гладких мышц кишечника. Среди хирургических пациентов всех профилей парез кишечника диагностируется у 0,2% прооперированных больных. Послеоперационный парез требует своевременного лечения, при отсутствии которого могут развиться осложнения.
Специалисты Юсуповской больницы разрабатывают для пациентов программы терапии пареза, в которые включены эффективные методы. Современное оснащение центра реабилитации Юсуповской больницы и профессионализм специалистов позволяют пациентам с данной патологией в минимальные сроки возвращаться к полноценной жизни.
Причины
Парез кишечника является довольно распространенным проявлением заболеваний внутренних органов. Паралич мышц кишечной стенки в 25% случаев развивается на фоне острой патологии органов брюшной полости, реже – при тяжелых заболеваниях легочной и сердечно-сосудистой систем, эндогенной интоксикации, генерализованной инфекции.
Более 70% пациентов, страдающих парезом кишечника, находятся в возрасте старше 60 лет, поэтому кишечный паралич считают заболеванием лиц пожилого возраста. Парез кишечника может встречаться у новорожденных, детей разного возраста, беременных. Одной из причин развития заболевания считается формирование воспалительного процесса, локализованного внутри или за пределами брюшной полости (при перитоните, забрюшинных флегмонах и других заболеваниях).
- нарушение кровоснабжения кишечника с развитием ишемии (при необратимой ишемии миокарда, разрыве аневризмы брюшного отдела аорты, острой коронарной недостаточности);
- нарушение иннервации (при опухолевом или травматическом повреждении спинного мозга, приеме блокаторов кальциевых каналов, угнетении синтеза ацетилхолина в нервных окончаниях).
Симптомы
Симптомы пареза кишечника схожи с отравлениями и проявлениями заболеваний желудочно-кишечного тракта. Боли при парезе кишечника имеют коликообразный характер, повышенное газообразование приводит к усилению интенсивности болевого синдрома, не имеющего четкой локализации. Характерным симптомом данного патологического состояния является отхождение небольшого количества каловых масс жидкой консистенции.
Основными проявлениями пареза кишечника после операции являются:
равномерное вздутие живота;
отсутствие кишечных шумов;
тахикардия (учащенное сердцебиение);
вторичная дыхательная недостаточность.
В начале заболевания в рвотных массах содержится съеденная пища, желудочный сок. Со временем рвотные массы приобретают каловый характер. Около 40% пациентов жалуются на запоры и отсутствие отхождения газов. У другой половины газы и кал могут отходить даже после развития клиники пареза кишечника. Субфебрильная лихорадка (повышение температуры тела до 37,0-37,1 градусов) отмечается не более чем у половины больных. Чаще всего это говорит о наличии осложнений (перфорации кишечной стенки, перитонита).
Значительное вздутие живота на фоне пареза кишечника приводит к смещению диафрагмы и сдавлению органов грудной полости. Клинически это проявляется следующими симптомами:
снижением артериального давления.
Длительная рвота на фоне пареза кишечника может приводить к обезвоживанию, которое проявляется сухостью слизистых и кожи, снижением темпа диуреза. У пациентов увеличивается окружность живота. При пальпации живот умеренно болезненный, при выслушивании определяется значительное уменьшение интенсивности или полное отсутствие кишечных шумов. На фоне полной тишины в брюшной полости выслушиваются дыхательные шумы, сердечные тоны. Пальцевое исследование прямой кишки выявляет расширенную и пустую ректальную ампулу.
При появлении данной симптоматики следует обратиться к врачу-гастроэнтерологу или хирургу Юсуповской больницы для прохождения диагностики.
Диагностика
Клинические проявления послеоперационного пареза устанавливаются врачом-хирургом и гастроэнтерологом. При диагностике патологии используются различные методы, к числу которых относится рентгеновское исследование органов брюшной полости. Результаты исследования отражаются на снимке. Парез кишечника характеризуется отсутствием механических причин непроходимости, одноуровневым расположением жидкости, а также скоплением газов в толстом кишечнике.
Наиболее информативными методами диагностики заболевания считаются:
мультиспиральная компьютерная томография;
Данные процедуры позволяют определить горизонтальный уровень жидкости, а также растянутые петли кишечника за счет того, что органы сканируются устройством в двух- и трехмерном изображении. Юсуповская больница оснащена высокоточным европейским оборудованием, позволяющим выявлять нарушения перистальтики кишечника.
Лечение
Лечение пациентов с парезом кишечника проводится в отделении реанимации и интенсивной терапии Юсуповской больницы. Начинают терапию с консервативных мероприятий:
- разгрузки кишечника путем выведения газов с помощью газоотводной прямокишечной трубки и толстого желудочного зонда;
- отмены энтеральной нагрузки;
- лечения основного заболевания (причины развития пареза кишечника);
- коррекции водно-электролитных и метаболических нарушений.
В качестве мероприятий, которые улучшают состояние пациента и ускоряют разрешение пареза, используют жевательную резинку (существует ряд научных работ в области гастроэнтерологии, которые указывают на стимуляцию перистальтики при жевании), колено-локтевое положение пациента, умеренную физическую активность.
Консервативная терапия включает медикаментозную стимуляцию перистальтики неостигмином. Существуют три методики нехирургической декомпрессии кишечника:
- введение толстого зонда под рентгенологическим контролем;
- чрескожная пункция слепой кишки и цекостомия;
- колоноскопия с последующим введением дренажа.
Эти методики применяют при наличии следующих показаний:
- увеличение диаметра толстого кишечника более 100 мм;
- длительность пареза кишечника более трех суток в сочетании с отсутствием эффекта от консервативной терапии на протяжении 48 часов;
- отсутствие положительной динамики от лечения неостигмином или наличие противопоказаний к его назначению.
Методом выбора при парезе кишечника является колоноскопия. Процедуру не проводят при перитоните, перфорации кишки. Изолированная колоноскопия эффективна у 25% пациентов, в то время как сочетание колоноскопии с введением дренажных трубок – практически в 90% случаев. Чрескожную цекостомию выполняют пациентам с высоким риском осложнений во время операции, при неэффективности консервативной терапии и колоноскопии с декомпрессией кишечника.
Открытое оперативное вмешательство используют при отсутствии эффекта всех перечисленных выше мероприятий, наличии прободения кишки и перитонита. Хирурги выполняют открытую цекостомию, резекцию пораженного отдела кишечника. После хирургического лечения наркотические анальгетики не назначают, так как они способны угнетать моторику кишечной трубки.
Реабилитация
При работе с пациентами, у которых диагностирован парез кишечника, врачи Юсуповской больницы разрабатывают не только терапевтический комплекс, но и программу реабилитации. Опытные реабилитологи стимулируют активность кишечника с помощью массажа живота. Кроме этого, пациенту в период восстановления показана специальная диета, позволяющая снизить нагрузку на кишечник.
В Юсуповской больнице осуществляется качественное медицинское обслуживание, а также поддерживается высокий уровень сервиса. Современное оборудование и высокая квалификация специалистов обеспечивают оперативную диагностику нарушения и определение наиболее рациональных методов терапии. Важным преимуществом многопрофильной клиники является отсутствие очередей и быстрая запись на прием по телефону.
Читайте также:
