Хирургическое лечение сердечной недостаточности. Ишемическая кардиомиопатия
Добавил пользователь Владимир З. Обновлено: 25.01.2026
Александрова Е. А., Шипулин В. М., Андреев С. Л.
ФГБУ НИИ кардиологии СО РАМН;
Актуальность: Особое место среди сердечно-сосудистых заболеваний занимает инфаркт миокарда, который при исключении смертельного исхода, во всех случаях ведет к развитию в той или иной мере кардиосклероза. При обширном повреждении миокарда начинаются процессы изменения формы и объема левого желудочка, что определяется как процесс ремоделирования сердца. Прогноз пациентов при естественном течении заболевания неудовлетворительный: пятилетняя выживаемость от 25 до 69%. Цель: Показать изменения степени сердечной недостаточности формы и объемов сердца после оперативного лечения пациентов с ишемической кардиомиопатией. Материал и методы: Работа выполнена на базе НИИ Кардиологии г.Томска. В работу включено 30 пациентов прооперированных в период с октября по декабрь 2012 года. Критерием включения пациентов в исследование явилось наличие ишемической кардиомиопатии: многососудистое поражение коронарного русла по данным коронарографии, показатели КДИ более 100 мл/м2, КСИ более 50 мл/м2, ФВ менее 40% по данным УЗИ сердца. Пациентам проводилось обследование, включающее тест шестиминутной ходьбой и велоэргоспирометрия (ВЭМ) для оценки функционального состояния пациентов и магнитно-резонансная томография (МРТ) сердца с контрастированием для морфологической оценки состояния миокарда. Эти же исследования проведены в течении 1 месяца после оперативного лечения. Результаты: По результатам проведенной до оперативного лечения теста шестиминутной ходьбы средняя пройденная дистанция составила 172,5 м, при этом распределение по классам сердечной недостаточности было: 4 пациента было отнесено ко второму классу ФК по NYHA, 3 пациента – к 4му классу ФК, остальные к третьему. После оперативного лечения данные распределения по классам не изменились. Средняя пройденная дистанция после операции составила 160,8 м. При проведении пробы велоэргоспирометрии достоверно положительных результатов после операции так же не получено. Коэффициент поглощения кислорода на килограмм веса тела в среднем составил 8,4 л/мин/кг для неоперированных пациентов и 8,01 л/мин/кг для тех же пациентов но в ближайшем послеоперационном периоде. Это соответствовало 3-4 ФК по NYHA. Максимальная переносимая нагрузка до операции в среднем составила 42,6%, после операции 42,3%. Однако причинами прекращения теста наиболее часто до операции становились одышка, появление изменений на ЭКГ, боли в груди (90%). Утомление – только в 10% случаев. При проведении контрольной пробы в течении первого месяца после операции утомление выступило на первый план и проявилось в 63,3% случаев, другие причины прекращения теста заняли оставшиеся 36,7%. Это может свидетельствовать о послеоперационной «слабости» пациентов в течение ближайшего послеоперационного периода. Выводы: В ближайшем послеоперационном периоде функциональный класс по NYHA соответствует ФК в дооперационном периоде в связи с недостаточной активизацией пациентов и наличием «послеоперационной слабости» по данным ВЭМ и теста шестиминутной ходьбы.
Комментарии посетителей
Комментарии могут отправлять участники данного мероприятия или члены Ассоциации.
Преимущества членства в ассоциации
Современное состояние проблемы хирургического лечения ишемической кардиомиопатии
В статье обсуждается современное состояние проблемы хирургического лечения ишемической кардиомиопатии (ИКМП). Рассматриваются патофизиологические аспекты ремоделирования левого желудочка при ИКМП. Приводится подробная характеристика и показана роль методов оценки жизнеспособности миокарда при ИКМП. Акцентировано внимание на методиках хирургического лечения при ИКМП. Обсуждается проблема дисфункции правого желудочка при ИКМП. Анализируются ограничения исследования Surgical Treatment for Ischemic Heart Failure (STICH). Статья рассчитана на кардиологов, терапевтов, кардиохирургов.
Ключевые слова
Об авторах
ФГБНУ «НИИ кардиологии», «Томский национальный исследовательский медицинский центр» РАН, ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
Россия
д.м.н., профессор, руководитель отдела сердечно-сосудистой хирургии НИИ Кардиологии
аспирант отдела сердечно-сосудистой хирургии НИИ кардиологии
к.м.н, старший научный сотрудник отдела сердечно-сосудистой хирургии НИИ кардиологии
аспирант лаборатории радионуклидных методов исследования НИИ Кардиологии
ФГБНУ «НИИ кардиологии», «Томский национальный исследовательский медицинский центр» РАН, ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России
Россия
ведущий научный сотрудник ОССХ, заведующий кардиохирургическим отделением №1 НИИ Кардиологии
Список литературы
1. Burch GE, Tsui CY, Harb JM. Ischemic cardiomyopathy. American Heart Journal. 1972;83(3):340–50. PMID: 4258217
2. Felker GM, Shaw LK, O’Connor CM. A standardized definition of ischemic cardiomyopathy for use in clinical research. Journal of the American College of Cardiology. 2002;39(2):210–8. PMID: 11788209
3. Pfeffer MA, Braunwald E. Ventricular remodeling after myocardial infarction. Experimental observations and clinical implications. Circulation. 1990;81(4):1161–72. PMID: 2138525
4. Шипулин В.М., Казаков В.А., Кривощеков Е.В, Суходоло И.В., Ваизов В.Х., Лежнев А.А. и др. Морфологические предикторы послеоперационного ремоделирования сердца у больных ишемической кардиомиопатией. Кардиология. 2007;47(8):57-9
5. Di Donato M, Castelvecchio S, Kukulski T, Bussadori C, Giacomazzi F, Frigiola A et al. Surgical Ventricular Restoration: Left Ventricular Shape Influence on Cardiac Function, Clinical Status, and Survival. The Annals of Thoracic Surgery. 2009;87(2):455–61. DOI: 10.1016/j.athoracsur.2008.10.071
6. Шипулин В.М., Козлов Б.Н., Кривощеков Е.В., Казаков В.А., Лежнев А.А., Бабокин В.Е. и др. Морфофункциональная характеристика миокарда пациентов с постинфарктным ремоделированием как возможная причина неблагоприятных результатов оперативного лечения. Грудная и сердечно-сосудистая хирургия. 2009;5:37-41
7. Redwood SR, Ferrari R, Marber MS. Myocardial hibernation and stunning: from physiological principles to clinical practice. Heart. 1998;80(3):218–22. DOI: 10.1136/hrt.80.3.218
8. Bolognese L, Neskovic AN, Parodi G, Cerisano G, Buonamici P, Santoro GM et al. Left Ventricular Remodeling After Primary Coronary Angioplasty: Patterns of Left Ventricular Dilation and Long-Term Prognostic Implications. Circulation. 2002;106(18):2351–7. DOI: 10.1161/01.CIR.0000036014.90197.FA
9. Shen YT, Vatner SF. Mechanism of impaired myocardial function during progressive coronary stenosis in conscious pigs. Hibernation versus stunning? Circulation Research. 1995;76(3):479–88. PMID: 7859393
10. Maes A, Flameng W, Nuyts J, Borgers M, Shivalkar B, Ausma J et al. Histological alterations in chronically hypoperfused myocardium. Correlation with PET findings. Circulation. 1994;90(2):735–45. PMID: 8044942
11. Schinkel AFL, Valkema R, Geleijnse ML, Sijbrands EJ, Poldermans D. Single-photon emission computed tomography for assessment of myocardial viability. EuroIntervention: Journal of EuroPCR in Collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. 2010;6(Suppl G):G115-122. PMID: 20542817
12. Thornhill RE, Prato FS, Wisenberg G. The assessment of myocardial viability: a review of current diagnostic imaging approaches. Journal of Cardiovascular Magnetic Resonance: Official Journal of the Society for Cardiovascular Magnetic Resonance. 2002;4(3):381–410. PMID: 12234110
13. Anagnostopoulos C, Georgakopoulos A, Pianou N, Nekolla SG. Assessment of myocardial perfusion and viability by Positron Emission Tomography. International Journal of Cardiology. 2013;167(5):1737–49. DOI: 10.1016/j.ijcard.2012.12.009
15. Einstein AJ, Moser KW, Thompson RC, Cerqueira MD, Henzlova MJ. Radiation Dose to Patients From Cardiac Diagnostic Imaging. Circulation. 2007;116(11):1290–305. DOI: 10.1161/CIRCULATIONAHA.107.688101
16. Perrone-Filardi P, Pace L, Prastaro M, Piscione F, Betocchi S, Squame F et al. Dobutamine echocardiography predicts improvement of hypoperfused dysfunctional myocardium after revascularization in patients with coronary artery disease. Circulation. 1995;91(10):2556–65. PMID: 7743617
17. Armstrong WF, Ryan T. Stress Echocardiography from 1979 to Present. Journal of the American Society of Echocardiography. 2008;21(1):22–8. DOI: 10.1016/j.echo.2007.11.005
18. McLean DS, Anadiotis AV, Lerakis S, Lerakis S. Role of Echocardiography in the Assessment of Myocardial Viability Symbol. The American Journal of the Medical Sciences. 2009;337(5):349–54. DOI: 10.1097/MAJ.0b013e3181a39391
20. Johri AM, Chitty DW, Hua L, Marincheva G, Picard MH. Assessment of Image Quality in Real Time Three-Dimensional Dobutamine Stress Echocardiography: An Integrated 2D/3D Approach. Echocardiography. 2015;32(3):496–507. DOI: 10.1111/echo.12692
21. Saeed M, Higgins CB, Geschwind J-F, Wendland MF. T1-relaxation kinetics of extracellular, intracellular and intravascular MR contrast agents in normal and acutely reperfused infarcted myocardium using echo-planar MR imaging. European Radiology. 2000;10(2):310–8. DOI: 10.1007/s003300050050
22. Tomlinson DR, Becher H, Selvanayagam JB. Assessment of Myocardial Viability: Comparison of Echocardiography versus Cardiac Magnetic Resonance Imaging in the Current Era. Heart, Lung and Circulation. 2008;17(3):173–85. DOI: 10.1016/j.hlc.2007.10.005
23. Packer M, Coats AJS, Fowler MB, Katus HA, Krum H, Mohacsi P et al. Effect of Carvedilol on Survival in Severe Chronic Heart Failure. New England Journal of Medicine. 2001;344(22):1651–8. DOI: 10.1056/NEJM200105313442201
26. Killip T, Passamani E, Davis K. Coronary artery surgery study (CASS): a randomized trial of coronary bypass surgery. Eight years follow-up and survival in patients with reduced ejection fraction. Circulation. 1985;72(6 Pt 2):V102-109. PMID: 3905050
27. Dreyfus GD, Duboc D, Blasco A, Vigoni F, Dubois C, Brodaty D et al. Myocardial viability assessment in ischemic cardiomyopathy: benefits of coronary revascularization. The Annals of Thoracic Surgery. 1994;57(6):1402–7. PMID: 8010780
28. Yamaguchi A, Ino T, Adachi H, Murata S, Kamio H, Okada M et al. Left ventricular volume predicts postoperative course in patients with ischemic cardiomyopathy. The Annals of Thoracic Surgery. 1998;65(2):434–8. PMID: 9485241
29. Yamaguchi A, Adachi H, Kawahito K, Murata S, Ino T. Left Ventricular Reconstruction Benefits Patients With Dilated Ischemic Cardiomyopathy. The Annals of Thoracic Surgery. 2005;79(2):456–61. DOI: 10.1016/j.athoracsur.2004.07.045
30. Beck CS. Operation for Aneurysm of the Heart. Annals of Surgery. 1944;120(1):34–40. PMID: 17858468
32. Cooley DA, Collins HA, Morris GC, Chapman DW. Ventricular aneurysm after myocardial infarction; surgical excision with use of temporary cardiopulmonary bypass. Journal of the American Medical Association. 1958;167(5):557–60. PMID: 13538738
33. Stoney WS, Alford WC, Burrus GR, Thomas CS. Repair of anteroseptal ventricular aneurysm. The Annals of Thoracic Surgery. 1973;15(4):394–404. PMID: 4540218
34. Jatene AD. Left ventricular aneurysmectomy. Resection or reconstruction. The Journal of Thoracic and Cardiovascular Surgery. 1985;89(3):321–31. PMID: 3974267
35. Dor V, Saab M, Coste P, Kornaszewska M, Montiglio F. Left Ventricular Aneurysm: A New Surgical Approach. The Thoracic and Cardiovascular Surgeon. 1989;37(01):11–9. DOI: 10.1055/s-2007-1013899
36. Dor V. Left ventricular aneurysms: the endoventricular circular patch plasty. Seminars in Thoracic and Cardiovascular Surgery. 1997;9(2):123–30. PMID: 9253074
38. Menicanti L, Di Donato M. Left ventricular aneurysm/reshaping techniques. Multimedia Manual of Cardio-Thoracic Surgery. 2005;2005(0425):mmcts.2004.000596. DOI: 10.1510/mmcts.2004.000596
40. Castelvecchio S, Menicanti L, Ranucci M, Di Donato M. Impact of Surgical Ventricular Restoration on Diastolic Function: Implications of Shape and Residual Ventricular Size. The Annals of Thoracic Surgery. 2008;86(6):1849–54. DOI: 10.1016/j.athoracsur.2008.08.010
41. Garatti A, Castelvecchio S, Di Mauro M, Bandera F, Guazzi M, Menicanti L. Impact of right ventricular dysfunction on the outcome of heart failure patients undergoing surgical ventricular reconstruction. European Journal of Cardio-Thoracic Surgery. 2015;47(2):333–40. DOI: 10.1093/ejcts/ezu152
43. Babokin V, Shipulin V, Batalov R, Popov S. Surgical ventricular reconstruction with endocardectomy along radiofrequency ablation-induced markings. The Journal of Thoracic and Cardiovascular Surgery. 2013;146(5):1133–8. DOI: 10.1016/j.jtcvs.2012.08.067
44. Velazquez EJ, Lee KL, Deja MA, Jain A, Sopko G, Marchenko A et al. Coronary-Artery Bypass Surgery in Patients with Left Ventricular Dysfunction. New England Journal of Medicine. 2011;364(17):1607–16. DOI: 10.1056/NEJMoa1100356
45. Kumanohoso T, Otsuji Y, Yoshifuku S, Matsukida K, Koriyama C, Kisanuki A et al. Mechanism of higher incidence of ischemic mitral regurgitation in patients with inferior myocardial infarction: quantitative analysis of left ventricular and mitral valve geometry in 103 patients with prior myocardial infarction. The Journal of Thoracic and Cardiovascular Surgery. 2003;125(1):135–43. DOI: 10.1067/mva.2003.78
46. Fattouch K, Sampognaro R, Speziale G, Salardino M, Novo G, Caruso M et al. Impact of Moderate Ischemic Mitral Regurgitation After Isolated Coronary Artery Bypass Grafting. The Annals of Thoracic Surgery. 2010;90(4):1187–94. DOI: 10.1016/j.athoracsur.2010.03.103
47. Pastorius CA, Henry TD, Harris KM. Long-Term Outcomes of Patients With Mitral Regurgitation Undergoing Percutaneous Coronary Intervention. The American Journal of Cardiology. 2007;100(8):1218–23. DOI: 10.1016/j.amjcard.2007.05.050
49. Kron IL, Hung J, Overbey JR, Bouchard D, Gelijns AC, Moskowitz AJ et al. Predicting recurrent mitral regurgitation after mitral valve repair for severe ischemic mitral regurgitation. The Journal of Thoracic and Cardiovascular Surgery. 2015;149(3):752-761.e1. DOI: 10.1016/j.jtcvs.2014.10.120
50. Oliveira GH, Al-Kindi SG, G. Bezerra H, Costa MA. Left Ventricular Restoration Devices. Journal of Cardiovascular Translational Research. 2014;7(3):282–91. DOI: 10.1007/s12265-014-9552-x
51. Costa MA, Pencina M, Nikolic S, Engels T, Templin B, Abraham WT. The PARACHUTE IV trial design and rationale: Percutaneous ventricular restoration using the parachute device in patients with ischemic heart failure and dilated left ventricles. American Heart Journal. 2013;165(4):531–6. DOI: 10.1016/j.ahj.2012.12.022
53. St John Sutton MG, Plappert T, Hilpisch KE, Abraham WT, Hayes DL, Chinchoy E. Sustained Reverse Left Ventricular Structural Remodeling With Cardiac Resynchronization at One Year Is a Function of Etiology: Quantitative Doppler Echocardiographic Evidence From the Multicenter InSync Randomized Clinical Evaluation (MIRACLE). Circulation. 2006;113(2):266–72. DOI: 10.1161/CIRCULATIONAHA.104.520817
54. Damy T, Viallet C, Lairez O, Deswarte G, Paulino A, Maison P et al. Comparison of four right ventricular systolic echocardiographic parameters to predict adverse outcomes in chronic heart failure. European Journal of Heart Failure. 2009;11(9):818–24. DOI: 10.1093/eurjhf/hfp111
55. Zornoff LAM, Skali H, Pfeffer MA, St John Sutton M, Rouleau JL, Lamas GA et al. Right ventricular dysfunction and risk of heart failure and mortality after myocardial infarction. Journal of the American College of Cardiology. 2002;39(9):1450–5. PMID: 11985906
56. Ghio S, Gavazzi A, Campana C, Inserra C, Klersy C, Sebastiani R et al. Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure. Journal of the American College of Cardiology. 2001;37(1):183–8. PMID: 11153735
57. Maslow AD, Regan MM, Panzica P, Heindel S, Mashikian J, Comunale ME. Precardiopulmonary bypass right ventricular function is associated with poor outcome after coronary artery bypass grafting in patients with severe left ventricular systolic dysfunction. Anesthesia and Analgesia. 2002;95(6):1507–18. PMID: 12456409
59. Di Donato M, Fantini F, Toso A, Castelvecchio S, Menicanti L, Annest L et al. Impact of surgical ventricular reconstruction on stroke volume in patients with ischemic cardiomyopathy. The Journal of Thoracic and Cardiovascular Surgery. 2010;140(6):1325-1331. e2. DOI: 10.1016/j.jtcvs.2010.01.031
60. Cho Y, Ueda T, Inoue Y, Shimura S, Aki A, Furuya H et al. Longterm results and mid-term features of left ventricular reconstruction procedures on left ventricular volume, geometry, function and mitral regurgitation. European Journal of Cardio-Thoracic Surgery. 2012;42(3):462–9. DOI: 10.1093/ejcts/ezs363
61. Kukulski T, She L, Racine N, Gradinac S, Panza JA, Velazquez EJ et al. Implication of right ventricular dysfunction on long-term outcome in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting with or without surgical ventricular reconstruction. The Journal of Thoracic and Cardiovascular Surgery. 2015;149(5):1312–21. DOI: 10.1016/j.jtcvs.2014.09.117
62. Couperus LE, Delgado V, van Vessem ME, Tops LF, Palmen M, Braun J et al. Right ventricular dysfunction after surgical left ventricular restoration: prevalence, risk factors and clinical implications. European Journal of Cardio-Thoracic Surgery. 2017;52(6):1161–7. DOI: 10.1093/ejcts/ezx201
63. Jones RH, Velazquez EJ, Michler RE, Sopko G, Oh JK, O’Connor CM et al. Coronary Bypass Surgery with or without Surgical Ventricular Reconstruction. New England Journal of Medicine. 2009;360(17):1705–17. DOI: 10.1056/NEJMoa0900559
64. Zembala M, Michler RE, Rynkiewicz A, Huynh T, She L, Lubiszewska B et al. Clinical Characteristics of Patients Undergoing Surgical Ventricular Reconstruction by Choice and by Randomization. Journal of the American College of Cardiology. 2010;56(6):499–507. DOI: 10.1016/j.jacc.2010.03.054
65. Oh JK, Pellikka PA, Panza JA, Biernat J, Attisano T, Manahan BG et al. Core Lab Analysis of Baseline Echocardiographic Studies in the STICH Trial and Recommendation for Use of Echocardiography in Future Clinical Trials. Journal of the American Society of Echocardiography. 2012;25(3):327–36. DOI: 10.1016/j.echo.2011.12.002
66. Resnic FS, Desai A. Highlights from the 59th Annual Scientific Sessions of the American College of Cardiology, March 13 to 17, 2010, Atlanta, Georgia. The Journal of Thoracic and Cardiovascular Surgery. 2010;140(1):257–9. DOI: 10.1016/j.jtcvs.2010.04.003
67. Neumann F-J, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. European Heart Journal. 2019;40(2):87–165. DOI: 10.1093/eurheartj/ehy394
68. Bonow RO, Maurer G, Lee KL, Holly TA, Binkley PF, Desvigne-Nickens P et al. Myocardial Viability and Survival in Ischemic Left Ventricular Dysfunction. New England Journal of Medicine. 2011;364(17):1617–25. DOI: 10.1056/NEJMoa1100358
69. White HD, Norris RM, Brown MA, Brandt PW, Whitlock RM, Wild CJ. Left ventricular end-systolic volume as the major determinant of survival after recovery from myocardial infarction. Circulation. 1987;76(1):44–51. PMID: 3594774
Отделение кардиохирургическое II (хирургического лечения дисфункций миокарда и сердечной недостаточности)
Отделение хирургического лечения дисфункций миокарда и сердечной недостаточности занимается исследованиями в области патогенеза, клиники и лечения заболеваний сердца, протекающих с явлениями выраженной сердечной недостаточности.
В настоящее время в отделении проводится научная работа по усовершенствованию обследования и лечения гипертрофической кардиомиопатии (ГКМП). Разработаны эффективные алгоритмы для диагностики и хирургического лечения пациентов с ГКМП.
У наиболее тяжелой категории пациентов с проявлениями сердечной недостаточности III-IV ФК по NYHA и анатомическим вариантом подлежащим коррекции, мы проводим оперативное лечение – миоэктомию из выходного отдела левого желудочка, расширенную миоэктомию, пластику или протезирование митрального клапана и их сочетание.
Работа отделения ведется в тесном контакте с ведущими подразделениями центра: отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции (зав. отд. – к.м.н. Подоляк Д.Г.), отделением анестезиологии-реанимации II (зав. отд. – д.м.н Аксельрод Б.А.), отделением реанимации и интенсивной терапии II (зав. отд. – член-корр. РАН, профессор Еременко А.А.), отделом клинической физиологии, инструментальной и лучевой диагностики (зав. отд. – академик РАН, профессор Сандриков В.А.) и лабораторией медицинской генетики (зав. лаб. – д.м.н. Заклязьминская Е.В.).
Всех пациентов высокого периоперационного риска мы в обязательном порядке выносим для обсуждения на консилиум ведущих специалистов центра - академиков РАН, профессоров, обладающих многолетним клиническим опытом и согласуем тактику лечения индивидуально.
Ежегодно в отделении получают лечение до 200 пациентов с заболеваниями сердца и сосудов.
Среди приоритетных направлений следует отметить развитие коронарной хирургии с применением микрохирургической техники (операционный микроскоп Carl Zeiss OPMI Vario, Germany). Использование операционного микросокопа с увеличением до х24 крат позволяет уверенно выполнять аорто- и маммарокоронарное шунтирование у пациентов с тяжелым поражением коронарного русла (на фоне сахарного диабета, диффузного дистального поражения) и добиваться полной реваскуляризации миокарда у всех пациентов.
Хирургическое лечение пациентов с распространенным атеросклерозом: гемодинамически значимыми стенозами внутренних сонных артерий, коронарного русла и артерий аортоподвздошного сегмента является объектом повышенного внимания сотрудников отделения и успешно осуществляется на протяжении последних 10 лет. Мы выполняем таким пациентам всестороннее обследование, определяем доминирующую патологию и предлагаем очередность и комбинацию операций персонифицировано с учетом всех особенностей пациента.
Важным направлением работы отделения является коррекция клапанной патологии у пациентов с ИБС, заболеваниями аорты и периферических сосудов. До 40% операций по коррекции заболеваний клапанов сердца мы выполняем в сочетании с коронарным шунтированием.
Реконструктивно-пластические операции на митральном клапане - важная часть научно-клинической работы отделения. Для реконструкции протезирования клапанов сердца мы применяем расходные материалы мировых лидеров в области производства имплантов для сердечно- сосудистой хирургии – St.Jude Medical, On-X, Carbomedics и т.д.
Пациентам с пороками сердца и ишемической болезнью сердца в сочетании с фибрилляцией предсердий мы выполняем ритм-конвертирующие операции («Лабиринт») – MAZE III и MAZE IV с использованием радиочастной (“AtriCure”) и криоабляции (“Cardioblate CryoFlex”).
При изолированном поражении клапанов сердца возможно выполнение операции из минидоступов - частичной J-образной стернотомии или миниторакотомии, что позволяет сохранить каркасную функцию грудной клетки и возможно при минимальной длине кожного разреза на груди - 6,5-7,0 см.
В своей работе хирургическая команда отделения активно использует передовые технологии для достижения максимального результата операции, уменьшения операционной травмы и минимизации послеоперационных осложнений.
Сотрудники отделения постоянно совершенствуют свои навыки и знакомятся с новейшими хирургическими технологиями при посещении ведущих клиник сердечно-сосудистой хирургии Европы, Америки и России. Активно участвуют в работе кардиохирургических форумов в Европе и России.
Научные разработки и результаты работы освещены в ведущих профильных российских печатных изданиях, в том числе рекомендованных Высшей аттестационной комиссий для публикации диссертационных исследований.
Научно-практическая работа отделения находится под пристальным внимаем администрации РНЦХ, Ученого совета и академика РАН, профессора Белова Ю.В.
В настоящее время в отделении в ежедневную практику введены:
- мобилизация большой подкожной вены для коронарного по методике «no-touch»
- использование операционного микроскопа при коронарном шунтировании
- выполнение операций при ИБС и пороках сердца из минидоступа (J-образной министернотомии, миниторакотомии)
- ритм-конвертирующие операции («Лабиринт») у пациентов с фибрилляцией предсердий – MAZE III и MAZE IV с использованием радиочастной (“AtriCure”) и криоабляции (“Cardioblate CryoFlex”)
- сочетанные и комбинированные вмешательства на сердце и сосудах у пациентов высокого риска с тяжелой сопутствующей патологией
Медикаментозная терапия и хирургическое лечение мы проводим в строгом соответствии с постоянно обновляемыми рекомендациями выпускаемыми ведущими европейскими и американскими профессиональными организациями.
Хирургическое лечение сердечной недостаточности
В РБ органная трансплантация осуществляется в соответствии с законом, в основе которого лежит "презумпция согласия": забор органа может быть осуществлен после констатации смерти мозга, если пожелания обратного не выражены пациентом до смерти.
Реципиент.
Основная цель подбора реципиентов состоит в том, чтобы идентифицировать больных с конечной стадией СН, невосприимчивых к медицикаментозному лечению, но обладающих потенциалом для возобновления нормальной активной жизни.
Показания к трансплантации сердца.
Реципиентами является больные с терминальной стадией СН, не подлежащие медикаментозной терапии или альтернативным хирургическим методам лечения сердечной недостаточности. Прогноз однолетней выживаемости без трансплантации < 50%. Объективными критериям такого прогноза являются: ФВ ЛЖ < 20%, Na сыворотки крови < 135 мэкв/л, давление заклинивания в легочной артерии >25 мм рт.ст, уровень норадреналина в плазме > 600 пкг/мл, кардиоторакальный индекс > 0,6, снижение максимального VO2 < 10 мл/кг/мин. на фоне максимальной медикаментозной поддержки.
Первичное обследование реципиента включает тщательный анализ анамнеза и объективное исследование: рентгенографию грудной клетки, нагрузочный тест на максимальное потребление кислорода (VO2), рутинные гематологические и биохимические тесты, серологические исследование на наличие инфекционных заболеваний определение человеческого лимфоцитарного антигена (HLA). Проведение зондирование сердца с тонометрией правых отделов сердца с целью исключения необратимой легочной гипертензии перед постановкой пациентов в лист ожидания для трансплантации сердца - обязательно.
Фармакологический мост к трансплантации.
Больные с критической стадией терминальной недостаточности требуют лечения в отделении интенсивной терапии инфузионными инотропными средствами. У больных с недостаточным эффектом медикаментозного лечения используется интрааортальная баллонная контрпульсация.
Механический мост к трансплантации. У потенциальных реципиентов, которые остаются гемодинамически нестабильными в течение 24-48 часов при максимальной фармакологической поддержке применяются устройства моно-, бивентикулярного обхода желудочков или полное искусственное сердце.
Донор подвергается скринингу в три этапа. Первый этап заключается в сборе точной информации относительно возраста пациента, роста, веса, пола, группы крови и Rh-фактора, причины смерти, лабораторных данных, включая биохимические тесты, и серологические исследования на инфекционные заболевания (цитомегаловирус, гепатиты В и С). Второй этап скрининга включает дальнейшее исследование в поисках потенциальных противопоказаний: оценивается ЭКГ, грудная рентгенография, насыщение О2 артериальный крови и ЭхоКГ. Финальный этап скрининга донора происходит во время операции забора органа: оценивается функция желудочков, клапанная или коронарная патология.
Совместимость донора и реципиента.
Критерии совместимости базируются на соответствии группы крови по АВО и размере тела пациента. Вес донора должен быть в пределах 30% веса. Проводится скрининг реципиента на титр человеческого лимфоцитарного антигена (HLA). Положительная перекрестная реакция - абсолютное противопоказание к трансплантации. Увеличение количества реактивных антител (PRA) больше 10-15% указывает на повышенную чувствительность реципиента к аллоантигенам.
В РНПЦ для трансплантации сердца используется классическая методика N.Shumway.
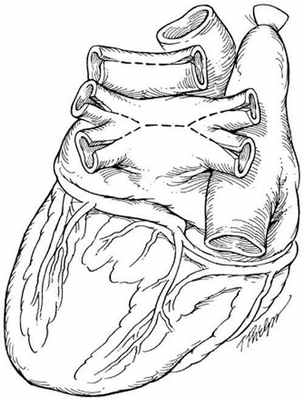 | 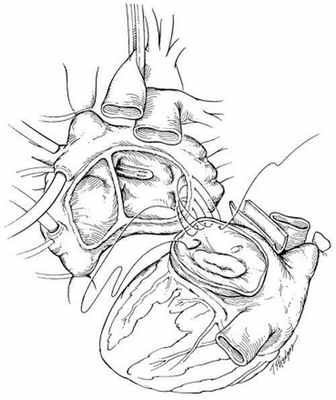 | 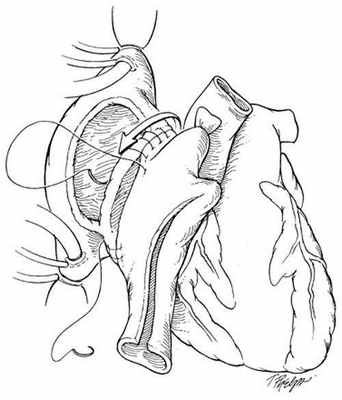 | 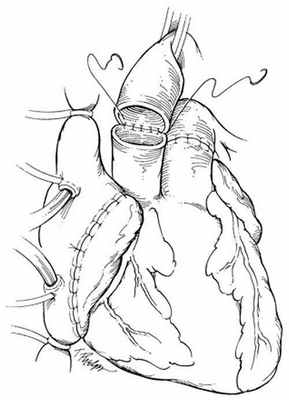 |
Успешные и долгосрочные результаты ортотопической трансплантации сердца сделали ее методом выбора для пациентов с отсутствием эффекта от медикаментозного лечения. Однако, очевидные ограничения трансплантации, включающие потребность в иммунодепрессии и дефицит донорских органов не позволяют использовать этот метод лечения у всех пациентов. В РНПЦ для решения этой проблемы широко используются альтернативные хирургические методы лечения СН.
Реваскуляризация миокарда.
Коррекция недостаточности артриовентрикулярных клапанов.
Функциональная недостаточность атриовентрикулярных клапанов наблюдается почти у всех пациентов ишемической или дилатационной кардиомиопатией. Ишемия приводит к развитию прямой дисфункции или разрыву папиллярных мышц и формированию митральной недостаточности. Снижение контрактильности миокарда ЛЖ вызывает дилатацию его полости, дисторсию задней папиллярной мышцы и усиливает митральную регургитацию. Оратный сброс крови в левое предсердие увеличивает перегрузку объемом ЛЖ и еще больше усиливает ишемию миокарда. Возникает порочный круг, прервать который может только восстановление запирательной функции митрального клапана.
Для этого коррекции митральной недостаточности используются опорные кольца с измененной пространственной геометрией, которые позволяют снизить рецидив митральной недостаточности в отдаленном послеоперационном периоде.
 |
Хирургическое ремоделирование левого желудочка.
Патологическое ремоделирование ЛЖ у больных с кардиомиопатией приводит к увеличению объема желудочка и напряжению его стенки. После того, как ЛЖ приобретает сферическую форму, меняется ориентация кардиомиоцитов. При одной и той же фракции укорочения фракция выброса в сферическом желудочке значительно уменьшается. При естественном течении заболевания 5-летняя выживаемость при КСИЛЖ < 100 мл/м 2 составляет 85%, а при КСИЛЖ > 100 мл/м 2 - 53%. Таким образом, любое вмешательство, направленное на оптимизацию этих отношений, оправдано, а благоприятный прогноз для пациента возможен при снижении КСИЛЖ < 90 мл/м 2 .
Способ циркулярной пластики.
Способ циркулярной пластики разработан с учетом восстановления геометрической формы и объема ЛЖ, близких к физиологической норме для данного пациента. Расчет нужного объема производится как функция нормального ударного индекса.
Оперативная техника.
Циркулярные швы, идущие в толще тканей на глубине не менее 5 миллиметров, накладывают со стороны эндокарда с шагом рассчитанным на основании эхокардиографических данных. Формируется конус ЛЖ с заранее рассчитанным конечнодиастолическим объемом.
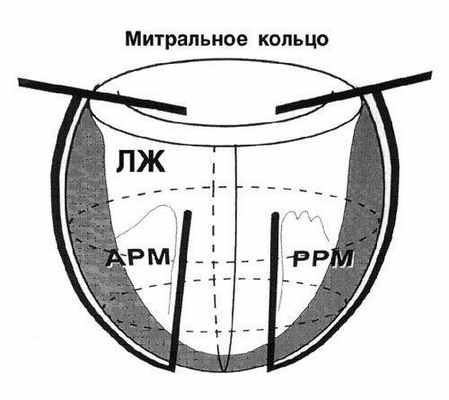 | 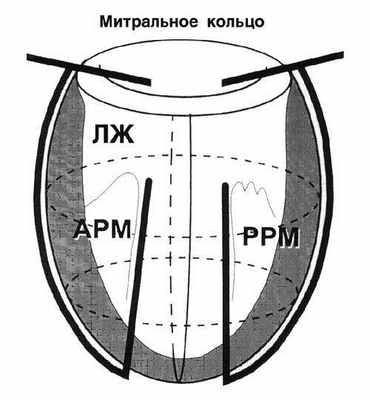 |
После восстановления сердечной деятельности с помощью транспищеводной ЭхоКГ проводится оценка хирургического ремоделирования ЛЖ.
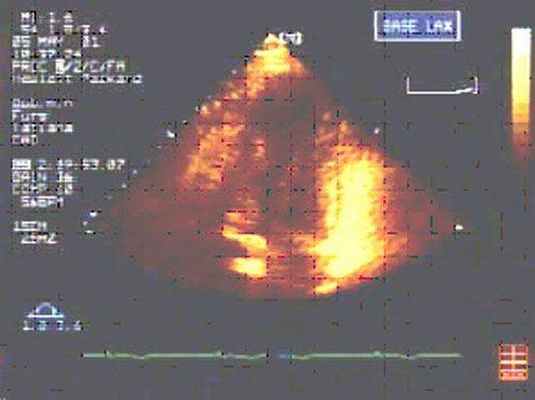
Поддерживающее устройство сердца.
Цель использования разработанного в РНПЦ устройства состоит в пассивной поддержке желудочков и предотвращении дальнейшей их дилатации. Экспериментальные исследования показали возможность уменьшения объема желудочков, снижение напряжение стенки, улучшение контрактильности миокарда и рост ФВ. Гистологические исследования животных также демонстрировали уменьшение гипертрофии миоцитов и интерстициального фиброза, а также снижение титра биохимических маркеров СН.
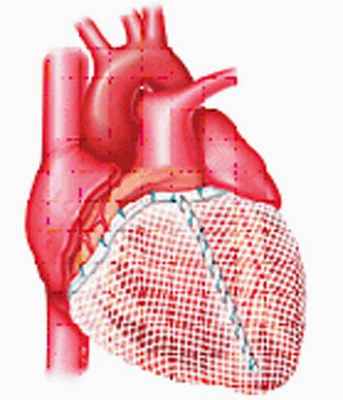 | 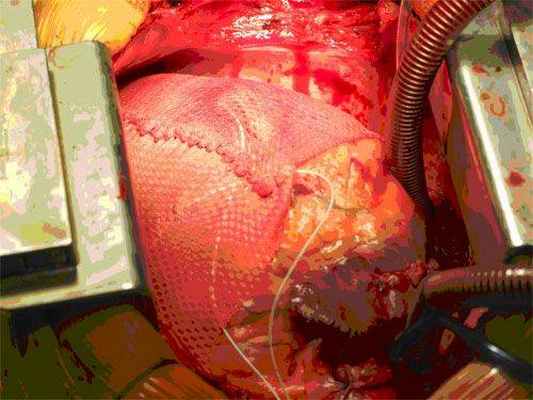 |
Ресинхронизация сердца.
Внутри- и межжелудочковая диссинхрония, связанная с задержкой внутри- и межжелудочкового проведения, является существенным компонентом патогенеза выраженной хронической сердечной недостаточности.
При СН изменяется внутри- и межкамерное взаимодействие. Нормальный физиологический асинхронизм между межжелудочковой перегородкой (МЖП) и задней стенкой ЛЖ (около 60 мсек.) нарастает и приводит к дисфункции ЛЖ.
Ресинхронизация сердца позволяет изменить степень электромеханической асинхронии предсердий и желудочков. Критерием прогнозирования успеха кардиосинхронизации является исходная пролонгация интервала QRS >130 мсек. Наиболее информативным критерием является оценка внутрижелудочковой механической задержки сокращения - увеличение исходного внутри- или межжелудочкового механического асинхронизма > 50 мсек.
Оперативная техника.
Коррекция указанных нарушений осуществляется путем имплантации многокамерного кардиостимулятора с раздельной стимуляцией правого предсердия и желудочков. Для этого три электрода проводятся через подключичную вену и фиксируются к стенке правого предсердия, в верхушке ПЖ и через коронарный синус в левой боковой вене ЛЖ у основания сердца.
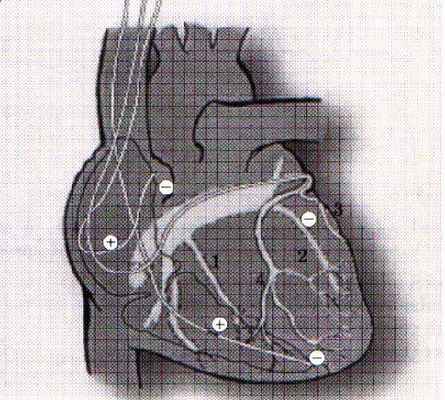 | 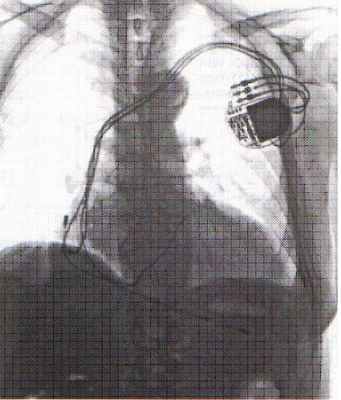 |
При открытых операциях реваскуляризации миокарда, ремоделирования ЛЖ или пластики митрального клапана электроды фиксируются эпикардиально - в правом предсердии и у основания сердца к обоим желудочкам.
Обязательным условием эффективности ресинхронизации является оптимизация работы кардиостимулятора.
Вспомогательное кровообращение.
Вследствие постоянного дефицита донорских органов большой группе пациентов целесообразно использовать длительную механическую поддержку кровообращения как основной терапии. Для этих целей могут быть использованы устройство Thoratec в виде моно или бивентрикулярногго обхода или аксиальный насос "HeartMate II".
Кардиомиопатия
Кардиомиопатией называют первичное поражение миокарда, не обусловленное воспалительным, опухолевым или ишемическим процессом. Зачастую патология имеет невыясненную этиологию. Для постановки пациенту диагноза «кардиомиопатия» необходимо исключить другие заболевания: врожденные аномалии развития, клапанные пороки сердца, поражение, обусловленное системными сосудистыми заболеваниями, артериальную гипертонию, перикардит и др. В зависимости от характера анатомических и функциональных изменений сердечной мышцы различают следующие типы кардиомиопатии:
- дилатационная (застойная);
- гипертрофическая (может быть асимметричной и симметричной, обструктивной и необструктивной);
- рестриктивная (различают облитерирующую и диффузную);
- аритмогенная правожелудочковая.
Причины
Этиология данной патологии на сегодняшний день изучена не до конца. Существует ряд вероятных причин, способных вызвать развитие кардиомиопатии:
- наследственная предрасположенность (генетический дефект, который обуславливает неправильное формирование и функционирование мышечных волокон миокарда);
- различные вирусные инфекции (Коксаки, герпес, грипп и др.);
- ранее перенесенный миокардит;
- поражение клеток сердца токсинами и аллергенами;
- нарушения эндокринной регуляции (негативное действие соматотропного гормона и катехоламинов);
- нарушения иммунной системы.
Виды и симптомы кардиомиопатии
Дилатационная
Явные симптомы кардиомиопатии данного вида отсутствуют до момента развития сердечной недостаточности. Проявления заболевания зависят от вовлеченности одной или обеих камер сердца в начинающийся патологический процесс. В связи с возникающим при кардиомиопатии дефицитом кислорода возникает одышка, повышается утомляемость, увеличивается ЧСС. На начальной стадии заболевания перечисленные симптомы связаны только с воздействием физической нагрузки, а со временем они проявляются и в состоянии покоя. Возникают бессонница, головокружение, боль в груди и под левой лопаткой, отеки.
Гипертрофическая
При данной патологии нарушается расслабление (уменьшение растяжимости) камер сердца ухудшается кровообращение, меняется форма левого желудочка, утолщается перегородка, в результате повышается давление, а стенки выносящего тракта становятся все тоньше. Симптомами кардиомиопатии гипертрофического типа, наряду с одышкой и болью в груди, являются склонность больного к обморокам, усиленное сердцебиение. При такой патологии нарушение ритма может привести даже к внезапной смерти.
Рестриктивная
На начальной стадии жалобы пациентов практически не отличаются от перечисленных для других видов кардиомиопатии. Но с течением времени отечность ног, одышка и утомляемость сменяются более тяжелыми симптомами. Печень перестает нормально функционировать, увеличивается в размерах, далее развивается водянка. Нестабильность сердечного ритма достигает такой степени, что становится причиной частых обмороков.
Аритмогенная
Наиболее распространенный симптом – желудочковая аритмия. В числе жалоб больные называют приступообразное учащенное сердцебиение, чаще всего – при значительных физических нагрузках. Пациенты с перечисленными симптомами, в чьей семье уже были зафиксированы случаи ранней смерти при таких проявлениях, относятся к группе повышенного риска.
Последствия и осложнения
Для всех видов кардиомиопатии характерным осложнением является прогрессирующая сердечная недостаточность. Кроме того, могут развиваться артериальная и легочная тромбоэмболии, нарушения проводимости сердца, тяжелые формы аритмии. Велик риск внезапной сердечной смерти. При наличии у больного вредных привычек, таких как табакокурение и употребление алкоголя, прогноз существенно ухудшается. На продолжительность жизни также может оказать влияние наличие тромбоэмболии и тахикардии, особенно на фоне отсутствия лечения кардиомиопатии. На сегодняшний день облегчение течения заболевания для таких больных становится возможным благодаря современным технологиям ранней диагностике.
Диагностика
Диагностика кардиомиопатии в обязательном порядке включает описание клинической картины и данные дополнительных исследований. Самый распространенный способ – электрокардиография (ЭКГ) – позволяет зафиксировать признаки гипертрофии сердечной мышцы, выявить различные формы нарушений ритма и проводимости. Особенно информативна эхокардиография (ЭхоКГ), которая помогает определить дисфункцию миокарда. Благодаря данным рентгенографии обнаруживаются дилатация (стойкое увеличение просвета), гипертрофия (увеличение объема и массы) сердечной мышцы, а также застойные явления в легких. В некоторых случаях в рамках диагностики кардиомиопатии показано проведение вентрикулографии (рентгенологического исследования желудочковой системы), магнитно-резонансной томографии (МРТ) сердца и мультиспиральной компьютерной томографии (МСКТ), а также зондирование полостей сердца с целью забора биоматериалов для дальнейшего морфологического исследования.
Лечение
В связи с отсутствием специфической терапии лечение кардиомиопатии направлено на предотвращение несовместимых с жизнью осложнений. Если заболевание находится в стабильной фазе, все мероприятия назначаются и проводятся амбулаторно. Обязательно под наблюдением кардиолога. Показанием для периодической плановой госпитализации является наличие тяжелой сердечной недостаточности, для экстренной – развитие некупируемых пароксизмов аритмий, а также тромбоэмболия и отек легких.
Медикаментозное лечение. При различных проявлениях кардиомиопатии целесообразно назначение:
- диуретиков, которые уменьшают легочные и системные венозные застои;
- сердечных гликозидов, помогающих бороться с нарушениями сократимости и насосной функции миокарда;
- антиаритмических препаратов, помогающих скорректировать сердечный ритм;
- антикоагулянтов и антиагрегантов, позволяющих предотвратить возникновение тромбоэмболических осложнений кардиомиопатии.
Хирургическое лечение. Показано в исключительно тяжелых случаях. Среди практикуемых на сегодняшний день методов можно выделить септальную миотомию (резекцию увеличенного участка межжелудочковой перегородки) и протезирование митрального клапана, а также трансплантацию сердца целиком.
Кроме того, специалисты подчеркивают необходимость снижения физической активности, соблюдения диеты, важным условием которой является ограничение потребления животных жиров и соли. Настоятельно рекомендуется исключить вредные привычки и воздействие негативных внешних факторов. Соблюдение этих рекомендаций позволит существенно снизить нагрузку на миокард и замедлить прогрессирование сердечной недостаточности.
Прогноз при кардиомиопатиях
В отношении кардиомиопатии прогноз является неблагоприятным: неуклонное прогрессирование сердечной недостаточности становится причиной высокой вероятности аритмических, тромбоэмболических осложнений, а также внезапной смерти пациента. Согласно статистике, при дилатационной кардиомиопатии 5-летняя выживаемость составляет 30 %. Планомерное лечение способно стабилизировать состояние больного на неопределенный срок. Известны также случаи превышения 10-летней выживаемости после проведения операции по трансплантации сердца. Хирургическое лечение, например, при гипертрофической кардиомиопатии, дает положительный результат, однако связано с высоким риском гибели пациента во время либо после операции. Женщинам, у которых проведенная диагностика выявила наличие кардиомиопатии, не рекомендуется беременеть, поскольку вынашивание и роды связаны с высокой вероятностью материнской смерти.
Профилактика
На сегодняшний день предупредительных мер для наследственной (врожденной) кардиомиопатии не существует. Однако разработаны некоторые рекомендации по снижению риска развития сопутствующих заболеваний, ухудшающих ее течение – инфаркта миокарда, артериальной гипертензии. В целом профилактика сводится к ведению здорового образа жизни, включая занятия физкультурой и отказ от табака, алкоголя. Чтобы выявить фоновое заболевание (артериальную гипертензию, гиперхолестеринемию или сахарный диабет) на его ранней стадии, важно следовать следующим рекомендациям:
- регулярно посещать врача и проходить назначаемые им обследования;
- выполнять все рекомендации специалиста по смене образа жизни, режиме дня, рационе и т. д.;
- принимать лекарственные и иные средства в строгом соответствии с назначением врача.
Для пациентов с высокой степенью риска внезапной сердечной смерти имеет большое значение своевременная имплантация кардиовертера-дефибриллятора – устройства для купирования угрожающих аритмий.
Цены на услуги
Прайс временно недоступен. Ведется обновление цен. Актуальные цены уточняйте у операторов call-центра. Извините за доставленные неудобства.
Читайте также:
