Хлорамбуцил для химиотерапии хронического лимфолейкоза - эффективность
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Главная страница » Химиотерапия хронического лимфолейкоза
Химиотерапия хронического лимфолейкоза
Принципы химиотерапии ХЛЛ
В течение более 40 лет препаратом выбора при хроническом лимфолейкозе был хлорамбуцил (лейкеран, хлорбутин). Хлорамбуцил в качестве монотерапии или в комбинации с преднизолоном позволял почти у всех больных добиться снижения уровня лейкоцитов, а использование его при первых признаках прогрессирования заболевания у ряда больных на несколько лет сдерживало это прогрессирование. Поскольку у подавляющего числа больных с помощью хлорамбуцила, его комбинации с преднизолоном и появившихся поздней других подобных препаратов (циклофосфан, дегранол, дипин, фотрин) удавалось получить лишь частичные ремиссии, в 70-80-х годах для лечения ХЛЛ стали применяться новые комбинированные схемы. Однако это не привело к существенным изменениям в статистике выживаемости. Это дало основание считать, что химиотерапия не привела к увеличению продолжительности жизни больных ХЛЛ в течение трех десятилетий (60-90 годы), а некоторое ее увеличение за этот период связано с более эффективным лечением инфекций, являющихся наиболее частым и грозным осложнением и основной причиной смерти больных ХЛЛ.
В начале 90-х годов в лечении хронического лимфолейкоза произошло событие, заметно изменившее имевшиеся результаты: появились новые лекарства, позволившие сделать первый шаг в увеличении продолжительности жизни больных ХЛЛ благодаря существенному увеличению числа и продолжительности полных ремиссий. Из трех препаратов (флюдарабин, пентостатин и кладрибин) наибольшую эффективность при хроническом лимфолейкозе продемонстрировал флюдарабин. К настоящему времени флюдарабин считается наиболее эффективным препаратом в терапии ХЛЛ.
Высокоэффективной оказалась комбинация антител с флюдарабином и циклофосфаном. К сожалению, лечение моноклональными антителами сопряжено с целым рядом побочных эффектов: высокая температура, озноб, нередко одышка и падение артериального давления, которые часто сопровождают первое введение препаратов, особенно у больных с высоким лейкоцитозом, Не менее серьезным является резкое снижение иммунитета и развитие тяжелых инфекций в связи с действием антител на нормальные лимфоциты. Поэтому лечение антителами, следует сочетать с антибактериальной и противовирусной терапией.
Трансплантация костного мозга или периферических стволовых клеток при ХЛЛ не получили столь широкого распространения, как при других лейкозах, в связи с пожилым возрастом большинства пациентов и частым отсутствием совместимого донора. Тем не менее, к настоящему времени сделано более 400 трансплантаций. Аллогенная трансплантация считается показанной больным до 55 лет с вышеуказанными неблагоприятными прогностическими признаками, больным до 65 лет при наличии признаков плохого прогноза показана аутологичная трансплантация.
Новые методы лечения в сочетании с успехами антибиотической, противогрибковой и противовирусной терапии привели к тому, что если в 80-х годах 10 и более лет жили всего 30% больных ХЛЛ, в 90-х - 50%, то в настоящее время этот процент возрос до 60.
Среди новых направлений терапевтических поисков, прежде всего, следует упомянуть радиоиммунотерапию - препарат Zevalin Продолжается поиск наиболее эффективных комбинаций препаратов, включающих флюдарабин, особенно для плохо поддающихся стандартной терапии вариантов ХЛЛ - пролимфоцитарного и Т-клеточного. Первые обнадеживающие результаты получены при сочетании флюдарабина с гуанин-арабинозидом (Ara-G). На стадии лабораторного изучения находятся работы по созданию антиидиотипических вакцин.
Хлорамбуцил для химиотерапии хронического лимфолейкоза - эффективность
Хлорамбуцил для химиотерапии хронического лимфолейкоза - эффективность
Главной целью лечения хронического лимфолейкоза является сокращение общей лимфоцитарной массы с тем, чтобы дезинфильтрировать ткани и особенно костный мозг.
Терапевтические показания для лечения хронического лимфолейкоза:
— Специфическое лечение противопоказано в стадии 0.
— Если болезнь стабилизировалась, то есть физические признаки или гематологические данные остаются без изменений в течение 12 месяцев или более не следует назначать цитотоксическое лечение ни в стадиях I—IV (Foa). «Стабильная» Хр.Л.Л. наблюдается обычно в стадиях I-II.
— В том случае, когда существует тенденция прогрессивного снижения гемоглобина (менее 11 г%) или тромбоцитов (менее 100 000/мм 3 ), или увеличение более чем на 50% объема селезенки или лимфатических узлов, или же удвоение числа лимфоцитов в течение 6—12 месяцев, болезнь считается прогрессивной и требуется применение цитотоксического лечения (Foa).
Прогрессивный характер болезни наблюдается обычно в стадиях III и IV.
— Лимфоцитарная инфильтрация нелимфатических органов (конъюнктивы, кожа и пр.) является также показанием для лечения.
Основными терапевтическими агентами являются алкилирующие препараты и лучевые агенты (среди которых мы представим подробнее лишь ходовые) и глюкокортикоидные гормоны.
Хлорамбуцил (синонимы: leukeran, clorammophene) является элективным медикаментом при хроническом лимфолейкозе, так как он значительно сокращает лимфоцитарную массу и хорошо переносится. Вводится перорально в один прием утром, за час до еды. Суточная доза — 0,1—0,2 мг/кг/сутки. На практике дается 6—8 мг/сутки. Доза выше 12 мг/сутки может вызывать диггестивные расстройства (отсутствие аппетита, понос) или резкий клеточный лизис с опасностью возникновения мочекислой нефропатии. Следует производить еженедельно контрольные гемограммы. Обычно, спутся 14 дней лечения, лейкоцитоз начинает сокращаться; начальную дозу надо сокращать наполовину, когда лейкоцитоз сократился наполовину.
Сохраняется доза в 2—4 мг/сутки до тех пор, пока число лейкоцитов становится ниже 7 000/мм 3 . Если вместе с нормализацией количества лейкоцитов не было достигнуто главной цели лечения (корригирование медуллярной недостаточности, сокращение объема лимфатических органов и пр.), надо продолжать применение малых доз хлорамбуцила (1—2 мг/сутки) до получения хорошего ответа. После осуществления ремиссии, можно либо прекращать введение медикамента с произведением ежемесячного контроля и возобновлением терапии если болезнь опять становится активной (интермиттирующее лечение), либо назначать дозы поддерживания — 0,5—2 мг/сутки в зависимости от числа лейкоцитов и с возобновлением дозы 6—8 мг/сутки, когда болезнь декомпенсируется (непрерывное лечение).
Интермиттирующее и непрерывное лечения хлорамбуцилом давали приблизительно одинаковые результаты. Однако теоретически, следует предпочитать интермиттирующее лечение, которое по-видимому способствует восстановлению гематопоэтического костного мозга и благоприятствует функциональному восстановлению иммунной системы. Существуют еще следующие варианты интермиттирующего лечения хронического лимфолейкоза: а) лечение хронического лимфолейкоза хлорамбуцилом с циклами и интервалами (Speck): 4—8 мг/сутки 2—3 недели с 2—3 недельной паузой; 4—8 мг/сутки 2—3 недели, затем пауза и т.д.;

б) двумесячное лечение хронического лимфолейкоза хлорамбуцилом (Knospe): 0,4 мг/кг за сутки, пауза 14 дней; 0,5 мг/кг за сутки, пауза 14 дней и т.д. до получения хорошего контроля над болезнью или до появления токсических эффектов. Многие авторы рекомендуют, с целью получения наиблоее прочной ремиссии, введение общей дозы 10 мг/кг хлорамбуцила.
Во время лечения хлорамбуцилом следует принимать меры по предупреждению мочекислой нефропатии, причем эти меры действительны и для лечения любым противолейкемическим препаратом: гидратация больного (2—3 литра жидкости в сутки), алкалинизация мочи при помощи 10—15 г бикарбоната натрия в сутки и, у больных с тенденцией к гиперурикемии, по 300 мг/сутки аллопуринола.
Результаты лечения хронического лимфолейкоза хлорамбуцилом: после первого курса лечения получаются ремиссии у 2/3 больных. Продолжительность ремиссий — в среднем 9 месяцев. При последующих курсах число и качество ремиссий прогрессивно понижаются. После вариабилыюго числа курсов лечения появляется устойчивость к хлорамбуцилу, что заставляет нас прибегать сбычно к лучевым агентам. Применение последних должно начаться спустя месяц после прекращения приема хлорамбуцила. Единственный важный токсический эффект хлорамбуцила -— медуллярная гипоплазия.
Она возникает главным образом у больных с развитой медуллярной недостаточностью, которым даются чрезмерно высокие общие дозы. Во измежание медуллярной гипоплазии надо внимательно следить за Гб, ретикулоцитами, тромбоцитами и нейтрофилмаи; если после 3—4 недель лечения они сокращаются без понижения числа лейкоцитов, лечение прерывается.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Обинутузумаб в качестве первой линии терапии при хроническом лимфолейкозе: обновленные результаты исследования CLL11
Среди опухолей лимфатической системы хронический лимфолейкоз (ХЛЛ) составляет около 7% случаев. ХЛЛ — в основном болезнь людей пожилого возраста. Более 70% заболевают в возрасте старше 60 лет, средний возраст пациентов составляет 65–69 лет. У менее 10% заболевание возникает в возрасте до 40 лет. Ежегодная заболеваемость ХЛЛ составляет 3–3,5 на 100 тыс. жителей, увеличиваясь до 20 на 100 тыс. для лиц в возрасте старше 65 и до 50 на 100 тыс. — для возрастной категории старше 70 лет [1].
Выбор подходов к терапии пациентов с ХЛЛ зависит от ряда факторов: возраста пациента, распространенности опухолевого процесса, наличия и тяжести сопутствующей патологии, биологических характеристик опухоли и др. Применение современных таргетных препаратов для лечения ХЛЛ позволяет расширить возможности терапии пациентов пожилого возраста, а также существенно увеличить продолжительность их жизни.
Обинутузумаб — новое гликоинжиниринговое гуманизированное моноклональное антитело ІІ типа, которое связывается с CD20-рецептором. В доклинических исследованиях обинутузумаб показал более высокую противолейкемическую активность по сравнению с таковой у негликоинжиниринговых анти-CD20-антител — ритуксимаба и офатумумаба [2–4].
Обинутузумаб в сочетании с хлорамбуцилом показан для лечения взрослых пациентов с ХЛЛ, которые ранее не получали лечения и имеют сопутствующие заболевания, что делает невозможным проведение терапии на основе флударабина в полных дозах. Решение об одобрении препарата было основано на первичных результатах исследования CLL11 (NCT01010061), в ходе которого изучали применение обинутузумаба в сочетании с хлорамбуцилом, ритуксимаба в сочетании с хлорамбуцилом или монотерапии хлорамбуцилом у пациентов, которые ранее не получали лечения и имеют сопутствующие заболевания [5]. При анализе данных по состоянию на май 2013 г., схема терапии обинутузумаб + хлорамбуцил продемонстрировала превосходство над схемой ритуксимаб + хлорамбуцил в отношении выживаемости без прогрессирования заболевания (ВБП) и ответа на лечение. Добавление обинутузумаба к хлорамбуцилу привело к повышению общей выживаемости (ОВ) по сравнению с лечением только хлорамбуцилом, тогда как добавление ритуксимаба к хлорамбуцилу по сравнению с только хлорамбуцилом не привело к статистически достоверному увеличению ОВ. Также не отмечено значимых различий в ОВ между группой, получавшей обинутузумаб + хлорамбуцил, и пациентами, которым была назначена терапия комбинацией ритуксимаб + хлорамбуцил.
В 2015 г. опубликованы обновленные результаты данного исследования относительно ВБП и ОВ по итогам апреля 2014 г. [6]. Так, в исследовании приняли участие 781 пациент с ХЛЛ, которые ранее не получали лечения и нуждались в проведении терапии на фоне тяжелой коморбидной патологии. Все участники были включены в исследование в период с апреля 2010 г. по июль 2012 г. и рандомизированы на три группы: первая получала обинутузумаб + хлорамбуцил, вторая — ритуксимаб + хлорамбуцил, а третья — только хлорамбуцил. Диагноз ХЛЛ был установлен в соответствии с критериями Международной рабочей группы по хроническому лимфолейкозу (International Workshop on Chronic Lymphocytic Leukemia) [7]. Тяжесть коморбидной патологии оценивали по системе CIRS (Cumulative Illness Rating Scale) и путем расчета клиренса креатинина, используя формулу Кокрофта — Голта. Таким образом, в исследование были включены пациенты, соответствовавшие следующим критериям: CIRS >6 и/или клиренс креатинина 30–69 мл/мин [8, 9].
Группы пациентов были хорошо сбалансированы по демографическим показателям и характеристикам заболевания. Медиана возраста пациентов, включенных в исследования, составила 73 года. При этом наиболее распространенными коморбидными заболеваниями были заболевания почек, сердечно-сосудистой, дыхательной систем и опорно-двигательного аппарата, а также метаболизма (медиана CIRS составила 8, диапазон 0–22). Делеции 17p или 11q и немутировавший IGHV выявлены у 8% пациентов, получавших обинутузумаб + хлорамбуцил, 16% больных, применявших ритуксимаб + хлорамбуцил, и 61% пациентов, получавших только хлорамбуцил. Данный анализ не показал каких-либо ранее не проявлявшихся побочных реакций. На рис. 1–6 показаны обновленные данные ВБП и ОВ. Показатель ВБП значительно улучшился для группы, получавшей обинутузумаб + хлорамбуцил, по сравнению с группой, которой была назначена терапия по схеме ритуксимаб + хлорамбуцил. Так, медиана ВБП составила 29,2 мес по сравнению 15,4 мес соответственно (отношение рисков — ОР — 0,40; 95% доверительный интервал — ДИ — 0,33–0,50; p<0,001).
Рис. 1. Обновленные данные ВБП для группы, получавшей обинутузумаб + хлорамбуцил, по сравнению с пациентами, получавшими ритуксимаб + хлорамбуцил
Адаптировано из: Goede V., Fischer K., Engelke A. et al., 2015 [6]
Рис. 2. Обновленные данные ОВ для
группы, получавшей обинутузумаб + хлорамбуцил, по сравнению с пациентами, получавшими ритуксимаб + хлорамбуцил
Адаптировано из: Goede V., Fischer K., Engelke A. et al., 2015 [6]
Рис. 3. Обновленные данные ВБП для группы, получавшей обинутузумаб + хлорамбуцил, по сравнению с пациентами, получавшими хлорамбуцил
Адаптировано из: Goede V., Fischer K., Engelke A. et al., 2015 [6].
Рис. 4. Обновленные данные ОВ для группы, получавшей обинутузумаб + хлорамбуцил, по сравнению с пациентами, получавшими хлорамбуцил
Адаптировано из: Goede V., Fischer K., Engelke A. et al., 2015 [6]
Рис. 5. Обновленные данные ВБП для группы, получавшей ритуксимаб + хлорамбуцил, по сравнению с пациентами, получавшими хлорамбуцил
Адаптировано из: Goede V., Fischer K., Engelke A. et al., 2015 [6]
Рис. 6. Обновленные данные ОВ для группы, получавшей ритуксимаб + хлорамбуцил, по сравнению с пациентами, получавшими хлорамбуцил
Адаптировано из: Goede V., Fischer K., Engelke A. et al., 2015 [6]
Таблица. Последующие линии терапии, которые получали пациенты после лечения с применением схем обинутузумаб + хлорамбуцил, ритуксимаб + хлорамбуцил или хлорамбуцила
| Первая линия терапии | |||
| Обинутузумаб + хлорамбуцил, n (%) | Ритуксимаб + хлорамбуцил, n (%) | Хлорамбуцил, n (%) | |
| Пациенты в группе терапии | 333 (100) | 330 (100) | 118 (100) |
| Пациенты, которые получали хотя бы один новый тип лечения | 76 (23) | 117 (35) | 70 (59) |
| Последующие типы терапии, которые назначались пациентам | |||
| Флударабин + циклофосфамид или флударабин | 3 (1) | 8 (2) | 4 (3) |
| Флударабин + циклофосфамид или флударабин + ритуксимаб | 14 (4) | 20 (6) | 7 (6) |
| Флударабин + циклофосфамид или флударабин + офатумумаб | 0 (0) | 2 (1) | 0 (0) |
| Флударабин + циклофосфамид или флударабин + обинутузумаб | 0 (0) | 0 (0) | 0 (0) |
| Бендамустин | 10 (3) | 6 (2) | 3 (3) |
| Бендамустин + ритуксимаб | 17 (5) | 33 (10) | 18 (15) |
| Бендамустин + офатумумаб | 0 (0) | 0 (0) | 0 (0) |
| Бендамустин + обинутузумаб | 2 (1) | 1 ( <1) | 0 (0) |
| Хлорамбуцил | 13 (4) | 12 (4) | 7 (6) |
| Хлорамбуцил + ритуксимаб | 2 (1) | 0 (0) | 2 (2) |
| Хлорамбуцил+ офатумумаб | 0 (0) | 0 (0) | 0 (0) |
| Хлорамбуцил+ обинутузумаб | 0 (0) | 0 (0) | 30 (25) |
| CHOP(-like) | 0 (0) | 3 (1) | 0 (0) |
| CHOP(-like) + ритуксимаб | 4 (1) | 3 (1) | 2 (2) |
| COP(-like) | 0 (0) | 3 (1) | 2 (2) |
| COP(-like) + ритуксимаб | 0 (0) | 6 (2) | 3 (3) |
| Ритуксимаб без химиотерапии | 8 (2) | 6 (2) | 0 (0) |
| Офатумумаб без химиотерапии | 1 ( <1) | 4 (1) | 0 (0) |
| Обинутузумаб без химиотерапии | 0 (0) | 0 (0) | 0 (0) |
| Алемтузумаб без/с химиотерапией | 2 (1) | 6 (2) | 1 (1) |
| Экспериментальное лечение | 4 (1) | 12 (4) | 1 (1) |
| Другое | 3 (1) | 7 (2) | 3 (3) |
На основании полученных данных сделан вывод о том, что добавление какого-либо из моноклональных антител (ритуксимаба или обинутузумаба) в первой линии химиотерапии приводит к продлению жизни и влияет на течение ХЛЛ у пациентов пожилого возраста, что согласуется с результатами, полученными по показателю ОВ при проведении химиоиммунотерапии в исследованиях с участием молодых пациентов [10, 11]. В недавно опубликованном исследовании, в котором сравнивали офатумумаб в сочетании с хлорамбуцилом с монотерапией хлорамбуцилом в качестве первой линии терапии у пациентов пожилого возраста, также пока не сообщается о наличии статистически достоверного преимущества относительно ОВ при использовании химиоиммунотерапии [12], которое, однако, может быть отмечено при последующих анализах более поздних данных. Основываясь на полученных результатах, можно говорить о том, что химиоиммунотерапию с применением анти-CD20-антител следует рассматривать в качестве стандарта медицинской помощи у пациентов всех возрастных групп, ранее не получавших лечения по поводу ХЛЛ и нуждающихся в терапии. Тем не менее преимущества применения анти-CD20-антител в сочетании с новыми таргетными препаратами требуют в дальнейшем детального изучения [13–16]. Представленные результаты показывают, что оптимизация лечения с использованием новых или модифицированных анти-CD20-антител может иметь большой потенциал в терапии пациентов с ХЛЛ. В анализируемом исследовании [5] применение обинутузумаба вместо ритуксимаба в сочетании с хлорамбуцилом позволило увеличить медиану ВБП почти в 2 раза — практически до 30 мес. Наблюдения в рамках данного исследования продолжаются, в будущем ожидаются дальнейшие обновления данных ОВ для обинутузумаба по сравнению с другими режимами терапии.
Список использованной литературы
1. Жевак Т.Н., Чеснокова Н.П., Шелехова Т.В. (2011) Хронический лимфолейкоз: современные концепции этиологии, патогенеза и особенностей клинического течения (обзор). Саратовский научно-медицинский журнал, 7(2).
2. Patz M., Isaeva P., Forcob N. et al. (2011) Comparison of the in vitro effects of the anti-CD20 antibodies rituximab and GA101 on chronic lymphocytic leukaemia cells. Br. J. Haematol., 152: 295–306.
3. Mossner E., Brunker P., Moser S. et al. (2010) Increasing the efficacy of CD20 antibody therapy through the engineering of a new type II anti-CD20 antibody with enhanced direct and immune effector cell-mediated B-cell cytotoxicity. Blood, 115: 4393–4402.
4. Herter S., Herting F., Mundigl O. et al. (2013) Preclinical activity of the type II CD20 antibody GA101 (obinutuzumab) compared with rituximab and ofatumumab in vitro and in xenograft models. Mol. Cancer Ther., 12: 2031–2042.
5. Goede V., Fischer K., Busch R. et al. (2014) Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N. Engl. J. Med., 370: 1101–1110.
6. Goede V., Fischer K., Engelke A. et al. (2015) Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: updated results of the CLL11 study. Leukemia, 29: 1602–1604.
7. Hallek M., Cheson B.D., Catovsky D. et al. (2008) Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood, 111: 5446–5456.
8. Parmelee P.A., Thuras P.D., Katz I.R., Lawton M.P. (1995) Validation of the Cumulative Illness Rating Scale in a geriatric residential population. J. Am. Geriatr. Soc., 43: 130–137.
9. Cockcroft D.W., Gault M.H. (1976) Prediction of creatinine clearance from serum creatinine. Nephron, 16: 31–41.
10. Hallek M., Fischer K., Fingerle-Rowson G. et al. (2010) Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet, 376: 1164–1174.
11. Tam C.S., O’Brien S., Wierda W. et al. (2008) Long-term results of the fludarabine, cyclophosphamide, and rituximab regimen as initial therapy of chronic lymphocytic leukemia. Blood, 112: 975–980.
12. Hillmen P., Robak T., Janssens A. et al. (2013) Ofatumumab + chlorambucil versus chlorambucil alone in patients with untreated chronic lymphocytic leukemia (CLL): results of the phase III study complement 1 (OMB110911). Blood, 122: 528.
13. Burger J.A., Keating M.J., Wierda W.G. et al. (2014) Safety and activity of ibrutinib plus rituximab for patients with high-risk chronic lymphocytic leukaemia: a single-arm, phase 2 study. Lancet Oncol., 15: 1090–1099.
14. Byrd J.C., Brown J.R., O’Brien S. et al. (2014) Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N. Engl. J. Med., 371: 213–223.
15. Furman R.R., Sharman J.P., Coutre S.E. et al. (2014) Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N. Engl. J. Med., 370: 997–1007.
16. O’Brien S., Furman R.R., Coutre S.E. et al. (2014)Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol., 15: 48–58.
Хронический лимфолейкоз (ХЛЛ)
Хронический лимфоцитарный лейкоз (ХЛЛ) характеризуется прогрессирующим накоплением фенотипически зрелых злокачественных В-лимфоцитов. Первичные места заболевания включают периферическую кровь, костный мозг, селезенку и лимфоузлы. Симптоматика заболевания может отсутствовать или проявляться лимфаденопатией, спленомегалией, гепатомегалией, утомляемостью, лихорадкой, ночными приливами, непреднамеренной потерей веса и чувством быстрого насыщения. Диагноз ставится на основании результатов проточной цитометрии и иммунофенотипирования периферической крови. Лечение откладывается до появления симптомов и, как правило, включает проведение химиотерапии и иммунотерапии. Тем не менее методы лечения прогрессируют, и схемы терапии первой линии могут включать в себя целевые агенты, такие как ингибиторы тирозинкиназы Брутона (Btk) и регуляторы апоптоза Bcl-2, с химиотерапией или без нее.
Хотя причина ХЛЛ неизвестна, в некоторых случаях отмечается семейный анамнез. ХЛЛ редко встречается в Японии и Китае и, судя по данным, частота заболеваемости не увеличивается у этнических японцев, живущих в Соединенных Штатах Америки, что также подтверждает важность генетических факторов. Наиболее распространен ХЛЛ у евреев из Восточной Европы.
Патофизиология ХЛЛ
Во время хронического лимфолейкоза CD5-положительные B-клетки подвергаются злокачественной трансформации. В-клетки непрерывно активируются путем приобретения мутаций, что приводит к моноклональному В-клеточному лимфоцитозу (MBL). Дальнейшее накопление генетических аномалий и последующая онкогенная трансформация моноклональных В-клеток приводит к развитию ХЛЛ. Лимфоциты сначала накапливаются в костном мозге, а затем распространяются в лимфатические узлы и другие лимфоидные ткани, в конечном итоге вызывая спленомегалию, гепатомегалию, а также системные проявления, такие как утомляемость, лихорадка, ночная потливость, чувство быстрого насыщения и необъяснимое снижение массы тела.
По мере прогрессирования ХЛЛ аномальный гемопоэз приводит к анемии, нейтропении, тромбоцитопении и снижению выработки иммуноглобулина. Гипогаммаглобулинемия может развиться у двух третей пациентов, повышая риск развития инфекционных осложнений. Пациенты имеют повышенную восприимчивость к аутоиммунным гемолитическим анемиям (с прямой положительной антиглобулиновой реакцией) и аутоиммунной тромбоцитопении.
ХЛЛ может прогрессировать в В-клеточный пролимфоцитарный лейкоз, а также может трансформироваться в высоко дифференцированную неходжкинскую лимфому Неходжкинские лимфомы Неходжкинские лимфомы представляют собой гетерогенную группу заболеваний, развивающихся по причине злокачественной моноклональной пролиферации лимфоидных клеток в лимфоретикулярной ткани в лимфоузлах. Прочитайте дополнительные сведенияСимптомы и признаки ХЛЛ
На ранних стадиях часто протекает бессимптомно с незаметным появлением неспецифических симптомов (например, усталости, слабости, анорексии, потери веса, лихорадки и/или ночной потливости), которые могут побуждать к проведению диагностики. У более половины пациентов наблюдается лимфаденопатия. Она может быть локализованной (чаще всего поражены шейные и надключичные узлы) или генерализованной. Спленомегалия и гепатомегалия встречаются реже, чем лимфаденопатия. Поражение кожи (лейкоз кожи) встречается редко.
Хронический лимфолейкоз
Хронический лимфолейкоз — злокачественное лимфопролиферативное заболевание, при котором опухолевыми клетками являются патологические В-лимфоциты, способные накапливаться в костном мозге, периферической крови и лимфатических узлах. В норме В-лимфоциты в течение своей жизни превращаются в иммуноглобулинсекретирующую клетку, которая обеспечивает приобретённый иммунитет. Опухолевые В-лимфоциты такой функции лишены, и, таким образом, иммунитет больного страдает, и повышается риск присоединения инфекционных заболеваний. Помимо этого, по мере прогрессирования заболевания нарушается выработка эритроцитов, нейтрофилов и тромбоцитов, возможно развитие аутоиммунных процессов. Наконец, хронический лимфолейкоз может трансформироваться в В-клеточный пролимфоцитарный лейкоз, в высокодифференцированную неходжкинскую лимфому, в частности — в диффузную В-крупноклеточную лимфому.
Причины развития лимфолейкоза
Хронический лейкоз является самым распространённым видом лейкоза, составляя до 30% в общей структуре заболеваемости. Частота встречаемости составляет 4 случая на 100 тысяч населения; у лиц старше 80 лет частота составляет более 30 случаев на 100 тысяч населения.
Факторами риска развития хронического лимфолейкоза являются:
- Пожилой возраст. До 70% всех выявленных случаев приходится на людей старше 60 лет,
- Мужской пол. Мужчины заболевают в два раза чаще женщин,
- Воздействие ионизирующего излучения,
- Контакт с бензолом и бензином.
Симптомы
Для хронического лимфолейкоза характерно длительное бессимптомное течение; основной причиной обращения к врачу являются изменения в общем анализе крови, сданном в рамках профилактического осмотра или по поводу иного заболевания. Активных жалоб на момент первичного осмотра пациент может и не предъявлять, но при этом зачастую даже в этой ситуации уже выявляется увеличение лимфатических узлов и изменение их консистенции до тестоватой. Сами лимфоузлы не уплотнены, сохраняют подвижность относительно окружающих тканей. В случае присоединения инфекции лимфатические узлы значительно увеличиваются; по мере прогрессирования хронического лимфолейкоза лимфоузлы — в первую очередь брюшной полости — способны
образовывать конгломераты.
Первые возникающие жалобы обычно не носят специфического характера: повышенная утомляемость, слабость, выраженная потливость. По мере развития заболевания могут возникнуть аутоиммунные проявления, в первую очень гемолитические анемии (в 10-25% случаев) и тромбоцитопении (в 2-3% случаев). Гемолитическая анемия развивается в связи с разрушением самим организмом эритроцитов; чаще всего развивается, как и сам хронический лимфолейкоз, постепенно, но может проявиться и острым кризом — с повышением температуры, появлением желтухи, потемнения мочи. Тромбоцитопения может быть гораздо более опасным состоянием в связи с развитием кровотечений, в том числе и жизнеугрожающих (например, кровоизлияния в головной мозг).
Кроме того, так как В-лимфоциты относятся к клеткам, обеспечивающим иммунитет, типичным является присоединение инфекционных осложнений, в том числе оппортунистических, то есть вызванных микроорганизмами, постоянно находящимися в человеческом организме и не проявляющими себя при адекватном иммунном ответе. Чаще всего оппортунистическими инфекциями поражаются лёгкие.
Диагностика хронического лимфолейкоза
Диагноз хронического лимфолейкоза может быть заподозрен при оценке результатов обычного клинического анализа крови — обращает на себя внимание увеличение абсолютного количества лимфоцитов и лейкоцитов. Основным диагностическим критерием является абсолютное количество лимфоцитов, превышающее 5×10 9 \л и прогрессивно увеличивающееся по мере развития лимфолейкоза, достигая цифр 100-500×10 9 \л. Важно обращать внимание не только на абсолютное число, — если в начале заболевания лимфоциты составляют до 60-70% от всего количества лейкоцитов, то при его дальнейшем развитии они могут составлять 95-99%. Другие показатели крови, такие, как гемоглобин и тромбоциты, могут быть в норме, но при прогрессировании заболевания может быть выявлено их снижение. Абсолютным критерием для установки диагноза «хронический лимфолейкоз» является выявление более 5000 клональных В-лимфоцитов в 1 мкл периферической крови.
В биохимическом анализе крови может быть выявлено снижение общего белка и количества иммуноглобулинов, но это характерно для более поздних стадий заболевания. Обязательным этапом в диагностическом поиске является трепанбиопсия костного мозга. При гистологическом исследовании полученного пунктата на ранних этапах заболевания так же, как и в общем анализе крови, обнаруживается небольшое содержание лимфоцитов (40–50%), но при высоком лейкоцитозе лимфоциты могут составлять 95–98% костномозговых элементов.
Так как изменения в костном мозге являются неспецифическими, окончательный диагноз хронического лимфолейкоза устанавливается на основании данных иммуногистохимического исследования. Характерный иммунофенотип хронического лимфолейкоза включает экспрессию антигенов CD19, CD5, CD20, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов IgM (нередко одновременно с IgD) и антигенов CD20 и CD22. Главным цитогенетическим маркером, непосредственно влияющим на выбор терапии, является делеция 17p. Желательно выполнять анализ, направленный на выявлении этой делеции, до начала лечения, так как её выявление приводит к изменению тактики ведения пациента. Помимо биопсии костного мозга, в случае значительного увеличения отдельных лимфатических узлов показана пункция и их с целью исключения лимфомы.
Из инструментальных методов диагностики проводятся рентгенография органов грудной клетки и УЗИ наиболее часто поражаемых групп лимфоузлов и органов брюшной полости – в первую очередь печени и селезёнки, так как именно эти органы чаще всего поражаются при хроническом лимфолейкозе.

Стадии заболевания
В настоящее время стадирование осуществляется согласно классификации, предложенной Binet:
- A — содержание гемоглобина более 100 г\л, тромбоцитов — более 100×10 9 \л, поражено менее трёх лимфатических областей (к ним относятся: шейные лимфоузлы, подмышечные лимфоузлы, паховые лимфоузлы, печень, селезёнка),
- B — содержание гемоглобина более 100 г\л, тромбоцитов — более 100×10 9 \л, поражено более трёх лимфатических областей,
- C — содержание гемоглобина менее 100 г\ или тромбоцитов — менее 100×10 9 \л.
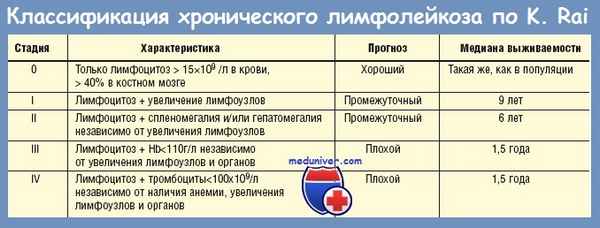
Помимо классификации по Binet, используется классификация по Rai, используемая преимущественно в США. Согласно ей, выделяют четыре стадии заболевания:
- 0 — клинические проявления включают в себя только повышение лимфоцитов более 15×10 9 в периферической крови и более 40% в костном мозге,
- I — повышено количество лимфоцитов, диагностируется увеличение лимфоузлов,
- II — повышено количество лимфоцитов, диагностируется увеличение печени и\или селезёнки вне зависимости от увеличения лимфоузлов,
- III — наблюдается повышение количества лимфоцитов и снижение уровня гемоглобина менее 110 г\л вне зависимости от увеличения селезёнки, печени и лимфоузлов,
- IV — наблюдается повышение количества лимфоцитов и снижение числа тромбоцитов менее 100×10 9 вне зависимости от уровня гемоглобина, увеличения органов и лимфоузлов.
0 стадия характеризуется благоприятным прогнозом, I и II — промежуточным, III и IV — неблагоприятным.
Лечение
В настоящее время хронический лимфолейкоз хорошо поддаётся лечению благодаря широкому спектру химиотерапевтических препаратов. Важно отметить, что современные руководства не рекомендуют начинать агрессивное лечение сразу же после установки диагноза — в случаях, когда клинические проявления минимальны, возможно активное динамическое наблюдение до момента возникновения показаний к проведению специфического лечения, к коим относятся:
- Возникновение или нарастание интоксикации, которая проявляется потерей массы тела более чем на 10% за полгода, ухудшением общего состояния; появление лихорадки, субфебрильной температуры, ночных потов.
- Нарастание явлений анемии и/или тромбоцитопении;
- Аутоиммунная анемия и/или тромбоцитопения — в случае, если состояние не корректируется преднизолоном;
- Значительные размеры селезёнки — нижний край на расстоянии >6 см и более ниже рёберной дуги;
- Размер поражённых лимфатических узлов более 10 см или его прогрессивное увеличение;
- Увеличение количества лимфоцитов более, чем на 50% за 2 месяца, или вдвое за 6 месяцев.
Основным методом лечения хронического лимфолейкоза на данный момент является химиотерапия. Один из первых химиотерапевтических агентов, показавших свою эффективность в лечении хронического лимфолейкоза, хлорамбуцил, используется и в настоящее время, хоть и ограниченно. С течением времени вместо хлорамбуцила стали использовать циклофосфамид, в комбинации с другими препаратами, и соответствующие схемы (например, CHOP, COP, CAP) на данный момент применяются у пациентов молодого возраста с хорошим соматическим статусом.
Впервые введённый в клиническую практику в 80-х годах прошлого века флударабин показал эффективность в отношении достижения стойкой ремиссии, превышающую эффективность хлорамбуцила, особенно в сочетании с циклофосфамидом. Важно отметить, что эта схема эффективна даже в случае развития рецидива заболевания. Последним словом в лечении хронического лейкоза в настоящее время является применение иммунотерапевтических средств — препаратов из группы моноклональных тел. В рутинную клиническую практику прочно вошел ритуксимаб. Данный препарат взаимодействует с антигеном CD20, который ограниченно экспрессируется при хроническом лимфолейкозе, поэтому для эффективного лечения требуется сочетание ритуксимаба с какой-либо из принятых схем химиотерапии, чаще всего с флударабином или COP. Ритуксимаб в монорежиме может применяться как поддерживающая терапия при частичном ответе на лечение.
Перспективным выглядит применение препарата алемтузумаб, который взаимодействует с антигеном CD52. Его также используют как в монорежиме, так и в комбинации с флударабином.
Отдельно хотелось бы упомянуть хронический лимфолейкоз с делецией 17p. Этот подтип лимфолейкоза часто бывает резистентен к стандартным схемам химиотерапии.
Определённые успехи в лечении этого подвида лимфолейкоза достигнуты благодаря применению упомянутого выше алемтузумаба. Кроме того, перспективным средством в этой ситуации является ибрутиниб. В настоящее время этот препарат применяется в монорежиме, сочетание его с различными схемами химиотерапии исследуется; определённое преимущество показала схема, включающая ибрутиниб, ещё одно моноклональное тело — ритуксимаб, и бендамустин.

Лучевая терапия, которая столетие назад была практически единственной возможностью лечения таких больных, и по сей день не утратила актуальности: рекомендуется её проведение в рамках комплексного подхода на область поражённых лимфоузлов, если наблюдается их продолженный рост на фоне стабилизации остальных проявлений заболевания. В этом случае необходимая суммарная доза составляет 20-30 Гр. Также лучевой метод может быть применён при рецидивах заболевания.
В лечении хронического лимфолейкоза нашёл своё место и хирургический метод, заключающийся в удалении поражённой селезёнки. Показаниями к данному вмешательству являются:
- Увеличение селезёнки в сочетании с тяжелой анемией и/или тромбоцитопенией, особенно если наблюдается химиорезистентность,
- Массивное увеличение селезёнки при условии отсутствия ответа на химиотерапию,
- Тяжёлая аутоиммунная анемия и/или тромбоцитопения при резистентности к медикаментозному лечению.
При развитии резистентности к применяемым ранее химиотерапевтическим агентам или же при быстром прогрессировании после проведённого лечения может быть проведена трансплантация костного мозга. Трансплантация костного мозга показана в первой ремиссии пациентам из группы высокого риска, молодым пациентам в отсутствие эффекта от проводимого лечения, пациентам с делецией 17p/мутацией TP53 при наличии прогрессии заболевания. Важно отметить, что после проведённой трансплантации рекомендуется применение ритуксимаба и леналидомида в качестве поддерживающей терапии с целью предотвращения рецидива.
Наконец, пациентам требуется проведение и поддерживающей терапии, которая включает:
- Переливание эритроцитарной массы при анемии;
- Переливание тромбоцитарной массы при кровотечении, вызванном тромбоцитопенией;
- Противомикробные средства при присоединении бактериальной, грибковой или вирусной инфекции, а также для её профилактики;
- Применение преднизолона в дозе 1-2 мг/кг при развитии аутоиммунных процессов.
В случае развития рецидива заболевания тактика лечения зависит от ряда факторов, таких как: проведённая ранее терапия, срок наступления рецидива, клиническая картина. В случае раннего (то есть возникшего в периоде 24 месяцев и ранее) рецидива основным препаратом является ибрутиниб. Он применяется как самостоятельно, так и в составе упомянутой выше схемы лечения (ибрутиниб+ритуксимаб+бендамустин).
Альтернативным препаратом выбора может быть алемтузумаб. Демонстрируя сопоставимую с ибрутинибом эффективность, он, однако, демонстрирует значительно большую токсичность.
Наконец, у ряда пациентов по поводу раннего рецидива хронического лимфолейкоза может быть выполнена трансплантация костного мозга.
В случае позднего (возникшего в срок более 24 месяцев с момента завершения лечения) рецидива основным критерием выбора является проведённая ранняя терапия.
- Если проводимая ранее терапия на основе флударабина не сопровождалась значительной токсичностью, то можно вернуться к этой схеме, а также дополнить её ритуксимабом.
- В случае выявления цитопении возможно применение ритуксимаба в сочетании с высокими дозами глюкокортикостероидов.
- При проведённом ранее лечении хлорамбуцилом показано применение схем с флударабином или сочетанием бендамустина и ритуксимаба.
- Монотерапия ибрутинибом или его сочетание с одной из схем полихимиотерапии также может быть эффективна при рецидиве хронического лимфолейкоза.
Оценка эффективности лечения
Диагностические исследования, направленные на оценку эффекта от проведённого лечения, проводятся не ранее, чем через 2 месяца после окончания последнего курса химиотерапии. Результат может быть оценён следующим образом:
- Полная ремиссия: уменьшение до нормальных размеров печени, селезёнки, лимфоузлов (допустимо их увеличение в размере не более чем 1,5 см), снижение числа лимфоцитов менее 4×10 9 \л в периферической крови и менее 30% в костном мозге, повышение числа тромбоцитов более 100×10 9 \л, гемоглобина — более 110 г\л, нейтрофилов — более 1,54×10 9 \л.
- Частичная ремиссия: уменьшение размеров лимфоузлов, печени и селезёнки на 50% и более, снижение количества лимфоцитов в периферической крови на 50%, повышение числа тромбоцитов более 100×10 9 \л, гемоглобина — более 110 г\л, нейтрофилов — более 1,54×10 9 \л или же повышение любого из этих параметров более чем на 50% от исходного уровня.
- Признаками прогрессирования заболевания являются, напротив, увеличение размеров лимфоузлов, печени и селезёнки на 50% и более, а также уменьшение количества тромбоцитов на 50% и более от исходного уровня и уменьшение количества тромбоцитов на 20 г\л и более.
Для установления полной ремиссии необходимо соблюдение всех перечисленных критериев, частичной — по крайней мере 2 критерия, касающихся состояния внутренних органов, и минимум одного критерия, касающегося клеточного состава крови.
Следует учитывать, что терапия ибрутинибом может привести к полному ответу со стороны лимфатических узлов и селезёнки, но с сохранением лейкоцитоза в периферической крови. Это состояние обозначается, как частичный ответ с лимфоцитозом.
Прогноз
Значительные успехи в терапии хронического лимфолейкоза позволили сделать это заболевание потенциально излечимым или же достаточно долго поддерживать жизнь человека без прогрессирования основного заболевания с сохранением её качества.
Напротив, без лечения заболевание медленно, но неуклонно прогрессирует, что способно стать причиной гибели пациента спустя несколько лет после дебюта заболевания, поэтому своевременное обращение к врачу и начало адекватной терапии очень важны.
Читайте также:
