Инфарктоподобные изменения ЭКГ. ЭКГ при гликозидной интоксикации и синдроме WPW
Добавил пользователь Евгений Кузнецов Обновлено: 09.01.2026
В статье подробно описаны инфарктоподобные изменения на электрокардиограмме при различных заболеваниях. Приведены клинические примеры, что позволяет более качественно проводить дифференциальную диагностику ЭКГ-изменений.
инфарктоподобная электрокардиограмма, клиническая диагностика.
Общеизвестно, что достоверный диагноз инфаркта миокарда (ИМ) устанавливается при наличии диагностической триады ВОЗ (1975): типичная для ИМ клиника; определенные изменения электрокардиографической кривой; повышение в крови уровня биомаркеров некроза миокарда.
В случае наличия 2 критериев диагноз ИМ достаточно достоверен. Наличие же 1 из диагностических критериев позволяет лишь заподозрить ИМ и чаще приводит к диагностической ошибке.
Ошибки в диагностике ИМ встречаются достаточно часто. По данным Фременгемского проспективного исследования, у каждого 4-го больного ИМ не распознается (В.А. Алмазов и соавт., 1985). В.А. Алмазов и соавт. отмечают, что до 50 % больных с ИМ, обратившихся в поликлинику, направляются в стационар на 2-е сутки от начала заболевания и позже. Несвоевременная госпитализация нередко происходит не только по вине участкового, семейного врача, но и по вине узких специалистов — кардиологов поликлиник, кардиологов специализированных бригад скорой помощи, врачей кабинета функциональной диагностики. Среди госпитализированных больных наблюдаются случаи как гиподиагностики, так и гипердиагностики ИМ. Ошибки при установлении диагноза ИМ опасны для больного в обеих ситуациях: гиподиагностика угрожает жизни больного, а в случае гипердиагностики («ошибка ложной тревоги») проводится несвоевременная, неадекватная терапия заболевания, ошибочно принятого за острое нарушение коронарного кровообращения.
Следует заметить, что диагностические ошибки могут быть субъективными и объективными. Последние чаще встречаются на догоспитальном этапе и являются следствием ограниченности диагностических возможностей, что не зависит от врача. Большая же часть ошибок носит субъективный характер и встречается не только на догоспитальном этапе, но и в условиях стационара, когда врач имеет возможность ежедневно наблюдать больного, проводить диагностические и лечебные мероприятия, непосредственно оценивая их информативность и эффективность. Субъективные причины ошибок состоят:
1) в недостаточно полном сборе информации и, прежде всего, в поверхностном опросе пациента. Наш более чем 25-летний опыт работы в инфарктном отделении и данные литературы (публикации сотрудников НИИ Центра профилактической медицины Минздрава Российской Федерации, 2000) свидетельствуют о том, что тщательный опрос больного при установлении диагноза ИБС по информативности не уступает пробам с физической нагрузкой;
2) в неправильной интерпретации полученной информации, особенно это касается результатов лабораторно-инструментальных методов исследования. Широкое внедрение высокотехнологичных лабораторно-инструментальных методов исследования значительно повышает точность диагностики, но диагностическое изобилие не всегда помогает практическому врачу в силу целого ряда причин: недоступность использования современной аппаратуры ввиду ее высокой стоимости; недостаток высококвалифицированных специалистов, работающих на этой аппаратуре; любые методы исследования имеют определенные диагностические возможности и пределы, чувствительность и специфичность. Если отдавать предпочтение лабораторно-инструментальным методам исследования, пренебрегая анализом жалоб больного, данными анамнеза и результатами объективного обследования, то это, как показывает практика, нередко и служит причиной диагностических ошибок.
Оценивая значимость клинического критерия ИМ, следует иметь в виду, что существуют атипичные проявления острого нарушения коронарного крообращения. В этом случае необходимо уделять особое внимание детализации кардиалгий, качественному, тщательному сбору анамнеза, наличию факторов риска (пол, возраст, наследственная отягощенность, курение, сахарный диабет, артериальная гипертензия и т.д.). К сожалению, патогномоничные объективные данные при ИМ отсутствуют.
Анализ следующего диагностического критерия ИМ — изменений ЭКГ показывает их неоднозначность, так как в ряде случаев эти изменения имитируют ИМ (тромбоэмболия легочной артерии, синдром ранней реполяризации желудочков, ЭКГ при врожденных пороках сердца, синдром WPW и т.д.) или же носят двусмысленный характер.
Гиподиагностика ИМ по данным ЭКГ может быть обусловлена небольшой площадью или небольшим объемом некротизированного миокарда, что не находит отражения в 12 общепринятых отведениях ЭКГ, запаздыванием электрокардиографических изменений по отношению к клиническим проявлениям ИМ, наличием предшествующих изменений ЭКГ (выраженная гипертрофия миокарда левого желудочка, полная блокада левой ножки пучка Гиса, пароксизмальная тахикардия, рубцовые поля после перенесенного раннее ИМ и т.д.).
Следующий диагностический критерий ИМ — определение в крови маркеров некроза миокарда. Идеальный биохимический маркер должен обладать максимальной специфичностью и чувствительностью в отношении некроза миокарда, в течение короткого времени после начала симптомов ИМ достигать в крови диагностически значимого уровня, который должен сохраняться в течение продолжительного времени. Из всех известных биомаркеров некроза к этим требованиям приближаются миоглобин, МВ-фракция креатинфосфокиназы, тропонины I и Т. Самым существенным их недостатком является низкая специфичность, так как их уровень может повышаться не только при некрозе миокарда, но и при патологии, не имеющий непосредственного отношения к миокарду (бронхиальная астма, физическое перенапряжение, внутримышечные инъекции, уремия и т.д.). Повышение биомаркеров некроза миокарда создает определенные затруднения при диагностике ИМ, особенно в случае атипичной клиники и неубедительных изменений ЭКГ.
Из сочетания двух диагностических критериев (клиника и ЭКГ-изменения, клиника и повышение уровня биомаркеров некроза, ЭКГ-изменения и повышение уровня биомаркеров некроза) наиболее информативным является сочетание клиники и ЭКГ-изменений. Однако в случае атипичной клиники акцент только на изменениях ЭКГ служит поводом к гипердиагностике ИМ, т.е. ЭКГ-кривая может носить инфарктоподобный характер.
В связи с вышеизложенным считаем целесообразным представить ряд клинических наблюдений.
Больная Б., 72 года, доставлена бригадой СМП в инфарктное отделение с диагнозом заднебазального инфаркта миокарда неопределенной давности.
При поступлении предъявляла жалобы на общую слабость, одышку, кардиалгии неопределенного характера. Из анамнеза установлено, что больная с детства знала о наличии у нее врожденного порока сердца (ДМПП), но ни близким родственникам (муж, 2 взрослые дочери), ни медицинским работникам это было неизвестно. Больная вела активный образ жизни и только примерно с 45 лет стала отмечать ежегодные ОРЗ, а затем бронхит, который приобрел характер хронического. Лечилась только амбулаторно.
Объективно: клиника выраженной правожелудочковой недостаточности.
На ЭКГ: синусовый ритм. Зубец Р увеличен в грудных отведениях V1–4 и прослеживается таким же увеличенным до отведенияV6. Электрическая ось сердца отклонена вправо более чем на 100 °.
В III стандартном отведении регистрируется непатологический зубец Q, который не выражен в отведениях II и aVF. В отведении aVR регистрируется поздний R. В отведениях II, III, aVF зубец Т отрицательный, асимметричный с широким основанием. Анализ грудных отведений от V1 до V6, а также дополнительных правых грудных отведений (V3R–V6R) выявляет четкие признаки гипертрофии правого желудочка и его дилатации (объемной перегрузки) (рис. 1).
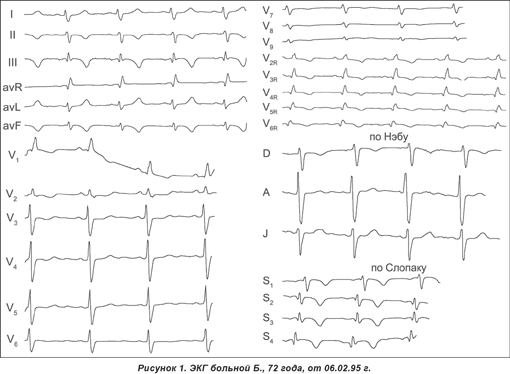
Результаты ультразвукового исследования: дилатация правых полостей сердца и симптомы легочной гипертензии. Тропониновый (I) тест отрицательный.
Таким образом, тщательный анализ жалоб, анамнестических, клинических данных и адекватная трактовка инструментальных методов исследования позволили снять диагноз инфаркта миокарда, который был установлен на основании недостаточно полного объема собранной информации и неверной оценки электрокардиографической кривой.
Больной В., 40 лет, слесарь-ремонтник, поступил 14.04.2006 г. в инфарктное отделение с жалобами на чувство недостатка воздуха, интенсивную боль в грудной клетке, больше в левой ее половине, не связанной с физической нагрузкой и положением тела.
Заболел 12.04, когда после переохлаждения появилось ощущение нехватки воздуха. За медицинской помощью не обращался. В ночь на 14.04 появилось ощущение дискомфорта (диффузная неинтенсивная боль) в грудной клетке, которое прошло самостоятельно. Утром обратился к врачу. Медикаментозная терапия не проводилась, ЭКГ не регистрировалась. В течение дня периодически сохранялось чувство недостатка воздуха и более выраженного дискомфорта в грудной клетке. Бригадой СМП больной доставлен в пульмонологическое отделение с предполагаемым диагнозом «пневмоторакс», который пульмонологами был исключен. После регистрации ЭКГ больной направлен в инфарктное отделение. Хотя имели место атипичные кардиалгии, учитывая изменения на ЭКГ от 14.04.06 г.: вольтаж достаточный, электрическая ось с тенденцией отклонения вправо. В отведениях II, III, аvF — непатологический зубец Q. Ритм синусовый, тахикардия. В отведениях I, II, III, avF, в грудных отведениях V4–6 обращает на себя внимание косовосходящий подъем сегмента ST над изолинией более 2 мм с переходом в ассиметричный с широким основанием и округлой верхушкой положительный зубец Т (рис. 2, 3). Подъем сегмента ST не связан с нисходящим коленом зубца R, а является как бы продолжением восходящего колена зубца S, больному был проведен тромболизис актелизе.
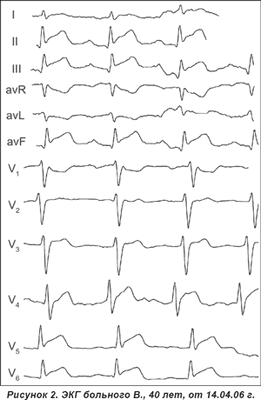
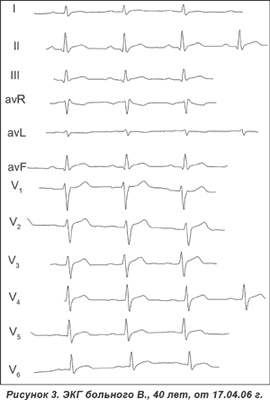
На ЭКГ от 17.04.06 г.: отсутствие эволюции ЭКГ-кривой по сравнению с ЭКГ от 14.04.06 г. УЗИ сердца: структурных нарушений не выявлено, обращает внимание полное отсутствие сепарации листков перикарда над правым желудочком.
17.04.06 г. у больного появились неврологические симптомы, которые невропатологом расценены как острое нарушение мозгового кровообращения по геморрагическому типу. Больной переведен в нейрохирургическое отделение, где ему было произведено удаление гематомы левой лобной доли.
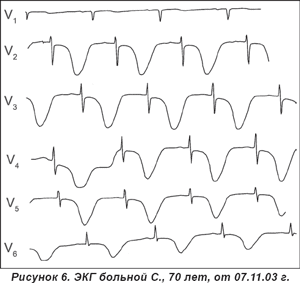
Учитывая появление кардиалгий после переохлаждения, нетипичных для инфаркта миокарда изменений на ЭКГ и отсутствие их динамики после тромболизиса, результаты УЗИ сердца, у больного диагностирован миоперикардит, по поводу которого после оперативного вмешательства в нейрохирургическом отделении больной продолжил лечение в кардиологическом отделении. ЭКГ от 14.05.06 г.: замедленная эволюция сегмента ST в виде его приближения в изолинии и формирование отрицательного зубца Т (рис. 4).
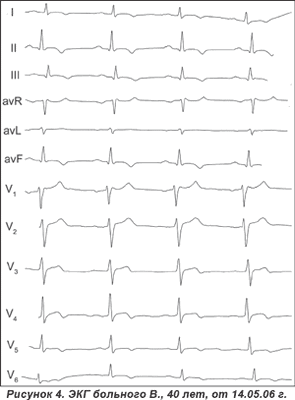
УЗИ: ТЗСЛЖд — 1,2; ТМЖПд — 1,2; ФВ — 61 %; ММЛЖ — 173. Склеротические изменения аорты, кальциноз кольца аортального клапана и подклапанных структур — склеротический аортальный стеноз; гипертрофия миокарда левого желудочка.
В области хвоста определяется pancreas в виде расширенной гипоэхогенной структуры.
При анализе ЭКГ (рис. 5) обращает на себя внимание графика комплекса QRS, а именно: наличие положительной волны соединения между комплексом QRS и сегментом ST, особенно выраженной в грудных отведениях от V3 до V6. Кроме этого, имеется диффузное нарушение реполяризации в виде подъема сегмента ST и инверсии зубца Т. Указанные изменения ЭКГ свидетельствуют о наличии волны Осборна на фоне гипертрофии миокарда левого желудочка, что ошибочно было оценено как Q-негативный перегородочно-верхушечно-боковой ИМ.
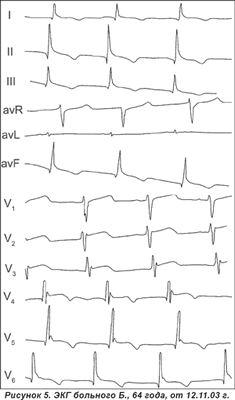
Наличие двусмысленных изменений ЭКГ при отсутствии жалоб больной («сердце никогда не болело»), данных анамнеза (отрицает повышение артериального давления, сахарный диабет), результатов отрицательного теста на тропонин I (качественный анализ полоской фирмы Roche) позволили их расценить как псевдоинфарктные и связать с острым нарушением мозгового кровообращения. Динамическое наблюдение невропатологом и кардиологом за больной позволило исключить предполагаемый ранее диагноз ИМ.
Представленные клинические наблюдения свидетельствуют о необходимости тщательного анализа клинических данных и данных ЭКГ при установлении диагноза ИМ, что позволяет избежать гипердиагностики последнего и проводить своевременную адекватную терапию основного заболевания.
1. Алмазов В.А., Чирейкин Л.В. Трудности и ошибки диагностики заболеваний сердечно-сосудистой системы. — Л.: Медицина, 1985. — 288 с.
2. Де Луна А.Б. Руководство по клинической ЭКГ. — М.: Медицина, 1993.
3. Кардиология в таблицах и схемах / Под ред. М. Фрид и С. Грайнс. — М.: Практика, 1996. — 736 с.
4. Крижанівський В.О. Діагностика та лікування інфаркту міокарда. — К.: Фенікс, 2000. — 451 с.
Инфарктоподобные изменения ЭКГ. ЭКГ при гликозидной интоксикации и синдроме WPW
Дифференциальная диагностика ЭКГ при инфаркте миокарда. ЭКГ при перикардите, эмболии легочной артерии
ЭКГ при инфаркте миокарда необходимо отличать от ЭКГ при перикардитах. На ЭКГ отражается не поражение самого перикардита, а поражение субэпикардиальных (прилегающих к перикарду) слоев миокарда, которые вовлекаются в патологический процесс при фибринозном перикардите. На ЭКГ с первых часов развития перикардита наблюдается подъем сегмента S—Т, который в отличие от такового при инфаркте миокарда не так резко выражен, имеет форму выпуклостью вниз, а при инфаркте миокарда — вверх, смещение вверх сегмента S—Т при перикардитах обычно регистрируется во многих отведениях.
При инфаркте миокарда изменения обычно локальные, ограниченные, а при перикардитах — распространенные, поэтому при них нет дискордантности между передней и задней стенками (ЭКГ изменяется конкордантно в I, II, III, в однополюсных отведениях от конечностей, кроме aVR, во всех грудных отведениях). При инфаркте к повреждениям присоединяется некроз (появляется глубокий зубец Q), а при перикардитах нет некроза (не определяется зубец Q). Подъем сегмента
S—Т при перикардитах наблюдается 10—14 дней и более (а при инфаркте миокарда подъем быстро уменьшается), при этом зубец Т остается положительным и только после возвращения сегмента S—Т к изолинии,, становится отрицательным (при инфаркте зубец Т становится отрицательным через 1—2 дня). Отрицательный зубец Т при перикардитах регистрируется долго (до 2 мес и более), принимает форму коронарного острого зубца Т.
Амплитуда комплекса QRS при фибринозном перикардите не изменяется. Если же к фибринозному перикардиту присоединяется экссудативный перикардит, то появляются характерные для последнего снижение вольтажа зубцов на ЭКГ на фоне описанных изменений сегмента S—Т и зубца Т. Для сдавливающего перикардита патогномоничны уменьшение амплитуды всех зубцов, инверсия зубца Т, нередко мерцательная аритмия.
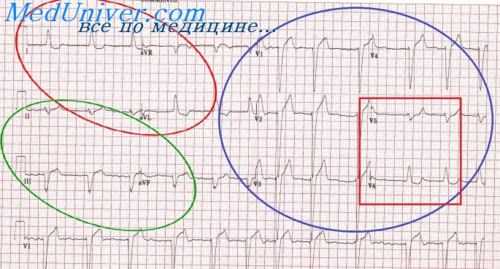
Кроме перикардита, инфаркт миокарда часто симулирует эмболия легочной артерии, массивный ателектаз, спонтанный пневмоторакс, острый отек легкого.
Эмболия легочной артерии в большинстве случаев возникает на фоне тромбофлебита периферических вен, флеботромбозов, после операции, у лежащих больных с травмами конечностей, у женщин в послеродовом периоде, при пороках сердца. Чем более выражена эмболия, чем чаще производится электрокардиография, тем чаще выявляются типичные электрокардиографические признаки.
При эмболии легочной артерии возникают изменения на ЭКГ, характерные для острой перегрузки правого желудочка и правого предсердия, отклонение электрической оси сердца вниз, вертикальное положение или вправо, поворот правым желудочком вперед (по часовой стрелке вокруг продольной оси) и верхушкой кзади. Поэтому на ЭКГ появляется синдром SI—QIII, переходная зона QRS смещена влево до V4—V5, где имеется выраженный, но ие широкий зубец QS.
Очень редко может быть неглубокий qII, aVF. Если доминирует поворот верхушкой кзади, то имеется синдром SI, SII, SIII, снижается зубец RI, II,III, углубляется зубец SI, а в отведении aVR увеличивается зубец R. RSI, qRIII при эмболии легочной артерии часто сочетаются с изменениями в грудных отведениях. Сегмент S—ТII,III,aVF,V1,2, может оказаться приподнятым вследствие повреждения миокарда правого желудочка (эта приподнятость обычно не очень резкая, но четкая), зубец Т в этих отведениях инвертирован. Сегмент S—ТII,III, aVF, V1,2 может не подниматься, а опускаться вниз с инверсией зубца Т за счет систолической перегрузки правого желудочка.
Если в III стандартном отведении зубец Q глубокий и приподнят сегмент S—Т, это напоминает картину зад-недиафрагмального инфаркта миокарда. Здесь ориентиром является отведение aVF. При эмболии легочной артерии зубец Q во II и aVF отведениях неширокий.
Иногда может быть смещение интервала S—Т вниз с отрицательным зубцом Т в левых грудных отведениях при массивных тромбоэмболиях легочной артерии.
Для эмболии легочной артерии характерна быстрая динамика (изменения наблюдаются часами, сутками), а при инфарктах — медленная.
Инфарктоподобные изменения ЭКГ могут быть при некоторых заболеваниях желудочно-кишечного тракта (холецистит, панкреатит, пищевые токсикозы, рак пищевода, кишечная непроходимость, феохромоцитома и др.). Уточнить диагноз помогает тщательный анализ клинических, электрокардиографических и лабораторных данных. Электрокардиографическую картину инфаркта миокарда необходимо дифференцировать также с интоксикацией сердечными гликозидами. При ней появляются корытообразное снижение сегмента S—Т, укорочение интервала QRS—Т, уплотнение зубца Т.
От субэндокардиальной формы инфаркта миокарда гликозидная интоксикация отличается диффузностыо, изменения более выражены там, где имеются высокий зубец Р, укорочение интервала Q—Т. При инфаркте миокарда интервал Q—Т удлинен. При токсическом действии сердечных гликозидов интервал S—Т в отведениях с высоким зубцом Р никогда не повышается, появляются желудочковые экстрасистолы (часто бигеминия) и другие нарушения ритма и проводимости.
Синдром Вольффа—Паркинсона—Уайта (WPW) иногда может симулировать инфаркт миокарда (инфарктоподобная ЭКГ). При типе А синдрома WPW во всех грудных отведениях может быть отрицательный зубец Т. В этом случае создаются ложные признаки мелкоочагового инфаркта миокарда переднебоковой стенки левого желудочка. При типе А в отведениях I и aVL появляется нередко широкий зубец Q, что создает ложные признаки переднебокового инфаркта миокарда.
При типе А синдрома WPW отмечается обычно высокий зубец Р в правых грудных отведениях со смещением сегмента S—Т вниз и положительным зубцом Т, что может симулировать признаки заднебазального инфаркта миокарда.
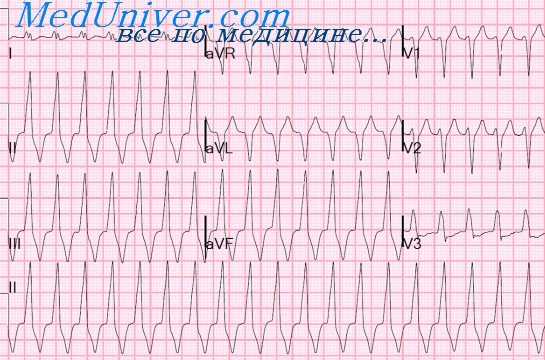
При типе Б синдрома WPW часто имеется зубец QS в II, III, aVF отведениях, что симулирует ложные признаки заднедиафрагмального инфаркта миокарда.
Для уточнения диагноза синдрома Вольффа—Паркинсона—Уайта следует применять такие тесты, как давление на глазные яблоки, синокаротидную зону; небольшой дозы хинина, инъекция атропина, аймалина др.
При гипертрофии правого желудочка наличие комплекса qRv1, смещение интервала S—ТV1,2 ниже изоэлектрической линии, двухфазный Т (+-) или инверсия зубца Т позволяют заподозрить задиебазальный или субэндокардиальный инфаркт миокарда переднесептальной области. Зубец QS в отведениях V1, V2, V3 с приподнятым сегментом S—ТV1-3 при гипертрофии левого желудочка подозрительны на инфаркт миокарда переднесептальной области. Дифференциально-диагностическими критериями является стойкость этих изменений при гипертрофиях в сочетании с другими их признаками и динамичность изменений на ЭКГ при инфаркте миокарда.
Хроническое легочное сердце. На ЭКГ больных хроническим легочным сердцем часто наблюдается так называемый S-тип, при котором во всех стандартных, усиленных однополюсных от конечностей отведениях (тип RSI-III,aVF), кроме aVR, грудных отведениях определяется выраженный зубец S (тип Rs или rS от V1 до V6).
При наличии выраженной эмфиземы легких часто встречается уменьшение вольтажа комплекса QRS в стандартных отведениях. Одни авторы объясняют это плохой электропроводимостью эмфизематозной легочной ткани, другие — поворотом сердца вокруг поперечной оси верхушкой кзади (RSI,II,III). При таком повороте пространственные векторы электродвижущей силы сердца принимают направление, почти перпендикулярное к фронтальной плоскости, что ведет к уменьшению величины проекции этих векторов на указанную плоскость, т. е. уменьшению зубцов в отведениях от конечностей. Один из электрокардиографических признаков легочного сердца — появление зубца P-puImonale, то есть высокого, заостренного зубца PII,III,aVF. В типичных случаях высота его может быть более 2—2,5 мм.
Другая рестриктивная кардиомиопатия (I42.5)
Рестриктивная кардиомиопатия — инфильтративное или фиброзное поражение миокарда, которое характеризуется ригидными, неподатливыми стенками желудочков, уменьшением наполнения и снижением диа-столического объема одного или обоих желудочков с нормальной или почти неизмененной систолической функцией и толщиной стенок. В основе заболевания лежит распространенный интерстициальный фиброз.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Выделяют три этиологических группы рестриктивных кардиомиопатий: идиопатическую (первичную) рестриктивную кардиомиопатию, эндомиокардиальную болезнь, вторичные рестриктивные кардиомиопатии. Идиопатическая рестриктивная кардиомиопатия является заболеванием неизвестной этиологии. При этом отсутствуют какие-либо другие заболевания или воздействия, которые могли бы вызвать эту патологию миокарда.
Ранее к идиопатической рестриктивной кардиомиопатий относили париетальный фибропластический эндокардит Леффлера и эндомиокардиальный фиброз. В последнее время эти два заболевания предлагается объединять в группу «эндомиокардиальная болезнь» и рассматривать их отдельно от идиопатической (первичной) рестриктивной кардиомиопатий, учитывая специфические клинические, патогенетические, патоморфологические особенности. Вторичные рестриктивные кардиомиопатии развиваются при различных заболеваниях.
Этиологическая классификация рестриктивных кардиомиопатий
Идиопатическая (первичная) рестриктивная кардиомиопатия
Эндомиокардиальная болезнь:
- Эндомиокардиальная болезнь с эозинофилией (фибропластический эндокардит Леффлера);
- Эндомиокардиальная болезнь без эозинофилии (эндомиокардиальный фиброз)
Вторичные рестриктивные кардиомиопатий (развиваются при ряде заболеваний):
- Гемохроматоз;
- Амилоидоз;
- Саркоидоз;
- Склеродермия;
- Карциноидная болезнь сердца;
- Гликогенозы;
- Радиационное поражение сердца;
- Лекарственное поражение сердца (антрациклиновая интоксикация, воздействие серотонина, метилсегрида, эрготамина, ртутьсодержащих веществ, бусульфана);
- Опухолевое поражение сердца
Рестриктивные кардиомиопатии также классифицируются на миокардиальные и эндомиокардиальные. Миокардиальные рестриктивные кардиомиопатии разделяют на инфильтративные, неинфильтративные, обусловленные болезнями накопления. . В группу неинфильтративных рестриктивных кардиомиопатий включены идиопатическая и семейная кардиомиопатия. Именно эти два заболевания полностью соответствуют определению рестриктивной кардиомиопатий.
В группу неинфильтративных рестриктивных кардиомиопатий отнесена гипертрофическая кардиомиопатия. Это заболевание не в полной мере соответствует определению, критериям рестриктивной кардиомиопатий и является самостоятельной нозологической формой. Остальные формы неинфильтративных рестриктивных кардиомиопатий развиваются при склеродермии, сахарном диабете, эластической псевдоксантоме и других заболеваниях
Таблица 42. Классификация типов рестриктивной кардиомиопатии (Kushwaha P. et al., 1997)
Рестриктивные кардиомиопатии миокардиальные:
Неинфильтративные:
- Идиопатическая кардиомиопатия;
- Семейная кардиомиопатия;
- Гипертрофическая кардиомиопатия;
- Склеродермия;
- Псевдоксантома эластическая;
- Диабетическая кардиомиопатия
Инфильтративные:
- Амилоидоз;
- Саркоидоз;
- Болезнь Гоше;
- Болезнь Гурлера;
- Жировая инфильтрация
Болезни накопления:
- Гемохроматоз;
- Болезнь Фабри;
- Болезнь накопления гликогена
Рестриктивные кардиомиопатии эндомиокардиальные:
- Эндомиокардиальный фиброз
- Гиперэозинофильный синдром
- Карциноидная болезнь сердца
- Метастатическое раковое поражение
- Радиационное поражение сердца
- Токсическое влияние антрациклинов
- Лекарственно обусловленный фиброзный эндокардит (серотонин, метисергид, эрготамин, ртутьсодержащие вещества, бусульфан)
Авторы рассматриваемой этиологической классификации не дают четкого определения инфильтративным болезням миокарда, относят к инфильтративным болезням миокарда не только его поражение при амилоидозе, саркоидозе, но и при болезни Гоше, болезни Гурлера. Однако эти заболевания относятся к лизосомальным болезням накопления. К болезням накопления, вызывающим развитие рестриктивной кардиомиопатий, относят лишь болезнь Фабри (патологию накопления гликогена, гемохроматоз). Аргументы за включение болезней накопления в разные классификационные группы не приводятся. Возможно, целесообразно объеденить в одну рубрику рестриктивные кардиомиопатии, обусловленные инфильтративными болезнями и лизосомальными болезнями накопления.
Этиология и патогенез
Болезнь может быть идиопатической или обусловленной инфильтративными системными заболеваниями (амилоидоз, гемохроматоз, саркоидоз и др.). К менее распространенным причинам относят миокардит, трансплантацию сердца. Одной из идентифицированных причин рестриктивной кардиомиопатии является гиперэозинофильный синдром.
В основе патогенеза лежит выраженное ограничение (рестрикция) заполнения кровью желудочков во время диастолы и постепенное уменьшение размеров желудочков , вплоть до их облитерации. Важной особенностью является то, что диастолическое заполнение желудочков происходит за очень короткий промежуток времени в самом начале диастолы во время периода быстрого наполнения, а дальнейшем заполнение желудочков кровью практически не происходит. В результате этого резко повышается конечное диастолическое давление (КДД) в желудочках, повышение давления в предсердиях и венах малого и большого кругов кровообращения. В результате этого развивается диастолическая сердечная недостаточность, которая в зависимости от выраженности поражения того или иного отдела сердца может быть право- ,левожелудочковой и бивентрикулярной.
В развитии рестриктивной кардиомиопатии выделяют три морфологические стадии:
некротическую — длится около 5 нед, характеризуется гиперэозинофи-лией, массивной дегенерацией и гибелью эозинофильных гранулоцитов, выраженной инфильтрацией эндокарда дегранулированными эозинофиль-ными гранулоцитами, наличием миокардита в сочетании с артериитом;
тромботическую — длится до 10 мес, характеризуется пристеночным внутриполостным тромбообразованием и нарушениями микроциркуляции в коронарном русле, обратным развитием инфильтрации миокарда и утолщением эндокарда;
стадия фиброза — длится годами, характеризуется наряду с поражением париетального эндокарда поражением сосочковых мышц и клапанного аппарата, возникновением митральной и трикуспидальной недостаточности. Фиброз может быть значительно выражен во внутренних слоях миокарда с последующим развитием гипертрофии и дилатации сердца, может носить очаговый или диффузный характер.
Клиническая картина
Cимптомы, течение
К наиболее характерным клиническим симптомам рестриктивной кардиомиопатии относятся:
1. При поражении правого желудочка:
• тяжелая правожелудочковая недостаточность,
• повышение венозного давления,
• набухание яремных вен,
• увеличение печени,
• выраженные периферические отеки,
• асцит,
•увеличение сердца с преобладанием гипертрофии и дилатации правых отделов,
• трехчленный ритм (ритм галопа),
• систолический шум недостаточности трехстворчатого клапана.
2. При поражении левого желудочка:
• признаки левожелудочковой недостаточности,
• митральная недостаточность,
• увеличение размеров левого предсердия,
• систолический шум,
• застой в легких,
• гипертензия малого круга кровообращения.
3. При поражении обоих желудочков:
• тотальная сердечная недостаточность.
4. Выпот в перикард.
5. Тяжелые нарушения ритма (мерцание предсердий, эктопические
аритмии).
6. Тромбоэмболический синдром.
Диагностика
- Наличие клинической симптоматики сердечной недостаточностис преимущественным преобладанием правожелудочковой
- Нормальные правая и левая границы относительной тупости и размер поперечника сердца
- Исключен диагноз констриктивного перикардита
- Отсутствие увеличения размеров и дилатации желудочков сердца, нормальный или даже уменьшенный объем полостей желудочков (по данным рентгенографии, эхокардиографии, вентрикулографии)
- Отсутствие гипертрофии желудочков (по данным эхокардиографии, вентрикулографии). Однако при инфильтративных болезнях миокарда, лизосомальных болезнях накопления, эндомиокардиальной болезни толщина стенки желудочков увеличена
- Кривая давления в левом желудочке в фазу диастолического наполнения в виде квадратного корня (по данным катетеризации сердца)
Нормальная систолическая функция левого желудочка (по данным доплерэхокардиографии и вентрикулографии), что проявляется нормальной фракцией выброса
На ЭКГ при поражении правого желудочка обнаруживаются:
синусовая тахикардия,
аритмии, наиболее часто мерцание предсердий,
блокада правой ножки пучка Гиса,
снижение вольтажа комплекса QRS,
патологический зубец Q в отведениях V1-2
снижение сегмента ST,
инверсия зубца Т,
высокий зубец Р.
На ЭКГ при поражении левого желудочка обнаруживаются:
синусовая тахикардия,
признаки гипертрофии левого желудочка,
признаки гипертрофии левого предсердия,
блокада левой ножки пучка Гиса,
наджелудочковые аритмии.
- систолическая функция не нарушена,
- парадоксальное движение межжелудочковой перегородки при поражении правого желудочка, М-образное движение при поражении левого желудочка,
- гипертрофия миокарда чаще отсутствует,
- утолщение эндокарда,
- уменьшение полости пораженного желудочка (или обоих желудочков),
- функциональная митральная регургитация вследствие инфильтрации миокарда и сосочковых мышц или утолщения эндокарда,
- увеличение скорости потока трикуспидальной регургитации,
- укорочение времени изоволюмического расслабления,
- увеличение пика раннего наполнения,
- уменьшение пика позднего предсердного наполнения желудочков,
- увеличение отношения раннего наполнения к позднему,
- рестриктивный тип диастолической дисфункции,
- расширение пути оттока из правого желудочка и расширение правого предсердия при поражении правого желудочка,
- пансистолическое пролабирование задней створки митрального клапана,
- изменение кровотока в легочной вене.
На рентгенограммах обычно определяются нормальные или уменьшенные размеры сердца, за исключением рентгенологических признаков расширения предсердий. Выявляются также признаки застоя крови в малом круге кровообращения.
Радионуклидная и рентгеноконтрастная вентрикулография обнаруживает нормальную толщину стенок желудочков, отсутствие их дилатации, в некоторых случаях уменьшение полости левого желудочка, иногда наличие тромба и облитерацию полости левого желудочка в области верхушки сердца, нормальную фракцию выброса левого желудочка.
Для всех видов рестриктивной кардиомиопатии характерно наличие в эндомиокардиальном биоптате интерстициального фиброза. Кроме того, при инфильтративных поражениях миокарда обнаруживаются характерные специфические изменения. Эндомиокардиальная биопсия производится лишь при невозможности диагностировать рестриктивную кардиомиопатию с помощью других методов исследования.
Синдром WPW
Синдром Вольфа-Паркинсона-Уайта (синдром WPW) - клинико-электрокардиографический синдром, характеризующийся предвозбуждением желудочков по дополнительным атриовентрикулярным путям проведения и развитием пароксизмальных тахиаритмий. Синдром WPW сопровождается различными аритмиями: наджелудочковой тахикардией, фибрилляцией или трепетанием предсердий, предсердной и желудочковой экстрасистолией с соответствующей субъективной симптоматикой (ощущением сердцебиения, одышкой, гипотензией, головокружением, обмороками, болями в грудной клетке). Диагностика синдрома WPW основана на данных ЭКГ, суточного ЭКГ-мониторирования, ЭхоКГ, ЧПЭКС, ЭФИ. Лечение синдрома WPW может включать антиаритмическую терапию, чреспищеводную электрокардиостимуляцию, катетерную РЧА.
Общие сведения
Синдром Вольфа-Паркинсона-Уайта (синдром WPW) - синдром преждевременного возбуждения желудочков, обусловленный проведением импульсов по добавочным аномальным проводящим пучкам, соединяющим предсердия и желудочки. Распространенность синдрома WPW, по данным кардиологии, составляет 0,15-2%. Синдром WPW чаще встречается среди мужчин; в большинстве случаев манифестирует в молодом возрасте (10-20 лет), реже - у лиц старшего возраста. Клиническое значение синдрома WPW заключается в том, что при его наличии часто развиваются тяжелые нарушения сердечного ритма, которые представляют угрозу для жизни больного и требуют особых подходов к лечению.
Причины синдрома WPW
По мнению большинства авторов, синдром WPW, обусловлен сохранением добавочных атриовентрикулярных соединений в результате незавершенного кардиогенеза. При этом происходит неполная регрессия мышечных волокон на этапе формирования фиброзных колец трикуспидального и митрального клапанов.
В норме дополнительные мышечные пути, соединяющие предсердия и желудочки, существуют у всех эмбрионов на ранних стадиях развития, но постепенно они истончаются, сокращаются и полностью исчезают после 20-й недели развития. При нарушении формирования фиброзных атриовентрикулярных колец мышечные волокна сохраняются и составляют анатомическую основу синдрома WPW. Несмотря на врожденный характер дополнительных АВ-соединений, синдром WPW может впервые проявиться в любом возрасте. При семейной форме синдрома WPW чаще имеют место множественные добавочные атриовентрикулярные соединения.
Классификация синдрома WPW
По рекомендации ВОЗ, различают феномен и синдром WPW. Феномен WPW характеризуется электрокардиографическими признаками проведения импульса по дополнительным соединениям и предвозбуждением желудочков, но без клинических проявлений АВ реципрокной тахикардии (re-entry). Под синдромом WPW подразумевается сочетание предвозбуждения желудочков с симптоматической тахикардией.
С учетом морфологического субстрата выделяют несколько анатомических вариантов синдрома WPW.
I. С добавочными мышечными АВ-волокнами:
- идущими через добавочное левое или правое париетальное АВ-соединение
- идущими через аортально-митральное фиброзное соединение
- идущими от ушка правого или левого предсердия
- связанными с аневризмой синуса Вальсальвы или средней вены сердца
- септальными, парасептальными верхними или нижними
II. Со специализированными мышечными АВ-волокнами («пучками Кента»), происходящими из рудиментарной, аналогичной структуре атриовентрикулярного узла, ткани:
- атрио-фасцикулярными - входящими в правую ножку пучка Гиса
- входящими в миокард правого желудочка.
Выделяют несколько клинических форм синдрома WPW:
- а) манифестирующую – с постоянным наличием дельта-волны, синусовым ритмом и эпизодами атриовентрикулярной реципрокной тахикардии.
- б) интермиттирующую – с преходящим предвозбуждением желудочков, синусовым ритмом и верифицированной атриовентрикулярной реципрокной тахикардией.
- в) скрытую – с ретроградным проведением по дополнительному атриовентрикулярному соединению. Электрокардиографические признаки синдрома WPW не выявляются, имеются эпизоды атриовентрикулярной реципрокной тахикардии.
Патогенез синдрома WPW
Синдром WPW обусловлен распространением возбуждения от предсердий к желудочкам по дополнительным аномальным путям проведения. В результате этого возбуждение части или всего миокарда желудочков происходит раньше, чем при распространении импульса обычным путем - по АВ-узлу, пучку и ветвям Гиса. Предвозбуждение желудочков отражается на электрокардиограмме в виде дополнительной волны деполяризации – дельта-волны. Интервал P-Q(R) при этом укорачивается, а длительность QRS увеличивается.
Когда в желудочки приходит основная волна деполяризации, их столкновение в сердечной мышце регистрируется в виде так называемого сливного комплекса QRS, который становится несколько деформированным и уширенным. Нетипичное возбуждение желудочков сопровождается нарушением последовательности процессов реполяризации, что находит выражение на ЭКГ в виде дискордантного комплексу QRS смещения RS-T сегмента и изменения полярности зубца T.
Возникновение при синдроме WPW пароксизмов суправентрикулярной тахикардии, мерцания и трепетания предсердий связано с формированием круговой волны возбуждения (re-entry). В этом случае импульс по AB-узлу движется в антероградном направлении (от предсердий к желудочкам), а по дополнительным путям – в ретроградном направлении (от желудочков к предсердиям).
Симптомы синдрома WPW
Клиническая манифестация синдрома WPW происходит в любом возрасте, до этого его течение может быть асимптомным. Синдром WPW сопровождается различными нарушениями сердечного ритма: реципрокной наджелудочковой тахикардией (80%), фибрилляцией предсердий (15-30%), трепетанием предсердий (5%) с частотой 280-320 уд. в мин. Иногда при синдроме WPW развиваются менее специфичные аритмии - предсердная и желудочковая экстрасистолия, желудочковая тахикардия.
Приступы аритмии могут возникать под влиянием эмоционального или физического перенапряжения, злоупотребления алкоголем или спонтанно, без видимых причин. Во время аритмического приступа появляются ощущения сердцебиения и замирания сердца, кардиалгии, чувство нехватки воздуха. Мерцание и трепетание предсердий сопровождается головокружением, обмороками, одышкой, артериальной гипотензией; при переходе в фибрилляцию желудочков может наступить внезапная сердечная смерть.
Пароксизмы аритмии при синдроме WPW могут длиться от нескольких секунд до нескольких часов; иногда они купируются самостоятельно или после выполнения рефлекторных приемов. Затяжные пароксизмы требуют госпитализации больного и вмешательства кардиолога.
Диагностика синдрома WPW
При подозрении на синдром WPW проводится комплексная клинико-иснтрументальная диагностика: ЭКГ в 12 отведениях, трансторакальная эхокардиография, мониторирование ЭКГ по Холтеру, чреспищеводная электрокардиостимуляция, электрофизиологическое исследование сердца.
К электрокардиографическим критериям синдрома WPW относятся: укорочение PQ-интервала (менее 0,12 с), деформированный сливной QRS-комплекс, наличие дельта-волны. Суточное ЭКГ мониторирование применяется для обнаружения преходящих нарушений ритма. При проведении УЗИ сердца выявляются сопутствующие пороки сердца, кардиомиопатию.
Проведение чреспищеводной электрокардиостимуляции при синдроме WPW позволяет доказать наличие дополнительных путей проведения, индуцировать пароксизмы аритмии. Эндокардиальное ЭФИ позволяет точно определить локализацию и количество дополнительных путей, верифицировать клиническую форму синдрома WPW, выбрать и оценить эффективность лекарственной терапии или РЧА. Дифференциальную диагностику синдрома WPW проводят с блокадами ножек пучка Гиса.
Лечение синдрома WPW
При отсутствии пароксизмов аритмии синдром WPW не требует специального лечения. При гемодинамически значимых приступах, сопровождающихся синкопэ, стенокардией, гипотензией, нарастанием признаков сердечной недостаточности, требуется выполнение незамедлительной наружной электрической кардиоверсии или чреспищеводной электрокардиостимуляции.
В некоторых случаях для купирования пароксизмов аритмий эффективными оказываются рефлекторные вагусные маневры (массаж каротидного синуса, проба Вальсальвы), внутривенное введение АТФ или блокаторов кальциевых каналов (верапамила), антиаритмических препаратов (новокаинамида, аймалина, пропафенона, амиодарона). В дальнейшем пациентам с синдромом WPW показана постоянная антиаритмическая терапия.
В случае резистентности к антиаритмическим препаратам, развития фибрилляцией предсердий проводится катетерная радиочастотная абляция добавочных путей проведения трансаортальным (ретроградным) или транссептальным доступом. Эффективность РЧА при синдроме WPW достигает 95%, риск рецидивов составляет 5-8 %.
Прогноз и профилактика синдрома WPW
У пациентов с бессимптомным течением синдрома WPW прогноз благоприятный. Лечение и наблюдение требуется только лицам, имеющим отягощенный семейный анамнез в отношении внезапной смерти и профессиональные показания (спортсменам, летчикам и др.). При наличии жалоб или жизнеугрожающих аритмий необходимо проведение полного комплекса диагностического обследования для выбора оптимального метода лечения.
Пациенты с синдромом WPW (в том числе, перенесшие РЧА) нуждаются в наблюдении кардиолога-аритмолога и кардиохирурга. Профилактика синдрома WPW носит вторичный характер и заключается в проведении противоаритмической терапии для предотвращения повторных эпизодов аритмий.
Читайте также:
- Вертельные и подвертельные переломы бедра. Диагностика и лечение
- Патогенез миелодиспластических синдромов (МДС) - причины апоптоза
- Показания к назначению амиодарона. Побочные эффекты амиодарона
- Диагностика острой сердечной недостаточности. Лечение острой сердечной недостаточности.
- Современная иммунотерапия опухолей.
