Патогенез миелодиспластических синдромов (МДС) - причины апоптоза
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Миелодиспластические синдромы (МДС) - эпидемиология, причины, клиника
Миелодиспластические синдромы (МДС) — биологически и клинически гетерогенная группа клональных заболеваний, характеризующихся дисплазией кроветворения с неэффективным гемопоэзом и цитопеническими синдромами периферической крови и различной вероятностью эволюции в острые миелоидные лейкозы.
Признаки дисплазии кроветворения нередко сопровождаются бластозом крови и костного мозга, однако количество бластных клеток всегда меньше 20% (при уровне бластов равном или более 20% ставится диагноз острого лейкоза). В медицинской литературе прежних лет миелодиспластический синдром (МДС) имел различные названия (малопроцентный острый лейкоз, предлейкоз, тлеющая лейкемия и др.).
Частота миелодиспластических синдромов (МДС) в популяции составляет 3-5 случаев на 100 000 населения в год и существенно увеличивается с возрастом (частота у лиц старше 70 лет достигает 20 случаев на 100 000 населения в год). Средний возраст больных на момент начала заболевания составляет 70 лет.
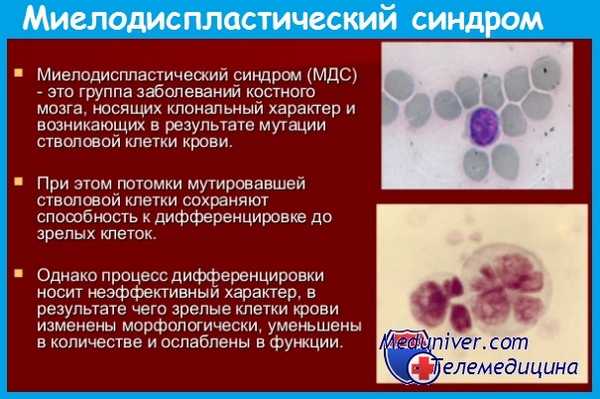
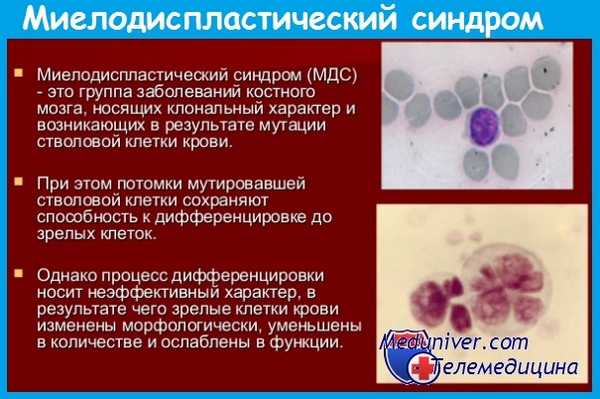
Этиология и патогенез миелодиспластических синдромов
К этиологическим факторам миелодиспластического синдрома (МДС) относятся ионизирующее излучение, цитостатические препараты, производные бензола и другие химические агенты (в том числе продукты табакокурения), генетические факторы.
Предшествующее лечение онкологических и онкогематологических заболеваний с использованием радиологических методов, алкилирующих средств (хлорамбуцил, циклофосфамид, мельфалан) и эпиподофиллотоксинов (этопозид, тенипозид) существенно повышает риск развития МДС, причем пик заболеваемости после лечения алкилирующими агентами отмечается через 5-10 лет, после эпиподофиллотоксинов — через 5 лет.
Длительное использование алкилирующих препаратов при лечении ревматических или других неопухолевых заболеваний также сопровождается высоким риском развития миелодиспластического синдрома (МДС). У детей с синдромом Швахмана-Дайемонда, анемией Фанкони и нейрофиброматозом 1-го типа частота развития миелодиспластического синдрома (МДС) выше, чем в общей популяции.
Как и другие гемобластозы, миелодиспластический синдром (МДС) имеет клональный патогенез. Родоначальницей клона является дефектная стволовая кроветворная клетка. В развитии заболевания имеют значение дефекты кроветворного микроокружения, приводящие к нарушению продукции цитокинов клетками стромы костного мозга и сопровождающиеся кумуляцией хромосомных повреждений и нарушением регуляции апоптоза.

Клиническая картина миелодиспластических синдромов
Симптоматика миелодиспластического синдрома (МДС) обусловлена наличием и выраженностью цитопении (чаще встречается панцитопения, реже — одно- и двуростковая цитопения). Основные клинические синдромы: анемический, геморрагический и инфекционных осложнений.
Наиболее часто первым признаком заболевания является анемия, проявляющаяся общей слабостью, одышкой при обычной физической нагрузке, головокружениями, сердцебиениями. Геморрагический синдром обусловлен тромбоцитопенией и качественными нарушениями клеток мегакариоцитарного ростка и обычно манифестирует подкожными кровоизлияниями, носовыми и десневыми кровотечениями, меноррагиями у женщин.
При глубокой тромбоцитопении могут возникать менометроррагии, желудочно-кишечные, почечные кровотечения, острые нарушения мозгового кровообращения. У 20-30% больных в клинической картине преобладают инфекционные осложнения, частота и выраженность которых связаны со степенью и длительностью нейтропении или агранулоцитоза: в более легких случаях возникают стрептодермии, стоматиты, синуситы, в тяжелых случаях — пневмонии, сепсис, причем возбудителями инфекционных осложнений часто являются условно-патогенная бактериальная, вирусная и грибковая микрофлора.
Увеличение лимфатических узлов, печени и селезенки наблюдается у 10-20% больных. Исключением является хронический миеломоноцитарный лейкоз, при котором спленомегалия отмечается почти у половины пациентов.
У 10% больных в начале заболевания клинические признаки отсутствуют и миелодиспластический синдром (МДС) обнаруживается случайно (при исследовании крови).
В 10-50% случаев (в зависимости от варианта миелодиспластического синдрома (МДС)) в исходе заболевания развиваются вторичные острые миелоидные лейкозы. В связи с резистентностью к цитостатической терапии и пожилым возрастом большинства пациентов ремиссии достигаются редко и обычно непродолжительны.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Патогенез миелодиспластических синдромов (МДС) - причины апоптоза
Увеличенная продукция гемопоэтических клеток при миелодиспластических синдромах (МДС) сочетается с их усиленной гибелью посредством апоптоза (программированной клеточной смерти). На сегодняшний день не вызывает сомнений, что усиленный апоптоз имеет одно из ключевых значений в патогенезе миелодиспластических синдромов, являясь объяснением неэффективного кроветворения, т. е. парадоксального сочетания панцитопении с гипер- или нормоклеточным костным мозгом.
Первые исследования этого явления при миелодиспластических синдромах выявили апоптоз более чем 75 % всех гемопоэтических клеток трех ростков кроветворения почти у половины больных. Кроме того, был обнаружен апоптоз клеток стромы (фибробластов, жировых клеток, клеток эндотелия). Возможно, наличие клеток (обнаружено 20—90 %) одновременно в процессе апоптоза и в S-фазе клеточного цикла является специфическим признаком миелодиспластического синдрома, так как это явление практически не встречается при других опухолевых заболеваниях, включая ОМЛ, при котором этот показатель достоверно ниже, чем при миелодиспластических синдромах (2,7 и 64,8 % клеток соответственно).
Число клеток, подверженных апоптозу, и число больных с увеличенным апоптозом в разных работах существенно варьирует, что прежде всего объясняется различиями в методах исследования, исследуемом материале (аспират или трепанобиоптат костного мозга, изучение «свежего» материала или культуры клеток), анализируемой популяции клеток и числом больных с различными ФАБ-вариантами миелодиспластических синдромов.
Наши результаты изучения апоптоза методом DNA laddering (фрагментация ДНК с образованием «лестницы», представленной ее регулярными участками; определяется методом электрофореза ДНК в геле) не обнаружили связи интенсивности апоптоза с ФАБ-вариантами МДС, однако выявили достоверную обратную связь с числом лейкоцитов и числом бластных клеток костного мозга. Среднее число клеток, подверженных апоптозу, составило 15 %, а число больных с усиленным апоптозом — 57 %.
По данным других отечественных исследователей (результаты получены с использованием метода TUNEL при анализе 16 больных МДС и 8 больных, представляющих контрольную группу), среднее число клеток, подверженных программированной клеточной гибели, при РА с 2- и/или 3-ростковой дисплазией составило 25%, что достоверно отличалось от этого показателя в контрольной группе (у пациентов с лимфомой Ходжкина — 11 %, ОМЛ— 8 %). У больных миелодиспластическими синдромами с уровнем бластных клеток костного мозга свыше 5 % число апоптотических клеток в среднем составило 13%.
Таким образом, во многих исследованиях было показано, что апоптоз клеток костного мозга более выражен, во-первых, у больных МДС по сравнению со здоровыми лицами, во-вторых, по сравнению с больными ОМЛ (с числом бластных клеток в костном мозге свыше 30 % по классификации ФАБ), в-третьих, у больных РА и РАКС, а также РАИБ по сравнению с РАИБ-Т. Данные о большем числе апоптотически погибающих клеток при РА и РАКС по сравнению с РАИБ представляются малочисленными. Однако общепринятым положением является преобладание усиленного апоптоза при «ранних» вариантах МДС по сравнению с «продвинутыми» (синоним «поздними», т. е. с числом бластных клеток в костном мозге >5%).
Причиной усиленной программированной клеточной смерти может быть увеличение концентрации цитокинов, индуцирующих программированную клеточную смерть: TNF-a (фактор некроза опухоли а), TGF-b (трансформирующий ростовой фактор (5) и ИЛ-1b (интерлейкин-1b). Имеются данные о корреляции между повышенным уровнем TNF-a в костном мозге и увеличением апоптоза гемопоэтических клеток, в том числе у большинства больных с гипоклеточным костным мозгом.
Кроме того, при миелодиспластических синдромах обнаружено увеличение количества гемопоэтических клеток, экспрессирующих CD95(Fas/Apo-l)-антиген, опосредующий апоптоз. Однако не все исследования подтвердили связь апоптоза клеток костного мозга с экспрессией Fas-антигена, что указывает на регуляцию программированной клеточной смерти совокупным влиянием про- и антиапоптотических факторов.
В регуляции апоптоза участвует множество генов, обладающих про- и антиапоптотической активностью. К первым относят: C-MYC, Р53, TNFR, FAS, ВАХ, BCL-XS, BAD, ВАК, BIK, BID, ко вторым-BCL-2, BCL-XU C-ABL, RAS. Многочисленные работы демонстрируют более высокую экспрессию белков, кодируемых проапоптотическими генами, при «ранних» вариантах миелодиспластических синдромов по сравнению с «продвинутыми».
Установлено, что одним из механизмов индукции апоптоза при миелодиспластических синдромах является изменение митохондри-ального трансмембранного потенциала, приводящее к нарушению проницаемости мембраны митохондрий и высвобождению цитохрома с (Cyt с) и белка Smac/DIABLO с последующей активацией каспазы-3 и, возможно, каспазы-9.
Поздним этапом многоступенчатого процесса апоптоза является активация протеаз — каспаз, присутствующих в клетке в неактивной форме. Как показали исследования, активность каспазы-3 выше у больных с «ранними» вариантами миелодиспластических синдромов по сравнению со здоровыми донорами и больными миелодиспластическими синдромами с «продвинутыми» вариантами. Имеются данные о большей активности каспазы-3, -8 и -9 в мононуклеарах костного мозга при РАКС, чем у здоровых лиц контрольной группы, в том числе после инкубации клеток в присутствии Fas-антител.
Установлено, что при миелодиспластических синдромах (МДС) Т-лимфоциты могут индуцировать апоптоз CD34-клеток, ингибируемый добавлением в культуры клеток (Т-лимфоцитов и CD34+-клеток) циклоспорина А.
В качестве еще одного механизма индукции апоптоза обсуждается роль так называемого «оксидативного шока», возникающего в результате внутриклеточного образования свободных радикалов кислорода. Как показали исследования на небольшой группе больных МДС, окисленные пиримидиновые нуклео-тиды были выявлены в CD34+-клетках костного мозга и крови, но отсутствовали в CD34+-клетках здоровых доноров.
При этом отмечалась выраженная связь между случаями окисления пиримидиновых нуклеотидов в CD34+-клетках костного мозга и обнаружением повышенной концентрации TNF-а в крови. Полученные результаты согласуются с данными об увеличении продукции синтетазы окиси азота (NOS) в результате взаимодействия моноклональных антител с Fas антигеном CD34+-клеток. Под влиянием NOS происходит образование токсичного метаболита окиси азота (N0) из L-аргинина.
Экспрессия мРНК так называемого индуцируемого NOS (iNOS) в клетках костного мозга была обнаружена у 11 из 12 больных миелодиспластическими синдромами (МДС), у 1 из 9 лиц контрольной группы и отсутствовала у больных ОМЛ. Аналогичная картина наблюдалась у больных миелодиспластическими синдромами (МДС) и при иммуногистохимическом определении белка iNOS, который выявлялся преимущественно в макрофагах и незначительно в миелоидных клетках.
В дальнейшем на большой группе больных миелодиспластическими синдромами (МДС) (96 пациентов) было показано, что среднее число iNOS позитивных клеток костного мозга и средняя концентрация окисей азота — нитратов (NО3~) и нитритов (NО2~) в крови достоверно больше, чем в контрольной группе здоровых доноров, но практически одинаковое при разных ФАБ-вариантах миелодиспластических синдромов. У больных с высокой экспрессией iNOS (>10 % клеток) средняя концентрация окисей азота была достоверно выше по сравнению с больными с низкой экспрессией iNOS (
Однако достоверная связь между числом апоптотически погибающих клеток и числом клеток, экспрессирующих iNOS, отсутствовала. Исследование D. Т. Bowen и соавт. указывает на повышенную экспрессию ряда ферментов, обладающих антиоксидантной активностью, в гранулоцитах, CD34+-клетках и мононуклеарах костного мозга больных МДС: глутатионпероксидазы 1 (GPX1), магнийпероксиддисмутазы 2 (SOD2), каталазы (CAT) и у-глутаминцистеинсинтетазы (GCS). Наличие этих ферментов, вероятно, направлено на подавление повышенного образования оксидантов и может объяснять устойчивость клеток к апоптозу.
Одним из новых направлений в изучении патогенеза миелодиспластических синдромов (МДС) и других гемобластозов являются исследования роли белков теплового шока (HSP — heat shock proteins), представляющих семейство пептидов, как постоянно присутствующих в гемопоэтических клетках, так и образующихся в результате применения химиопрепаратов, теплового или «оксидативного шока (стресса)». Большинство HSP оказывают выраженный цитопротективный эффект. HSP72 и HSP27 участвуют в регуляции апоптоза, пролиферации и дифференцировке клеток. В работе S. Michalopoulou и соавт. было показано, что экспрессия HSP72, HSP27 и HSP70 мононуклеарами костного мозга достоверно выше при МДС, особенно при «продвинутых» вариантах, чем в контрольной группе здоровых доноров. Различия в экспрессии HSP72 между РА/РАКС и РАИБ/РАИБ-Т приближались к достоверным (р=0,054).
Кроме того, была выявлена достоверная обратная связь между экспрессией HSP72 в CD34+-клетках и их апоптозом, индуцированным TNF-а и ИФН-у, что подтверждает антиапоптотическую активность этого белка.
К возможному механизму развития заболевания, включая индукцию апоптоза, относится дефект микроокружения. При миелодиспластических синдромах (МДС) обнаружены качественные и количественные изменения клеток стромы костного мозга с нарушением продукции цитокинов, регулирующих апоптоз. Выявлена возможность прямого межклеточного взаимодействия, индуцирующего апоптоз как нормальных CD34+-клеток, так и лейкемических клеток. Однако роль клеток стромы в формировании неэффективного гемопоэза остается дискутабельной. Так, на материале 80 трепанобиоптатов костного мозга было показано, что TNF-a продуцировался преимущественно мононуклеарами, включая клетки-предшественники, а не клетками микроокружения.
Выработка TNF-a клетками микроокружения у больных миелодиспластическими синдромами (МДС) была сопоставима со здоровыми донорами. В связи с полученными результатами авторы высказали предположение о том, что апоптоз клеток стромы, описанный многими исследователями, является ответом на повышенную продукцию TNF-a мононуклеарами.
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% - нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Миелодиспластический синдром у взрослых
1. Клинический протокол диагностики и лечения пациентов с заболеванием «миелодиспластический синдром» (далее-МДС) предназначен для оказания медицинской помощи в амбулаторных и стационарных условиях районных, областных и республиканских организаций здравоохранения, имеющих в своем составе гематологические отделения.
2. Возрастная категория: взрослое население.
3. Наименование нозологической формы заболевания (шифр по МКБ-10): миелодиспластический синдром - С92.1;
4. Определение: МДС - группа биологически и клинически гетерогенных клональных заболеваний, характеризующихся неэффективным гемопоэзом и цитопенией в периферической крови вследствие повышения апоптотической активности гемопоэтических предшественников с тенденцией к развитию костно-мозговой недостаточности или острого мие- лобластного лейкоза.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЯ
5. Классификация МДС, принятая Всемирной организацией здравоохранения (далее-ВОЗ) в 2008 году базируется на цитоморфологических, кариотипических и клинических признаках заболевания.
Классификация миелодиспластических синдромов
- 5 % бластов Палочки Ауэра отсутствуют
- 1 -10 9 /л моноцитов
*- хромосомные аномалии, которые рассматривают как предполагаемое свидетельство наличия МДС при стойкой цитопении неопределенного происхождения и при отсутствии абсолютных морфологических критериев МДС:
несбалансированные аномалии: - 7 или del(7q); - 5 или del(5q); i( 1 7q) или t(17p); - 13 или del(13q); del(l lq); del(12p) или t(12p); del(9q); idic(X)(ql3);
сбалансированные аномалии: t(l 1; 16)(q23;p 13.3); t(3;21) (q26.2;q22.1); t(l;3) (рЗб.З; q21.1); t(2;l 1) (p21;q23); inv(3) (q21q26.2); t(6;9)(p23;q34);
сложный кариотип (3 или более хрмосомных аномалий) с вовлечением вышеупомянутых нарушений.
Диагностика
КРИТЕРИИ ДИАГНОЗА МДС
6. Предварительные критерии (А).
6.1. Стабильная цитопения по > 1 из следующих клеточных линий:
эритроидной (уровень гемоглобина < 110 г/л);
нейтрофильной (количество нейтрофилов < 1,5х10 9 /л);
мегакариоцитарной (количество тромбоцитов < 100 х10 9 /л).
6.2. Исключение других гематологических и негематологических заболеваний - причин цитопении/дисплазии.
7. МДС-ассоциированные критерии (В).
7.1. Дисплазия в > 10% клеток эритроидной, нейтрофильной или мегакариоцитарной клеточных линиях костного мозга, либо наличие > 15% кольцевых сидеробластов.
7.2. От 5 до 19% бластных клеток в костном мозге.
7.3. Типичные хромосомные абберации по результатам стандартного цитологического исследования или флюоресцентной гибридизации in situ (+8, -7, 5q-, 20q- и др. согласно классификации)
8. Вспомогательные критерии (С) (для пациентов, имеющих критерии А, но не имеющих критерии В).
8.1. Аномальный иммунный фенотип эритроидных или миелоидных клеток костного мозга, указывающий на их клональное происхождение (по результатам проточной цитометрии).
8.2. Молекулярно-генетические признаки наличия клональной клеточной популяции в костном мозге (по результатам HUMARA исследования или биологического микрочипирования).
8.3. Значительное и стабильное снижение колониеобразующей активности костного мозга и/или периферической крови.
Диагноз устанавливается при наличии 2 предварительных критериев (А) и не менее чем одного МДС-ассоциированных критериев (В). Вспомогательные
критерии (С) используются при отсутствии критериев В и наличии у пациента признаков клональной миелоидной пролиферации. Критерии группы С не входят в обязательный стандарт диагностики МДС.
Диагноз «идиопатическая цитопения неопределенного значения» применяется для обозначения случаев цитопении по одной и более клеточным линиям в течение > 6 месяцев при отсутствии критериев МДС и других причин цитопении. Такие пациенты должны наблюдаться и обследоваться гематологом с интервалом 1-6 месяцев.
Диагностические критерии разработаны ICWG (International Consensus Working Group), 2007 г.
Алгоритм диагностики МДС включает в себя клинические и лабораторные исследования, мультидисциплинарный подход с привлечением смежных специалистов и последовательно проводится на базе учреждений здравоохранения различного уровня с соблюдением преемственности на всех этапах. Это обусловлено полиэтиологичностью и гетерогенностью проявлений при данной патологии, стремлением к рационализации использования специального диагностического оборудования, минимизации диагностических ошибок.
Этапы диагностики МДС:
| Этап | Задачи | Уровень медицинского учреждения и специалисты | Содержание |
| Первичного скрининга | Выявление пациентов с цитопе- ническими синдромами и клиническими проявлениями МДС; обоснование необходимости и направле-ние пациентов, нуждающихся в дополнительном обследовании, на следующий этап | Районный, городской (врачи любой специальности амбулаторно - поликлинических и стационарных учреждений здравоохранения) | Анамнез (химио- или лучевая терапия в прошлом, случаи МДС/ОМЛ в семье, рецидивирующие инфекционные заболевания или геморрагический синдром) Физикальное обследование (бледность, инфекционновоспалительные процессы, геморрагический синдром, спле- номегалия) Общий анализ периферической крови, с подсчетом количества тромбоцитов, лейкоцитарной формулы. Биохимический анализ крови (общий белок, альбумины, глобулины, мочевина, креатинин, билирубин, щелочная фосфатаза, ACT, АЛТ, ЛДГ, сывороточное железо) |
| Углубленного кли- нико - лабораторного и инструментального обследования | Углубленное клиниколабораторное и инструментальное обследование и выявление МДС - ассоциированных критериев; обосно-вание необходимости и направление па-циентов на следующий этап; диспансеризация пациентов с ранее верифицированным МДС | Областной, городской (гематоло гические отделения, кабинеты) | Общий анализ периферической крови, с подсчетом количества тромбоцитов, ретикулоцитов, лейкоцитарной формулы, морфологической оценкой. Биохимический анализ крови (сывороточный ферритин) Исключение реактивной дисплазии (мегалобластная анемия в результате дефицита витамина В12 и фолиевой кислоты, инфицирование ВИЧ, алкоголизм, недавнее цитотоксическое лечение, солидные злокачественные новообразования): маркеры вирусных гепатитов В и С, сифилиса, вируса иммунодефицита человека, ФГДС, колоноскопия, ультразвуковое исследование органов брюшной полости и малого таза, лимфатических узлов, щитовидной железы, рентгенография органов грудной полости. Аспирационная биопсия костного мозга: морфологическое исследование, иммунный фенотип, цитохимическое исследование эритрокариоцитов |
| Дифференциальной диагностики и подбора терапии | Клинико - лабораторное и инструментальное обследование пациентов с целью дифференциальной диагностики, верификации диагноза; подбор и коррекция индиви-дуальной про-граммы терапии; диспансеризация пациентов с ранее верифицированным МДС; создание базы и анализ данных пациентов с МДС для изучения проблемы МДС и усовершенствования оказания медицинской помощи | Областной, республи канский (гематоло гические отделения) | Исключение реактивной дисплазии: маркеры вируса Эпштейна - Барр, цитомегаловируса, определение в сыворотке крови уровня витамина В]2 и фолиевой кислоты. Определение в сыворотке крови уровня эритропоэтина Аспирационная биопсия костного мозга: морфологическое, цитогене- тическое исследования, иммунный фенотип, цитохимическое исследование эритрокариоцитов костного мозга Билатеральная трепанобиопсия передних или задних остей подвздошных костей Молекулярно-биологический анализ Клоногенный тест |
Лечение
КЛИНИЧЕСКИЕ ВАРИАНТЫ МДС
10. Определение клинического варианта МДС имеет значение для выбора тактики лечения.
10.1. 5ц-синдром: болеют преимущественно женщины, характерны вялотекущий характер заболевания, низкая вероятность трансформации в ОМЛ (10%), тяжелая макроцитарная анемия, нормальный или умерено сниженный уровень лейкоцитов и тромбоцитов, дисплазия мегакариоци- тарного ростка, отсутствие значительно повышения уровня бластных клеток в костном мозге; хороший ответ на леналидомид*.
10.2. Вторичный МДС: частота вторичного МДС нарастает в связи с успехами химиотерапии опухолей и воздействием загрязнения окружающей среды; для большинства пациентов характерны множественные хромосомные аберрации; прогноз хуже, чем при первичном МДС.
10.3. Гипопластический МДС:
до 15% случаев МДС характеризуются низкой клеточностью костного мозга при гистологическом исследовании (доля кроветворной ткани в препарате менее 30% у пациентов моложе 60 лет или менее 20% у пациентов 60 лет и старше);
дисплазия мегакариоцитов и клеток миелоидного ряда может отсутствовать;
возможны трудности в дифференциации от апластической анемии, для которой характерна более выраженная панцитопения, отсутствие типичных для МДС хромосомных аббераций и снижение содержания CD34+ клеток в костном мозге.
10.4. МДС с миелофиброзом: до 50% случаев всех вариантов МДС характеризуется фиброзом костного мозга (до 15% имеют выраженный фиброз); фиброз более характерен для вторичного МДС; характерны ги- перклеточность костного мозга, диффузный ретикулиновый фиброз его стромы и дисплазия не менее чем в 2 клеточных линиях; в периферической крови панцитопения, признаки клеточной дисплазии и лейкоэрит- робластоза; органомегалия нехарактерна; заболевание быстро прогрессирует; необходимо дифференцировать от острого мегакариобластного лейкоза, острого миелофиброза (острого панмиелоза с фиброзом), хронических миелопролиферативных заболеваний, метастатического рака, лимфом и волосатоклеточного лейкоза.
ЛЕЧЕНИЕ
11. Выбор терапии основан на диагнозе и группе риска по международной прогностической бальной системе (IPSS). В соответствии с международными рекомендациями для выбора терапевтической тактики пациентов с МДС подразделяют на 2 большие группы риска:
группу относительно низкого риска, включая в нее пациентов с низким и промежуточным 1 риском по системе IPSS;
группу высокого риска, включая в нее пациентов с промежуточным 2 и высоким риском по системе IPSS.
У пациентов из группы относительно низкого риска возможно применение только поддерживающей терапии либо терапии малой интенсивности. Интенсивная терапия показана пациентам группы высокого риска с учетом возраста, анамнеза заболевания, клинических проявлений, общего состояния и наличия признаков прогрессирования заболевания.
11.1. Поддерживающее лечение.
Поддерживающее лечение назначают с целью уменьшения проявлений заболевания и поддержания качества жизни. У пациентов из группы относительно низкого риска это может быть основным видом терапии.
11.1.1. Трансфузии донорских эритроцитов. Основным клиническим показанием для трансфузии донорских эритроцитов является не столько уровень гемоглобина, сколько степень адаптированности пациента к анемии.
11.1.2. Применение хелаторов железа.
Показаниями к применению хелаторов железа является переливание более 20-25 доз эритроцитной массы, уровень сывороточного ферритина более 2500 мкг/л, наличие дисфункции сердца (аритмия, сердечная недостаточность) и поражения печени.
Дефероксамин применяют в дозе 30-40 мг/кг в виде 12 часовых подкожных инфузий 5-7 раз в неделю (ночью). Дозу лекарственного средства снижают до 25 мг/кг при уровне ферритина < 2000 мкг/л. Необходимы контроль функции почек, аудиометрия и офтальмологический контроль до начала терапии и ежегодно на фоне ее проведения.
11.1.3. Трансфузии донорских тромбоцитов в стандартных дозировках показаны пациентам с глубокой тромбоцитопенией и петехиально - пятнистой кровоточивостью.
11.1.4. Эмпирическая антибактериальная и противогрибковая терапия лекарственными средствами широкого спектра действия показана пациентам с фебрильной нейтропенией. Профилактический прием антибактериальных и противогрибковых лекарственных средств показан лишь пациентам с рецидивирующими инфекционными осложнениями на фоне нейтропении.
11.2. Терапия малой интенсивности.
11.2.1. Эритропоэтин применяют в качестве терапии первой линии у пациентов группы относительно низкого риска с РА и РАИБ, частота трансфузий донорских эритроцитов у которых менее 2 доз в месяц и базальный уровень эритропоэтина в сыворотке крови менее 200 МЕ/л, в дозе 10 000 Ед подкожно в сутки ежедневно (40-60 000 ЕД 1-3 раза в неделю) в течение 6 недель.
11.2.2. Филграстим (далее - Е-КСФ) назначают пациентам резистентным к монотерапии эритропоэтином в дозе 1-2 мкг/кг подкожно в сутки ежедневно или 1-3 раза в неделю (в сочетании с эритропоэтином). При отсутствии ответа на терапию в течение 2-3 месяцев её прекращают. При наличии ответа постепенно снижают дозу эритропоэтина и Е-КСФ до минимально эффективной.
Возможно монотерапия Е-КСФ у пациентов с нейтропенией и рецидивирующими или резистентными к антибиотикотерапии инфекциями. Профилактическое применение препарата не целесообразно.
11.2.3. Эпигенетическую терапию применяют у пациентов группы высокого риска, у которых невозможно применение интенсивной терапии:
децитабин 20 мг/м в сутки внутривенно 5 дней ежемесячно 4-6 курсов.
11.2.4. Иммуносупрессивную терапию применяют преимущественно у пациентов с гипопластическим вариантом МДС.
Антитимоцитарный глобулин (далее-АТГ) 40 мг/кг в сутки внутривенно 4 дня.
Циклоспорин А в дозе 1-5 мг/кг/день в 2 приема не менее 6 месяцев. Дозу корригируют в соответствии с концентрацией препарата в сыворотке крови (не выше 400 мкг/мл), уровнем артериального давления, функциональным состоянием печени и почек.
11.2.5. Пациентам с РАИБ-1 и РАИБ-2, гипопластическим вариантом МДС показан мелфалан в дозе 2 мг/сутки перорально до получения клинико-гематологического эффекта.
11.3. Интенсивная терапия.
11.3.1. Пациентам группы высокого риска в возрасте менее 60 лет показано применение терапии индукции ремиссии острого миелобластно- го лейкоза.
11.3.2. Высокодозная химиотерапия с трансплантацией аллогенных гемопоэтических стволовых клеток показана всем пациентам с МДС в возрасте менее 60 лет при наличии HLA-идентичного родственного донора.
11.3.3. Критерии клинико-гематологического ответа при лечении первич
Миелодиспластический синдром (МДС) сегодня является одной из самых сложных проблем гематологии. Лишь недавно лечение МДС вышло за рамки поддерживающей терапии, проводившейся с помощью облегчения симптомов. МДС является патологией старшей возрастной группы: 80 % случаев МДС приходится на лица старше 60 лет. МДС в детском возрасте встречается крайне редко. В европейских странах среди лиц 50—69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения. Заболеваемость МДС в РФ в среднем составляет 3—4 случая на 100 тыс. населения в год и увеличивается с возрастом [1].
1.Рукавицын О. Гематология: национальное руководство / О. Рукавицын. – Москва: ГЭОТАР-Медиа, 2017. –С. 193-226.
2. Герминг У. Миелодиспластические синдромы: диагностика, прогноз, лечение / У. Герминг, Г. Коббе, Р. Хаас // Deutsches Ärzteblatt International. -2013. -№110(46). -90 с.
4. Иванага М. Риск миелодиспластических синдромов у людей, подвергшихся воздействию ионизирующего излучения: ретроспективное когортное исследование людей, переживших атомную бомбу Нагасаки / М. Иванга, М. Сода, Ю. Такасаки [и др.] // Журнал клинической онкологии. -2011. -№29(4). С. 34-42.
5. Каззола М. Экспрессия митохондриального ферритина в эритроидных клетках пациентов с сидеробластной анемией / М. Каззола, Р. Инверниззи, Дж. Бергамаши, С. Леви [и др.] // Журнал Кровь. -2003. -№101(5). –С. 1996-2000.
7. Бхатнагар Н. Транзиторный аномальный миелопоэз и острый миелоидный лейкоз при синдроме Дауна / Н. Бхатнагар, Л. Низери, О. Танстолл, П. Вьяс, И. Робертс // Текущие гематологические отчеты о злокачественных заболеваниях. -2016. -№11(5). –С. 33-41.
МДС – группа заболеваний со сложным патогенезом, который приводит к развитию диспластического кроветворения в сочетании с нормальным. Вначале симптомы обычно не проявляются. Позже симптомы могут включать чувство усталости, одышку, нарушения свертываемости крови, анемию или частые инфекции. Некоторые типы могут перерасти в острый миелоидный лейкоз [2].
Первичный (идиопатический) тип — 80—90 % случаев, вторичный (вследствие предшествующей химиотерапии и др. факторов) — 10—20 %. Большинство случаев МДС являются первичными — идиопатическими или de novo (с лат. — «вновь появившийся, новый»).
Вторичный МДС является значительно более неблагоприятным и резистентным к лечению типом МДС, обладающим заведомо более худшим прогнозом в сравнении с первичным МДС.
Признаки и симптомы неспецифичны и обычно связаны с цитопенией крови: анемия (хроническая усталость, одышка, ощущение холода, иногда боль в груди); нейтропения (повышенная восприимчивость к инфекции); тромбоцитопения (повышенная склонность к кровотечениям и экхимозам, а также к подкожным кровотечениям, приводящим к пурпуре или петехиям) [3].
Многие люди не имеют симптомов, и цитопения крови или другие проблемы выявляются при обычном анализе крови: нейтропения, анемия и тромбоцитопения; спленомегалия или редко гепатомегалия; аномальные гранулы в клетках, аномальная форма и размер ядер; хромосомная аномалия, включая хромосомные транслокации и аномальное количество хромосом
Хотя существует определенный риск развития острого миелоидного лейкоза, около 50% смертей происходит в результате кровотечения или инфекции. Однако лейкоз, возникающий в результате миелодисплазии, обычно не поддается лечению. На раннем этапе преобладает анемия. Большинство пациентов жалуются на постепенное наступление утомляемости и слабости, одышки и бледности, но, по крайней мере, у половины пациентов симптомы отсутствуют, и МДС обнаруживается лишь случайно при обычных анализах крови. Предшествующая химиотерапия или облучение являются важным фактором в истории болезни человека. Лихорадка и потеря веса должны указывать на миелопролиферативный, а не на миелодиспластический процесс. [3]
Некоторые люди в анамнезе подвергались химиотерапии (особенно алкилирующим агентам, таким как мелфалан, циклофосфамид, бусульфан и хлорамбуцил) или облучению (терапевтическому или случайному) или тому и другому (например, во время трансплантации стволовых клеток по поводу другого заболевания). Рабочие в некоторых отраслях промышленности, подвергающихся сильному воздействию углеводородов, таких как нефтяная промышленность, имеют несколько более высокий риск заражения этим заболеванием, чем население в целом. Воздействие ксилола и бензола было связано с миелодисплазией. Ветераны Вьетнама, подвергшиеся воздействию агент «оранж», рискуют заболеть МДС. Связь может существовать между развитием МДС «у людей, переживших атомную бомбу через 40-60 лет после облучения» (в данном случае имеется в виду людей, которые были в непосредственной близости от атомных бомб в Хиросиме и Нагасаки во время мировой войны. II). Дети с синдромом Дауна предрасположены к МДС, и семейный анамнез может указывать на наследственную форму сидеробластной анемии или анемии Фанкони [4].
МДС чаще всего развивается без видимой причины. Факторы риска включают воздействие агента, который, как известно, вызывает повреждение ДНК, такого как радиация, бензол и некоторые виды химиотерапии; о других факторах риска сообщалось непоследовательно. Доказать связь между предполагаемым воздействием и развитием МДС может быть сложно, но наличие генетических аномалий может предоставить некоторую подтверждающую информацию. Вторичный МДС может возникать как поздняя токсичность раковой терапии (МДС, ассоциированный с терапией, t-МДС). МДС после воздействия радиации или алкилирующих агентов, таких как бусульфан, нитрозомочевина или прокарбазин, обычно возникает через 3-7 лет после воздействия и часто демонстрирует потерю хромосомы 5 или 7. МДС после воздействия ингибиторов ДНК-топоизомеразы II возникает после более короткого латентного периода - всего 1–3 года и может иметь транслокацию 11q23. Другие ранее существовавшие заболевания костного мозга, такие как приобретенная апластическая анемия после иммуносупрессивного лечения и анемия Фанкони, могут перерасти в МДС.
Считается, что МДС возникает из-за мутаций в мультипотентных стволовых клетках костного мозга, но конкретные дефекты, ответственные за эти заболевания, остаются плохо изученными. Дифференциация клеток-предшественников крови нарушается, и в клетках костного мозга происходит значительное увеличение уровней апоптотической гибели клеток. Клональная экспансия аномальных клеток приводит к образованию клеток, утративших способность дифференцироваться. Если общий процент миелобластов костного мозга превышает определенный предел (20% для ВОЗ), то считается, что произошла трансформация в острый миелогенный лейкоз (ОМЛ). Прогрессирование МДС в ОМЛ - хороший пример многоэтапной теории канцерогенеза, в которой серия мутаций происходит в изначально нормальной клетке и превращает ее в раковую клетку.
Хотя признание лейкемической трансформации было исторически важным, значительная часть заболеваемости и смертности, связанных с МДС, является результатом не трансформации в ОМЛ, а, скорее, цитопений, наблюдаемых у всех пациентов с МДС. В то время как анемия является наиболее распространенной цитопенией у пациентов с МДС, учитывая доступность переливания крови, пациенты с МДС редко страдают от тяжелой анемии. Двумя наиболее серьезными осложнениями у пациентов с МДС в результате их цитопении являются кровотечение (из-за недостатка тромбоцитов) или инфекция (из-за недостатка лейкоцитов). Длительное переливание эритроцитов приводит к перегрузке железом.
Признание эпигенетических изменений в структуре ДНК при МДС объяснило успех двух (а именно гипометилирующих агентов 5-азацитидин и децитабин) из трех (третий - леналидомид) коммерчески доступных лекарств, одобренных Управлением по контролю за продуктами и лекарствами США для лечения МДС. Правильное метилирование ДНК имеет решающее значение для регуляции генов пролиферации, а потеря контроля метилирования ДНК может привести к неконтролируемому росту клеток и цитопении. Недавно одобренные ингибиторы ДНК-метилтрансферазы используют этот механизм, создавая более упорядоченный профиль метилирования ДНК в ядре гемопоэтических стволовых клеток, тем самым восстанавливая нормальные показатели крови и замедляя прогрессирование МДС до острого лейкоза [3].
Некоторые авторы предположили, что потеря митохондриальной функции с течением времени приводит к накоплению мутаций ДНК в гемопоэтических стволовых клетках, и это объясняет повышенную частоту МДС у пожилых пациентов. Исследователи указывают на накопление митохондриальных отложений железа в кольцевых сидеробластах как на доказательство митохондриальной дисфункции при МДС [5].
По крайней мере, с 1974 г. известно, что делеция в длинном плече хромосомы 5 связана с диспластическими аномалиями гемопоэтических стволовых клеток. К 2005 году леналидомид, химиотерапевтический препарат, был признан эффективным у пациентов с МДС с 5q-синдромом, а в декабре 2005 года FDA США одобрило этот препарат для этого показания. Пациенты с изолированным 5q-, низким риском IPSS и трансфузионной зависимостью лучше всего реагируют на леналидомид. Как правило, прогноз для этих пациентов благоприятный, средняя выживаемость составляет 63 месяца. Леналидомид имеет двойное действие, снижая количество злокачественных клонов у пациентов с 5q- и индуцируя лучшую дифференцировку здоровых эритроидных клеток, как это наблюдается у пациентов без делеции 5q [6].
Мутации в факторах сплайсинга были обнаружены в 40-80% случаев миелодиспластического синдрома, особенно у пациентов с кольцевидными сидеробластами.
Мутации в генах, кодирующих изоцитратдегидрогеназу 1 и 2 (IDH1 и IDH2), встречаются у 10–20% пациентов с миелодиспластическим синдромом и приводят к ухудшению прогноза при МДС низкого риска. Поскольку частота мутаций IDH1 / 2 увеличивается по мере увеличения злокачественности заболевания, эти данные вместе предполагают, что мутации IDH1 / 2 являются важными факторами прогрессирования МДС в более злокачественное состояние.
Преходящее миелопролиферативное заболевание - аномальная пролиферация клона доброкачественных мегакариобластов в печени и костном мозге. Заболевание ограничивается людьми с синдромом Дауна или генетическими изменениями, аналогичными таковым при синдроме Дауна, развивается во время беременности или вскоре после рождения и проходит в течение 3 месяцев, или примерно в 10% случаев прогрессирует до острого мегакариобластного лейкоза [7].
Читайте также:
- Коклюш - инфекция Bordetella pertussis и parapertussis: диагностика, лечение, профилактика
- Период дегенеративных и антропогенных заболеваний. Распространение сердечно-сосудистых заболеваний
- Рефлекс мочеиспускания. Воздействие головного мозга на мочеиспускание
- Иммуноглобулин при лечении миопатий. Прогноз при миопатиях.
- Моноканаликулярный стент, кольцевой стент при травме слезных канальцев. Применение
