Инфекционные осложнения послеоперационного периода. Оксигенотерапия в послеоперационном периоде
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
1. Обратимая экспираторная обструкция дыхательных путей, сопряженная с изменением газового состава крови.
2. Бронхиальная гиперреактивность.
3. Причины обструкции дыхательных путей:
— фармакологические препараты (нестероидные противовоспалительные средства, аспирин, β-антагонисты);
— инфекции (респираторные вирусы);
— физическая нагрузка (приступ чаще возникает после тренировки);
4. Заболевание может развиться в любом возрасте — 2/3 случаев до 40 лет.
5. Заболеваемость достигает 4—5%.
Нет достоверных данных, что наличие в анамнезе астмы увеличивает частоту послеоперационных легочных осложнений, однако неадекватная терапия астмы в предоперационном периоде может привести к развитию периоперационных легочных осложнений.
Хронические обструктивные болезни легких (ХОБЛ) относят к числу наиболее распространенных заболеваний [20]. В структуре заболеваемости они входят в число лидирующих по числу дней нетрудоспособности, причинам инвалидности и занимают четвертое место среди причин смерти. При этом в развитых странах мира прогнозируется увеличение смертности от ХОБЛ в недалеком будущем. ХОБЛ наносят значительный экономический ущерб, связанный с временной и стойкой утратой трудоспособности самой активной части населения. ХОБЛ — собирательное понятие, которое объединяет группу хронических болезней дыхательной системы: хронический обструктивный бронхит, эмфизему легких, бронхиальную астму тяжелого течения, облитерирующий бронхиолит и бронхоэктатическую болезнь [21].
Бронхоэктатическая болезнь — хроническое заболевание, характеризующееся локальным расширением бронхов вследствие деструктивного воспалительного процесса, вовлекающего стенку бронха.
Бронхиолит — заболевание детского возраста, обусловленное чаще всего респираторно-синцитиальным вирусом. Процесс может сопровождаться вирусной пневмонией, ревматоидным артритом. Пациенты часто получают кортикостероиды для подавления воспалительного процесса.
Обструктивное сонное апноэ присутствует у всех тучных людей — чаще у мужчин (ИМТ более 30 кг/м 2 ), при этом чаще встречается в возрасте более 50 лет и у детей с гипертрофией миндалин, для диагностики необходимо определение индекса обструктивного сонного апноэ (количество эпизодов апноэ за ночь) > 5 у 24% мужчин и 9% женщин. Заболевание нередко сопровождается дневной сонливостью — у 16% мужчин и 22% женщин. Диагноз формируется при опросе пациента или беседе с его родственниками, однако в 90% случаев синдром не диагностируется [23].
Рестриктивная патология
1. Характеристика [24]:
— повышение жесткости ткани легких;
— уменьшение объема легких при нормальной бронхиальной проходимости;
— уменьшение легочной паренхимы после операции;
— ограничение подвижности легких (патология костно-мышечного каркаса грудной клетки, повышение абдоминального давления).
2. Патологические сдвиги:
— увеличение работы дыхания.
Интерстициальные болезни легких — это группа заболеваний, объединенная рентгенологическим синдромом двустороннего поражения, представлена приблизительно 200 нозологическими единицами, что составляет около 20% всех заболеваний легких [25].
Интерстициальные болезни легких являются гетерогенной группой болезней с общими клиническими проявлениями, изменениями физиологии дыхания и определенным патоморфологическим сходством. Несмотря на полиморфизм клинико-морфологических проявлений интерстициальных болезней легких, все они морфологически проявляются фиброзирующим альвеолитом со стереотипными изменениями альвеолярной мембраны и легочного интерстиция: в начале заболевания — в виде альвеолита, по мере прогрессирования — с постепенным замещением интерстициальным фиброзом, на терминальных стадиях — формированием «сотового легкого», дисплазией и малигнизацией эпителия альвеол и мелких бронхов.
В группу интерстициальных болезней легких входят различные болезни с установленной и неустановленной этиологией, с иммунным и неиммунным патогенезом, сопровождающиеся и не сопровождающиеся образованием гранулем.
Заболевания грудной клетки и плевры являются причиной компрессии легких и снижения легочных объемов, что приводит к гиповентиляции. Работа дыхания увеличивается вследствие нарушения механических свойств грудной клетки и повышения сопротивления дыхательных путей. Деформация грудной клетки может приводить к компрессии легочных сосудов и острой правожелудочковой недостаточности.
Факторы риска, связанные с оперативным вмешательством
Длительность
Длительное оперативное вмешательство (>3—4 ч) — независимый фактор риска респираторных осложнений [26].
Экстренность
У пациентов, подвергшихся экстренным операциям, риск развития легочных осложнений в 2,6 раза выше, чем при плановых оперативных вмешательствах [27].
Локализация
1. Наибольшее влияние на механические свойства легких оказывают операции на верхнем этаже брюшной полости и торакотомия [28, 29].
2. Операции на нижнем этаже брюшной полости и стернотомия — в меньшей степени.

Позиционирование (табл. 7). Таблица 7. Влияние положения на операционном столе на респираторную систему
Техника оперативного вмешательства
1. Частота легочных осложнений при малоинвазивных полостных вмешательствах ниже [30].
2. Преимущества лапароскопических операций (при поддержании уровня ВБД не выше 12 мм рт.ст.) [31]:
— снижение частоты послеоперационных ателектазов;
— улучшение показателей спирометрии;
— уменьшение частоты развития ателектазов;
— уменьшение легочных осложнений.
— Рекомендуется оценивать респираторный риск с помощью шкалы риска послеоперационной дыхательной недостаточности.
Уровень убедительности рекомендаций IIa (уровень достоверности доказательств C).
Комментарии

Оценка риска должна производиться с помощью Шкалы риска послеоперационной дыхательной недостаточности [32] (табл. 8). Таблица 8. Шкала оценки риска послеоперационной дыхательной недостаточности Примечание. NYHA — New York Heart Association.
При результате менее 12 баллов риск развития дыхательной недостаточности низкий (1,1%), от 12 до 22 — средний (4,6%), 23 и более — высокий (18,8%).
— Рекомендуется профилактика нейромышечной дыхательной недостаточности с целью снижения послеоперационных легочных осложнений.
Уровень убедительности рекомендаций I (уровень достоверности доказательств B).
Профилактика нейромышечной дыхательной недостаточности, связанной с применением миорелаксантов [33]:
1. Использование препаратов короткого действия (частота развития остаточной нейромышечной блокады выше в 5 раз, а послеоперационных легочных осложнений в 3 раза при использовании панкурониума, в сравнении с короткодействующими миорелаксантами) [34].
2. Использование нейромышечного мониторинга.
Мониторинг нейромышечного блока:
1. Является наиболее реальным методом снижения частичной послеоперационной блокады.
2. Рутинное применение мониторинга нейромышечной проводимости является эффективной мерой снижения риска легочных осложнений.
Способ оценки восстановления мышечной проводимости:
1. Ответ на TOF (train-of-four)-стимуляцию составляет не менее 90% от исходного.
2. Пациент может пожать руку.
3. Пациент может поднять голову и удерживать ее в течение 5 с.
Лечение нейромышечной дыхательной недостаточности, связанной с применением миорелаксантов:
2. Неостигмин 1,25—2,5 мг в/в (максимально до 0,07 мг/кг) или при использовании миорелаксанта рокурония бромида — суггамадекс (Брайдан) 2 мг/кг (максимально до 16 мг/кг). Неостигмин следует вводить только при появлении клинических признаков самостоятельного дыхания или ответа на TOF-стимуляцию не менее 25%. Рекомендовано предварительное (за 5—10 мин) введение атропина в дозе 7—15 мкг/кг.
3. Лечение суксаметониевого апноэ — ИВЛ до полного восстановления нейромышечной проводимости с седацией.
— Рекомендуются незамедлительная диагностика и лечение при подозрении на тромбоэмболию легочной артерии.
Уровень убедительности рекомендаций I (уровень достоверности доказательств А).
Быстрая и корректная диагностика ТЭЛА является краеугольным камнем ведения этой патологии, поскольку чем раньше установлен диагноз, тем более эффективным может быть лечение. Для определения риска Европейское общество кардиологов рекомендует ориентироваться на три группы маркеров — клинические маркеры, маркеры дисфункции ПЖ и маркеры повреждения миокарда.
Ни клинические признаки, ни стандартные методы обследования не дают возможности ни подтвердить, ни исключить диагноз ТЭЛА. К чувствительным и специфичным методам диагностики этой патологии относятся определение D-димера, эхокардиография (ЭхоКГ), компьютерная томография (КТ) с контрастированием, вентиляционно-перфузионная сцинтиграфия, ангиография, а также методы диагностики тромбоза глубоких вен нижних конечностей (ультрасонография, КТ-венография).
Вероятность ТЭЛА предварительно можно оценить по шкале:
— клинические симптомы тромбоза глубоких вен нижних конечностей — 3 балла;
— при проведении дифференциального диагноза ТЭЛА более вероятна, чем другие патологии, — 3 балла;
— тахикардия >100 уд/мин — 1,5 балла;
— иммобилизация или хирургическое вмешательство на протяжении последних 3 дней — 1,5 балла;
— тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе — 1,5 балла;
— кровохарканье — 1 балл;
— онкологическая патология в настоящее время или давностью до 6 мес — 1 балл.
Если сумма не превышает 2 баллов, вероятность ТЭЛА низкая; при сумме баллов 2—6 — умеренная; более 6 баллов — высокая.
Основными направлениями лечения ТЭЛА являются гемодинамическая и респираторная поддержка, реперфузия (тромболизис или хирургическое удаление эмболов из легочных артерий), антикоагулянтная терапия. При этом стратегия лечения существенно зависит от степени риска.
Лечение ТЭЛА у пациентов высокого риска
1. Немедленно должна быть начата антикоагулянтная терапия нефракционированным гепарином.
2. Для профилактики дальнейшего прогрессирования правожелудочковой недостаточности необходимо устранить системную гипотензию. С этой целью рекомендуются вазопрессоры. У пациентов с низким сердечным выбросом и нормальным АД могут быть использованы добутамин и допамин.
3. Не рекомендована агрессивная инфузионная терапия.
4. Пациентам с гипоксемией необходимо проведение оксигенотерапии.
5. У пациентов высокого риска с ТЭЛА, сопровождающейся шоком и/или артериальной гипотензией, показана тромболитическая терапия.
6. Если тромболизис абсолютно противопоказан или оказался неэффективным, альтернативным методом реперфузии является хирургическая эмболэктомия.
7. Если тромболизис абсолютно противопоказан или оказался неэффективным, в качестве альтернативного метода реперфузии может рассматриваться также чрескожная катетерная эмболэктомия или фрагментация тромба.
Инфекционные осложнения послеоперационного периода. Оксигенотерапия в послеоперационном периоде
Острая недостаточность мозгового кровообращения после операций. Послеоперационные тромбозы и эмболии
Острая недостаточность мозгового кровообращения после операций связана с рядом разнообразных причин: эмболией в мозг (воздушной, материальной), неадекватной перфузией, гипертензией в системе верхней полой вены, недостаточностью кровообращения и дыхания, геморрагическим диатезом, артериальной гипсртензнен. Следует заметить, что чаще всего эти осложнения возникают во время операции и продолжаются в послеоперационном периоде. Сведения о частоте этих осложнений весьма вариабельны. При операциях на сердце они наблюдаются у 1 % и более оперированных. Различия в частоте определяются главным образом различием в учете, а также неодинаковым контингентом оперированных больных. Наряду с оценкой неврологического статуса в диагностике недостаточности мозгового кровообращения используются люмбальная пункция, определение лактата. пирувата, артериовенозной разности по кислороду в притекающей и оттекающей от мозга крови, электроэнцефалография.
Используются дегидратационная терапия, ИВЛ в режиме умеренной гипервентиляции, глюкокортикоидные гормональные препараты, гипербарнческая окенгенация. Непременными условиями лечения неврологических осложнений являются гигиенический уход, лечебная физкультура, массаж, применение режима ранней двигательной активности, рациональное питание. При коматозном состоянии в сочетании с парентеральным питанием применяется питание через зонд. В особо тяжелых случаях проводятся пролонгированная гипотермия и гипербарическая окенгенация. Исход осложнений со стороны центральной нервной системы в значительной степени зависит от тяжести поражения и раннего начала лечения.
Среди послеоперационных тромбозов и эмболии, нуждающихся в интенсивной терапии, важнейшее место принадлежит тромбозам и эмболиям в системе легочной, коронарных и мозговых артерий. Частота этих осложнений в послеоперационном периоде в значительной степени зависит от контингента больных и характера оперативного вмешательства. Среди больных, поступивших в послеоперационное отделение интенсивной терапии Всесоюзного научного центра хирургии Министерства здравоохранения России, тромбозы и эмболнн имели место в 0,2% случаев после торакоабдомннальных и сосудистых операций. Наиболее угрожаемый контингент составляют больные атеросклерозом, приобретенными пороками сердца, злокачественными новообразованиями, заболеваниями артериальной и венозной систем. Другими предпосылками для тромбообразовання являются изменения в ответ на операцию в русле микроцнркуляиии и в свертывающих свойствах крови. В первые часы и дни после операции тромбоз и эмболнн легочной и коронарных артерий протекают атипично.
Лечение антикоагулянтами в раннем послеоперационном периоде связано с риском кровотечения, однако вполне возможно при тщательном контроле за состоянием свертываемости, тщательном гемостазе и соответствующем контроле за областью операции. Проблема тромбозов и эмболии подробно освещается в специальном разделе нашего сайта.
Исключительно важное значение в практике интенсивной терапии и реанимации имеет проблема парентерального питания, когда больные по различным причинам длительное время не о состоянии принимать пищу сами и обычным путем не могут бить обеспечены адекватным питанием. Характерной особенностью неосложненного (и тем более осложненного) послеоперационного периода является заметное усиление процессов катаболизма, что приводит к накоплению в организме недоокисленных продуктов обмена веществ и значительным сдвигам гомеостаза. У таких больных имеет место усиленный гликогенолиз с быстрым истощением запасов гликогена и прогрессирующим распадом тканевых белков. В условиях нарастающего энергетического дефицита за счет дезаминирования аминокислот существенно нарастают потери организмом азота. При прогрессирующем катаболизме отмечаются также повышенная потеря клетками кальция, калия и задержка в них натрия, существенно снижается потребление тканями кислорода.
Из парентеральных путей питания наиболее универсальным является внутривенный. Он дает возможность максимально обеспечить больного необходимым количеством питательных веществ при минимальном введении жидкости. Парентеральное питание преследует две основные цели: обеспечение организма и сохранение запаса источников энергии путем постоянного введения легкоусвояемых моиосахаров и обеспечение адекватных условий поддержания пластических процессов. Последнее достигается введением в организм сбалансированных растворов аминокислот, которые, включаясь в общий обмен веществ, становятся источником синтеза необходимых белков. Эффективное парентеральное белковое питание может быть осуществлено только введением в организм заранее растепленных белков или растворов, составленных из смеси незаменимых кристаллических аминокислот в соответствующих пропорциях. Наиболее доступным источником энергии для клинической практики является глюкоза.
Средняя энергетическая потребность тяжелобольного составляет 50—60 ккал/кг в сутки. Наиболее оптимальной концентрацией глюкозы для парентерального применения следует считать 25 или 30% раствор. Для обеспечения адекватного метаболизма вводимой в организм глюкозы требуется на каждые 5 г раствора добавлять 1 ЕД инсулина. Включение жировых эмульсий (интралипид, липофундин) в смесь для парентерального питания значительно облегчает проблему калорийного обеспечения н позволяет существенно уменьшить количество вводимых больному углеводов н жидкости.
Помимо веществ — источников энергетических н пластических процессов, смесь для парентерального питания должна содержать калий, натрий и хлор. Натрий и хлор необходимы для поддержания равновесия жидкости в организме, а также для регуляции осмотического и кислотно-щелочного состояния. Калий играет важную роль в метаболизме углеводов в тканях, способствуя лучшему их усвоению. В целях повышения анаболической эффективности парентерального питания в последнее время широко используют анаболические гормоны (ретаболил), а также инсулин. Последний, помимо участия в углеводном обмене, способствует включению аминокислот в белки, повышает проникновение калия и уменьшает содержание натрия во внутриклеточном пространстве.
Исключительно важным является скорость поступления питательной смеси в кровь. Чрезмерно быстрое введение приводит к высокой концентрации моносахаридов и аминокислот в крови, а это значительно снижает их усвоение организмом в связи с повышенным выделением этих питательных элементов почками. Кроме того, быстрое поступление в кровеносное русло аминокислот может сопровождаться побочными проявлениями (тошнота, чувство жара, гиперемия кожных покровов и др.).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Дыхательную недостаточность в послеоперационном периоде. Профилактика дыхательной недостаточности
Клиника дыхательной недостаточности характеризуется четко очерченными симптомами: одышкой, акроцнанозом кожи и слизистых оболочек, снижением парциального напряжения кислорода в артериальной крови, увеличением парциального напряжения углекислоты. Снижение сердечного выброса, увеличение артсриовспозпой разности по кислороду, повышение содержания лактата крови свидетельствуют о присоединившейся вторичной сердечной недостаточности. При этом, как правило, имеет место компенсаторное учащение сердцебиения — тахикардия.
В условиях гипоксии ее применение является рискованным. Эндотрахеальпая интубация и искусственная вентиляция легких после хирургических вмешательств широко используются главным образом в первые дни послеоперационного периода.
Пожилым больным, подвергнутым большим хирургическим вмешательствам, и больным, имеющим низкие резервы дыхания в связи с хроническими заболеваниями легких, у которых по окончании операции имеют место недостаточность кровообращения или дыхания, показано продолжение управляемой искусственной вентиляции легких в первые часы, сутки, а в случае необходимости и в последующие дни после операции.
Если дыхательная недостаточность развивается в послеоперационном периоде, при решении вопроса об эндотрахеалыюй интубации и управляемой ИВЛ учитывается сумма показателей: тяжесть состояния и выраженность дыхательной недостаточности, причина, вызвавшая дыхательную недостаточность, реальные возможности преодоления ее другими методами, наличие сопутствующей недостаточности кровообращения, состояние газового состава крови. Показанием к ИВЛ является падение парциального давления кислорода в артериальной крови до 8 кПа и ниже или повышение давления углекислоты более 6—7,3 кПа. В ближайшем послеоперационном периоде редко отмечается гиперкапния; чаше имеет место снижение уровня артериального рО2.
В зависимости от места вскрытия трахеи различают верхнюю, среднюю, нижнюю трахсостомию. У детей чаще производится нижняя трахеостомия в связи с более сложным обнажением верхних трахсальных хрящей и наличием достаточно большого расстояния между перешейком щитовидной железы и яремной вырезкой грудины. У взрослых может быть сделана либо верхняя, либо нижняя трахсостомия. При наложении трахеостомы больной лежит на спине с запрокинутой головой и валиком под лопатками. Кожу вскрывают поперечно, реже продольно, соответственно уровню второго — третьего трахсального хряща.
Строго по средней линии вскрывают поверхностную фасцию, сосуды перевязывают или коагулируют. Перешеек щитовидной железы оттягивают тупым крючком в краниальном или в дистальном направлении с таким расчетом, чтобы обнажились второй и третий или третий и четвертый трахеальные хрящи. Стенку трахеи захватывают двумя острыми крючками и рассекают между ними скальпелем в вертикальном направлении. Края разреза трахеи растягивают. Ннтубационную трубку извлекают. Отсасывают мокроту из просвета трахеи и бронхов. Через отверстие в трахее вводят трахсостомнчсскую канюлю и фиксируют ее тесьмой на шее.
В комплексе мер по ликвидации дыхательной недостаточности, если нет опасности развития пневмоторакса, возможно использование гипербарической оксигенации. У больных с легочной недостаточностью, по-видимому, перспективным является метод вспомогательного дыхания с помощью экстракорпорального кровообращения и искусственного легкого. Возможность заместить функцию легких с помощью мембранного оксигенатора создает перспективы для лечения массивных пневмоний, отека легких и других острых состояний, сопровождающихся развитием легочной недостаточности.
Важной проблемой послеоперационного периода является коррекция изменений водно-электролитного баланса. Общеизвестно, что сама по себе операционная травма ведет к задержке жидкости и натрия в организме и усиленному выведению калия. Кроме того, развитию послеоперационной гипокалнемии (главным образом у больных желудочно-кишечными заболеваниями и заболеваниями сердца) способствует предоперационная потеря электролитов вследствие применения сердечных гликозидов н диуретиков. Нарушение электролитного обмена является одной из причин появления расстройств сердечного ритма, повышенной чувствительности к сердечным гликозидам (с развитием дигиталисной интоксикации), пареза желудка и кишечника, дыхательной, сердечной и вторичной почечной недостаточности, послеоперационного метаболического алкалоза.
Наиболее часто аритмии возникают как проявление сердечной недостаточности, гипоксии. Экстрасистолия, бради- и тахнаритмия — наиболее частые нарушения ритма сердца, нередко предшествующие развитию фибрилляции желудочков. Следует отметить, что расстройства ритма чаще всего возникают в течение первых 5 дней после операции, главным образом после хирургических вмешательств на сердце. Коррекция электролитного обмена, введение антиаритмических препаратов способствуют ликвидации нарушений ритма сердца. При пароксизмальной тахикардии, пароксизмальной фор. ме мерцания и трепетания предсердий шнрокое распространение нашла электрическая дефибрилляция сердца.
Опасность развития инфекционных осложнений у больных, находящихся в критическом состоянии, дает основание для создания в отделениях интенсивной терапии определенного гигиенического режима. При этом необходимо учитывать, что путями проникновения инфекции чаще всего являются полиэтиленовые катетеры, трахеостомические трубки, катетеры, а источниками инфекции — воздух, кожа, персонал, приборы, вентиляторы, белье. Для защиты больных от перекрестной инфекции целесообразно создание боксированных одноместных палат, куда направляются больные из числа находившихся в отделении интенсивной терапии, у которых возникло инфекционное осложнение, или заведомо инфицированные пациенты, нуждающиеся в интенсивном лечении. Хоти и отделении интенсивной терапии могут встречаться вес виды бактерий, однако вес чаще отмечаются грамотрицательные формы. Все шире обсуждается вопрос о том, что в этом определенную роль играет не всегда оправданное профилактическое применение антибиотиков.
Кондиционирование воздуха, использование бактериальных фильтров для вентиляторов, создание подпора воздуха в палатах интенсивной терапии—важные гигиенические требования. В отделениях реанимации нельзя допускать чрезмерного скопления больных, пребывания больных, не нуждающихся в мероприятиях по интенсивному лечению и уходу. Не следует стремиться заполнить весь конечный фонд отделения интенсивной терапии н не только из-за необходимости создания оптимальных гигиенических условий его работы, но и для обеспечения возможности беспрепятственного поступления ургентных больных. Администрация лечебного учреждения должна заботиться об обеспечении беспрепятственного перевода больных из отделения интенсивной терапии, не нуждающихся в дальнейшем пребывании в нем. Необходимо резко ограничить посещение отделении персоналом других подразделений больничного учреждения.
Оксигенотерапия является одним из методов специфической патогенетической терапии гипоксии, находит широкое распространение в практике современного здравоохранения. Однако возможности оксигенотерапии, проводимой при обычном атмосферном давлении, относительно невелики. Даже при здоровых легких и нормально функционирующей сердечно-сосудистой системе нормобарическая оксигенация (рО2 вдыхаемого кислорода до 1 атм) далеко не всегда ликвидирует гипоксию, так как кислородная емкость переносчика кислорода — гемоглобина ограничена, а растворимость кислорода в плазме при этом возрастает ненамного. Лишь применение значительных парциальных давлений кислорода, что возможно только при дыхании им под давлением, превышающим 1 атм, т. е. при гипербарической оксигенации (ГБО). Регулируя давление кислорода во вдыхаемой газовой смеси, можно дозированно увеличить его концентрацию и во внутренних средах организма.

История ГБО практически начинается со второй половины XX века, хотя экспериментальное и клиническое изучение терапевтического эффекта сжатого воздуха широко проводилось уже в XIX веке, а первая лечебная барокамера была построена в Англии еще в 1662 г.
В основе дыхания, как известно, лежит газообмен между окружающей газовой средой (вдыхаемой газовой смесью) и тканями тела. В результате вдыхания клетки организма получают кислород и из них удаляется конечный продукт окисления — СО2. Однако прежде чем молекулы кислорода проникнут в митохондрии клеток, они должны проделать в организме человека длинный и сложный путь. Схематично его можно представить состоящим из отдельных этапов. При этом PO2 каждого последующего этапа меньше предыдущего, т. е. здесь мы имеем дело с каскадом постепенно и непрерывно снижающихся уровней нормальных давлений кислорода. Именно эта разность давлений определяет степень диффузионного напора кислорода, обусловливая тем самым направленность и скорость диффузии газа в различных физических средах организма.
В условиях ГБО также отмечается неуклонное падение РО2, но кислородный каскад при ГБО имеет характерные черты.
Давление воздуха в альвеолах равно окружающему (атмосферному) и в соответствии с законом Дальтона представляет собой сумму парциальных давлений отдельных газов (кислорода, азота, углекислоты, паров воды). При повышении давления внешней среды парциальное давление кислорода, азота и других газов в легких увеличивается пропорционально их нарастанию во вдыхаемом воздухе.
Дыхание чистым кислородом приводит к вымыванию азота из альвеол, и альвеолярное р02 при этом зависит не только от величины рО2 во вдыхаемой смеси, но и от уровня PСО2 и РH2O в альвеолах (это более или менее стабильные величины, практически не изменяющиеся при перемене окружающего давления и не зависящие от того, дышит ли человек кислородом, воздухом или иной газовой смесью). Увеличение давления вдыхаемого кислорода до 1, 2, 3, 4 ата (ата — атмосфера абсолютная, представляющая собой сумму атмосферного и избыточного давления) обусловливает подъем альвеолярного рО2 до 90, 191, 292, 393 кПа. (при дыхании воздухом под атмосферным давлением р02 альвеолярного равно примерно 13,3 кПа. Повышение рО2 в легких в свою очередь ведет к нарастанию напряжения кислорода в артериальной крови: до 146,6—186,6 кПа при 2 ата и до 226,6— 253,3 кПа при 3 ата (исходное артериальное рО2 12,0—12,5 кПа). При обычных условиях дыхания оксигенацня гемоглобина достигает 96—97%. Для полного насыщения гемоглобина у здоровых людей, но расчетам Дугласа и соавт. (1949), достаточно повысить парциальное давление кислорода в альвеолах в среднем до 28,4 кПа, что соответствует 35% кислорода во вдыхаемом воздухе.
Содержание кислорода в клетках можно повысить не только при усилении его доставки, но и в результате снижения уровня потребности кислорода тканями. Это достигается при помощи лекарственных препаратов (например, наркотиков) и гипотермии, которая наряду с уменьшением утилизации кислорода клеткой увеличивает также его растворимость в жидких средах организма. Уменьшая метаболизм клетки, наркотики и гипотермия вместе с тем обусловливают и значительное удлинение расстояния эффективной диффузии кислорода в тканях. Однако нужно помнить, что применение гипотермии и наркотиков, если они не вызывают соответствующего снижения интенсивности окислительных процессов в клетке, может привести в условиях ГБО к развитию кислородной интоксикации.
Срединная стернотомия - один из распространенных доступов к сердцу, широко применяемый в кардиохирургии, при котором возможно развитие целого ряда осложнений, наиболее неблагоприятным из них является стернальная инфекция.
По данным Л.А. Бокерия и Р.Г. Гудкова [1], в России выполняется более 46 тыс. операций на открытом сердце в год. Послеоперационная стернальная инфекция и нестабильность грудины - это ведущие причины увеличения заболеваемости, летальности, социально-экономических издержек и дискомфорта пациентов после кардиохирургических вмешательств с выполнением срединной стернотомии [45]. Как известно, стернальная инфекция встречается в 0,5-4% наблюдений, а летальность при развившемся послеоперационном гнойном медиастините достигает 32% [9, 27, 33, 34, 47].
Согласно рекомендациям Центра по контролю и профилактике заболеваний США, выделяют следующие виды стернальной инфекции: поверхностная стернальная раневая инфекция и глубокая стернальная раневая инфекция, или медиастинит. Поверхностная стернальная раневая инфекция характеризуется вовлечением в инфекционный процесс кожи и/или подкожной жировой клетчатки в месте разреза, в то время как при глубокой стернальной раневой инфекции отмечается поражение ткани или пространства под подкожной жировой клетчаткой и наличие у пациента хотя бы одного из следующих критериев:
1) выделение возбудителей из посевов медиастинальных тканей и жидкости;
2) интраоперационные доказательства медиастинита;
3) послеоперационная боль в грудине, нестабильность или лихорадка (>38 °C).
При наличии гнойных выделений из средостения или при выделении возбудителей из посевов крови или дренажных потерь средостения у больных также диагностируют глубокую стернальную инфекцию [28].
Этиология возбудителей стернальной инфекции
В большинстве наблюдений возбудителями стернальной инфекции являются грамположительные бактерии, в частности Coagulase negative staphylococci (CONS) и Staphylococcus aureus (SA) [33, 43].
CONS обнаруживают в 43-64% всех наблюдений послеоперационного медиастинита. CONS-медиастинит чаще всего возникает у пациентов с ожирением, хронической обструктивной болезнью легких, послеоперационной нестабильностью грудины и в большинстве наблюдений после остеосинтеза грудины с помощью проволоки [21]. Эти микроорганизмы синтезируют большое количество внеклеточного полисахарида, образуя защитную капсулу вокруг колонии, что существенно снижает эффект антибактериальной терапии и затрудняет санацию очага инфекции. При этом течение медиастинита, как правило, латентное: лихорадка и повышение уровней маркеров воспаления, таких как С-реактивный белок, могут отсутствовать [46]. Следовательно, единственно возможным вариантом лечения таких пациентов является удаление инфицированного инородного тела.
SA-медиастинит, по данным B. Gardlund и соавт. [21], составляет 26% послеоперационных медиастинитов. Авторами было обнаружено, что эта разновидность возбудителей медиастинита чаще встречается у пациентов после рестернотомий. При этом течение медиастинита, как правило, классическое: с высоким уровнем маркеров воспаления и лихорадкой [27].
Помимо грамположительной флоры, возбудителями стернальной инфекции могут выступать грибы и грамотрицательная флора, а именно Pseudomonas aeruginosa, Enterobacter spp., Кlebsiella pneumoniae [22]. Установлено, что грамотрицательный медиастинит чаще встречается у пациентов с несанированными очагами инфекции [21].
Факторы риска возникновения стернальной инфекции
В соответствии с «Российскими клиническими рекомендациями по хирургическому лечению больных послеоперационным медиастинитом и остеомиелитом грудины и ребер 2014 г.» выделяют предоперационные, интраоперационные и послеоперационные факторы риска возникновения стернальной инфекции.
К предоперационным факторам риска относят хронические нарушения обмена веществ (ожирение, сахарный диабет); обострения хронических заболеваний легких (хроническая обструктивная болезнь легких, астма); нарушения функций выделительной системы (хроническая почечная недостаточность); снижение иммунной реактивности организма; длительный прием лекарственных препаратов, снижающих свертываемость крови; прием стероидных гормонов, препаратов комплексного лечения гипертонической болезни [35].
Интраоперационными факторами риска считают значительную кровопотерю, продолжительность операции, длительность искусственного кровообращения (ИК), компрессию (ишемия) в зоне операционной раны. Риск развития воспалительного процесса выше при наличии гематом, являющихся инкубатором для бактерий.
Послеоперационные факторы риска - это нестабильность грудины, ишемия сосудов грудины, прорезывание швов грудины, рестернотомии, продолжительная ИВЛ, непрямой массаж сердца, низкий сердечный выброс, респираторный дистресс-синдром, иммунодепрессия, декомпенсация хронических заболеваний (рис. 1 и 2).

Рис. 1. Внешний вид раны больного стерномедиастинитом после операции коронарного шунтирования. Состояние после удаления металлических швов.
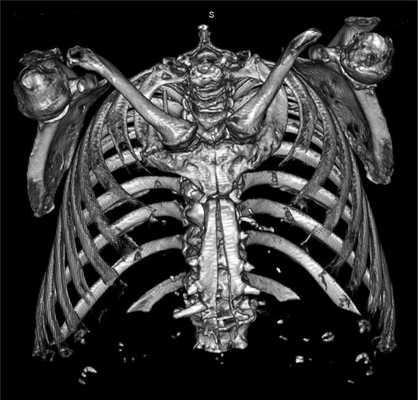
Рис. 2. Мультиспиральная компьютерная томограмма грудной клетки пациента с диастазом грудины после операции коронарного шунтирования.
Зарубежные авторы дополняют перечень факторов риска, приведенный в российских рекомендациях. В проспективном исследовании S. Rehman и соавт. [33], выявлено, что, помимо пожилого возраста, ожирения, сахарного диабета, к дооперационным факторам риска относятся экстренная операция и длительное дооперационное нахождение пациента в стационаре (р<0,05). C. Diez и соавт. [18] рассматривают ожирение как изменяемый предоперационный фактор риска развития медиастинита. Они обнаружили, что риск развития медиастинита увеличивается на 3% на каждый дополнительный килограмм массы тела на площадь поверхности тела. Снижение массы тела до операции позволяет снизить риск развития этого послеоперационного осложнения [33].
Повторные операции, в частности экстренные рестернотомии, связанные с кровотечением в послеоперационном периоде, признаны значимыми факторами риска развития медиастинита [26]. По данным R. Ghotaslou и соавт. [22], помимо приведенных факторов риска, возникновению стернальной инфекции в послеоперационном периоде способствует длительное нахождение больного в стационаре до операции.
Нестабильность грудины после операции в значительной степени провоцирует развитие медиастинита [7, 30, 39]. Это объясняется тем, что кожные и подкожные инфекции могут проникать в средостение ввиду отсутствия механического барьера между престернальными тканями и средостением в виде грудины вследствие ее нестабильности [21].
Было обнаружено, что периоперационными факторами риска развития медиастинита у кардиохирургических больных является выполнение коронарного шунтирования в сочетании с протезированием аортального клапана пожилым пациентам с повышенным индексом массы тела (р<0,05) [33].
В проведенном многофакторном анализе риска возникновения послеоперационного медиастинита C. Abboud и соавт. [5] установили, что наиболее значимыми факторами, связанными непосредственно с пациентом, являются продолжительность пребывания в отделении реанимации и интенсивной терапии; наличие несанированных очагов инфекции; ожирение; курение.
Кровотечение как фактор риска возникновения стернальной инфекции
Несмотря на большое количество факторов риска, особое внимание следует уделить периоперационным кровотечениям. Вынужденное переливание донорской крови увеличивает частоту возникновения острой почечной недостаточности, тромботических и тромбоэмболических осложнений, инсульта, инфаркта миокарда, синдрома острого посттрансфузионного повреждения легких [23], а нередко наблюдающаяся посттрансфузионная иммуномодуляция увеличивает вероятность развития нозокомиальной инфекции и сепсиса [40]. Кроме того, переливание компонентов донорской крови является независимым фактором риска увеличения заболеваемости, смертности и послеоперационных затрат лечебного учреждения [24]. Послеоперационное кровотечение достоверно увеличивает 30-дневную летальность [14] и значительно ухудшает течение послеоперационного периода у кардиохирургических пациентов [15, 32]. Говоря об экономической составляющей, следует отметить, что, по данным литературы, послеоперационное кровотечение увеличивает сроки госпитализации в среднем на 3 дня, а стоимость лечения в среднем на 20% [47].
Профилактика возникновения стернальной инфекции
Некоторые меры как в госпитальных, так и в амбулаторных условиях доказали свою эффективность в отношении профилактики и лечения инфекции в области хирургического вмешательства. К этим мерам относятся обработка кожи хлоргексидином за 24 ч до операции, жесткий контроль гликемического профиля, использование антисептиков при обработке кожного шва, назначение антибиотиков в случае гиперемии кожного шва, немедленная консультация хирурга при первых признаках инфекции в области хирургического вмешательства после выписки из стационара [8].
R. San Juan и соавт. [36] изучили послеоперационный медиастинит, вызванный St. aureus. Авторы публикуют данные о том, что для предотвращения медиастинита, вызываемого метициллинчувствительным золотистым стафилококком (MSSA), крайне важно проводить предоперационную санацию носа антибиотиком широкого спектра действия мупироцином. Возникновение медиастинита, вызываемого метициллинрезистентным золотистым стафилококком (MRSA), не связано с носовыми культурами, а полностью зависит от наличия госпитальной инфекции в послеоперационном периоде.
Миниинвазивная хирургия и коронарное шунтирование на работающем сердце являются важными факторами снижения частоты возникновения послеоперационного медиастинита ввиду уменьшения хирургической травмы и обеспечения более быстрого послеоперационного восстановления пациента [11].
Использование при срединной стернотомии препаратов местного действия, содержащих антибиотик, таких как гентамицин-коллаген, рекомендованный Центральным университетским госпиталем Хельсинки (Финляндия), также снижает частоту возникновения медиастинита [19].
В исследовании M. Arruda и соавт. [10] показана эффективность ванкомицинсодержащей пасты для профилактики послеоперационного медиастинита у кардиохирургических пациентов. По данным этого исследования, при нанесении на края грудины после срединной стернотомии пасты, содержащей 1 г ванкомицина и 1 мл физиологического раствора, медиастинит возник у 5 (0,49%) пациентов из 1020. При этом отмечено, что всем пациентам с медиастинитом выполняли коронарное шунтирование с использованием в качестве кондуита левой внутренней грудной артерии и у 4 пациентов в анамнезе был инсулинзависимый сахарный диабет.
B. Gardlund и соавт. [21] утверждали, что если грамотрицательный медиастинит является серьезной проблемой в учреждении, то строгое соблюдение санитарно-гигиенических процедур позволяет уменьшить распространение внутрибольничных инфекций, а в случае преобладания в больнице медиастинита, вызванного золотистым стафилококком, все меры должны быть направлены на выявление и ликвидацию источников бактерий в операционной и на строгий контроль своевременного назначения антибиотиков в профилактических целях.
Периоперационное назальное назначение антибиотика широкого спектра действия мупироцина позволяет предотвратить инфекцию, вызванную St. aureus, в 95-100% случаев и на 67% снизить частоту возникновения других осложнений [16].
Методы борьбы с локальным кровотечением и их роль в возникновении послеоперационного медиастинита
Широкое применение костного воска в кардиохирургии объясняется его высокой эффективностью в отношении остановки кровотечения из губчатого вещества грудины за счет образования практически непроницаемого гемостатического барьера [6]. Легкий способ применения костного воска, небольшая его стоимость и отсутствие необходимости в дополнительной гемостатической терапии [45], обусловили рекомендацию его использования после срединной стернотомии [17]. Однако интенсивное развитие кардиохирургии и исследование послеоперационных стернальных инфекций показали, что костный воск играет не последнюю роль в возникновении инфекционных осложнений после срединной стернотомии. J. Kirklin и B. Barratt-Boyes [25] не рекомендовали широкое применение костного воска, так как это может приводить к возникновению инфекции и плохому заживлению грудины.
В экспериментах разными авторами было показано, что костный воск замедляет регенерацию костной ткани, что препятствует заживлению грудины [20, 44] и повышает риск возникновения стернальной инфекции [31, 39]. По данным B. Sudmann и соавт. [41], остатки костного воска, обнаруженные через 10 лет с момента нанесения, послужили причиной хронического воспаления костной ткани грудины.
В связи с высоким риском послеоперационных осложнений при использовании костного воска в настоящее время в кардиохирургической практике широко применяются локальные гемостатические средства, которые обладают адгезивными свойствами, закрывают раневую поверхность, стимулируют коагуляцию и вызывают вазоконстрикцию. В качестве основы для их производства используют коллаген, желатин, альбумин, окисленную целлюлозу (ОЦ), полисахариды, неорганические вещества, хитозан, фибрин, полимеры и т. д. [12, 37].
При сравнительной оценке и выборе гемостатических препаратов рассматривают их безопасность, эффективность, удобство в использовании, стоимость, доступность и другие факторы [38]. Так, например, М. Chalupová [13] исследовал гемостатическую активность Gelitacel (гемостатический материал на основе ОЦ) по сравнению с «Gelaspon» (гемостатический материал на основе желатина) в эксперименте на крысах линии vistar. При выполнении резекции каудального полюса левой почки и аппликации исследуемых гемостатиков к раневой поверхности отмечено что время остановки кровотечения при использовании Gelitacel и Gelaspon составило 1,40±0,18 и 2,33±0,27 мин соответственно (р<0,01), это свидетельствует о выраженной гемостатической активности материалов на основе ОЦ.
I. Takács и соавт. [42] сравнили гемостатические свойства материалов на основе ОЦ (Surgicel) с материалами на основе бычьего коллагена (Sangustop) и лошадиного коллагена, покрытого фибрином и тромбином (TachoSil). Путем выполнения стандартной 5-сантиметровой резекции печени в эксперименте на свиньях было установлено время кровотечения при использовании Sangustop, составившее 140±88 с, TachoSil - 243±140 с (р=0,005) и Surgicel - 352±70 с (р<0,001), что говорит о выраженных гемостатических свойствах препаратов на основе коллагена по сравнению с препаратами на основе ОЦ.
На рынке медицинских изделий гемостатики на основе ОЦ представлены в различных формах - марля, порошок, вата и др. Наиболее известным и широко используемым в медицине материалом местного действия на основе ОЦ является гемостатическая марля Surgicel («Ethicon, Johnson & Johnson», США), которая находит применение практически во всех областях хирургии [4]. Также не менее популярными материалами на основе ОЦ являются гемостатический порошок Equicel (Equimedical, Netherlands), материал Oxycel (Becton Dickinson and Company), оксицелодекс (Россия), поликапран (Беларусь) и т. д.
Нами был разработан способ окисления целлюлозы и получен гемостатический материал в форме марли и порошка. Эффективность гемостатического действия полученного материала изучена на моделях крыс линии vistar. Было показано, что он по сравнению с марлей Surgicel проявляет более выраженную коагуляционную активность и снижает время кровотечения в 2 раза [3].
ОЦ может служить основой для создания гемостатиков полифункционального действия и систем с контролируемым выделением лекарственных веществ. Например, эффективный гемостатический препарат местного действия поликапран представляет собой ОЦ с включением ε-аминокапроновой кислоты как ингибитора фибринолиза [2]. Кроме того, ОЦ комбинируют с другими гемостатическими средствами для успешного достижения гемостаза при различных операциях [29].
Таким образом, в связи с постоянным увеличением количества кардиохирургических операций в Российской Федерации, как и в странах Европы и США, ежегодно проводимых на открытом сердце с использованием искусственного кровообращения, актуальность снижения осложнений, увеличивающих летальность, сроки госпитализации и стоимость лечения, очень велика.
В настоящее время известно множество полимерных материалов, применяющихся в качестве носителей лекарственных веществ, но наибольший интерес, с нашей точки зрения, представляет окисленная целлюлоза - признанный во всем мире гемостатик, который благодаря наличию карбоксильных групп может быть использован в качестве матрицы для иммобилизации антибиотиков путем химической связи.
Внедрение в клиническую практику новых гемостатических содержащих антибиотик средств, позволило бы не только сделать прорыв в области борьбы с осложнениями кардиохирургических вмешательств и существенно снизить риск возникновения кровотечений и стернальных инфекций, но и вытеснить с российского рынка медицинской продукции зарубежные гемостатические средства, тем самым активно способствуя развитию медицинских импортозамещающих технологий в РФ.
Читайте также:
- Комплексное исследование при сочетанной травме.
- Диагностика и лечение гипопроакцелеринемии
- Перспективы изучения ядра клетки
- Классификация микроорганизмов. Принципы классификации микроорганизмов. Систематика микроорганизмов. Естественная ( филогенетическая ) систематика микроорганизмов.
- Пенициллины и их свойства. Устойчивые к бета-лактамазам антистафилококковые пеницилины
