Комплексное исследование при сочетанной травме.
Добавил пользователь Владимир З. Обновлено: 20.01.2026
Решение проблемы лечения сочетанных черепно-лицевых повреждений возможно при адекватном взаимодействии и взаимопонимании специалистов различного профиля на всех этапах обследования и проведения комплексного лечения [1, 2, 4, 5].
Актуальность проблемы своевременной диагностики и квалифицированной помощи пострадавшим с черепно-лицевыми повреждениями определяется следующими факторами.
Во-первых, постоянным ростом пострадавших с сочетанной черепно-лицевой травмой [4, 5].
Во-вторых, ошибками сотрудников службы скорой медицинской помощи и поликлинического звена в диагностике на догоспитальном этапе.
Это приводит к госпитализации пострадавших с сочетанной черепно-лицевой травмой в непрофильные стационары [2, 4, 5].
В большинстве случаев наличие у пострадавшего повреждения органов и тканей челюстно-лицевой области маскирует неврологическую симптоматику, что не позволяет в полной мере оценить тяжесть состояния пострадавшего. С другой стороны, пострадавшим, поступившим в стационары в состоянии шока, мозговой комы, тяжелой гипоксии проводятся реанимационные мероприятия и лечение черепно-мозговой травмы в полном объеме, а диагностика повреждений костей лицевого черепа проводится в последующем или не проводится вообще 3.
При поступлении пострадавших и раненых в специализированный стационар по лечению тяжелых травм прежде всего, должна объективно определяться тяжесть состояния пациента, причины ее обусловливающие, жизнеобеспечивающие системы организма, в которых произошли жизнеугрожающие нарушения и степень их выраженности [5,7,9]. Для этих целей разработан диагностический алгоритм, составной частью его является шкала объективной оценки тяжести состояния пострадавших при поступлении в лечебные учреждения – ВПХ-СП. Реализация диагностического алгоритма завершается постановкой диагноза, который при сочетанных травмах и ранениях формулируется по областям тела. Затем каждое повреждение оценивается по шкале ВПХ-П (МТ) для механических травм, по шкале ВПХ-П (ОР) для огнестрельных ранений и по шкале ВПХ-П (Р) для неогнестрельных ранений. Полученные индексы каждого повреждения позволяет объективно оценить их тяжесть и выделить ведущее повреждение. В завершение индексы повреждений суммируются, и получается общий индекс тяжести повреждений – ВПХ-П.
Для мониторинга тяжести состояния пострадавших во втором периоде травматической болезни – периоде относительной стабилизации жизненно важных функций, в отделении интенсивной терапии, для определения показаний к выполнению отсроченных операций используется шкала ВПХ-СГ. Она позволяет осуществлять мониторинг состояния пострадавших в баллах на любой момент времени, и выделять три уровня состояния: компенсированное, субкомпенсированное и декомпенсированное, очерченные количественными границами.
Во втором и третьем (максимальной вероятности развития осложнений) периодах травматической болезни в организме тяжелопострадавших и раненых протекает целый ряд защитно-приспособительных и патологических процессов, нарушающих функционирование отдельных органов и систем. В результате развивается их полиорганная дисфункция, а затем и полиорганная несостоятельность (недостаточность), являющаяся морфологическим субстратом и функциональной основой для развития тяжелых инфекционных осложнений вплоть до сепсиса.
Своевременное выявление этих процессов и их коррекция – основной механизм управления течением травматической болезни. Методика оценки тяжести состояния ВПХ-СГ в процессе мониторинга констатирует недостаточность функционирования основных жизнеобеспечивающих систем организма, декомпенсацию и развитие осложнений. Дальнейший мониторинг состояния проводится с помощью объективной селективной поликритериальной методики оценки тяжести состояния пострадавших ВПХ-СС. Шкала позволяет диагностировать следующие синдромы: синдром системного воспалительного ответа (ССВО); синдром острого повреждения легких, синдром эндотоксикоза и полиорганной недостаточности [10].
Данная проблема приобретает особую актуальность в условиях многопрофильных больниц мегаполиса, при необходимости одновременного участия в лечении нескольких специалистов различного профиля у одного пострадавшего в тех случаях, когда повреждения требует неотложных специализированных мероприятий по каждому медицинскому профилю (устранение внутричерепных гематом, остановки продолжающегося кровотечения из носа, восстановления проходимости верхних дыхательных путей).
Цель исследования – предложение комплекса мероприятий направленных на совершенствование медицинской помощи пострадавшим с сочетанной черепно-лицевой травмой.
Материалы и методы. С 01.01.2005 по 01.01.2013 в отделение сочетанной черепно-лицевой травмы «Александровской больницы» - клиническую базу кафедры челюстно–лицевой хирургии и хирургической стоматологии СПбГУ - поступило 1650 пострадавших с сочетанными черепно-лицевыми повреждениями в сроки от 5 дней до нескольких месяцев после получения травмы. При этом преобладали лица молодого и трудоспособного возраста от 18 до 45 лет.
Причина задержки госпитализации у пострадавших: ошибки в диагностике и лечебной тактике врачей поликлинического звена и службы скорой медицинской помощи – 32%. Это приводит к госпитализации пострадавших с сочетанной черепно-лицевой травмой в непрофильные стационары. Вследствие неполной и несвоевременной диагностики у них повреждений костей лицевого черепа, около трети пострадавших направляют в отделение черепно-лицевой травмы в сроки от 1 недели до нескольких месяцев. Это значительно затрудняет лечение таких пострадавших, приводит к развитию воспалительных осложнений, неоправданно удлиняет сроки и ухудшает исходы лечения, в некоторых случаях ведет к инвалидизации пострадавшего [3-6, 9].
Основной задачей догоспитального этапа является рациональное использование «золотого часа», включающее не только доставку больного в профильный стационар и поддержание при этом жизненно важных функций организма, но и проведение максимального объема лечебных процедур. Анализ медицинской помощи на догоспитальном этапе показал, что пострадавшие были госпитализированы в лечебно-профилактические учреждения города, имеющие неодинаковый состав дежурных бригад, а также различную систему приема и оказания помощи пострадавшим. Однако лишь в двух стационарах Санкт-Петербурга созданы отделения сочетанной черепно-лицевой травмы, что существенно повышает качество и эффективность оказания помощи пострадавшим. Создание таких отделений в многопрофильных стационарах города повысило бы эффективность оказания помощи пострадавшим с сочетанной черепно-лицевой травмой и снизило бы риск развития осложнений и посттравматических деформаций.
Среди 1645 пострадавших, нуждавшихся в оперативном лечении по поводу сочетанной черепно-лицевой травмы у 732 (44,5%) человек была несвоевременно и нерадикально проведена первичная хирургическая обработка ран лица и рта с оставлением инородных тел, нежизнеспособных тканей, очагов хронической инфекции, неоправданное расширение показаний к наложению глухого шва раны. Этой группе пострадавших произведена вторичная хирургическая обработка, 167 (10,2%) пострадавшим потребовалось косметическое иссечение рубца спустя несколько месяцев после травмы. 578 (35,13%) больных были прооперированны, однако повреждения челюстно-лицевой области или не входили в план лечения или были выполнены не в полном объеме. У всех пострадавших потребовалось повторное вмешательство. Вследствие необходимости повторного оперативного вмешательства длительность периода нетрудоспособности возросла более чем в 2 раза. Несвоевременное и нерадикальное лечение ранений глазниц и глазного яблока привело к полной потере зрения на один глаз у 32 (2%) пострадавших, причем в первые сутки после травмы трое из них были осмотрены выездным челюстно-лицевым хирургом и была настоятельно рекомендована экстренная консультация офтальмолога и перевод в отделение сочетанной черепно-лицевой травмы. Двое пострадавших были переведены в сроки до семи суток, один переведен через четырнадцать суток. Хирургическое лечение по поводу проникающего ранения глазного яблока было проведено в поздние сроки, к сожалению, время было упущено, что привело к потере зрения. 628 (38,2%) пострадавших переведены в отделение сочетанной черепно-лицевой травмы в сроки до трех недель, при этом у 132 (21%) из них отмечалась назоликворрея, у 68 (10,9%) – пневмоцефалия, связанная с неоправданно агрессивной техникой выполнения декомпрессионной трепанации черепа и удаления большого объема костной ткани. С посттравматическими деформациями средней зоны лицевого черепа поступило 965 (58,8%) человек из них нарушение прикуса наблюдалось у 326 (33,8%), глазодвигательные нарушения и дистопия глазного яблока диагностирована у 658 (68,2%), нарушение носового дыхания у 526 (54,5%). В табл. 1 представлена структура осложнений у пострадавших, поступивших в стационар в поздние сроки.
Всем 1645 больным выполнено 2567 операции. При этом количество госпитализаций и соответственно этапных реконструктивных операций у 468 (28,5%) пациентов в среднем было от 2 до 4. В среднем суммарная величина койко?дня при лечении данной группы больных составила 92,013 дня.
Таблица 1. Частота эстетических и функциональных нарушений у пострадавших с черепно-лицевой травмой
На этапе устранения жизнеугрожающих последствий травмы и фиксации поврежденных структур, который соответствует I периоду травматической болезни (ТБ) – (острого нарушения жизненно важных функций) и длится от момента получения травмы до 12 часов, челюстно-лицевому хирургу необходимо решить следующие задачи:
- выполнение элементов первичной пластики мягких тканей;
- создание условий для проведения интенсивной терапии (подготовка к реабилитации пострадавшего);
- фиксация переломов (назубными шинами) либо с помощью малоинвазивного остеосинтеза [7,8].
На рис. 1, 2 представлен внешний вид и контрольная рентгенограмма пострадавшего после малоинвазивного остеосинтеза.
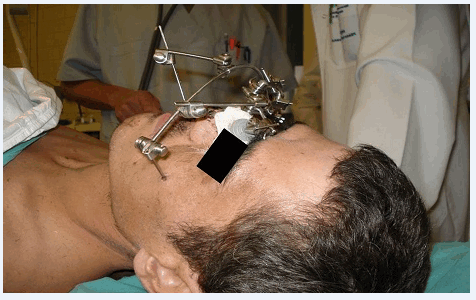
Рис. 1. Внешний вид пострадавшего И. после операции
Не менее опасным последствием травмы является продолжающееся кровотечение, источником, которого являются повреждения мягких тканей, органов и костных структур челюстно-лицевого отдела (ЧЛО). Остановка наружного кровотечения осуществляется перевязкой сосудов в ране, либо перевязкой ветвей наружной сонной артерии.
К тяжёлым повреждениям ЧЛО средней зоны лица относятся переломы верхней челюсти по верхнему (черепно-лицевые разъединения) и по среднему типу. При таких переломах основной задачей хирурга является фиксация лицевого скелета к мозговому минимально инвазивным способом. Репозиция и фиксация отломков осуществляется внеочаговыми методами. Хорошо зарекомендовал себя при данных повреждениях малоинвазивный внеочаговый остеосинтез по методике Д.Ю. Мадай [7, 8] (рис. 1).
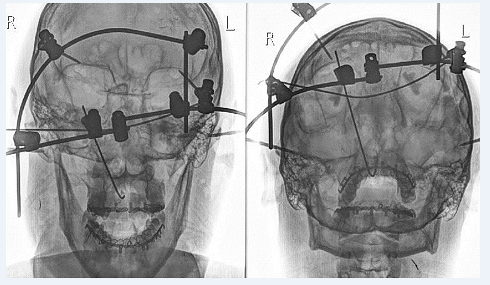
Рис. 2. Контрольная рентгенограмма пострадавшего И. после операции
Повреждения мягких покровных тканей ЧЛО требуют раннего восстановления. Наиболее сложными из них являются:
- обширные повреждения мягких тканей ЧЛО с истинным дефектом, проникающими в полость рта, носа или околоносовые пазухи;
- обширные сквозные ранения век, носа, ушных раковин и губ с их дефектом;
- отрывы частей и органов лица (носа, губ, ушных раковин и подбородка).
При данных повреждениях с целью раннего восстановления покровных тканей, необходимо применение элементов местной пластики. Наиболее простым и эффективным на наш взгляд является метод перемещенных треугольных лоскутов. Обязательному укрытию подлежат выступающие в рану поврежденные и неповрежденные кости. Обязательным мероприятием является инфильтрация краев раны раствором антибиотиков и дренирование. Данные лечебные мероприятия являются первым этапом запрограммированной многоэтапной хирургической тактики.
Заключение
1. Для рационального комплексного лечения пострадавших с повреждениями головного мозга, костей лицевого и мозгового черепа, зрительного анализатора и других систем организма необходимо госпитализировать только в специализированные отделения сочетанной черепно-лицевой травмы.
2. При поступлении нетранспортабельных больных с черепно-лицевой травмой в другие стационары города для их обследования и лечения целесообразно вызывать сотрудников дежурной бригады черепно-лицевых хирургов.
Список использованных источников:
1. Агаджанян В.В., Пронских А.А., Устьянцева И.М. и др. Политравма. – Новосибирск: Наука, 2003. – 492 с.
2. Багненко С.Ф., Ермолов А.С., Стожаров В.В. и др. Основные принципы диагностики и лечения тяжелой сочетанной травмы// Скорая мед. помощь. – 2008. – № 3. – С. 3-7.
3. Еолчиян С.А., Потапов A.A., Ван Дамм Ф.А. и др. Краниофациальная травма// Клиническое руководство по черепно-мозговой травме/ Под ред. А.Н. Коновалова и др. – М., 2002. – Т. 3. – С. 313-364.
4. Лимберг А.А., Данилевич М.О., Лежнев К.К. и др. Актуальные проблемы оптимизации специализированной медицинской помощи пострадавшим с сочетанной черепно-лицевой травмой// Сб. науч. трудов, посвящ. 70-летию НИИ СП им. И.И. Джанелидзе и 20-летию отдела сочетанной травмы. – СПб., 2002. – С. 153-171.
5. Мадай Д.Ю. Сочетанная черепно-лицевая травма. - В. Новгород, 2011. – 223 с.
6. Значение эндовидеохиругии в лечении хирургических инфекций/ Д.Ю.Мадай, К.П. Головко, В.В.Суворов и др.// Вестник хирургии им.И.И. Грекова – 2006. – Т. 165, №5 – 63-67.
7. Мадай Д.Ю. Способ внеочагового-стержневого остеосинтеза при переломах верхней челюсти по типу Ле-Фор II средний и комплект для его осуществления. – Пат. на изобретение № 2430698. – 2011.
8. Мадай Д.Ю. Способ внеочагового-стержневого остеосинтеза при переломах верхней челюсти по типу Ле-Фор и Герен. – Пат. на изобретение № 105151. – 2011.
9. Титова А.Т., Лимберг А.А. Сочетанная травма челюстно-лицевой области// Травмы челюстно-лицевой области; под ред. Н.М. Александрова, П.З. Аржанцева. - М.: Медицина, 1986. - С. 196-203.
10. Федоров И.В., Сигал Е.И., Одинцов В.В. Эндоскопическая хирургия. - М.: Медицина, 1998. - С. 109-126.
Подписано в печать: 18.10.2013
Комплексное исследование при сочетанной травме.
Магнитно-резонансная томография, ангиография, радиоизотопное исследование при сочетанной травме.
Наиболее информативным методом диагностики интраабдоминальных повреждений считается МРТ, однако ее применение ограничено сложностью, длительностью и дороювизной исследования, а также такими противопоказаниями, как нарушения сознания, нестабильная гемодинамика, неподготовленность кишечника и т.д. [Ермолов А.С. и др., 1999; Цыбуляк Г.Н. и др., 2001; Velmahos G.C. et al., 1996J. Исходя из этого, МРТ не относят, как правило, к экстренным диагностическим исследованиям и не применяют в остром периоде травмы, при клинической картине травматического шока, комы, дыхательной и сердечной недостаточности. Между тем данный метод высокоинформативен при выявлении в динамике внутриорганных повреждении и при диагностике посттравматических осложнений у пострадавших со стабильными показателями гемодинамики
Ангиография при сочетанной травме
При стабильной гемодинамике у пострадавших с диагностированными повреждениями паренхиматозных органов для решения вопроса о выборе тактики лечения выполняют ангиографию [Абакумов М.М., 1994; Болотников А.И., 1999; Цыбуляк Г.Н. и др., 2001; Ермолов А.С. и др., 2002; Sclafani S.L.A. et al., 1995; Nast-Kolb D. et al., 1998]. Как правило, речь идет о селективной артериографии с визуализацией паренхиматозной и венозной фаз гемодинамики [Белозеров Г.Е. и др., 1994; Шербатенко М.К. и др., 1997; Sclafani S.L.A. et al., I995|. Отсутствие экстравазата контрастного вещества при ангиографии является достоверным фактором прогнозировании успеха при проведении консервативного лечения [Sclafani S.L.A. et al., 1995]. Применение эндоваскулярного гемостаза путем эмболизации или баллонирования намного расширяет возможности хирургического лечения тяжелых повреждений паренхиматозных органов и магистральных сосудов [Абакумов М.М , 1994; Белозеров Г.Е. и др., 1994, 1999; Макаров В.И. и др., 1995; Болотников А.И., 1999; Цыбуляк Г.Н. и др., 2001; Sclafani S.L.A. et al., 1995].
Радиоизотопное исследование при сочетанной травме
В настоящее время сцинтиграфия используется для оценки функционального состояния паренхиматозных органон в различные сроки после травмы. Применение данного метода позволяет оценить восстановительные функции при благоприятном течении посттравматического периода или нарушение функции органа при формировании осложнений [Щербатенко М.К. и др.. 1997; Шарифуллин А.Ф. и др., 200!; Morse M А et аl., 1994].
Как видно из анализа применяемых диагностических методов, при повреждениях живота у пострадавших с сочетаннои травмой ни один из этих методов диагностики повреждений органов брюшной полости не является абсолютно точным либо имеет ограничения в связи с тяжестью состояния пострадавшего.
Ультразвуковая диагностика, являясь неннвазивной и высокоинформативной, у 10,5 % пострадавших с повреждениями живога при сочетанной травме, требующими оперативного лечения, не позволяет обнаружить признаки повреждения органов брюшной полости. Топическая диагностика повреждения возможна только у 38 % пострадавших. Кроме того, УЗИ практически не информативно в диагностике повреждений органов желудочно-кишечного тракта.
Использование видеолапароскопии дает возможность практически во всех случаях определить наличие гемоперитонеума, однако субъективизм исследователя в 16,5 % случаев приводит к завышению величины гемоперигонеума, что ведет к выполнению неоправданных лапаротомии. Кроме того, при лапароскопии невозможна диагностика внутриорганных повреждении паренхиматозных органов. Этот метод, являясь инвазивным, сопряжен с опасностью повреждения органов брюшной полости и возникновения гемодинамических нарушений (вплоть до смерти пострадавшего) при проведении исследования.
Лапароцентез позволяет выявить лишь косвенные признаки повреждения и требует тщательного соблюдения методики проведения.
КТ, являясь неинвазнвным и высокоинформативным методом исследования, требует для своего выполнения транспортировки пострадавшего в рентгеновский кабинет, что опасно у пострадавших, находящихся в крайне тяжелом состоянии. В связи с этим особое значение при сочетанной травме приобретает алгоритм диагностики повреждений живота.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечебно-диагностический алгоритм при сочетанной травме.
Задачей врача скорой помощи на месте происшествия, с нашей точки зрения, яваяется констатация самого факта сочетанной травмы, что служит абсолютным показанием к немедленной транспортировке пострадавшего в многопрофильный стационар. До настоящего времени остаются актуальными положения, высказанные еще в 1938 г. Мартином Киршнером в публикации «Первое оказание помощи при дорожно-транспортном происшествии» |по: Shumacher Н. et а]., 1997]. М. Киршнер считал, что при этом требуются немедленные действия, исходя из жизненных показаний, без учета отдельных деталей и характера местных повреждений, причем длительные исследования должны быть исключены. Действительно, уточнение на месте происшествия всех повреждении приводит, как правило, к потере времени и неблагоприятным последствиям. В то же время необходимо не только быстро принять меры по восстановлению проходимости дыхательных путей, ликвидации напряженного пневмоторакса и обеспечению временного гемостаза при открытых переломах конечностей, но и контролировать эффективность этих реанимационных мероприятий. Особое внимание и специфические меры транспортной иммобилизации необходимы при переломах позвоночника, особенно шейного отдела.
Клинический опыт, накопленный нами на протяжении 30 лет в НИИ скорой помощи им Н.В. Склифосовского, свидетельствует, что на этапе стационарной помощи правильный диагностический алгоритм намного облегчает принятие адекватных решений, способствует уменьшению летальности и числа осложнений.
Как и на догоспитальном этапе, независимо от вида сочетанных повреждений при поступлении пострадавшего в тяжелом состоянии в первую очередь необходимо обеспечить сохранение жизненных функций организма (эндотрахеальная интубация или трахеостомия ИВЛ, инфузионно-трансфузионная терапия для возмещении ОЦК). Одновременно с этими мероприятиями осуществляется диагностика повреждении груди, живота, черепа, таза и конечностей.
Вероятность повреждения органов брюшной полости у пострадавших с сочетанной травмой возрастает при травме груди, переломах костей таза, гипотонии на месте происшествия и при поступлении в стационар.
Американские авторы большое значение, кроме того придают наличию метаболического ацидоза.

Наиболее трудной проблемой является определение основной причины нестабильной гемодинамики. Опыт последнего десятилетия показал, что у значительной части пострадавших с повреждением паренхиматозных органов брюшной полости (в частности, печени), которых мы успешно лечили консервативным путем, в брюшной полости имелось небольшое (до 500 мл) количество крови с соответствующей клинико-инструментальной симптоматикой, но без каких-либо гемодинамических нарушений. В то же время множественные переломы костей конечностей, таза приводят к значительной внебрюшной крово-потере. На этом фоне дополнительная кровопотеря до 500 мл при травме печени может проявляться достаточно выраженной гипотонией. Понятно, что лапаротомия в такой ситуации только усугубит тяжесть состояния пострадавшего и сделает прогноз более неблагоприятным.
Весьма затрудняет правильную интерпретацию данных физикального обследования неврологический дефицит. Это объясняется тем, что у 25 % пострадавших с сочетанными повреждениями имеется закрытая черепно-мозговая травма, а у 2 % — травма позвоночника. При таких повреждениях клинический осмотр мало что дает для правильного выбора лечебной тактики. В частности, при повреждениях шейного отдела позвоночника часто наблюдается гипотония вследствие поражения симпатической нервной системы [Fabian Т.С. et al., 1994]. У пациентов, находящихся в состоянии алкогольного опьянения или наркотического воздействия, проведение физикального обследования еще более затруднено.
Клинический опыт показывает, что источники массивного внутреннего кровотечения следует прежде всего искать в плевральных полостях, брюшной полости, полости таза, в области бедер.
После исключения переломов бедренных костей и кровотечения в плевральную полость (что достаточно легко осуществить с помощью рентгенографии) наиболее вероятными источниками кровотечения являются брюшная полость и таз.
При тяжелых сочетанных повреждениях от скорости проведения и информативности дополнительных методов исследования напрямую зависят быстрота, объем и характер экстренной помощи, а в конечном итоге — исход травмы. Временные, организационные и технические возможности использования лечебно-диагностических алгоритмов при этом весьма ограничены [Сельцовскии А.П. и др., 1994; Ермолов А.С. и др., 1999; Фатхутдинов И.М., 2000; Ertel W. et al., 1997; Sarihan H. et al.! 1998; Jacobs D.G. et al., 2000]. Необходимо учитывать и тот факт, что при поступлении пострадавшего с сочетанной травмой в реанимационное отделение учебные и диагностические процедуры проводят одновременно. При этом надо быстро определить, какие диагностические мероприятия должны быть выполнены до начала неотложного оперативного вмешательства — лапаротомии, краниотомии, остеосинтеза и др., а какие могут быть отложены до его завершения [Ерюхин И.А. и др. 1997; Ertel W. et al., 1997J.
Нетранспортабельность, нестабильная гемодинамика, нарушения дыхания, психомоторное возбуждение, проведение реанимационных мероприятий исключают возможность использования высокоэффективных, но стационарных диагностических установок. Крайне опасным является чрезмерное увлечение разнообразными диагностическими методами, особенно связанными с транспортировкой в подсобные диагностические кабинеты. Кроме того, выбор диагностических методов зависит от оснащенности лечебного учреждения.
В абсолютном большинстве работ для диагностики абдоминальных повреждений предлагается комплексное использование инструментальных методов исследования, дополняющих друг друга [Гринев М.В., 1997; Луцевич Э.В. и др., 1997; Ермолов А.С. и др., 1999; Молитвословов А.Б. и др., 2002; Агаджанян В.В. и др., 2003; Newman et al., 1999; Jacobs D.G. et al., 2000J, однако последовательность их использования не оговаривается.
В ряде работ предлагается первоначально использовать лапароцентез [Боярпнцев В.В. и др., 1999; Prall J.A. et al., 1994] пли лапароскопию [Ларичев А.Б. и др., 1994; Чумаков А.А. и др., 1994; Добродеев С.А. и др., 1997; Брискин Б.С. и др., 1997, 1999; Баулин НА. и др., 1999; Грибков Ю.И. и др., 1999; Smith R.S. et al., 1995] как основные методы инструментальной диагностики абдоминальных повреждений в первые часы после поступления пострадавшего.
В комплексе диагностических мероприятий большинство отечественных и зарубежных авторов ведущее значение отводят неинвазивным методам исследования. В настоящее время основным (скрининговым) методом диагностики абдоминальных повреждений является ультразвуковое исследование, проводимое сразу при поступлении пострадавшего в стационар.
По мнению других хирургов, в случаях сомнительного заключения УЗИ или при обнаружении в брюшной полости незначительного (до 250 мл) количества крови целесообразнее использовать инвазивные методы исследования - лапароскопию, что позволяет сократить период диагностики органов брюшной полости до 3-15 мин В ряде случаев лапароскопию рекомендуют применять после лапароцентеза, давшего сомнительные результаты [Болотников А И 1999; Бояринцев В.В. и др., 1999; Совцов С.А., 1999]
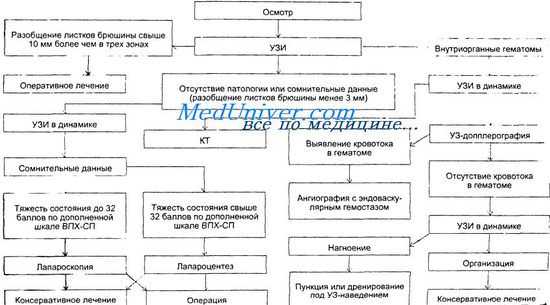
Лечебно-диагностический алгоритм у пострадавших с повреждением живота при сочетанной травме
По мнению ряда авторов, определяющим методом в диагностике травмы живота является КТ, при сомнительных результатах которой проводят леритонеальный лаваж [Kearney PA ct al., 1989; Fabian T.C. et al., 1995; Jacobs D.G. et al 2000-GarberB.G. etal., 2000].
Учитывая достоинства и недостатки каждого метода, нами была поставлена задача создания алгоритма комплексного применения инструментальных методов исследования, использование которого позволило бы в минимальные сроки с момента поступления диагностировать повреждения органов брюшной полости у пострадавших с сочетанной травмой и определить тактику лечения
Анализ лечебно-диагностической тактики у 208 пострадавших с повреждениями живота при сочетанной травме, составивших контрольную группу (группу сравнения), позволил нам установить наиболее рациональный лечебно-диагностический алгоритм и последовательность исследований, что было применено у 194 больных, составивших группу исследования.
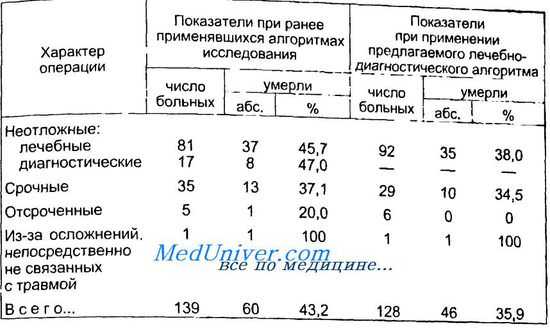
Распределение и исходы лечения пострадавших с повреждением живота при сочетанной травме
При отсутствии явных клинических признаков повреждения органов брюшной полости или при неясной клинической картине во всех случаях применяли инструментальные методы исследования. Учитывая высокую информативность и простоту УЗИ, мы начинали инструментальную диагностику повреждений органов брюшной полости с сонографии, которую проводили в первые 15—20 мин с момента поступления пострадавшего. При отсутствии ультразвуковых признаков повреждения органов брюшной полости или выявлении гемоперитонеума менее 400—500 мл УЗИ повторяли через 1—2 ч. За это время пострадавшему проводили реанимационные мероприятия, консультации врачей различных специальностей (травматолог, невролог, нейрохирург), получали результаты инструментальной диагностики сочетанных повреждений (рентгенологическое исследование черепа, грудной клетки, костей таза, конечностей, эхоэнцефалоскопия и т.д.). Выявление гемоперитонеума от 500 мл и более считали показанием к оперативному лечению. При сомнительных данных повторного УЗИ, когда невозможно достоверно судить о характере интраабдоминальных повреждений (подкожная эмфизема, мешающая осмотру брюшной полости, необъяснимая гипотония, парез кишечника), отказывались от повторных УЗИ и проводили лапароскопию (при тяжелом состоянии пострадавшего — до 32 баллов по дополненной шкале ВПХ-СП) или лапароцентез (при крайне тяжелом состоянии — свыше 32 баллов по дополненной шкале ВПХ-СП), что позволяло выявить недоступные для сонографии повреждения, избежать задержки с оперативным вмешательством или отказаться от него. При выявлении внутриорганных гематом (печени, селезенки) и отсутствии ге-моперитонеума проводили динамические УЗИ с допплеров-ским исследованием и (если позволяла тяжесть состояния пострадавшего) КТ. Нарастание размеров гематом, выявление в них при УЗ-допплерографин артериального кровотока или ар-териовенозного сброса считали показанием к операции.
Данная лечебно-диагностическая тактика использована у 194 пострадавших с повреждениями живота при сочетанной травме. Оперативные вмешательства по поводу повреждений органов брюшной полости произведены 127 больным (65,5 %). Время с момента поступления до операции у пострадавших с неотложными показаниями составило в среднем 3,2 ч, что на 4,9 ч меньше, чем в группе сравнения (8,1 ч). При этом удалось полностью избежать диагностических лапаротомий.
Распределение и исходы лечения пострадавших с повреждениями живота при сочетанной травме представлены в таблице.
Клиническая оценка методов аналгезии при внутрибольничной транспортировке пациентов с сочетанной травмой
Сочетанные травмы являются основными при массовых несчастных случаях и катастрофах. В Российской Федерации число травм среди всего населения превысило 13 млн. случаев.
Показатель травматизма ежегодно возрастает во всех возрастных группах и в среднем по стране составил у взрослых 89, у детей 99, а у подростков 113 на 1000 человек соответствующего населения (2012) [9]. В Республике Казахстан по данным журнала «О состоянии здоровья населения Республики Казахстан и деятельности организаций здравоохранения» – 2012 ежегодно около 600 тысяч человек получают различные повреждения, из них 22% составляют дети, 8% - подростки и 70% - взрослые. Тенденция роста травматизма сохраняется и составляет ежегодно 1,3%.
Проблема интенсивной терапии сочетанной травмы в последние десятилетия во многих странах заняла одно из ведущих мест. Она определяется гигантскими масштабами травматизма и тенденцией к постоянному его возрастанию. Механическая травма является одной из трёх основных причин смертности, причем у трудоспособного населения эта причина вышла на первое место [2,12].
Лечение сочетанных травм трудоемкое, сложное, ответственное и требует больших материальных затрат. Тяжесть повреждений, преимущественно опорно-двигательного аппарата и головного мозга, сложность лечения и реабилитации, ошибки и осложнения приводят к тому, что стойкая утрата трудоспособности при них достигает 15-20%. [2,8].
Таким образом, сочетанную травму можно сравнить с катастрофой и стихийным бедствием, остановить которое можно только комплексной интенсивной терапией. В этом плане актуальным является повышение эффективности лечебно-диагностических мероприятий, направленных на снижение летальности, уменьшению осложнений травматической болезни и улучшению качества жизни пострадавших с сочетанной травмой.
Боль неизбежный спутник сочетанной травмы. Доказано, что неадекватное обезболивание может явиться причиной развития множественных осложнений, в том числе кардиореспираторных и тромбоэмболических, нарушений функций желудочно-кишечного тракта и других органов и систем организма [11,13]. Для достижения адекватного обезболивания в настоящее время существует широкий выбор аналгетиков с различными механизмами действия.
Среди большого количества лекарственных средств, влияющих на проведение болевой импульсации, опиоиды по силе своего обезболивающего действия занимают ведущее место. Но введение опиоидных аналгетиков в дозе, необходимой для адекватного обезболивания, сопряжено с риском развития нежелательных явлений (выраженный снотворный эффект, парез желудочно-кишечного тракта, затрудненное мочеиспускание, угнетение дыхания) [6,10].
В противоположность, нейроаксиальная блокада позволяет обеспечить длительную управляемую анальгезию/анестезию, гемодинамическую и нейровегетативную стабильность при минимальных дозах опиоидных анальгетиков и локальных анестетиков [6,14].
При этом, антиноцицептивная защита центральными и региональными методами позволит обеспечить более быстрый выход пострадавшего из шокового состояния, осуществить транспортировку, в полном объеме комплекс диагностических мероприятий и, в целом, сократит пребывание пациента в стационаре [5]. При разработке лечебной тактики необходимо принять во внимание проблему внутрибольничной транспортировки пациентов с сочетанной травмой. Чтобы адекватно оценить риск при транспортировке, рассматривается сумма факторов, угрожающих больному во время транспортировки. Это состояние пациента перед транспортировкой, стресс при транспортировке, адекватность лечебных мероприятий до и во время транспортировки и спонтанное течение заболевания [1].
При транспортировке пациентов в критическом состоянии время перемещения имеет очень важное значение, поэтому необходимо отлаженное действие бригады. Транспортировка пациента с сочетанной травмой должна быть заранее спланированной и продуманной. Это позволяет обеспечить полный объем интенсивной терапии во время транспортировки, исключить возможные ошибки, и сделать транспортировку как можно более безопасной [1,3].
Решение о транспортировки пациента должно быть принято на основе изучения положительных факторов и потенциального риска от этой транспортировки [4,7].
Целью настоящего исследования являлось изучение влияния различных видов обезболивания на гемодинамику пострадавших с сочетанной травмой при внутригоспитальной транспортировке.
Материалы и методы. В основу работы были положены результаты проспективного исследования 78 пострадавших с тяжелыми травмами, экстренно госпитализированных в отделение интенсивной НИИ травматологии и ортопедии г. Астаны за период 2009-2010 г.
Транспортировку осуществляли в первые сутки внутригоспитальную из отделения анестизиологии, реанимации и интенсивной терапии (ОАРИТ) в диагностическое отделение и обратно. Общее время, затраченное на транспортировку, составило 1,2±0,3 часа. По принципу обезболивания пациенты были разделены на две группы: наркотические аналгетики вводили парентерально в I группе (n=36), во II группе проводили нейроаксиальную аналгезию/анестезию местным анестетиком с добавлением наркотических аналгетиков (n=42). Обезболивание проводили за 20-30 мин до транспортировки.
Возраст пациентов с сочетанной травмой колебался от 24 до 42 лет. Из них мужчин было в I группе – 27, во II группе – 30, женщин в I группе – 9, во II группе – 12 . Все пострадавшие были доставлены в течение первого часа после полученной травмы, с учетом правила «золотого часа». Все пациенты получили повреждения в результате дорожно-транспортного происшествия (ДТП) (столкновение автомашин, наезды на пешеходов).
В группу включили пациентов с повреждением опорно-двигательного аппарата и внутренних органов. Все обследованные имели повреждения 2-х и более областей тела. Частота повреждений областей тела у пострадавших обеих групп распределяли следующим образом: закрытая травма груди - 71,3% пациентов, закрытая травма живота - 37,3%, закрытая травма таза - 26,1%, закрытая травма конечностей - 67,8%.
Степень повреждения у пострадавших с сочетанной травмой оценивали по шкале ISS (Injury Severity Score). Количество баллов у пострадавших в I группе 33,2 ± 2,1 баллов, во II группе составило 34,7 ± 1,1 баллов (р>0,05), что соответствовало тяжелой степени повреждения [8].
По шкале APACHE (Acute Physiology and Chronic Health Evaluation) степень тяжести состояния пострадавших в I группе 15,5 ± 0,8 баллов, во II группе составило 15,8±0,7 баллов (р>0,05), что соответствовало тяжелой степени.
Из групп были исключены пациенты, у которых количество баллов по шкале Глазго было меньше 10 (затруднен словесный контакт с пострадавшим).
В I группе пациентам вводили внутримышечно тримеперидина гидрохлорид (промедол) 2% - 1,0 – 2,0 мл «золотой стандарт».
У пациентов II группы выполняли чрескожную катетеризацию эпидурального пространства при помощи одноразовых наборов фирмы «В.Braun» размером 18 G, снабженных антибактериальными фильтрами. Пункцию эпидурального пространства выполняли в положении пациента на боку в асептических условиях на уровнях Th10-11-L4. Локальный анестетик и опиоид использовали в следующих дозировках: бупивакаин 0,25% - 20,0 мл и морфина гидрохлорида 3-5 мг.
Изучение интенсивности болевого синдрома у пациентов с сочетанной травмой производили путем субъективной количественной и качественной оценки болевых ощущений в зоне повреждения в состоянии покоя, при кашле, а также переносе пациента с кровати на каталку на фоне проводимой аналгезии. Для стандартизации количественной оценки болевого синдрома использовали визуально-аналоговую шкалу (ВАШ). Оценку интенсивности боли по визуально-аналоговой шкале производили в динамике, начиная с момента поступления и далее на протяжении всей транспортировки.
Всем пациентам проводилась комплексная интенсивная терапия по принципам «damage control» (контроль повреждений – современная концепция лечения критических сочетанных травм) [8,15,16]. Интенсивная терапия проводилась с этапа подготовки пациента к транспортировке и продолжалась весь период транспортировки и проведения диагностических мероприятий. Во время транспортировки всем пациентам проводился неинвазивный мониторинг артериального давления (АД), среднего артериального давления (АДсред) частоты сердечных сокращений (ЧСС), частоты дыхания (ЧД), насыщения артериальной крови кислородом (Sp O2).
Группы обследованных были сопоставимы по полу, возрасту, характеру повреждений, величине кровопотери и продолжительности времени от момента травмы (1,2±0,3 часа).
Результаты и выводы. До транспортировки в диагностическое отделение пациентов с сочетанной травмой выраженность болевых ощущений по ВАШ составляла в состоянии покоя 5,05±1,2 баллов. При движении болевые ощущения усиливались до 7,1±0,5 баллов.
В первой группе на всем протяжении транспортировки болевые ощущения в покое составили 2,8±1,0 баллов, при движении 5,0±1,1 баллов. В состоянии покоя уровень боли снижался на 45% от исходного показателя (р<0,05). При движении на 30% от первоначальных данных.
Во второй группе болевые ощущения уменьшились в покое до 2,0±0,7 баллов (на 60,3%), при движении 3,95±0,2 баллов (на 45%).
Во второй группе в покое уровень болевых ощущений снижался на 28,5% в сравнении с первой группой. При движении на 22% относительно второй группы. Анализ полученных данных показал, что обезболивание во второй группе было более эффективное, чем в первой группе.
Сердечно-сосудистая недостаточность отмечалась во всех группах и являлась отражением тяжести шока. При поступлении у всех пациентов отмечалась тахикардия. Во время транспортировки после начала интенсивной терапии и обезболивания показатели ЧСС в I и II группах снизились относительно исходных данных на 15,7% (p>0,05) и на 20,1% (p>0,05), достоверной разницы между группами не выявлено.
До начала транспортировки у всех пострадавших отмечалась гипотония. Во второй группе после обезболивания наблюдалось снижение АДсред на 3,1% (р>0,05) относительно первоначальных данных. В I группе наблюдали повышение АДсред относительно исходных данных на 10,9% (р<0,05).
Таким образом, нейроаксиальная блокада при транспортировке обеспечивала эффективное блокирование ноцицептивной импульсации из поврежденных тканей, стабильность гемодинамики и мнение об опасности применения нейроаксиальных блокад в медицине критических состояний у пациентов с сочетанной травмой в качестве анестезии/аналгезии сильно преувеличено. Летальных исходов во время транспортировки не было.
1. Агаджанян В.В., Шаталин А.В., Кравцов С.А., Скопинцев Д.А. Организация медицинской транспортировки пострадавших с политравмой// Сб. матер. Всеросс. конгр. анестезиологов и реаниматологов и ХI съезда Федерации анестезиологов и реаниматологов/ Под ред. Ю.С. Полушина.- СПб., 2008.- С.178.
2. Агаджанян В.В. Политравма: перспективы исследования проблемы// Политравма, 2007, №3, С. 5-7.
3. Бочаров С.Н., Плахотина Е.Н. Проблема профилактики и лечения синдрома жировой эмболии// Сб. матер. Всеросс. конгр. анестезиологов и реаниматологов и ХI съезда Федерации анестезиологов и реаниматологов/ Под ред. Ю.С. Полушина.- СПб., 2008.- С.179.
4. Братищев И.В. Принципы транспортировки пациентов в критическом состоянии// Рос. мед. журн. — 2008. — № 3. — С. 6-10.
5. Вахидов А.В., Ходжиев А.Б., Косимов З.К. Оценка общей стрессорной реакции при эпидуральной и спинальной анестезии при сочетанной травме// Сб. матер. Всеросс. конгр. анестезиологов и реаниматологов и ХI съезда Федерации анестезиологов и реаниматологов/ Под ред. Ю.С. Полушина.- СПб., 2008.- с.181-182.
6. Жакупов Р.К. Обоснование эффективности и безопасности эпидуральной анестезии/аналгезии с позиций проницаемости твердой мозговой оболочки: Автореф. дис. д-ра мед. наук. - Алматы, 2004.- 42 с.
7. Карлова О.А., Кравцов С.А., Власов С.В., Шаталин А.В., Скопинцев Д.А. Межгоспитальная транспортировка больных с политравмой. Особенности респираторной поддержки// Сб. матер. Всеросс. конгр. анестезиологов и реаниматологов и ХI съезда Федерации анестезиологов и реаниматологов/ Под ред. Ю.С. Полушина.- СПб., 2008.- С.193-194.
8. Соколов В.А. Множественные и сочетанные травмы. – М., 2006. – 512 с.
9. Травматизм, ортопедическая заболеваемость и состояние травматолого-ортопедической помощи в Россиии/ Т.М. Андреева, М.М. Попова и соавт. – М., 2012
10. Фадеев Б.М., Зайцев А.В., Зайцева О.Б., Пигузов В.А. Эффективность применения современных методов регионарной анестезии в экстренной травматологии// Тез. докл. II съезда Ассоциации анестезиол.-реаниматол. ЦФО. - М., 2005. - С. 65-66.
11. Устьянцева И.М., Хохлова О.И., Петухова О.В. Метаболические проявления шока// Политравма, 2009, №4, С. 72-75.
12. Цыбуляк Г.Н. Лечение тяжелых и сочетанных повреждений. – СПб.: Гиппократ, 1995. – 432 с.
13. Шок: Теория, клиника, организация противошоковой помощи/ Под общ. ред. Г.С. Мазуркевича, С.Ф. Багненко. – СПб.: Политехника, 2004. – 539 с.: ил.
14. Ferrante F.M., VadeBoncouer T.R. Postoperative Pain. - M.: Медицина, 1998. - 640 c.
15. Rotondo M.F., Schwab C.W., Gonigal M.C. et al. «Damage control» on approach for improved survival in exsanguinafing penetrafing abdominal injuries// J Trauma. 1993; 35: 375-382.
16. Przkova R., Bosch U., Zelle et al. Damage control orthopedics: a case Report// J of Trauma 2002: 53, № 4, 765–769.
Подписано в печать: 30.06.2013
Читайте также:
- Рентгенограмма, КТ, МРТ при повреждении дельтовидной связки
- Гипертермический синдром. Причины гипертермического синдрома. Этиология гипертермического синдрома.
- Показания, подготовка к операции при разрыве сухожилия надколенника
- КТ, МРТ при доброкачественной гипертрофии жевательных мышц
- Дифференциальная диагностика папиллита. Гипертрофия анальных сосочков.
