Ингибиторы протеаз. Применение и побочные эфекты ингибиторов протеаз
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Применение и побочные эффекты зидовудина. Ненуклеозидные ингибиторы обратной транскриптазы
Зидовудин в сочетании с другими анти-ВИЧ-препаратами способен замедлить развитие заболевания и удлинить период выживания пациентов. Зидовудин был с успехом использован в лечении ассоциированной с ВИЧ деменции. При введении беременным, начиная со II триместра беременности, и их детям в первые 6 нед после родов зидовудин снижает риск передачи ВИЧ от матери ребенку с 25 до 8%.
NRTI как класс редко ассоциируется с печеночным стеатозом и лактоацидозом. Предполагается, что эти осложнения, а также другие побочные эффекты NRTI, такие как миопатия (зидовудин), нейропатия (ставудин, зальцитабин) и панкреатит (диданозин), возникают в результате ингибиции митохондриальных ДНК-полимераз и последующей дисфункции митохондрий.
Абакавир ассоциируется с реакцией гиперчувствительности по типу идиосинкразии. Наиболее часто эта реакция возникает в первые 6 нед терапии (> 85%) и сопровождается лихорадкой, сыпью, простудными явлениями, кашлем и другими расстройствами дыхательной системы, тошнотой, рвотой и другими симптомами со стороны ЖКТ Прием лекарства следует прекратить и не возобновлять, поскольку повторное возникновение этой реакции может вызвать летальный сердечнососудистый коллапс.
Ненуклеозидные ингибиторы обратной транскриптазы
Ненуклеозидные ингибиторы обратной транскриптазы получены в течение последних 10 лет. В настоящее время используют три препарата: невирапин, дела-вирдин и эфавиренц, принадлежащие к различным классам химических веществ.
МNNRTI ингибируют репликацию ВИЧ, связываясь в гидрофобном кармане обратной транскриптазы (RT), что вызывает конформационные изменения фермента и приводит к его инактивации.
Препараты класса NNRTI обладают следующими общими характеристиками:
• являются сильными ингибиторами ВИЧ-1, но не ВИЧ-2, других ретровирусов или клеточных ДНК-полимераз;
• для антивирусной активности не нуждаются в фосфорилировании;
• точковая мутация RT в аминокислотной позиции 103 обусловливает перекрестную резистентность ко всем другим NNRTI. NNRTI обладают превосходной оральной биодоступностью. Они эффективно связываются с белками и проникают в ЦНС пропорционально концентрации свободного вещества в плазме. NNRTI метаболизируются CYP и оказывают различные индуцирующие/ингибирующие эффекты на ферменты этой системы.
В комбинации с NRTI препараты класса NNRTI служат эффективными ингибиторами репликации ВИЧ. Их антивирусные эффекты сопоставимы с эффектами, наблюдаемыми при использовании комбинации NRTI с ингибиторами протеаз. NNRTI применяют для лечения пациентов, ранее не получавших антиретровирусные препараты, или в тех случаях, когда ингибиторы протеаз не дают нужного эффекта. Показано, что однократное введение невирапина беременным во время родов и их детям в ранние сроки после рождения снижает риск передачи ВИЧ от матери ребенку примерно на 40%.
Основным побочным эффектом препаратов этого класса является возникновение макулопапулезной сыпи — примерно у 20% пациентов при лечении невирапином, у 10-20% пациентов, получавших делавирдин, и у 5-10% пациентов, принимавших эфавиренц. Это обусловливает необходимость прекращения терапии у 7, 5 и 1% пациентов соответственно. Слабую до умеренной сыпь можно лечить симптоматически, используя антагонисты H1-рецепторов. Применение невирапина ассоциировано с тяжелым гепатитом. Эфавиренц обладает особыми нейротоксическими побочными эффектами, включая головокружение, нарушение концентрации, тревожное возбуждение и аномальные сновидения. Чаще всего эти симптомы появляются в первые дни терапии и обычно ослабевают или исчезают в течение 2-4 нед.
Недавно в лечебную практику был введен тенофовир диспроксил фумарат, представляющий собой нуклеозидный ингибитор обратной транскриптазы, иногда классифицируемый как нуклеотидный аналог, ингибирующий обратную транскриптазу. Его оральная биодоступность составляет 34%, а Т1/2 — 17 час. Лекарство можно вводить также в/в и использовать в комбинации с эмтрицитабином.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Клиническая фармакология: антиретровирусные препараты
Первые антиретровирусные препараты — нуклеозидные ингибиторы обратной транскриптазы — были лишь частично эффективны в отношении вируса иммунодефицита человека. Только с появлением следующего класса, ингибиторов протеазы, удалось достичь контроля над заболеванием и резко снизить смертность. Им, а также ингибиторам ещё одного жизненно важного для лечения ВИЧ фермента — интегразы, и посвящена наша следующая статья из цикла об антиретровирусных препаратах.
Ингибиторы протеазы: механизм действия
Внедрение в клиническую практику ингибиторов протеазы стало краеугольным камнем лечения ВИЧ. Их добавление в схему терапии к двум нуклеозидным ингибиторам обратной транскриптазы (НИОТ) позволило уменьшить количество пациентов с прогрессирующим течением заболевания (до развития СПИДа или смерти) в два раза. У 90 % пациентов, получавших комбинацию из трёх препаратов, число частиц РНК ВИЧ в крови снизилось с более чем 20 000 на миллилитр до менее чем 500 на миллилитр за 24 недели терапии [1].
Механизм действия ингибиторов протеазы основан на их способности блокировать один из ферментов, служащих важным элементом созревания вируса в жизненном цикле ВИЧ. Геном ВИЧ кодирует длинный полипептид. После удаления оболочки вируса и обратной транскрипции генома РНК образуется полипептид, содержащий все продукты вирусных генов, включая структурные белки и ферменты. Затем протеаза ВИЧ расщепляет его на составляющие вирусные белки. При подавлении активности протеазы этот процесс блокируется, что приводит к нарушению созревания вирусной мРНК, в результате чего образуются вирусные частицы, не способные заражать новые клетки [1].
Первыми ингибиторами протеазы стали пептидомиметические молекулы, схожие с пептидом-предшественником и конкурирующие с ним. Однако, как и большинство пептидомиметических белков, ранние ингибиторы протеазы имели существенный фармакокинетический недостаток: они плохо всасывались и быстро выводились при пероральном приёме. Проблема была решена заменой участка пиридина в структуре ингибиторов протеазы на тиазол, менее богатый электронами. Благодаря этому удалось повысить метаболическую стабильность молекулы и улучшить растворимость вещества в воде, а также увеличить его эффективность в отношении вируса [1, 2].
Первым ингибитором протеазы, одобренным американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) стал саквинавир — он получил «зелёный свет» всего через 97 дней после того, как была подана соответствующая заявка. В течение следующих нескольких месяцев было получено разрешение на продажу двух других ингибиторов протеаз — ритонавира и индинавира. Сегодня одобрение регулятора имеют десять препаратов этого класса: ампренавир, атазанавир, лопиновир, ритонавир, типранавир, нелфинавир, индинавир, саквинавир, фосампренавир и дарунавир.
Общие свойства ингибиторов протеазы
Препараты этой группы снижают концентрацию вирусной РНК, увеличивают количество белых кровяных клеток, отвечающих за реакцию иммунной системы на инфекцию (CD-4 клеток) и, в итоге, улучшают выживаемость при включении в терапию наряду с антиретровирусными препаратами других классов.
В целом ингибиторы протеазы имеют сходные терапевтические эффекты. Их активность в отношении ВИЧ-1 и ВИЧ-2 расценивается как высокая, а устойчивость к ним развивается медленно.
Фармакокинетика
Ингибиторы протеазы интенсивно метаболизируются изоферментами системы цитохрома Р450, в частности, CYP3A4, что открывает возможности для целого ряда межлекарственных взаимодействий. Средства, индуцирующие активность ферментов Р450, например, рифампицин или экстракт зверобоя, ускоряют метаболизм ингибиторов протеазы, уменьшая их концентрацию в плазме и терапевтическую эффективность. И наоборот: препараты-ингибиторы ферментов Р450, такие как кетоконазол или циметидин, повышают уровень ингибиторов протеазы в плазме, что связано с увеличением токсичности последних [2].
На сегодня наиболее мощным ингибитором CYP3A4 является ритонавир. Он специально комбинируется с другими ингибиторами протеазы, являющимися субстратами CYP3A4 для продления их периода полувыведения [4].
Ингибиторы протеазы лучше всасываются при приёме во время или после еды [2, 3].
Показания
Препараты этого класса применяются для лечения ВИЧ-инфекции, профилактики передачи инфекции от матери к ребёнку и постконтактной профилактики заболевания.
Противопоказания
Противопоказано одновременное применение ритонавира с препаратами, выведение которых зависит от активности CYP3A4, во избежание токсичности антиретровирусной терапии.
Побочные эффекты
Неблагоприятные реакции при применении ингибиторов протеазы включают [2, 3, 4]:
- желудочно-кишечные расстройства, в частности, диарею с неустановленным механизмом, которая осложняется тем, что она нередко становится одним из осложнений ВИЧ;
- гиперлипидемию — общий побочный эффект для всех ингибиторов протеазы, реже возникает при приёме атазанавира; по всей видимости, нарушение липидного обмена связано с перераспределением жировой ткани, характерным для ВИЧ, которое обостряется при приёме ингибиторов протеазы;
- гипергликемию, инсулинорезистентность, которые развиваются, вероятно, в результате подавления ингибиторами протеаз переносчика глюкозы, что приводит к подавлению активности поглощения глюкозы клетками; с меньшей вероятностью этот побочный эффект проявляет атазанавир по сравнению с другими ингибиторами протеазы;
- сыпь, чаще всего возникает при приёме ампренавира.
Известен и ряд уникальных побочных эффектов: так, при приёме атазанавира может фиксироваться гипербилирубинемия, которая не считается признаком гепатотоксичности препарата, а на фоне применения индинавира возникает кристаллурия и нефролитиаз, что связано с плохой растворимостью препарата в воде. Поэтому пациентам, получающим индинавир, рекомендуют увеличить потребление жидкости во время лечения.
Особые указания
Использование ритонавира в качестве единственного ингибитора протеазы ограничено из‑за его выраженных пищеварительных побочных эффектов в терапевтических дозировках. Сегодня препарат применяют в низких дозах для повышения активности других ингибиторов протеаз. Одним из самых частых комбинированных препаратов, используемых для лечения ВИЧ, сегодня является лопинавир + ритонавир. Следует обратить внимание на то, что капсулы и растворы ритонавира содержат этиловый спирт, поэтому пациентам, получающим препарат, необходимо избегать приёма препаратов, вызывающих дисульфирамовую реакцию, в частности, дисульфирама и метронидазола [4].
Ингибиторы интегразы: механизм действия
Интеграза наряду с обратной транскриптазой и протеазой — один из ключевых участников репликации ВИЧ-1. Она катализирует процессы, приводящие к перемещению ДНК или её фрагментов внутри генома или между геномами. Будучи частью прединтеграционного комплекса, интеграза распознаёт длинные терминальные повторы на концах двойной цепи вновь синтезированной вирусной ДНК, отщепляет по два или по три основания с каждого конца, а также участвует в транспортировке вирусной ДНК в ядро клетки-мишени, где определяет предпочтительный сайт внедрения вирусной ДНК в хромосому и осуществляет её интеграцию в клеточный геном [5].
Ингибиторы интегразы, связываясь с её активным участком и блокируя этап переноса цепей во время интеграции ретровирусной ДНК, предотвращают образование ковалентных связей с ДНК хозяина и включение ВИЧ в геном хозяина [4].
В отличие от обратной транскриптазы и протеазы, интеграза не имеет близких аналогов в эукариотической клетке, поэтому у препаратов, избирательно действующих на неё, побочные эффекты должны быть минимальны [5].
Первым ингибитором протеазы стал ралтегравир, одобренный Администрацией по продуктам питания и лекарственным препаратам США в 2007 году [6]. Сегодня наряду с ралтегравиром используются ещё 4 препарата этого класса: элвитегравир, долутегравир, биктегравир и каботегравир. В разработке находится ещё две молекулы, одна из которых, по всей вероятности, имеет длительность действия до 4 раз больше по сравнению с ралтегравиром и, возможно, будет отнесена к ингибиторам интегразы второго поколения.
Общие свойства ингибиторов протеаз
Механизмы устойчивости к ингибиторам интегразы отличаются от таковых к другим классам антиретровирусных препаратов. Если в основе резистентности большинства ненуклеозидных ингибиторов обратной транскриптазы и ингибиторов протеазы лежит изменение конфигурации активного центра фермента и следующее за ним блокирование присоединения молекулы лекарства, то в случае с ингибиторами интегразы, по всей вероятности, имеют место другие феномены, причём для разных мутаций они могут отличаться [7]. Считается, что ралтегравир имеет низкий генетический барьер для развития устойчивости, поскольку единичная точечная мутация ВИЧ может приводить к изменению способности интегразы к ингибированию. Возможно, имеет место перекрёстная резистентность между ингибиторами интегразы [4].
Основной путь выведения ралтегравира — через печень, тем не менее коррекция дозы препарата у пациентов с печёночной недостаточностью лёгкой и средней степени тяжести не требуется. Почечное выведение играет незначительную роль в метаболизме ингибиторов протеазы, поэтому при почечной недостаточности дозу не пересматривают.
Ралтегравир не является субстратом для ферментов цитохрома CYP450, не ингибирует и не индуцирует их, с чем связана низкая частота лекарственных взаимодействий.
Ингибиторы протеазы показаны при ВИЧ-1 инфекции у пациентов, у которых выработалась устойчивость к другим классам антиретровирусных препаратов.
Не имеют терапевтического значения ввиду высокого профиля безопасности препаратов.
Поскольку антиретровирусные препараты обычно назначаются в комбинированных схемах, возникают сложности с определением неблагоприятных реакций, связанных с конкретным классом или лекарственным средством. В целом ингибиторы протеазы хорошо переносятся. В контролируемых исследованиях побочные эффекты при приёме ралтегравира были сопоставимы с таковыми при приёме плацебо. Ралтегравир считается одним из самых безопасных препаратов для лечения ВИЧ-инфекции благодаря минимальному риску развития нежелательных явлений, причём как у пациентов, ранее не получавших антиретровирусную терапию, так и уже имевших опыт лечения препаратами других классов [4, 8].
В настоящее время существуют ограниченные данные об активности ингибиторов протеазы в отношении ВИЧ-2.
Во время клинических исследований наблюдалось небольшое, статистически незначимое увеличение заболеваемости раком у пациентов, получавших ралтегравир, по сравнению с пациентами, получавшими плацебо.
Как и в случае с большинством других антиретровирусных препаратов, безопасность ингибиторов интегразы при применении во время беременности не установлена.
Препараты-ассистенты
Фармакокинетические усилители не проявляют фармакологического эффекта, их задача — усиление действия основного препарата. Выполняя функцию «проводников» для ведущего компонента терапии, они открывают уникальные возможности для врача и пациента: позволяют снизить терапевтическую дозировку, уменьшить побочные эффекты и улучшить переносимость лечения в целом, что особенно актуально при антиретровирусной терапии (АВТ). Так какие же они, фармакокинетические усилители, и как они работают?
От антибиотиков — к антиретровирусной терапии
Наверное, самыми распространёнными фармакокинетическими усилителями, или энхансерами (от англ. to enhance — усиливать), которые хорошо знакомы каждому фармспециалисту, можно считать ингибиторы бета-лактамазы. Инактивируя бактериальный фермент лактамазу, они подавляют гидролитическое разрушение бета-лактамных антибиотиков, обеспечивая их антибактериальную активность. К известным энхансерам также можно отнести карбапенем-лактамазы, гидролизующие другие антибиотики лактамного типа — в частности, цефалоспорины — и бросающие вызов устойчивым штаммам Acinetobacter baumannii, Pseudomonas aeruginosa и Proteus mirabilis [1].
Первым поколением бета-лактамных ингибиторов в клинической практике стали клавулановая кислота, сульбактам и тазобактам. Позже появились энхансеры, активные в отношении бета-лактамаз С- и D-типа, — авибактам, релебактам, зидебактам.
Ещё одним широко используемым в клинической практике энхансером можно считать кларитромицин в схеме эрадикационной терапии Helicobacter pylori. Он включён в состав комбинированного лечения хеликобактерной инфекции наряду с ингибиторами протонного насоса, которые используются, как минимум, по двум причинам. Во-первых, при повышенном pH желудочного сока увеличивается доля клеток H. pylori, находящихся в фазе пролиферации, а во‑вторых, период полураспада чувствительных к кислой среде антибиотиков, использующихся для эрадикации (пенициллинов — амоксициллин, макролидов — кларитромицин) увеличивается при более высоком pH.
Кларитромицин является мощным ингибитором CYP3A4 и CYP2C19, а также субстратом данных ферментов печени. Ингибиторы протонной помпы, в частности, омепразол, лансопразол — субстраты как CYP3A4, так и CYP2C19. Благодаря этому кларитромицин и ингибиторы протонной помпы взаимно влияют на фармакокинетику, что приводит к замедлению метаболизма празолов [2]. Таким образом, макролид в составе эрадикационной терапии действует, как фармакокинетический усилитель ингибитора протонной помпы, прежде всего омепразола и лансопразола.
Есть и другие примеры энхансеров, которые используются в клинической практике, и особое место среди них принадлежит средствам, применяемым в составе антиретровирусной терапии. Они позволили решить проблему низкой биодоступности препаратов первой линии лечения ВИЧ — ингибиторов протеазы.
Ингибиторы протеазы ВИЧ: возможности и ограничения
Главная цель антиретровирусной терапии — снижение вирусной нагрузки. Для её достижения необходимо обеспечить адекватное и постоянное влияние лекарственного препарата на вирус. Кроме того, для повышения приверженности лечению и улучшения терапевтического эффекта уместно подбирать удобную для пациента схему дозирования. Одним из ведущих классов антиретровирусных препаратов стали ингибиторы протеазы. Блокируя фермент, участвующий в созревании вируса иммунодефицита, они нарушают созревание вирусной мРНК, предотвращая выход вирулентных вирусных частиц [3].
Однако ингибиторы протеазы имеют и серьёзный недостаток — низкую биодоступность при пероральном применении. Она связана с их восприимчивостью к окислению ферментом цитохрома Р450 CYP3A4 в энтероцитах тонкого кишечника и гепатоцитах. В то же время именно биотрансформация препарата в стенке кишечника вносит существенный вклад в его первичное прохождение через печень и степень абсорбции [4].
Повысить биодоступность ингибиторов протеазы позволяет целенаправленное ингибирование CYP3A4, обеспечивающее более высокую экспозицию лекарственного препарата, снижение дозы и упрощение схемы применения. Поскольку практически все ингибиторы протеазы являются субстратами CYP3A4, введение в комбинации с ними бустерного агента, ингибирующего данный фермент, стало ведущей стратегией повышения абсорбции. В качестве энхансеров ингибиторов протеазы сегодня используются 2 препарата: ритонавир и кобицистат [5].
Фармакокинетические усилители антиретровирусной терапии
Ритонавир был разработан как ингибитор протеазы ВИЧ, но его первоначальное использование в качестве антиретровирусного препарата в терапевтической дозе 600 мг 2 раза в день было существенно ограничено ввиду дозозависимых побочных эффектов, таких как диарея и тошнота. Однако выяснилось, что препарат, будучи ингибитором ферментов CYP, особенно CYP3A4, действует как усилитель фармакокинетики для некоторых ЛС при совместном применении. Кроме того, ритонавир обладает высоким сродством к Р-гликопротеину. Это АТФ-зависимый белок-транспортер, который участвует в транспорте субстратов, в том числе лекарственных препаратов, из клеток, включая энтероциты кишечника. Ритонавир, блокируя Р-гликопротеин, предотвращает перенос препаратов-ингибиторов протеазы из стенки кишечника обратно в его просвет, способствуя повышению их пероральной биодоступости [6].
Сегодня ритонавир применяется в роли фармакокинетического усилителя в комбинации с другими ингибиторами протеазы ВИЧ, например, лопинавиром, атазанавиром и дарунавиром в хорошо переносимых дозах от 100 до 200 мг в сутки. Его включение в состав антиретровирусной терапии обеспечивает поддержание терапевтических уровней основных препаратов в сыворотке крови, а также снижение кратности применения и доз, что способствует повышению эффективности лечения. Кроме того, ритонавир используется в комбинации с ингибитором интегразы элвитегравиром, который, в отличие от других препаратов этой группы, метаболизируется в основном за счёт CYP3A4 [7].
Кобицистат стал вторым фармакокинетическим усилителем, используемым в составе антиретровирусной терапии. Он структурно близок к ритонавиру, однако, в отличие от него, не проявляет ингибирующей активности в отношении протеазы ВИЧ и действует исключительно как усилитель ингибирования CYP3A4 и блокатор транспортёра Р-гликопротеина [5]. Препарат был разработан для снижения частоты нежелательных побочных эффектов ритонавира, а именно — нарушения липидного обмена, желудочно-кишечных расстройств, а также лекарственных взаимодействий [8].
По сравнению с ритонавиром кобицистат имеет улучшенные физико-химические свойства (например, растворимость в воде) и является более мощным ингибитором CYP3A, но при этом почти не влияет на активность других ферментов CYP. В то же время ритонавир, помимо CYP3A4, подавляет ряд других ферментов CYP и является индуктором CYP1A2 и CYP2C9 [9].
В дозе 150 мг один раз в сутки кобицистат демонстрирует бустирующий эффект, сопоставимый с ритонавиром в дозе 100 мг один раз в сутки. Как и ритонавир, кобицистат дополнительно усиливает всасывание ингибиторов протеазы ВИЧ в кишечнике за счёт ингибирования транспортёра кишечного оттока Р-гликопротеина. В клинических исследованиях было показано, что фармакокинетические эффекты обоих энхансеров при комбинировании с атазанавиром, дарунавиром и элвитегравиром были почти идентичны. А вот в комплексе с ингибитором протеазы типранавиром кобицистат продемонстрировал менее выраженные бустерные свойства по сравнению с ритонавиром [9].
Клинически значимые бустерные режимы антиретровирусной терапии [10]:
- ритонавир + атазанавир;
- ритонавир + дарунавир;
- ритонавир + лопинавир;
- ритонавир + фосампренавир;
- кобицистат + элвитегравир;
- кобицистат + тенофовира алафенамид.
В процессе изучения находятся комбинации «кобицистат + атазанавир» и «кобицистат + дарунавир».
Высокая терапевтическая ценность фармакокинетических усилителей в составе антиретровирусной терапии стали мощным стимулом для создания новых улучшенных бустеров. На сегодняшний день изучается ряд перспективных формул.
Ритонавир — энхансер терапии гепатита С
Лечение больных гепатитом С с помощью интерферонов и рибавирина, как показала клиническая практика, имеет довольно низкую частоту терапевтического ответа и плохо переносится. Революцией в терапии вирусного гепатита С стало создание противовирусных препаратов прямого действия. Они нацелены на специфические неструктурные белки, кодируемые одноцепочечным РНК вирусом гепатита С. К препаратам этой группы относятся ингибиторы протеазы NS3/4A, ингибиторы NS5A и ингибиторы полимеразы NS5B. Как правило, в составе терапии гепатита С применяются комбинации из нескольких противовирусных препаратов прямого действия, нацеленных на разные белки [11].
Мощным конкурентным ингибитором сериновой протеазы NS3 и её кофактора NS4A вирусов гепатита С 1 и 4 генотипа является паритапревир. Он служит субстратом для CYP3A4 и, следовательно, нуждается в фармакокинетическом усилении. Эту задачу выполняет ритонавир: его включение в схему лечения обеспечивает достаточно высокие и продолжительные уровни паритапревира в плазме, позволяющие назначать однократный приём препарата. Ритонавир не обладает собственной активностью в отношении протеаз вируса гепатита С (в отличие от ВИЧ).
Следует отметить, что ритонавир увеличивает потенциал лекарственного взаимодействия для комбинации «паритапревир + ритонавир», поэтому во время терапии противопоказаны препараты, которые активно метаболизируются CYP3A4, как резко снижающие концентрацию в плазме основного действующего вещества [12].
Великолепная девятка
Цель современной фармацевтической отрасли — создание эффективных лекарственных средств, которые позволяют пациентам сохранять активность и высокое качество жизни даже при неизлечимых заболеваниях. Примером этого стало открытие средств для антиретровирусной терапии, которая перевела изначально смертельную ВИЧ-инфекцию в хроническое контролируемое заболевание. И одними из первых представителей этого класса стали нуклеозидные ингибиторы обратной транскриптазы ВИЧ.
Общая информация
Нуклеозидные ингибиторы обратной транскриптазы ВИЧ (НИОТ) — первый класс антиретровирусных препаратов, одобренных американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов FDA [1]. НИОТ активны в отношении ВИЧ-1 (наиболее распространённого серотипа вируса) и ВИЧ-2. Несмотря на то что препараты этой группы менее эффективны против вируса иммунодефицита, чем ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), они играют центральную роль в антиретровирусной терапии и остаются важной частью процесса лечения [4].
В группу нуклеозидных ингибиторов обратной транскриптазы входят 9 препаратов:
- зидовудин;
- диданозин;
- ламивудин;
- эмтрицитабин;
- абакавир;
- ставудин;
- тенофовира дизопроксила фумарат;
- тенофовира алафенамид;
- залцитабин.
Фармакологическое действие
Нуклеозидные ингибиторы обратной транскриптазы представляют собой модифицированные аналоги нуклеозидов (тимидина, аденина, цитилина, гуанина), которые фосфорилируются в организме под влиянием клеточных киназ. Все НИОТ — пролекарства: после превращения в соответствующие трифосфаты они ингибируют активность обратной транскриптазы ВИЧ [1].
Вирус иммунодефицита человека реплицируется за счёт преобразования своей одноцепочечной РНК в двухцепочечную ДНК, которая встраивается в ДНК клеток хозяина. В этом решающем для репликации вируса преобразовании, в отличие от нормальной клеточной транскрипции нуклеиновых кислот, участвует фермент под названием «обратная транскриптаза». Наряду с двумя другими — интегразой и протеазой — он находится внутри капсида вируса иммунодефицита человека [1].
Известно, что обратная транскриптаза проявляет три эффекта:
- обеспечивает синтез односпиральной комплементарной ДНК (кДНК) на матрице вирионной РНК;
- участвует в синтезе второй спирали ДНК ВИЧ;
- гидролизует РНК в составе гибридного комплекса РНК-ДНК.
Таким образом, обратная транскриптаза позволяет транскрибировать РНК ВИЧ в одноцепочечную и, в конечном счёте, в двухцепочечную провирусную ДНК и включать её в геном клетки-хозяина [1–3].
Нуклеозидные ингибиторы обратной транскриптазы, ингибируя активность обратной транскриптазы ВИЧ, препятствуют образованию ДНК на матрице вирусной РНК, блокируя ранние стадии цикла размножения вируса. Немаловажно, что способность препаратов этой группы ингибировать обратную транскриптазу ВИЧ в сотни раз выше по сравнению со способностью подавлять ДНК-полимеразу человека [2]. Поэтому НИОТ активны именно в инфицированных ВИЧ Т-клетках и макрофагах.
Устойчивость к НИОТ
Резистентность к нуклеозидным ингибиторам обратной транскриптазы возникает по одному из двух механизмов: нарушение включения в цепь провирусной ДНК или удаление провирусной ДНК из цепи [4, 5]. Мутации, приводящие к устойчивости, обычно развиваются постепенно. Как правило, необходимо накопление сразу нескольких мутаций для развития клинически значимой резистентности. Исключение — мутация M184V, которая гарантирует высокий уровень устойчивости к нескольким препаратам, в частности, к ламивудину и эмтрицитабину.
Известно несколько мутаций, приводящих к развитию устойчивости к НИОТ:
- мутации, которые выборочно нарушают включение в цепь провирусной ДНК — M184V, Q151M и K65R;
- мутации аналога тимидина, связанные с устойчивостью к зидовудину — M41L, D67N, K70R, L210W, T215Y, T215F, K219Q, K219E.
Фармакокинетика НИОТ
Пероральная биодоступность нуклеозидных ингибиторов обратной транскриптазы колеблется в пределах от 25 % до 93 %, причём самые низкие показатели характерны для двух средств — тенофовира и диданозина. Пища не оказывает значимого влияния на абсорбцию НИОТ. Исключение составляет диданозин, который принимают натощак. Остальные препараты можно принимать независимо от приёма пищи.
Большинство НИОТ выводятся через почки и требуют корректировки дозы у больных с почечной недостаточностью. Исключение — абакавир: его назначают в обычной дозе независимо от клиренса креатинина.
НИОТ не метаболизируются системой цитохрома Р450, поэтому лекарственные взаимодействия для них не характерны. В клинически значимые взаимодействия вступает лишь диданозин: при приёме с тенофовиром биодоступность диданозина увеличивается, поэтому целесообразно использовать более низкие дозы во избежание развития серьёзных побочных эффектов. Похожая реакция развивается и при одновременном приёме диданозина с рибавирином (у больных с сочетанным ВИЧ и вирусным гепатитом С). В подобных случаях этого сочетания препаратов следует избегать [4].
Побочные эффекты НИОТ
Неблагоприятные реакции нуклеозидных ингибиторов обратной транскриптазы включают митохондриальную токсичность, в частности, лактоацидоз, панкреатит, периферическую нейропатию, стеатоз печени и липоатрофию [4].
Митохондриальная токсичность обусловлена связыванием НИОТ с ферментом митохондриальной ДНК-полимеразы гамма человека, что ведет к переходу нормального аэробного метаболизма в анаэробный и нарушению клеточного дыхания. Афинность связывания НИОТ с митохондриальной ДНК-полимеразой гамма позволяет прогнозировать развитие потенциальных побочных эффектов. В порядке убывания афинности (а, следовательно, повышения профиля безопасности) НИОТ можно расположить так: залцитабин, диданозин, ставудин, ламивудин/эмтрицитабин, зидовудин, абакавир и тенофовир [6, 7].
Отдельные побочные эффекты, характерные для НИОТ, включают подавление активности костного мозга, миопатию, головную боль при приёме зидовудина и реакцию системной гиперчувствительности при приёме абакавира. Приём абакавира и диданозина также связан с повышенным риском сердечно-сосудистых событий [8].
На начальных этапах терапии НИОТ может регистрироваться повышенный обмен костной ткани и потеря костной массы в позвоночнике и бедренной кости, причём она может составлять около 6 % в течение 1 года после начала лечения [9].
В клинических исследованиях у больных, получающих комбинированную терапию элвитегравир + кобицистат + тенофовира алафенамид + эмтрицитабин, было выявлено большее увеличение уровня общего холестерина и липопротеинов высокой плотности по сравнению с пациентами, получавшими другие схемы антиретровирусной терапии [9].
Пациентам с тяжёлой почечной недостаточностью не рекомендуется принимать тенофовира алафенамид, однако при умеренной форме заболевания препарат может применяться. По всей вероятности, алафенамиду присуща меньшая токсичность для почек и менее выраженное снижение плотности костной ткани по сравнению со схемами, содержащими тенофовир, которые использовались раньше [10].
Особенности отдельных НИОТ
Первый синтезированный антиретровирусный препарат, аналог тимидина. При использовании в составе монотерапии резистентность к нему развивается быстро за счёт последовательного накопления мутаций. При включении препарата в состав комбинированной терапии наряду с ламивудином и эмтрицитабином восприимчивость к нему увеличивается. Выпускается в парентеральной и пероральной формах. Применяется для лечения ВИЧ-инфекции как часть комбинированного режима, а также антенатально у матери и в качестве монотерапии новорождённых [1, 11].
Активность сопоставима с зидовудином. Обладает коротким периодом полураспада, однако проявляет более длительный внутриклеточный эффект по сравнению с зидовудином, что обеспечивает пролонгированную антиретровирусную активность. Лучше принимать натощак или не менее чем через 2 часа после еды [1, 11].
Ламивудин и эмтрицитабин
Ламивудин стал первым аналогом нуклеозидов, рекомендованным для терапии хронического гепатита B в составе монотерапии, а также для лечения сочетанного гепатита B и вируса иммунодефицита человека инфекции в составе с тенофовиром. Устойчивость развивается через 1 год терапии у 30 % пациентов и через 5 лет терапии — у 70 % пациентов.
Эмтрицитабин имеет аналогичную с ламивудином структуру, переносимость, эффективность и уровень резистентности, поэтому эти два НИОТ не используют в комбинации [1, 11].
Выделяется в ряду НИОТ высокой терапевтической эффективностью. Обычно хорошо переносится, но у 8 % пациентов могут возникать реакции гиперчувствительности, особенно в начале лечения [1, 11].
Тенофовир, вводимый перорально в качестве пролекарства тенофовира фумарата, эффективен против вируса гепатита B [1,11].
Ингибирует обратную транскриптазу и дополнительно включается в вирусные ДНК, прекращая удлинение цепи. Применение препарата ограничено из‑за связанного с ним аномального перераспределения жира с лица и конечностей на туловище, шею, грудь и живот — липоатрофии [1, 11].
Широко используется для лечения хронического гепатита B, активен в отношении штаммов, устойчивых к ламивудину. Вводится перорально. Как правило, хорошо переносится. Резистентность развивается гораздо реже, чем при применении ламивудина (через 5 лет лечения у 30 % пациентов). Это связывают с гибкостью молекулы адефовира. Терапевтические дозы при гепатите B недостаточны для эффективного лечения ВИЧ-инфекции, поэтому ВИЧ-статус должен быть определён/подтверждён до начала приёма препарата при вирусе гепатита B [1, 11].
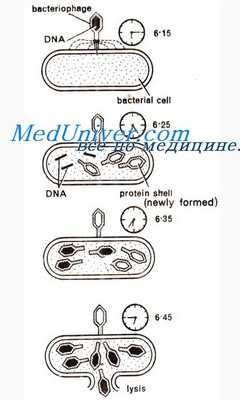
Ингибиторы протеаз. Применение и побочные эфекты ингибиторов протеаз
Первым ингибитором протеаз был сахинавир (1995), однако его эффективность оказалась ограниченной вследствие плохой биодоступности. Затем было получено большое число PL
PI имеют следующие общие характеристики:
• конкурентно связываются с аспартатпротеазами ВИЧ-1 и ВИЧ-2, препятствуя посттрансляционному расщеплению вирусного полипротеина на компоненты, необходимые для сборки и почкования вируса;
• их внутриклеточная активация не требуется;
• к PI развивается заметная резистентность вследствие накопления мутаций с заменой аминокислот в активном центре ферментов и других областях. Вирусы с мутатными протеазами, по-видимому, менее чувствительны, чем вирусы дикого типа.
Некоторые PI (сахинавир, ритонавир, индинавир и ампренавир) относятся к пептидомиметическим и структурно соответствуют участкам расщепления полипротеинов ВИЧ. Другие PI (нелфинавир) не являются пептидомиметическими. Ампренавир представляет собой сульфонамидный компонент.
После перорального приема абсорбция ритонавира, индинавира, нелфинавира и ампренавира составляет от 60 до 80%. Для сахинавира эта величина равна приблизительно 10%. Проникновение в СМЖ ограничено, хотя концентрация индинавира в ЦНС может достигать клинически значимых величин.
Все PI метаболизируются посредством CYP, и при их использовании наблюдается важный феномен лекарственного взаимодействия.
PI в комбинации с NRTI (а также с NNRTI) служат эффективными ингибиторами репликации ВИЧ-1 и ВИЧ-2. Их применение удлиняет период выживаемости пациентов и снижает число ВИЧ-инфицированных больных, нуждающихся в госпитализации. В клинических испытаниях установлено, что частота полного подавления виремии достигает 80% и более на период до 3 лет. В клинической практике результаты менее впечатляющие (подавление виремии на 50-60% в течение 1 года), возможно, в связи с проблемами лекарственной токсичности и соблюдения указаний врача.
Основные побочные эффекты PI связаны с их действием на ЖКТ. Появление тошноты регистрируют у 3-30% пациентов, чаще всего — при использовании ритонавира и ампренавира. Диарея различной степени тяжести возникает в 5-30% случаев, особенно часто ее вызывают ритонавир и нелфинавир.
В случае длительного применения PI все чаще наблюдается появление синдрома липодистрофии — истощение жировой ткани на периферии, центральное накопление жира, гиперлипидемия и резистентность к инсулину. Эти нарушения встречаются в различных комбинациях и пропорциях. Элементы данного синдрома могут появиться и без применения PI; предполагается, что развитию синдрома способствует опосредованная NRTI митохондриальная токсичность.
Антиретровирусные ингибиторы слияния. Недавно для лечения ВИЧ-инфекции стали использовать ингибитор слияния энфувиритид (Т20). Этот препарат предотвращает слияние ВИЧ с наружной клеточной мембраной, тем самым препятствуя инфицированию клеток организма-хозяина.
- Вернуться в оглавление раздела "фармакология"
Читайте также:
