Инсулиномы. Диагностика инсулином. Признаки инсулином.
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Интраоперационная диагностика инсулиномы. Методы диагностики инсулиномы во время операции.
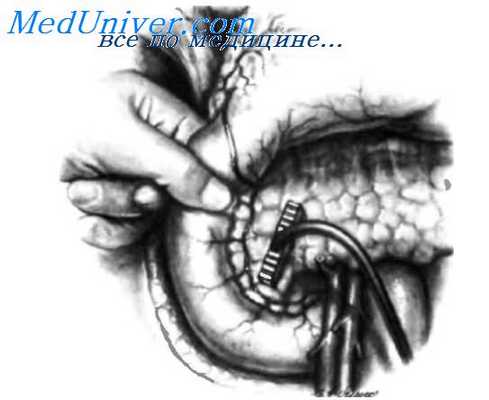
Для диагностики инсулином малых размеров в последние годы все чаще применяют интраоперационную ультрасонографию. Используют высокочастотный датчик меньшего размера, чем при чрескожнои ультрасонографии. Инсулинома проявляет себя снижением эхогенности по сравнению с нормальной паренхимой поджелудочной железы. Есть авторы, которые считают, что интраоперационная ультрасонография не лучше хорошего пальпаторного исследования, выполненного опытным хирургом.
Другие хирурги полагают, что интраоперационная ультрасонография показана во всех случаях не только из-за того, что дает хорошие результаты, но и потому, что это неинвазивный метод, выявляющий наличие инсулином, которые не видны или не пальпируются. Известно, что с помощью ультрасонографии можно установить взаимоотношение инсулиномы и протока поджелудочной железы. Таким образом, хпрург может принять все меры предосторожности при энуклеации опухоли, чтобы не повредить панкреатический проток. Для получения наилучших результатов ультрасонографию должен выполнять хпрург вместе с опытным врачом ультразвуковой диагностики.
На рисунке изображена техника ультрасонографического исследования поджелудочной железы. Для проведения этого исследования во время операции применяют высокочастотный датчик меньшего размера, чем при чрескожной ультрасонографии. Инсулинома обычно видна как образование пониженной эхогенности, по сравнению с нормальной паренхимой поджелудочной железы.
Селективная катетеризация эфферентных вен поджелудочной железы во время оперативного вмешательства для определения уровня инсулина радиоиммунным экспресс-методом все чаще используется во время операции для уточнения локализации скрытых инсулином и основана на методике, разработанной Ingemansson и его коллегами, как мы описывали выше. Во время операции берут пробы крови из эфферентных вен поджелудочной железы для определения уровня инсулина радиоиммунным экспресс-методом, для чего требуется около 30 минут. Повышение уровня инсулина укажет сегмент, в котором локализована инсулпнома, что позволит избежать слепой резекции поджелудочной железы у некоторых пациентов. Кроме того, этот метод позволяет выполнить УЗИ области предполагаемой локализации инсулиномы, давая возможность обнаружить и энуклеировать опухоль у некоторых пациентов. В случаях, когда метод, разработанный Ingemansson и его коллегами, применяют до операции, достигнутые результаты сравнимы с результатами, полученными интраоперационно.
Тест с применением толуидинового синего
Некоторые авторы рекомендуют этот тест для интраоперационного установления локализации инсулином с помощью инъекции толуцдпнового синего в селезеночную шш желудочно-двенадцатиперстную артерию. В трех случаях, когда мы применяли этот метод, результаты были недостаточно убедительными.
Прогрессирующая дистальная резекция поджелудочной железы
При наличии скрытых инсулином, которые не удается обнаружить с помощью ранее описанных методов, необходимо прибегнуть к прогрессирующей резекции поджелудочной железы. Ее выполняют, последовательно пересекая поджелудочную железу через каждые 5 мм, для того чтобы можно было непосредственно увидеть опухоль, либо пропальпировать ее, либо обнаружить с помощью микроскопического исследования поверхностей срезов. Таким образом нам удалось обнаружить лишь одну инсулиному, которую невозможно было распознать другими способами. Не вызывает сомнения, что этим методом можно обнаружить 30—40% скрытых инсулином. Некоторые авторы не согласны с применением прогрессирующей резекции, предпочитая закрывать брюшную полость и в течение 1 или 2 лет ждать второго оперативного вмешательства, надеясь, что инсулинома увеличится в размерах и ее можно будет обнаружить. В течение этого периода времени гипогликемию лечат назначением диазоксида. Аргументы против такой тактики следующие:
1. Как было показано, при прогрессирующей резекции поджелудочной инсулиномы обнаруживаются в 30—40% случаев.
2. Повторное тщательное исследование поджелудочной железы — нелегкая задача, несомненно увеличивающая тяжесть операции и послеоперационную смертность. Поэтому, если это возможно, желательно произвести резекцию инсулиномы во время первого оперативного вмешательства.
3. Диазоксид эффективен не у всех пациентов и часто дает побочные и токсические эффекты, особенно при длительном применении.
4. В случае, когда инсулинома включенная в резецируемый сегмент, является злокачественной, лечение на этом завершается. Некоторые авторы, основываясь на том факте, что большинство скрытых инсулином локализуется в головке поджелудочной железы, предложили выполнять панкреатодуоденальную резекцию (операцию Whipple) вместо дистальной резекции поджелудочной железы. Однако не вызывает сомнения и тот факт, что операция Whipple сопровождается более высоким операционным риском, тяжелыми осложненими и послеоперационной смертностью, кроме того, и при этой операции существует вероятность оставить инсулиномы, которые не удалось обнаружить.
Исследование замороженных срезов
После удаления опухоли необходимо подтвердить диагноз микроскопически. По этой причине, в случае вероятного удаления инсулиномы важно присутствие патологоанатома. При микроскопическом исследовании инсулиному можно принять за лимфатический узел, узел при хроническом панкреатите и т. д.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инсулиномы. Диагностика инсулином. Признаки инсулином.
Инсулиномы это опухоли, происходящие из бета-клеток островков Langerhans, образующих систему АПУД, что означает: А-амино; П-предшественник; У-усвоение; Д-декарбоксилирование. Клетки АПУД-системы имеют общие цитохимические характеристики со способностью синтезировать, сохранять и секретировать полипептиды и амины.
Инсулиномы встречаются не часто, но и не слишком редко. Этот факт, наряду с их изменчивой симптоматикой, способствует тому, что распознавание инсулином, будучи фрагментарным и неполным, во многих случаях, однако, приводит к правильной диагностике и лечению. Инсулиномы составляют 70— 80% эндокринных опухолей поджелудочной железы и были открыты первыми.
Обнаружению и дальнейшему исследованию инсулином предшествовали три важных научных открытия. Первое — открытие Лангергансом (Paul Langerhans, Германия), который был еще лишь студентом-медиком, в 1869 г. островков в поджелудочной железе. Эта островки были названы островками Лангерганса в честь пх первооткрывателя. Второе — революционное открытие инсулина в Канаде в 1922 г. Banting и Best, причем последний в то время также был еще студентом-медиком. Третье — открытие методики радпоиммунного анализа Yalow и Berson в СШАв 1959 г., что дало возможность определять уровень инсулина с помощью иммунореактивных анализов плазмы крови и точно диагностировать инсулиному. Введение концепции гиперинсулинизма (Harris в 1925 г. в США) и установление взаимосвязи между гиперинсулинизмом и гипогликемией (Wilder в 1927 г. в США) дополнили три эти концепции.
Хирурги, занимающиеся лечением гормонсекретирующих инсулином, не должны ограничиваться лишь выполнением хирургической операции. Хпрург должен знать тактику диагностики и установления локализации инсулиномы, иметь четкие критерии относительно стратегии проведения хирургической операции и адекватного исследования поджелудочной железы, а также знать другие методы исследования, если во время операции пропальпировать инсулиному не удается. Обнаружить инсулиному обычно легко, но в некоторых случаях могут возникнуть затруднения, что служит испытанием для хирурга, отражая его опыт, а также умение добиваться положительных результатов и сводить к минимуму количества ошибок.
Лечение гормонпродуцирующих инсулином включает четыре этапа:
1. Четкая диагностика гормонпродуцирующей инсулиномы.
2. Установление локализации инсулиномы в паренхиме поджелудочной железы.
3. Обнаружение инсулиномы во время операции.
4. Хирургическая резекция инсулиномы.
Для достижения наилучших результатов за одну операцию, если это возможно, хирург должен хорошо представлять себе тактические подходы к разработке каждого этапа. Проанализируем все эти этапы.
На этом этапе следует четко диагностировать гормонпродуцирующую инсулиному, основываясь на клинических симптомах, подкрепляемых биохимическими исследованиями. Биохимическая диагностика основана на анализе уровня инсулина в плазме вместе с уровнем глюкозы в крови. Для подтверждения диагноза необходимо также определить уровень проинсулина и С-пептидов в плазме. Очень важно брать кровь на анализ во время гипогликемического криза, поскольку, когда он пройдет, уровни инсулина и глюкозы могут быть нормальными. Наиболее важное значение имеет не абсолютный уровень инсулина в плазме, а его соотношение с уровнем глюкозы в крови. В норме соотношение инсулина и глюкозы всегда меньше 0.4. При инсулиномах отношение уровня инсулина к глюкозе обычно превышает 1. Уровень инсулина 10—20 мкг/мл при уровне глюкозы 90 мг% не имеет диагностического значения, но такой же уровень инсулина, сопровождаемый содержанием глюкозы в крови ниже 45 мг% в течение всего периода гипогликемии имеет диагностическую ценность. Если у пациента отсутствует клиническая симптоматика, диагноз гормонпродуцирующей инсулиномы сомнителен.
Одновременно с уровнем инсулина в плазме крови нужно определять содержание проинсулина и пептидов (С-пептидов). У здоровых лиц содержание проинсулина составляет 22% от концентрации иммунореак-тивного инсулина плазмы. При инсулиномах концентрация проинсулина составляет более 25% от концентрации иммунореактпвного инсулина плазмы. Если концентрация проинсулина выше 50% концентрации инсулина плазмы, следует предполагать, что инсулинома является злокачественной. В норме С-пептпды находятся в крови в эквимолярной концентрации с инсулином, поэтому изменение концентрации С-пептидов в плазме отражает концентрацию инсулина. У пациентов с инсулиномой уровень С-пептцдов увеличивается, и это является важным фактом, требующим проведения дифференциальной диагностики между гормонпродуцирующими инсулиномамп, вызывающими гипогликемию, и гипогликемией, вызванной введением аптечного инсулина. В этом случае содержание С-пептидов не увеличено или находится на очень низком уровне, потому что промышленный инсулин не содержит С-пептидов. Кроме того, эту искусственную гипогликемию можно диагностировать по наличию антител к инсулину, которые вырабатываются у пациента спустя два месяца после начала введения экзогенного инсулина.
Убедительным тестом для установления диагноза гормонпродуцирующей инсулиномы является длительное голодание с отбором проб крови каждые шесть часов для определения уровней инсулина и сахара в крови, до тех пор пока не разовьется гипогликемический криз, который обычно появляется в течение 72 ч. от начала голодания. Во время гипогликемического криза необходимо получить, по крайней мере, две пробы крови с интервалом в 2—3 минуты. Затем тест необходимо прервать пероральным или внутривенным введением глюкозы.
Триада Whipple и Franz многократно использовалась и после 1935 г.. Для этого теста характерны три особенности: пациенты должны иметь симптомы гипогликемии, уровень глюкозы в крови должен составлять менее 45 мг%, симптомы исчезают после перорального или внутривенного назначения глюкозы. Тест является диагностическим, но не специфичным для инсулиномы. поскольку бывает положительным при некоторых гипогликемиях, не связанных с заболеваниями поджелудочной железы. Перед проведением операции у пациентов с инсулиномой целесообразно выполнить тест ингибирования диазокспда. Этот препарат может быть показан в послеоперационном периоде, поэтому необходимо знать о его эффективности и переносимости до операции.
Гиперинсулинизм
Гиперинсулинизм — клинический синдром, характеризующийся повышением уровня инсулина и снижением сахара в крови. Гипогликемия приводит к слабости, головокружению, повышению аппетита, тремору, психомоторному возбуждению. При отсутствии своевременного лечения развивается гипогликемическая кома. Диагностика причин состояния основывается на особенностях клинической картины, данных функциональных проб, динамическом исследовании глюкозы, ультразвуковом или томографическом сканировании поджелудочной железы. Лечение панкреатических новообразований – хирургическое. При внепанкреатическом варианте синдрома проводят терапию основного заболевания, назначают специальную диету.
Общие сведения
Гиперинсулинизм (гипогликемическая болезнь) - врожденное или приобретенное патологическое состояние, при котором развивается абсолютная или относительная эндогенная гиперинсулинемия. Признаки болезни впервые были описаны в начале ХХ века американским врачом Харрисом и отечественным хирургом Оппелем. Врожденный гиперинсулинизм встречается достаточно редко - 1 случай на 50 тыс. новорожденных. Приобретенная форма заболевания развивается в возрасте 35-50 лет и чаще поражает лиц женского пола. Гипогликемическая болезнь протекает с периодами отсутствия выраженной симптоматики (ремиссия) и с периодами развернутой клинической картины (приступы гипогликемии).
Причины гиперинсулинизма
Врожденная патология возникает вследствие внутриутробных аномалий развития, задержки роста плода, мутаций в геноме. Причины возникновения приобретенной гипогликемической болезни разделяют на панкреатические, приводящие к развитию абсолютной гиперинсулинемии, и непанкреатические, вызывающие относительное повышение уровня инсулина. Панкреатическая форма болезни встречается при злокачественных или доброкачественных новообразованиях, а также гиперплазии бета-клеток поджелудочной железы. Непанкреатическая форма развивается при следующих состояниях:
- Нарушения в режиме питания. Длительное голодание, повышенная потеря жидкости и глюкозы (поносы, рвота, период лактации), интенсивные физические нагрузки без потребления углеводной пищи вызывают резкое снижение уровня сахара в крови. Чрезмерное употребление в пищу рафинированных углеводов увеличивает уровень сахара крови, что стимулирует активную выработку инсулина.
- Поражение печени различной этиологии (рак, жировой гепатоз, цирроз) приводит к снижению уровня гликогена, нарушению обменных процессов и возникновению гипогликемии.
- Бесконтрольный прием сахароснижающих препаратов при сахарном диабете (производных инсулина, сульфанилмочевины) вызывает медикаментозную гипогликемию.
- Эндокринные заболевания, приводящие к снижению уровня контринсулиновых гормонов (АКТГ, кортизол): гипофизарный нанизм, микседема, болезнь Аддисона.
- Недостаток ферментов, участвующих в процессах обмена глюкозы (печеночная фосфорилаза, почечная инсулиназа, глюкозо-6-фосфатаза) вызывает относительный гиперинсулинизм.
Патогенез
Глюкоза является главным питательным субстратом центральной нервной системы и необходима для нормального функционирования головного мозга. Повышенный уровень инсулина, накопление гликогена в печени и торможение гликогенолиза приводит к снижению уровня глюкозы в крови. Гипогликемия вызывает торможение метаболических и энергетических процессов в клетках головного мозга. Происходит стимуляция симпатоадреналовой системы, увеличивается выработка катехоламинов, развивается приступ гиперинсулинизма (тахикардия, раздражительность, чувство страха). Нарушение окислительно-восстановительных процессов в организме приводит к снижению потребления кислорода клетками коры головного мозга и развитию гипоксии (сонливость, заторможенность, апатия). Дальнейший дефицит глюкозы вызывает нарушение всех обменных процессов в организме, увеличение притока крови к мозговым структурам и спазм периферических сосудов, что может привести к инфаркту. При вовлечении в патологический процесс древних структур мозга (продолговатый и средний мозг, варолиев мост) развиваются судорожные состояния, диплопия, а также нарушение дыхательной и сердечной деятельности.
Классификация
В клинической эндокринологии наиболее часто используется классификация гиперинсулинемии в зависимости от причин возникновения заболевания:
- Первичный гиперинсулинизм (панкреатический, органический, абсолютный) является следствием опухолевого процесса или гиперплазии бета-клеток островкового аппарата поджелудочной железы. Повышению уровня инсулина в 90% способствуют доброкачественные новообразования (инсулинома), реже – злокачественные (карцинома). Органическая гиперинсулинемия протекает в тяжелой форме с выраженной клинической картиной и частыми приступами гипогликемии. Резкое понижение уровня сахара в крови возникает утром, связано с пропуском приема пищи. Для данной формы заболевания характерна триада Уиппла: симптомы гипогликемии, резкое снижение сахара в крови и купирование приступов введением глюкозы.
- Вторичный гиперинсулинизм (функциональный, относительный, внепанкреатический) связан с дефицитом контринсулярных гормонов, поражением нервной системы и печени. Приступ гипогликемии возникает по внешним причинам: голодание, передозировка гипогликемических препаратов, интенсивная физическая нагрузка, психоэмоциональное потрясение. Обострения болезни возникают нерегулярно, практически не связаны с приемом пищи. Суточное голодание не вызывает развернутой симптоматики.
Симптомы гиперинсулинизма
Клиническая картина гипогликемической болезни обусловлена понижением уровня глюкозы в крови. Развитие приступа начинается с повышения аппетита, потливости, слабости, тахикардии и ощущения голода. Позже присоединяются панические состояния: чувство страха, тревога, раздражительность, дрожь в конечностях. При дальнейшем развитии приступа отмечается дезориентация в пространстве, диплопия, парестезии (онемение, покалывание) в конечностях, вплоть до возникновения судорог. При отсутствии лечения наступает потеря сознания и гипогликемическая кома. Межприступный период проявляется снижением памяти, эмоциональной лабильностью, апатией, нарушением чувствительности и онемением в конечностях. Частый прием пищи, богатой легкоусвояемыми углеводами, провоцирует увеличение массы тела и развитие ожирения.
В современной практике выделяют 3 степени гиперинсулинизма в зависимости от тяжести течения болезни: легкую, среднюю и тяжелую. Легкая степень проявляется отсутствием симптоматики межприступного периода и органического поражения коры головного мозга. Обострения болезни проявляются реже 1 раза в месяц и быстро купируются медикаментозными препаратами или сладкой пищей. При средней степени тяжести приступы возникают чаще 1 раза в месяц, возможна потеря сознания и развитие коматозного состояния. Межприступный период характеризуется легкими нарушениями поведенческого характера (забывчивость, снижение мышления). Тяжелая степень развивается при необратимых изменениях коры головного мозга. При этом приступы случаются часто и заканчиваются потерей сознания. В межприступном периоде пациент дезориентирован, память резко снижена, отмечается тремор конечностей, характерна резкая смена настроения и повышенная раздражительность.
Осложнения гиперинсулинизма
Осложнения можно условно разделить на ранние и поздние. К ранним осложнениям, возникающим в ближайшие часы после приступа, относят инсульт, инфаркт миокарда вследствие резкого снижения метаболизма сердечной мышцы и головного мозга. В тяжелых ситуациях развивается гипогликемическая кома. Поздние осложнения проявляются спустя несколько месяцев или лет от начала болезни и характеризуются нарушением памяти и речи, паркинсонизмом, энцефалопатией. Отсутствие своевременного диагностики и лечения заболевания приводит к истощению эндокринной функции поджелудочной железы и развитию сахарного диабета, метаболического синдрома, ожирения. Врожденный гиперинсулинизм в 30% случаев приводит к хронической гипоксии головного мозга и снижению полноценного умственного развития ребенка.
Диагностика гиперинсулинизма
Диагностика основывается на клинической картине (потеря сознания, тремор, психомоторное возбуждение), данных анамнеза заболевания (время начала приступа, его связь с приемом пищи). Эндокринолог уточняет наличие сопутствующих и наследственных заболеваний (жировой гепатоз, сахарный диабет, синдром Иценко-Кушинга), после чего назначает лабораторные и инструментальные исследования. Пациенту проводится суточное измерение уровня глюкозы крови (гликемический профиль). При выявлении отклонений выполняют функциональные пробы. Проба с голоданием используется для дифференциальной диагностики первичного и вторичного гиперинсулинизма. Во время теста измеряют С-пептид, иммунореактивный инсулин (ИРИ) и глюкозу в крови. Повышение данных показателей свидетельствует об органическом характере болезни.
Для подтверждения панкреатической этиологии заболевания проводят тесты на чувствительность к толбутамиду и лейцину. При положительных результатах функциональных проб показано УЗИ, сцинтиграфия и МРТ поджелудочной железы. При вторичном гиперинсулинизме для исключения новообразований других органов выполняют УЗИ брюшной полости, МРТ головного мозга. Дифференциальная диагностика гипогликемической болезни проводится с синдромом Золлингера-Эллисона, началом развития сахарного диабета 2 типа, неврологическими (эпилепсия, новообразования головного мозга) и психическими (неврозоподобные состояния, психоз) заболеваниями.
Лечение гиперинсулинизма
Тактика лечения зависит от причины возникновения гиперинсулинемии. При органическом генезе показано хирургическое лечение: частичная резекция поджелудочной железы или тотальная панкреатэктомия, энуклеация новообразования. Объем оперативного вмешательства определяется местоположением и размерами опухоли. После операции обычно отмечается транзиторная гипергликемия, требующая медикаментозной коррекции и диеты с пониженным содержанием углеводов. Нормализация показателей наступает через месяц после вмешательства. При неоперабельных опухолях проводят паллиативную терапию, направленную на профилактику гипогликемии. При злокачественных новообразованиях дополнительно показана химиотерапия.
Функциональный гиперинсулинизм в первую очередь требует лечения основного заболевания, вызвавшего повышенную продукцию инсулина. Всем больным назначается сбалансированная диета с умеренным снижением потребления углеводов (100-150 гр. в сутки). Отдается предпочтение сложным углеводам (ржаные хлебцы, макароны из твердых сортов пшеницы, цельнозерновые крупы, орехи). Питание должно быть дробным, 5-6 раз в день. В связи с тем, что периодические приступы вызывают у пациентов развитие панических состояний, рекомендована консультация психолога. При развитии гипогликемического приступа показано употребление легкоусвояемых углеводов (сладкий чай, конфета, белый хлеб). При отсутствии сознания необходимо внутривенное введение 40 % раствора глюкозы. При судорогах и выраженном психомоторном возбуждении показаны инъекции транквилизаторов и седативных препаратов. Лечение тяжелых приступов гиперинсулинизма с развитием комы осуществляют в условиях реанимационного отделения с проведением дезинтоксикационной инфузионной терапии, введением глюкокортикоидов и адреналина.
Прогноз и профилактика
Профилактика гипогликемической болезни включает в себя сбалансированное питание с интервалом в 2-3 часа, употребление достаточного количества питьевой воды, отказ от вредных привычек, а также контроль уровня глюкозы. Для поддержания и улучшения обменных процессов в организме рекомендованы умеренные физические нагрузки с соблюдением режима питания. Прогноз при гиперинсулинизме зависит от стадии заболевания и причин, вызывавших инсулинемию. Удаление доброкачественных новообразований в 90% случаев обеспечивают выздоровление. Неоперабельные и злокачественные опухоли вызывают необратимые неврологические изменения и требуют постоянного контроля за состоянием пациента. Лечение основного заболевания при функциональном характере гиперинсулинемии приводит к регрессии симптомов и последующему выздоровлению.
Инсулинома
Инсулинома – гормонально-активная опухоль β-клеток островков поджелудочной железы, в избыточном количестве секретирующая инсулин и приводящая к развитию гипогликемии. Гипогликемические приступы при инсулиноме сопровождаются дрожью, холодным потом, чувством голода и страха, тахикардией, парестезиями, речевыми, зрительными и поведенческими нарушениями; в тяжелых случаях – судорогами и комой. Диагностика инсулиномы проводится с помощью функциональных проб, определения уровня инсулина, С-пептида, проинсулина и глюкозы крови, УЗИ поджелудочной железы, селективной ангиографии. При инсулиноме показано хирургическое лечение – энуклеация опухоли, резекция поджелудочной железы, панкреатодуоденальная резекция или тотальная панкреатэктомия.
Инсулинома – доброкачественная (в 85-90% случаев) или злокачественная (в 10-15% случаев) опухоль, исходящая из β-клеток островков Лангерганса, обладающая автономной гормональной активностью и приводящая к гиперинсулинизму. Неконтролируемая секреция инсулина сопровождается развитием гипогликемического синдрома – комплекса адренергических и нейрогликопенических проявлений.
Среди гормонально-активных опухолей поджелудочной железы инсулиномы составляют 70-75%; примерно в 10% наблюдений они являются компонентом множественного эндокринного аденоматоза I типа (наряду с гастриномой, опухолями гипофиза, аденомой паращитовидных желез и др.). Инсулиномы чаще выявляются у лиц в возрасте 40-60 лет, у детей встречаются редко. Инсулинома может располагаться в любой части поджелудочной железы (головке, теле, хвосте); в единичных случаях она локализуется экстрапанкреатически – в стенке желудка или двенадцатиперстной кишки, сальнике, воротах селезенки, печени и др. областях. Обычно размеры инсулиномы составляют 1,5 – 2 см.
Патогенез гипогликемии при инсулиноме
Развитие гипогликемии при инсулиноме обусловлено избыточной, неконтролируемой секрецией инсулина опухолевыми b-клетками. В норме при падении уровня глюкозы в крови происходит снижение продукции инсулина и его поступления в кровяное русло. В опухолевых клетках механизм регуляция выработки инсулина нарушается: при понижении уровня глюкозы его секреция не подавляется, что создает условия для развития гипогликемического синдрома.
Наиболее чувствительными к гипогликемии являются клетки головного мозга, для которых глюкоза служит основным энергетическим субстратом. В связи с этим при инсулиноме отмечаются явления нейрогликопении, а при длительной гипогликемии развиваются дистрофические изменения ЦНС. Гипогликемическое состояние стимулирует выброс в кровь контринсулярных гормонов (норадреналина, глюкагона, кортизола, соматотропина), которые обусловливают адренергическую симптоматику.
Симптомы инсулиномы
В течении инсулиномы выделяют фазы относительного благополучия, на смену которым периодически приходят клинически выраженные проявления гипогликемиии и реактивной гиперадреналинемии. В латентном периоде единственными проявлениями инсулиномы могут являться ожирение и повышенный аппетит.
Острый гипогликемический приступ является результатом срыва адаптационных механизмов ЦНС и контринсулярных факторов. Приступ развивается натощак, после продолжительного перерыва в приеме пищи, чаще в утренние часы. Во время приступа происходит падение содержания глюкозы в крови ниже 2,5 ммоль/л.
Нейрогликопенические симптомы инсулиномы могут напоминать различные неврологические и психиатрические нарушения. У больных может возникать головная боль, мышечная слабость, атаксия, спутанность сознания. В некоторых случаях гипогликемический приступ у больных с инсулиномой сопровождается состоянием психомоторного возбуждения: галлюцинациями, бессвязными выкриками, двигательным беспокойством, немотивированной агрессией, эйфорией.
Реакцией симпатико-адреналовой системы на резкую гипогликемию служит появление тремора, холодного пота, тахикардии, страха, парестезий. При прогрессировании приступа могут развиться эпилептический припадок, потеря сознания и кома. Обычно приступ купируется внутривенным вливанием глюкозы; однако, придя в себя, больные о случившемся не помнят. Во время гипогликемического приступа возможно развитие инфаркта миокарда вследствие острого нарушения питания сердечной мышцы, признаки локального поражения нервной системы (гемиплегия, афазия), которые могут быть ошибочно приняты за ОНМК.
При хронической гипогликемии у пациентов с инсулиномой нарушается функционирование центральной и периферической нервной системы, что отражается на течении фазы относительного благополучия. В межприступном периоде имеет место преходящая неврологическая симптоматика, нарушения зрения, миалгия, снижение памяти и умственных способностей, апатия. Даже после удаления инсулиномы снижение интеллекта и энцефалопатия обычно сохраняются, что приводит к утрате профессиональных навыков и прежнего социального статуса. У мужчин при часто повторяющихся приступах гипогликемии может развиваться импотенция.
При неврологическом обследовании у пациентов с инсулиномой выявляется асимметрия периостальных и сухожильных рефлексов, неравномерность или снижение брюшных рефлексов, патологические рефлексы Россолимо, Бабинского, Маринеску-Радовича, нистагм, парез взора вверх и др. Ввиду полиморфности и неспецифичности клинических проявлений, больным с инсулиномой могут ставиться ошибочные диагнозы эпилепсии, опухоли головного мозга, вегетососудистой дистонии, инсульта, диэнцефального синдрома, острого психоза, неврастении, остаточных явлений нейроинфекции и пр.
Диагностика инсулиномы
Установить причины гипогликемии и дифференцировать инсулиному от других клинических синдромов позволяет комплекс лабораторных тестов, функциональных проб, визуализирующих инструментальных исследований. Проба с голоданием направлена на провокацию гипогликемии и вызывает патогномоничную для инсулиномы триаду Уиппла: снижение глюкозы крови до 2,78 ммоль/л или ниже, развитие нервно-психических проявлений на фоне голодания, возможность купирования приступа пероральным приемом или внутривенным вливанием глюкозы.
С целью индуцирования гипогликемического состояния может использоваться инсулиносупрессивный тест с введением экзогенного инсулина. При этом отмечаются неадекватно высокие концентрации C-пептида в крови на фоне крайне низких показателей глюкозы. Проведение инсулинпровокационного теста (внутривенного введения глюкозы или глюкагона) способствует высвобождению эндогенного инсулина, уровень которого у больных с инсулиномой становится существенно выше, чем у здоровых лиц; при этом соотношение инсулина и глюкозы превышает 0,4 (в норме менее 0,4).
При положительных результатах провокационных проб проводится топическая диагностика инсулиномы: УЗИ поджелудочной железы и брюшной полости, сцинтиграфия, МРТ поджелудочной железы, селективная ангиография с забором крови из портальных вен, диагностическая лапароскопия, интраоперационная ультрасонография поджелудочной железы. Инсулиному приходится дифференцировать от лекарственной и алкогольной гипогликемии, гипофизарной и надпочечниковой недостаточности, рака надпочечников, демпинг-синдрома, галактоземии и др. состояний.
Лечение инсулиномы
В эндокринологии в отношении инсулиномы предпочтение отдается хирургической тактике. Объем операции определяется локализацией и размерами образования. При инсулиноме может выполняться как энуклеация опухоли (инсулиномэктомия), так и различные виды резекций поджелудочной железы (дистальная, резекция головки, панкреатодуоденальная резекция, тотальная панкреатэктомия). Эффективность вмешательства оценивается с помощью динамического определения уровня глюкозы крови в процессе операции. В числе послеоперационных осложнений могут развиваться панкреатит, панкреонекроз, свищи поджелудочной железы, абсцесс брюшной полости или перитонит.
При неоперабельных инсулиномах проводят консервативную терапию, направленную на купирование и профилактику гипогликемии, с помощью гипергликемизирующих средств (адреналина, норадреналина, глюкагона, глюкокортикоидов и др.). При злокачественных инсулиномах проводится химиотерапия (стрептозотоцин, 5-фторурацил, доксорубицин и др.).
Прогноз при инсулиноме
У 65-80% больных после хирургического удаления инсулиномы наступает клиническое выздоровление. Ранняя диагностика и своевременное хирургическое лечение инсулиномы приводят к регрессу изменений со стороны ЦНС по данным ЭЭГ.
Послеоперационная летальность составляет 5-10 %. Рецидив инсулиномы развивается в 3% случаев. Прогноз при злокачественных инсулиномах неблагоприятен - выживаемость в течение 2-х лет не превышает 60%. Пациенты с инсулиномой в анамнезе находятся на диспансерном учете у эндокринолога и невролога.
Инсулинома — гормонально-активная опухоль β-клеток поджелудочной железы. Опухоль неконтролируемо секретирует инсулин в избыточном количестве, что проявляется приступами гипогликемиии (резкого снижения уровня глюкозы в крови) после физической нагрузки или натощак. Для обозначения этого заболевания используются различные термины: гиперинсулинизм, инсулома, инсулинсекретирующая инсулома, гипогликемическая болезнь. Однако, наиболее часто употребляемым и общепринятым является термин «инсулинома». Это редкие опухоли, которые выявляются с частотой 1-2 случая на 1 000 000. Чаще всего инсулинома локализуются в поджелудочной железе, причем с равной частотой расположения в головке, теле и хвосте. Инсулин-секретирующая опухоль встречается у лиц разного возраста, но чаще всего в возрасте 30-50 лет. Женщины болеют в 2 раза чаще.
Основная задача гормональной системы — поддержание глюкозы на определенном уровне от 2,8 до 7 ммоль/л. Регулируется содержание глюкозы инсулином. Каждый раз, когда после приема пищи или стрессовых ситуаций повышается уровень глюкозы, одновременно повышается уровень инсулина. И наоборот, низкий уровень глюкозы тормозит выработку инсулина. Это взаимоотношение не соблюдается при наличии инсулиномы. У больных при этом заболевании отмечается постоянный выброс инсулина. Его секреция опухолевыми клетками не подавляется даже при низком и критическом уровне глюкозы. Постоянная повышенная продукция инсулина вызывает резкое снижение уровня глюкозы (гипогликемия). Гипогликемией считают снижение глюкозы у мужчин ниже 2,5-2,7 ммоль/л, а у женщин — меньше 1,9-2,1 ммоль/л.
Приступы гипогликемии устраняются приемом пищи (простыми углеводами), поэтому больные имеют при себе сдобные изделия, конфеты или сахар. Важность проблемы заключается в том, что постоянные приступы снижения глюкозы негативно сказываются на состоянии головного мозга, а крайняя степень гипогликемии — гипогликемическая кома относится к жизнеугрожающим состояниям и человек может погибнуть, если вовремя не оказать ему помощь. Важно, чтобы сам больной и его родственники были информированы о симптомах и могли вовремя прервать приступ, не дожидаясь развития комы. Повторяющиеся приступы гипогликемии влекут изменения в центральной нервной системе.
β-клеточные аденомы, постоянно высвобождая инсулин даже при низкой концентрации глюкозы, вызывают развитие хронической гипогликемии. Гиперинсулинизм также вызывает повышенный распад гликогена в печени и мышцах. Глюкоза — это важный компонент метаболизма и источник энергии для всех тканей, особенно мозга. Мозг не имеет запасов глюкозы, поэтому на его функцию расходуется около 20% глюкозы, поступившей в организм. Если в кору полушарий прекращается поступление глюкозы, в ее клетках развиваются необратимые изменения (гибель элементов коры) и возникают когнитивные и другие психические нарушения.
Гипогликемия является причиной выброса в кровь катехоламинов, это проявляется слабостью, тревогой, потливостью, учащенным сердцебиением, дрожью, возбудимостью. В результате гипогликемии замедляются все виды обмена в головном мозге, снижается тонус сосудов и увеличивается приток крови к мозгу из-за спазма сосудов на периферии. Все это ведет к развитию отека мозга.
- Доброкачественной.
- Злокачественной.
- Пограничной.
Типы гистологического строения:
- Альвеолярный.
- Солидный.
- Железистый.
- Трабекулярный.
- Смешанный.
Из всех типов чаще встречаются солидный и трабекулярный, которые напоминают строение островков Лангерганса. Затем следуют альвеолярный, железистый и смешанный тип строения. Длительность заболевания с момента появления первых симптомов до установления диагноза — 3-4 года, а иногда и 10 лет. В первый год заболевания диагностируется менее 10% случаев.
Небольшая часть инсулином (около 2%) локализуются вне поджелудочной железы — печени, двенадцатиперстной кишке, селезенке. Около 95% инсулином — это доброкачественные опухоли. Размеры их от 0,2 до 10 см, но большинство имеют небольшие размеры (не более 1,5 см). В большей части случаев — это одиночные (солитарные) опухоли, множественные встречаются в 10-15% случаев. Злокачественные опухоли, на долю которых приходится 5-10%, чаще имеют большие размеры (3-12 см).
Причины
В большинстве случаев опухоль развивается спорадически и точные причины не установлены. В некоторых случаях инсулинома является проявлением синдрома множественных эндокринных неоплазий 1 типа (MEN-1).
Синдром МЭН-1 — семейное заболевание, передаваемое по наследству половине детей, при котором отмечается генетический дефект длинного плеча 11 хромосомы. При этом синдроме мутация приводит к пролиферации нейроэндокринных клеток паращитовидных желез, поджелудочной железы, надпочечников и передней доли гипофиза. В связи с этим важно установить: является ли опухоль самостоятельным заболеванием или проявлением синдрома МЭН-1.
Симптомы инсулиномы поджелудочной железы
Клинические проявления обусловлены гормональной активностью опухоли. Выраженность проявлений в каждом случае зависит от индивидуальной чувствительности пациентов к недостатку сахара — больные по-разному его переносят. Триада Уиппла считается классической при инсулиноме:
- периодическая гипогликемическая симптоматика;
- снижение глюкозы менее 2,5 ммоль/л;
- купирование приступа введением глюкозы.
При этом у всех у больных отмечается латентный период (фаза относительного благополучия) и периоды выраженной гипогликемии.
Симптомы можно разделить на две группы:
- Связанные с приступом гипогликемии, который возникает чаще всего в утренние часы, после длительных перерывов в приеме пищи или после физической нагрузки. Проявления гипогликемии имеют разную степень выраженности. У больных появляются слабость, дрожь, обморочные состояния, сердцебиение, чувство голода, возбудимость, ощущение страха, потливость, тошнота, возможна потеря сознания. Во время приступа глюкоза крови снижается ниже 2,8 ммоль/л.
Длительность приступов от нескольких минут до нескольких часов. Характерным является то, что симптомы исчезают после приема углеводов (сахар, конфеты, мед, сладкий чай или внутривенное введение глюкозы). Часто больные, чувствуя приближение приступа, не допускают его развития приемом углеводистой пищи. Чем больше размер опухоли, тем ниже показатели глюкозы при приступе гипогликемии. Частота приступов разная — от одного до нескольких раз в неделю. Больные отмечают, что с течением времени частота и тяжесть гипогликемии увеличивается. - Симптомы инсуломы поджелудочной железы, связанные с поражением центральной нервной системы и наблюдаемые в межприступном периоде (латентной фазе). Это — головная боль, ухудшение зрения, спутанное сознание, параличи, нарушение походки, потеря сознания и кома. Они возникают при постепенно развивающейся хронической гипогликемии, которая оказывает повреждающее действие на ЦНС.
Ведущее место в латентной фазе занимают нервно-психические расстройства: недостаточность VII (лицевого) и ХII (подъязычного) черепно-мозговых нервов, асимметрия сухожильных и снижение брюшных рефлексов. Наблюдаются также патологические рефлексы (Россолимо, Бабинского). У некоторых отмечается пирамидная недостаточность (нарушения мелкой моторики, эпилептические припадки, паралич глазодвигательного нерва, парезы руки и ноги, параличи, судороги ночью).
Степень неврологических расстройств отражает индивидуальную чувствительность нервной ткани к уровню глюкозы. Стволовые нарушения проявляются нистагмом и парезом взора вверх. Нарушения кожной чувствительности в области корешков С3, Д4, L2-5. Левое полушарие мозга является более чувствительным к гипогликемическим состояниям, поэтому оно чаще поражается по сравнению с правым. Симптомы поражения обоих полушарий наблюдаются при тяжелом течении.
Наиболее характерные симптомы инсулиномы — повышение аппетита, чувство голода и ожирение. Некоторые больные съедают до 1 кг конфет в день. У большинства повышенный аппетит и голод появляются перед приступом. Однако у части больных аппетит может отсутствовать, и они испытывают отвращение к пище, поэтому крайне истощены. Такие больные требуют и внутривенного вливания белковых гидролизатов и глюкозы.
У некоторых мужчин по мере ухудшения течения заболевания развивается эректильная дисфункция. Она наиболее выражена в том случае, если гипогликемические приступы возникают ежедневно. У отдельных больных отмечаются мышечные боли, которые связывают с развитием дегенеративных процессов в мышцах и замещением их соединительной тканью.
Анализы и диагностика
Диагностика является сложной задачей. Считается, что инсулиномы в первый год клинических проявлений диагностируются только у 10% больных. Правильный диагноз устанавливают только на третьем году заболевания.
В большинстве случаев для профилактики гипогликемии эффективно частое высокоуглеводное питание. Некоторым больным назначается медикаментозное лечение. Консервативное лечение назначается при отказе больного от операции, перед операцией, неоперабельной злокачественной опухоли и наличии метастазов.
Медикаментозное лечение предусматривает:
- устранение симптомов гипогликемии (диазоксид, глюкокортикоиды);
- контроль гипогликемии и пролиферации злокачественной опухоли (аналоги соматостатина — Октреотид-депо, Сандостатин Лар, Ланреотид);
- химиотерапию (5-Фторурацил, стрептозотоцин, Эпирубицин-Эбеве);
- иммунотерапию (интерферон альфа).
К средствам, повышающим уровень глюкозы, относятся адреналин, норадреналин, глюкагон и глюкокортикоиды. Эти препараты дают кратковременный эффект, поэтому их использование ограничено.
Глюкокортикоиды для получения эффекта нужно применять в высоких дозах, что опасно развитием кушингоидного синдрома. Положительное влияние на уровень глюкозы оказывает диазоксид (Гиперстат), который тормозит секрецию инсулина. Применяется по 100-600 мг/сутки в 3 раза. Эффект наступает через час и длится несколько часов. Нужно учитывать, что препарат задерживает воду в организме вызывает отечный синдром. Поэтому прием диазоксида сочетают с мочегонными средствами, а комбинация его с тиазидными диуретиками усиливает гипергликемический эффект.
Для контроля злокачественной инсулиномы используются аналоги соматостатина — Октреотид, Октреотид-Депо и другие, которые подавляют секрецию многих пептидов гастропанкреатической системы (инсулин, гастрин, глюкагон, соляная кислота), а также их действие на периферии. Кроме этого, они оказывает умеренное противоопухолевое и антипролиферативное действие. У пациентов с неоперабельными опухолями препарат хорошо контролирует гликемию без одновременного снижения инсулина. Назначается в виде частых инъекций в течение дня или раз в месяц (пролонгированные формы).
Химиотерапия
При больших размерах опухоли и метастазах, для лечения низкодифференцированного рака применяется химиотерапия самостоятельно или в комбинации с аналогами соматостатина. Эффективным считается препарат стрептозотоцин, который оказывает избирательную деструкцию островковых клеток железы. К этому препарату чувствительны 50-60% пациентов. У половины больных отмечается уменьшение в размерах метастазов и первичной опухоли. Вводится внутривенно в виде инфузий в суточной дозе 2 г, курсовая доза составляет 30 г.
Как и все химиотерапевтические препараты, он имеет побочные эффекты — тошнота, рвота, диарея, нефротоксичность, анемия, гепатотоксичность. При отсутствии чувствительности к этому препарату применяются препараты доксорубицина и 5-фторурацила. К улучшению течения приводит сочетанное назначение стрептозотоцина, фторурацила и Октреотида.
Хирургическое лечение
Радикальным методом лечения является хирургический. В большинстве случаев инсулиномы поддаются хирургическому лечению и после операции у больных нормализуется содержание сахара и инсулина.
Затрудняют выполнение операций следующие моменты:
- Труднодоступность области.
- Небольшие размеры опухоли. Большинство опухолей железы имеют размеры 0,5-2 см и их трудно обнаружить во время операции. Бывают случаи, когда их не удается обнаружить при даже при второй и третьей операции.
- Соседство опухоли с жизненно важными органами.
- Близость к нервным сплетениям.
- Повышенная чувствительность железы к операционной травме, что влечет деструктивные изменения в ней.
В связи с этим важно проводить интраоперационное УЗИ (во время операции), позволяющее точно определить локализацию образования и скорректировать тактику проведения операции. Для этого вскрывается сальниковая сумка, делают ревизию поджелудочной железы и проводят УЗИ, на котором определяется округлое гипоэхогенное образование, ограниченное от здоровой ткани.
Объем вмешательства определяется размером, типом и локализацией образования. При доброкачественной инсулиноме небольшого размера, локализующейся в теле или хвосте, возможно проведение энуклеации или средней панкреатэктомии. Эти операции максимально сохраняют здоровую ткань и снижают риск развития недостаточности функции.
Энуклеация проводится, если опухоль:
- доброкачественная;
- размеры ее 2-3 см;
- поверхностно расположена;
- не соприкасается с панкреатическим протоком.
Дистальная резекция выполняется при:
- расположении в глубине тела и хвоста;
- близости к сосудам и протоку;
- злокачественной опухоли.
Удаление поджелудочной железы показано при:
- прилежании опухоли к панкреатическому протоку;
- локализации в глубине головки;
- расположении возле протока железы;
- множественных очагах;
- нечетких границах опухоли и размерах более 4 см, что свидетельствует о злокачественности.
Точно судить о злокачественности можно на основании морфологических данных, отдаленных метастазах и прорастании опухоли.
После операции часты осложнения: панкреатический свищ, деструктивный панкреатит, абсцесс в полости, псевдокиста, перитонит. Хорошим результатом лечения считается исчезновение гипогликемии и нормализация уровня глюкозы и инсулина. У большинства больных после операции нормализуются вес, улучшается память и повышается работоспособность. У 10% после операции не исчезают симптомы энцефалопатии.
У лиц пожилого возраста или при тяжелом состоянии больного применяются менее инвазивные операции:
Читайте также:
