Калликреин-кининовая система при бронхиальной астме.
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Одной из важнейших физиологических систем организма является калликреин-кининовая система (ККС), играющая центральную роль в регуляции активности каскадных протеолитических систем – кининогенеза, свёртывания крови, фибринолиза (см. 3.14.2.4), комплемента (см. 3.10.3), ренин-ангиотензивной системы (3.16) – и обеспечивающая процессы адаптации и защиты организма. Благодаря деятельности ККС осуществляется контроль над различными стадиями морфогенеза клеток отдельных тканей, иммунитетом, развитием воспаления, возникновением злокачественных новообразований и другими патологическими процессами.
В норме ККС совместно с ренин-ангиотензин-альдостероновой системой (РААС) регулирует локальную микроциркуляцию (см. 3.16). При этом, если преобладает активность РААС, то наступает сокращение артериол и повышение кровяного давления. Усиление же активности калликреин-кининовой системы ведёт к местному расширению сосудов и покраснению кожи, что, в частности, наблюдается при воспалении (эритема).
В настоящее время известно, что калликреины относятся к трипсиноподобным сериновым протеиназам и делятся на плазменные и тканевые. Плазменный калликреин имеет ММ, равную приблизительно 90 кДа. Тканевые калликреины (ихне менее десяти) содержатся в тканях некоторых органов и их секретах – в поджелудочной железе, слюнных железах, стенке кишечника, почках и моче, половых и потовых железах. Их ММ колеблется от 24 до 40 кДа.
В плазме крови активность калликреина контролируют инактиватор первого компонента комплемента (С1-ina), a2-макроглобулин и в меньшей степени – антитромбин III и инактиватор PrC. Активность тканевых калликреинов регулируется тканевыми и плазменными серпинами, среди которых выделяется a1-протеазный ингибитор и инактиватор PrC.
Прекалликреин по своей природе является гликопротеином и состоит из одной пептидной цепочки, включающей 619 аминокислотных остатков. Основное место синтеза прекалликреина – гепатоциты.
Кининогены являются полифункциональными гликопротеидами, молекулы которых состоят из одной полипептидной цепи. Синтезируются кининогены в основном гепатоцитами, но перед тем как секретироваться в кровоток, они подвергаются посттрансляционному гликолизированию. В плазме крови человека существует два вида кининогена: высокомолекулярный (ВМК) с ММ около 120 кДа (состоит из 626 аминокислотных остатков) и низкомолекулярный (НМК) с ММ около 65 кДа (состоит из 409 аминокислотных остатков).
Период полураспада брадикинина в большом круге кровообращения равен 17-24 секундам, но еще быстрее он разрушается в малом круге кровообращения. Это обусловлено наличием в крови и тканях высокоактивных ферментов – киназ, осуществляющих контроль за уровнем кининов. Киназы, разрушающие брадикинин, относятся к металлоферментам, гидролизующим отдельные пептидные связи в молекуле брадикинина и тем самым переводящим его в неактивные продукты. Расщепление любой из имеющихся 8 пептидных связей приводит к полной или частичной инактивации брадикинина. Наиболее важную роль в метаболизме брадикинина играют кининаза I (аргинин-карбоксипептидаза) и кининаза II (карбоксикатепсин или ангиотензин-I-превращающий фермент).
Активация прекалликреина происходит за счет его расщепления аквированным фактором Хагемана (XIIa) с образованием легкой и тяжелой цепей, связанных дисульфидной связью. Появившийся после активации прекалликреина калликреин обладает чрезвычайно широким спектром функций. Под его влиянием расщепляются две пептидные связи в ВМК, благодаря чему освобождается брадикинин, регулирующий течение многих физиологических функций и способствующий возникновению патологических состояний. Следует, однако, заметить, что активация прекалликреина под воздействием фактора XIIa осуществляется лишь на поверхности, в том числе на анионной поверхности поврежденного эндотелия, на коллагене, кристаллах уреатов и др.
В контактной системе активации участвуют 4 белка: прекалликреин, факторы XII и ХI свёртывания крови и ВМК. В результате конформационных изменений и протеолитического расщепления образуются высокоактивные биологические продукты – калликреин, факторы XIIa, XIa и ВМКа. Следует также заметить, что существуют как минимум 2 формы активного фактора Хагемана – a и b (aXIIa и bXIIa), обладающие различными биологическими эффектами.
В настоящее время контактная система активации рассматривается как триггерный механизм, запускающий активацию всех 5 протеолитических систем плазмы крови: свёртывание, фибринолиз, комплемент, калликреин-кининовую и ренин-ангиотензивную, действующих совместно и обеспечивающих течение адаптационных реакций организма в меняющихся условиях окружающей среды.
В результате активации калликреин-кининовой системы образуются кинины, превращающиеся под воздействим аминопептидаз в брадикинин.
Следует также обратить внимание на то, что в сердце находится «собственная» калликреин-кининовая система. В частности, в гомогенатах сердца обнаружена кининогеназа, активируемая трипсином. Существуют факты, доказывающие, что в сердце образуется калликреин и кининоген. Предполагается, что кинины облегчают локальный рилизинг норадреналина и тем самым приспосабливают деятельность сердца к стрессорным воздействиям.
Какие же функции выполняет калликреин-кининовая система?
1. Принимает участие во внутреннем механизме образования протромбиназы, благодаря активации фактора XIa;
2. Обеспечивает через фактор XIIa и калликреин взаимосвязь между внешним и внутренним путем образования протромбиназы, активируя факторы VII и XI.
3. Активирует фибринолиз. Недавно установлено, что не только калликреин, но и факторы XIIa и XIa способны непосредственно активировать плазминоген, переводя его в плазмин. Кроме того, калликреин является проактиватором проурокиназы и плазминогена. Однако наиболее эффективно активация проурокиназ происходит при связывании калликреина через ВМК с рецептором урокиназы.
4. Участвует в регуляции основных биологических функций сосудистой стенки. В частности, брадикинин расширяет просвет периферических и коронарных артерий, тем самымым снижая артериальное давление и повышая проницаемость капилляров. За последние годы установлена тесная связь между образованием брадикинина и высвобождением из эндотелия простациклина и эндотелиального фактора гиперполяризации.
5. Ферменты кининовой системы активируют С1-компонент комплемента и проренин, а также стимулируют активацию нейтрофилов либо непосредственно, либо через высвобождение брадикинина.
6. Кинины принимают участие в возникновении воспаления, обеспечивая местное развитие его основных признаков;
7. Под влиянием кининов происходит усиление секреции IL-1, TNFa, IL-8, а также простагландинов и лейкотриенов.
8. Кинины оказывают влияние на продукцию и секрецию оксида азота (NO), расширяющего кровеносные сосуды и являющегося мощным дезагрегантом тромбоцитов, активатором фибринолиза и медиатором в ЦНС.
9. Под воздействием брадикинина усиливается сокращение гладкой мускулатуры бронхов и других органов и стимулируется болевой эффект. Брадикинин обладает инсулиноподобным действием, способствует усвоению глюкозы периферическими органами, модулирует передачу нервных импульсов в ЦНС.
Калликреин-кининовая система при бронхиальной астме.
Калликреины, брадикинин, калледины в очаге воспаления.
При обструктивных воспалительных процессах бронхов, формировании респираторного дистресс-синдрома взрослых отмечается увеличение в несколько раз содержания МБР в очаге воспаления. Наибольшую концентрацию этого соединения можно обнаружить В тканях при анафилаксии и атопических процессах. Имеются сведения о том, что при бронхиальной астме главный основной белок способен повреждать эпи-телиоциты бронхов и тем самым увеличивать выраженность воспалительного процесса. Его содержание в мокроте больных коррелирует со степенью тяжести бронхиальной астмы.
Выделяют плазменные, с молекулярной массой до 97 кДа, и тканевые калликреины, имеющие молекулярную массу 33-36 кДа. Калликреины, воздействуя на а, глобулины плазмы, способствуют образованию брадикинина и каллидина, состоящих соответственно из 9 и 10 аминокислотных остатков. Основная физиологическая роль компонентов калликреин-кининовой системы в норме связана с регуляцией тонуса и проницаемости сосудов микроциркуляторного русла. В условиях острого и хронического воспаления выраженное активирование компонентов этой системы сопровождается увеличением экссудативных процессов в очаге воспаления за счет повышения проницаемости сосудистой стенки и увеличения локального кровотока из-за сосудорасширяющего действия кининов.
Калликреин принимает активное участие в регуляции процессов фагоцитоза, оказывая влияние на хемотаксис нейтрофильных лейкоцитов.
Чрезмерное активирование компонентов калликреин-кининовой системы сопровождается усилением сосудистых воспалительных реакций, увеличением гидростатического давления ,во внеклеточной среде, нарастанием отека ткани, ухудшением ее обеспечения кислородом и субстратами биологического окисления. Вследствие этого происходит перерастание компенсаторно-приспособительных реакций в патологические, результатом чего является увеличение зоны вторичной альтерации.
Из других факторов, избыточное активирование которых придает преимущественно патологическую направленность воспалительному процессу, следует отметить систему комплемента, лизосомальные ферменты, катионные белки, лимфокины и монокины.
Система комплемента оказывает влияние не течение всех стадий воспаления за счет как воздействия на альтерацию и экссудацию, так и фагоцитарную активность нейтрофилов и макрофагов, индукцию иммунного ответа. Например, С1 - приводит к усилению экссудативных процессов, СЗа и С5а - способствует увеличению проницаемости сосудистой стенки, активированию процессов высвобождения гистамина из тучных клеток, СЗ и С5 - активируют хемотаксис, С5 и С9 - обладают цитоклитической активностью.

Лизосомальные ферменты в очаге воспаления накапливаются в результате их высвобождения из лизосом нейтрофильных лейкоцитов, макрофагов и клеток поврежденной в ходе альтерации ткани. Выделяясь в значительном количестве в очаге воспаления, ферменты лизосом усиливают вторичную альтерацию, повреждают как внутриклеточные мембраны, так и плазмолемму. Гидролитическое расщепление компонентов базальной мембраны микрососудов и повреждение плазмолеммы эндотелиозцитов сопровождаются выраженным увеличением проницаемости сосудистой стенки и усилением экссудативных процессов.
Катионные белки выделяются в значительном количестве нейтрофильными лейкоцитами. Обладая широким спектром биологической активности, они воздействуют на все стадии воспалительного процесса. К основным их эффектам следует отнести повышение проницаемости сосудистой стенки, усиление экссудации, индукцию высвобождения гистамина тучными клетками.
В очаге воспаления отмечается увеличение концентрации лимфокинов и монокинов, оказывающих влияние на фагоцитоз, хемотаксис и пролиферативные процессы. Избыточное накопление этих веществ сопровождается усилением цитолитических процессов.
L-аргинин + НАДФН2 + О2-» NO + L-цитруллин
Высокая активность синтетазы окиси азота определяется в эндотелиоцитах. Ее уровень коррелирует с содержанием в клетке комплекса Са-кальмодулин. Рост содержания в эндотелиоцитах окиси азота происходит при поступлении в цитозоль Са.
Предполагается, что к числу многочисленных свойств этого соединения следует отнести его участие в процессах межклеточного взаимодействия, регуляции сосудистого тонуса и проходимости бронхов.
Положительное действие окиси азота при воспалении, связанное с активированием его высвобождения из L-аргинина, заключается в антимикробных свойствах этого соединения и влиянии на процессы миграции полиморфноядерных лейкоцитов через стенку капилляра. При воспалении создаются условия для чрезмерного образования окиси азота. Ключевым механизмом этого процесса следует считать возрастание в очаге воспаления уровня активности синтетазы окиси азота, которая активируется в присутствии комплекса Са-кальмодулин. Возрастание в цитозоле свободного кальция при воспалении непременно должно сопровождаться ростом активности фермента, катализирующего синтез окиси азота. Чрезмерное накопление окиси азота клетками воспалительного очага приводит к иммунодепрессии, снижению устойчивости цитоплазматических мембран к гипоксическому воздействию. Токсические концентрации этого соединения приводят к необратимым нарушениям микроциркуляции, что негативно влияет на течение воспалительного процесса в целом.
По мере развития воспалительного процесса в его очаге происходит накопление биологически активных веществ, обладающих преимущественно противовоспалительными эффектами. Помимо окиси азота к ним следует отнести простациклин и аденозин.
Простациклин синтезируется эндотелиоцитами и имеет биологические эффекты, сходные с окисью азота. Рост концентрации этого соединения сопровождается снижением аггрегации тромбоцитов и улучшением за счет этого процессов микроциркуляции. В условиях наблюдаемого при воспалении активирования свободно-радикального окисления простациклин обладает протекторными свойствами, защищает цитоплазматические мембраны эндотелиоцитов от деструкции.
Выделяющийся в очаге воспаления аденозин оказывает положительное влияние на течение воспалительного процесса за счет стабилизации проницаемости сосудистой стенки и уменьшения процессов экстравазации жидкости. В условиях избыточных концентраций аденозина наблюдается уменьшение цитотоксических эффектов полиморфно-ядерных лейкоцитов.
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Калликреин-кининовая система играет большую роль в развитии иммунного и неиммунного воспаления и нарушениях микроциркуляции, поскольку в структурном и функциональном отношениях находится в связи со свертывающей и фибринолитическими системами в рамках единой системы фактора Хагемана, а калликреин является основным ферментом, образующим кинины и модулирующим активность общего для этих систем фактора Хагемана. Калликреин-кининовая система состоит из кининов, кининообразующих и кининразру-щающих ферментов, и их дисбаланс приводит к патологии. Существует наследственная предрасположенность к такому дисбалансу: есть люди, обладающие генетически более мощным потенциалом биосинтеза калликреина, а другие - его ингибиторов.
При бронхиальной астме обычно увеличено образование и накопление кининов, снижена ингибиторная активность кининазы и двух высокомолекулярных ингибиторов калликреина - медленнодействующего и быстродействующего (МИК и БИК соответственно), что часто сочетается с нарушением микроциркуляции: показано, что лечение тренталом, сопровождаемое улучшением диффузного и локального кровотока в легких, приводит к усилению ингибиторной активности крови по содержанию в ней БИК и МИК. С помощью COMOD-технологии нами выделены группы больных, у которых по совокупности статистически достоверно связанных признаков показана ведущая роль дисбаланса калликреин-кининовой системы в патогенезе бронхиальной обструкции, в частности при преобладающем отечном механизме нарушения бронхиальной проходимости, что встречалось при различных вариантах воспаления бронхов, в том числе при преобладании в бронхиальном смыве неизмененного эпителия бронхов.
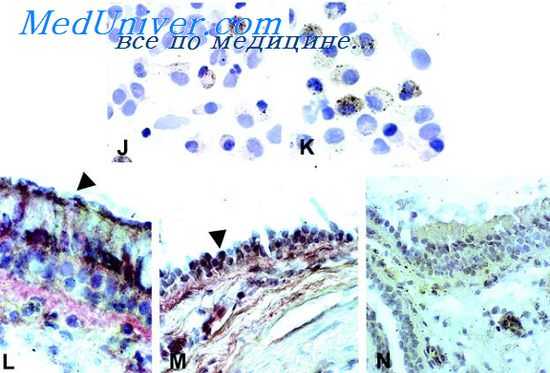
Помимо вирусной инфекции, возможной причиной активации калликреин-кининовой системы при легочной патологии является блокирование кининазы II (нейтральной эндопептидазы), которая содержится в специальных микровезикулах легочного эндотелия, повреждаемого лизосомальными ферментами и вазоактивными веществами, в результате чего активируется фактор Хагемана и инициируется гемокоагуляция по внутреннему пути, а выделение тканевого тромбопластина из поврежденных клеток активирует гемокоагуляцию по внешнему пути, что, в итоге, может проявиться ДВС-синдромом. Снижение активности кининаз у больных бронхиальной астмой приводит к относительному дефициту ингибитора протеаз, что способствует воспалительной реакции. Участие брадикинина в воспалительных реакциях при болезнях легких связывают с изначальным повреждением эпителиальных клеток, в которых находятся терминалы "С"-фибрилл, через которые вовлекаются в воспаление не только холинэргические механизмы, но также выделяются нейролептиды - высокоактивные пептиды, образуемые нейросекреторными клетками АПУД-системы. Важнейшие медиаторы нейрогенного воспаления - вещество "Р" и нейрокинины выделяются путем антидромного аксон-рефлекса при возбуждении ирритантных рецепторов, что особенно типично при повышенной десквамации эпителия.
Активация аксон-рефлекса приводит к расширению сосудов, увеличению кровотока, отеку и нарушениям микроциркуляции, причем нейропептиды показывают сосудистую реакцию даже в следовых количествах, недостаточных для реакции гладких мышц бронхов, поэтому, возможно, что гиперемия и отек у больных бронхиальной астмой связаны, прежде всего, с выделением нейропептидов. Нейрокины метаболизируются нейтральной эндопептидазой базальных клеток эпителия дыхательных путей, повреждение которого типично для вирусной инфекции, что приводит к снижению активности этого фермента, а также сопровождается дисбалансом калликреин-кининовой системы, поскольку этот же фермент метаболизирует брадикинин.
Таким образом, обмен нейропептидов и развитие нейрогенного воспаления, чему способствует брадикинин, тесно связаны с дисбалансом калликреин-кининовой системы, и этот механизм может реализоваться в выделенной нами группе больных бронхиальной астмой.
Совершенно иной по своим характеристикам оказалась вторая группа больных с повышенной десквамацией эпителия бронхов, выделенная COMOD-технологией. У всех больных оказались значительные нарушения бронхиальной проходимости, в диагностически значимых титрах определялась патогенная или непатогенная микрофлора в бронхиальном дереве, выявлен "макрофагальный дефицит", снижение числа Т-лимфоцитов в периферической крови, а также другие иммунные нарушения: увеличение ЦИК, повышение концентрации IgE и активности кислой фосфатазы, что в сочетании со снижением показателя "диффузия легких" (менее 80% должной величины) позволяет предположить развитие микроваскулита легочных сосудов, вызывающего свеобразный сосудистый вариант бронхиальной астмы.
Обнаружение большого количества ресничных и бокаловидных клеток среди клеток эпителия бронхов позволило выделить с помощью COMOD-технологии третью группу больных бронхиальной астмой, в состав которой вошли больные как атопического, так и инфекционно-зависимого клинико-патогенетических вариантов бронхиальной астмы, у которых в генезе болезни существенную роль играет бокаловидноклеточная гиперплазия, сопровождаемая гиперсекрецией и дискринией мокроты. У всех больных этой группы определялась НГБ по пробе с ацетилхолином, и выявлена статистически достоверная связь (знак связи отрицательный) между дозой ацетилхолина и количеством бокаловидных клеток в бронхиальном смыве, что подтверждает роль бокаловидноклеточной гиперплазии в развитии НГБ.
У больных выявлены также признаки вирусной инфекции (серологически и иммунофлуоресцентными методами, без клинических признаков ОРВИ), которая может способствовать гиперплазии бокаловидных клеток, слущиванию эпителия бронхов и изменениям состава слизи. Возрастание в бронхиальном смыве числа ресничных клеток - показатель выраженного повреждения цилиарного эпителия и возможное свидетельство ослабления его связи с базальными клетками и базальной мембраной, что способствует проникновению в подслизистую аллергенов и других стимуляторов воспаления, и чаще является вторичным, но не исключено, что у некоторых больных бронхиальной астмой нарушение десмосом и ослабление связи эпителия с базальными клетками - первичный дефект. В настоящее время также показано, что бронхиальный эпителий выделяет провоспалительные цитокины, привлекающие в просвет бронхов эозинофилы и нейтрофилы, а также RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted), влияющие на многие клетки воспаления, в том числе на Т-лимфоциты и моноциты. Бронхиальный эпителий выделяет также окись азота (N0) под влиянием различных стимулов, в частности фактора некроза опухолей. Окись азота вызывает бронходилатацию и функционально уравновешивает действие других факторов, в частности эндотелина, выделяемых также эпителием бронхов и осуществляющих бронхоконстрикцию и вазоконстрикцию, а у больных бронхиальной астмой баланс выделения этих веществ при повреждении эпителия нарушается, что может играть роль в генезе бронхоконстрикции.
С другой стороны, вазодилатация, вызванная N0, может быть вредна, т.к. она увеличивает пропотевание плазмы, что поддерживает воспаление, тем более, что у больных бронхиальной астмой обнаружены поры в васкуляр-ном эндотелии, способствующие экссудации плазмы. Все это, а также ряд других феноменов, указывающих на роль эпителия в генезе воспаления бронхов, описанных ранее, подтверждают значимость обнаружения повышенного количества эпителия бронхов в лаважной жидкости БА и позволяют говорить о своеобразном десквамативном бронхите у некоторых больных. Если описание бронхиальной астмы как эозинофильного бронхита относится к 1916 году, то в настоящее время С. Person ставит вопрос: "не назвать ли бронхиальной астму десквамативным бронхитом?".
Краткая характеристика неэозинофильных вариантов воспаления бронхов у больных бронхиальной астмой, выделенных с помощью COMOD-технологии, представлена в таблице.
Патогенетические особенности. У всех больных - профессиональные вредности и первичное развитие токсического или пылевого бронхита, колонизация бронхиального дерева микрофлорой и вторичное присоединение бронхиальной астмы.
Имеются причинно-значимые неинфекционные аллергены, часто -признаки вирусной инфекции; преимущественно дистальные нарушения бронхиальной проходимости. У некоторых больных - дефицит эндогенных глюкокортикоидов.
Имеются причинно-значимые неинфекционные аллергены и признаки вирусной инфекции, особенности изменения активности ККС.
Выявляется патогенная или непатогенная микрофлора в диагностически значимых титрах, иммунные нарушения. У некоторых больных возможен иммунный микроваскулит легочных сосудов.
Важную роль в развитии гиперчувствительности бронхов играет гиперсекреция и дискриния. Нарушена связь эпителия с базальными клетками, не исключено, что у некоторых больных это - первичный дефект. У некоторых больных выявляются причинно-значимые неинфекционные аллергены, у других - колонизация микрофлорой бронхиального дерева и признаки инфекционно-зависимой бронхиальной астмы.
Варианты эозинофильного воспаления при бронхиальной астме.
Показано, что у больных бронхиальной астмой существует спонтанная продукция "гистамин-освобождающего фактора" мононуклеарами, связанная, в частности, с иммунными нарушениями. Важную роль играют процессы кооперации тучных клеток с макрофагами-протаганистами воспаления при бронхиальной астме: медиаторы тучных клеток усиливают метаболическую активность макрофагов и выделение ими эйкозаноидов.
При эозинофильно-макрофагальном воспалении нами с помощью COMOD-технологии удалось выделить на основе статистически достоверно связанных признаков состояния группу больных со сравнительно коротким анамнезом бронхиальной астмы, отсутствием признаков необратимой обструкции, доказанной вирусной (серологическими методами) и бактериальной инфекциями, а также с выраженными иммунными нарушениями (повышение ЦИК и снижение Т-лимфоцитов). У всех больных отмечалась эозинофилия периферической крови и повышение уровня свободного серотонина крови, а у некоторых больных - повышение давления в легочной артерии.
Все эти данные укладываются в концептуальную модель иммунного васкулита легочных микрососудов и позволяют предположить аутоиммунный клинико-патогенетический вариант бронхиальной астмы, развившийся, возможно, на фоне инфекционно-зависимого. Повреждение легочных сосудов привело к нарушению инактивации серотонина эндотелием легочных сосудов, и маркером этого является повышение уровня свободного серотонина в крови. Серотонин является одним из наиболее важных БАВ, инактивация которого нарушается при легочной патологии, в частности при бронхиальной астме.
Эозинофильно-моноцитарный вариант воспаления оказался у некоторых больных атопической бронхиальной астмы (аллергия к домашней пыли) с иммунными нарушениями (повышение IgM и ЦИК, увеличение индекса торможения миграции мононуклеаров) и косвенными признаками нарушений микроциркуляции (преобладание отечного механизма в генезе бронхообструкции, нарушение вентиляционно-перфузионных соотношений при незначительных изменениях вентиляции). При этом было повышено количество моноцитов в периферической крови (> 8%).
Эти данные не противоречат концепции иммунных нарушений, связанных с активностью макрофагально-моноцитарной системы и, в частности, с патологической функцией моноцитов у выделенной группы больных атопической БА, о чем было написано ранее.

Более подробная оценка различных эпителиальных клеток, обнаруживаемых в бронхиальном смыве, позволила нам выделить еще один вариант эозинофильного воспаления, представленный увеличенным количеством эозинофилов и бокаловидных клеток.
Увеличение количества бокаловидных клеток-показатель бокаловидно-клеточный гиперплазии эпителия бронхов, что является доказательством гиперпродукции слизи, как правило, с измененными у больных бронхиальной астмой и другими ХНЗЛ свойствами. Имеются данные о том, что у некоторых больных бронхиальной астмой гиперплазия бокаловидных клеток, гиперсекреция слизи и изменение ее свойств являются ведущими в патогенезе бронхиальной астмы. Защитные свойства нормальной бронхиальной слизистой оболочки связаны с глюкоконъюгатами бокаловидных клеток, поскольку слизистые железы не содержат сиаломуцинов, а нарушение содержания и распределение гликопротеинов в эпителиоцитах бронхов, в частности в бокаловидных клетках, может способствовать персистенции микроорганизмов в структурах бронхиальной стенки. Нами выявлена связь увеличения бокаловидных клеток с формированием эозинофильного воспаления и неспецифической гиперчувствительности бронхов. Характеристику эозинофильных вариантов воспаления см. в таблице.
Патогенетические особенности. Причинно-значимы неинфекционные аллергены. Привлечение нейтрофилов (если оно происходит) вторично и иногда может быть связано с колонизацией бронхов микрофлорой без клинических признаков инфекционного воспаления.
Первичен хронический бронхит и колонизация бронхов микрофлорой. Эозинофильное воспаление и бронхиальной астма присоединяются вторично.
Существенная роль микрофлоры и вирусов, преобладают дистальные нарушения бронхиальной проходимости по механизму отека, существенна роль нарушений функции легких по инактивации БАВ. У многих больных нарушения микроциркуляции, возможен аутоиммунный васкулит.
У многих больных колонизация микрофлорой бронхиального дерева. Имеются признаки иммунных нарушений, значительная эозинофилия периферической крови, признаки нарушения функции инактивации БАВ легкими. У некоторых больных - повышено давление в легочной артерии, возможен иммунный микроваскулит легочных сосудов.
Признаки нарушения микроциркуляции и иммунных нарушений связанных с изменением активности моноцитов у больных с наличием причинно-значимых неинфекционных аллергенов.
Существенную роль в развитии неспецифической гиперчувствительности и гиперреактивности бронхов играет бокаловидно-клеточная гиперплазия и сопутствующая ей гиперсекреция слизи и дискриния мокроты.
Роль калликреин-кининовой системы
Активация этой системы приводит к образованию кининов (схема 4). Кинины- группа биологически активных нейровазоактивных полипептидов. Наиболее изученной является калликреин-кининовая система плазмы крови и один из кининов - нонапептид брадикинин.
Физиологическое значение кининов основано на том, что они оказывают непосредственное влияние на тонус и проницаемость сосудистой стенки, вызывая расширение прекапиллярных сосудов и увеличивая проницаемость капилляров. В связи с этим кинины играют особую роль в органах, периодически экскретирующих значительные количества жидкости (слюнные железы, поджелудочная железа, потовые железы, желудок, кишечник).
Активация калликреин-кининовой системы происходит при действии на организм различных повреждающих факторов, нарушающих целостность клеток и тканей и приводящих, как правило, к активации фактора Хагемана.Это - травмы, токсины, облучение, накопление продуктов обмена веществ (например, кристаллов мочекислого натрия), ишемия и др. Обычно в результате местных повреждающих воздействий развивается воспаление. В его развитии определенную роль играет увеличение содержания кининов, которые через изменение сосудистой реакции оказывают влияние на интенсивность и характер воспаления, а также участвуют в формировании чувства боли. Участвуют кинины и в развитии общих реакций организма на повреждение, причем главным образом в формировании компенсаторно-приспособительных механизмов, и только в случаях неадекватного их образования кинины могут стать патогенетическим фактором различных расстройств.
Одно из таких компенсаторно-приспособительных влияний выявляется в генерализованном действии на гемодинамику. При определенной концентрации кинины уменьшают периферическое сопротивление сосудов малого и большого кругов кровообращения, что увеличивает возврат крови к сердцу, а это, в свою очередь, увеличивает ударный объем обоих желудочков сердца. Этот механизм может включаться при срочных или длительных адаптивных реакциях организма в условиях действия на него различных факторов в виде эмоциональных или физических нагрузок, тепла, гипоксии и др. При острой ишемии и инфаркте миокарда компенсаторная роль увеличенного образования кининов сводится к расширению сосудов миокарда и увеличению сердечного выброса, а также к развитию гипотензии, что облегчает работу сердца и вызывает перераспределение крови. Неадекватность активации калликреин-кининовой системы может стать патогенетическим фактором развития фатальной гипотензии, шока, болевого эффекта (кардиогенный шок).
Кинины принимают участие в развитии реакций
Глава 3 / МЕСТНЫЕ И ОБЩИЕ РЕАКЦИИ ОРГАНИЗМА НА ПОВРЕЖДЕНИЕ
при аллергической альтерации тканей. Аллергическое воспаление, как и обычное, также сопровождается увеличением концентрации кининов. Их обнаруживают в экссудате суставов при ревматоидном артрите, причем иногда в довольно значительной концентрации. Отмечают их увеличение в крови и спинно-мозговой жидкости у собак с экспериментальным аллергическим энцефаломиелитом, в миокарде и плазме крови кроликов с экспериментальным аллергическим миокардитом.
Установлено 10-15-кратное увеличение содержания кининов в крови больных людей во время обострения бронхиальной астмы. Очевидно, кинины играют определенную роль в развитии бронхоспазма, так как обладают способностью вызывать при определенной концентрации спазм гладкой мускулатуры бронхиол. Сокращение гладкомышечных клеток при взаимодействии кининов с рецепторами клетки приводит к активации кальциевых каналов и поступлению кальция в цитоплазму, где он и стимулирует процесс сокращения. Это действие усиливается на фоне снижения активности Р-адренергических рецепторов, а последнее, как правило, выявляется у больных бронхиальной астмой. Поэтому может сложиться и такая ситуация, когда концентрация кининов, недостаточная для того, чтобы вызвать бронхоспазм у здорового человека, будет вызывать его у больного, имеющего сниженную активность р-адренергических рецепторов.
Активация калликреин-кининовой системы обнаружена при шоках различной этиологии,
ревматизме, нефритах, артритах, карциноидном и демпинг-синдромах, атеросклерозе, гипертонической болезни и ряде других заболеваний. Соотношение защитного и патогенного компонентов в каждом конкретном случае различно. Применяя ингибиторы протеолиза, можно ограничить активность калликреин-кининовой системы, а следовательно, выраженность соответствующих симптомов и интенсивность развития патологического процесса.
Роль системы комплемента
Комплемент - система функционально связанных сывороточных белков, активация которых приводит к образованию биологически активных веществ, участвующих в осуществлении защитных реакций организма. Комплемент обозначают буквой «С», а его компоненты - соответствующей цифрой. При обозначении активированного компонента над цифрой ставится черточка: CI, C2 и т. д. Различают два пути активации комплемента: классический и альтернативный.
Классический путь активируется комплексом Аг + Ат (схема 5).
Как видно из схемы, в процессе активации происходит расщепление ряда компонентов С с образованием активных продуктов. Некоторые из них уходят из цепи активации, другие объединяются. Конечным этапом активации является образование комплекса С5-9, оказывающего цитотоксическое действие на клетки-мишени (клетки тканей, микробы с фиксированными на них антителами). Если проанализировать эффек-
Часть I. ОБЩАЯ НОЗОЛОГИЯ
Схема 5 Классический путь активации комплемента и биологические эффекты продуктов его активации
Процесс начинается с присоединения к антителу комплексов Clq, а затем С1г. Последний приобретает протеазную активность и расщепляет Cls, в результате чего он превращается в активную эстера-зу. Происходит активация первого компонента -Clq. В свою очередь С1 вызывает расщепление С4 и С2. Из фрагментов С4в + С2а образуется активный компонент С4в2а, являющийся конвертазой третьего компонента - СЗ-конвертазы. Она расщепляет СЗ на два фрагмента: СЗа и СЗв. Последний компонент совместно с С4в2а принимает участие в активации последующих компонентов комплемента.
гы различных компонентов С, то окажется, что все они участвуют в развитии того или иного компонента воспалительной реакции. Поэтому сложилось представление, что биологический смысл активации Сзаключается в подключении к иммунной(специфической) реакции неспецифических механизмов защиты- фагоцитоза, воспаления, при помощи которых образовавшийся комплекс фиксируется и фагоцитируется.
Альтернативный путь активации С является важнейшим механизмом противоин-фекционной защиты и активируется бактериальными полисахаридами. Он включается быстро и без участия иммунных механизмов. В отличие от классического пути активация начинается с расщепления С с участием ряда дополнительных факторов. Процессы активации комплемента контролируются ингибиторами различных звеньев этой системы. Наиболее изучены С1- и СЗ-ингибиторы. С1-ингибитор эстеразы блокирует спонтанную активацию С1. Кроме того, он ограничивает активность калликреин-кининовой и фибринолитической систем.
Неконтролируемая активация комплемента приводит к развитию патологических процессов. Возможны генетически детерминированные дефициты отдельных ингибиторов, передающиеся по аутосомно-рецессив-ному типу. Так, при дефиците С1-ингибитора различные, даже не очень выраженные повреждения запускают начальную цепь классического пути активации комплемента до СЗ, которая обрывается СЗ-ингибитором. В результате формируется врожденный ангионевротический отек в связи с образованием С2в фрагмента, обладающего кининоподобной активностью (см. схему 5). При дефиците СЗ-ингибитора усиливается действие СЗ и нарушается функционирование альтернативного пути активации, что приводит кснижению противоинфекционной защиты с развитием тяжелых бактериальных инфекций (пневмония, отиты, гаймориты, менингиты).
Встречаются случаи дефицитов отдельных компонентов системы С. Они обычно передаются также по аутосомно-рецессивному типу и служат причиной бактериальных инфекций и вол-чаночноподобных синдромов.
Избыточная активация того или иного компонента комплемента является патогенетическим фактором ряда патологических процессов. Она лежит в основе многих случаев неиммунологических аллергических реакций (псевдоаллергических) на лекарственные препараты, принимает в той или иной степени участие в развитии некоторых видов шока, особенно септического. Последнее связано,с выраженными активирующими свойствами эндотоксина. Эндотоксин является универсальным активатором ряда
| Свертывание крови |
протеолитических систем (схема 6) плазмы крови. И если эта активация не носит лавинообразного характера, то только потому, что она ограничивается различными ингибиторами и механизмами обратной связи.
Активирующим действием обладают и некоторые эндогенно образующиеся ферменты. Так, трипсин, плазмин, калликреин могут запускать альтернативный путь активации комплемента. Все эти энзимы обычно активируются при различных повреждающих воздействиях.
Шок(от англ. shock - удар) - остро развивающийся синдром, характеризующийся резким уменьшением капиллярного (обменного, нутритивного) кровотока в различных органах, недостаточным снабжением кислородом, неадекватным удалением из ткани продуктов обмена и проявляющийся тяжелыми нарушениями функций организма.
Шок необходимо отличать от коллапса(от лат. collabor - падать, спадать), так как иногда одно и то же состояние обозначают то как шок, то как коллапс, например кардиогенный коллапс и кардиогенный шок. Это связано с тем, что в обоих случаях происходит падение артериального давления. Коллапспредставляет собой острую сосудистую недостаточность, характеризующуюся резким снижением артериального давления, уменьшением массы циркулирующей крови.Человек при этом теряет сознание. При шоке также снижается артериальное давление и затемняется сознание.
Однако между этими двумя состояниями имеются принципиальные различия. При коллапсе процесс развивается с первичной недостаточностью вазоконстрикторной реакции. При шоке в связи с активацией симпатоадреналовой системы вазоконстрикция резко выражена. Она же и является начальным звеном развития нарушений микроциркуляции и обмена веществ в тканях, получивших название шок-специфических (схема 7), которых нет при коллапсе. Например, при потере крови вначале может развиться геморрагический коллапс, а затем произойти трансформация процесса в шок. Есть еще некоторые различия между коллапсом и шоком. При шоках, особенно травматическом, восновном можно видеть две стадии в их развитии: возбуждения и угнетения. В стадии возбуждения артериальное давление бывает даже повышенным. При коллапсе нет стадии возбуждения и сознание выключается полностью. При шоках сознание спутано и выключается только на поздних стадиях и в тяжелых случаях развития.
По этиологии различают следующие виды шоков: 1) геморрагический;2) травматический;3) дегидратационный; 4) ожоговый; 5) кардиогенный; 6) септический; 7) анафилактический.
Естественно, что патогенез каждого вида шока имеет свои особенности развития, свои ведущие звенья. В зависимости от характера действующей причины и особенностей развивающегося повреждения основными ведущими патогенетическими звеньями становятся: гиповолемия(абсолютная или относительная), болевое раздражение, инфекционный процесс на стадии сепсиса.Их соотношение и выраженность при каж-
дом виде шока различны. Вместе с тем в механизмах развития всех видов шока можно выделить и общее звено. Им становится последовательное включение двух типов компенсаторно-приспособительных механизмов.
Первый (вазоконстрикторный) тип - активация симпатоадреналовой и гипофизарно-надпочечниковой систем. Они включаются ведущими патогенетическими звеньями. Гиповолемия абсолютная (потеря крови) или относительная (снижение минутного объема крови и венозного возврата к сердцу) приводит к снижению артериального давления крови и раздражению барорецепторов (см. схему 7), что через центральную нервную систему активирует указанный приспособительный механизм. Болевое раздражение, как и сепсис, стимулирует его включение. Результатом активации симпатоадреналовой и гипофизарно-надпочечниковой систем является выброс катехоламинов и кортикостероидов. Ка-техоламины вызывают сокращение сосудов, имеющих выраженную а-адренорецепцию: главным образом кожи, почек, органов брюшной полости. Нутритивный кровоток в этих органах резко ограничивается. Коронарные и мозговые сосуды не имеют этих адренорецепторов, поэтому не сокращаются. Происходит так называемая «централизация кровообращения»,т. е. сохранение кровотока в жизненно важных органах - сердце и мозге и поддерживается давление вкрупных артериальных сосудах. Именно в этом заключается биологическое значение включения первого типа компенсаторно-приспособительных механизмов. Однако резкое ограничение перфузии кожи, почек, органов брюшной полости вызывает их ишемию. Возникает гипоксия. Это включает второй (вазодилятаторный) типмеханизмов, направленных на ликвидацию ишемии. Начинают образовываться вазоактивные амины, полипептиды и другие биологически активные вещества, вызывающие расширение сосудов, повышение их проницаемости и нарушение реологических свойств крови. Значительный вклад в их образование вносят поврежденные ткани, в которых идет распад тучных клеток, активация протеолитических систем, выход из клеток ионов калия и др. Развивается неадекватность вазодилятаторного типа компенсаторно-приспособительных механизмов из-за избыточного образования вазоактивных веществ. Все вместе взятое изменяет микроциркуляцию в тканях, снижая капиллярный и усиливая шунтовой кровоток, изменяя реакцию прекапиллярных сфинктеров на катехоламины и увеличивая проницаемость капиллярных сосудов. Меняются реологические свойства крови, включаются «порочные круги». Это и есть шокспецифические изменения микроциркуляции и обмена (схема 8). Результатом этих нарушений является выход жидкости из сосудов в ткани и уменьшение венозного возврата. Включается «порочный круг» на уровне сердечно-со-
Читайте также:
