Обмен веществ плода и новорожденного.
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Физиология обмена жиров у плода и новорожденного ребенка
Наиболее выраженные изменения метаболизма липидов происходят при рождении. Эти изменения касаются скорости поступления в организм жирных кислот, их роли как источников энергии и значения для накопления жировой ткани. Плод получает жирные кислоты от матери путем переноса их через плаценту.
В случае преждевременных родов этот путь передачи прерывается. После рождения ребенка способность усваивать энергетические субстраты и нутриенты зависит от степени зрелости и функциональных возможностей ЖКТ. У недоношенных детей, которые способны усваивать энтеральное питание, всасывание жирных кислот происходит через стенку кишечника после переваривания жира, находящегося в составе грудного молока или молочной смеси. К детям, находящимся на парентеральном питании, жирные кислоты поступают в форме внутривенных липидов.
В процессе развития плода основным источником энергии является глюкоза, меньшее значение имеют лактат и излишек аминокислот. Жирные кислоты играют минимальную роль в энергетическом обеспечении плода, но после рождения ребенка они становятся основными источниками энергии. Накопление жировой ткани у плода происходит преимущественно в конце III триместра. Следовательно, преждевременно рожденные младенцы имеют ограниченный запас жировой ткани при рождении.
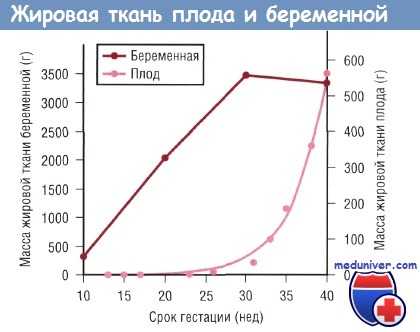
Изменения массы жировой ткани беременной и плода в зависимости от срока гестации. Данные по плоду отражают изменения в позднем фетальном периоде (в течение 9 нед до окончания полного срока беременности), когда рост плода зависит от поступающих через плаценту питательных веществ.
После рождения жирные кислоты, находящиеся в жировых депо, расходуются в качестве источников энергии и структурных компонентов новых клеточных мембран. Недоношенные дети, у которых при рождении запасы жировой ткани недостаточны, в большей степени по сравнению с доношенными младенцами зависят от поступления липидов с пищей или с парентеральным питанием для удовлетворения потребности в жирных кислотах. В перинатальном периоде ребенку необходимо большое количество жирных кислот для обеспечения высокой скорости роста, что особенно актуально для головного мозга.
При формировании мембран в нервной ткани нужно большое количество жирных кислот для образования фосфолипидов. Кроме того, необходимы стеролы и сложные липиды. Серое вещество головного мозга содержит в большом количестве как 22:6 n-3, так и 20:4 n-6. Палочки и колбочки сетчатки также содержат много 22:6 n-3. Около 50% всех жирных кислот в наружном сегменте палочек составляют жирные кислоты 22:6 n-3. Поскольку в организме млекопитающих образование омега-6 и омега-3 ПНЖК невозможно, они должны поступать с пищей или отдельно в виде DHA и ARA либо «родительских» жирных кислот — ALA и LA соответственно.
Многие смеси, предназначенные для вскармливания детей, содержат добавки ARA и DHA. Кроме того, стало возможным дополнительное обогащение DHA специализированных продуктов питания для беременных и кормящих женщин.
За последние два десятилетия наибольший интерес в исследованиях потребности в липидах вызывает роль омега-6 и омега-3 ДЦПНЖК в развитии зрительного анализатора и когнитивной функции ребенка. Особое внимание уделяется жирным кислотам 22:6 n-3 и 20:4 n-6. Они обнаружены в грудном молоке, причем уровни DHA колеблются от 0,1 до 1% общего количества жирных кислот. Уровни ARA менее вариабельны и составляют обычно 0,3—0,7% общего количества.
Кишечник ребенка может повреждаться при различных патологических состояниях, что приводит к нарушению усвоения пищи и возникновению ЯНЭК. Чем меньше срок гестации и масса тела при рождении, тем больше риск возникновения различных заболеваний. Клиническими показателями здоровья (или отсутствия заболевания) служат нутритивный статус (антропометрические и физиологические параметры) и функциональные возможности ребенка, связанные с физическим ростом и неврологическим развитием. Клиническая оценка питания заключается в оценке общего состояния ребенка, его толерантности к пищевой нагрузке, а также в наличии симптомов недостаточного или избыточного питания. Сниженные запасы жировой ткани и питательных веществ, связанные с недоношенностью или задержкой внутриутробного развития, необходимость в парентеральном питании, эпизоды ограниченного поступления в организм энергии и высокая потребность в питательных веществах могут влиять на рост и развитие ребенка.
Способ энтерального кормления для каждого конкретного ребенка выбирают с учетом срока гестации, массы тела при рождении и клинического состояния. Прежде чем начать энтеральное кормление, необходимо убедиться в отсутствии структурных аномалий, а также учесть состояние ЖКТ и респираторной системы. Для создания алгоритма энтерального кормления недоношенного ребенка необходимо ответить на следующие вопросы: когда начинать кормление, чем кормить ребенка (грудным молоком или смесью), каким способом, а также определить частоту приемов пищи и скорость увеличения объема питания. Некоторые дети до начала энтерального кормления получают парентеральное питание. Другими словами, выбор режима питания ребенка основывается на многих факторах, что обусловливает разнообразие индивидуальных подходов в отношении недоношенных детей и детей с задержкой внутриутробного развития.
Недоношенные дети с незрелым ЖКТ и ограниченными запасами жировой ткани составляют группу риска по постнатальной задержке физического развития. Плохая переносимость энтерального питания может привести к уменьшению поступающей к ребенку энергии, развитию дефицита питательных веществ, мальабсорбции жиров и клиническим симптомам дефицита незаменимых жирных кислот. Плохая переносимость питания может быть следствием незрелости ЖКТ и пищеварительных ферментов, получения ребенком питательной смеси с повышенной осмолярностью, слишком быстрого увеличения объема питания, а также следствием таких патологических состояний, как ЯНЭК или сепсис. К симптомам непереносимости пищи относят учащение периодов апноэ и брадикардии, связанных с питанием, увеличение остаточного объема содержимого желудка, вздутие живота, рвоту, обильные срыгивания, наличие в стуле крови или непереваренной пищи. Плохой сосательный рефлекс или неспособность координировать одновременно сосание и глотание также ограничивают возможность ребенка получать адекватное количество энергии и питательных веществ. Как было показано, первичное питание (питание небольшими объемами грудного молока или искусственной смесью) в первые несколько дней может стимулировать активность ЖКТ и улучшить толерантность к энтеральному кормлению. Для оптимального роста и развития очень важна возможность обеспечивать адекватное питание, одним из компонентов которого являются пищевые жиры.
Мальабсорбция жиров может привести к дефициту незаменимых жирных кислот, жирорастворимых витаминов (A, D, Е, К). Наиболее часто у недоношенных детей отмечают дефицит кальция, фосфора, витаминов D и Е, железа, цинка, карнитина, незаменимых жирных кислот и белка. Заподозрить мальабсорбцию жиров можно по изменению характера стула, который становится обильным, жирным, приобретает зловонный запах. В случае недостаточной функции поджелудочной железы или дефицита желчных кислот стул может стать белым, серым или цвета глины. Клинические симптомы дефицита незаменимых жирных кислот включают чешуйчатый дерматит, тромбоцитопению, повышенный риск возникновения инфекций, недостаточный рост и алопецию.
В течение неонатального периода, особенно у недоношенных детей или детей с задержкой внутриутробного развития, может отмечаться несовершенство терморегуляции. Новорожденные адаптируются к холодовому стрессу, вырабатывая тепло за счет калорий, необходимых для роста. Сокращение во время холодового стресса запасов бурой жировой ткани обеспечивает организм энергией за счет недрожательного термогенеза. Тепло также образуется, когда ребенок плачет и двигается. Метаболизм бурой жировой ткани, обеспечивающий производство тепла, характерен только для новорожденных. Дети с малой массой тела или менее зрелые к моменту рождения имеют неадекватные запасы жира, большую площадь поверхности по отношению к массе тела и большее содержание воды в организме. Это способствует большим потерям жидкости и, соответственно, тепла. Среди недоношенных детей нарушение температурного контроля встречается чаще, чем у доношенных.
Суммируя сказанное, можно сделать вывод о значимом различии между физиологией и метаболизмом липидов у плодов и недоношенных детей. Жиры пищи являются важнейшими источниками энергии после рождения. Существенными для развития ЦНС и, возможно, иммунной системы являются омега-6 и омега-3 ДЦПНЖК, которые ребенок получает постнатально в виде ARA и DHA или которые образуются in situ из незаменимых жирных кислот пищи LA и ALA. Преждевременно родившиеся дети зависят от функциональной зрелости ЖКТ, т.к. она определяет способность ребенка получать адекватное количество энергии для роста и необходимое количество омега-6 и омега-3 жирных кислот для развития ЦНС. За последние несколько лет произошли значительные сдвиги в понимании физиологии фетального и постнатального периодов, вопросов питания и лечения недоношенных детей, что мы представили в следующих статьях на нашем сайте МедУнивер. Тем не менее остается еще много нерешенных вопросов. Дальнейшие исследования могут помочь улучшить качество нутритивной поддержки недоношенных младенцев.
Обмен веществ плода и новорожденного.
2. Иванов Д. О. Нарушения обмена глюкозы у новорожденных /Д. О. Иванов — СПб.: Изд-во Н-Л, 2011. — 103-105 стр.
Углеводы – основные поставщики энергии в питании человека. Как правило, на их долю приходится более 50% калорийности и почти ¾ веса суточного рациона. Углеводы, потребляемые с пищей, представлены главным образом крахмалом. Гликоген животных продуктов имеет в питании сравнительно малое значение. Важным компонентом молочных продуктов является лактоза.
Основным биологическим назначением углеводов в организме является обеспечение энергетических затрат. Разложение их на углекислоту и воду представляет главный источник энергии. Некоторые продукты углеводного обмена действуют как катализаторы и способствуют окислению целого ряда веществ. Углеводы используются организмом в качестве начальных соединений для биологического синтеза других веществ (например, жирных кислот, аминокислот), а также входят в состав некоторых соединений: глюкопротеидов, гепарина, нуклеиновых кислот и т.д.
Углеводы выполняю в организме человека следующие функции:
1) Энергетическая функция, заключающаяся в том, что 60% энергетических потребностей организма покрывается при утилизации углеводов;
2) Пластическая функция – углеводы входят в состав многих структур организма (нуклеиновые кислоты, мембраны клеток, основное вещество соединительной ткани);
3) Функция резерва питательных веществ – глюкоза откладывается в тканях в виде биологического полимера – гликогена. Последний в отличие от глюкозы не обладает осмотической активностью, в связи с чем присутствие больших количеств гликогена (до 10%) в тканях не сопровождается нарушениями гомеостаза;
4) Защитная функция – осуществляется мукополисахаридами, которые входят в состав секретов слизистых желез; мукополисахариды является также одним из компонентов кожи;
5) Специфические функции – углеводы входят в состав антител и факторов, определяющих групповую принадлежность крови.
Основными фазами углеводного обмена являются:
1) Расщепление полисахаридов в ЖКТ;
2) Всасывание моносахаридов в кишечнике и транспортировка их к печени;
3) Синтез и депонирование гликогена;
4) Мобилизация гликогена, превращение его в глюкозу и транспорт глюкозы клетками тканей.
Для характеристики состояния углеводного обмена применяют:
1) Определение содержания глюкозы в крови;
2) Нагрузочные пробы с глюкозой, левулезой (фруктозой), галактозой;
3) Определение влияния на уровень глюкозы в крови эндокринных препаратов: адреналина, инсулина, кортизона, питуитрина;
4) Исследование активности ферментов углеводного обмена;
5) Определение содержания гликогена или промежуточных продуктов его распада в крови;
6) Определение содержания глюкозы и кетоновых тел в моче, являющееся косвенным показателем. Наибольшее распространение получили два первых метода оценки углеводного обмена.
Глюкоза содержится и в плазме крови, и в эритроцитах, однако внутриклеточный обмен и меньшее количество воды в эритроцитах создают условия, при которых в плазме крови содержание глюкозы несколько выше, чем в цельной крови. Уровень глюкозы в венозной крови ниже, чем в артериальной. У детей, страдающих диабетом, эта разница может варьировать в значительных пределах (до 40 мг в 100 мл крови) в течение нескольких часов.
Содержание глюкозы в крови является довольно постоянной величиной и поддерживается на определенном уровне благодаря сложным нейро - гуморальным механизмам, среди которых ведущую роль играют нервная и эндокринная системы.
Основными факторами, вызывающими быстрое повышение уровня глюкозы в плазме, являются прием пищи, распад гликогена в печени и, возможно, в других тканях, образование глюкозы из жиров и аминокислот. Главнейшими факторами, снижающими содержание глюкозы в плазме крови, являются усиленное потребление глюкозы функционирующими органами, печенью, мышцами, образование липидов и глюкозурия.
Кровь у детей для определения содержания глюкозы берут, как правило, из пальца, реже из пятки или мочки уха. Эта кровь по происхождению является капиллярной или артериальной и содержит такое же количество глюкозы, как и кровь, взятая при артериальной пункции. Рекомендуется производить определение глюкозы в пределах не более часа с момента взятия крови, так как в случае хранения ее в течение длительного времени при комнатной температуре обнаруживается постепенное уменьшение содержания глюкозы в результате обмена веществ в эритроцитах и лейкоцитах.
Содержание глюкозы в плазме крови у здорового ребенка – величина довольно постоянная до тех пор, пока запасы глюкогена в печени достаточны.
Этих запасов хватает для поддержания постоянного уровня глюкозы в течение 6-12 часов у детей первых месяцев жизни и в течение 12-24 часов и более у детей старшего возраста. При истощении запасов гликогена развивается гипогликемия и ускоряется процесс использования жиров для энергетических затрат организма.
Содержание глюкозы в крови у здоровых детей колеблется в весьма широких пределах: от 3,3-5,6 ммоль/л. У детей первых 2 лет жизни наблюдаются ещё большие колебания, что, возможно, объясняется лабильностью обмена веществ в этом возрасте.
Сразу после рождения ребенка в пупочной в пупочной вене содержится на 7-10% больше глюкозы, чем в пупочной артерии. В течение первых 4 часов после перевязки пуповины содержание глюкозы начинает медленно снижаться и достигает минимума к концу 1-3-го дня. К концу первой недели жизни оно повышается до нормального для данного ребенка уровня. У детей, рождающихся с низким весом и недоношенных, как правило, содержание глюкозы в крови ниже.
У здорового ребенка после приема пищи в течение первых 30 минут уровень глюкозы в плазме заметно повышается. У детей, страдающих лихорадочными заболеваниями, это повышение бывает выражено значительнее – 30 мг% в течение первого получаса после еды. При диабете и гликогенной болезни повышение уровня глюкозы выражено ещё более резко и достигает своего максимума через 1(1/2) – 2 часа с постепенным снижением до исходного уровня через 4-5 часов.
Для более точной оценки толерантности к глюкозе, иными словами, для оценки возможностей и способностей регулирующих углеводный обмен механизмов, предложены нагрузочные тесты. Суть этих тестов сводится к введению через рот или внутривенно глюкозы (1,85-2 г на 1 кг веса) с последующим контролем за изменениями уровня глюкозы в крови в течение нескольких часов.
Метаболизм глюкозы регулирует инсулин и «контринсулярные» гормоны. Основными контринсулярными гормонами являются глюкагон и адреналин. При снижении уровня глюкозы адреналин стимулирует выброс из клеток лактата и аланина и запускает процесс глюконеогенеза. Выработку инсулина стимулирует повышение уровня глюкозы.
Инсулин не проходит транспланцентарно, его уровень у плода не зависит от содержания инсулина в крови матери, в-клетки поджелудочной железы плода только в последний триместр беременности становится чувствительными к концентрации глюкозы. Они заметно увеличиваются в объеме, и инсулин стимулирует поступление глюкозы в мышечные и жировые клетки, создавая запасы энергии к рождению ребенка. Таким образом, плод практически целиком зависит от уровня глюкозы в крови матери, так как сам не может активно ее синтезировать.
При рождении у новорожденного ребенка происходит резкое переключение метаболизма, направленное на самостоятельное образование глюкозы. В связи с этим, недоношенные дети имеют многочисленные причины для развития гипогликемии. Во-первых, у них меньше энергетических запасов (гликоген печени и жир). Во-вторых, они имеют более высокие концентрации инсулина. В-третьих, у недоношенных новорожденных гораздо хуже развиты механизмы глюконеогенеза. Имеется еще достаточно большое количество состояний неонатального периода, сопровождающихся нарушением метаболизма глюкозы в виде гипогликемии.
Гипогликемия чаще развивается у детей младшего возраста в силу меньшего содержания гликогена в печени и характерной для них лабильности всех видов обмена веществ, в частности, углеводного. Установлено, что печень новорожденного в норме содержит 2-3 г гликогена на 100 г., в то время как в печени детей старшего возраста его количество достигает 6-8 г.
В качестве сопутствующего состояния при гипогликемии часто наблюдается кетоз, который может быть иногда первым явным признаком ее существования. Кетоз связан с истощением запасов гликогена в печени.
У многих здоровых новорожденных и особенно у недоношенных в первые дни и недели жизни определяется физиологическая галактозурия (до 60 мг на 100 мл мочи). При пероральной или внутривенной нагрузке галактозой у новорожденных развивается гипергликемия, взрослые реагируют на эту нагрузку снижением содержания глюкозы в крови. Активность галактозо-1-фосфат-уридилтрансферазы в крови новорожденного ребенка сравнительно высока и ещё больше увеличивается в грудном возрасте, а после 1 года существенно снижается. Однако фосфорилирование галактозы в печени у новорожденных ограничено, что объясняет наличие транзиторной галактоземии и галактозурии в этом периоде жизни.
Частью из тяжелых форм нарушения углеводного обмена являются гликогенные болезни. Под этим термином понимают наследственные нарушения углеводного обмена, характеризующееся избыточным отложением гликогена в печени, почках. Содержание глюкозы в крови у таких больных характеризуется небольшим снижением ниже нормы (60-50 мг%). В моче содержится ацетон, но сахар не определяется. Так как при гликогенной болезни превращение глюкозы из гликогена печени и других органов очень затруднено, то после 6-12 часового голодания может наступить значительная гипогликемия.
Практическое значение приобретает определение в крови другого моносахарида – галактозы, так как описаны редкие случаи галактоземии – заболевание, при котором организм ребенка с рождения неспособен регулировать обмен галактозы. В моче у детей с галактоземией постоянно содержится галактоза, небольшое количество белков и никогда не обнаруживается ацетон. Галактозурия и протеинурия исчезают через несколько дней после прекращения приема галактозы с пищевыми продуктами, главным образом молоком.
С помощью высокочувствительных методов углеводы обнаруживаются в моче здоровых детей. Так, в суточной моче недоношенных может содержаться до 130 мг углеводов, у доношенных – до 80 мг, причем половину этого количества составляет лактоза, кроме того, выводится много фруктозы (20-40 мг) и 10 – 20 мг глюкозы.
В суточной моче детей грудного возраста содержатся следующие углеводы: глюкоза – до 15 мг, галактоза – до 10 мг, лактоза – до 35 мг, фруктоза – менее 10 мг, ксилоза – менее 30 мг, арабиноза – менее 30 мг.
Заключение:
Метаболизм глюкозы имеет специфические особенности у детей:
- В тканях новорожденного и ребенка первых месяцев жизни активно протекает анаэробный гликолиз. Это в значительной степени обеспечивает устойчивость детей к гипоксии и обеспечивает возможность использовать метаболиты гликолиза для синтеза соединений других классов.
- Метаболизм глюкозы по пентозофосфатному пути (ПФП) резко активируется после рождения ребенка. Этот вид утилизации глюкозы обеспечивает растущие ткани достаточным количеством фосфопентоз и НАДФН, необходимых для синтеза нуклеотидов, стероидов и жирных кислот.
- Синтез и накопление гликогена в печени определяются особенностями функционирования организма ребенка на конкретном этапе развития.
Биосинтез гликогена идет активно у плода в последние 2-3 месяца внутриутробного развития. Содержание этого полисахарида в печени плода в последние недели беременности может достигать 10% массы органа (у взрослого 4%).
В ранние сроки беременности важнейшими органами обмена веществ плода являются трофобласт и плацента. На более поздних этапах внутриутробного развития в этих процессах все заметнее становится роль печени.
Углеводы. Основным источником энергии в период онтогенетического развития является глюкоза. В физиологических условиях содержание углеводов в крови плода составляет приблизительно 60—75 % от соответствующих концентраций в крови матери. К сроку беременности 8 нед плацента сама начинает синтезировать гликоген, а с 12—15 нед в этом процессе начинает участвовать печень плода.
Глюкозе принадлежит важнейшая роль как в тканевом дыхании (цикл трикарбоновых кислот, или цикл Кребса), так и в процессах осуществления физиологического метаболического ацидоза — важнейшей формы обмена плода. Именно процессы анаэробного гликолиза лежат в основе физиологической защиты плода от кислородного голодания и предохраняют все его жизненно важные органы и ткани от гипоксического состояния.
Белки. Большим своеобразием отличается белковый обмен плода. Обмен белка у плода совершается значительно быстрее, чем у взрослого человека. Большинство аминокислот переходят от матери к плоду благодаря механизму активного транспорта, вследствие чего их концентрация в фе-тальнои крови всегда выше, чем в крови матери. Некоторые аминокислоты (глутаминовая кислота, аланин) синтезируются в плаценте и не адсорбируются из крови матери. Концентрация аминокислот в плаценте в 5 раз выше чем в материнской крови. Таким образом, особенности белкового обмена плода характерны для анаболического метаболизма и обусловливают высокие показатели роста плода в период его антенатального развития.
Липиды. У плода обмен липидов тесно связан с соответствующим обменом матери. Свободные жирные кислоты активно проникают через плацентарный барьер, их содержание в крови плода находится приблизительно на таком же уровне, что и у матери. Начиная с III триместра беременности некоторые жирные кислоты синтезируются в организме самого плода. В настоящее время пересматривается точка зрения, согласно которой основным источником энергии в период онтогенеза являются углеводы. Установлено, что в этом процессе участвуют и липиды плода. Кроме того, роль липидов заключается в том, что они необходимы для развития головного мозга и легких.
Витамины, микроэлементы и вода. Витамины активно переходят через плаценту и накапливаются в организме плода. В первую очередь это относится к водорастворимым витаминам. Плацента ограниченно проницаема для витаминов А и D. Активно переходят через плаценту железо, кальций, калий, натрий, магний, а также различные микроэлементы (медь, кобальт, цинк и др.). Вода переходит через плаценту путем диффузии. Таким образом, рост и развитие плода практически целиком зависят от питательных веществ, поступающих к нему из организма матери. Поэтому рациональное, сбалансированное питание матери имеет очень большое значение не только для ее организма, но и для растущего плода.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Во время физиологической беременности системы гемостаза матери и плода функционируют относительно автономно, при этом плацента оказывает лишь опосредованное влияние на обе системы гемостаза. Если система гемостаза матери характеризуется явлениями физиологической гиперкоагуляции, то аналогичная система у плода имеет все признаки гипокоагуляции. В период внутриутробного развития в прокоагу-лянтном звене системы гемостаза плода происходят выраженные изменения. Первые белки-прокоагулянты появляются у плода на 12-й неделе онтогенеза, а фибриноген удается обнаружить еще раньше (на 5-й неделе). Способность крови эмбриона к свертыванию появляется на 12-й неделе развития. В период 12—24 нед активность факторов II, VII и X составляет всего 20—23 %, а фактора IX— 14—40% от аналогичных показателей взрослых. На сравнительно низком уровне находятся также и показатели агрегации тромбоцитов.
Система гемостаза новорожденного характеризуется также признаками гипокоагуляции. Это касается как плазменного, так и клеточного звена данной системы. Только в постнатальном периоде наблюдается постепенное увеличение показателей свертывающей системы крови и ее приближение к параметрам взрослого.
Кислотно-основное состояние крови.
Кислотно-основное состояние (КОС) крови плода характеризуется всеми признаками физиологического метаболического ацидоза. Ацидоз обусловлен накоплением в организме плода недоокисленных продуктов обмена веществ, прежде всего углеводов. Ацидоз отражает также особенности газообмена в антенатальном периоде развития.
Ацидоз плода имеет метаболический характер. О метаболическом характере ацидоза свидетельствует отсутствие повышения показателей парциального давления С02 (Р СO2 ) при значительном накоплении кислых продуктов обмена веществ (BE). Это подтверждается также изменениями показателей буферной системы крови, что находит свое выражение в снижении щелочных резервов крови (ВВ, SB, общее содержание С02).
Состояние физиологического метаболического ацидоза отражает в основном преобладание в организме плода процессов анаэробного гликолиза при котором энергии выделяется меньше, чем при аэробном, однако этого вполне достаточно для внутриутробной жизни.
По мере приближения срока родов у плода нарастает физиологический метаболический ацидоз, в связи с чем повышается возбудимость мезэнцефаличеекого ядра тройничного нерва, ретикулярной формации и некоторых друтих центров гомеостаза. Это в свою очередь приводит к резкому повышению возбудимости всех центральных структур регуляции дыхательной системы плода, включая и бульбарный дыхательный центр. Так создаются важнейшие предпосылки к первым внеутробным дыхательным движениям. Таким образом, состояние физиологического метаболического ацидоза плода не свидетельствует о его патологии. Оно является выражением весьма своеобразного физиологического состояния плода и его адаптации к внутриутробному существованию.
Как происходит питание ребенка в утробе матери?

Долгожданная беременность – это трогательный и волнительный процесс в жизни любой представительницы прекрасного пола. В это время возникает много вопросов по поводу роста и развития эмбриона.
После того, как произошло оплодотворение яйцеклетки, в женском организме начинается активный процесс роста и деления клеток. Многие будущие мамы задумываются над тем, как происходит питание ребенка в утробе и чем дышит эмбрион.
Как происходит питание ребенка в утробе матери сразу после зачатия?
После того, как произошло оплодотворение, яйцеклетка не сразу успевает прикрепиться к поверхности матки, поэтому она получает питание из толстой оболочки, находящейся в ней и обозначенной как желточный мешок.
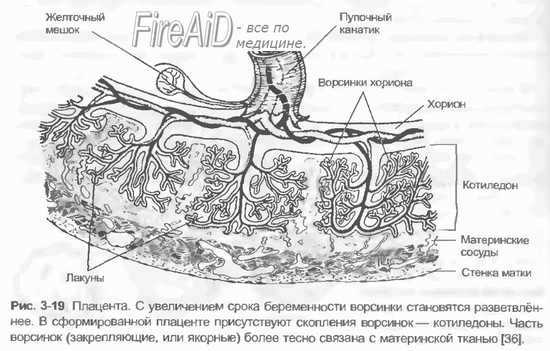
Когда имплантация будущего зародыша происходит успешно, то яйцеклетка начинает получать вещества для питания через тонкие ворсинки, называемые хорионами – это прообраз будущей плаценты. Постепенно из этих ворсин образовывается орган, именуемый детским местом, который и является основной системой, передающей от матери к ребенку все вещества для питания, необходимые для его полноценного развития.
Как происходит питание ребенка через пуповину?
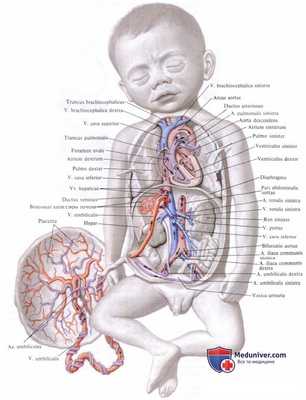
Таким образом, изучая работу такого временного органа – пуповины и плаценты, можно понять, как происходит питание ребенка в утробе матери. Именно через такой жизненно важный орган, как плацента, к ребенку поступают все нужные ему вещества: белки, углеводы, витамины и жиры, а также минералы. Через этот жизненно важный орган ребенок обретает и кислород (поэтому будущей маме нужно стараться больше находиться на свежем воздухе). Через пуповину от организма ребенка организм матери получает продукты обмена и выводит их обычным способом.
Исключительное значение плаценты заключается и в том, что кровь матери и плода не смешиваются между собой, что не допускает конфронтации между клетками материнского организма и клетками организма ребенка. При этом через плаценту происходит взаимообмен гормонами между матерью и ее крохой.
Получение пищи: как происходит питание ребенка в утробе?
Ответив на вопрос, как происходит питание ребенка через пуповину, рассмотрим теперь проблему того, какое питание необходимо малышу. Конечно же, мама должна питаться полноценно. Это значит не следовать заблуждению о том, что нужно много есть, а думать о том, чтобы пища была разнообразной и содержала необходимые витамины и вещества, нужные для роста и развития ее крохи. Питательные вещества для ребенка извлекаются не только из пищи, которую употребляет мама, но и из ее организма (костей, мягких тканей и т.д.).
Следует заметить, что материнская утроба являет собой уникальную систему человеческого организма, призванную питать ребенка и защищать его от опасностей. Создается важное равновесие, когда органы ребенка и его матери работают как будто в унисон, что приводит к гармоничному развитию плода.
Читайте также:
