Катетеризация бедренной вены под ультразвуковым контролем
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
Для центрального венозного доступа чаще используют правую внутреннюю яремную вену или правую подключичную вену. Это связано с тем, что слева проходит грудной лимфатический проток и возможно его повреждение во время катетеризации. А также по внутренней левой яремной вене происходит отток крови от доминирующего полушария головного мозга. И в случае возникновения гнойных или тромботических осложнений, неврологические последствия для пациента могут быть более серьезными.
Считается, что катетеризация внутренней яремной вены сопровождается меньшим числом осложнений (пневмоторакс, тромбозы, кровотечение) по сравнению с катетеризацией подключичной вены. В то же время в каких-то случаях удобнее использовать подключичный доступ, например: при гиповолемии, двигательном возбуждении, низком артериальном давлении у больного и т.д.
Катетеризация бедренной вены ассоциируется с повышенным риском инфекционных и тромботических осложнений. И используется, как запасной вариант при невозможности выполнить центральную катетеризацию из другого доступа. Облегчить поиск вены, уменьшить риск осложнений позволяет проведение ультразвукового исследования, позволяющее уточнить индивидуальные особенности расположения венозных стволов пациента.
Внимание! Если попытка катетеризации вены закончилась неудачей, не упорствуйте и сразу позовите коллегу на помощь – часто помогает если не решить проблему, то, по крайней мере, избежать неприятностей в дальнейшем.

Пункция правой внутренней яремной вены центральным доступом
Пациента уложите на спину, руки – вдоль туловища, голову поверните влево. Для увеличения наполнения центральных вен и снижения риска воздушной эмболии придайте положение Тренделенбурга (головной конец стола опускают на 15° вниз), если конструкция кровати не позволяет это сделать – горизонтальное.
Определите положение правой сонной артерии. Внутренняя яремная вена располагается поверхностнее, латеральнее и параллельно сонной артерии. Обработайте кожу антисептиком и ограничьте место пункции стерильными салфетками. Инфильтрируйте кожу и подкожную клетчатку над передним краем грудино-ключичнососцевидной мышцы на уровне щитовидного хряща 5 мл 1% раствором лидокаина. Поисковая пункция выполняется внутримышечной иглой с целью локализовать расположение вены с минимальным риском получить значительное кровотечение при непреднамеренной пункции артерии.
Также «поисковой иглой» стоит воспользоваться, если есть коагулопатия, или игла для пункции из набора неудобна для вас, или необходимо ввести катетер большого диаметра. При наличии хороших мануальных навыков, вы, естественно, от использования «поисковой пункции» может отказаться. Левой рукой определите ход сонной артерии. Иглу введите чуть латеральнее (приблизительно 1 см) артерии под углом 45° к коже по направлению к правому соску у мужчины или правой верхней передней подвздошной ости у женщин. Продвигайте иглу медленно, поддерживая разрежение в шприце, до получения крови. Вена расположена поверхностно, поэтому не следует вводить иглу глубже 3-4 сантиметров.
Если вы не обнаружили вену, медленно извлеките иглу под кожу, поддерживая разряжение в шприце (т. к. игла могла случайно проколоть обе стенки вены). Если получить кровь не удалось, повторите попытку, взяв на этот раз направление немного медиальнее. Убедившись, что вы нашли вену, можно удалить поисковую иглу запомнив направление пункции, либо оставить ее на месте, удалив ее после попадания иглы из набора в вену. Пункция вены иглой из набора выполняется в направлении, определенном при поисковой пункции.
Пункция правой подключичной вены
Больного уложите на спину, руки – вдоль туловища, голову поверните влево. Чтобы отвести плечи назад и вниз, между лопатками положите валик. Для увеличения наполнения центральных вен и снижения риска воздушной эмболии придайте положение Тренделенбурга (головной конец стола опускают на 15° вниз), если конструкция кровати не позволяет это сделать – горизонтальное.
Нащупайте яремную вырезку грудины, грудино-ключичное и акромиально-ключичное сочленения. Далее обработайте кожу раствором антисептика и ограничьте место пункции стерильными салфетками. Точка пункции находится на 2-3см ниже ключицы, на границе средней и медиальной трети ее. Инфильтрируйте кожу и подкожную клетчатку вокруг места пункции 5-10 мл 1% раствором лидокаина.
Введите иглу через указанную точку до соприкосновения с ключицей. Постепенно продвиньте конец иглы вниз так, чтобы она оказалась сразу под ключицей. Затем поверните и направьте иглу на яремную вырезку. Медленно продвигайте иглу вперед, поддерживая разрежение в шприце, до получения крови. Срез конца иглы должен быть повернут в сторону сердца – это увеличивает вероятность правильной установки катетера. Старайтесь держать иглу параллельно плоскости кровати (во избежание пункции подключичной артерии или плевры);
Если вы не попали в вену, медленно извлеките иглу под кожу, поддерживая разряжение в шприце. Промойте иглу и убедитесь, что она проходима. Повторите попытку, взяв направление вкола немного краниальнее.
Пункция правой бедренной вены
Положение пациента на спине, с подложенным под ягодицы валиком. Ногу следует несколько отвести и развернуть кнаружи. Определите пульсацию бедренной артерии ниже паховой связки: бедренная вена располагается медиальнее. Обработайте кожу антисептиком и ограничьте место пункции стерильными салфетками. Далее инфильтрируйте кожу и подкожную клетчатку 5 мл 1 % раствором лидокаина. Надсеките кожу скальпелем с небольшим лезвием.
На 2 см ниже паховой связки определите ход бедренной артерии двумя пальцами левой руки. Иглу вводят на 1 см медиальнее бедренной артерии под углом 30° к коже и направляют ее по ходу вены, поддерживая разрежение в шприце, до получения крови. Вена обычно расположена на глубине 2-4 см от поверхности кожи. В качестве иглы удобно использовать периферический венозный катетер G14-16, предварительно убедившись, что он пропускает проводник.
Если вы не обнаружили вену, медленно извлеките иглу, поддерживая разряжение в шприце. Промойте иглу и убедитесь, что она проходима. Повторите попытку, направляя иглу немного правее или левее от первоначального места пункции.
Введение катетера по Сельдингеру
Сразу после пункции вены убедитесь, что кровь легко поступает в шприц. Отсоедините шприц, удерживая иглу на месте. Старайтесь опираться кистью на тело больного, чтобы минимизировать риск миграции иглы из просвета вены. Закройте павильон иглы пальцем во избежание попадания воздуха;
Введите в иглу гибкий конец проводника. Если возникает какое-либо сопротивление продвижению проводника, осторожно поверните его, и попробуйте продвинуть. Если это не помогло – металлический проводник удалите. Снова оцените аспирацию крови из вены. Измените угол наклона иглы или поверните ее, проверьте поступление крови в шприц. Повторите попытку. Если не удалось провести проводник из пластика, во избежание срезания, он должен удаляться обязательно вместе с иглой.
После заведения проводника в вену на половину его длины удалите иглу. Перед введением дилататора надсеките кожу скальпелем с небольшим лезвием; Введите по проводнику дилататор. Старайтесь брать дилататор пальцами ближе к коже, чтобы избежать перегиба проводника и дополнительной травмы тканей, а то и вены. Нет необходимости вводить дилататор на всю длину, достаточно создать туннель в коже и подкожной клетчатке без проникновения в просвет вены. Извлеките дилататор и введите катетер. Удалите проводник. Проведите аспирационную пробу. Свободный ток крови свидетельствует о том, что катетер находится в просвете вены.
Контроль правильного положения дистального конца яремного или подключичного катетера
Конец катетера должен находиться в полой вене. При высоком расположении катетера в верхней части полой вены, конец его может упираться в противоположную стенку вены, что затрудняет проведение инфузий и способствует формированию пристеночного тромба. Нахождение катетера в полостях сердца вызывает нарушения ритма, увеличивает риск перфорации сердца.
Установка катетера под ЭКГ контролем
Установка катетера под ЭКГ контролем позволяет оптимизировать его положение и уменьшить вероятность осложнений.
1.Катетер промывают физиологическим раствором. В катетер вводят металлический проводник, так, чтобы он не выходил за пределы катетера (на некоторых проводниках есть специальная метка). Или через заглушку катетера вводится металлическая в/м игла и катетер заполняют 7,5% раствором натрия хлорида. На иглу надевают заглушку;
2.Присоедините провод грудного отведения ―V‖ электрокардиографа или кардиоскопа к игле или проводнику с помощью зажима типа ―крокодил‖. И включите режим «грудное отведение» на регистрирующем устройстве. Или к дистальному электроду подсоединить провод правой руки и включить второе (II) отведение на кардиоскопе или кардиографе;
3. Если конец катетера находится в правом желудочке, на экране монитора видим высокоамплитудный (в 5-10 раз больше обычного) комплекс QRS. Медленно подтягивая катетер, видим снижение амплитуды комплекса QRS, но при этом зубец P остается очень высоким, что указывает на нахождение катетера в предсердии.
Дальнейшее подтягивание катетера приводит к нормализации амплитуды зубца P. Еще приблизительно на 1 см подтягиваем катетер — это и есть оптимальное положение катетера в верхней полой вене.
4. Зафиксируйте катетер к коже швом или лейкопластырем. Наложите стерильную повязку.
Рентгенологический контроль положения центрального катетера
После катетеризации внутренней яремной или подключичной вены необходимо произвести рентгенографию органов грудной клетки для подтверждения правильного расположения катетера и исключения пневмоторакса. Если больному проводится ИВЛ – рентгенография проводится сразу после катетеризации. При самостоятельном дыхании больного – через 3-4 часа. При признаках гемоторакса, пневмоторакса – рентгенография проводится немедленно.
Определение правильного положения дистального конца катетера на ретгенограмме
На рентгенограмме грудной клетки в передней проекции у взрослых конец катетера должен располагаться не более чем на 2 см ниже линии, соединяющей нижние концы ключицы. Эта линия разделяет верхнюю полую вену на два участка, расположенных ниже верхней границы перикарда и выше нее. Если катетер вводят в нижнюю полую вену, его конец должен располагаться ниже уровня диафрагмы.
Осложнения
Пункция артерии
При случайной пункции артерии прижимайте место пункции в течение 5-10 минут, затем повторите венепункцию.
Пневмоторакс/гидроторакс
У пациента, находящегося на ИВЛ, возможно развитие напряженного пневмоторакса. В этом случае даже при небольшом пневмотораксе необходимо дренирование плевральной полости. Если больной находится на самостоятельном дыхании, при небольшом пневмотораксе осуществляют динамическое наблюдение. При большом, признаках дыхательной недостаточности – дренирование плевральной полости.
Гидроторакс чаще связан с нахождением конца катетера в плевральной полости. Иногда через этот неправильно установленный катетер жидкость удается эвакуировать, опустив головной конец стола или кровати.
Смещение подключичного катетера во внутреннюю яремную вену
Положение катетера следует изменить, так как введение гипертонических растворов во внутреннюю яремную вену может вызвать венозный тромбоз.
Частые желудочковые экстрасистолы или желудочковая тахикардия
Развитие этих аритмий может указывать, что конец катетера находится прямо на трехстворчатом клапане. Подтяните катетер на несколько сантиметров назад.
Инфицирование катетера
Чаще всего происходит инфицирование Staphylococcus aureus и S. epidermidis, но у пациентов с иммунодефицитом возбудителями инфекции могут стать грамотрицательные палочки или грибки.
Явные признаки инфицирования катетера: болезненность, покраснение кожи и гнойное отделяемое в месте стояния катетера.
Возможное инфицирование катетера: при наличии лихорадки или других системных признаков сепсиса, но отсутствии признаков инфицирования в месте стояния катетера.
Катетеризация центральных вен под контролем ультразвука. Современные рекомендации и директивы.
По материалам статьи Julie A.Gayle, MD, Allan David Kaye, MD, PhD Ultrasound guided central veins cannulation. Anesthesiology News, June 2012 (5)
Julie A.Gayle, MD Старший преподаватель кафедры клинической анестезиологии медицинского факультета Государственного Университета штата Луизиана, Новый Орлеан, Луизиана
Allan David Kaye, MD, PhD Профессор, глава отделения анестезиологии медицинского факультета Государственного Университета штата Луизиана, Новый Орлеан, Луизиана
Данная статья не спонсирована никакими медицинскими компаниями.
Ультразвук в настоящее время все больше и больше входит в ежедневную практику в анестезиологии. Из большого количества его возможных применений следует выделить установку центральных венозных, артериальных и периферических катетеров, а также нервные блокады. До недавнего времени не существовало ни национальных, ни неких общепринятых стандартов относительно обучения постановке центрального венозного катетера (ЦВК) под контролем ультразвука. За последние годы сразу несколько обществ и ассоциаций, включая Американское Общество Анестезиологов (ASA), Американское Общество Эхокардиографии (ASE), Общество Кардиоваскулярных Анестезиологов (Society of Cardiovascular Anaesthesiologists) и Центры Контроля и Предотвращения Распространения Заболеваний (Centers for Disease Control and Prevention (CDC) опубликовали рекомендации по проведению катетеризации под контролем ультразвука.
Катетеризация центральных вен позволяет клиницисту начать гемодинамический мониторинг, введение лекарственных препаратов, жидкостей и парентерального питания, введение периферических внутривенных устройств и проведение гемодиализа. Внутренняя яремная вена, подключичная и бедренная вены - наиболее часто катетеризируемые сосуды при выполнении сосудистого доступа. Многие анестезиологи для катетеризации выбирают внутреннюю яремную вену (IJV). Использованию внутренней яремной вены способствует возможность визуализации и пальпации определенных анатомических ориентиров. Дополнительные вспомогательные методики включают в себя использование иглы меньшего диаметра для локации IJV, а затем стандартной иглы для канюляции; применение предварительной ультразвуковой локации, во время которой врач помечает на теле пациента расположение вены перед пункцией, и, наконец, ультразвуковую навигацию в реальном времени, сопровождающую пункцию [1].
Согласно исследованиям [2], риск осложнений во время катетеризации центральных сосудов варьируется от 2 до 15%. Эти показатели во многом зависят от опытности медицинского персонала и общего состояния пациента [3,4]. Наиболее часто встречающиеся осложнения катетеризации – это пневматоракс (0-6.6%), прокол сонной артерии (6%), прокол подключичной артерии (0,5%-4%) и гематоракс (1%) [1]. Общий процент неудачных попыток катетеризации IJV составляет 12% [5].
Ранние работы в этой области показали, что использование ультразвука может снизить число травматических осложнений и повысить процент удачных попыток катетеризации [6]. Более современные публикации подтверждают, что применение ультразвуковой навигации во время установки ЦВК увеличивает процент успешных первых попыток катетеризации и снижает опасность повреждения близлежащих артерий [7].
История применения ультразвуковой навигации при катетеризации центральных вен
В 2011 году Центр по контролю заболеваний (Center of Disease Control, CDC) рекомендовал применение ультразвуковой навигации при установке ЦВК для снижения количества попыток канюляции и механических осложнений. В продолжение тематики в публикации «Руководство по профилактике инфекционных осложнений, связанных с внутрисосудистым катетером» (Guidelines for the Prevention of Intravascular Catheter- Related Infections) Центр по контролю заболеваний (Center of Disease Control, CDC) постановил, что ультразвуковая навигация должна использоваться только теми клиницистами, которые прошли соответствующее обучение [12].
Статическая и динамическая визуализация
Статическая или непрямая ультразвуковая визуализация во время центрального венозного доступа дает оператору возможность определить точку вкола на коже перед стерильной обработкой места катетеризации. Она позволяет выявить и принять во внимание различия анатомических структур пациентов. По сравнению с традиционным слепым методом с анатомическими метками использование статической ультразвуковой визуализации для маркировки поверхности кожи перед канюляцией IJV увеличивает успешность проводимой процедуры [13]. Динамическая или прямая ультразвуковая визуализация в реальном времени во время установки ЦВК позволяет визаулизировать иглу при продвижении ее к искомому сосуду.
Динамическая или прямая ультразвуковая визуализация при проведении катетеризации дает возможность отслеживать продвижение иглы к искомому сосуду. В дополнение к тому, что ультразвуковая навигация более часто позволяет выполнить катетеризацию удачно с первой попытки, возможность наблюдать канюляцию IJV в реальном времени позволяет сократить время, требующееся для выполнения процедуры, частоту прокола близлежащих артерий и имеет более высокую долю успешных попыток 14.
Доказательства явно свидетельствуют о том, что использование ультразвуковой навигации во время катетеризации центральных вен, в особенности, внутренней яремной вены (IJV) позволяет проводить ее более безопасно и успешно. Однако техника ультразвукового контроля требует прохождения определенного обучения. Обязательным является знание анатомии сосудов и окружающих тканей. Интерпретация двухмерных изображений сосудов и окружающих их структур, полученных на ультразвуковом аппарате, требует практики. Кроме того, намного больше практики требуется для выполнения катетеризации при одновременном отслеживании взаимного расположения датчика и иглы с тем, чтобы визуализация иглы была наиболее четкой.
Несмотря на то, что медицинский персонал осваивает необходимые знания и навыки с разной скоростью, было предложено считать единицей контроля 10 выполненных под наблюдением профессионала ультразвуковых процедур [7]. Kaye et al предложил критическое количество установок ЦВК под ультразвуковым контролем для того, чтобы отличать опытного пользователя ультразвука от новичка. Авторы опытным путем определили, что анестезиологи, выполнившие, по меньшей мере, 20 катетеризаций с использованием ультразвуковой навигации, потенциально создавали существенно меньшее количество осложнений по сравнению с неопытными докторами (Рисунок 1) [1].
Обучение технике установки ЦВК с помощью фантомов зарекомендовало себя в качестве эффективного тренировочного инструмента для получения навыков катетеризации под контролем УЗИ. Результатом работы на фантомах является увеличение скорости нахождения искомых сосудов при использовании ультразвука, нежели чем при работе слепым методом; кроме того, даже неопытный персонал с помощью ультразвука достигает более высокого процента успешных попыток катетеризации при общем более высоком уровне безопасности проводимых манипуляций [17, 18]. Исследования, рассматривающие обучение с использованием симуляторов и последующие результаты проведенных с помощью ультразвука катетеризаций, выполненных обучившимися, позволяют признать предварительную работу на фантомах эффективным методом обучения медицинского персонала. Этот метод дает следующие результаты: значительно более высокая доля успешных канюляций с первой попытки, меньшее количество введений иглы, успешная установка катетера и меньше количество осложнений в виде пневматоракса [19, 20].
Выбор доступа При выборе оптимального венозного доступа рекомендуется принимать во внимание риск возникновения катетерной туннельной инфекции, тромбоза, гематомы, пневматоракса и артимий. Для минимизации риска возникновения туннельной инфекции и тромбоза предпочтительнее устанавливать ЦВК во внутреннюю яремную вену, подключичную вену и другие доступы верхней части тела, нежели чем использовать бедренный доступ. Место пункции должно быть свободным от воспаления и иметь самый низкий потенциал заражения по сравнению с другими возможными доступами. При выборе доступа и места пункции следует обходить участки тела с близко расположенными ранами, ожогами, а также избегать попадания слюны, экскрементов и инфекции на место пункции.
Подключичный доступ имеет преимущества перед яремным доступом в случае длительного нахождения катетера в центральной вене и характеризуется наиболее низким процентом возникновения катетерной туннельной инфекции и тромбоза. Однако в отличие от катетеризации IJV под контролем ультразвука, пользующейся всеобъемлющей поддержкой как в публикациях, так и у пользователей, работа с ультразвуком при канюляции подключичной вены является более технологичной. Ключица затрудняет визуализацию сосуда, тем самым усложняя динамическую визуализацию канюляции. Тем не менее, для работы с пациентами, у которых затруднено распознавание поверхностных ориентиров (тучные больные, пациенты с послеоперационными и постлучевыми рубцовыми изменениями области шеи), применение статического ультразвука перед манипуляцией может упростить визуализацию сосуда и исключить наличие тромбоза [7].
Бедренная вена — доступ выбора в кардиологии, неотложной медицине и в других случаях, требующих осуществления краткосрочного доступа к сосуду. Ясные анатомические ориентиры, относительно быстрое проведение катетеризации и безопасность являются преимуществами при канюляции бедренной вены. Исследование области прокола перед пункцией позволяет уточнить расположение сосудов и окружающих структур. Однако данных в пользу того, что ультразвуковой контроль в реальном времени во время катетеризации бедренной вены позволяет улучшить или ускорить процесс катетеризации, недостаточно. Исследования свидетельствуют о том, что рутинное использование ультразвука во время процедуры не имеет влияния на ее проведение.7
Подтверждение положения катетера
Во избежание случайной дилатации артерии во время катетеризации необходимо подтвердить расположение проводника перед дилатацией сосуда. Ультразвуковая навигация в реальном времени — надежный способ определить местонахождение проводника (в вене или артерии) [22]. Использование ультразвука дает возможность избежать дилатации сонной артерии при попытке катетеризации IJV (Рисунок 2).
Визуализация проводника по длинной оси дает более четкое представление о его местоположении, чем поперечный срез (Рисунки 3, 4). Позиционирование ультразвукового датчика для получения наиболее четкого изображения центральной вены и проводника в ней занимает у большинства пользователей менее минуты, но является самым быстрым и наглядным подтверждением отсутствия опасности повреждения артерий во время процедуры [7]. Манометрия, трансэзофагеальная эхокардиография, трансдукция прямого давления, анализ газов крови, флуороскопия и электрокардиография могут также помочь подтвердить локализацию проводника в вене [23].
В случае если эти методы доступны в лечебном учреждении, они дают более определенное подтверждение расположения проводника. Однако они занимают существенно больше времени, за которое при ошибке катетеризации у пациента могут произойти негативные изменения. Для подтверждения расположения кончика катетера после проведения процедуры необходимо проводить радиографию или флуороскопию.
Попытка удаления катетера после непреднамеренной катетеризации артерии может привести к серьезным осложнениям, таким как инсульт, гематоракс и артериовенозная фистула. В такой ситуации катетер следует оставить на месте и получить немедленную консультацию общего или кардиохирирурга для оптимального удаления катетера [24].
Инфекционный контроль
В рекомендациях по предотвращению катетерассоциированных инфекций особое внимание уделяется обучению и тренингу медицинского персонала, устанавливающего ЦВК и следящего за состоянием катетера в вене и доступа в целом. Темы для обучения – асептические приемы, поддержание стерильности поля во время установки катетера, использование спиртового раствора хлоргексидина для дезинфекции места вкола, а также манипуляции с уже установленным катетером [12]. Для снижения риска инфицирования следует избегать рутинной установки ЦВК пациентам отделения, а ставить катетер только при наличии показаний. Рекомендуется первым делом оценить доступы, расположенные в верхней части тела, и только при невозможности их осуществления рассматривать возможность использования бедренного и других доступов, расположенных на нижних конечностях.
С целью минимизации риска инфекционных осложнений предпочтительнее выбирать подключичный доступ. По завершении процедуры установки катетера рекомендуется использовать био-окклюзивные повязки. Любые манипуляции с уже установленным катетером (извлечение и замена, обработка катетера) должны выполняться специально обученным медицинским персоналом [12]. В случае возникновения катетерассоциированной инфекции необходимо установить новый катетер в новый доступ. Производить замену катетера в том же доступе не рекомендуется [24]. Как только необходимость наличия катетера в вене исчезает, необходимо немедленно извлечь ЦВК. Согласно публикациям, использование ультразвуковой навигации во время катетеризации не приводит к инфицированию места установки катетера. Использование стерильных проводников и чехлов для датчиков дает возможность сохранить полную стерильность рабочего поля при установке ЦВК.
Стоимость внедрения методики, соотношение затраты-польза
Подавляющее большинство исследователей свидетельствуют о том, что применение ультразвуковой навигации во время катетеризации позволяет повысить безопасность пациента, улучшить клинический исход и увеличить скорость процедуры. Однако технология должна быть не только полезной, она также должна оправдывать затраты лечебного учреждения на ее внедрение и использование. Стандартная стоимость ультразвукового аппарата составляет от 20000 до 30000 долларов США в зависимости от количества датчиков. Таким образом, важно принимать во внимание затраты при использовании ультразвука для контроля установки ЦВК. Ультразвуковая навигация при катетеризации внутренней яремной вены всегда обеспечивает более высокий процент успешных канюляций, снижение частоты осложнений и неудачных попыток, а также уменьшение количества времени, затрачиваемого на процедуру [25]. Ориентировочная стоимость лечения пневматоракса, полученного больным во время установки ЦВК слепым методом с помощью меток, составляет 134 доллара США на одного пациента. На основе данных о количестве пневматораксов (1,5 на 100 пациентов) при использовании техники поверхностных ориентиров это осложнение приводит к расходам в диапазоне от 5 до 10 миллионов долларов США в год в государственных масштабах [26].
Снижение процента неудачных катетеризаций и количества попыток установки ЦВК повышают профессионализм и помогают продемонстрировать экономическую выгоду применения ультразвука. Более того, ультразвуковые исследования играют большую роль также и в других процедурах. Эта технология отлично зарекомендовала себя как средство контроля при выполнении регионарной анестезии и катетеризации артерий [27, 28]. Снижение расходов в результате применения методики возможно отследить путем регистрации снижения количества осложнений, повышения скорости выполнения процедур и профессионализма медицинского персонала, а также безопасности пациента.
Будущее технологии
В последнее время много обсуждается возможность потери медицинским персоналом наработанных навыков и квалификации для работы слепым методом, а также развития зависимости от использования ультразвука в работе. Выдвигались предположения о том, что в случае если ультразвуковая навигация станет стандартом при установке ЦВК, слепой метод с использованием анатомических ориентиров может быть забыт. Вследствие этого медицинский персонал потеряет навыки, а молодые специалисты вообще не научатся работать методом поверхностных ориентиров. В этих случаях при недоступности ультразвукового аппарата, или выходе его из строя может существенно увеличиться доля неудачных катетеризаций и сопутствующих осложнений. Сторонники слепого метода с использованием анатомических ориентиров заявляют о том, что анестезиолог должен уметь устанавливать ЦВК без помощи ультразвука и при этом иметь достаточный уровень успешных попыток и малое количество осложнений.
Некоторые авторы пытались примирить два с первого взгляда противоположные методики, предлагая обучать медицинский персонал слепому методу с использованием поверхностных ориентиров наряду с ультразвуковыми методиками контроля манипуляций. Но реалистичным ли выглядит требование к учащимся овладевать слепой методикой, в то время как априори ясно, что она не будет использоваться в достаточной мере для наработки навыка, или хотя бы для того, чтобы учащиеся считались компетентными в применении методики? [30] В современном мире ультразвуковая навигация в реальном времени стала уже стандартной практикой при катетеризации IJV, и она постепенно приобретает все большую важность при работе с другими доступами. В публикациях постоянно подчеркивается важность прохождения врачами обучения для развития навыков работы с ультразвуком во время катетеризации для улучшения клинических исходов в целом. Таким образом, можно заключить, что время, выделенное на обучение, разумнее потратить не на овладение методикой поверхностных ориентиров, а на изучение основ и техники катетеризации под контролем ультразвука.
Заключение Современные публикации и научные труды всецело поддерживают использование ультразвуковой навигации в реальном времени при катетеризации внутренней яремной вены для увеличения доли успешных попыток установки катетера и снижения количества осложнений. Доказательства также свидетельствуют о том, что для повышения безопасности пациента и улучшения клинического исхода операторам необходимо пройти соответствующий тренинг.
Ультразвуковой контроль при катетеризации центральных вен у детей
Российский государственный медицинский университет им. Н.И. Пирогова.
Детская инфекционная больница N5.
Москва, Россия.
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
Катетеризация центральных вен является одним из необходимых мероприятий интенсивной терапии критических состояний. Как правило, эту операцию врачи делают на основании знаний о нормальной анатомии, руководствуясь наружными ориентирами (ключица, грудино-ключично-сосцевидная мышца, яремная вырезка и т.д.). Однако существует множество факторов, затрудняющих налаживание сосудистого доступа у больных, находящихся в тяжелом состоянии: особенности телосложения, гиповолемия, шок, врожденные деформации и аномалии развития. В связи с этим вероятность таких тяжелых ятрогенных осложнений, встречающихся при катетеризации центральных вен, как пневмоторакс, гемоторакс, лимфоторакс и их сочетаний (при ранении легкого, вены, артерии или грудного лимфатического протока), остается достаточно высокой даже при проведении процедуры опытными специалистами.
По данным ряда зарубежных авторов, механические осложнения при катетеризации центральных вен встречаются в 5-19% случаев (David C. McGee, Michael K. Gould 2003).
Количество осложнений во время катетеризации центральных вен у детей варьирует от 2,5 до 16,6% при катетеризации подключичной вены (James, Myers, Blackett et al.) и от 3,3 до 7,5% при катетеризации внутренней яремной вены (Prince et al., Hall, Geefhuysen). По нашим данным, осложнения при катетеризации внутренней яремной вены до использования предварительного ультразвукового исследования (УЗИ) встречались в 11% случаев. Все это побуждало врачей-исследователей искать пути визуализации предполагаемой вены с целью снижения частоты осложнений.
Материал и методы
Обследовано более 300 больных детей при катетеризации центральных вен с неотложными состояниями, вызванными инфекционными заболеваниями, в возрасте от 1 мес до 14 лет с массой тела от 2,6 до 62 кг. Для исследования использовались ультразвуковой сканер SonoAce-Pico (фирма "Medison", Южная Корея) с возможностью цветового допплеровского картирования, микроконвексный датчик с изменяемой частотой от 4 до 9 МГц. В своей практике мы применяли статическую и динамическую методики ультразвукового наведения.
Статическая методика: контрольное УЗИ с визуализацией интересуемых сосудов выполнялось непосредственно перед пункцией центральных вен, разметка на коже наносилась до стерилизации операционного поля (рис.1). УЗИ проводилось в двух взаимно перпендикулярных плоскостях в поперечном и сагиттальном (продольном) сечении между ножками грудино-ключично-сосцевидной мышцы при исследовании внутренней яремной вены (рис. 2, 3) и в паховой складке при исследовании бедренной вены. С помощью предварительного УЗИ определяли глубину расположения вены от поверхности кожи, непосредственно ход венозного ствола, диаметр вены, диаметр артерии, взаимное расположение вены и артерии, степень сокращения (спадения) внутренней яремной вены на вдохе при наличии гиповолемического состояния.
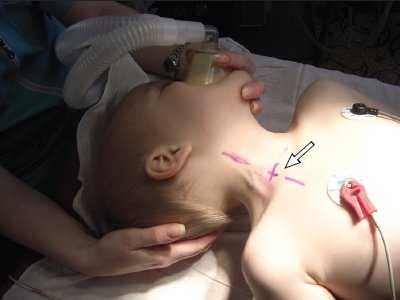
Рис. 1. Предварительная разметка расположения внутренней яремной вены.
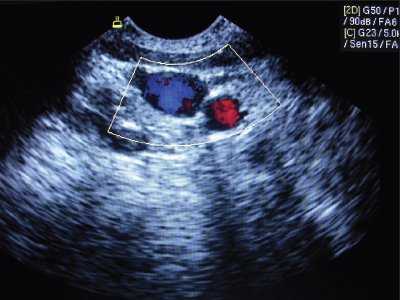
Рис. 2. Нормальное расположение и размеры внутренней яремной вены и сонной артерии при исследовании в поперечном сечении.
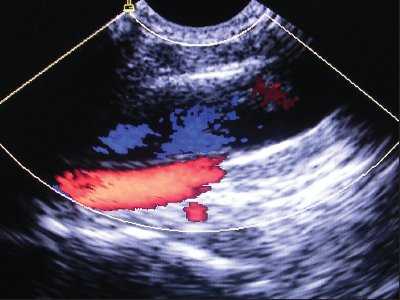
Рис. 3. Нормальное расположение и размеры внутренней яремной вены и сонной артерии при исследовании в продольном сечении (сонная артерия находится глубже внутренней яремной вены).
У детей раннего возраста УЗИ и катетеризация вены осуществлялись под общей анестезией (ингаляционный масочный наркоз фторотаном или внутривенное введение кетамина в сочетании с дормикумом), у более старших детей - под местной анестезией 1% раствором лидокаина, при необходимости проводилась седация дормикумом. Катетеризация центральных вен выполнялась по методике Сельдингера.
Динамическая методика отличается от статической тем, что на операционное поле устанавливается стерильный датчик и пункция сосуда проводится под ультразвуковым наведением в режиме реального времени. При динамической методике ультразвукового наведения нами использовался как упомянутый выше сканер SonoAce-Pico, так и специальный ультразвуковой сканер для катетеризации центральных вен Site-Rite 5 (производства BARD Access, США) с линейным мультичастотным датчиком от 5 до 11 МГц, оснащенным направляющей пункционной иглой. Стерильность датчика в области операционного поля поддерживалась путем одевания на датчик специальных стерильных одноразовых "рукавов" или как альтернативный и более дешевый вариант использования стерильной перчатки.
Результаты и обсуждение
Данные УЗИ показали, что из всех центральных вен наименьшую глубину расположения имеет внутренняя яремная вена (глубина расположения от 4 до 9 мм независимо от возраста больного).
Нами были установлены факторы риска безуспешных пункций и катетеризаций независимо от опыта врача. К таким факторам относятся аномалии развития сосудов шеи и степень спадения (уменьшения диаметра вены) во время вдоха в условиях гиповолемии.
Так, в 3% наблюдений нам удалось выявить различные аномалии размеров и расположения сосудов шеи, при наличии которых успешные пункция и катетеризация внутренней яремной вены практически были невозможными. Аномалии условно были разделены на аномалии размеров и расположения сосудов. В норме внутренняя яремная вена находится более поверхностно и латерально по отношению к сонной артерии (см. рис. 2).
При аномалии размеров отмечалось нормальное расположение внутренней яремной вены и сонной артерии, однако диаметр внутренней яремной вены был меньше диаметра сонной артерии (рис. 4).
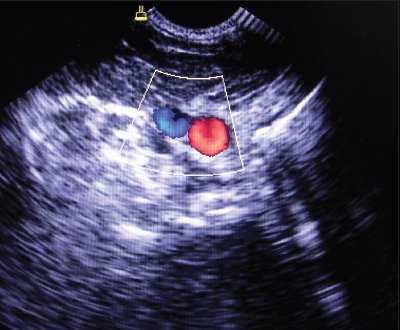
Рис. 4. Аномалия размера внутренней яремной вены при ее нормальном расположении (вена меньше сонной артерии и имеет округлый вид).
При аномалии расположения отмечалось обратное расположение сосудов: внутренняя яремная вена находилась более глубоко и медиально по отношению к сонной артерии. Как правило, диаметр внутренней яремной вены при аномалии расположения сосудов был существенно меньше диаметра сонной артерии (рис. 5). Все аномалии имели односторонний характер.
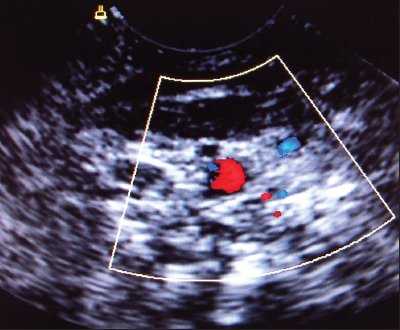
Рис. 5. Аномалия расположения и размера внутренней яремной вены (вена располагается медиальнее артерии, ее размер существенно меньше размера артерии).
С целью определения диагностической значимости степени сокращения размеров внутренней яремной вены (спадения) во время вдоха мы исследовали 10 здоровых взрослых (медицинский персонал) и в динамике 50 больных детей с грубыми волемическими нарушениями: при поступлении до проведения инфузионной терапии и перед переводом из отделения реанимации и интенсивной терапии после устранения волемических расстройств. Нами было установлено, что у здорового человека без признаков гиповолемии внутренней яремной вены имеет также тенденцию к спадению во время вдоха в горизонтальном положении, однако сокращение ее размеров не превышает 25-30%. В то же время при выраженных явлениях гиповолемии отмечается спадение внутренней яремной вены во время вдоха на 50% и более, до полного смыкания стенок вены. У больных с острыми кишечными инфекциями и явлениями обезвоживания без признаков острой дыхательной недостаточности спадение внутренней яремной вены на вдохе более 50% было расценено нами как диагностический критерий гиповолемии. Он находится в тесной взаимосвязи с другими диагностическими признаками и данными инструментальных исследований. Этот признак соответствует снижению центрального венозного давления менее 1 см вод.ст. и повышению фракции выброса, по данным ЭхоКГ, более 80%.
К методам профилактики спадения внутренней яремной вены относятся: положение пациента при катетеризации с пониженным головным концом (положение Тренделенбурга) и создание кратковременного избыточного давления под маской во время наркоза, что увеличивает кровенаполнение внутренней яремной вены и ее диаметр на 25-50%.
Если катетеризация проводится у детей старшего возраста под местной анестезией и ребенок способен сотрудничать с врачом, то при проведении пробы Вальсальвы отмечается увеличение диаметра вены в 1,5-2 раза.
Одной из проблем при катетеризации центральных вен является корректная позиция центрального венозного катетера, при которой его конец должен находиться в полости верхней полой вены над правым предсердием. По данным отечественных и зарубежных исследователей, некорректная позиция центрального венозного катетера против тока крови встречается в 0,5-18% случаев (в 5-18% при катетеризации v. subclavia и в 0,5-5% при катетеризации v. jugularis interna). Наиболее частым вариантом некорректной позиции является расположение катетера в полости внутренней яремной вены при катетеризации одноименной подключичной вены (рис. 6). В настоящее время существует несколько методов верификации позиции центрального венозного катетера: рентгено-контроль, ЭКГ-контроль; одним из них на практике становится УЗИ для уточнения положения центрального венозного катетера (рис. 7, 8).
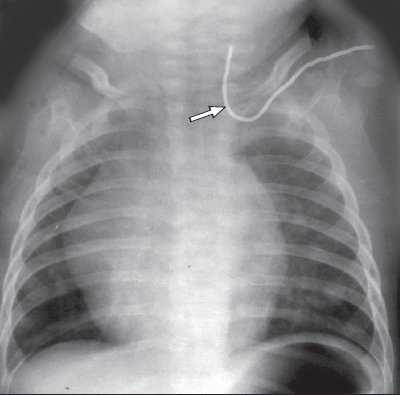
Рис. 6. Рентгенография. Некорректная позиция центрального венозного катетера, установленного через подключичную вену (катетер расположен против тока крови во внутренней яремной вене).
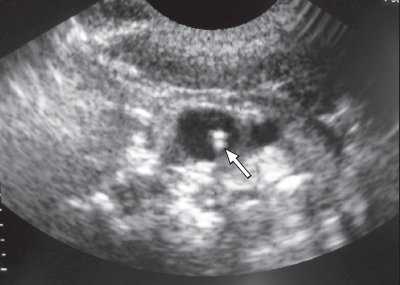
Рис. 7. Тот же катетер в просвете внутренней яремной вены при поперечном сканировании.
Катетеризация подмышечной вены малого диаметра под ультразвуковым контролем
Актуальность. Хорошо известно, что малый просвет любого сосуда затрудняет его катетеризацию. Инвазивные манипуляции сегодня рекомендуется осуществлять под ультразвуковым контролем по соображениям их безопасности и эффективности. При катетеризации подключичной вены, однако, ультразвук не повышает эффективности процедуры по данным шести метаанализов.
Цель исследования. Продемонстрировать эффективность катетеризации подмышечной вены малого размера под ультразвуковым контролем.
Материалы и методы. Проведена катетеризация подмышечной вены малого диаметра под контролем ультразвука по модифицированной методике у 12 пациентов.
Результаты. Процедура была успешна с первой пункции кожи и вены без изменения направления иглы в 11 из 12 наблюдений, среднее время до введения проводника составило 171 ± 6 с. Осложнений отмечено не было.
Заключение. Предлагаемый вариант методики эффективен при малом диаметре подмышечной вены и может быть внедрен в клиническую практику.
Ключевые слова: катетеризация центральных вен, подключичная вена, подмышечная вена, ультразвуковой контроль, продольное сечение, площадь поперечного сечения.
Поступила: 01.04.2019
Принята к печати: 03.09.2019
Введение
Подключичный доступ к подключичной вене (ПВ) в меньшей степени, чем прочие доступы, ассоциирован с инфекционными и тромботическими осложнениями [1]. Механических осложнений, прежде всего характерного для данного доступа пневмоторакса, по данным последних исследований, можно избежать при использовании ультразвука [2, 3]. С другой стороны, некоторые показатели эффективности, в частности, частота успешных катетеризаций, в том числе с первой попытки, и время проведения манипуляции не улучшаются при применении ультразвука, что показано в нескольких метаанализах [4–9].
На сегодняшний день известны три методики катетеризации ПВ под ультразвуковым (УЗ) контролем [10]. Первая — катетеризация в продольном сечении сосуда, преимущества которой в том, что по крайней мере след от продвижения иглы визуализируется по всей длине, меньше вероятность непреднамеренной пункции задней стенки (ПЗС) вены и больше — беспрепятственного введения проводника в просвет сосуда по методике Сельдингера. Недостатки — невидимость окружающих анатомических структур и легкость потери совмещенного изображения вены и следа от продвижения иглы. Возможно, это объясняет невысокую вероятность пункции ПВ с первой попытки без перенаправлений иглы в продольном сечении, составившую в недавнем исследовании лишь 48 % [2].
Вторая методика — катетеризация в поперечном сечении. Плюсы заключаются в том, что видны окружающие ткани, изображение вены «фиксировано» в плоскости сканирования, однако визуализируется лишь одна точка иглы (не всегда понятно, срез или кончик), которая вводится в вену под крутым углом, что может приводить к ПЗС [11] и затруднениям при введении проводника.
Третья методика — пункция в косом сечении сосуда [12]. В ней сочетаются преимущества предыдущих методик: видны окружающие структуры, в частности артерия, вена не теряется из вида так легко, как в продольном сечении, а пункция ее осуществляется под достаточно пологим углом. В то же время смещение тканей при про- движении иглы не может гарантировать пункцию имен- но вены, а не рядом расположенной артерии.
Граница между подмышечной веной (ПМВ) и ПВ условна [13]. Переднезадний диаметр ПМВ составляет около 0,7 см, причем вена может залегать глубоко от поверхности тела, особенно у женщин [14]. Размер и глубину расположения сосуда невозможно прогнозировать в зависимости от стороны доступа, возраста, массы, роста и доминирующей верхней конечности [15]. Продемонстрирован несколько больший просвет ПМВ в ее латеральном отделе [16].
Малый просвет вены обусловливает дополнительные сложности во время манипуляции: след от смещения тканей иглой легко потерять из вида, при неосторожном смещении датчика на повторное нахождение небольшого просвета ПМВ, совмещенного со следом от иглы, расходуется много времени. В отличие от ПВ, пункция которой по анатомическим ориентирам осуществляется легко ввиду прочных связок, натягивающих стенку сосуда, стенки ПМВ, которую можно визуализировать с помощью ультразвука, податливые. Пункцию вены малого диаметра непросто осуществить, не пунктировав ее заднюю стенку. При попадании в сосуд в фазе вдоха, когда просвет ПМВ может полностью спадаться, игла может выйти за пределы сосуда [17]. Ввиду описанных сложностей врачи часто или прекращают манипуляцию с ПВ и переходят на другую крупную вену, или вовсе не рассматривают ПМВ как объект катетеризации.
Важное значение имеет положение больного во время процедуры. В ряде работ показано, что такие приемы, как подкладывание валика между лопатками, поворот головы в противоположную сторону, тракция руки на стороне манипуляции в каудальном направлении, придание пациенту положения Тренделенбурга не увеличивают просвет ПВ и не повышают эффективность процедуры [18–21]. У здоровых пациентов в положении Тренделенбурга просвет ПВ, напротив, может уменьшаться [22]. Показано значительное, едва ли не в 2–3 раза, увеличение поперечного сечения ПМВ с валиком под ипсилатеральной лопаткой и несколько отведенной рукой [23, 24]. С отведенной, согнутой под углом 90 ° и ротированной наружу под углом 90 ° рукой [25], с валиком под поясницей [26], с головой, повернутой на 30 ° в сторону доступа [27], при положительном давлении в конце выдоха [28], особенно в сочетании с пассивным подъемом нижних конечностей [29], просвет ПМВ также может увеличиваться.
Цель исследования: продемонстрировать эффективность катетеризации ПМВ малого диаметра под УЗ-контролем.
Материалы и методы
В рамках выполнения автором диссертационной работы, предполагавшей катетеризацию ПМВ под УЗ-контролем в продольном сечении, сделана и проанализирована отдельно выборка из 12 катетеризаций ПМВ диаметром ≤ 7 мм. Процедуры выполняли с сентября 2018 г. по январь 2019 г. в отделении реанимации и интенсивной терапии для больных кардиологического профиля СПб ГБУЗ «Городская Покровская больница». Использовали УЗ-аппарат AU4 Idea (Италия), устанавливали центральные венозные катетеры Certofix® и Intradyn®. В исследование были включены пациенты 18–95 лет, которым была показана катетеризация центральной вены. Критериями исключения были несогласие на участие в исследовании, местные воспалительные процессы в подключичной области, выраженная тромбоцитопения и коагулопатия. Манипуляции выполнял врач анестезиолог-реаниматолог с опытом работы по специальности 3 года. Работа одобрена локальным этическим комитетом СЗГМУ им. И.И. Мечникова, пациенты подписывали добровольное информированное согласие на участие в исследовании.
Ультразвуковая диагностика венозного тромбоза в амбулаторных условиях

Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Острый венозный тромбоз - распространенное и опасное заболевание. Согласно статистическим данным, его частота в общей популяции составляет около 160 на 100 000 населения [1]. Тромбоз в системе нижней полой вены (НПВ) представляет собой наиболее частую и опасную разновидность этого патологического процесса и является основным источником эмболии легочных сосудов (84,5%). Система верхней полой вены дает 0,4-0,7% тромбоэмболий легочной артерии (ТЭЛА), правые отделы сердца - 10,4%. На долю тромбозов вен нижних конечностей приходится до 95% случаев всех тромбозов в системе НПВ. Диагноз острого венозного тромбоза прижизненно диагностируется у 19,2% больных [2]. В долгосрочной перспективе тромбоз глубоких вен (ТГВ) ведет к формированию посттромбофлебитической болезни, проявляющейся хронической венозной недостаточностью вплоть до развития трофических язв, что существенно снижает трудоспособность и качество жизни пациентов.
Основными механизмами внутрисосудистого образования тромбов, известными со времен R.Virchow, являются замедление тока крови (стаз), гиперкоагуляция, травма стенки сосуда (повреждение эндотелия). Острый венозный тромбоз достаточно часто развивается на фоне различных онкологических заболеваний (злокачественные опухоли желудочнокишечного тракта, женской половой сферы и др.) в силу того, что раковая интоксикация вызывает развитие гиперкоагуляционных изменений и угнетение фибринолиза, а также из-за механического сдавления вен опухолью и прорастания ее в сосудистую стенку. Предрасполагающими факторами ТГВ считаются также ожирение, беременность, прием оральных гормональных контрацептивов, наследственные тромбофилии (дефицит антитромбина III, протеина C и S, лейденовская мутация и др.), системные заболевания соединительной ткани, хронические гнойные инфекции, аллергические реакции [3, 4]. Наибольшему риску развития ТГВ подвержены больные пожилого и старческого возраста и лица, страдающие хронической венозной недостаточностью нижних конечностей, а также пациенты с инфарктом миокарда, декомпенсированной сердечной недостаточностью, инсультом, пролежнями, гангреной нижних конечностей. Особую тревогу вызывают травматологические больные, так как переломы бедренной кости в основном встречаются у лиц пожилого и старческого возраста, наиболее отягощенных соматическими заболеваниями [5]. Тромбозы у травматологических больных могут возникнуть при любой травме нижних конечностей, так как при этом имеют место все этиологические факторы тромбоза (повреждение сосуда, венозный застой и изменения свертывающих свойств крови) [6].
Надежная диагностика флеботромбоза является одной из актуальных клинических задач. Физикальные методы обследования позволяют поставить правильный диагноз лишь в типичных случаях заболевания, при этом частота диагностических ошибок достигает 50% [7]. Так, например, тромбоз вен икроножных мышц при сохраненной проходимости остальных вен нередко протекает бессимптомно. Из-за опасности пропустить острый ТГВ голеней клиницисты зачастую ставят этот диагноз в каждом случае появления болей в икроножных мышцах [8]. Особое внимание заслуживают "травматологические" больные, у которых наличие боли, отека и изменения окраски конечности могут быть следствием самой травмы, а не ТГВ. Иногда первым и единственным проявлением подобного тромбоза служит массивная ТЭЛА.
В задачи инструментального обследования входят не только подтверждение или опровержение наличия тромба, но также определение его протяженности и степени эмбологенности. Выделение эмболоопасных тромбов в отдельную группу и изучение их морфологической структуры имеют большое практическое значение, так как без этого невозможны разработка эффективной профилактики легочной эмболии и выбор оптимальной тактики лечения. Тромбоэмболические осложнения чаще наблюдаются при наличии флотирующего тромба с гетерогенной структурой, неровным гипо- или изоэхогенным контуром в отличие от тромбов, имеющих гиперэхогенный контур и гомогенную структуру. Важным критерием эмбологенности тромба является степень его подвижности в просвете сосуда. Эмболические осложнения чаще отмечаются при выраженной и умеренной подвижности тромбомасс [9, 10].
Венозный тромбоз - достаточно динамичный процесс. С течением времени процессы ретракции, гуморального и клеточного лизиса способствуют уменьшению размеров тромба. Одновременно с этим идут процессы его организации и реканализации. В большинстве случаев проходимость сосудов постепенно восстанавливается, клапанный аппарат вен разрушается, а остатки тромбов в виде пристеночных наложений деформируют сосудистую стенку. Затруднения в диагностике могут быть при возникновении повторного острого тромбоза на фоне частично реканализованных вен у больных с посттромбофлебитической болезнью. В этом случае достаточно надежным критерием является различие вен в диаметре: у пациентов с признаками реканализации тромбомасс происходит уменьшение вены в диаметре вследствие стихания острого процесса; при развитии ретромбоза вновь происходит достоверное увеличение диаметра вены с нечеткими ("размытыми") контурами стенок и окружающих тканей [9]. Этими же критериями пользуются при дифференциальной диагностике острого пристеночного тромбоза с посттромботическими изменениями вен.
Из всех неинвазивных методов, применяемых для диагностики тромбоза, в последнее время все чаще используется ультразвуковое сканирование венозной системы. Метод триплексного ангиосканирования, предложенный Barber в 1974 г., включает исследование сосудов в В-режиме, анализ допплеровского сдвига частот в виде классического спектрального анализа и цветового картирования потока (в скоростном и энергетическом режимах). Использование спектральной допплерографии позволило точно измерять кровоток внутри просвета вен. Применение метода цветового допплеровского картирования (ЦДК) обеспечило возможность быстро отличать окклюзирующий тромбоз от неокклюзирующего, выявлять начальные стадии реканализации тромбов, а также определять местоположение и размер венозных коллатералей. При исследованиях в динамике ультразвуковой метод позволяет обеспечить достаточно точный контроль за эффективностью тромболитической терапии. Кроме того, с помощью ультразвукового исследования можно установить причины появления клинической симптоматики, сходной с таковой при патологии вен, например выявить кисту Бейкера, межмышечную гематому или опухоль. Внедрение в практику ультразвуковых приборов экспертного класса с датчиками частотой от 2,5 до 14 МГц позволило достичь практически 99% точности диагностики.
Обследование включало осмотр пациентов с клиническими признаками венозного тромбоза и ТЭЛА. Больные предъявляли жалобы на отек и боль в нижней (верхней) конечности, боль в икроножной мышце (чаще распирающего характера), "тянущую" боль в подколенной области, боль и уплотнение по ходу подкожных вен. При осмотре выявлялись умеренный цианоз голени и стопы, плотный отек, болезненность при пальпации мышц голени, у большинства пациентов - положительные симптомы Хоманса и Мозеса.
Всем обследуемым проводилось триплексное сканирование венозной системы на современных ультразвуковых аппаратах линейным датчиком с частотой 7 МГц. При этом оценивалось состояние вен бедра, подколенной вены, вен голени, а также большой и малой подкожных вен. Для визуализации подвздошных вен и НПВ использовался конвексный датчик с частотой 3,5 МГц. При сканировании НПВ, подвздошных, большой подкожной вены, бедренных вен и вен голени в дистальном отделе нижних конечностей пациент находился в положении лежа на спине. Исследование подколенных вен, вен верхней трети голени и малой подкожной вены проводилось в положении пациента лежа на животе с валиком, подложенным под область голеностопных суставов. Затруднения в диагностике возникали при визуализации дистального отдела поверхностной бедренной вены у тучных пациентов, визуализации вен голени при выраженных трофических и индуральных изменениях тканей. В этих случаях также использовался конвексный датчик. Глубину сканирования, усиление эхо-сигнала и другие параметры исследования подбирали индивидуально для каждого пациента и сохраняли неизменными во время всего обследования, включая наблюдения в динамике.
Сканирование начинали в поперечном сечении для исключения наличия флотирующей верхушки тромба, о чем свидетельствовало полное соприкосновение венозных стенок во время легкой компрессии датчиком. Убедившись в отсутствии свободно флотирующей верхушки тромба, компрессионную пробу датчиком проводили от сегмента к сегменту, от проксимальных отделов к дистальным. Предлагаемая методика является наиболее точной не только для выявления тромбоза, но и для определения его протяженности (исключая подвздошные вены и НПВ, где проходимость вен определялась в режиме ЦДК). Продольное сканирование вен подтверждало наличие и характеристики венозного тромбоза. Кроме того, продольное сечение использовалось для локации анатомического слияния вен. Во время обследования оценивались состояние стенок, просвет вен, локализация тромба, его протяженность, степень фиксации к сосудистой стенке.
Ультразвуковая характеристика венозных тромбов проводилась по отношению к просвету сосуда: они различались как пристеночные, окклюзирующие и флотирующие тромбы. Признаками пристеночного тромбоза считались визуализация тромба с наличием свободного кровотока в просвете вены, отсутствие полного спадения стенок при компрессии вены датчиком, наличие дефекта заполнения при ЦДК, наличие спонтанного кровотока при спектральной допплерографии (рис.1).
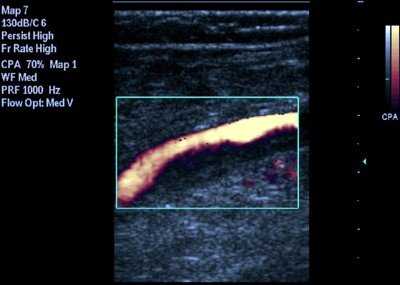
Рис. 1. Неокклюзирующий тромбоз подколенной вены. Продольное сканирование вены. Огибающий кровоток в режиме энергетического кодирования потока.
Ультразвуковыми критериями флотирующих тромбов считали: визуализацию тромба как эхогенной структуры, расположенной в просвете вены с наличием свободного пространства, колебательные движения верхушки тромба, отсутствие соприкосновения стенок вены при компрессии датчиком, наличие свободного пространства при выполнении дыхательных проб, огибающий тип кровотока при ЦДК, наличие спонтанного кровотока при спектральной допплерографии. При выявлении флотирующего тромба оценивалась степень его подвижности: выраженная - при наличии спонтанных движений тромба при спокойном дыхании и/или задержке дыхания; умеренная - при обнаружении колебательных движений тромба в ходе проведения функциональных проб (кашлевая проба); незначительная - при минимальной подвижности тромба в ответ на функциональные пробы.
Результаты исследования
С 2003 по 2006 г. были обследованы 236 пациентов в возрасте от 20 до 78 лет, из них 214 с клиникой острого тромбоза и 22 с клиникой ТЭЛА.
В первой группе в 82 (38,3%) случаях проходимость глубоких и поверхностных вен не была нарушена и клиническая симптоматика обусловлена иными причинами (табл. 1).
| Патология | Количество больных | |
|---|---|---|
| абс. | % | |
| Травма | 33 | 40,2 |
| Заболевания суставов | 18 | 22,0 |
| Лимфовенозная недостаточность | 12 | 14,6 |
| Киста Бейкера больших размеров | 6 | 7,3 |
| Лимфаденит | 5 | 6,1 |
| Внутримышечная гематома | 4 | 4,9 |
| Экстравазальная компрессия | 4 | 4,9 |
Диагноз тромбоза был подтвержден у 132 (61,7%) больных, при этом в большинстве случаев (94%) тромбоз выявлялся в системе НПВ. ТГВ был обнаружен в 47% случаев, поверхностных вен - в 39%, поражение как глубокой, так и поверхностной венозной системы наблюдалось в 14%, в том числе у 5 больных с вовлечением перфорантных вен.
Вероятные причины (факторы риска) развития венозного тромбоза представлены в табл. 2.
| Фактор риска | Количество больных | |
|---|---|---|
| абс. | % | |
| Травма (в том числе длительная гипсовая иммобилизация) | 41 | 31,0 |
| Варикозная болезнь | 26 | 19,7 |
| Злокачественные новообразования | 23 | 17,4 |
| Операции | 16 | 12,1 |
| Прием гормональных препаратов | 9 | 6,8 |
| Тромбофилии | 6 | 4,5 |
| Хроническая ишемия конечностей | 6 | 4,5 |
| Ятрогенные причины | 5 | 4,0 |
В наших наблюдениях наиболее часто выявлялись распространенная форма тромбоза, а также поражение вен на уровне подколенно-берцового и бедренно-подколенного сегментов (табл. 3).
| Локализация | Количество больных | |
|---|---|---|
| абс. | % | |
| Вены голени | 19 | 14,4 |
| Подколенная вена | 8 | 6,0 |
| Подколенно-берцовый сегмент | 34 | 25,8 |
| Бедренно-подколенный сегмент | 21 | 15,9 |
| Илеофеморальный сегмент | 5 | 3,8 |
| Бедренно-подколенно-берцовый сегмент | 38 | 38,8 |
| Подвздошно-бедренно-подколенно-берцовый сегмент | 7 | 5,3 |
Чаще (63%) имели место тромбозы, полностью окклюзирующие просвет сосуда, на втором месте по частоте (30,2%) были пристеночные тромбы. Флотирующие тромбы диагностированы в 6,8% случаев: у 1 пациента - в сафенофеморальном соустье при восходящем тромбозе ствола большой подкожной вены, у 1 - илеофеморальный тромбоз с флотирующей верхушкой в общей подвздошной вене, у 5 - в общей бедренной вене при тромбозе бедренно-подколенного сегмента и у 2 - в подколенной вене при ТГВ голени.
Протяженность нефиксированной (флотирующей) части тромба, по ультразвуковым данным, варьировала от 2 до 8 см. Чаще выявлялась умеренная подвижность тромботических масс (5 больных), в 3 случаях подвижность тромба была минимальной. У 1 пациента при спокойном дыхании визуализировались спонтанные движения тромба в просвете сосуда (высокая степень подвижности). В наших наблюдениях чаще выявлялись флотирующие тромбы с неоднородной эхоструктурой (7 человек), при этом в дистальном отделе преобладал гиперэхогенный компонент, а в области головки тромба - гипоэхогенный (рис. 2).
Рис. 2. Флотирующий тромб в общей бедренной вене. В-режим, продольное сканирование вены. Тромб гетероэхогенной структуры с четким гиперэхогенным контуром.
В первом случае зафиксирован изоэхогенный тромб с гиперэхогенным контуром (рис. 3), во втором - гомогенный "организованный" тромб с четким контуром (рис. 4).
Рис. 3. Флотирующий тромб в поверхностной бедренной вене. В-режим, продольное сканирование вены. Тромб изоэхогенной структуры с гиперэхогенным контуром.
Рис. 4. Флотирующий тромб в поверхностной бедренной вене. В-режим, продольное сканирование вены. Тромб гомогенной эхоструктуры с четким контуром.
В группе пациентов с клиникой ТЭЛА у 5 (22,7%) больных имел место ТГВ различных стадий развития (преимущественно бедренно-подколенный сегмент).
В динамике для оценки течения тромботического процесса были обследованы 82 пациента, из них у 63 (76,8%) отмечалась частичная реканализация тромботических масс. В этой группе у 28 (44,4%) больных наблюдался центральный тип реканализации (при продольном и поперечном сканировании в режиме ЦДК реканализационный канал визуализировался в центре сосуда); у 23 (35%) пациентов диагностирована пристеночная реканализация тромботических масс (чаще кровоток определялся вдоль стенки вены, непосредственно прилежащей к одноименной артерии); у 13 (20,6%) больных выявлялась неполная реканализация с фрагментарным асимметричным окрашиванием в режиме ЦДК. Тромботическая окклюзия просвета вены наблюдалась у 5 (6,1%) больных, в 6 (7,3%) случаях отмечалось восстановление просвета вены. Признаки ретромбоза сохранялись у 8 (9,8%) обследованных.
Выводы
Комплексное ультразвуковое исследование, включающее ангиосканирование с использованием спектрального, цветового и энергетического допплеровских режимов и эхографию мягких тканей, является высокоинформативным и безопасным методом, позволяющим наиболее достоверно и быстро решать вопросы дифференциальной диагностики и лечебной тактики в амбулаторной флебологической практике. Это исследование целесообразно проводить на амбулаторном этапе для более раннего выявления пациентов, которым не показана (а иногда и противопоказана) тромболитическая терапия, и направления их в профильные отделения; при подтверждении наличия венозного тромбоза необходимо выявлять лиц с высоким риском развития тромбоэмболических осложнений; наблюдать в динамике за течением тромботического процесса и тем самым корректировать лечебную тактику.
Литература
- Lindblad, Sternby N.H., Bergqvist D. Incidence of venous thromboembolism verified by necropsy over 30 years. // Br.Med.J. 1991. V. 302. P. 709-711.
- Савельев В.С. Тромбоэмболия легочной артерии - классификация, прогноз и хирургическая тактика. // Грудная и сердечно-сосудистая хирургия 1985. N°5. С. 10-12.
- Баркаган З.С. Геморрагические заболевания и синдромы. Изд. 2-е, перераб. и доп. М.:Медицина 1988; 525 с.
- Bergqvist D. Postoperative thromboembolism. // New York 1983. P. 234.
- Савельев В.С. Флебология. М.: Медицина 2001; 664 с.
- Кохан Е.П., Заварина И.К. Избранные лекции по ангиологии. М.: Наука 2000. С. 210, 218.
- Hull R., Hirsh J., Sackett D.L. et al. Combined use of leg scenning and impedance plethysmography in suspected venous thrombosis. An alternative to venography. // N.Engl.J.Med. 1977. N° 296. P. 1497-1500.
- Савельев В.С., Думпе Э.П., Яблоков Е.Г. Болезни магистральных вен. М., 1972. С. 144-150.
- Альбицкий А.В., Богачев В.Ю., Леонтьев С.Г. и др. Ультразвуковое дуплексное ангиосканирование в диагностике ретромбозов глубоких вен нижних конечностей. // Кремлевская медицина 2006. N°1. С. 60-67.
- Харченко В.П., Зубарев А.Р., Котляров П.М. Ультразвуковая флебология. М.: ЗОА "Эники". 176 с.
Журнал "SonoAce Ultrasound"
Читайте также:
