Катетеризация внутренней яремной вены под ультразвуковым контролем
Добавил пользователь Дмитрий К. Обновлено: 29.01.2026
Периферический венозный доступ
Показания:
1. Длительная инфузионная терапия.
2. Частые внутривенные вливания.
3. Экстракорпоральная терапия.
4. Повышенный риск катетеризации центральных вен.
5. Необходимость проведения наркоза.
Противопоказания. Любое патологическое состояние периферической вены: флебиты, тромбофлебиты, инфицирование места пункции.
Катетеризация через локтевую ямку. Минимальная длина катетера — 600 мм. После пункции в вену вводят на 2—4 см катетер и распускают жгут.
Катетеризация через подмышечную вену. Минимальная длина катетера — 600 мм. Частота успешных катетеризации — 90 %. После пункции вводят катетер, положение которого определяют рентгенографически. Из осложнений иногда отмечается преходящая боль.
Видео техника постановки периферического венозного катетера
Центральный венозный доступ
Показания:
1. Длительная инфузионная терапия.
2. Измерение центрального венозного давления. Преимущества
Основное достоинство — быстрое разведение раствора кровью и предотвращение раздражения стенки вены благодаря быстрому кровотоку. Возможность введения больших объемов ин-фузионных растворов. Кроме того, необходимо отметить малую вероятность выпадения катетера из вены (тщательная фиксация катетера у места вкола препятствует его слишком далекому продвижению, исключая опасность перфорирования стенки правого предсердия и возникновения летального гемоперикарда).
Центральный венозный катетер вводят через подключичную, подмышечную или яремную вены. Для контроля положения катетера и исключения пневмоторакса проводят рентгенографию.
Признаки правильного нахождения катетера в центральной вене: по катетеру должна поступать кровь, при соединении катетера с манометром уровень давления колеблется соответственно с дыхательными движениями, данные рентгенографии (если кончик катетера перфорировал стенку сосуда и находится вне его, вокруг него будет видно облачко контрастного вещества).
Катетеризация через подключичную вену. Минимальная длина катетера — 200 мм. После успешного выполнения пункции через иглу по направлению к сердцу вводят J-образный проводник. Он не должен встречать сопротивления. Если это происходит, проводник извлекают и проверяют нахождение иглы, создавая разрежение в шприце: при интенсивной струе крови повторяют введение проводника. После продвижения проводника производят извлечение иглы, расширяют пункционное отверстие скальпелем, вводят расширитель по проводнику на 3—4 см. Затем расширитель извлекают и вводят центральный венозный катетер по проводнику (при правостороннем доступе на длину 150 мм, при левостороннем — на 180 мм). Удаляют проводник, фиксируют катетер шелковыми швами к коже и начинают инфузию. Помимо общих осложнений венепункции и катетеризации, может наблюдаться осложнение в виде неправильного нахождения катетера:
• в правом предсердии или правом желудочке. При таком положении могут возникать нарушения ритма сердечных сокращений. Это связано с раздражением стенок правых отделов сердца катетером. В данном случае подтягивают катетер, пока он не попадет в верхнюю полую вену. При этом нарушения сердечного ритма проходят;
• в яремной или грудной вене. Необходимо повторное введение проводника в катетер, удаление катетера, а по проводнику вводят длинный внутривенный катетер. После подтверждения нахождения его в вене проводник можно ввести в верхнюю полую вену, изменив положение пациента — подтягивание руки в каудальном направлении и поворачивание головы и шеи в сторону катетеризации.
Катетеризация внутренней яремной вены. После успешной венепункции через иглу вводят J-образный проводник (метод Сельдингера), затем извлекают иглу, расширяют пункционное отверстие и вводят по проводнику центральный венозный катетер (справа на длину 90 мм, слева — на 120 мм). Затем извлекают проводник. После подтверждения правильности нахождения катетера (аспирацией крови) начинают инфузию. Фиксируют катетер шелковыми швами к коже, накладывают стерильную повязку. Осложнения могут наблюдаться те же, что и в предыдущем варианте (неправильное положение катетера и нарушение сердечного ритма). Иногда отмечается синдром Горнера — птоз, миоз и энофтальм вследствие раздражения каротидного клубочка, при повреждении иглой или гематомой шейной части симпатического ствола, расположенного позади сонной артерии, но вне сонного влагалища. Обычно это состояние самостоятельно проходит и не требует специальной терапии. К факторам, затрудняющим катетеризацию внутренней яремной вены, относятся ожирение, короткая толстая шея у пациента, гиповолемия.
Ультразвуковой контроль при катетеризации центральных вен у детей
Российский государственный медицинский университет им. Н.И. Пирогова.
Детская инфекционная больница N5.
Москва, Россия.

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
Катетеризация центральных вен является одним из необходимых мероприятий интенсивной терапии критических состояний. Как правило, эту операцию врачи делают на основании знаний о нормальной анатомии, руководствуясь наружными ориентирами (ключица, грудино-ключично-сосцевидная мышца, яремная вырезка и т.д.). Однако существует множество факторов, затрудняющих налаживание сосудистого доступа у больных, находящихся в тяжелом состоянии: особенности телосложения, гиповолемия, шок, врожденные деформации и аномалии развития. В связи с этим вероятность таких тяжелых ятрогенных осложнений, встречающихся при катетеризации центральных вен, как пневмоторакс, гемоторакс, лимфоторакс и их сочетаний (при ранении легкого, вены, артерии или грудного лимфатического протока), остается достаточно высокой даже при проведении процедуры опытными специалистами.
По данным ряда зарубежных авторов, механические осложнения при катетеризации центральных вен встречаются в 5-19% случаев (David C. McGee, Michael K. Gould 2003).
Количество осложнений во время катетеризации центральных вен у детей варьирует от 2,5 до 16,6% при катетеризации подключичной вены (James, Myers, Blackett et al.) и от 3,3 до 7,5% при катетеризации внутренней яремной вены (Prince et al., Hall, Geefhuysen). По нашим данным, осложнения при катетеризации внутренней яремной вены до использования предварительного ультразвукового исследования (УЗИ) встречались в 11% случаев. Все это побуждало врачей-исследователей искать пути визуализации предполагаемой вены с целью снижения частоты осложнений.
Материал и методы
Обследовано более 300 больных детей при катетеризации центральных вен с неотложными состояниями, вызванными инфекционными заболеваниями, в возрасте от 1 мес до 14 лет с массой тела от 2,6 до 62 кг. Для исследования использовались ультразвуковой сканер SonoAce-Pico (фирма "Medison", Южная Корея) с возможностью цветового допплеровского картирования, микроконвексный датчик с изменяемой частотой от 4 до 9 МГц. В своей практике мы применяли статическую и динамическую методики ультразвукового наведения.
Статическая методика: контрольное УЗИ с визуализацией интересуемых сосудов выполнялось непосредственно перед пункцией центральных вен, разметка на коже наносилась до стерилизации операционного поля (рис.1). УЗИ проводилось в двух взаимно перпендикулярных плоскостях в поперечном и сагиттальном (продольном) сечении между ножками грудино-ключично-сосцевидной мышцы при исследовании внутренней яремной вены (рис. 2, 3) и в паховой складке при исследовании бедренной вены. С помощью предварительного УЗИ определяли глубину расположения вены от поверхности кожи, непосредственно ход венозного ствола, диаметр вены, диаметр артерии, взаимное расположение вены и артерии, степень сокращения (спадения) внутренней яремной вены на вдохе при наличии гиповолемического состояния.
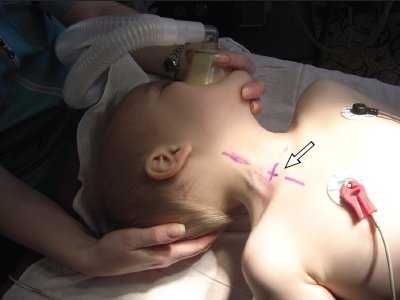
Рис. 1. Предварительная разметка расположения внутренней яремной вены.
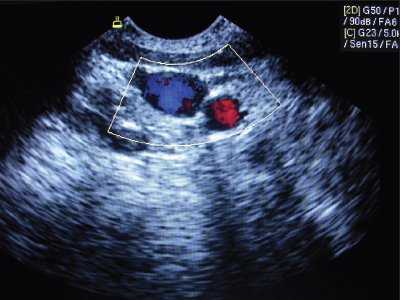
Рис. 2. Нормальное расположение и размеры внутренней яремной вены и сонной артерии при исследовании в поперечном сечении.
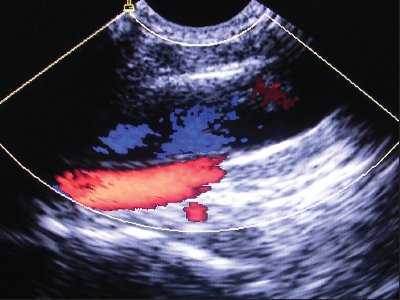
Рис. 3. Нормальное расположение и размеры внутренней яремной вены и сонной артерии при исследовании в продольном сечении (сонная артерия находится глубже внутренней яремной вены).
У детей раннего возраста УЗИ и катетеризация вены осуществлялись под общей анестезией (ингаляционный масочный наркоз фторотаном или внутривенное введение кетамина в сочетании с дормикумом), у более старших детей - под местной анестезией 1% раствором лидокаина, при необходимости проводилась седация дормикумом. Катетеризация центральных вен выполнялась по методике Сельдингера.
Динамическая методика отличается от статической тем, что на операционное поле устанавливается стерильный датчик и пункция сосуда проводится под ультразвуковым наведением в режиме реального времени. При динамической методике ультразвукового наведения нами использовался как упомянутый выше сканер SonoAce-Pico, так и специальный ультразвуковой сканер для катетеризации центральных вен Site-Rite 5 (производства BARD Access, США) с линейным мультичастотным датчиком от 5 до 11 МГц, оснащенным направляющей пункционной иглой. Стерильность датчика в области операционного поля поддерживалась путем одевания на датчик специальных стерильных одноразовых "рукавов" или как альтернативный и более дешевый вариант использования стерильной перчатки.
Результаты и обсуждение
Данные УЗИ показали, что из всех центральных вен наименьшую глубину расположения имеет внутренняя яремная вена (глубина расположения от 4 до 9 мм независимо от возраста больного).
Нами были установлены факторы риска безуспешных пункций и катетеризаций независимо от опыта врача. К таким факторам относятся аномалии развития сосудов шеи и степень спадения (уменьшения диаметра вены) во время вдоха в условиях гиповолемии.
Так, в 3% наблюдений нам удалось выявить различные аномалии размеров и расположения сосудов шеи, при наличии которых успешные пункция и катетеризация внутренней яремной вены практически были невозможными. Аномалии условно были разделены на аномалии размеров и расположения сосудов. В норме внутренняя яремная вена находится более поверхностно и латерально по отношению к сонной артерии (см. рис. 2).
При аномалии размеров отмечалось нормальное расположение внутренней яремной вены и сонной артерии, однако диаметр внутренней яремной вены был меньше диаметра сонной артерии (рис. 4).
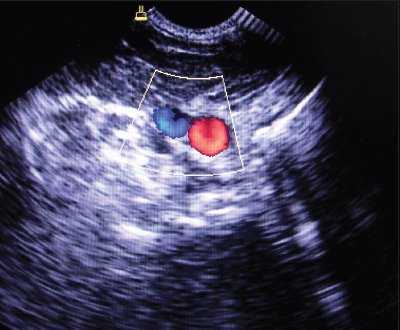
Рис. 4. Аномалия размера внутренней яремной вены при ее нормальном расположении (вена меньше сонной артерии и имеет округлый вид).
При аномалии расположения отмечалось обратное расположение сосудов: внутренняя яремная вена находилась более глубоко и медиально по отношению к сонной артерии. Как правило, диаметр внутренней яремной вены при аномалии расположения сосудов был существенно меньше диаметра сонной артерии (рис. 5). Все аномалии имели односторонний характер.
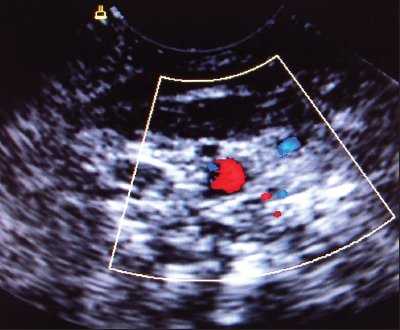
Рис. 5. Аномалия расположения и размера внутренней яремной вены (вена располагается медиальнее артерии, ее размер существенно меньше размера артерии).
С целью определения диагностической значимости степени сокращения размеров внутренней яремной вены (спадения) во время вдоха мы исследовали 10 здоровых взрослых (медицинский персонал) и в динамике 50 больных детей с грубыми волемическими нарушениями: при поступлении до проведения инфузионной терапии и перед переводом из отделения реанимации и интенсивной терапии после устранения волемических расстройств. Нами было установлено, что у здорового человека без признаков гиповолемии внутренней яремной вены имеет также тенденцию к спадению во время вдоха в горизонтальном положении, однако сокращение ее размеров не превышает 25-30%. В то же время при выраженных явлениях гиповолемии отмечается спадение внутренней яремной вены во время вдоха на 50% и более, до полного смыкания стенок вены. У больных с острыми кишечными инфекциями и явлениями обезвоживания без признаков острой дыхательной недостаточности спадение внутренней яремной вены на вдохе более 50% было расценено нами как диагностический критерий гиповолемии. Он находится в тесной взаимосвязи с другими диагностическими признаками и данными инструментальных исследований. Этот признак соответствует снижению центрального венозного давления менее 1 см вод.ст. и повышению фракции выброса, по данным ЭхоКГ, более 80%.
К методам профилактики спадения внутренней яремной вены относятся: положение пациента при катетеризации с пониженным головным концом (положение Тренделенбурга) и создание кратковременного избыточного давления под маской во время наркоза, что увеличивает кровенаполнение внутренней яремной вены и ее диаметр на 25-50%.
Если катетеризация проводится у детей старшего возраста под местной анестезией и ребенок способен сотрудничать с врачом, то при проведении пробы Вальсальвы отмечается увеличение диаметра вены в 1,5-2 раза.
Одной из проблем при катетеризации центральных вен является корректная позиция центрального венозного катетера, при которой его конец должен находиться в полости верхней полой вены над правым предсердием. По данным отечественных и зарубежных исследователей, некорректная позиция центрального венозного катетера против тока крови встречается в 0,5-18% случаев (в 5-18% при катетеризации v. subclavia и в 0,5-5% при катетеризации v. jugularis interna). Наиболее частым вариантом некорректной позиции является расположение катетера в полости внутренней яремной вены при катетеризации одноименной подключичной вены (рис. 6). В настоящее время существует несколько методов верификации позиции центрального венозного катетера: рентгено-контроль, ЭКГ-контроль; одним из них на практике становится УЗИ для уточнения положения центрального венозного катетера (рис. 7, 8).
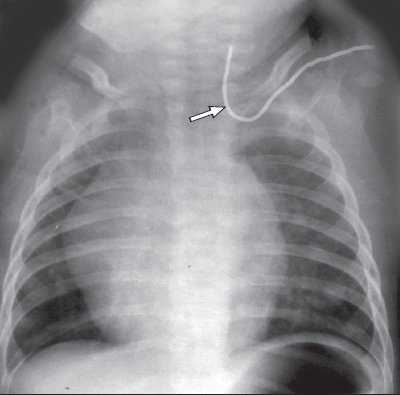
Рис. 6. Рентгенография. Некорректная позиция центрального венозного катетера, установленного через подключичную вену (катетер расположен против тока крови во внутренней яремной вене).
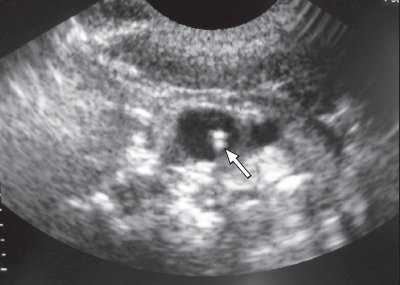
Рис. 7. Тот же катетер в просвете внутренней яремной вены при поперечном сканировании.
Применение алгоритма комплексного ультразвукового исследования сосудистой системы головного мозга при гипертонической энцефалопатии
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
В настоящее время одними из наиболее приоритетных направлений современной ангионеврологии являются профилактика, ранняя диагностика и лечение сосудистых заболеваний головного мозга в том числе их хронических форм в виде дисциркуляторной энцефалопатии 2. Ведущим фактором риска развития и прогрессирования дисциркуляторной энцефалопатии считается артериальная гипертония [1, 3, 5]. Наиболее перспективными, безопасными и доступными для оценки состояния сосудистого русла при артериальной гипертонии являются ультразвуковые (УЗ) методики 6. Как правило, наиболее глубоко изучается при дисциркуляторной энцефалопатии состояние магистральных артерий головы, в то время как морфометрические исследования головного мозга показали, что примерно 85% объема сосудистого русла мозга приходится на венозные сосуды, 10% - на артерии и 5% - на капилляры [14]. Ю.М. Никитин [10] предложил упорядочить систему применения ультразвука на фоне развернутого структурирования всей системы кровоснабжения сосудистой системы головного мозга. Представлен алгоритм комплексного УЗ-исследования сосудистой системы головного мозга на основе концепции ее построения на пяти функционально-морфологических уровнях: первый - магистральные артерии головы, второй - экстра- и интрацеребральные артерии, третий - микроциркуляторное русло, четвертый - венозная система головы (венулы, малые вены, венозные сплетения, синусы), пятый - яремные, позвоночные вены, шейные венозные сплетения, верхняя полая вена. При артериальной гипертонии наблюдаются изменения сосудов на всех структурно-функциональных уровнях единой сосудистой системы головного мозга. При этом в ряде случаев необходимо учитывать конституциональный и наследственный факторы.
209 больных гипертонической энцефалопатией (ГЭ) I-III ст. в возрасте от 37 лет до 71 года (средний возраст 52±10,7 года) были разделены на группы: с конституциональной флебопатией (КФП) - 93 (44,5%) человека и без конституциональной флебопатии (НФ) - 116 (55,5%) человек. Критериями включения в группу с КФП являлись наличие жалоб, обусловленных венозной церебральной дисциркуляцией, наличие нескольких типичных локализаций венозной патологии (варикозное расширение и тромбоз вен нижних конечностей, геморрой, варикоцеле, варикозное расширение вен пищевода), семейный "венозный" анамнез [11]. Критериями исключения явилось наличие соматических заболеваний, сопровождающихся вторичными нарушениями венозного кровообращения. Группу контроля (ГК) составили 30 человек.
Исследование сосудов шеи (артерий и вен) проводили методом цветового дуплексного сканирования в положении пациента лежа на спине после 10-минутного отдыха на современном ультразвуковом приборе линейными датчиками 5-12 МГц по алгоритму Ю.М. Никитина [10]. Оценивали структурное состояние сосудов, линейную скорость кровотока (ЛСК): максимальную (Vmax), минимальную (Vmin), усредненную по времени (Vmed), а также объемный кровоток (Vvol med, Vvol max, Vvol min) и индекс резистентности (IR).
Исследование интракраниальных сосудов проводилось методом транскраниального цветового дуплексного сканирования линейными и фазированными датчиками 2,1-2,5 МГц. Оценивали ЛСК и IR.
Первый функционально-морфологический уровень включал общие сонные артерии (ОСА), внутренние сонные артерии (ВСА), позвоночные артерии (ПА).
Оценка состояния сосудов второго функционально-морфологического уровня включала исследование кровотока по средней мозговой артерии (СМА), так как этот сосуд приносит 75% крови к полушариям мозга.
Для исследования сосудов третьего функционально-морфологического уровня - микроциркуляторного русла - оценивали цереброваскулярный резерв (ЦВР), поскольку прямое обследование мелких артерий и капилляров технически невозможно, а данный показатель непосредственно связан с их поражениями [10]. ЦВР, или гемодинамический резерв, мозга определяется уровнем реактивности мозговых сосудов [7, 9]. Для изучения реактивности вен Розенталя (ВР) выполняли пробу с сублингвальным введением 0,25 мг нитроглицерина. Динамическая оценка показателей кровотока осуществлялась на 1, 2, 3, 4, 5-й минутах после введения препарата.
Четвертый морфофункциональный уровень включал вены основания мозга, прямой синус (ПС). Исследование проводилось в положении лежа и в ортостазе.
Пятый морфофункциональный уровень включал внутренние яремные вены (ВЯВ), позвоночные вены (ПВ). Проводилась проба Вальсальвы.
Перед началом исследования всем больным выполнялась проба с отведением верхних конечностей для исключения синдрома компрессии сосудисто-нервного пучка при выходе из грудной клетки [13]. Для лучшей визуализации и устранения давления на сосуды применяли методику создания "гелевой подушки".
Все случаи гипертонической энцефалопатии были подтверждены магнитно-резонансной томографией, выполненной на аппаратах с напряженностью магнитного поля 1,5 Тл. В сосудистом режиме оценивали верхний сагиттальный, прямой, поперечные венозные синусы головного мозга, поверхностные вены мозга, большую мозговую вену, ВЯВ.
Статистическая обработка результатов проводилась с использованием прикладных программ Statistica 6.0 и Excel, с вычислением критерия достоверности (р), средней арифметической (M), стандартного отклонения (SD), результаты представлены в виде М (SD). За достоверные принимались различия при р 2 ] по сравнению с контролем [0,82 (0,29) см 2 ; p 2 ; p 0,05).
Другие закономерности выявлены при анализе параметров, характеризующих венозные нарушения. Поверхностные вены мозга у больных с КФП были статистически значимо шире по сравнению с таковыми в ГК и у НФ при всех стадиях, при этом расширение нарастало во II и III ст. ГЭ по сравнению с I ст. [с 2,97 (0,22) до 3,97 (0,33) мм]. В группе с КФП III ст. ГЭ установлено также увеличение по сравнению с ГК размеров ПС и большой мозговой вены. В группе НФ эти показатели были сопоставимы с контрольными. Гипоплазия правого или левого поперечных синусов была выявлена у 35 (37,6%) больных с КФП и у 30 (25,9%) с НФ (p>0,05). Тромбоз одного из поперечных синусов диагностирован у 7 (7,5%) больных с КФП и 2 (1,7%) НФ (p>0,05).
Полученные данные свидетельствуют о том, что гипертоническая энцефалопатия характеризуется гетерогенностью нейровизуализационных и гемодинамических показателей. Определенное значение при этом имеет наличие конституциональной венозной недостаточности. По нашим данным, при гипертонической энцефалопатии на первом и втором структурно-функциональных уровнях сосудистой системы мозга происходят нарастание структурных изменений сосудов и сосудистого сопротивления, депрессия ЛСК. Однако если по ОСА и ВСА статистически значимое снижение ЛСК выявляли лишь во II ст. ГЭ, то по СМА снижение кровотока определяли уже в I ст. ГЭ. Этот факт является подтверждением многочисленных морфологических исследований, указывающих на максимальную выраженность адаптивной перестройки церебрального циркуляторного русла в ответ на патологические повышения АД на уровне терминальных артерий и артериол [15]. Сопоставимая динамика показателей в группах с КФП и НФ свидетельствует о единстве патофизиологических механизмов и минимальном воздействии конституциональной флебопатии на формирование данных нарушений.
Функционально-нагрузочный тест с сублингвальным приемом нитроглицерина широко применяется для оценки реактивности артериальной системы головного мозга. [9]. Для интракраниальных вен не существует единого мнения о сроках и выраженности реакции на этот тест. Однако нитроглицерин является вазодилататором смешанного действия и по чувствительности к нему сосуды располагаются в следующем порядке: вены > артерии > артериолы и капиллярные сфинктеры [18]. Исходя из этого, можно предположить, что показатели реактивности интракраниальных вен при пробе с нитроглицерином являются более информативными, чем показатели реактивности СМА. Повышение IR и ЛСК по ВР в ГК в ответ на введение нитроглицерина, очевидно, свидетельствует об активной реакции со стороны мозговых венозных сосудов [7, 12, 19], что в данной ситуации позволяет предотвратить губительную гиперемию для мозга, находящегося в замкнутом пространстве черепной коробки. Снижение IR и ЛСК по ВР в группе НФ, вероятно, свидетельствует о неадекватном функционировании миогенного механизма ауторегуляции при артериальной гипертонии. Снижение только ЛСК в группе пациентов с КФП может свидетельствовать о неадекватном функционировании миогенного механизма ауторегуляции при артериальной гипертонии у больных с исходной гипотонией венозной стенки.
Повышение фоновых показателей ЛСК по ПС в группе с КФП является одной из составляющих допплерографического паттерна недостаточности венозного оттока из полости черепа и свидетельствует о включении путей коллатерального венозного оттока [12]. При проведении пробы Вальсальвы наблюдались разнонаправленные реакции. В ГК скоростные показатели возрастали, что свидетельствует о включении механизмов ауторегуляции мозгового кровообращения и активации путей коллатерального венозного оттока. У больных гипертонической энцефалопатией независимо от наличия конституциональной венозной недостаточности скоростные показатели снижались, что опять же свидетельствует о неадекватном функционировании механизмов ауторегуляции мозгового кровообращения.
У пациентов с гипертонической энцефалопатией при всех клинических вариантах течения заболевания отмечается расширение ВЯВ в области нижней луковицы, что можно рассматривать как необратимые нарушения венозной циркуляции, возникающие вследствие повышенной нагрузки объемом при артериальной гипертонии. Выявленные наряду с этим аномалии строения брахиоцефальных вен в группе с КФП значительно ограничивают резерв венозного оттока, что может приводить к клинической декомпенсации при повышении артериального притока, при нарушении центральных механизмов венозного оттока, при присоединении патологии контралатеральной вены [13]. Снижение линейных и увеличение объемных параметров кровотока по ВЯВ у больных с КФП могут свидетельствовать о наличии венозного застоя у больных данной группы на фоне веногипотонии.
Усиление кровотока по ПВ при гипертонической энцефалопатии, прежде всего у больных с КФП, позволяет расценивать их как дополнительные пути оттока крови от мозга [11, 13]. Однако отсутствие взаимосвязей между увеличением скорости кровотока по ПВ и гемодинамическими параметрами в интракраниальных венозных сосудах свидетельствует о том, что состояние гемодинамики по ПВ может лишь косвенно отражать состояние интракраниальной венозной гемодинамики.
Данные МРТ подтвердили наличие интракраниального венозного застоя у больных с КФП: увеличение размеров поверхностных вен мозга, прямого синуса и большой мозговой вены.
В нашем исследовании отсутствовала взаимосвязь между показателями гемодинамики сосудов четвертого и пятого структурно-функциональных уровней. По данным МРТ также с одинаковой частотой были выявлены тромбозы внутричерепных синусов у больных как с КФП, так и без таковой. Эти факты, вероятно, свидетельствуют о том, что при гипертонической энцефалопатии тромбоз и несостоятельность магистральных путей венозного оттока могут быть компенсированы включением коллатеральных путей оттока и не являются основной причиной нарушения интракраниальной венозной гемодинамики. Однако, оценивая структуру ВЯВ, состояние остиальных клапанов, гемодинамику по магистральным венам, мы можем выделить группу больных с наличием конституциональной флебопатии с нарушением тонуса и функциональных возможностей интракраниальных вен, что и служит основной причиной развития внутричерепной венозной дисциркуляции при гипертонической энцефалопатии.
Заключение
При гипертонической энцефалопатии выявлены изменения на всех пяти структурно-функциональных уровнях сосудистой системы головного мозга, что требует при инструментальных исследованиях системного подхода к оценке результатов.
При этом патологические процессы, развивающиеся на первом и втором структурно-функциональных уровнях, соответствуют ремоделированию, характерному для артериальной гипертонии, нарастают по мере утяжеления стадии заболевания и не зависят от наличия конституциональной венозной недостаточности. Характер изменений третьего, четвертого и пятого структурнофункциональных уровней в определенной степени зависит от конституционального и наследственного факторов.
Применение алгоритма комплексного УЗ-исследования сосудистой системы головного мозга способствует раскрытию закономерностей возникновения и развития гипертонической энцефалопатии у больных как с интактными венами, так и с конституциональной венозной недостаточностью, что необходимо для оптимизации этиопатогенетической терапии.
Литература
- Варакин Ю.Я. Эпидемиология сосудистых заболеваний головного мозга // Очерки ангионеврологии / Под ред. Суслиной З.А. М.: Атмосфера, 2005. 368 с.
- Котова Е.Ю., Машин В.В. Артериальная гипертония и острое нарушение мозгового кровообращения (по данным регистра инсульта в г. Ульяновске) // Тезисы докладов Российской конференции "Артериальная гипертония: спорные и нерешенные вопросы". Клиническая медицина. 2010. N 1. С. 44-45.
- Суслина З.А., Фонякин А.В., Гераскина Л.А. и др. Практическая кардионеврология М.: ИМА-ПРЕСС, 2010. 304 с.
- Yvonne Teuschl, Michael Brainin. Stroke education: discrepancies among factors influencing prehospital delay and stroke knowledge. International Journal of Stroke. 2010. V. 5, Issue 3. P. 187-208.
- Гипертоническая энцефалопатия: клинико-патогенетические подтипы, классификация, диагностика / Л.А. Белова, В.В. Машин, Ю.М. Никитин, В.Г. Белов. Ульяновск: УлГУ, 2010. 210 с.
- Белова Л.А. Ультразвуковая диагностика гипертонической энцефалопатии с позиции системного подхода (обзор литературы) // Клиническая физиология кровообращения. 2010. N 2. С. 12-15.
- Куликов В.П. Артериовенозная церебральная реактивность на гиперкапнию в диагностике нарушений мозгового кровообращения // Материалы I Международной конференции "Нейросонология и церебральная гемодинамика" // Клиническая физиология кровообращения. 2009. N 4. С. 5-15.
- Кунцевич Г.И., Танашян М.М., Скрылев С.И. и др. Роль ультразвуковых методов исследования на этапах медикаментозного и хирургического лечения сосудисто-мозговой недостаточности // Материалы I Международной конференции "Нейросонология и церебральная гемодинамика". Клиническая физиология кровообращения. 2009. N 4. С. 63-69.
- Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология М.: Реальное Время, 2004. 304 с.
- Никитин Ю.М. Алгоритм ультразвуковой диагностики поражений функционально-морфологических уровней кровоснабжения головного мозга в неврологической практике // Журн. неврол. и психиатр. им. С.С. Корсакова. 2007. Вып. 20. С. 46-49.
- Стулин И.Д., Дебиров М.Д., Хорева Е.Т. и др. Энцефалопатия пробуждения - синдром преходящей венозной дисгемии у флебопатов // Клиническая физиология кровообращения. Материалы конференции "Нейросонология и церебральная гемодинамика". М., 2009. С. 33-36.
- Шахнович А.Р., Шахнович В.А. // Клиническая физиология крообращения. Материалы конференции "Нейросонология и церебральная гемодинамика". 2009. N 3. С. 5-15.
- Шумилина М.В. Комплексная ультразвуковая диагностика патологии периферических сосудов. Учебно-методическое руководство. М. НЦССХ им. А.Н. Бакулева РАМН, 2007. 310 с.
- Мчедлишвили Г.И. Спазм артерий головного мозга. Тбилиси: Мецниереба, 1977. 181 с.
- Верещагин Н.В., Гулевская Т.С., Моргунов В.А. Системный подход как основа методологии изучения сосудистых заболеваний головного мозга // Очерки ангионеврологии / Под ред. Суслиной З.А. М.: Атмосфера, 2005. 368 с.
- Белова Л.А., Никитин Ю.М., Машин В.В. и др. Клинико-неврологические и ультразвуковые критерии конституциональной венозной недостаточности при гипертонической энцефалопатии // Кремлевская медицина. Клинический вестник. 2010. Вып. 4 "Неврология". С. 12-15.
- Попова Е.В., Иванов А.Ю., Иванова Н.Е. и др. Взаимосвязь внутричерепного давления и скорости кровотока по позвоночным венам // Ультразвуковая и функциональная диагностика. 2007. N 4. С. 126.
- Харкевич Д.А. Фармакология: учебник / Д.А. Харкевич. 6-е изд., перераб. и доп. М.: ГЭОТАР Медицина, 1999. 664 с.
- Белова Л.А., Машин В.В., Белов В.Г. и др. Оценка состояния реактивности вен Розенталя у больных гипертонической энцефалопатией при нагрузочном тестировании нитроглицерином // Неврол. вестник. 2009. N 3. С. 32-37.
УЗИ сканер RS80
Катетеризация внутренней яремной вены под ультразвуковым контролем
Для катетеризации внутренней яремной вены под контролем ультрасонографии используется ультразвук в режиме реального времени (динамически) для проведения венопункции и проволочный направитель (метод Сельдингера) для введения центрального венозного катетера через внутреннюю яремную вену в верхнюю полую вену. Используются три доступа (центральный, передний и задний); центральный доступ описан здесь.
Ультразвуковой контроль постановки внутреннего яремного катетера увеличивает вероятность успешной катетеризации и снижает риск осложнений. При наличии ультразвукового контроля и обученного персонала этот метод установки является предпочтительным.
Центральный венозный катетер (ЦВК) внутренней яремной вены или периферически вводимый центральный венозный катетер (ПВЦК) Катетеризация периферической вены Ряд манипуляций выполняется для получения сосудистого доступа. Потребности большинства пациентов во внутривенных инфузиях жидкости и лекарств могут быть удовлетворены с помощью чрескожного периферического. Прочитайте дополнительные сведения (См. также Сосудистый доступ Катетеризация центральной вены Ряд манипуляций выполняется для получения сосудистого доступа. Потребности большинства пациентов во внутривенных инфузиях жидкости и лекарств могут быть удовлетворены с помощью чрескожного периферического. Прочитайте дополнительные сведения и Выполнение катетеризации внутренней яремной вены Как выполнить катетеризацию внутренней яремной вены При чрескожной катетеризации внутренней яремной вены анатомические ориентиры используются для проведения венепункции, а при методе Сельдингера – для введения центрального венозного катетера. Прочитайте дополнительные сведенияПоказания к катетеризации внутренней яремной вены под контролем УЗИ
Безопасный или долгосрочный венозный доступ, недоступный при использовании других участков
Невозможность получить периферический венозный доступ Катетеризация периферической вены Ряд манипуляций выполняется для получения сосудистого доступа. Потребности большинства пациентов во внутривенных инфузиях жидкости и лекарств могут быть удовлетворены с помощью чрескожного периферического. Прочитайте дополнительные сведенияВнутривенное вливание жидкостей и препаратов для пациентов с остановкой сердца
Внутривенное вливание концентрированных или раздражающих жидкостей
Внутривенное вливание интенсивных потоков или больших объемов жидкости, превышающих допустимые возможности при использовании периферических венозных катетеров
Мониторинг центрального венозного давления (ЦВД)
Гемодиализ или плазмаферез
Трансвенозная электрокардиостимуляция (см. видео Установка трансвенозного электрокардиостимулятора Электрокардиостимуляторы (катетер Свана-Ганца)*
Установка фильтра нижней полой вены
* Для трансвенозной кардиостимуляции или мониторинга легочных артерий предпочтительнее использовать канюляцию левой подключичной Методика проведения катетеризации подключичной вены под контролем УЗИ Для катетеризации подключичной вены под контролем ультрасонографии используется ультразвук в режиме реального времени (динамически) для проведения венопункции и проводник (метод Сельдингера). Прочитайте дополнительные сведенияПротивопоказания к катетеризации внутренней яремной вены под УЗ-контролем
Абсолютные противопоказания
Нетренированный или неопытный оператор УЗИ
Неподходящая внутренняя яремная вена, тромбированная (несжимаемая) или недоступная по данным ультразвукового исследования
Локальная инфекция в месте введения
Катетер, пропитанный антибиотиком, для пациента с аллергией
Относительные противопоказания
Коагулопатия, включая терапевтическую антикоагуляцию*
Локальные искажения анатомических структур, травматические или врожденные, или выраженное ожирение
Злокачественный синдром верхней полой вены
Тяжелая кардиореспираторная недостаточность или повышенное внутричерепное или внутриглазное давление (состояние пациентов может усугубить позиция Тренделенбурга [головой вниз])
Анамнез предшествующей катетеризации предполагаемой центральной вены
Неконтактный пациент (при необходимости следует воздействовать седативным средством)
Блокада левой ножки пучка Гиса: проволочный направитель или катетер в правом желудочке могут вызывать полную блокаду сердца.
* Антикоагулянтная терапия (например, при тромбоэмболии легочной артерии) увеличивает риск кровотечения при катетеризации внутренней яремной вены, однако это должно сопоставляться с повышенным риском тромбоза (например, инсульта) при отмене антикоагулянтной терапии. Обсудите все предполагаемые изменения с лечащим врачом, назначившим антикоагулянтную терапию, а затем с пациентом. Может быть предпочтителен катетер бедренной вены или артерии Катетеризация бедренной вены При чрескожной катетеризации бедренной вены анатомические ориентиры используются для проведения венепункции, а при методике Сельдингера – для введения центрального венозного катетера через бедренную. Прочитайте дополнительные сведения
Осложнения при катетеризации внутренней яремной вены под ультразвуковым контролем
Аритмии или перфорация предсердий, обычно вызванные неправильным введением проволочного направителя или катетера
* Редкие осложнения, связанные с неправильной установкой катетера, включают катетеризацию артерии, гидроторакс, гидромедиастинум и повреждение трехстворчатого клапана.
Эмболия по причине проволочного направителя или катетера также встречается редко.
Чтобы снизить риск венозного тромбоза и сепсиса, ЦВК следует удалять сразу же по мере отсутствия в нем необходимости.
Оборудование для катетеризации внутренней яремной вены под ультразвуковым контролем
Стерильные процедуры, барьерная защита
Раствор антисептика (например, спиртовый раствор хлоргексидина, хлоргексидин, повидон-йод, этаноловый спирт)
Большие стерильные хирургические простыни, полотенца
Стерильные головные уборы, маски, медицинские халаты, перчатки
Защитные лицевые щитки
Ультразвуковое исследование
Ультразвуковой аппарат с высокочастотным (например, от 5 до 10 МГц) линейным матричным датчиком (преобразователем)
Контактный гель для ультразвуковых исследований, нестерильный или же стерильный
Стерильный чехол для датчика для складывания в него датчика и шнура, стерильные эластичные ленты (в качестве альтернативы, датчик может быть помещен в стерильную перчатку, а шнур – в стерильную салфетку)
Техника Селдингера (замена катетера по проволочному направителю
Мониторинг сердечной деятельности
Местный анестетик (например, 1% раствор лидокаина без адреналина объёмом около 5 мл)
Небольшая игла для анестезии (например, 25–27 калибра, около 1 дюйма [3 см] длиной)
Большая игла для анестезии/поиска * (22 калибра, около 1,5 дюйма [4 см] длиной)
Игла-интродьюсер (например, тонкостенная, 18 или 16 калибра, с скошенной внутрь втулкой, около 2,5 дюймов [6 см] длиной)
3- и 5-мл шприцы (используйте шприцы с соответствующим наконечником для надевания иглы-интродьюсера)
Проволочный направитель, наконечник в форме буквы J
Центральный венозный катетер (взрослый: 8 по французской шкале диаметра катетеров или больше, минимальная длина катетера для внутренней яремной вены составляет 15 см для правой стороны и 20 см для левой стороны)
Стерильная марля (например, квадраты 4 × 4 дюйма [10 × 10 см])
Стерильный солевой раствор для промывки катетерного порта или портов
Невсасывающий шелк или нейлон (например, 3-0 или 4-0)
Хлоргексидиновый пластырь, прозрачная окклюзионная повязка
* Поисковая игла – это более тонкая игла, используемая для определения местоположения вены перед введением проводниковой иглы. Обычно её использование не требуется для катетеризации под ультразвуковым контролем.
Для уменьшения риска тромбоза наружный диаметр ЦВК должен быть меньше или равен 1/3 внутреннего диаметра вены (по данным УЗИ).
Полезно иметь при операции одного или двух помощников.
Дополнительные факторы
Короткоосевую (кросс-секционную, поперечную) ультразвуковую проекцию легко получить, и она является лучшим изображением для идентификации вен и артерий и их ориентации относительно друг друга. Идентификация кончика иглы в поперечном сечении требует некоторого навыка, поскольку игла выглядит как эхогенная (то есть, белая) точка, и кончик можно отличить только по исчезновению и повторному появлению точки при перемещении кончика иглы назад и вперед через плоскость визуализации. Короткоосевая проекция обычно используется для определения подходящего места пункции вены и направления введения иглы под большим углом (например, ≥ 45 °).
Длинноосевую (продольную, в плоскости) ультразвуковую проекцию технически более трудно получить (необходимо держать датчик, вену и иглу в одной плоскости), однако она показывает иглу в продольном направлении, так что вся игла, включая кончик, может непрерывно визуализироваться по мере приближения и вхождения в вену. Это помогает избежать неправильного размещения. Длинносевая проекция эффективна, если угол введения иглы небольшой (например, при канюляции подмышечной/подключичной вен) и для подтверждения правильного продольного расположения иглы при введении по короткой оси.
Иногда попытки катетеризации оказываются безуспешными. Не следует повторять более 2 или 3 попыток (что увеличивает риск осложнений), и с каждой новой попыткой следует использовать новое оборудование (т.е. не использовать повторно иглы, катетеры или другое оборудование, поскольку оно может быть закупорено тканью или кровью).
Во время остановки сердца или даже при низком кровяном давлении и гипоксии артериальная кровь может быть темной и не пульсирующей, поэтому ошибочно может быть принята за венозную кровь.
Если внутренняя яремная артерия канюлирована либо расширителем ткани, либо ЦВК, оставьте расширитель или катетер на месте и получите хирургическую консультацию по поводу возможного хирургического удаления.
Сопутствующая анатомия
Передний шейный треугольник внизу ограничен ключицей, а латерально и медиально – ключичной и грудинной головками грудино-ключично-сосцевидной мышцы.
В пределах переднего шейного треугольника внутренняя яремная вена обычно располагается поверхностно и латерально (часто минимально латерально) к сонной артерии. Однако, поскольку вариантная анатомия этих сосудов встречается регулярно (у 9–19% пациентов), особенно целесообразным является проведение катетеризации внутренней яремной вены под ультразвуковым контролем.
Чаще всего используется центральный доступ на внутренней яремной вене. Игла-интродьюсер вводится в кожу на вершине шейного треугольника и продвигается проксимально (каудально) под углом 45° к коже до пересечения с веной.
На место входа катетера влияют как сама визуализация, так и размеры наконечника датчика (т.е. место входа катетера при длинноволновой ультразвуковой визуализации может быть на несколько сантиметров дистальнее, чем при коротковолновой ультразвуковой визуализации).
Для катетеризации правая внутренняя яремная вена обычно предпочтительнее левой, так как она имеет больший диаметр и обеспечивает более прямой доступ к верхней полой вене.
Положение для катетеризации внутренней яремной вены под ультразвуковым контролем
Необходимо поднять кровать пациента на удобную для оператора высоту (чтобы во время выполнения процедуры можно было стоять прямо).
Уложите пациента на спину в положение Тренделенбурга (кровать с опущенным на 15–20°головным концом), чтобы растянуть внутреннюю яремную вену и предотвратить воздушную эмболию.
Слегка поверните голову пациента в противоположную сторону, чтобы заранее открыть доступ к внутренней яремной вене, при этом не перекрывая его сонной артерией (во время процедуры следует использовать ультрасонографию для оптимального облегчения доступа к вене).
Встаньте на край кровати.
Пошаговое описание методики
Предварительная подготовка (нестерильная)
Проверьте правильность настройки и работы ультразвукового аппарата: убедитесь, что изображение на экране соответствует пространственной ориентации датчика в тот момент, когда вы держите и перемещаете его. Боковая метка на кончике датчика соответствует синей маркерной точке на экране ультразвукового аппарата. При необходимости отрегулируйте настройки экрана и положение датчика для достижения точной ориентации влево-вправо.
Выполните нестерильное (т.е. с использованием датчика без чехла и нестерильного геля) ультразвуковое исследование бедренной вены на 2,5 см ниже паховой связки и определите, подходит ли она для катетеризации. Используйте короткоосевую проекцию (поперечного сечения). Начните с вершины переднего шейного треугольника и медленно проведите датчиком проксимально (по направлению к ключице) вдоль латерального края грудино-ключично-сосцевидной мышцы. Кровеносные сосуды имеют гипоэхогенную структуру (на экране ультразвукового аппарата отображаются черным). Вены, как правило, более крупные, тонкостенные и яйцевидные (а не толстостенные и круглые) и легче сдавливаются (легким надавливанием на верхлежащую кожу), чем их парные артерии. Диаметр внутренней яремной вены меняется в зависимости от дыхания и увеличивается в положения Тренделенбурга и при проведении пробы Вальсальвы.
Венозный тромбоз может проявляться в виде участка эхогенности (серой неровности) в просвете сосуда, но часто диагностируется, потому что тромбированная вена не сдавливается. Тромбоз дисквалифицирует вену как подходящее место проведения катетеризации.
Канюлируют центральную вену в месте оптимальной короткоосевой визуализации (т.е., в месте поперечного сечения вены большого диаметра, без вышележащей артерии).
Читайте также:
