Кератины промежуточных филаментов
Добавил пользователь Cypher Обновлено: 29.01.2026
В состав промежуточных филаментов входит большая группа изобелков, родственных белков, которую можно разделить на четыре типа. Первый – кератины, кислые и нейтральные, встречающиеся в эпителиальных клетках; они образуют гетерополимеры из этих двух подтипов. Кератины, кроме того, имеют некоторую гетерогенность, зависящую от тканевого источника. Так, в эпителиях встречается до 20 форм кератинов, 10 форм других кератинов найдено в волосах и ногтях. Молекулярный вес кератинов колеблется от 40 до 70 тыс.
Второй тип белков ПФ включает в себя три вида белков, имеющих сходный молекулярный вес (45-53 тыс.). Это – виментин, характерный для клеток мезенхимного происхождения, входящий в состав цитоскелета клеток соединительной ткани, эндотелия, клеток крови. Десмин – характерен для мышечных клеток, как гладких, так и исчерченных. Глиальный фибриллярный белок входит в состав ПФ некоторых клеток нервной глии – в астроциты и некоторые Шванновские клетки. Периферин – входит в состав периферических и центральных нейронов.
Третий тип – белки нейрофиламентов (мол. вес от 60 до 130 тыс.) встречается в аксонах нервных клеток.
И наконец, четвертый тип – белки ядерной ламины. Хотя эти последние имеют ядерную локализацию, они сходны по строению и свойствам со всеми белками промежуточных филаментов.
Как уже говорилось, промежуточные филаменты, построены из фибриллярных белков наподобие каната. При этом некоторые белки могут образовывать сополимеры, например виментин с десмином, или виментин с глиальными белками.
Все белки промежуточных филаментов обладают сходной аминокислотной последовательностью из 130 остатков в центральной части фибриллярной молекулы, которая обладает -спиральным строением. Концевые же участки молекул имеют разные последовательности аминокислот, разную длину, и не имеют -спирального строения. Наличие протяженных -спиральных участков позволяет двум молекулам образовывать двойную спираль, подобно тому, что приводит к образованию палочковидного димера, длиной около 48 нм. Два димера, объединяясь бок о бок, образуют короткий протофиламент, тетрамер, толщиной около 3 нм. Такие протофиламенты могут объединяться в более толстые и длинные фибриллы и в конечном итоге в промежуточный полный филамент, состоящий из 8 продольных протофиламентов (рис. 242).
Иначе полимеризуются белки ядерной ламины: они образуют димеры с головками на одном конце и полимеризуются, образую рыхлую прямоугольную решетку. Такие слои ламины быстро разрушаются во время митоза при фосфорилировании ламинов.
Цитоплазматические промежуточные филаменты относятся к самым стабильным и долгоживущим элементам цитоскелета. Однако in vivo наблюдается включение инъецированных меченых молекул кератина в состав ПФ эпителиальных клеток. ПФ устойчивы к действию солей низкой и высокой концентрации, разрушаются только после воздействия денатурирующих растворов, таких как мочевина.
Такая структура и химическая устойчивость промежуточных филаментов, вероятно, определяет и их физическую устойчивость. Они служат как бы истинно опорной системой в клетках подвергающихся значительным физическим нагрузкам. В клетках кожного эпидермиса промежуточные филаменты образуют пучки (тонофиламенты), связанные с десмосомами, и создают жесткую внутриклеточную сеть (рис. 243). Так, в нервных аксонах, простирающихся на многие десятки сантиметров, ПФ или нейрофиламенты создают жесткую основу, обеспечивающую гибкость и целостность тонких цитоплазматических отростков нервных клеток. В поперечно исчерченных мышечных клеток десминовые филаменты входят в состав z-дисков и связывают их друг с другом как в составе саркомера, так и в соседних миофибриллах, а также с плазматической мембраной.
Специфических ингибиторов полимеризации белков промежуточных филаментов пока еще не найдено. Поэтому остается неясным сам процесс сборки и разборки этих элементов цитоскелета в живой клетке. Вероятнее всего, что они подобно ламинам деполимеризуются при действии цитоплазматических киназ, приводящих к их фосфорилированию. Выделенные промежуточные филаменты под действием фосфорилаз могут распадаться на мономеры, деполимеризоваться.
Топографически в клетке расположение промежуточных филаментов повторяет расположение микротрубочек, они как бы идут бок о бок. При разрушении микротрубочек колхицином, происходит т.н. колапс промежуточных филаментов: они собираются в плотные пучки или кольца вокруг ядра. Восстановление новой сети промежуточных филаментов начинается от зоны клеточного центра. Это наводит на мысль, что центром их полимеризации или нуклеации могут быть центры, общие с микротрубочками.
Кератины промежуточных филаментов
• У млекопитающих большая часть белков промежуточных филаментов представлена кератинами
• Кератины являются облигатными гетерополимерами белков типа I и II
• Характер совместной экспрессии кератинов обоих видов служит показателем степени дифференцировки клеток эпителия и их пролиферативного статуса
• К числу наименее специализированных относятся простые кератины К8 и К18
• Из белков всех промежуточных филаментов наиболее сложным и варьирующим типом экспрессии отличаются кератины, выполняющие барьерную функцию
• Структурные кератины твердых опорных структур отличаются от других кератинов и, вероятно, принадлежат к эволюционно наиболее поздним белкам
Большинство генов белков промежуточных филаментов у человека кодируют кератины. Как показано в таблицах ниже, известно 28 кератинов, относящихся к типу I, и 26 белков, относящихся ко II типу. В ткани эпителия кератины, которые иногда называются цитокератинами, экспрессируются совместно, т. е. как тип I/тип II. Экспрессия кератинов является настолько характерной особенностью клеток эпителия, что их присутствие может служить признаком эпителиальной ткани. Ткани, которые не экспрессируют кератины (например, клетки эндотелия кровеносных сосудов) не относятся к эпителиальным.
Кератиновые филаменты связаны с межклеточными контактами (десмосомами) и с местами контактов клетки с матриксом (полудесмосомами).
Все вместе образует структурную сеть, которая особенно характерна для многослойного эпителия, например эпидермиса. Основные кератины эпителиального слоя подразделяются на группы в зависисмости от заряда и молекулярной массы. В состав группы К1 (тип II) входят наиболее крупные и основные белки, а в состав группы К19 — более мелкие и кислые белки группы I.
Каждый кератин группы I экспрессируется совместно с кератином группы II, и каждая пара характерна для степени дифференцировки и специализации определенного типа клеток эпителия. Хотя in vitro любой из кератинов, относящихся к I или II типу, будет образовывать филаменты с различными комплементарными кератинами другого типа, in vivo они проявляют гораздо большую селективность, образуя специфические пары.
Экспрессия таких пар кератинов тесно связана со специфическими направлениями дифференцировки эпителия или даже с различными стадиями этого процесса, и присутствие одного представителя пары почти всегда служит признаком наличия другого. С функциональной точки зрения, пары кератинов можно подразделить по крайней мере на три группы: простые, барьерные и структурные кератины.

Экспрессия кератинов характеризуется тканевой специфичностью.
Они экспрессируется попарно: тип I/тип II.
Каждая пара характерна для специфического типа дифференцировки эпителия. Выделены первичные кератины.
Кератины экспрессируются в клетках эпителия. Эпителиальная ткань представляет собой тип тканевой организации, который характеризуется плотной упаковкой клеток в один или несколько слоев. Эпителий образует границу органов, а также секреторных и всасывающих протоков. В этих случаях обычно говорят об однослойном эпителии, клетки которого непосредственно контактируют с подлежащим слоем внеклеточного матрикса (базальной ламины), а свободная поверхность открыта в просвет протока или кишки.
Крайний случай представляет собой многослойный или стратифицированный эпителий, образующий основную барьерную ткань оболочек тела и органов. К этому типу относятся эпидермис, покрывающий внешнюю поверхность тела, а также специализированный эпителий, выстилающий отверстия и полости прилегающих к ним протоков. Клетки стратифицированного эпителия обычно называют кератиноцитами. Ткань стратифицированного эпителия также формирует дополнительные структуры эмбрионального происхождения, состоящие из специализированного сложного эпителия, образующего, например, железы, волосы и ногти, которые могут включать участки, состоящие из простого эпителия.
Наружные клетки полностью сформировавшегося стратифицированного барьерного эпителия плоской или чешуйчатой формы. Этот эпителий обычно состоит из 6-10 слоев клеток Чтобы защитить тело от физических, химических и канцерогенных воздействий, клетки постоянно обновляются.
Клетки эпителия скрепляются вместе посредством десмосом, а также полудесмосом с субстратами. Все контакты в виде плотной сети, состоящей из связок кератиновых филаментов, проходят через цитоплазму каждой клетки. По сравнению с клетками других типов, кератиноциты многослойного эпителия экспрессируют большее количество и более широкий набор белков промежуточных филаментов, что связано с тем, что эти клетки должны противостоять массивным внешним физическим воздействиям.
Состав специфических белков кератиновых филаментов, которые экспрессируются в эпителиальных клетках, зависит от локализации и физиологического состояния последних. Особенно отчетливо это прослеживается в изменении экспрессии кератина, которое происходит при дифференцировке клеток стратифицированного эпителия. К числу наименее дифференцированных клеток стратифицированного эпителия принадлежат базальные клетки, которые еще сохраняют контакт с базальной мембраной. Эти клетки еще способны к делению, некоторые из них являются стволовыми клетками ткани, и делиться крайне редко, однако большая часть клеток делится, обеспечивая тем самым рост ткани.
После того как базальная клетка разделилась, одна из дочерних клеток покидает базальный компартмент и перемещается в первый супрабазальный слой. В результате этого важного перемещения клетка выходит из-под прямого влияния базальной мембраны и сигналов роста и становится коммитированной к терминальной дифференцировке. Затем клетка начинает свой путь к поверхности эпителия. Этот путь представляет собой процесс терминальной дифференцировки, который в конце концов завершается гибелью клетки и ее потерей из ткани. Рисунок ниже иллюстрирует прогрессирующие изменения экспрессии кератинов, связанные с выходом некоторых клеток из пролиферативного компартмента и их коммитированием к дифференцировке.
В процессе развития первыми экспрессируются простые кератины. В этой группе первичные или универсальные кератины представлены белками К8 (тип II) и К18 (тип I). Они присутствуют в ранних эмбриональных клетках и, по-видимому, представляют собой эволюционно наиболее древние кератины. Их экспрессия минимальна, что соответствует наименее дифференцированному состоянию кератинов, характерному для функционального эпителия, пласт которого состоит из поляризованных и плотно, без промежутков, скрепленных между собой клеток.
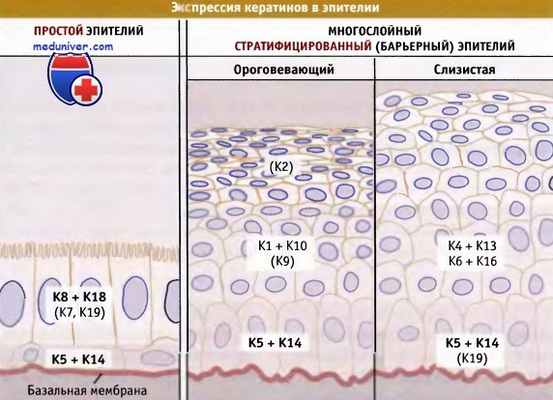
Последовательность экспрессии основных кератинов в однослойном (например, в железистом) и барьерном (например, в ороговевающем или слизистом) эпителии.
Первичные кератины выделены жирным шрифтом. Вариабельные или минорные кератины не показаны.
Экспрессия кератинов зависит от положения клеток в ткани и, таким образом, от ее пролифертивного статуса:
утрата контакта клеток с базальным слоем приводит к их выходу из цикла и к вступлению в дифференцировку.
У позвоночных К8 и К18 представляют собой белки с наиболее консервативной первичной структурой и присутствуют в клетках на всех ступенях развития, от яйцеклетки до зрелой ткани. Все эмбриональные клетки экспрессируют К8 и К18 до стадии гаструляции, когда некоторые эктодермальные клетки начинают дифференцироваться, образуя слой мезодермы, прекращают синтез К8/К18, и начинают экспрессировать виментин, белок, относящийся к типу III.
Белки К8 и К18 продолжают экспрессироваться в клетках эмбрионального эпителия до тех пор, пока эти клетки не станут коммитированными к специфическому направлению морфогенеза, т. е. когда они начинают экспрессировать тканеспецифические белки промежуточных филаментов. Во взрослом организме К8 и К18 характерны для клеток простого эпителия, обладающих секреторными и/или всасывающими функциями, например клеток желез, печени, дыхательного эпителия и желудочно-кишечного тракта. Эти белки экспрессируются в клетках различных карцином, и антитела к ним широко используются для диагностики различных патологических состояний. Наряду с первичными кератинами, известны, по меньшей мере, еще два простых кератина, К7 (близкий к К8 в основном содержится в клетках протоков желез) и К20 (близкий к К18, который содержится в отделах желудочно-кишечного тракта).
Барьерные кератины характерны для стратифицированного эпителия. К первичным, или основным, кератинам этой группы относятся К14 (тип I) и К5 (тип II), присутствующие в кератиноцитах базального слоя стратифицированного сквамозного эпителия, например эпителия кожи. Этот слой, состоящий из одного ряда базальных клеток, экспрессирующих К5/К14, представляет собой наименее дифференцированный тканевой компартмент, сохраняющий способность к пролиферации. В сложном железистом эпителии, наряду с простыми клетками, экспрессирующими К8/К18, находятся базальные клетки, экспрессирующие К5/К14. В некоторых тканях базальные пролиферирующие клетки экспрессируют другие кератины, например К19, К15 и К6/К17.
Когда клетки выходят из базального слоя, они прекращают продуцировать К5/К14 и начинают экспрессировать вторую пару кератинов, специфичную для дифференцирующихся клеток. В эпидермисе это кератины К1 типа II и К10 типа I. Экспресия вторичных кератинов в супрабазальных слоях клеток зависит от типа ткани. Один набор кератинов, представляющий собой изоформы К6, а также К16 и К17, проявляет свойства стрессорных белков эпидермиса, и их синтез индуцируется вскоре после раневых повреждений и воспалительного процесса. В других тканях эти «стрессорные» кератины экспрессируются постоянно, и этим тканям свойственна роль характерных индукторов воспаления.
Таким образом, пролиферативный компартмент (базальный слой клеток) многослойного барьерного эпителия характеризуется спектром синтеза кератинов отличным от дифференцирующегося компартмента (супрабазальных слоев). Для этих барьерных тканей выход клеток из цикла тесно связан с остановкой синтеза первичных кератинов и с началом синтеза вторичных, специфичных для процесса дифференцировки. Кератины клеток супрабазального слоя обеспечивают большую тканевую упругость, и экспрессия нескольких вторичных кератинов может препятствовать делению клеток в митозе и, таким образом, несовместима с пролиферацией.
Третья группа «структурных» кератинов включает большое количество белков промежуточных филаментов, которые экспрессируются только в специализированных поддерживающих структурах, таких как волосы и ногти. К ним относятся кератины клеток волос или трихоцитов, образующих эти структуры, а также специализированные кератины, образующиеся в продуцирующих их эпителиальных клетках. Первичная структура этих двух типов структурных кератинов различна, и считается, что у позвоночных они представляют собой поздний продукт эволюции.
Последовательная экспрессия структурных кератинов особенно характерна для волосяных фолликулов. Первая группа структурных кератинов экспрессируется в концентрических слоях эпителиальных трубочек внутреннего корневого чехла волосяного фолликула. Эта структура становится очень прочной и формирует основную часть волоса. Вторая группа опорных кератинов (трихоцитов или клеток волоса) экспрессируется в основной части волоса, ногтях, некоторых опорных клетках поверхностных сосочков языка (что характерно для языка кошачьих), и в небольшом количестве в тимусе. Эти кератины трихоцитов отличаются высоким содержанием цистеина и пролина в головных и хвостовых доменах.
Последнее позволяет им образовывать дисульфидные связи с белками, которые находятся в цитоплазме клеток волоса по мере дифференцировки и упрочения последних. Эти белки не входят в состав филаментарных структур и называются белками, связывающимися с кератином. Наличие дисульфидных связей приводит к образованию очень прочных структур, формирующих поддерживающую ткань.
Иммуногистохимическое окрашивание простых кератинов на срезе слизистой толстого кишечника.
Локализация двух кератинов I типа, К18 и К20 определена с помощью двух моноклональных антител с последующим иммунопероксидазным выявлением.
Кератины окрашиваются коричневым цветом на фоне голубой окраски гематоксилином.
Первичный кератин К18 находится во всех клетках простого эпителия, в то время как К20 специфичен для определенных клеток желудочно-кишечного тракта.
Как видно на препарате, его присутствие отмечено только в более дифференцированных клетках эпителия, по мере миграции клеток вверх от основания крипты. Тканевая специфичность экспрессии кератина в коже.
На срезах, окрашенных антителами к К7, простому кератину типа II, видны только секреторные клетки потовых желез (иммунопероксидазой окрашиваются в темно-коричневыц цвет).
Многослойный ороговевающий барьерный эпителий (эпидермис) не окрашивается антителами, и после окраски гематоксилином ядра имеют бледно-голубую окраску.
Справа: срез плотного эпидермиса, окрашенный антителами на К10,
тип I вторичный или тканеспецифичный кератин, экспрессирующийся в постмитотических супрабазальных клетках ороговевших барьерных тканей.
Базальный слой клеток не окрашивается антителами, и ядра окрашены в синий цвет. Белки промежуточных филаментов человека, относящиеся к гомологичной группе типа I (кератины типа I).
Белки сгруппированы в простые кератины (клетки простого эпителия), барьерные кератины (характерные для многослойного чешуйчатого эпителия и эпителия сложной структуры)
и в два типа структурных кератинов, связанных с эпидермальными элементами Белки промежуточных филаментов человека, относящиеся к гомологичной группе типа II (кератины типа II).
Белки сгруппированы в простые кератины (клетки простого эпителия),
барьерные кератины (характерные для многослойного ороговевающего эпителия и эпителия сложной структуры)
и в два типа структурных кератинов, связанных с эпидермальным элементами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Кератины промежуточных филаментов
О проекте
Предмет клеточной биологии
Строение и химия клеточного ядра
Цитоплазма
Системы энергообеспечения клетки
Цитоскелет
Механизмы клеточного деления
Промежуточные филаменты (ПФ) строятся из фибриллярных мономеров. Поэтому основная конструкция промежуточных филаментов напоминает канат, имеющий толщину около 8—10 нм. Они локализуются главным образом в околоядерной зоне и в пучках фибрилл, отходящих к периферии клеток и располагающихся под плазматической мембраной (рис. 238, 240 и 241). Встречаются промежуточные филаменты во всех типах клеток животных, но особенно они обильны в тех клетках, которые подвержены механическим воздействиям: клетки эпидермиса, нервные отростки, гладкие и исчерченные мышечные клетки. В клетках растений ПФ не обнаружены.
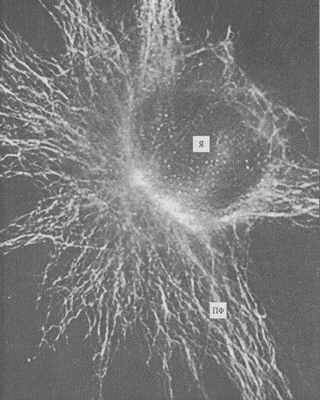
Рис. 240. Промежуточные филаменты (ПФ) фибробласта в культуре ткани, окрашенные флуоресцирующими антителами к виментину (фото Л.А. Горгидзе)
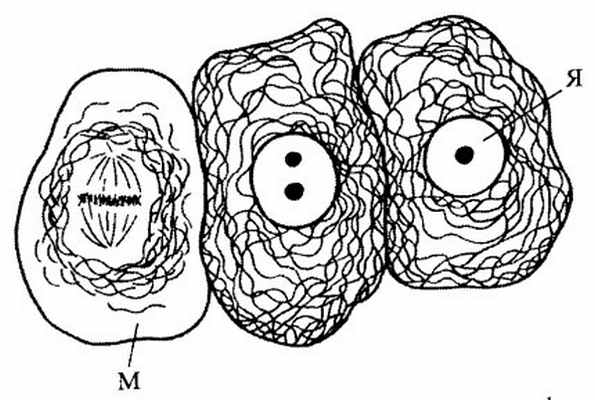
Рис. 241 . Расположение промежуточных филаментов в клетках эпителия
М — митоз; Я — ядро
В состав промежуточных филаментов входит большая группа изобелков (родственных белков), которую можно разделить на четыре типа. Первый тип составляют кератины, кислые и нейтральные, встречающиеся в эпителиальных клетках; они образуют гетерополимеры из этих двух подтипов. Кератины, кроме того, имеют, некоторую гетерогенность, зависящую от тканевого источника. Так, в эпителиях встречается до 20 форм кератинов, 10 форм других кератинов найдено в волосах и ногтях. Молекулярная масса кератинов колеблется от 40 до 70 тыс.
Второй тип белков ПФ включает в себя три вида белков, имеющих сходную молекулярную массу (45—53 тыс.). Это — виментин, характерный для клеток мезенхимного происхождения, входящий в состав цитоскелета клеток соединительной ткани, эндотелия, клеток крови. Десмин характерен для мышечных клеток, как гладких, так и исчерченных. Глиальный фибриллярный белок входит в состав ПФ некоторых клеток нервной глии — в астроциты и некоторые шванновские клетки. Периферинвходит в состав периферических и центральных нейронов.
Третий тип — белки нейрофиламентов (молекулярная масса от 60 до 130 тыс.), встречается в аксонах нервных клеток.
И наконец, четвертый тип — белки ядерной ламины. Хотя эти последние имеют ядерную локализацию, они сходны по строению и свойствам со всеми белками промежуточных филаментов.
Как уже говорилось, промежуточные филаменты построены из фибриллярных белков наподобие каната. При этом некоторые белки могут образовывать сополимеры, например виментин с десмином или виментин с глиальными белками.
Все белки промежуточных филаментов обладают сходной аминокислотной последовательностью из 130 остатков в центральной части фибриллярной молекулы, которая обладает α-спиральным строением. Концевые же участки молекул имеют разные последовательности аминокислот, разную длину и не имеют α-спирального строения. Наличие протяженных α-спиральных участков позволяет двум молекулам образовывать двойную спираль, подобно тому как это происходит в молекуле миозина, что приводит к образованию палочковидного димера длиной около 48 нм. Два димера, объединяясь бок о бок, образуют короткий протофиламент — тетрамер, толщиной около 3 нм. Такие протофиламенты могут объединяться в более толстые и длинные фибриллы, и в конечном итоге образуется промежуточный полный филамент, состоящий из восьми продольных протофиламентов (рис. 242).
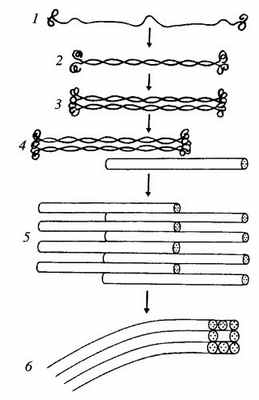
Рис. 242. Этапы полимеризации белков (1—5) и промежуточных филаментов
1 — отдельная молекула; 2 — димер; 3 — тетрамер-протофиламент; 4, 5 — полимеризация протофиламентов; 6 — сформированный промежуточный филамент
Иначе полимеризуются белки ядерной ламины: они образуют димеры с головками на одном конце и полимеризуются, создавая рыхлую прямоугольную решетку. Такие слои ламины быстро разрушаются во время митоза при фосфорилировании ламинов.
Цитоплазматические промежуточные филаменты относятся к самым стабильным и долгоживушим элементам цитоскелета. Однако in vivo наблюдается включение инъецированных меченых молекул кератина в состав ПФ эпителиальных клеток. ПФ устойчивы к действию солей низкой и высокой концентрации, разрушаются только после воздействия денатурирующих растворов, таких как мочевина.
Такая структура и химическая устойчивость промежуточных филаментов, вероятно, определяют и их физическую устойчивость. Они служат как бы истинно опорной системой в клетках, подвергающихся значительным физическим нагрузкам. В клетках кожного эпидермиса промежуточные филаменты образуют пучки (тонофиламенты), связанные с десмосомами, и создают жесткую внутриклеточную сеть (рис. 243). Так, в нервных аксонах, простирающихся на многие десятки сантиметров, ПФ, или нейрофиламенты, создают жесткую основу, обеспечивающую гибкость и целостность тонких цитоплазматических отростков нервных клеток. В поперечно исчерченных мышечных клетках десминовые филаменты входят в состав Z-дисков и связывают их друг с другом как в составе саркомера, так и в соседних миофибриллах, а также с плазматической мембраной.
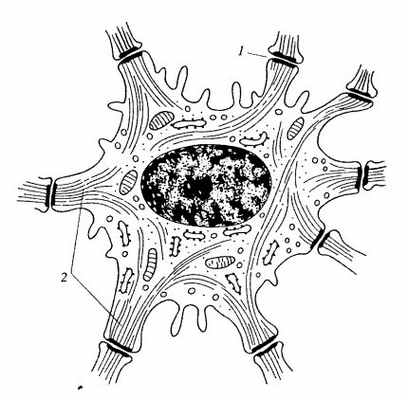
Рис. 243. Клетка шиповатого слоя эпидермиса кожи
1 — десмосомы; 2 — кератиновые промежуточные филаменты
Специфических ингибиторов полимеризации белков промежуточных филаментов пока еще не найдено. Поэтому остается неясным сам процесс сборки и разборки этих элементов цитоскелета в живой клетке. Вероятнее всего, что они подобно ламинам деполимеризуются при действии цитоплазматических киназ, приводящих к их фосфорилированию. Выделенные промежуточные филаменты под действием фосфорилаз могут распадаться на мономеры, деполимеризоваться.
Топографически в клетке расположение промежуточных филаментов повторяет расположение микротрубочек, они как бы идут бок о бок. При разрушении микротрубочек колхицином происходит так называемый коллапс промежуточных филаментов: они собираются в плотные пучки или кольца вокруг ядра. Восстановление новой сети промежуточных филаментов начинается от зоны клеточного центра. Это наводит на мысль, что центром их полимеризации или нуклеации могут быть центры, общие с микротрубочками.
Цитоскелет
Промежуточные филаменты
11.5.1. Промежуточные филаменты образуются из фибриллярных полипептидов четырех типов [51, 52]
В отличие от мономеров актина и тубулина, которые представляют собой глобулярные белки, субъединицы ПФ имеют вытянутую, фибриллярную форму. Они объединяются в продольные пучки, где перекрываются по длине, так что образуют длинные нити с высокой механической прочностью. В латеральных взаимодействиях, за счет которых строятся ПФ, нередко участвует лишь часть молекулы белковой субъединицы ПФ, поэтому структура остальной ее части может значительно варьировать, не изменяя общего строения нити. В связи с этим ПФ в отличие от актиновых филаментов и микротрубочек построены из полипептидов с весьма различной молекулярной массой - от 40 до 130 тыс. в зависимости от типа клеток.
Промежуточные филаменты по их первичной структуре делят на четыре большие группы (табл. 11-5). Белки ПФ типа I наиболее характерны для эпителиальных клеток и включают два подсемейства кератинов: кислые кератины и нейтральные или основные кератины. Кератиновые филаменты - всегда гетерополимеры, образованные поровну субъединицами каждого из этих двух подсемейств. Вообще кератины - самая обширная группа белков ПФ; известно уже не менее 19 различных форм в составе эпителиев человека и еще 8 в волосах и ногтях. Многие типы эпителиев, различающихся морфологически и функционально, синтезируют также разные формы кератинов.
Таблица 11-5. Главные типы белков промежуточных филаментов
Образующий полипептид (мол. масса)
Кислые кератины (40000-70000)
Нейтральные и основные кератины (40 000-70 000)
Эпителиальные клетки и производные эпидермиса (волосы, ногти и т.п.)
Многие клетки мезенхимного происхождения; часто экспрессируется клетками в культуре Мышечные клетки
Глиальный фибриллярный кислый белок (45000)
Глиальные клетки (астроциты и некоторые шванновские клетки)
Белки нейрофиламентов (около 130000 1) , 100000 1) и 60000)
Ядерные ламины А, В и С (65000 -75000)
Ядерная ламина во всех клетках
1) Из-за того, что эти белки при электрофорезе в гелях с додецилсульфатом натрия мигрируют аномально медленно, раньше их молекулярную массу считали большей.
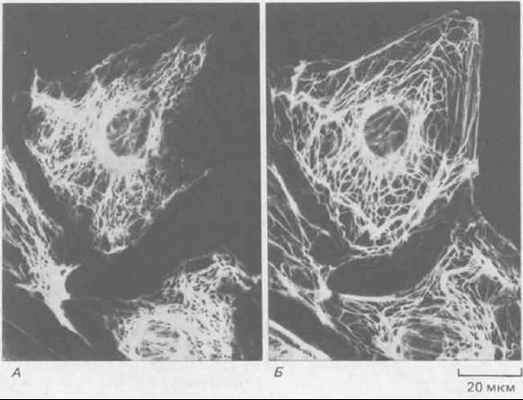
Рис. 11-73. Иммунофлуоресцентная микрофотография эпителиальных клеток кенгуровой крысы (PtK2) в интерфазе. Клетки окрашены одновременно антителами к виментину (А) и к кератину (Б). Обратите внимание, что содержащиеся в клетке системы виментиновых и кератиновых филаментов существуют раздельно, хотя и имеют сходное распределение. (С любезного разрешения Магу Osborn.)
К белкам ПФ типа II относятся 1) виментин, 2) десмин и 3) глиальный фибриллярный кислый белок. Виментин широко распространен в клетках мезенхимного происхождения, включая фибробласты, клетки эндотелия кровеносных сосудов и лейкоциты; он часто образуется в культивируемых клетках и временно появляется в различных клетках в ходе онтогенеза. Десмин содержится в клетках мышц, как гладких, так и поперечнополосатых, а глиальный фибриллярный кислый белок образует глиальные филаменты в определенного рода клетках глии (астроцитах и некоторых шванновских клетках) в нервной системе. Все эти белки способны in vitro к самосборке с образованием гомополимеров, а также к образованию гетерополимеров с другими белками типа II. Последняя способность проявляется и in vivo: в клетках некоторых типов были обнаружены сополимеры виментина с десмином и виментина с глиальным фибриллярным кислым белком.
Из белков ПФ типа III построены нейрофиламенты - важный компонент цитоскелета в аксонах и дендритах нервных клеток. У позвоночных три таких белка, их называют «нейрофиламентным триплетом». И наконец, белки ПФ типа lV-это ядерные ламины (разд. 11.5.5); они сходны с другими белками ПФ по аминокислотной последовательности, но имеют несколько характерных отличий. Наиболее примечательно то, что они образуют высокоупорядоченные двумерные сети из филаментов, подвергающиеся быстрой разборке и сборке на определенных стадиях митоза.
Все клетки эукариот синтезируют ядерные ламины и по крайней мере один тип цитоплазматических белков ПФ. В некоторых клетках есть цитоплазматические ПФ двух типов, образующие раздельные структуры. Таковы, например, некоторые эпителиальные клетки, содержащие отдельные системы кератиновых и виментиновых филаментов (рис, 11-73). 11-28
11.5.2. Промежуточные филаменты образуются из димерных субъединиц со стержневидным срединным доменом [53]
Несмотря на значительную разницу в размерах, все белки ПФ цитоплазмы кодируются генами одного мультигенного семейства. У всех этих белков в первичной структуре полипептида есть гомологичный срединный участок примерно из 310 аминокислот, образующий протяженную а-спираль с тремя короткими не-а-спиральными вставками (рис. 11-74). Кроме того, большие отрезки этой срединной области имеют последовательность, характерную для полипептидов, способных к образованию спирали из двух спиралей (см. разд. 11.1.6). Подобно тропомиозину или хвосту мышечного миозина, эта двухцепочечная спираль представляет собой димер из двух одинаковых полипептидов ПФ. Эти две цепи в гомодимере ПФ уложены параллельно друг другу, причем к срединному стержневидному домену примыкают на обоих концах глобулярные домены. При сборке ПФ стержневидные домены взаимодействуют друг с другом и формируют однородную сердцевину филамента, а глобулярные, величина которых сильно варьирует у разных белков ПФ, выступают с поверхности филамента наружу. Одна из моделей сборки ПФ из димерных субъединиц показана на рис. 11-75.
11.5.3. Промежуточные филаменты простираются от ядерной оболочки до периферии клетки [54]
Если окрасить культивируемые клетки антителами к одному из цитоплазматических белков ПФ (например, виментину), то обычно будет видна ажурная сеть нитей, окружающая ядро и охватывающая всю, цитоплазму (см. рис. 11-73). По структуре эта сеть отлична от других компонентов цитоскелета, хотя местами ее нити, по-видимому, идут параллельно микротрубочкам цитоплазмы. Вероятно, организация цитоплазматических ПФ зависит от взаимодействия с микротрубочками, так как деполимеризация микротрубочек при обработке веществами типа колхицина ведет к «осаждению» всей сети ПФ в виде околоядерной «шапки». Можно думать, что многие ПФ цитоплазмы связаны с ядерной оболочкой и в норме оттягиваются от нее к периферии клетки микротрубочками, с которыми они соединены.
Организация ПФ в цитоплазме может также определяться их взаимодействием с плазматической мембраной. В эритроцитах птиц (которые в отличие от эритроцитов млекопитающих имеют ядро и ПФ) виментин, как полагают, связан с плазматической мембраной через анкирин (разд. 6.2,4). В эпителиальных клетках кератиновые ПФ присоединены к плазматической мембране в десмосомах - специализированных межклеточных соединениях, помогающих удерживать соседние клетки вместе (разд. 14.1.4). Так как кератиновые филаменты каждой клетки через десмосомы соединены с такими же филаментами соседних клеток, они образуют непрерывную сеть, охватывающую весь эпителий.
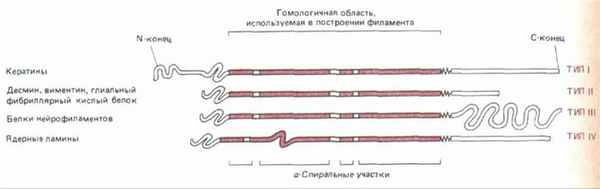
Рис. 11-74. У всех белков промежуточных филаментов имеется гомологичная центральная область (около 310 аминокислотных остатков), формирующая протяженную а-спираль с тремя короткими участками иной структуры. N-концевой и С-концевой домены не состоят из а-спирали и сильно варьируют по размерам и последовательности аминокислот у белков разных промежуточных филаментов.
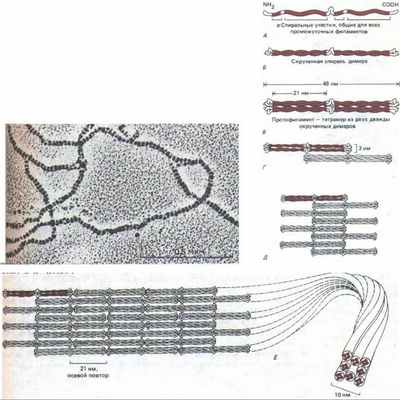
Рис. 11-75. Одна из современных моделей сборки промежуточных филаментов (ПФ). Мономер (А) объединяется с таким же мономером, образуя димер (Б), в котором консервативные а-спиральные участки лежат параллельно, обвиваясь друг около друга. Затем два таких димера укладываются бок о бок, образуя протофиламент длиной 48 нм и толщиной 3 нм, который состоит из четырех полипептидных цепей (В). Такие протофиламенты затем образуют все более крупные структуры, укладываясь с продольным сдвигом (Г и Д). Окончательная структура промежуточного филамента толщиной 10 нм состоит из восьми рядов протофиламентов (32 полипептидных цепей), соединенных в длинный тяж, похожий на канат (Е). Вверху представлена электронная микрофотография такого «окончательного» филамента. Неизвестно, являются ли ПФ полярными структурами, как актин и тубулин, или неполярными, как двойная спираль ДНК (или, что то же самое, лежат ли две скрученные спирали в составе протофиламента в параллельной ориентации или же в антипараллельной. (Микрофотография любезно предоставлена N. Geisler и К. Weber.)
11.5.4. Сборка промежуточных филаментов может контролироваться с помощью фосфорилирования [55]
Изолированные промежуточные филаменты (ПФ) в ионной среде, соответствующей цитоплазме, чрезвычайно стабильны; более того, сколько-нибудь значительного пула неполимеризованных белков ПФ (какой имеется в случае актина и тубулина) в клетке нет. И все же клетка явно может регулировать число, длину и расположение своих промежуточных филаментов, что указывает на ее способность контролировать их сборку и разборку. Важный фактор этого контроля-фосфорилирование определенных остатков в белках ПФ. Виментин, например, существует как в нефосфорилированной, так и в фосфорилированной форме. Если фосфорилировать изолированные виментиновые нити с помощью протеинкиназы, они распадаются на меньшие фрагменты. Однако самый впечатляющий пример того, насколько важную роль играет в контроле разборки ПФ фосфорилирование, - это ядерные ламины, которые подвергаются деполимеризации всякий раз, когда клетка вступает в митоз,
11.5.5. Ядерная ламина образована особым классом промежуточных филаментов [56]
Ядерная ламина - это белковая сеть (обычно толщиной от 10 до 20 нм), подстилающая изнутри поверхность внутренней ядерной мембраны (см. рис. 9-1). Она представляет собой прямоугольную решетку из промежуточных филаментов (рис. 11-76, Д), построенных у млекопитающих из трех белков ПФ типа Vl-ламинов А, В и С (см. рис. 11-74 и табл. 11-3), Ламины образуют димеры, у которых имеется стержневидный домен и две глобулярные головки на одном из концов (рис. 11-76, Б). При подходящих рН и ионной силе димеры самопроизвольно ассоциируют, образуя филаменты, которые по толщине и повторяющейся структуре сходны с цитоплазматическими ПФ.
Однако по ряду признаков ядерные ламины отличаются от белков ПФ цитоплазмы. Наиболее очевидное отличие-это организация образуемых филаментов в прямоугольную решетку (рис. 11-76, А), хотя для такой организации, видимо, необходимо объединение их с другими белками. Кроме того, ядерная ламина - структура очень динамичная. Когда клетки млекопитающих вступают в митоз, кратковременное фосфорилирование нескольких остатков серина в ламинах вызывает обратимую диссоциацию ядерной ламины на тетрамеры гиперфосфорилированных ламинов А и С и связанного с мембраной ламина В. При возвращении клетки в интерфазу ламины дефосфорилируются, и вокруг разошедшихся хромосом вновь образуется цельная ядерная оболочка (разд. 13.5.11).
11.5.6. Кератиновые филаменты удивительно разнообразны [52]
Из всех типов промежуточных филаментов наиболее стабильные и долгоживущие - кератиновые, они же и самые разнообразные. Эпителии с примитивной организацией, например в развивающемся эмбрионе, а также некоторые зрелые ткани (такие, как печень) содержат кератины двух типов - один кислый и один нейтральный. В эпителиях других органов (например, языка, мочевого пузыря, потовых желез) имеются шесть или больше различных кератинов, причем их конкретный спектр зависит от анатомической локализации. Кератиновые филаменты ввиду их многообразия и стабильности могут служить своего рода «отпечатками пальцев», позволяющими уточнить происхождение некоторых опухолей эпителиальной природы. Еще разнообразнее кератины в эпидермисе, который представляет собой плотный многослойный эпителий (разд. 17.4.2). В клетках разных слоев эпидермиса экспрессируются разные наборы кератинов. Кератиновые филаменты в них постепенно сшиваются поперечными ковалентными связями друг с другом и с ассоциированными белками, и по мере гибели клеток в самых наружных слоях эпидермиса поперечносшитый кератиновый скелет становится важнейшим защитным барьером на поверхности тела. Специализированные эпителиальные клетки, образующие такие поверхностные структуры, как волосы, когти и перья, обеспечивают дополнительные локальные вариации в наборе кератинов. Таким образом, промежуточные филаменты защищают животное от потери тепла и воды, предоставляют ему «оружие» и средства камуфляжа или, наоборот, привлечения партнера (окраска).
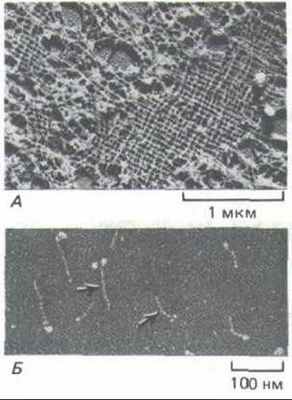
Рис. 11-76. А. Электронная микрофотография участка ядерной ламины в ооците Xenopus (препарат получен методом лиофилизации и напыления металлом). Ламину образует высокоупорядоченная прямоугольная сеть из промежуточных филаментов, состоящих из ядерных ламинов. Б. Изолированные димеры ламина (L) (электронная микрофотография, напыление металлом). По форме они напоминают мышечный миозин (М): у них есть стержневидный хвост и две глобулярные головки, но они гораздо меньше. Глобулярные головки образованы двумя большими С-концевыми доменами. (С любезного разрешения Ueli Aebi.)
11.5.7. Какова функция промежуточных филаментов?
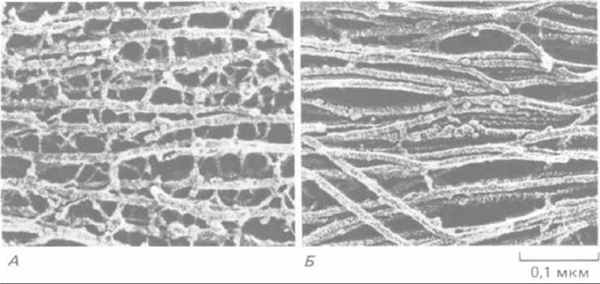
Рис. 11-77. Электронная микрофотография промежуточных филаментов двух типов, встречающихся в нервной ткани (препарат после быстрого замораживания и глубокого травления). А. Нейрофиламенты в аксоне соединены многочисленными поперечными белковыми сшивками; как полагают, такая организация придает этому длинному клеточному отростку большую прочность на разрыв. По-видимому, сшивки образованы длинными неспиральными участками С-концевой части наиболее крупного белка нейрофиламентов (см. рис. 11-74). Б. Промежуточные филаменты (называемые глиальными филаментами) в астроците. Они подвергаются меньшим механическим нагрузкам. Их поверхность довольно гладкая, и поперечных сшивок между ними мало. (С любезного разрешения N. Hirokawa.)
Различные потенции к связыванию других белков могут обеспечиваться вариабельными участками белков промежуточных филаментов, Влияя на свойства филамента, эти вариабельные участки определяют не только его способность к самосборке, но и то, как он будет взаимодействовать с другими компонентами клетки (например, с микротрубочками и плазматической мембраной). Это совершенно иная стратегии чем в случае двух других важнейших элементов цитоскелета - актиновных филаментов и микротрубочек; как мы уже знаем, эти полимеры в основном инвариантны по структуре, а к выполнению различных функций они приспосабливаются с помощью разных наборов актин-связывающих белков и белков, ассоциированных с микротрубочками. Таким образом, роль вариабельных участков в белках промежуточных филаментов та же, что и у вспомогательных белков актиновых филаментов и микро-трубочек, - разница лишь в том, что одни ковалентно связаны с субъединицами филамента, а другие представляют собой отдельные молекулы.
Промежуточные филаменты (ПФ) - это полимеры, по структуре подобные канатам, собранным из нитевидных полипептидов. По- видимому, они поддерживают структуру клеток или противостоят растягивающим нагрузкам. Существует много тканеспецифических форм ПФ, построенных из различных полипептидов: кератиновые филаменты эпителиальных клеток, нейрофиламенты нейронов, глиальные филаменты астроцитов и шванновских клеток, десминовые филаменты мышечных волокон и виментиновые филаменты фибробластов и клеток многих других типов. Отдельное семейство белков ПФ составляют ядерные ламины, из которых построена волокнистая пленка (ламина), выстилающая изнутри оболочку ядра; они имеются во всех эукариотических клетках.
Полипептиды, входящие в состав промежуточных филаментов различных типов, различаются по аминокислотной последовательности, а также - и очень сильно - по молекулярной массе. Однако у всех имеется гомологичный центральный домен, который при димеризации белка образует жесткую структуру из обвивающих друг друга спиралей. Такие димерные субъединицы складываются в большие пучки «внахлест», формируя промежуточные филаменты. Стержневидные домены субъединиц при этом создают структурную сердцевину ПФ, а глобулярные домены на обоих концах выступают наружу и обусловливают разнообразие свойств ПФ. Именно благодаря этой вариабельности механические свойства ПФ и взаимодействия их с другими клеточными компонентами приспособлены к специфическим нуждам клеток того или иного типа.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Промежуточные филаменты
Промежуточные филаменты (ПФ) — нитевидные структуры из особых белков, один из трех основных компонентов цитоскелета клеток эукариот. Содержатся как в цитоплазме, так и в ядре большинства эукариотических клеток. Средний диаметр ПФ — около 10 нм (9-11 нм), меньше, чем у микротрубочек (около 25 нм) и больше, чем у актиновых микрофиламентов (5-9 нм). Название получили из-за того, что толщина цитоскелетных структур, состоящих из ПФ, занимала промежуточное положение между толщиной миозиновых филаментов и микротрубочек [1] . В ядре известен только один тип ПФ — ламиновых, остальные типы — цитоплазматические.
Содержание
Структура
Доменная структура белковых молекул ПФ довольно консервативна. Полипептид обычно имеет два глобулярных домена на N- и C-концах, которые соединены протяженным суперскрученным палочковидным доменом, состоящим из альфа-спиралей. Основной строительный блок филамента — димер, а не мономер. Он образован двумя полипептидными цепями, обычно двух разных белков, которые взаимодействуют между собой своими палочковидными доменами, образующими двойную суперскрученную спираль. Цитоплазматические ПФ образованы из таких димеров, образующих неполярные нити, толщиной в один блок. Отсутствие полярности у ПФ обусловлено антипараллельной ориентацией димеров в тетрамере. Из них далее образуются более сложные структуры, в которых ПФ могут уплотняться, вследствие чего имеют непостоянный диаметр.
В отличие от актина и тубулина белки ПФ не имеют сайта сязывания нуклеозидтрифосфатов.
Распространение
Цитоплазматические ПФ есть не у всех эукариот, они обнаружены только у некоторых групп животных. Так, ПФ есть у нематод. моллюсков и позвоночных. но не найдены у членистоногих и иглокожих. У позвочноных ПФ отсутствуют в некоторых клетках (например, олигодендроцитах). В растительных клетках ПФ не обнаружены. [2] [3]
В большинстве животных клеток ПФ образуют «корзинку» вокруг ядра, откуда направлены к периферии клеток. ПФ особенно много в клетках, подверженных механическим нагрузкам: в эпителиях, где ПФ участвуют в соединении клеток друг с другом через десмосомы, в нервных волокнах, в клетках гладкой и поперечно-полосатой мышечной ткани.
В отличие от других основных элементов цитоскелета, ПФ в цитоплазме клеток разных тканей состоят из разных, хотя и похожих по своей структуре белков. Всего белки ПФ у человека кодируют около 70 генов. На основе особенностей аминокислотного состава и строения выделяют пять основных групп белков ПФ.
Тип I — кератины
Из кератинов с молекулярной массой 40 - 70 кДа состоит наиболее разнообразная группа ПФ. Данный тип белков делится на 2 подсемейства:
- кислые кератины,
- нейтральные и основные кератины.
Димер кератина состоит из одного кислого и одного основного кератина. Среди многочисленных изоформ кератина выделяют две основные группы — эпителиальные кератины (см. цитокератин), включающую около 20 видов кератинов, и кератины волос (примерно 10 видов), из которых построены также ногти, рога и чешуя пресмыкающихся.
Тип II
Второй тип белков ПФ включает в себя 4 вида белков:
- - белок с массой 45 - 53 кДа, характерный для клеток мезенхимного происхождения: входит в состав клеток соединительной ткани, эндотелия, клеток крови; ;
- глиальный фибриллярный кислый белок;
- периферин.
Тип III
- Альфа-интернексин
- Белки нейрофиламентов
- Нестин
- Синемин
- Синкойлин
Тип IV
Функции
ПФ в ряде случаев обеспечивают механическую прочность клеток, их отростков или эпителиальных слоев. Они участвуют в образовании межклеточных контактов — десмосом и гемидесмосом.
Медицинское значение
Мутации генов кератинов krt5 и krt14 связаны с развитием наследственного кожного заболевания, буллёзного эпидермолиза (Epidermolysis bullosa simplex). При этом заболевании нарушено прикрепление эпидермиса к базальной пластинке, на коже образуются заполненные серозным содержимым пузыри.
Примечания
См. также
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Промежуточные филаменты" в других словарях:
ФИЛАМЕНТЫ — (от позднелат. filamentum нитевидное образование, нить), общее назв. внутриклеточных цитоплазматич. фибриллярных (нитеподобных) белковых структур. Электронно микроскопически различают 3 класса Ф: микрофиламенты; толстые Ф. миозиноподобные,… … Биологический энциклопедический словарь
Цитоскелет — эукариот. Актиновые микрофиламенты окрашены в красный, микротрубочки в зелёный, ядра клеток в голубой цвет. Цитоскелет это клеточный каркас или скелет, находящийся в цитоплазме живой клет … Википедия
Кресцентин — Модели белка кресцентина из Caulobacter vibrioides Q … Википедия
Структурная функция белков — заключается в том, что белки участвуют в образовании практически всех органоидов клеток, во многом определяя их структуру (форму); образуют цитоскелет, придающий форму клеткам и многим органоидам и обеспечивающий механическую форму ряда тканей;… … Википедия
Кератины — Микроскопическое изображение нитей кератина внутри клетки Кератины семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов… … Википедия
Клетка — У этого термина существуют и другие значения, см. Клетка (значения). Клетки крови человека (РЭМ) … Википедия
Десмосомы — desmosomes … Википедия
СОЕДИНИТЕЛЬНАЯ ТКАНЬ — главная опорная и защитная ткань организма, основа всех его связующих и опорных структур. В широком смысле это несколько разных тканей, образующих соединительнотканные структуры кости, сухожилия, связки, суставы, дерму и кровеносные сосуды,… … Энциклопедия Кольера
Межклеточные контакты — соединения между клетками, образованные при помощи белков. Межклеточные контакты обеспечивают непосредственную связь между клетками. Кроме того, клетки взаимодействуют друг с другом на расстоянии с помощью сигналов (главным образом сигнальных… … Википедия
Межклеточные соединения — – соединения между клетками, образованные при помощи белков. Остальные виды взаимодействий клеток проходят посредством соединительной ткани. Межклеточные связи сводятся не только к электрическим взаимодействиям. Взаимосвязь между клетками… … Википедия
Читайте также:
